Method Article
تقييم إعداد وRespirometric من الميتوكوندريا المعزولة من الأنسجة العضلية الهيكلية التي تحصل عليها عن طريق الجلد إبرة الخزعة
In This Article
Summary
يتم وصف طرق لخزعة من الوحشية المتسعة، وإعداد الميتوكوندريا النقى والتنميط respirometric. استخدام حجم العضلات الصغيرة يجعل هذه التقنية مناسبة لتطبيقات البحوث السريرية.
Abstract
يستخدم التنميط Respirometric الميتوكوندريا معزولة عادة للتحقيق في سلسلة نقل الإلكترون وظيفة. نحن تصف طريقة للحصول على عينات من الوحشية المتسعة الإنسان، عزل الميتوكوندريا من كميات ضئيلة من الأنسجة العضلية الهيكلية، ومقرها لوحة التنميط respirometric باستخدام تدفق خارج الخلية (XF) محلل. مقارنة لمحات respirometric تم الحصول عليها باستخدام 1.0، 2.5 و 5.0 ميكروغرام من الميتوكوندريا تشير إلى أن 1.0 ميكروغرام يكفي لقياس التنفس وأن 5.0 ميكروغرام يوفر نتائج أكثر اتساقا على أساس المقارنة بين الأخطاء المعيارية. تحليل لطخة الغربي من الميتوكوندريا معزولة عن علامة الميتوكوندريا COX IV وغير الميتوكوندريا علامة الأنسجة GAPDH تشير إلى أن هناك تلوث غير محدود الميتوكوندريا باستخدام هذا البروتوكول. القدرة على دراسة قياس التنفس الميتوكوندريا في اقل من 20 ملغ من الأنسجة العضلية تتيح للمستخدمين الاستفادة من الخزعات الفردية بالنسبة لنهايات متعددة في دراسة سريريةالمشاريع البحثية.
Introduction
الميتوكوندريا هي مواقع إنتاج الطاقة الأولية في الخلية ولها أدوار مهمة في الشيخوخة فضلا عن مختلف اضطرابات سن ذات الصلة، مثل أمراض القلب والشرايين، ومرض الزهايمر، ومرض السكري، والسرطان، والسمنة. التنميط Respirometric الميتوكوندريا معزولة يوفر التحليل المباشر لسلسلة نقل الإلكترون (ETC) وظيفة وساهم بشكل كبير في فهمنا للبيولوجيا الميتوكوندريا ودورها في الصحة والمرض. وتستخدم الميتوكوندريا المعزولة لدراسة جوانب مختلفة من الطاقة الحيوية مثل النقل الركيزة، والنشاط سينسيز اعبي التنس المحترفين، تسرب بروتون، الخ وقد تم تحسين المنهجية الموضحة في هذه المخطوطة للسماح تحليل respirometric الميتوكوندريا المعزولة من عينات للفحص أنسجة العضلات والهيكل العظمي تم الحصول عليها من البشر. وقد استخدمت بروتوكول خزعة الموضحة في هذه المخطوطة من قبل العاملين لدينا على مدى السنوات ال 12 الماضية. كان أداء مجموعتنا أكثر من 700 إجراءات على الكبار من مختلف الأعمار،تصل إلى 90 عاما، ومع مختلف الحالات المرضية المزمنة دون أي قضايا السلامة السلبية. أحد الجوانب الرئيسية لهذا البروتوكول هو أنه مصمم خصيصا للاستفادة من كميات ضئيلة من الأنسجة، مما يسهل استخدامها في البحوث والدراسات السريرية.
وقد وضعت بروتوكولات مختلفة لعزل الميتوكوندريا. فرنانديز-Vizarra وآخرون 1،2 وصف طريقة لعزل الميتوكوندريا من أنسجة الفئران المختلفة وكذلك الخلايا المستزرعة. وأفادت جارسيا لCazarin وآخرون. 3 وسيلة لعزل الميتوكوندريا من عضلات الهيكل العظمي من الجرذان والفئران. كما تم الإبلاغ عن طريقة لعزل الميتوكوندريا من دماغ الفئران التي ايغليسياس-غونزاليس وآخرون 4 الإجمالي.، وآخرون. 5 وذكرت وسيلة لعزل الميتوكوندريا باستخدام barocycler و / أو التقطيع معاهدة التعاون بشأن البراءات. مؤخرا، ذكرت فرانكو وآخرون. 6 وسيلة لعزل الميتوكوندريا التخصيب باستخدام المضادة-TOM22 حبات مغناطيسية.
في حين أن هذه البروتوكولات تسفر عن نتائج ممتازة، ومتطلبات حجم الأنسجة مرتفعة مقارنة مع الطريقة الموضحة في هذه المخطوطة. على سبيل المثال، جروس وآخرون. 5 تستخدم 1.5-1.8 غرام من عضلة الساق، وحوالي 2 غرام من أنسجة الكلى. وبالمثل، وتستخدم فرانكو وآخرون 6 500 ملغ الأنسجة الكبد الماوس. من تجربتنا، والمحاصيل التقليدية التي يمكن توقعها من إبرة الخزعة عن طريق الجلد من العضلات الهيكلية (الوحشية المتسعة) تتراوح ما بين 100-200 مجم. القدرة على تقييم وظيفة الميتوكوندريا في 20-50 ملغ من الأنسجة العضلية باستخدام بروتوكول الموصوفة هنا تسمح للمستخدمين إجراء عمليات تقييم متعددة لكل خزعة وعينات متجر لاستخدامها في المستقبل في غيرها من التجارب البيولوجيا الجزيئية. هذه هي ميزة حاسمة في البحوث السريرية وغيرها من الدراسات التي تتطلب استخدام الدؤوب من العينات. وتجدر الإشارة إلى أن الميتوكوندريا مجمدة في السابق ليست جيدة لدراسة التنفس إلى جانب بسبب outeص الضرر غشاء الميتوكوندريا وفقدان النشاط السيتوكروم C. وقد تم تكييف أسلوبنا وتعديلها من الأسلوب الذي نشرته تشابيل وبيري 7.
باستخدام الطرق الموضحة في هذه المخطوطة، ونحن قد ذكرت مؤخرا أن ملف التعريف respirometric الميتوكوندريا المعزولة من المتسعة الوحشية الإنسان مرتبطة بشكل مباشر مع القدرة البدنية، ويقاس سرعة المشية 8.
Protocol
ملاحظة: بروتوكول الموصوفة وافق عليها مجلس المراجعة المؤسسية للمدرسة ويك فورست الطب. تم الحصول على الموافقة المسبقة في الكتابة. وكان جميع المشاركين كبار السن الأصحاء (65-79 سنة) من كلا الجنسين، مع متوسط مؤشر كتلة أجسامهم تتراوح 23-35.
1. الهيكل العظمي خزعة العضلات
- كما هو موضح سابقا، 9 أداء جميع الخزعات في الصباح الباكر بعد O / N بسرعة. طرح الموضوعات الامتناع عن تناول الاسبرين، وصفة طبية ودون وصفة طبية غير الستيرويدية المضادة للالتهابات المخدرات، أو غيرها من المركبات التي قد تؤثر على النزيف، والصفائح الدموية، أو كدمات للأسبوع قبل الخزعة. اطلب من المشاركين أن تمتنع أيضا عن أي نشاط المضنية لمدة 36 ساعة على الأقل قبل الخزعة.
يتم الحصول على العضلات من المتسعة الوحشية باستخدام تقنية إبرة الخزعة عن طريق الجلد بإبرة عن طريق الجلد تحت التخدير الموضعي مع 1٪ ليدوكائين: ملاحظة. أي مضاعفات طبية أو سذر ذكرت وقعت أحداث سلبية من الإجراء في وحدة الأبحاث السريرية. - ملاحظة: الإجراء خزعة وصف ويتم تكييف من ذلك من بيرجستروم 10.
- لفترة وجيزة، وإدارة محليا 1٪ جني يدوكائين الحرص على عدم اختراق العضلات. اتبع هذا مع فترة الانتظار 10 دقيقة للسماح الذهول كافية.
- أخذ خزعات من بطن العضلات (المنطقة الوسطى من العضلات بين الإدراج والأصل) تجنب المناطق تحت اللفافة وmyotendonous.
- استخدام إبرة عن طريق الجلد (شفط بمساعدة جهاز قابلة لإعادة الاستخدام مع الجانب قطع النافذة والداخلية قطع اسطوانة) واتباع فافي "البوب" أو مقاومة لفافة كدليل.
- تقدير عمق مع إبرة التخدير، ثم مرة أخرى نرى انه مع شفرة مشرط الضيقة وجعل 4-5 ملم شق طريق لفافة. دفع الإبرة من خلال شق حتى يتم إدخالها في العضلات.
- جمععينات متعددة مع نافذة تحولت في اتجاهات مختلفة. تطبيق الشفط المستمر باستخدام حقنة 60 سم مكعب في حين تقدم وسحب عينات العضلات في إبرة عن طريق الجلد مرتين إلى أربع مرات في اتجاهات مختلفة. وقف شفط وإزالة الإبرة.
ملاحظة: كل تمريرة (الإدراج وإزالة إبرة) يجب أن يأخذ أقل من دقيقة. - هل لديك مساعد تنطبق الضغط على الشركة ثقب الموقع لمدة 5 دقائق لإنشاء الارقاء. قطع إبرة شفط من الأنابيب وإزالة بعناية عينات العضلات من النافذة وبرميل.
- جعل تمريرة الثاني إذا كان هناك حاجة المزيد من العضلات من خلال تكرار الإجراء أعلاه.
- إزالة أي جلطات الدم مرئية من عينة العضلات باستخدام ملقط، وزن العينة، ووضع على الفور في أنبوب يحتوي على DPBS الجليد الباردة.
ملاحظة: إن متوسط العائد باستخدام هذه المنهجية هو 150 ± 20 ملغ.
2. عزل الميتوكوندريا
<رأ>3. غسل الميتوكوندريا
- أجهزة الطرد المركزي لطاف من الخطوة أعلاه في 10، 000 x ج، 4 درجة مئوية لمدة 10 دقيقة. تعليق بيليه في 4 مل من CP II العازلة ومزيد من أجهزة الطرد المركزي في 10،000 x ج، 4 درجة مئوية لمدة 10 دقيقة.
ملاحظة: في حالات نادرة، تشكيل بيليه رقيقة من الدم أقل من بيليه الميتوكوندريا. في هذه الحالة، وإزالة بيليه الميتوكوندريا بواسطة طموح لطيف مع العازلة CPII. ويمكن تجنب هذه الخطوة عن طريق غسل بدقة بعيدا الدم في الخطوة 2. - تعليق بيليه الحصول عليها في من 2ml CP I العازلة. في هذه المرحلة استخدام قسامة صغيرة من هذا التعليق لتقدير البروتين. Resuspend والعينة المتبقية في CP I العازلة وأجهزة الطرد المركزي على النحو الوارد أعلاه. تعليق بيليه النهائي في الحد الأدنى (200 ميكرولتر) من الميتوكوندريا الفحص الحل (MAS).
ويعاير البروتين في هذه المرحلة لأن CP I عازلة لايوجد BSA، في حين MAS التي سيتم تعليق العينات في وقت لاحق لا يكون BSA فيه: ملاحظة.
4. تقدير المحتوى الميتوكوندريا بواسطة قياس تركيز البروتين باستخدام بروتين BCA الفحص كيت
الطبقة = "jove_content"> ملاحظة: استخدم هذا التركيز لحساب كمية من الميتوكوندريا تستخدم لتحميل الصعود إلى صفيحة ميكروسكوبية 24-جيدا لقياس respirometric، أو لإجراء التجارب طخة غربية. تأخذ بعين الاعتبار عامل التخفيف (10) لحساب تركيز البروتين.
5. قم بإجراء فحوصات XF كما وصفها روجرز، GW، وآخرون. 12
ملاحظة: تصور معدل استهلاك O 2 (OCR) في pMoles O 2 / دقيقة، أو المستويات المطلقة للO 2 ودرجة الحموضة في إخراج البيانات.
- استخدام 1X MAS لإعداد المركبات ليتم حقنه. إضافة تركيز 10X من المركبات إلى الموانئ م لإعطاء تركيز النهائي على النحو التالي: ميناء A، ADP [الأدينوساين 5 '-diphosphate، 2 مم، 50 ميكرولتر]. ميناء B، أوليغوميسين (2 ميكرومتر، 55 ميكرولتر)؛ ميناء C، FCCP [الكربونيل السيانيد 4- (trifluoromethoxy) فينيل هيدرازون، 6 ميكرومتر، 60 ميكرولتر]. ومنفذ D، 2 ميكرومتر antimycin-A (65 ميكرولتر). إعدادحجم كاف من المركبات عن العدد المطلوب من الآبار.
- تحديد المبلغ الأمثل للالميتوكوندريا بواسطة المعايرة. على سبيل المثال، تحميل 1.0 ميكروغرام، و 2.5 ميكروغرام و 5.0 ميكروغرام من الميتوكوندريا لكل بئر في حجم 50 ميكرولتر من 1X الجليد الباردة MAS تحتوي على الركيزة. لتقليل التباين بين الآبار، وتمييع لأول مرة 10X الميتوكوندريا في الباردة 1X MAS + الركيزة. وبعد ذلك، تقدم 50 ميكرولتر من هذا التعليق على كل بئر (باستثناء الآبار تصحيح الخلفية).
- أجهزة الطرد المركزي لوحة في 2،000 x ج، 20 دقيقة على 4 درجات مئوية. بعد الطرد المركزي، إضافة بلطف 450 ميكرولتر من 1X MAS + سكسينات (10 ملم) وروتينون (2 ميكرومتر) (الظروف الأولية؛ انظر أدناه) إلى كل بئر. عرض الميتوكوندريا تحت المجهر لضمان الالتزام متجانسة إلى جيدا قبل نقل لوحة لمحلل XF.
ملاحظة: الشروط الأولية المستخدمة سيعتمد على ما إذا كان الدافع وراء التنفس إما أنا أو معقدة II معقدة ETC. لالمعقد التنفس يحركها II، استخدم سوccinate (10 ملم) وروتينون (2 ميكرومتر) كشروط أولية. كتل روتنون I معقدة وسكسينات توفر الوقود لمجمع II (سكسينات نازعة). لدراسة التنفس يقودها مجمع I، استخدم إما البيروفات ومالات، كل بتركيز نهائي من 5 ملم أو الغلوتامات ومالات كل بتركيز نهائي من 10 ملي كشروط أولية. هذا الأخير يمكن أن يساعد في التمييز بين الخلل دورة حمض الثلاثي الكربوكسيل والنقل الركيزة. لدراسة التنفس يقودها كلا I معقدة ومعقدة II، وتشمل البيروفات وسكسينات دون روتينون أو مالات كشروط أولية. استخدام بالميتويل الكارنيتين باعتبارها الركيزة لβ للأكسدة. - بالتتابع قياس التنفس الميتوكوندريا في الوقت الحقيقي باستخدام مقياس التنفس عن طريق برمجة ذلك كما هو موضح سابقا (12). استخدام الإعدادات لمقياس التنفس المنصوص عليها في الجدول 2.
ملاحظة: شرح موجز من مختلف الدول التنفس الميتوكوندريا هي كما يلي: - الدولة 2 = دولة إلى جانب ركيزة الحاضر. الدولة 3 = phosphorylating التنفس في وجود تشبع ADP. الدولة 4 س = غير phosphorylating التنفس الناجم عن أوليغوميسين. 3U الدولة = القصوى التنفس وفكت يحفزه على FCCP uncoupler. المتبقي غير الميتوكوندريا التنفس = التنفس بعد مجمع III تثبيط من قبل antimycin-A. كما ينبغي الإشارة إلى أن، وطول قياس OCR في تركيبة مع تركيز الميتوكوندريا يمكن أن تؤثر البيانات بواسطة المستنفدة الأكسجين أثناء فترات القياس.
6. البقعة الغربية
ملاحظة: تحديد علامة الميتوكوندريا COX الرابع وGAPDH الأنسجة كله قبل الغرب النشاف لضمان إثراء الميتوكوندريا في العينة النهائية
- فصل الميتوكوندريا معزولة واستخراج النسيج كله بنسبة 12٪ دوديسيل الصوديوم كبريتات المواد الهلامية بولي أكريلاميد.
- نقل البروتينات على غشاء البولي فينيل الفلوريد (PVDF).
- احتضان مع COX IV الأضداد (1: 20،000)، تليها الفجل البيروكسيديز (HRP) -conjugated الأجسام المضادة الثانوية. لتحديد GAPDH، تجريد صمة عار والتحقيق مع الأجسام المضادة وحيدة النسيلة GAPDH (1: 2،000).
ملاحظة: إذا كان الاختلاف في تلوث ER هي التي تهم، تشمل علامات ER مثل ERp72، calnexin، أو calreticulin في التحليل.
النتائج
الشكل 1 يصور مخطط تفصيلي لبروتوكول بأكمله.
لمحات طخة غربية من COX IV / GAPDH (الشكل 2) تصور التعبير عن بروتين الميتوكوندريا، COX IV، وعلامة غير الميتوكوندريا، GAPDH. التعبير عن كل من COX الرابع وGAPDH واضحة في المحللة العضلات كله. بعد عزل الميتوكوندريا باستخدام تقنية الموصوفة في هذا البروتوكول، والعصابات COX IV لا تزال واضحة في حين GAPDH غائب في نفس التعرض. التعرض أطول قد تكشف عن وجود الفرقة GAPDH باهتة. هذه البقع تشير إلى أن الميتوكوندريا المعزولة لها الحد الأدنى من التلوث غير الميتوكوندريا. وعلاوة على ذلك، COX IV التعبير في الميتوكوندريا معزول يتسق بين العينات.
ويبين الشكل 3 لمحات respirometric نموذجية يقودها مجمع II (سكسينات وروتينون) باستخدام 1.0 ميكروغرام، و 2.5 ميكروغرام و 5.0 ميكروغرام من الميتوكوندريا. كما هو متوقع، يتم زيادة الشامل OCR ثإيث كميات أكبر من الميتوكوندريا. نسبة سيطرة الجهاز التنفسي المحسوبة (RCR) لهذا الاختبار هو 7.95، مشيرا إلى أن إعداد الميتوكوندريا هي ذات جودة عالية. وعلاوة على ذلك، 3U الدولة OCR هو أعلى بقليل من الدولة 3، مؤكدا جودة الميتوكوندريا.
من أجل مقارنة اتساق النتائج عند التنميط كميات مختلفة من الميتوكوندريا، أجرينا ANOVA (تحليل التباين) وحساب مجموع المربعات (SS) كقيم الفعلية التباين باستخدام 1.0 ميكروغرام، و 2.5 ميكروغرام و 5.0 ميكروغرام من الميتوكوندريا تحميلها في كذلك (الشكل 4). وتقدم SS للدولة 2، 3 الدولة، 3U الدولة، أنتيمايسين إيه، وRCR. للدولة 2 و 3 قياسات الدولة، وكان اتجاه واحد ANOVA ذات دلالة إحصائية (P <0.01 و p <0.05، على التوالي). وبالمثل، كان وسيلة واحدة ANOVA ذات دلالة إحصائية لantimycin وRCR (P <0.01 و p <0.0001 على التوالي. وكان ينظر لا فرق كبير ل3U الدولة بين المجموعات. ثوتشير النتائج أن 5.0 ميكروغرام جنوب شرقي الميتوكوندريا لكل بئر أعطى أدنى SS مقارنة تركيزات الأخرى وهو المبلغ الأمثل لاستخدامها في نظام XF 24 مع سكاننا من المشاركين.
يخدم الشكل 5 كدليل للإشارة إلى كيفية يمكن توقع الكثير من البروتين الميتوكوندريا على أساس الأولي حجم العينة العضلات. كما هو متوقع هناك علاقة قوية بين كمية العضلات (ملغ) المصنعة والمحتوى الكلي للبروتين الميتوكوندريا (ملغ) من العينة النهائية.
| شابل-بيري عازلة I (CPI) | |
| مادة كيميائية | تركيز |
| بوكل | 100 ملي |
| اجتماعات الأطراف | 50 ملي |
| EDTA | 1 ملم |
| MgSO 4 | 5 مم |
| ATP | 1 ملم |
| درجة الحموضة | 7.4 |
| شابل-بيري عازلة II (CPII) | |
| مادة كيميائية | تركيز |
| بوكل | 100 ملي |
| اجتماعات الأطراف | 50 ملي |
| EDTA | 1 ملم |
| MgSO 4 | 5 مم |
| ATP | 0.2 ملم |
| الأحماض الدهنية الحرة BSA | 0.50٪ |
| درجة الحموضة | 7.4 |
| الميتوكوندريا الفحص الحل (MAS) (2X) | |
| مادة كيميائية | تركيز |
| سكر القصب | 35 ملي |
| مانيتول | 110 ملي |
| KH 2 PO 4 | 2.5 ملم |
| MgCl 2 | 2.5 ملم |
| HEPES | 1.0 ملم |
| EGTA | 0.5 ملم |
| الأحماض الدهنية الحرة BSA | 0.10٪ |
| درجة الحموضة | 7.4 |
| الميتوكوندريا الفحص الحل (MAS) مع مجمع II الظروف الأولية | |
| مادة كيميائية | تركيز |
| 1X MAS | |
| سكسينات | 10 ملي |
| روتنون | 2 ميكرومتر |
| درجة الحموضة | 7.4 |
| الميتوكوندريا الفحص الحل (MAS) مع معقدة I الظروف الأولية | |
| مادة كيميائية | تركيز |
| 1X MAS | |
| البيروفات | 5 مم |
| مالات | 5 مم |
| درجة الحموضة | 7.4 |
| * جميع مخازن ليكون في الماء منزوع الأيونات | |
الجدول 1. الحل وصفات العازلة.
| بروتوكول خطوات | ||
| StartProtocol | ||
| القيادة | الوقت (دقيقة) | ميناء |
| عاير | 0.00 | |
| انتظر | 10.00 | |
| مزيج | 1.00 | |
| انتظر | 3.00 | |
| مزيج | 1.00 | |
| انتظر | 3.00 | |
| مزيج | 0.50 | |
| قياس | 3.00 | |
| مزيج | 1.00 | |
| قياس | 3.00 | |
| مزيج | 0.50 | |
| حقن | A | |
| مزيج | 1.00 | |
| قياس | 6.00 | |
| مزيج | 1.00 | |
| حقن | B | |
| مزيج | 1.00 | |
| قياس | 3.00 | |
| مزيج | 1.00 | |
| حقن | C | |
| مزيج | 1.00 | |
| قياس | 3.00 | |
| مزيج | 1.00 | |
| حقن | D | |
| مزيج | 1.00 | |
| قياس | 3.00 | |
| EndProtocol | ||
الجدول 2. ميكس، وقياس، وتخلط إعداد دورة لمقياس التنفس.

الشكل 1. مخطط انسيابي لبروتوكول بأكمله. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
/ftp_upload/52350/52350fig2highres.jpg "/>
تم immunoblotted الشكل 2. وصمة عار الغربية كلها تمثيلية للأنسجة العضلات والهيكل العظمي وكذلك الميتوكوندريا المعزولة. استخراج الأنسجة كله، وكذلك الميتوكوندريا المعزولة مع COX IV الأجسام المضادة كعلامة الميتوكوندريا وGAPDH الأجسام المضادة من أجل السيطرة غير الميتوكوندريا. لم يلاحظ أي فرقة GAPDH في الميتوكوندريا معزولة مشيرا إلى تلوث ضئيلة أو معدومة من مصادر غير الميتوكوندريا. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
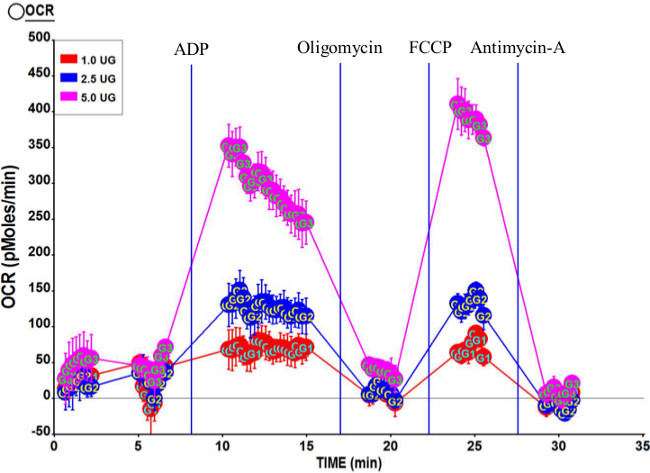
الشكل 3. الملف الشخصي respirometric الممثل الميتوكوندريا المعزولة من المتسعة الوحشية الإنسان. ثلاثة تركيزات الميتوكوندريا معزولة و 5.0 ميكروغرام، و 2.5 ميكروغرام، و 1.0 ميكروغرام نحن إعادة المستخدمة في هذا الاختبار. وكانت تركيزات النهائية من المركبات بعد الحقن ميناء 2 ملي ADP (منفذ A). 2 ميكرومتر أوليغوميسين (منفذ B)؛ 6 ميكرومتر FCCP (منفذ C)؛ و2 ميكرومتر أنتيمايسين إيه (منفذ D). كان RCR يحسب لهذا المدى 7.95. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
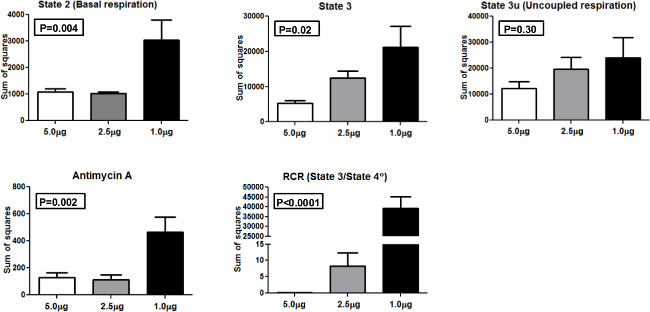
الشكل 4. مجموع المربعات. مجموع المربعات لمختلف الدول التنفس الميتوكوندريا وRCR باستخدام 5.0 ميكروغرام، و 2.5 ميكروغرام، و 1.0 ميكروغرام الميتوكوندريا. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
ig5highres.jpg "/>
الرقم 5. وهذا يمكن أن تستخدم كدليل لتقدير كمية البروتين الميتوكوندريا التي يمكن توقعها على أساس أولي العضلات عينة الوزن تحليل الانحدار: من كمية العضلات (ملغ) ومجموع العائد البروتين الميتوكوندريا (ملغ). كما هو متوقع، هناك علاقة إيجابية مباشرة بين كمية العضلات والبروتين الكلي الميتوكوندريا التي تم الحصول عليها.
Discussion
وغالبا ما تستخدم الميتوكوندريا المعزولة في الدراسات أن دراسة دور وظيفة ETC، فضلا عن الأنشطة الميتوكوندريا أخرى، بما في ذلك النقل الركيزة وTCA وظيفة دورة. المقايسات Respirometric باستخدام العضيات معزولة تسمح الفحص المباشر للعمليات الأساسية للالفسفرة والخصائص الذاتية للالخ. التنميط Respirometric الميتوكوندريا معزولة بالمقارنة مع الخلايا الكاملة أو الألياف العضلية permeabilized والمزايا من السهل نسبيا تفسير البيانات وعدم وجود "تدخل" من العمليات غير الميتوكوندريا أو التغيرات في الميتوكوندريا كتلة / نشوء حيوي. ويستند تطبيع البيانات عن محتوى البروتين الميتوكوندريا، مما يسمح مباشرة عبر المقارنة من الميتوكوندريا بين العينات. التنميط Respirometric الميتوكوندريا المعزول هو النهج المفضل عندما يكون الهدف من هذه الدراسة هو تحديد الآليات الكامنة وتحديد أهداف محددة مثل عنصر ETCق / المجمعات، أو آليات النقل الميتوكوندريا.
ووصف هو بروتوكول لخزعة العضلات وعزل الميتوكوندريا وظيفية من عينات الأنسجة الصغيرة. هذه الطريقة تعطي نتائج استنساخه بين المستخدمين، نظرا للاستخدام من الخالط الآلي مقابل يد تعمل المجانسة dounce. عزل الميتوكوندريا لا يمكن أن يؤديها مع اقل من 20 ملغ من الأنسجة العضلية. كمية من الميتوكوندريا المعزولة التي يمكن الحصول عليها من هذا حجم العينة كافية لتشغيل فرس البحر قياس التنفس القائم على لوحة في حين ترك الميتوكوندريا الفائضة للتجارب والتخزين الأخرى لإجراء المزيد من التحليلات الجزيئية. وتجدر الإشارة إلى أن هذا الأسلوب يمكن أن تترجم إلى XF 96، حيث يمكن استخدام كميات أصغر من الميتوكوندريا (1-2 ميكروغرام لكل بئر).
عدة بروتوكولات لعزل الميتوكوندريا تعتمد على المجانسة dounce لتعطيل الأنسجة الأولي. من عيوب هذا الأسلوب هو التدريب العملي على طبيعة الأنسجة الأوليةالتجانس. قوة وسرعة مدقة في الخالط يمكن أن تختلف بشكل كبير بين المشغلين 6. هذا يمكن أن يؤدي إلى التجربة إلى تجربة الاختلاف، فضلا عن الاختلاف المختبر إلى المختبر، ويؤدي إلى صعوبة في مقارنة البيانات بين التجارب. هذا هو مصدر قلق خاص في الدراسات تدخل الإنسان عندما يتم جمع البيانات من المشاركين في نقاط زمنية منفصلة، وعادة قبل وبعد العلاج، ويحتمل أن تكون في مواقع متعددة. نستخدم الخالط الآلي لاتباع نهج أكثر اتساقا أن يعطي نتائج أكثر استنساخه مع اختلاف محدود من شخص إلى شخص. سرعة إعداد أيضا يجعل هذا النهج مناسبة للتعامل مع عينات متعددة في نفس الوقت. عادة، ما يصل الى ثلاث تجارب لا يمكن أن يؤديها في يوم واحد.
تنشأ القيود المحتملة للتقنية وصفها هنا من استخدام العضيات معزولة واستخدام شكل قائم على طبق من ذهب. على سبيل المثال، بيكار وآخرون. يكون شيطانstrated أن الميتوكوندريا المعزولة تمتلك الخصائص الفنية التي تختلف جوهريا عن تلك التي الميتوكوندريا سليمة في myofibers permeabilized. واقترحوا أن تقنيات عزل الميتوكوندريا تنتج في وظيفة الطاقة البيولوجية المتغيرة، مثل زيادة كبيرة RCR مقارنة myofibers permeabilized يرافقه إنتاج أنواع الأكسجين التفاعلية أكبر 13. مقارنة ألياف العضلات permeabilized، والعزلة الميتوكوندريا لا تتطلب وقتا أطول التحضير. أيضا، وفقدان المحتوى الخلوي يقلل أهمية الفسيولوجية، وهو الأمر الذي يتم الاحتفاظ في الخلايا الكاملة والألياف حتى permeabilized. استخدام قياس التنفس القائم على لوحة مع تصاريح تقنية الموضحة تكرار أشواط لكل عينة. ومع ذلك، يجب الميتوكوندريا تلتزم الجزء السفلي من كل بئر. هذا التكوين يختلف عن بيئتهم الطبيعية ويمكن أن يؤثر على الخصائص الوظيفية. وبالإضافة إلى ذلك، تجدر الإشارة إلى أن استخدام هذا البروتوكول لعزل الميتوكوندريا، ذره قد تكون لا تزال تلوث من الشبكة الإندوبلازمية (ER) في إعداد الميتوكوندريا. الاختلافات في تلوث ER قد تؤثر على تحديد العائد والنفوذ النتائج الميتوكوندريا.
في الختام، تقدم هذه الدراسة البيانات التي تؤكد أن الميتوكوندريا المعزولة من الأنسجة باستخدام هذا الإجراء تنشط وظيفيا، ويمكن استخدامها للدراسات / التطبيقات التي تتطلب عالية الجودة الميتوكوندريا معزولة عن الحد الأدنى من عينات العضلات والهيكل العظمي. وميزة هذه الطريقة هي أن: ط) أنه من الممكن عزل الميتوكوندريا من كميات ضئيلة من العضلات والهيكل العظمي، والثاني) إجراء سريع، الثالث) مع التكنولوجيا لوحة مقرها، فمن الممكن لتشغيل عينات متعددة في نفس الوقت، والرابع) هناك ما يكفي من الأنسجة الفائض والميتوكوندريا معزولة بعد الفحص الطاقة البيولوجية للتخزين العينة وغيرها من التحقيقات البيولوجية الجزيئية.
Disclosures
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
Acknowledgements
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
References
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved