Method Article
경피적 바늘 생검에 의해 획득 골격근 조직에서 고립 된 미토콘드리아의 준비 및 호흡계 평가
요약
광근의 lateralis의 조직 검사, 정제 미토콘드리아의 준비, 호흡계 프로파일 링하는 방법이 설명되어 있습니다. 작은 부피의 근육 사용은 임상 연구 애플리케이션이 기술에 적합하다.
초록
절연 미토콘드리아 호흡계 프로파일은 일반적으로 전자 수송 체인 기능을 조사하기 위해 사용된다. 우리는 세포 외 플럭스 (XF) 분석기를 사용하여, 인간의 측광 근 lateralis의 샘플들을 획득하는 골격근 조직 최소량에서 미토콘드리아를 분리하는 방법은, 기초 플레이트 및 호흡계 프로파일을 설명한다. 1.0, 2.5 및 미토콘드리아의 5.0 μg의를 사용하여 얻은 호흡계 프로파일의 비교는 1.0 μg의는 호흡을 측정하기 위해 충분하다는 것을 나타냅니다 및 5.0 μg의 표준 오차의 비교를 기반으로 가장 일관된 결과를 제공. 미토콘드리아 마커 COX IV 및 비 미토콘드리아 조직 마커 GAPDH에 대한 격리 된 미토콘드리아의 웨스턴 블롯 분석이 프로토콜을 사용하여 제한된 비 미토콘드리아 오염이 있음을 나타냅니다. 근육 조직의 적은 20 mg의 미토콘드리아 respirometry을 연구 할 수있는 기능은 사용자가 임상에서 여러 연구 엔드 포인트에 대한 개별 조직 검사를 활용할 수 있습니다연구 프로젝트.
서문
미토콘드리아는 세포의 주 에너지 생산 현장이며 노화에 중요한 역할뿐만 아니라 심혈관 질환, 알츠하이머 질환, 당뇨병, 암, 비만 등의 각종 연령 관련 질환이있다. 격리 된 미토콘드리아의 호흡계 프로파일 링은 전자 수송 체인 (ETC) 함수를 직접 분석을 제공하고, 미토콘드리아 생물학에 대한 우리의 이해와 건강과 질병에서의 역할에 크게 기여하고있다. 격리 미토콘드리아이 원고에 기재된 방법론은 피험자로부터 얻어 골격근 조직 생검으로부터 분리 미토콘드리아 호흡계 분석을 허용하도록 최적화되었다 등 기판 운반, ATP 합성 효소 활성, 양자 누출, 같은 생체 에너지의 다양한 양상을 연구하기 위해 사용된다. 이 논문에 기술 된 조직 검사 프로토콜은 지난 12 년 동안 우리의 직원에 의해 이용되고있다. 우리 그룹은 다양한 연령대의 성인에 700 절차를 수행하고있다90년 이전까지, 어떤 불리한 안전 문제없이 다양한 만성 질환 조건. 이 프로토콜의 중요한 측면은 특별히 이에 임상 연구 과정에서의 사용을 촉진, 조직의 최소량을 이용하도록 설계되어 있다는 것이다.
다양한 프로토콜은 미토콘드리아를 분리하기 위해 개발되었다. 페르난데스-Vizarra 등. 1,2- 다양한 랫트 조직뿐만 아니라 배양 된 세포에서 미토콘드리아를 분리하는 방법을 설명했다. 가르시아 - Cazarin 등. 3 쥐와 마우스에서 골격 근육에서 미토콘드리아를 분리하는 방법을보고있다. 쥐의 뇌에서 미토콘드리아를 분리하는 방법도 이글 레시아 - 곤잘레스 등. 4 총에 의해보고 된, 등. 5 barocycler 및 / 또는 PCT 분쇄기를 사용하여 미토콘드리아를 분리하는 방법을보고했다. 최근, 프랑코 등. 6 항을 이용하여 고농축 미토콘드리아를 단리하는 방법을보고-TOM22 자석 구슬.
이러한 프로토콜은 우수한 결과를 산출하는 동안, 조직 크기 요구는이 원고에 기재된 방법에 비해 높다. 예를 들어, 총 등. 5 비복근 근육 1.5-1.8 g 및 신장 조직의 약 2g을 사용했다. 마찬가지로, 프랑코 등. 6은 500 mg의 마우스 간 조직을 사용 하였다. 우리의 경험에서, 전형적인 수율은 골격 근육 (광근의 lateralis)의 경피적 바늘 생검에서 예상되는 100 ~ 200 mg의 범위. 여기에 설명 된 프로토콜을 이용하여 근육 조직에 20-50 mg의 미토콘드리아 기능을 평가하는 능력은 다른 분자 생물학 실험하는데있어서의 장래의 사용을 위해 저장 당 생검 샘플에 여러 평가를 수행 할 수 있도록 허용. 이 임상 연구 및 샘플의 성실한 사용을 필요로하는 다른 연구에서 중요한 기능입니다. 그것은 이전에 냉동 미토콘드리아가 oute에 커플 호흡으로 인해 공부에 대한 좋은 아니라는 것을 주목해야한다미토콘드리아 막 손상 및 시토크롬 C 활동의 손실을 r에. 우리의 방법은 적응 챠펠 및 페리 (7) 발행 방법에서 수정되었습니다.
이 원고에 설명 된 방법을 사용하여, 우리는 최근 인간의 광근에서 분리 된 미토콘드리아의 호흡계의 프로필을 직접 보행 속도 (8)로 측정 된 신체 능력과 상관 관계가 lateralis 것으로보고있다.
프로토콜
참고 : 의학의 웨이크 포레스트 대학의 임상 시험 심사위원회의 승인 설명 프로토콜입니다. 동의서는 서면으로 얻었다. 모든 참가자는 23-35까지 BMIs으로, 남녀의 건강한 노인 (65-79년)이었다.
1. 골격 근육 생검
- 상술 한 바와 같이, 9 O / N 빠른 후 이른 아침에 모든 조직 검사를 수행합니다. 조직 검사 이전에 주 동안 출혈, 혈소판, 또는 멍이 영향을 미칠 수있는 아스피린, 처방전 이상 - 더 - 카운터 비 스테로이드 성 항 염증 약물, 또는 다른 화합물 것을 삼가하는 주제를 물어보십시오. 또한 조직 검사 이전에 적어도 36 시간 동안 격렬한 활동을 자제하는 참가자에게 물어보십시오.
주 : 근육 1 % 리도카인으로 국소 마취 경피적 바늘 경피적 생검 기술을 이용 lateralis 측광 근으로부터 구해진다. 의학 합병증하거나 오거기는이 과정에서 부작용이 임상 연구 장치에서 발생한보고했다. - 참고 : 설명 생검 절차는 버그 스트롬 (10)의 각색된다.
- 간단히 로컬 근육에 침투하지 1 % 리도카인 돌보는을 관리 할 수 있습니다. 충분한 마비를 허용하기 위해 10 분 대기 기간이 따릅니다.
- subfascial 및 myotendonous 지역을 피하고 근육 (삽입과 원점 사이의 근육의 중간 영역)의 뱃속에서 조직 검사를 가져 가라.
- 경피적 바늘 (창 내부 절단 실린더를 절단면이 흡입 지원 재사용 장치)를 사용하여 가이드로 근막의 근막 "팝업"또는 저항을 따릅니다.
- , 마취 바늘 깊이를 추정 한 후 다시 좁은 메스 블레이드로 느낌과 근막을 통해 4 ~ 5 밀리미터 절개를합니다. 그것이 근육에 삽입 될 때까지 절개를 통해 바늘을 전진.
- 수집창 여러 샘플을 서로 다른 방향으로 돌았 다. 전진과 다른 방향으로 경피적 바늘에 2-4 회 근육 샘플을 회수하는 동안 60 CC 주사기를 사용하여 연속 흡입을 적용합니다. 흡입을 중단하고 바늘을 제거합니다.
주 : 각 패스 (삽입 바늘의 제거) 분 미만 소요됩니다. - 5 분 지혈을 설정하는 보조 사이트에 구멍을하는 회사 압력을가 되세요. 흡입 튜브에서 바늘을 분리하고 조심스럽게 창 및 배럴에서 근육 샘플을 제거합니다.
- 더 근육이 상기 절차를 반복하여 필요한 경우 제 지나간다.
- , 집게를 사용하여 근육 샘플에서 보이는 혈전을 제거 샘플의 무게, 즉시 얼음처럼 차가운 DPBS를 포함하는 튜브에 배치합니다.
참고 :이 방법을 사용하여 평균 수율이 150 ± 20 mg을.
2. 미토콘드리아 절연
- 갓 실험, 또는 나누어지는 날에 어링 - 페리 (CP)과 미토콘드리아 분석 솔루션 (MAS) 버퍼 (표 1)을 준비하고 -20 ° C에 저장합니다. -20 ° C에서 2.5 mm의 농도와 나누어지는 및 매장에서 디메틸 설폭 사이드의 화합물을 제조. 준비의 하루 후 2 개월 이내에 -20 ° C에 저장된 버퍼와 화합물 분취 량을 사용합니다.
- 날카로운 가위와 핀셋을 사용하여 샘플에서 볼 결합 조직을 제거; 사용이 단계에 대한 해부 현미경이 필요합니다. 철저하게 피를 제거하기 위해 얼음처럼 차가운 DPBS 버퍼로 표본을 3 ~ 4 회 반복한다. 조직 검사에서 이상이 45 분을 초과하지 않도록주의하면서 가능한 한 빨리 얼음처럼 차가운 DPBS 및 프로세스에 샘플을 보관하십시오. 조심스럽게 근육 샘플에서 모든 힘줄이나 지방 조직을 제거하기 위해 예방 조치를 가져 가라.
- 즉시 살균 된 가위를 사용하여 미세 조각으로 근육 조직을 잘라 1 ml의 CPI 포함 된 홍보에 500 μL에 일시 중지0.2 ㎎ / g 조직 농도 oteinase (Nagarse). RT에서 5 분 배양과이에 따라 다음 얼음에 전송할 수 있습니다.
- 호 모지 나이저를 이용하여 자동으로 처리 Nagarse 다진 조직 균질화. 이 과정에서 얼음에 샘플을 유지합니다. 10,000 rpm의 속도 설정으로 자동화 된 균질기를 이용하여 2 초 펄스의 각 조직 샘플 네 번마다 균질화. 조직 사이의 증류수 다음 70 % 에탄올로 프로브를 씻으십시오.
- CP I (1 ml를 500 μL) 및 CP II의 2 배 볼륨 (2 ml의 1 ml)을 같은 부피로 균질화 된 조직을 씻고, 600 XG, 4 ° C에 대한에 원심 분리기 튜브와 원심 분리기의 내용을 수집 10 분. , 젖은 치즈 천 통해 뜨는을 전달 여액을 수집하고, 따라서 비 미토콘드리아 분획의 대부분을 제거, 펠렛을 폐기합니다.
3. 세척 미토콘드리아
- (10)에 위의 단계에서 뜨는을 원심 분리기,000 XG, 10 분 동안 4 ° C. 10,000 XG, 10 분 동안 4 ° C에서 CP II 버퍼와 더 원심 분리기의 4 용액에 펠렛을 일시 중단합니다.
참고 : 드문 경우, 혈액의 얇은 펠릿 미토콘드리아 펠릿 아래에 형성된다. 이 경우, CPII 버퍼와 부드러운 흡인에 의해 미토콘드리아 펠렛을 제거합니다. 이 단계는이 단계에서 완전히 혈액을 씻어함으로써 회피 할 수있다. - CP의 I 완충액 2 ㎖에서 얻어진 펠릿을 중단. 이 단계에서 단백질 추정을위한 현탁액에서 작은 나누어지는을 사용합니다. 나는 위와 같이 버퍼와 원심 분리기 CP의 나머지 샘플을 재현 탁. 미토콘드리아 정량법 솔루션 (MAS)의 최소량 (200 μL)에 최종 펠렛을 일시.
주 : CP의 I 버퍼 BSA가 없으므로 단백질 시료에서 나중에 BSA이 있는가 현탁 될 것이다 MAS 반면,이 단계에서 분석된다.
4. 추정 BCA 단백질 분석 키트를 사용하여 단백질 농도를 측정하여 콘텐츠 미토콘드리아
참고 : 호흡계 측정을 위해, 또는 웨스턴 블롯 실험에 대해 24 웰 마이크로 플레이트에로드하는 데 사용 미토콘드리아의 양을 계산하기 위해이 농도를 사용합니다. 단백질 농도의 계산에 고려 희석 계수 (10)를 타고.로저스, GW, 등에 의해 설명 된대로 5. XF 분석을 수행합니다. (12)
주 : 2 pmole의 O / 분 2 O 소비율 (OCR)를 시각화, 또는 데이터 출력이 O 및 산도의 절대 수준.
- 화합물을 제조하는 1 배 MAS를 사용하는 주입한다. 다음과 같이 최종 농도를 제공하기 위해 포트 AD에 화합물의 10 배 농도를 추가 포트, ADP를 [아데노신 5 '-diphosphate, 2 mM의 50 μL] 포트 B, oligomycin (2 μM, 55 μL); 포트 C, FCCP [카르 보닐 시안화 4- (트리 플루오 로메 톡시) 페닐, 6 μM, 60 μL] 및 포트 D, 2 μM의 antimycin-A (65 μL). 준비웰의 수에 필요한 충분한 양의 화합물.
- 적정에 의해 미토콘드리아의 최적의 양을 결정합니다. 예를 들어, 부하 1.0 μg의 2.5 μg의, 및 기판을 포함하는 얼음처럼 차가운 1 배 MAS의 50 μl의 볼륨에 잘 당 미토콘드리아의 5.0 μg의. 첫째 차가운 1X MAS + 기판에 10 배 미토콘드리아를 희석, 우물 사이의 변동성을 최소화합니다. 다음으로, (배경 보정 우물 제외) 각 웰에 현탁액의 50 μl를 제공합니다.
- 2000 XG, 4 ° C에서 20 분에서 접시를 원심 분리기. 각 웰 (아래 참조 초기 조건) 원심 분리 후, 부드럽게 1X MAS의 + 숙시 네이트 (10 mM의) 및 로테 논 (2 μM)의 450 μl를 추가합니다. XF 분석기에 접시를 전송하기 전에 잘 균질 준수를 확인하기 위해 현미경으로 미토콘드리아를 볼 수 있습니다.
참고 : 호흡 중 ETC 복잡한 I 복잡한 II에 의해 구동되어 있는지 여부에 따라 달라집니다 사용되는 초기 조건. 복잡한 II 중심의 호흡을 위해, SU를 사용ccinate (10 mM)을 초기 상태 로테 논 (2 μM). 로테 논 블록 복잡한 I 및 숙시 네이트는 복잡한 II (숙신산 탈수소 효소)의 연료를 제공합니다. 복합체 I에 의해 구동 호흡 공부, 초기 조건으로서 10 mM의 최종 농도 5mM의 말산 또는 글루타메이트 각각의 최종 농도로 피루브산 말산, 각 하나를 사용한다. 후자는 트리 카르 복실 산주기 및 기판 이송 중 장애를 구별에 도움이 될 수 있습니다. 모두 복잡한 I 복잡한 II에 의해 구동 호흡을 연구 초기 조건으로 로테 논 또는 말 산염없이 피루브산과 숙시 네이트를 포함합니다. β 산화를위한 기판으로 팔미 토일 카르니틴을 사용합니다. - 순차적으로 앞서 기술 된 바와 같이 (12)를 프로그래밍하여 호흡계를 이용하여 실시간으로 미토콘드리아 호흡을 측정한다. 표 2에 제공된 호흡계의 설정을 사용한다.
참고 : 다음과 같이 다양한 미토콘드리아 호흡 상태에 대한 간략한 설명은 다음과 같습니다 : - 주 2 = 기판 현재와 결합 된 상태; 주 ADP 포화의 존재에 호흡을 인산화 3 =; oligomycin에 의해 유도 주 4 O = 비 인산화 호흡; 주 3U = uncoupler FCCP에 의해 자극 최대 비 결합 호흡; antimycin-A로 복잡한 III 억제 후 잔여 비 미토콘드리아 호흡 = 호흡. 또한, 미토콘드리아 농도와 조합 OCR 측정의 길이가 측정 기간 동안 산소를 파괴하여 데이터에 영향을 미칠 수 있음을 지적한다.
6. 서쪽 오점
참고 : 최종 샘플에서 미토콘드리아의 농축을 보장하기 위해 웨스턴 블로 팅에 의해 미토콘드리아 마커 COX IV 및 전체 조직 GAPDH를 결정
- 12 % 나트륨 도데 실 설페이트 폴리 아크릴 아미드 겔에 의해 격리 된 미토콘드리아 및 전체 조직 추출물을 분리.
- 폴리 불화 비닐 리덴 (PVDF) 막에 단백질을 전송.
- COX IV 항체 (1 : 20,000)과 함께 인큐베이션 고추 냉이 퍼 옥시 다제 (HRP)은 다음, 이차 항체를 π 공역. GAPDH 검지, GAPDH 모노클로 날 항체 (: 2000 1)와 프로브 블롯 스트립.
참고 : ER 오염의 차이가 문제의 경우, 이러한 분석에 ERp72, calnexin, 또는 칼레 티 큘린 같은 ER 마커를 포함한다.
결과
도 1은 전체 프로토콜의 상세한 흐름도를 나타낸다.
COX IV / GAPDH (그림 2)의 웨스턴 블롯 프로파일은 미토콘드리아 단백질, COX IV 및 비 미토콘드리아 마커, GAPDH의 발현을 묘사한다. COX IV 및 GAPDH의 발현은 모두 전체 근육 해물 분명하다. 미토콘드리아가이 프로토콜에 기재된 기술을 이용하여 분리 한 후 GAPDH가 동일한 노출 부재시에, COX IV 밴드는 여전히 명백하다. 긴 노출 희미한 GAPDH 대역을 표시 할 수 있습니다. 이 말은 고립 된 미토콘드리아는 최소한의 비 미토콘드리아 오염을 나타냅니다. 또한, 절연 미토콘드리아 COX IV 식은 샘플 간의 일치한다.
그림 3은 1.0 μg의 2.5 μg의, 미토콘드리아의 5.0 μg의를 사용하여 복잡한 II (숙시 네이트와 로테 논)에 의해 구동 전형적인 호흡계 프로파일을 보여줍니다. 예상대로, 전체 OCR 승 증가i 번째의보다 많은 양의 미토콘드리아. 이 분석을위한 계산 된 호흡 비율 제어 (RCR)은 미토콘드리아 제제 고품질 인 것을 나타내는, 7.95이다. 더욱이, 상태 3U OCR은 미토콘드리아 품질 확인, 상태 (3)보다 약간 높다.
미토콘드리아의 상이한 양을 프로파일 링 할 때 결과의 일관성을 비교하기 위해, 우리는 ANOVA (분산 분석)을 수행하여 분산의 실제 값과 같은 사각형 (SS)의 합계를 산출 1.0 μg의 2.5 μg의, 미토콘드리아의 5.0 μg의 당로드 잘 (그림 4). SS는 상태 2, 상태 3, 상태 3U, antimycin의 A, 및 RCR 위해 제시된다. 주 2 및 주 3 측정을 위해 한 방향으로 분산 분석 (각각 P <0.01, P <0.05) 통계적으로 유의했다. 마찬가지로, 하나의 방법 ANOVA가 antimycin 및 RCR (P <0.01, P <0.0001 통계적으로 유의 한 각각. 유의 한 차이는 그룹 간 상태 3U에 대한 보이지 않았다. 목양반 결과가 아니라 당 미토콘드리아의 5.0 μg의 다른 농도에 비해 가장 낮은 SS를 준 참가자의 우리의 인구를 가진 XF 24 시스템에서 사용할 수있는 최적의 양을 나타냅니다.
도 5는 많은 단백질이 미토콘드리아 초기 근육 샘플 크기에 기초하여 예상 될 수있는 방법을 나타 내기 위해 가이드로서 기능한다. 예상 한 바와 같이 처리 된 근육 (MG)의 양과 최종 시료의 총 미토콘드리아 단백질 함량 (mg)을 사이에 강한 상관 관계가있다.
| 어링 - 페리 버퍼 I (CPI) | |
| 화학 | 집중 |
| 의 KCl | 100 mM의 |
| MOPS | 50 mM의 |
| EDTA | 1 ㎜ |
| 황산 | 5 mM의 |
| ATP | 1 ㎜ |
| pH를 | 7.4 |
| 어링 - 페리 버퍼 II (CPII) | |
| 화학 | 집중 |
| 의 KCl | 100 mM의 |
| MOPS | 50 mM의 |
| EDTA | 1 ㎜ |
| 황산 | 5 mM의 |
| ATP | 0.2 mM의 |
| 지방산 무료 BSA | 0.50 % |
| pH를 | 7.4 |
| 미토콘드리아 분석 솔루션 (MAS) (2 배) | |
| 화학 | 집중 |
| 자당 | 35 mM의 |
| 만니톨 | 110 mM의 |
| KH 2 PO 4 | 2.5 mM의 |
| 의 MgCl 2 | 2.5 mM의 |
| HEPES | 1.0 mM의 |
| EGTA | 0.5 mM의 |
| 지방산 무료 BSA | 0.10 % |
| pH를 | 7.4 |
| 복잡한 II 초기 조건과 미토콘드리아 분석 솔루션 (MAS) | |
| 화학 | 집중 |
| 1X MAS | |
| 호박산 | 10 mM의 |
| 로테 논 | 2 μM |
| pH를 | 7.4 |
| 복잡한 I 초기 조건과 미토콘드리아 분석 솔루션 (MAS) | |
| 화학 | 집중 |
| 1X MAS | |
| 피루브산 | 5 mM의 |
| 말라 테 | 5 mM의 |
| pH를 | 7.4 |
| * 모든 버퍼 탈 이온수로 만들어 질 | |
표 1. 솔루션 및 버퍼 조리법.
| 프로토콜 단계 | ||
| StartProtocol | ||
| 명령 | 시간 (분) | 포트 |
| 교정 | 0.00 | |
| 잠깐만 요 | 10.00 | |
| 혼합 | 1.00 | |
| 잠깐만 요 | 3.00 | |
| 혼합 | 1.00 | |
| 잠깐만 요 | 3.00 | |
| 혼합 | 0.50 | |
| 측정 | 3.00 | |
| 혼합 | 1.00 | |
| 측정 | 3.00 | |
| 혼합 | 0.50 | |
| 주사 | ||
| 혼합 | 1.00 | |
| 측정 | 6.00 | |
| 혼합 | 1.00 | |
| 주사 | B | |
| 혼합 | 1.00 | |
| 측정 | 3.00 | |
| 혼합 | 1.00 | |
| 주사 | C | |
| 혼합 | 1.00 | |
| 측정 | 3.00 | |
| 혼합 | 1.00 | |
| 주사 | 디 | |
| 혼합 | 1.00 | |
| 측정 | 3.00 | |
| EndProtocol | ||
표 2. 믹스, 측정, 및 호흡계에 대한주기 설정을 섞는다.

그림 전체 프로토콜 1. 순서도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
/ftp_upload/52350/52350fig2highres.jpg "/>
그림 2. 전체 골격 근육 조직뿐 아니라 고립 된 미토콘드리아에 대한 대표적인 웨스턴 블롯. 전체 조직 추출물뿐만 아니라 고립 된 미토콘드리아는 비 미토콘드리아 제어를위한 미토콘드리아 마커와 GAPDH 항체와 같은 COX IV 항체 immunobloting을했다. 어떤 GAPDH 대역이 아닌 미토콘드리아 소스에서 거의 또는 전혀 오염을 나타내는 격리 된 미토콘드리아에서 관찰되지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
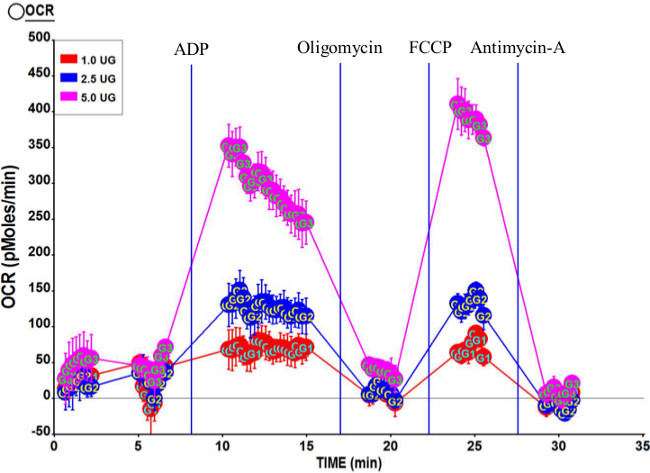
인간 광근에서 분리 미토콘드리아의 그림 3. 대표 호흡계의 프로필 lateralis. 격리 된 미토콘드리아의 세 가지 농도 5.0 μg의 2.5 μg의, 1.0 μg의 우리 이 분석에 사용되는 재. 포트 주사 후 화합물의 최종 농도는 2 mM의 ADP (포트)을했다; 2 μM의 oligomycin (포트 B); 6 μM FCCP (포트 C); 2 μM는 A (포트 D)를 antimycin. 이 실행에 대한 계산 RCR는 7.95이었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
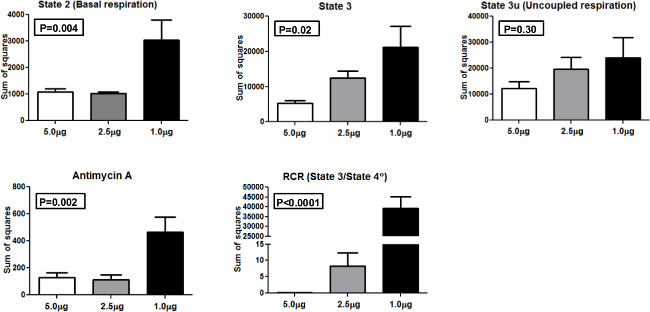
5.0 μg의 2.5 μg의, 1.0 μg의 미토콘드리아를 사용하여 다른 미토콘드리아 호흡 상태와 RCR을위한 사각형의 그림 4 제곱의 합계. 합계. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
ig5highres.jpg "/>
.도 5는이 샘플의 초기 중량 근육 회귀 분석에 기초하여 예상 될 수 미토콘드리아 단백질의 양을 추정하기위한 안내로서 사용될 수있다 : 근 (㎎) 총 미토콘드리아 단백질 수율 (MG)의 양. 예상 한 바와 같이, 근육의 양과 얻어지는 총 미토콘드리아 단백질 사이의 직접적인 상관 관계가있다.
토론
미토콘드리아는 종종 절연 기판 운반 및 TCA 사이클 기능을 구비 ETC 함수의 역할뿐만 아니라 다른 미토콘드리아 활동을 조사 연구에 이용된다. 고립 된 세포 기관을 사용 호흡계 분석은 산화 적 인산화의 기본 프로세스와 등 고유 특성을 직접 시험을 허용 전체 세포 또는 투과 가능 근육 섬유에 비해 고립 된 미토콘드리아의 호흡계 프로파일 링은 상대적으로 쉽게 데이터 해석의 장점과 미토콘드리아 질량 / 생물 발생에 비 미토콘드리아 프로세스 또는 변경에서 "간섭"의 부재가있다. 데이터의 정규화함으로써 샘플 간의 미토콘드리아 간단한 상호 비교를 허용 미토콘드리아 단백질 함량에 기초한다. 절연 미토콘드리아 호흡계 프로파일 링 연구의 목적은 기저 메커니즘 및 ETC 성분으로서 특정 목표물을 식별 결정하는 바람직한 접근법이다S / 착체 또는 미토콘드리아 반송기구.
작은 조직 샘플에서 근육 조직 검사 및 기능 미토콘드리아의 분리를위한 프로토콜입니다 설명한다. 손 다운스 균질화 조작 대 인해이 방법은 자동화 된 균질의 사용자들 사이에 이용 재현 가능한 결과를 산출한다. 미토콘드리아의 분리 근조직의 적은 20 mg을 행할 수있다. 이 샘플 크기로부터 얻어 질 수 절연 미토콘드리아의 양은 상기 분자에 대한 다른 실험 분석 및 저장을 위해 잉여 미토콘드리아 남기고 해마 플레이트 기반 respirometry을 실행하기에 충분하다. 이것은이 방법은 미토콘드리아의 더 작은 양 (μg의 웰 당 1-2)을 사용할 수있다 XF (96)로 변환 될 수 있다는 점에주의 할 수있다.
분리 미토콘드리아에 대한 몇 가지 프로토콜은 초기 조직 중단에 대한 다운스 균질에 의존하고있다. 이 방법의 단점은 실습 초기 조직의 특성상균질화. 균질에서 유봉의 힘과 속도는 사업자 6 사이에 상당히 다를 수 있습니다. 이 실험 대 실험 변동뿐만 아니라 실험실 사이 변동 초래 실험간에 데이터를 비교하는 어려움에 이르게 할 수있다. 참가자의 데이터가 일반적으로 치료 전과 후, 그리고 잠재적으로 여러 사이트에서 별도의 시점에서 수집 할 때 인간의 개입 연구에서 특별히 관심을 가져야하는 부분입니다. 우리는 제한된 개인 대 개인의 변화와 재현성 결과를 얻을 수보다 일관된 접근 방식에 대한 자동화 된 호모 게 나이저를 사용합니다. 제제의 속도도 동시에 여러 샘플을 처리하기에 적합한 이러한 접근한다. 통상적으로, 최대 세 실험은 하루에 수행 될 수있다.
여기에 기재된 기술의 제한점을 격리 소기관의 사용과 플레이트 - 기반 포맷의 사용으로부터 발생한다. 예를 들어는, 피카 등. 악마가격리 된 미토콘드리아가 투과 가능 근섬유에 손상 미토콘드리아와는 근본적으로 다른 기능적 특성을 가지고 있음을 strated. 그들은 미토콘드리아 분리 기술은 큰 반응성 산소 종 생산을 13 수반 투과 가능 근섬유에 비해 상당히 증가 RCR로서 바이오 에너지 변경된 기능 발생할 것을 제안했다. 투과 가능 근육 섬유에 비해 미토콘드리아 단리 긴 준비 시간이 필요 않는다. 또한, 휴대 내용의 손실은 생리 학적 관련성, 전체 세포와도 투과 가능 섬유에 유지 뭔가를 감소. 설명 된 기술 허가와 함께 접시 기반 respirometry의 사용은 샘플 당 실행을 복제합니다. 그러나 미토콘드리아 각 웰의 바닥을 준수해야합니다. 이 구성은 통상 상이한 환경 및 기능적 특성에 영향을 미칠 수있다. 또한, 유의할 점은이 미토콘드리아 단리 프로토콜을 사용하여, 거기는전자는 여전히 미토콘드리아 준비 소포체 (ER)에서 오염 될 수있다. ER 오염의 차이는 미토콘드리아의 수율과 영향력 결과의 결정에 영향을 미칠 수 있습니다.
결론적으로,이 연구는이 절차를 사용하여 조직으로부터 격리 미토콘드리아 기능적 활성 연구 및 / 골격근 샘플 최소량에서 고품질 절연 미토콘드리아를 필요로하는 애플리케이션을 위해 사용될 수 있음을 확인하는 데이터를 제공한다. 이 방법의 장점이 있다는 것이다 : I)는 골격근의 최소량에서 미토콘드리아를 분리 할 수 있고, ⅱ) 과정은, ⅲ) 플레이트 기반 기술로는 동시에 여러 샘플을 실행할 수있어, 신속 및 ⅳ) 샘플 저장 및 다른 분자 생물학적 연구를위한 바이오 에너지 분석 후 충분한 잉여 조직과 격리 된 미토콘드리아가있다.
공개
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
감사의 말
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
참고문헌
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유