Method Article
Préparation et respirométrique évaluation des mitochondries isolées de tissu musculaire squelettique Obtenu par biopsie percutanée aiguille
Dans cet article
Résumé
Méthodes pour la biopsie du vaste externe, préparation de mitochondries purifiées, et le profilage respirométrique sont décrits. L'utilisation de petit volume musculaire rend cette technique convient pour des applications de recherche clinique.
Résumé
Respirométrique profilage des mitochondries isolées est couramment utilisé pour étudier la fonction électronique de la chaîne de transport. Nous décrivons une méthode pour obtenir des échantillons de vaste externe humaines, isoler les mitochondries des quantités minimes de tissu musculaire squelettique, et la plaque profilage respirométrique base en utilisant un flux extracellulaire (XF) analyseur. Comparaison des profils respirométriques obtenus en utilisant 1,0, 2,5 et 5,0 pg de mitochondries indiquent que 1,0 ug est suffisant pour mesurer la respiration et que 5,0 ug fournit des résultats plus constants sur la base de la comparaison des erreurs standard. Analyse par Western blot des mitochondries isolées pour le marqueur mitochondrial COX IV et non mitochondrial marqueur de tissu GAPDH indiquer qu'il ya contamination non limitée mitochondriale utilisant ce protocole. La possibilité d'étudier respirométrie mitochondrial en aussi peu que 20 mg de tissu musculaire permet aux utilisateurs d'utiliser biopsies individuels pour plusieurs paramètres de l'étude en cliniqueprojets de recherche.
Introduction
Les mitochondries sont les sites de production d'énergie primaire dans la cellule et ont un rôle important dans le vieillissement ainsi que divers troubles liés à l'âge comme les maladies cardiovasculaires, la maladie d'Alzheimer, le diabète, le cancer et l'obésité. Respirométrique profilage des mitochondries isolées fournit une analyse directe de la fonction de la chaîne de transport d'électrons (ETC) et a contribué de manière significative à notre compréhension de la biologie mitochondriale et son rôle dans la santé et la maladie. Mitochondries isolées sont utilisées pour étudier divers aspects de la bioénergétique comme, transport de substrat, l'activité de l'ATP synthase, fuite de protons, etc. La méthodologie décrite dans ce manuscrit a été optimisé pour permettre une analyse respirométrique des mitochondries isolées de biopsies de tissus du muscle squelettique obtenus à partir de sujets humains. Le protocole de biopsie décrit dans ce manuscrit a été utilisé par notre personnel pour les 12 dernières années. Notre groupe a effectué plus de 700 procédures sur les adultes de différents âges,jusqu'à 90 ans, et avec diverses maladies chroniques sans aucun problème de sécurité défavorables. Un aspect clé de ce protocole est qu'il est spécifiquement conçu pour utiliser des quantités minimes de tissu, ce qui facilite son utilisation dans les études de recherche clinique.
Divers protocoles ont été développés pour isoler les mitochondries. Fernandez-Vizarra et al. 1,2 décrit un procédé pour isoler les mitochondries à partir de différents tissus de rat ainsi que des cellules en culture. Garcia-Cazarin et al. 3 ont fait état d'une méthode pour isoler les mitochondries à partir de muscles squelettiques de rat et la souris. Procédé pour isoler les mitochondries à partir de cerveau de rat a également été rapporté par Iglesias-Gonzales et al. 4 Gross, et al. Ont rapporté 5 un procédé pour isoler les mitochondries à l'aide du barocycler et / ou le destructeur de PCT. Récemment, Franko et al. 6 rapporté un procédé pour isoler les mitochondries fortement enrichis utilisant des anticorps anti-TOM22 Billes magnétiques.
Bien que ces protocoles donnent d'excellents résultats, les exigences de taille de tissu sont élevées par rapport à la méthode décrite dans ce manuscrit. Par exemple, Gross et al., 5 g de 01/05 à 01/08 utilisé le muscle gastrocnémien, et environ 2 g de tissu rénal. De même, Franco et al. 6 utilisé 500 mg de tissu de foie de souris. D'après notre expérience, les rendements typiques à attendre de la biopsie percutanée du muscle squelettique (vaste externe) vont de 100 à 200 mg. La capacité à évaluer la fonction mitochondriale dans 20-50 mg de tissu musculaire en utilisant le protocole décrit ici permet aux utilisateurs d'effectuer des évaluations multiples par biopsie et à conserver les échantillons pour une utilisation future dans d'autres expériences de biologie moléculaire. Ce est une caractéristique essentielle dans la recherche clinique et d'autres études qui nécessitent l'utilisation diligente des échantillons. Il convient de noter que les mitochondries préalablement congelés ne sont pas bonnes pour l'étude de la respiration couplé en raison de outEr dommages de la membrane mitochondriale et la perte de l'activité du cytochrome C. Notre méthode a été adaptée et modifiée de la méthode publiée par Chappell et Perry 7.
En utilisant les méthodes décrites dans ce manuscrit, nous avons récemment rapporté que le profil respirométrique des mitochondries isolées à partir Vastus humaine lateralis est directement corrélée avec la capacité physique, mesurée comme la vitesse de marche 8.
Protocole
REMARQUE: Le protocole décrit a été approuvé par le Conseil de l'École de médecine de Wake Forest Institutional Review. Le consentement éclairé a été obtenu par écrit. Tous les participants étaient des adultes âgés en bonne santé (65 à 79 ans) des deux sexes, ayant un IMC allant de 23 à 35.
1. Skeletal Muscle biopsie
- Comme décrit précédemment, neuf effectuer toutes les biopsies en début de matinée après une O / N rapide. Demandez aux sujets de se abstenir de prendre de l'aspirine, de prescription et over-the-counter médicaments anti-inflammatoires non stéroïdiens, ou d'autres composés qui peuvent affecter des saignements, des plaquettes, ou des ecchymoses pour la semaine avant la biopsie. Demandez aux participants de se abstenir également de toute activité physique intense pendant au moins 36 heures avant la biopsie.
REMARQUE: Muscle est obtenu à partir du vaste externe en utilisant la technique aiguille de biopsie percutanée avec une aiguille percutanée sous anesthésie locale avec 1% de lidocaïne. Pas de complications médicales ou other signalé les effets indésirables de la procédure ont eu lieu dans notre unité de recherche clinique. - NOTE: La procédure de biopsie décrite est adaptée de celle de 10 Bergstrom.
- Brièvement, administrer localement une prise% de lidocaïne soin de ne pas se infiltrer dans le muscle. Suivez ce avec une période d'attente de 10 min pour permettre engourdissement suffisante.
- Prenez les biopsies du ventre du muscle (la région centrale du muscle entre l'insertion et de l'origine) en évitant les zones sous-aponévrotique et myotendonous.
- Utilisez percutanée à l'aiguille (un appareil réutilisable d'aspiration assistée avec un côté fenêtre et cylindre de coupe intérieure de coupe) et de suivre un aponévrotique «pop» ou la résistance de l'aponévrose comme un guide.
- Estimer la profondeur avec l'aiguille d'anesthésie, puis de nouveau sentir avec la lame de bistouri étroit et faire une incision de 4-5 mm à travers le fascia. Avancer l'aiguille à travers l'incision jusqu'à ce qu'elle soit insérée dans le muscle.
- Recueillirplusieurs échantillons avec la fenêtre tournés dans des directions différentes. Appliquer une aspiration continue à l'aide d'une seringue de 60 cc en avançant et en retirant des échantillons de muscles dans l'aiguille percutanée deux à quatre fois dans des directions différentes. Cesser d'aspiration et de retirer l'aiguille.
NOTE: Chaque passage (insertion et le retrait de l'aiguille) devraient prendre moins d'une minute. - Demander à un assistant applique une pression ferme pour percer site pour 5 min à établir l'hémostase. Débranchez aiguille du tuyau d'aspiration et enlever soigneusement échantillons de muscles de la fenêtre et le baril.
- Faire une deuxième passe si plus de muscle est nécessaire en répétant la procédure ci-dessus.
- Retirez les caillots de sang de l'échantillon musculaire en utilisant une pince, peser l'échantillon, et le placer immédiatement dans un tube contenant du DPBS glacées.
NOTE: Le rendement moyen en utilisant cette méthodologie est de 150 ± 20 mg.
2. Isolement mitochondriale
- Fraîchement préparer le Chappel-Perry (CP) et mitochondrial Dosage Solution (MAS) tampons (tableau 1) le jour de l'expérience, ou aliquote et de les stocker à -20 ° C. Préparer les composés dans du diméthylsulfoxyde à une concentration de 2,5 mM et aliquote et stocker à -20 ° C. Utilisez les aliquotes de tampon et de composés stockées à -20 ° C dans les 2 mois à partir du jour de préparation.
- Retirer le tissu conjonctif visible de l'échantillon en utilisant ciseaux et des pinces acérées; si nécessaire l'utilisation d'un microscope binoculaire pour cette étape. Laver soigneusement les spécimens 3-4 fois avec un tampon de DPBS glacé pour éliminer le sang. Gardez les échantillons sur DPBS et processus glacés dès que possible, en prenant soin de ne pas dépasser plus de 45 min de biopsie. Prenez des précautions pour retirer soigneusement tous les tendons ou les tissus adipeux de l'échantillon de muscle.
- Hacher immédiatement le tissu musculaire en petits morceaux à l'aide d'une paire de ciseaux stériles et de suspendre dans 500 pi à 1 ml contenant IPC proteinase (Nagarse) à une concentration de 0,2 mg / g de tissu. Suivez ce avec une incubation de 5 min à température ambiante, puis les transférer à la glace.
- Homogénéiser les tissus hachés traités avec l'aide d'un homogénéisateur Nagarse automatisé. Conserver l'échantillon sur la glace tout au long de ce processus. Homogénéiser chaque échantillon de tissu à quatre reprises, chaque fois pour une impulsion de 2 secondes, aide de l'homogénéisateur automatisé à un réglage de vitesse de 10 000 tours par minute. Laver la sonde avec de l'éthanol à 70% puis à l'eau distillée entre les tissus.
- Laver le tissu homogénéisé avec un volume égal de CP I (500 ul à 1 ml) et 2x volume de CP II (1 ml à 2 ml), et de recueillir le contenu dans un tube de centrifugation et centrifuger à 600 xg, 4 ° C pendant 10 min. Passez le surnageant à travers une étamine mouillée, recueillir le filtrat et jeter le culot, éliminant ainsi la majorité des fractions non-mitochondriales.
3. laver les mitochondries
- Centrifuger le surnageant provenant de l'étape ci-dessus à 10,000 xg, 4 ° C pendant 10 min. Suspendre le culot dans 4 ml de CP II tampon et encore centrifuger à 10 000 xg, 4 ° C pendant 10 min.
NOTE: En de rares occasions, une fine pastille de sang est formée en dessous le culot mitochondrial. Dans ce cas, retirez le culot de mitochondries par aspiration douce avec un tampon de CPII. Cette étape peut être évité en lavant soigneusement le sang à l'étape 2. - Suspendre le culot obtenu à 2 ml de tampon CP I. A ce stade, utiliser une petite aliquote de cette suspension pour l'estimation de la protéine. Reprendre l'échantillon restant dans CP I tampon et centrifuger comme décrit. Suspendre le culot final dans une quantité minimale (200 pi) de mitochondrial Assay Solution (MAS).
REMARQUE: Les protéines sont dosés à ce stade car tampon CP I n'a pas BSA, alors que MAS dans laquelle les échantillons seront suspendus tard ne avoir BSA en elle.
4. Estimation du contenu mitochondrial par mesure Concentration en protéines aide d'un kit de dosage de protéines BCA
NOTE: Utilisez cette concentration pour calculer la quantité de mitochondries utilisés pour le chargement sur une microplaque de 24 puits pour les mesures respirométriques, ou pour des expériences de Western blot. Prendre en compte le facteur de dilution (10) pour le calcul de la concentration en protéines.5. Effectuer les tests XF comme décrit par Rogers, GW, et al. 12
REMARQUE: Visualiser le taux de consommation d'O 2 (OCR) en O 2 pmoles / min, ou les niveaux absolus de O 2 et un pH dans la sortie de données.
- Utilisez 1x MAS pour préparer des composés à injecter. Ajouter une concentration 10X des composés aux ports AD pour donner une concentration finale comme suit: Port A, ADP [Adénosine 5 '-diphosphate, 2 mM, 50 ul]; le port B, oligomycine (2 uM, 55 ul); le port C, FCCP [carbonyl cyanure 4- (trifluorométhoxy) phénylhydrazone, 6 pm, 60 pi]; et le port D, 2 uM antimycine-A (65 pi). Préparerun volume suffisant de composés pour le nombre requis de puits.
- Déterminer la quantité optimale de mitochondries par titrage. Par exemple, charge 1,0 ug, 2,5 ug, 5,0 ug et de la mitochondrie par puits dans un volume de 50 ul de 1 x glacées contenant MAS substrat. Pour minimiser la variabilité entre les puits, d'abord dilué 10x mitochondries dans le substrat 1x MAS + froid. Ensuite, 50 ul de fournir cette suspension dans chaque puits (à l'exception des puits de correction d'arrière-plan).
- Centrifuger la plaque à 2000 xg, 20 min à 4 ° C. Après centrifugation, ajouter doucement 450 ul de 1 x MAS succinate + (10 mM) et la roténone (2 pM) (conditions initiales, voir ci-dessous) à chaque puits. Voir les mitochondries sous le microscope pour assurer le respect homogène pour le bien avant de transférer la plaque à l'analyseur XF.
REMARQUE: Les conditions initiales utilisées dépendra de savoir si la respiration est entraîné soit par ETC I ou II du complexe complexe. Pour la respiration complexe entraîné II, utilisez succinate (10 mM) et la roténone (2 uM) en tant que conditions initiales. blocs de roténone I et succinate complexe fournit le carburant pour les complexes II (succinate déshydrogénase). Pour étudier la respiration entraînée par complexe I, appliquez une pyruvate et malate, chacun à une concentration finale de 5 mM de glutamate ou malate et chacun à une concentration finale de 10 mM en tant que conditions initiales. Celui-ci peut aider à distinguer entre la dysfonction cycle de Krebs et de transport de substrat. Pour étudier la respiration entraînée par deux I et II du complexe complexe, notamment pyruvate et succinate sans roténone ou malate comme conditions initiales. Utilisation palmitoyl carnitine en tant que substrat pour β-oxydation. - Mesurer séquentiellement la respiration mitochondriale en temps réel en utilisant le respiromètre par elle programmation comme décrit précédemment 12. Utilisez les paramètres pour le respiromètre fourni dans le tableau 2.
REMARQUE: Une brève explication des différents états de la respiration mitochondriale sont comme suit: - État 2 = état couplé avec le substrat présente; 3 = Etat de phosphorylation respiration en présence de saturer ADP; Etat 4 o = non-phosphorylation induite par la respiration oligomycine; 3u État = maximale respiration découplé stimulé par le FCCP découplant; Résiduelle non mitochondrial respiration = respiration après complexe III inhibition par antimycine-A. Il convient également de rappeler que, la longueur de la mesure OCR en combinaison avec la concentration mitochondrial pourrait influencer les données en épuisant l'oxygène au cours des périodes de mesure.
6. Western Blot
NOTE: Déterminer le marqueur mitochondrial COX IV et GAPDH de tissu entier par Western blot pour assurer l'enrichissement des mitochondries dans l'échantillon final
- Séparez les mitochondries isolées et l'extrait de tissu entier de 12% dodécyle sulfate de sodium gels de polyacrylamide.
- Transférer les protéines sur un polyfluorure de vinylidène (PVDF).
- Incuber avec l'anticorps COX IV (1: 20.000), suivi par la peroxydase de raifort (HRP) conjugué à des anticorps secondaires. Pour la détermination de GAPDH, dépouiller la tache et la sonde avec un anticorps monoclonal GAPDH (1: 2000).
NOTE: Si les différences dans la contamination de l'ER sont préoccupantes, notamment marqueurs ER tels que ERp72, calnexine ou la calréticuline dans l'analyse.
Résultats
La figure 1 représente un organigramme détaillé de l'ensemble du protocole.
Des profils de transfert de Western de la COX IV / GAPDH (Figure 2) représentent l'expression de la protéine mitochondriale, COX IV, et le marqueur non mitochondrial, GAPDH. L'expression de la COX IV et GAPDH sont évidentes dans l'ensemble du lysat de muscle. Après mitochondries sont isolées en utilisant la technique décrite dans ce protocole, des bandes COX IV sont encore visibles tout GAPDH est absent à la même exposition. Des expositions plus longues peuvent révéler une bande de GAPDH faible. Ces empreintes indiquent que les mitochondries isolées ont contamination non mitochondrial minime. En outre, l'expression de la COX IV dans les mitochondries isolées est compatible entre les échantillons.
La figure 3 montre les profils typiques respirométriques entraînés par le complexe II (succinate et la roténone) en utilisant 1,0 ug, 2,5 pg et 5,0 pg de mitochondries. Comme prévu, l'ensemble OCR est augmentée wvec des montants plus élevés de mitochondries. Le rapport de contrôle respiratoire calculée (RCR) pour ce dosage est 7,95, ce qui indique que la préparation mitochondriale est de haute qualité. En outre, l'état 3U OCR est légèrement supérieur à celui de l'Etat 3, confirmant la qualité mitochondrial.
Afin de comparer l'uniformité des résultats lors du profilage des quantités différentes de mitochondries, nous avons effectué ANOVA (analyse de variance) et calculé la somme des carrés (SS) en tant que valeurs réelles de la variance en utilisant 1,0 ug, 2,5 ug, 5,0 ug et chargés par des mitochondries ainsi (Figure 4). SS est présenté pour l'état 2, 3 état, état 3U, antimycine A et RCR. Pour l'état 2 et l'état trois mesures, une ANOVA était statistiquement significative (p <0,01 et p <0,05, respectivement). De même, une ANOVA était statistiquement significatif pour antimycine et RCR (p <0,01 et p <0,0001 respectivement. Aucune différence significative n'a été observée pour l'état 3U entre les groupes. ThCes ré- sultats montrent que 5,0 ug par puits des mitochondries a donné le SS bas par rapport à d'autres concentrations et est la quantité optimale à utiliser dans le système 24 XF avec notre population de participants.
La figure 5 sert de guide pour indiquer la quantité de protéines mitochondriales peut se attendre sur la base de la taille initiale de l'échantillon de muscle. Comme on s'y attendait, il existe une forte corrélation entre la quantité de muscle (mg) traitées et la teneur totale en protéines mitochondriales (mg) de l'échantillon final.
| Tampon Chappel-Perry I (IPC) | |
| Chimique | Concentration |
| KCl | 100 mM |
| MOPS | 50 mM |
| EDTA | 1 mM |
| MgSO 4 | 5 mM |
| ATP | 1 mM |
| pH | 7.4 |
| Tampon Chappel-Perry II (CPII) | |
| Chimique | Concentration |
| KCl | 100 mM |
| MOPS | 50 mM |
| EDTA | 1 mM |
| MgSO 4 | 5 mM |
| ATP | 0,2 mM |
| Acides gras libres BSA | 0,50% |
| pH | 7.4 |
| Mitochondrial Assay Solution (MAS) (2X) | |
| Chimique | Concentration |
| Saccharose | 35 mM |
| Mannitol | 110 mM |
| KH 2 PO 4 | 2,5 mM |
| MgCl 2 | 2,5 mM |
| HEPES | 1,0 mM |
| EGTA | 0,5 mM |
| Acides gras libres BSA | 0,10% |
| pH | 7.4 |
| Mitochondrial Assay Solution (MAS) avec complexes II conditions initiales | |
| Chimique | Concentration |
| 1X MAS | |
| Succinate | 10 mM |
| Roténone | 2 uM |
| pH | 7.4 |
| Mitochondrial Assay Solution (MAS) avec complexes I conditions initiales | |
| Chimique | Concentration |
| 1X MAS | |
| Pyruvate | 5 mM |
| Malate | 5 mM |
| pH | 7.4 |
| * Tous les tampons à effectuer dans l'eau déminéralisée | |
Tableau 1. Solution Recettes tampons.
| Étapes de protocole | ||
| StartProtocol | ||
| Commandement | Temps (min) | Port |
| Étalonner | 0,00 | |
| Attendez | 10,00 | |
| Mélanger | 1,00 | |
| Attendez | 3,00 | |
| Mélanger | 1,00 | |
| Attendez | 3,00 | |
| Mélanger | 0,50 | |
| Mesure | 3,00 | |
| Mélanger | 1,00 | |
| Mesure | 3,00 | |
| Mélanger | 0,50 | |
| Injecter | Un | |
| Mélanger | 1,00 | |
| Mesure | 6,00 | |
| Mélanger | 1,00 | |
| Injecter | B | |
| Mélanger | 1,00 | |
| Mesure | 3,00 | |
| Mélanger | 1,00 | |
| Injecter | C | |
| Mélanger | 1,00 | |
| Mesure | 3,00 | |
| Mélanger | 1,00 | |
| Injecter | Ré | |
| Mélanger | 1,00 | |
| Mesure | 3,00 | |
| EndProtocol | ||
Tableau 2. Mix, mesurer et mélanger réglage de cycle pour le respiromètre.

Figure 1. Organigramme de l'ensemble du protocole. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
/ftp_upload/52350/52350fig2highres.jpg "/>
Figure 2. Un Western blot représentatif de tissu musculaire squelettique ensemble ainsi que mitochondries isolées. Extrait de tissu entier ainsi que mitochondries isolées ont été immuno- empreinte avec COX IV anticorps comme marqueur mitochondrial et l'anticorps GAPDH pour le contrôle non-mitochondriale. Aucune bande de GAPDH a été observée dans les mitochondries isolées indiquant peu ou pas de contamination à partir de sources non-mitochondriales. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
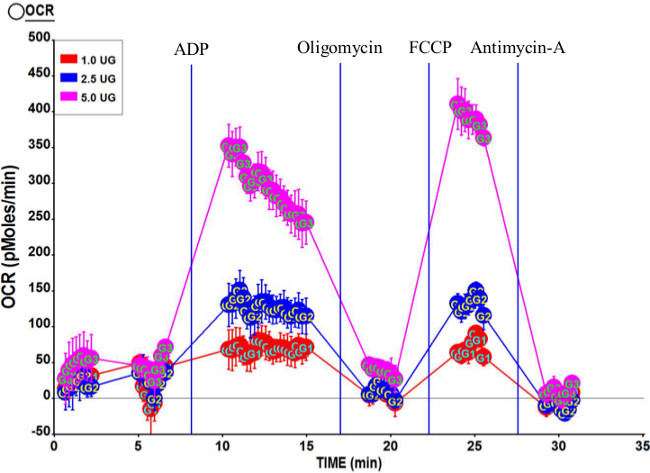
Figure 3. Profil respirométrique Représentant des mitochondries isolées à partir Vastus humaine lateralis. Trois concentrations de mitochondries isolées, 5,0 ug, 2,5 pg et 1,0 ug nous re utilisé dans cet essai. Les concentrations finales des composés après injections portuaires étaient 2 mM ADP (port A); 2 uM oligomycine (port B); 6 uM FCCP (port C); et 2 uM antimycine A (port D). RCR calculée pour cette course était 7,95. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
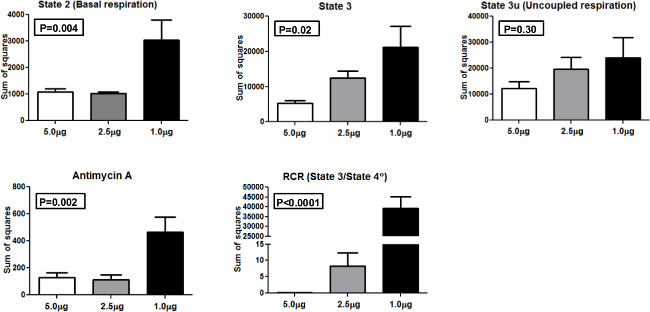
Figure 4. Somme des carrés. Somme des carrés pour les différents états de la respiration mitochondriale et RCR en utilisant 5,0 pg, 2,5 pg et 1,0 ug mitochondries. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
ig5highres.jpg "/>
Figure 5. Ceci peut être utilisé comme un guide pour estimer la quantité de protéine mitochondriale qui peut être attendu sur la base de l'analyse initiale échantillon muscle poids de régression:. De quantité de muscle (mg) et le rendement en protéine mitochondriale totale (mg). Comme prévu, il ya une corrélation positive directe entre la quantité de muscle et la protéine mitochondriale total obtenu.
Discussion
Mitochondries isolées sont souvent utilisés dans les études qui examinent le rôle de la fonction ETC, ainsi que d'autres activités mitochondriales, y compris le transport de substrat et la fonction du cycle TCA. Dosages respirométriques utilisant organites isolés permettent examen direct des processus fondamentaux de la phosphorylation oxydative et les propriétés intrinsèques de la ETC. Respirométrique profilage des mitochondries isolées par rapport aux cellules entières ou fibres musculaires perméabilisées a les avantages de relativement facile l'interprétation des données et l'absence d '"ingérence" de processus non mitochondriaux ou des changements de masse mitochondriale / biogenèse. Normalisation des données est basée sur la teneur en protéine mitochondriale, permettant ainsi simple comparaison croisée des mitochondries entre les échantillons. Respirométrique profilage des mitochondries isolées est une approche privilégiée lorsque le but de l'étude est de déterminer les mécanismes sous-jacents et identifier des cibles spécifiques tels que composante de ETCs / complexes, ou des mécanismes de transport mitochondriales.
L'invention concerne un protocole de biopsie musculaire et l'isolement des mitochondries fonctionnelles à partir de petits échantillons de tissu. Cette méthode donne des résultats reproductibles entre les utilisateurs en raison de l'utilisation d'un homogénéisateur automatisé par rapport à main homogénéisateurs de Dounce. Isolement des mitochondries peut être effectuée avec aussi peu que 20 mg de tissu musculaire. La quantité de mitochondries isolées qui peut être obtenu à partir de cette taille d'échantillon est suffisant pour exécuter Seahorse respirométrie base plaque tout en laissant mitochondries excédentaires à d'autres expériences et de stockage pour d'autres analyses moléculaires. On peut noter que cette méthode peut être traduit à la XF 96, où même de petites quantités de mitochondries peuvent être utilisés (1-2 ug par puits).
Plusieurs protocoles d'isolement pour les mitochondries se appuient sur homogénéisateurs de Dounce pour la perturbation initiale du tissu. Un inconvénient de cette méthode est la pratique de la nature du tissu initialhomogénéisation. La force et la vitesse du pilon dans le homogénéisateur peuvent varier considérablement entre les opérateurs 6. Ceci peut entraîner des variations expérience à l'expérience, ainsi que la variation laboratoire à laboratoire, et conduit à des difficultés dans la comparaison des données entre les expériences. Ce est particulièrement préoccupante dans les études d'intervention humaine lorsque les données des participants sont collectées à des moments distincts, généralement avant et après traitement, et potentiellement à des sites multiples. Nous utilisons un homogénéisateur automatisé pour une approche plus cohérente qui donne des résultats plus reproductibles avec une variation limitée de personne à personne. La vitesse de préparation rend également cette approche appropriée pour le traitement de plusieurs échantillons en même temps. En général, un maximum de trois expériences peuvent être effectuées en une seule journée.
Limitations potentielles de la technique décrite ici résultent de l'utilisation des organites isolés et l'utilisation d'un format à base de plaque. Par exemple, Picard et al. ont démontré que les mitochondries isolées possèdent des caractéristiques fonctionnelles qui diffèrent fondamentalement de celles des mitochondries intactes dans myofibres perméabilisées. Ils ont proposé que les techniques d'isolement mitochondriales résultent en fonction bioénergétique altérée, comme l'augmentation significative par rapport à RCR myofibres perméabilisées accompagnés de plus d'oxygène production d'espèces réactives 13. Par rapport aux fibres musculaires perméabilisées, l'isolement des mitochondries ne nécessite plus de temps de préparation. En outre, la perte de la teneur cellulaire diminue pertinence physiologique, ce qui est retenu dans des cellules entières perméabilisées même et les fibres. L'utilisation de respirométrie base plaque avec les permis de répliquer pistes technique décrite par échantillon. Cependant, les mitochondries doivent adhérer au fond de chaque puits. Cette configuration est différente de leur environnement normal et peut affecter les caractéristiques fonctionnelles. En outre, il convient de noter que l'utilisation de ce protocole pour l'isolement des mitochondries, there peut encore être contamination de réticulum endoplasmique (RE) dans la préparation mitochondriale. Les différences dans la contamination de ER peuvent affecter la détermination du rendement et d'influencer les résultats mitochondriales.
En conclusion, cette étude présente des données qui confirment que les mitochondries isolées à partir de tissus en utilisant cette procédure sont fonctionnellement actifs et peuvent être utilisés pour des études / applications qui nécessitent une haute qualité à partir de mitochondries isolées quantité minimale d'échantillons de muscles squelettiques. L'avantage de cette méthode est que: i) il est possible d'isoler les mitochondries à partir de quantités minimales de muscle squelettique, ii) la procédure est rapide, iii) avec la technologie de plaque sur la base, il est possible d'exécuter plusieurs échantillons en même temps, et iv) il ya assez de tissu excédentaire et les mitochondries isolées après l'analyse bioénergétique pour le stockage de l'échantillon et d'autres enquêtes de biologie moléculaire.
Déclarations de divulgation
The author, George Rogers, is an employee of Seahorse Bioscience that produces the instrument used in this article. Open Access fees were supported by Seahorse Biosciences.
Remerciements
We would like to thank Dr. Marc Liesa, Boston University School of Medicine, helpful discussions; Ms. Karin Murphy, Ms. Heather Gregory, and Mr. John Stone, all from Wake Forest School of Medicine, for helpful technical assistance in the development of this protocol.
matériels
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Homogenizer Bio-Gen PRO200 | BioExpress | ||
| Eppendorf Centrifuge 5804 R | Fisher Scientific | ||
| Deepwell late Rotor | Fisher Scientific | ||
| 6 mm University College Hospital Needle | Cadence | ||
| 60 cc syringe | Fisher Scientific | ||
| 96-well plate reader | Tecan (Genios-basic) | ||
| Seahorse XF 24-3 analyzer | Seahorse Biosciences, Inc. | ||
| Protein gel system | Life Technologies (Invitrogen) | ||
| Kodak Gel Logic 112 | Carestream Health, Inc | ||
| Kodak camera assembly | Carestream Health, Inc | ||
| Consumables | |||
| XF24 V7 Cell Culture Microplate and XF24 sensor cartridge | Seahorse Bioscience | 100850-001 | |
| 100867-100 | |||
| Potassium hydroxide (KOH) | Sigma-Aldrich Co | 221473 | |
| Hydrochloric acid (HCl) | Acros | 12421-0010 | |
| Dulbecco's Phosphate buffered saline | Lonza | 17-512F | |
| Potassium chloride (KCl) | Fisher Scientific | P333 | |
| MOPS | Fisher Scientific | BP308 | |
| EDTA | Fisher Scientific | BP118 | |
| Magnesium sulfate (MgSO4) | Sigma-Aldrich Co | M7506 | |
| ATP | Sigma-Aldrich Co | A9187 | |
| Fatty acid-free BSA | Calbiochem | 126575 | |
| Sucrose | Sigma-Aldrich Co | S0389 | |
| Bacterial proteinase | Sigma-Aldrich Co | P-8038 | |
| D-Mannitol | Sigma-Aldrich Co | M9546 | |
| KH2PO4 | Fisher Scientific | P284 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich Co | M9272 | |
| HEPES | Sigma-Aldrich Co | H3784 | |
| EGTA | Sigma-Aldrich Co | E3889 | |
| BCA protein assay kit | Sigma-Aldrich Co | PI23227 | |
| Succinic Acid* | Sigma-Aldrich Co | S3674 | |
| Pyruvic acid* | Sigma-Aldrich Co | P5280 | |
| Malic acid* | Sigma-Aldrich Co | 2288 | |
| ADP(K+ salt)* | Sigma-Aldrich Co | A5285 | |
| XF Cell mito stress test kit | Seahorse Biosciences | 101706 | |
| Tween-20 | Santa Cruz Biotechnology, Inc. | SC-29113 | |
| NuPAGE 12% Bis-Tris Gel | Life Technologies (Invitrogen) | NP0343BOX | |
| Immobilin Transfer Membranes (0.45 um) | Millipore | IPVH20200 | |
| MOPS SDS Running Buffer (20X)-500 ml | Life Technologies (Invitrogen) | NP0001 | |
| NuPAGE Transfer Buffer (20X)-1 liter | Life Technologies (Invitrogen) | NP0006-1 | |
| Primary antibodies (mAB to VDAC1/Porin) | Abcam | ab14734 | |
| Primary antibodies (mAB to GAPDH) | Abcam | ab9484 | |
| Anti-Mouse IgG (Goat), HRP-labeled | PerkinElmer | NEF822E001EA | |
| Anti-Rabbit IgG (Goat), HRP-labeled | PerkinElmer | NEF812E001EA | |
| *ADP, succinic acid, pyruvic acid, and malic acid should be adjusted to pH 7.4 with KOH only |
Références
- Fernandez-Vizarra, E., et al. Isolation of mitochondria for biogenetical studies: An update. Mitochondrion. 10, 253-262 (2010).
- Fernandez-Vizarra, E., Lopez-Perez, M. J., Enriquez, J. A. Isolation of biogenetically competent mitochondria from mammalian tissues and cultured cells. Methods. 26, 292-297 (2002).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. Journal of Visualized Experiments : JoVE. , (2011).
- Iglesias-Gonzalez, J., Sanchez-Iglesias, S., Beiras-Iglesias, A., Soto-Otero, R., Mendez-Alvarez, E. A simple method for isolating rat brain mitochondria with high metabolic activity: effects of EDTA and EGTA. Journal of Neuroscience Methods. 213, 39-42 (2013).
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418, 213-223 (2011).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PloS One. 8, e82392 (2013).
- Chappell, J. B., Perry, S. V. The respiratory and adenosinetriphosphatase activities of skeletal-muscle mitochondria. The Biochemical Journal. 55, 586-595 (1953).
- Tyrrell, D. J., et al. Respirometric Profiling of Muscle Mitochondria and Blood Cells Are Associated With Differences in Gait Speed Among Community-Dwelling Older Adults. J Gerontol A Biol Sci Med Sci. , (2014).
- Nicklas, B. J., et al. Relationship of physical function to vastus lateralis capillary density and metabolic enzyme activity in elderly men and women. Aging Clinical and Experimental Research. 20, 302-309 (2008).
- Bergstrom, J. Percutaneous needle biopsy of skeletal muscle in physiological and clinical research. Scandinavian Journal of Clinical and Laboratory Investigation. 35, 609-616 (1975).
- Rogers, G. W., et al. High throughput microplate respiratory measurements using minimal quantities of isolated mitochondria. PloS One. 6, e21746 (2011).
- Picard, M., et al. Mitochondrial structure and function are disrupted by standard isolation methods. PloS One. 6, e18317 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon