Method Article
تكييف عملية Electrospinning لتوفير ثلاث بيئات فريدة من نوعها لثلاثي الطبقات
In This Article
Summary
Advancements in biomaterial technologies enable the development of three-dimensional multi-cell-type constructs. We have developed electrospinning protocols to produce three individual scaffolds to culture the main structural cells of the airway to provide a 3D in vitro model of the airway bronchiole wall.
Abstract
Electrospinning is a highly adaptable method producing porous 3D fibrous scaffolds that can be exploited in in vitro cell culture. Alterations to intrinsic parameters within the process allow a high degree of control over scaffold characteristics including fiber diameter, alignment and porosity. By developing scaffolds with similar dimensions and topographies to organ- or tissue-specific extracellular matrices (ECM), micro-environments representative to those that cells are exposed to in situ can be created.
The airway bronchiole wall, comprised of three main micro-environments, was selected as a model tissue. Using decellularized airway ECM as a guide, we electrospun the non-degradable polymer, polyethylene terephthalate (PET), by three different protocols to produce three individual electrospun scaffolds optimized for epithelial, fibroblast or smooth muscle cell-culture. Using a commercially available bioreactor system, we stably co-cultured the three cell-types to provide an in vitro model of the airway wall over an extended time period.
This model highlights the potential for such methods being employed in in vitro diagnostic studies investigating important inter-cellular cross-talk mechanisms or assessing novel pharmaceutical targets, by providing a relevant platform to allow the culture of fully differentiated adult cells within 3D, tissue-specific environments.
Introduction
مجال الطب التجديدي وهندسة الأنسجة تتقدم بسرعة، مع اختراقات في القصبة الهوائية والكلى تجديد اثنين من إنجازات لافتة في الآونة الأخيرة. المواد الحيوية المتقدمة في هندسة الأنسجة أصبحت أكثر سهولة، مع فرص لنقل هذه البروتوكولات إلى المختبرات المتخصصة أقل. حقل واحد تستعد للاستفادة من خلال زيادة استخدام المواد الحيوية في التشخيص المختبر.
في الدراسات المختبرية هي منصة هامة للتحقيق في مسارات الإشارات داخل الخلوية داخل خلية واحدة، أنواع، وساعدت على رسم الآليات الكامنة وراء العديد من pathophysiologies المرض. تعتمد هذه الدراسات عادة على خلية واحدة من نوع المستزرعة كما أحادي الطبقة على البلاستيك زراعة الأنسجة (TCP)؛ ويتعرض ثنائي الأبعاد (2D) سطح جامد أقل مرونة يسهل اختراقها حتى الآن ومن ثلاثية الأبعاد الخلايا (3D) البيئة ضمن النسيج أو العضو. وكانت النماذج الحيوانية تقليديا هmployed لتأكيد الآثار الموجودة في المختبر ترجمة أيضا إلى النسيج كله، ويمكن أيضا أن تستخدم كمنصات ما قبل السريرية للتحقيق في الأمراض التي تصيب الإنسان. ومع ذلك، فإن الاختلافات بين الأنواع تقوض هذا الاعتماد على نماذج حيوانية في فهمنا لمرض البشري -. على سبيل المثال، يستند فهم الكثير من الربو وأمراض الرئة بناء على نموذج الفأر على الرغم من الخلافات الكامنة بين حالة الإنسان وهذا النموذج بما في ذلك أدلة قليلة من تسلل الخلايا البدينة من حزمة العضلات الملساء مجرى الهواء، أو القدرة على تطور المرض عفوية داخل الحيوان نموذج 3،4. هناك أيضا اعتبارات أخلاقية فيما يتعلق باستخدام نماذج حيوانية، مع معيار "3RS" من "بديل، والصقل، والحد من" في التجارب على الحيوانات التي شجعت في المملكة المتحدة وبلدان أخرى.
سيكون بديلا جذابا يكون خلاصة الأنسجة البشرية في المختبر هيكل خلقالصورة للتحقيق في طبيعة تعاونية بين أنواع الكبار الخلايا البشرية في وحدة واحدة. وتوجد الخلايا في هياكل متعددة الخلايا 3D داخل الأنسجة، كل ضمن بيئة صغيرة فريدة من نوعها. وزراعة الخلايا على TCP فقط يسمح للثقافة الطبقات الوحيدة الخلية، غير قادر على تكرار هذه البيئة، أو توفير القدرة للثقافة متعددة الخلايا. يوفر الحيوية التقدم الفرصة لتطوير كل المنابر 3D الطبيعية والاصطناعية لزراعة الخلايا. ECM Decellularized يمكن استخدامها لزراعة الخلايا 3D عندما recellularized مع غيرها من أنواع الخلايا بما في ذلك خلايا جذعية 1، لكن هذه البروتوكولات يمكن أن تكون معقدة وتستغرق وقتا طويلا، مع توافر الأنسجة محدودة ومعظمها من أصل غير البشرية. بروتوكولات أخرى تسمح مزيدا من السيطرة على البيئات الخلوية خلق مثل nanoimprinting، ترسب ECM والتكنولوجيات رقة خلية، أو electrospinning. Electrospinning يخلق الحصير التي يسهل اختراقها 3D غير المنسوجة من ألياف بأقطار تتراوح ما بين نانومتر إلى ميكرومتر، صeplicating أبعاد ECM الطبيعية. يتزايد تشغيل السقالات Electrospun كما 3D منصات زراعة الخلايا -. التلاعب المعلمات electrospinning يسمح تحكم معقدة على خصائص سقالة مثل حجم المسام، وقطره الألياف، والطوبوغرافيا والمواءمة، والكيمياء السطحية. وقد ثبت التعديلات من هذه المعالم أن تؤثر مباشرة التصاق الخلايا والنمو، وعندما تم مثقف الخلايا في العزلة.
وقد تم استغلال هذه المزايا في هذه الدراسة للسماح للزراعة من أنواع الخلايا متعددة كما واحدة بناء الأنسجة 3D، وذلك باستخدام قصيبة الهوائية كنموذج 3D بنية الأنسجة. ويتكون جدار قصيبة من ثلاث مناطق رئيسية (الشكل 1). الغشاء المخاطي هو المكان الذي يجلس الخلايا الظهارية مجرى الهواء في واجهة الهواء السائل (ALI)، وتوفير عائقا هاما في البيئة الخارجية. يقيمون في غشاء شبكي الطابق السفلي (RBM)، وهو ECM المدمجة بإحكام يتكون أساسا من collagأون IV، perlecans، وlaminins. تم العثور على طبقة شبه المخاطية مباشرة تحت الغشاء المخاطي، وهي منطقة أكثر مسامية تتألف من أنواع الخلايا متعددة بما في ذلك الخلايا الليفية، myofibroblasts والتسلل الكريات البيض في ظل ظروف المرض. أخيرا حزم العضلات الملساء يلتف حول مجرى الهواء بطريقة حلزونية، وتتألف من أوراق الانحياز مجرى الهواء العضلات الملساء (ASM). فمن الدولة مقلص النسبية العضلات الملساء التي تتحكم نغمة مجرى الهواء. توظيف السقالات electrospun داخل الجهاز الرئوي وحتى وقت قريب كان محدودا لأغراض التجدد. مع استبدال القصبة الهوائية electrospun يجري زرعها بنجاح. بينما نجحت مثل هذه العلاجات هي محدودة في الأرقام، وركزت على القصبة الهوائية نظرا لطبيعة بسيطة نسبيا في وظيفة الأنسجة و. أمثلة محدودة من نماذج الهوائية المستخدمة في التشخيص في المختبر موجودة، وركزت أساسا على نحو سلس القياسات تقلص العضلات. غير سامة، وليسوقد سبق electrospun ن تحلل البوليمر البولي اثيلين (PET)، وكان يعمل في هذه الدراسة لضمان السقالات المنتجة يمكن تخزينها لفترات طويلة دون المهينة (السماح لهم لاستخدامها "على الرف")، وأيضا تكون مناسبة للثقافة الخلية مستقرة على مدى فترات زمنية طويلة. وقد أظهرت دراسات سابقة من مجموعتنا أن توظيف ثلاثة بدائل لبروتوكول electrospinning الأساسي، وثلاثة الفردية السقالات electrospun PET يمكن أن تنتج لتقديم الرسومات الطبوغرافية المثلى لزراعة الخلايا الظهارية مجرى الهواء، الخلايا الليفية، وخلايا العضلات الملساء في عزلة 21،22 وcoculture مجرى الهواء الخلايا الظهارية والخلايا الليفية (22). تم العثور على قطر الألياف تؤثر إلى حد كبير وظيفة الظهارية 22، والمواءمة الألياف سمح جيل من أوراق الانحياز العضلات الملساء 21. وأجريت هذه الدراسات بشكل مستقل عن بعضها البعض في ظل ظروف ثابتة. في هذه الدراسة، وهذه احتم cocultured السقالات الإقليم الشمالي، تحتوي على خلايا الإنسان الكبار متباينة تماما لمدة أسبوع واحد في ALI في مفاعل حيوي متاح تجاريا باسم قسم 3D الجدار مجرى الهواء، وتوفير الناحية الفسيولوجية ذات الصلة في نموذج المختبر للتحقيق في مجرى الهواء الردود بين الخلايا. ومع أن هذا البروتوكول يستخدم قصيبة الهوائية كنظام نموذج، يمكن تكييفها على أنها منصة للcoculture 3D الوحدات المخاطية من الأجهزة الأخرى.
Protocol
تم عزل خلايا ASM الأولية من الأفراد غير المصابين بالربو من الخزعات الشعب الهوائية في مستشفى جلينفيلد (ليستر، المملكة المتحدة) كما هو موضح سابقا. تمت الموافقة على البحث من قبل لجنة الأخلاقيات يسسترشاير وأعطى المرضى، وموافقتهم الخطية على علم بذلك.
1. Electrospinning PET السقالات (الشكل 2)
- إعداد محلول (10 مل) من زجاجة مشروب الصف PET في 1: 1 ثنائي كلورو ميثان (DCMro) - حمض trifluoroacetic (TFA) حل. ويلزم تركيزات PET من 8٪، 30٪ و 10٪ الوزن / الحجم (وزن / المجلد) لnanofiber، ستوكات ومحاذاة السقالات على التوالي ثم يقلب الحل O / N في RT لPET حل.
- نقل الحل PET في حقنة وإرفاق 23-G (لnanofiber) أو 18-G (للستوكات والانحياز) الإبرة إلى حقنة ومكان الحقنة إلى ضخ حقنة الآلية. تأكد من استدارة نقطة من الإبرة إلى أسفل.
- وضع أماهوأشار ndrel 15 سم بعيدا عن رأس الإبرة، وضمان الإبرة في وسط طبل.
- نعلق امدادات الكهرباء لطرف الإبرة مع مقاطع التمساح والأرض مغزل (عبر مقبس الموز) إلى الأرض. التبديل على إمدادات الطاقة إلى مغزل وضبط سرعة إلى 60 دورة في الدقيقة (أي ما يعادل حوالي 13.2 م · دقيقة -1) لnanofiber وستوكات السقالات. مجموعة سرعة 2000 دورة في الدقيقة (أي ما يعادل حوالي 440 م · دقيقة -1) السقالات لالانحياز.
- تعيين ضخ حقنة لمعدل تدفق 0.5 مل * ساعة -1 لnanofiber السقالات العشوائية والانحياز أو 2.0 مل * ساعة -1 لالسقالات ستوكات. السماح للمضخة لتشغيل حتى يتم حل مقذوف من طرف الإبرة من أجل إزالة أي الهواء في الإبرة. ثم توقف المضخة.
- على ضخ حقنة، تعيين الحجم الكلي للحل ليطرد إلى 2 مل وتبدأ المضخة.
- مجموعة امدادات التيار الكهربائي إلى 14 كيلو فولت، والتبديل على السلطة تحاميللاي.
- Electrospin حتى يتم electrospun 2 مل من محلول (4 ساعات لnanofiber والسقالات الانحياز، 1 ساعة لالسقالات ستوكات).
- قطع سقالة بشفرة على طول عرض مغزل. وهذا ينتج ورقة 2D من سقالة حجم مساحة مغزل (في هذه الحالة، ورقة مستطيلة الشكل 22 سم × 11 سم) والتي يمكن مقشر بعناية قبالة مغزل). تخزين سقالة في رقائق الألومنيوم للحد من تهمة الكهربائي).
ملاحظة: يتم إنتاج السقالات ثنائي الطور من قبل متتابعة electrospinning سقالة nanofiber مباشرة على سقالة ستوكات.
2. تعقيم السقالات قبل استخدامها في زراعة الخلايا
- من ورقة سقالة، لكمة من أقراص السقالات ثنائية الطور أو الانحياز باستخدام 0.8 مم خزعة من ركلة جزاء والتمسك طوقا استخدام غير سامة الحوض الغراء.
- تعقيم السقالات باستخدام أشعة فوق البنفسجية لمدة 30 دقيقة على كل جانب من السقالات قبل تمرغ في 20٪ المجلد / المجلد الحل المضادات الحيوية / مضاد فطري (2x10 5 وحدات مل -1 البنسلين G، 2000 ملغ مل -1 كبريتات الستربتومايسين و 500 ميكروغرام مل -1 الأمفوتريسين B) O / N عند 4 درجات مئوية.
- غسل السقالات مع PBS 3 مرات، ومن ثم تخزين السقالات في لوحات TCP جيدا في برنامج تلفزيوني في 4 درجات مئوية حتى الاستخدام.
3. خلية مكونات الثقافة وسائل الإعلام
- ثقافة CALU3 الخلايا الظهارية في وسائل الاعلام DMEM-F12 تستكمل مع المصل 10٪ المجلد / المجلد العجل الجنين (FCS)، حل 2 نانومتر L-الجلوتامين، 1٪ المجلد / المجلد مضاد حيوي / مضاد فطري حل (10،000 وحدة مل -1 البنسلين G، 100 ملغ مل -1 كبريتات الستربتومايسين و 25 ميكروغرام مل -1 الأمفوتريسين B).
- ثقافة MRC5 الليفية وASM الخلايا في وسائل الاعلام DMEM تستكمل مع المصل 10٪ المجلد / المجلد العجل الجنين (FCS)، حل 2 نانومتر L-الجلوتامين، 1٪ المجلد / المجلد مضاد حيوي / مضاد فطري حل (10،000 وحدة مل -1 البنسلين G، 100 ملغ مل -1 كبريتات الستربتومايسين و 25 ميكروغرام مل -1 الأمفوتريسين B).
- خليط سائل الاعلام DMEM: زراعة الخلايا الظهارية-الليفية-ASM في 70:30 DMEM-F12 الثقافات المشارك.
4. البذر من الخلايا الليفية والخلايا الظهارية على ثنائي الطور سقالة
- في لوحة زراعة الأنسجة، ونقع السقالات في وسائل الاعلام DMEM تستكمل واحتضان عند 37 درجة مئوية لمدة 1 ساعة قبل البذر الخلية.
- إزالة وسائل الاعلام DMEM تستكمل، وضع المرحلة ستوكات من سقالة apically والبذور 1.5 X10 4 MRC5 الخلايا الليفية في 30 ميكرولتر من وسائل الاعلام DMEM تستكمل. تستنهض الهمم لوحة على شاكر المداري لمدة 2 ساعة، قبل أن يغادر في حاضنة عند 37 درجة مئوية 5٪ CO 2 في الهواء O / N.
- تحويل سقالة على ذلك مرحلة nanofiber من سقالة تواجه apically، والبذور 3.0 X10 4 CALU3 الخلايا الظهارية في 30 ميكرولتر من وسائل الإعلام تستكمل-F12-DMEM على المرحلة nanofiber من السقالة واحتضان FOص 2 ساعة على 37 درجة مئوية، و 5٪ CO 2 في الهواء قبل غمر سقالة في 70:30 DMEM-F12: تستكمل DMEM وسائل الإعلام O / N قبل ان ينتقل الى مفاعل حيوي.
5. البذر من الخلايا ASM على سقالة الانحياز
- في لوحة زراعة الأنسجة، ونقع السقالات في وسائل الاعلام DMEM تستكمل واحتضان لمدة 1 ساعة على 37 درجة مئوية قبل البذر 2.5 X10 4 خلايا في 30 ميكرولتر من وسائل الاعلام DMEM تستكمل واحتضان لمدة 2 ساعة (37 ° C، 5٪ CO 2 في الهواء). غمر سقالة في المقابل وسائل الاعلام DMEM تستكمل لالحاضنة وترك O / N قبل تأسيس ثقافة ثلاثي في مفاعل حيوي.
6. إعداد ثلاثي الثقافة باستخدام نظام مفاعل حيوي (الشكل 7)
- وضع طوقا سقالة ثنائي الطور في أخدود في غرفة واحدة مع المرحلة الظهارية التي تواجه ما يصل الى غرفة.
- ضع سقالة الانحياز تحت السقالة ثنائية الطور (ولذلك فمن المتاخمة للميلالمرحلة crofiber من السقالة ثنائية الطور) وقفل غرفتي مفاعل حيوي معا.
- تجميع اثنين من الدوائر تدفق نضح متصلة خزانين المتوسطة (وسائل الإعلام تستكمل DMEM-F12 في خزان القمي، DMEM-F12 / وسائل الإعلام DMEM تستكمل في خزان القاعدية) وسائل الإعلام مضخة حول الدوائر اثنين على ما يقرب من 0.1 مل / دقيقة باستخدام مضخة تحوي (يتم إعادة تدوير 40 مل سائل الإعلام من خلال كل دائرة). بيت كل أجزاء النظام داخل حاضنة عند 37 درجة مئوية، و 5٪ CO 2 في الهواء.
- بعد أسبوع واحد، وإزالة وسائل الإعلام من غرفة قمي، والثقافة الخلايا الظهارية في ALI لمدة أسبوع آخر قبل التحليل.
النتائج
صور المجهر الإلكتروني الماسح أنسجة الشعب الهوائية decellularized أو الصور immunohistological من الخزعات الشعب الهوائية حددت الخصائص المرغوبة من ECM الهوائية أردنا أن ندخل electrospun تضاريس سقالة: RBM الأم مصفوفة تتكون من ألياف حوالي 153 نانومتر ± 30.6 نانومتر (يعني ± SD ن = 50 القياسات ) في قطر (الشكل 3A و 5A)، في حين أن مصفوفة المحيطة RBM كان أكثر مسامية في الطبيعة (الشكل 3C). تظهر المقاطع Immunohistological من خلال حزم العضلات الملساء ASM بوصفها ورقة محاذاة الخلايا 21 (الشكل 3E). تم استخدام هذه المعلومات لتوجيه الخصائص التي أدخلت على السقالات electrospun. تمكن مغزل الدورية لتدوير مستقر بسرعات عالية (> 2000 دورة في الدقيقة / 440 م · دقيقة -1) لإنتاج السقالات مع الألياف الانحياز. تناوب مغزل البطيء (60 دورة في الدقيقة 13.2 م · دقيقة -1) لم يؤثر على اتجاه الألياف، ولكن إنتاجها السقالات مع سمك أكثر اتساقا مما كانت عليه عندما electrospinning على طبق من ذهب ثابتة. عن طريق تغيير المعلمات electrospinning (تركيز PET ومعدل التدفق الحل)، كان من الممكن لخلق السقالات الألياف مع أقطار عدة ميكرومتر أو مئات نانومتر (تدرج المعلمات electrospinning في الجدول 1).
الألياف Electrospun بأقطار الألياف تعادل الألياف الطبيعية RBM (150 نانومتر) أنتجت باستخدام محلول PET 6٪، ولكن في مثل هذه التركيزات المنخفضة PET، الديكور من الألياف حدث الشكل (4A). تم القضاء على هذا عن طريق زيادة تركيز المحلول PET إلى 8٪ التي تنتج ألياف النانو موحدة حيازة متوسط قطرها 255 نانومتر ± 2.4 نانومتر (يعني ± SEM) ومتوسط حجم المسام 1.43 ميكرون ± 0.02 ميكرون (أرقام 4B، 5A & B). لelectrospin ألياف النانو كان من الضروري تقليل حجم الإبرة في الفترة من 18 إلى 23 G G، مما يسمح أبطأ معدلات تدفق whilsتي الحفاظ على أعلى سرعة تدفق والحد من انسداد إبرة، وهي مشكلة متكررة مع الإبرة الكبيرة. عندما electrospinning microfibers، زيادة في حل PET ل> 30٪ من الرصاص PET إلى عدم الاتساق في الألياف قطرها (الشكل 4F) بالإضافة إلى انسداد متعددة في طرف الإبرة بسبب اللزوجة العالية الحل. الحصير ستوكات موحدة تمتلك متوسط قطرها الألياف من 2.50 ميكرون ± 0.02 ميكرون (يعني ± SEM) ومتوسط حجم المسام من 10.45 ميكرومتر ± 0.13 ميكرومتر أنتجت عندما electrospinning 30٪ محلول PET بالوزن / المجلد بمعدل تدفق 2 مل / ساعة -1 (أرقام 4F، 5A & B). خلق electrospinning متتابعة من السقالة nanofiber مباشرة على سقالة ستوكات (لا تزال تعلق على مغزل) سقالة ثنائية الطور (الشكل 3D). كان متوسط قطر الألياف 280 نانومتر ± 20 نانومتر و 2.30 ميكرومتر ± 0.06 ميكرون لnanofiber وستوكات مراحل على التوالي،مماثلة لأبعاد nanofiber وستوكات الفردية السقالات. بالإضافة إلى ذلك، كان سمك سقالة ثنائية الطور مماثل لمبلغ الفردية nanofiber وستوكات السقالات (الشكل 5C). من خلال زيادة سرعة مغزل (2000 دورة في الدقيقة / 440 م · دقيقة -1)، وأنتجت الانحياز للغاية النانوية أو ستوكات السقالات. كان الحل PET بالوزن / المجلد 8٪ ليس الأمثل لإنتاج ألياف النانو الانحياز والألياف المنتجة امتلاك موجة تشبه التشكل (الشكل 3F). زيادة إلى 10٪ PET ألغى هذا التأثير، ولكن لا يزال أسفرت عن قطر الألياف مخفضة (216 نانومتر ± 2.2 نانومتر (يعني ± SEM)) مقارنة السقالات nanofiber الانحياز بشكل عشوائي. تم احتساب محاذاة الألياف من خلال تحديد انحراف زاوية كل الألياف من المتوسط زاوية الألياف. في السقالات nanofiber الانحياز هي التي تنسجم 79٪ من الألياف (± 10 ° متوسط الألياف زاوية) مقارنة مع 10.2٪ من الألياف في محاذاة بشكل عشوائي سكاف nanofiberالذين تتراوح أعمارهم بين (الشكل 5D).
تم استخدام nanofiber سقالة 8٪ إلى تلخيص الإدارة القائمة على النتائج التي تتواجد الخلايا الظهارية، وكانت تستخدم لدعم الثقافة من الخلايا CALU3 (مجرى الهواء الظهارية خط الخلية). تم استخدام 30٪ بالوزن / المجلد سقالة ستوكات، ويجري أكثر مسامية في الطبيعة لتقليد المنطقة شبه المخاطية، وكان المثقف مع MRC5 الخلايا (مجرى الهواء الليفية خط الخلية). 10٪ بالوزن / المجلد nanofiber الانحياز سقالة المقدمة الرجوع الطوبوغرافية لضمان ASM محاذاة الخلية عند المثقف على منصة الاعدام. وأظهرت جميع أنواع الخلايا ثلاث زيادة في قابلية عند المثقف على السقالات الفردية خلال فترة أسبوع 2 (الشكل 6A)، وأعرب عن الخلية من نوع بروتينات معينة بعد فترة ثقافة الأسبوع 2 (الشكل 6B، 6C، و6D). وقد تم الإبلاغ عن مزيد من توصيف الفردية التفاعلات خلية سقالة في أماكن أخرى 21. وelectrospinning متتابعة من السقالة nanofiberعلى أنتجت سقالة ستوكات سقالة ثنائية الطور للcoculture من الخلايا الظهارية CALU3 والخلايا الليفية MRC5 على nanofiber وستوكات مراحل على التوالي. وقد تم الإبلاغ عن زراعة الخلايا اثنين معا تحت ظروف ثابتة في مكان آخر (22). مزيد من العمل في محاولة لإضافة طبقات الخلايا الأخرى أو تمديد الأوقات زراعة ثنائية الطور بعد 2 أسابيع في ظل ظروف ثابتة أثبتت ناجحة (لا تظهر البيانات). للثقافة نموذج ثلاثي الطبقات على مدى فترة طويلة، استخدمنا مفاعل حيوي تدفق نضح. وفاز المصنف CALU3 وMRC5 الخلايا على سقالة ثنائية الطور، والخلايا ASM المصنف على سقالة الانحياز، وكان المثقف كلا على حدة لمدة 2 أيام. والسقالات اثنين ثم اشترى معا لتشكيل نموذج ثلاثي طبقة من الجدار مجرى الهواء داخل مفاعل حيوي (الشكل 7). تم perfused لكلا المجلسين مع وسائل الإعلام لمدة 7 أيام قبل كانت غرفة الظهارية القمية إزالة إعلامه، وكانت الخلايا الظهارية مثقف فيALI ل7 أيام أخرى. كانت ثابتة السقالات وإما مقطوع وملطخة، أو و immunostained السقالات كاملة للعلامات خلية محددة. وأظهرت المقاطع من خلال ثقافة ثلاثي طبقة نواة الخلية توزيعها من خلال جميع الطبقات الثلاث من coculture (الشكل 8B). عندما و immunostained الخلايا للعلامات خلية محددة، الخلايا الظهارية ملؤها المرحلة nanofiber قمي باعتبارها متموجة خلايا طبقة وملطخة إيجابية لcytokeratin (الشكل 8C)، في المرحلة ستوكات، الخلايا الليفية ملطخة إيجابية لS100A4 (الشكل 8D)، وعلى والانحياز 10٪ خلايا سقالة ASM ملطخة إيجابية لSM22α (الشكل 8E)، مما يدل على بقاء جيد لكل نوع الخلايا داخل نموذج 3D الجدار مجرى الهواء.
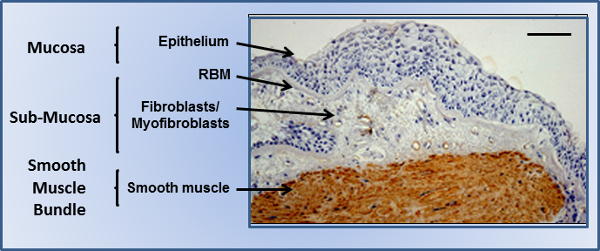
الشكل 1. قصيبة مجرى الهواء. الخزعة القصبي من شدةالهوائية الربو تظهر الظهارة على غشاء شبكي الطابق السفلي (RBM)، مع المنطقة تحت المخاطية الأساسية بالسكان مع خلايا اللحمة المتوسطة، وحزم العضلات الملساء المحيطة بالسكان مع خلايا العضلات الملساء الملون لالعضلات الملساء ألفا الأكتين (البني). يشير الشريط على نطاق 200 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
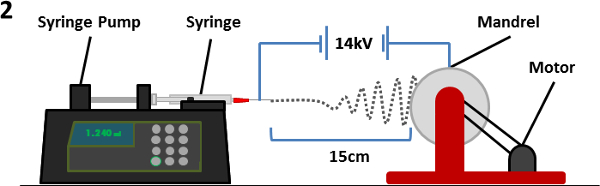
يتم وضع الشكل 2. التخطيطي للمعدات electrospinning. حقنة تحتوي على البوليمر / محلول مذيب (مع الإبرة المرفقة) على ضخ حقنة التي تواجه مغزل. يتم تأسيس الجهد الكهربائي بين الألياف الإبرة ومغزل التسبب في طرد من طرف الإبرة وتترسب على مغزل الدورية. مع مرور الألياف عبر الغلاف الجوي،يتبخر المذيب تسبب ترسب ألياف البوليمر على مغزل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
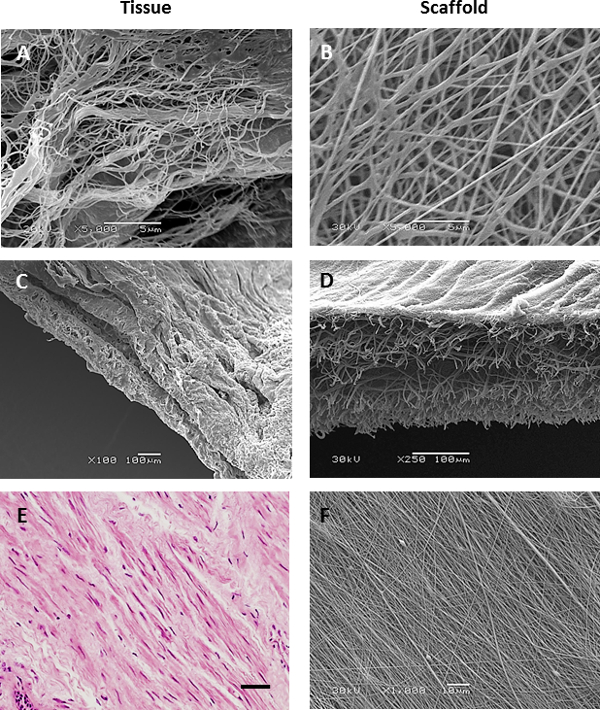
الشكل 3. مقارنة السقالات electrospun إلى ECM الهوائية الأصلي. صور المجهر الإلكتروني الماسح لdecellularized الغشاء القاعدي (A)، مجرى الهواء decellularized قصيبة المقطع العرضي (C) وقسم النسيجي لحزمة العضلات الملساء مجرى الهواء (ملطخة haematoxylin ويوزين، وعلى نطاق شريط 40 ميكرون) (E) مقارنة مع nanofiber (B) ثنائي الطور (D) والانحياز (F) السقالات PET. الرجاء انقر هنا لعرضنسخة أكبر من هذا الرقم.
الجدول 1. معلمات تستخدم لelectrospinning ستوكات، nanofiber ومحاذاة السقالات بشكل فردي وللسقالة ثنائية الطور.

الرقم 4. التعديلات في تركيزات PET يؤثر خصائص الألياف. صور المجهر الإلكتروني الماسح السقالات electrospun نسج من 6٪ و 8٪ و 10٪ (AC)، 25٪، 30٪ و 35٪ (EG) (وزن / المجلد) حلول PET . أظهرت أيضا والسقالات الانحياز أنتجت من 8٪ (D) و 30٪ حلول PET (H) وزن / المجلد AD تصوير في 5،000X التكبير، EH تصويرها في 1،000X التكبير. الرجاء انقر هنا لعرض أكبرنسخة من هذا الرقم.
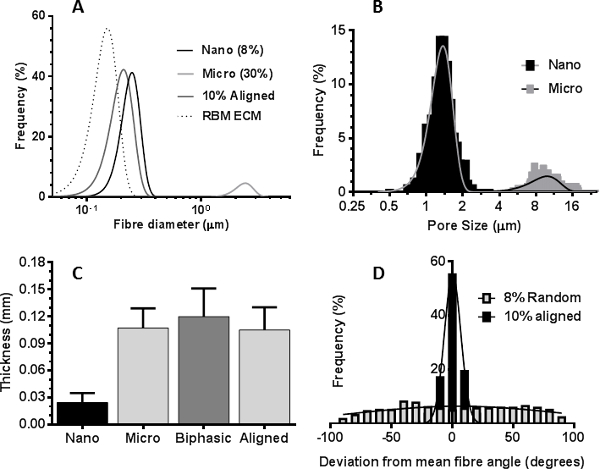
الرقم 5. خصائص السقالات PET electrospun. منحنيات (A) توزيع تبين توزيع قطرها الألياف من غشاء شبكي الطابق السفلي المصفوفة خارج الخلية (RBM ECM)، محاذاة بشكل عشوائي النانوية والألياف المتناهية الصغر السقالات، والسقالة nanofiber الانحياز. (B) الرسم البياني يبين توزيع حجم المسام النسبي في النانوية والألياف المتناهية الصغر السقالات. (C) متوسط سمك nanofiber، ستوكات، السقالات ثنائية الطور والانحياز (يعني ± الانحراف المعياري، ن = 6). (D) مؤامرة الرسم البياني يبين انحراف عن نفسه اتجاه الألياف في السقالات nanofiber عشوائية أو الانحياز أجري تحليل الألياف سقالة خارج باستخدام برنامج يماغيج. Pتأجير انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 6. ثقافة أنواع الخلايا الفردية على السقالات الفردية. (A) النتائج بقاء الخلية alamarBlue فحص للخلايا ASM على السقالات الانحياز، خلايا CALU3 على السقالات nanofiber وMRC5 الخلايا على السقالات ستوكات (يعني ± SEM، ن = 3- 20). صور المجهر الإلكتروني الماسح لnanofiber، ستوكات والسقالات الألياف الانحياز (B، C و D على التوالي) والصور مناعي خلايا CALU3 الملون لE-كادهيرين (أحمر)، MRC5 الخلايا الملون لvinculin (أحمر) والخلايا ASM الملون لSM22α (الأحمر) كل على سقالة تخصصهم (E، F و G على التوالي). وقد استخدم هويشت وصمة عار النوى (الأزرق)، ويشير الشريط على نطاق و40 &# 181؛ م الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
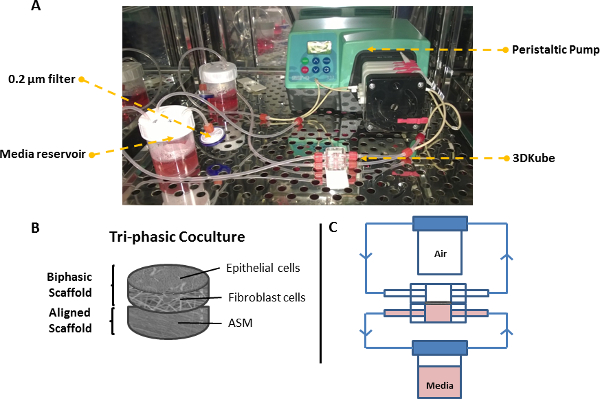
الرقم 7. نظام الإرواء للثلاثي طبقة نموذج جدار الشعب الهوائية. (A) صورة من السفينة مفاعل حيوي متصلة مضخة تحوي والخزانات وسائل الإعلام 2X. (B) تخطيطي من السقالات ثلاثي الطبقات. (C) تخطيطي لاثنين من الدوائر مفاعل حيوي عندما تعقد نموذج الهوائية في واجهة الهواء السائل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
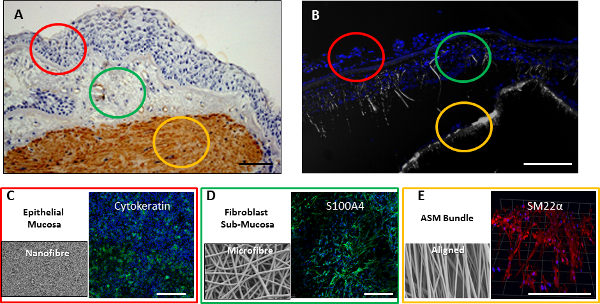
الرقم 8. كاملة 3 D نموذج جدار الشعب الهوائية. (A) الخزعة القصبي من جدار الشعب الهوائية مع الطبقة المخاطية باللون الأحمر، أبرزت المنطقة تحت المخاطية باللون الأخضر، وسلط الضوء على حزمة العضلات الملساء في الذهب. (B) القسم من خلال جدار الشعب الهوائية الطبقات الثلاثية المكونة من السقالات ثنائية الطور والانحياز بالسكان مع طلائي، الخلايا الليفية وخلايا العضلات الملساء ثابتة بعد 2 أسابيع coculture. كانت ملطخة نواة الخلية مع دابي (الأزرق) مع الانعكاس سقالة (الرمادي) تصوير متزامن. كما تم إصلاح السقالات وimmunostained عن علامات معينة من الخلايا بعد 2 أسابيع، مع خلايا CALU3 الملون لcytokeratin (الأخضر) (C)، MRC5 الخلايا الملون لS100A4 (الأخضر) (D)، وخلايا العضلات الملساء الملون لSM22α (أحمر) ( E). يشير الشريط على نطاق 200 ميكرون. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
الحمار = "jove_content" FO: المحافظة على together.within صفحة = "دائما"> 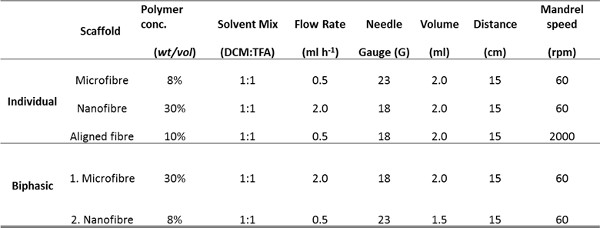
الجدول 1.
Discussion
وقد أدى القدرة على electrospin ألياف البوليمر مع الخصائص الهيكلية للمقارنة إلى ECM الطبيعي للعديد من البوليمرات الطبيعية أو الاصطناعية، أو خليط البوليمر يجري electrospun لإعادة هذه البيئات. التلاعب في عملية المعلمات (بما في ذلك اختيار البوليمر، وتركيز البوليمر، والمذيبات، وبعد المسافة طرف الإبرة ودرجة الحرارة) يمكن لجميع خصائص تأثير سقالة؛ ولكن بعض المعلمات يمكن أن يكون لها تأثير أكبر على خصائص سقالة من غيرها 25. عند تعديل PET الألياف قطر، وجدنا المعايير الأساسية ليكون تركيز البوليمر المستخدمة، والمعدل الذي كان حل البوليمر electrospun، وقطر الإبرة. عندما electrospinning الألياف محاذاة المعايير الأساسية هي طريقة جمع المستخدمة (مغزل الدورية)، والسرعة التي تدور مغزل. من خلال الحد من سرعة مغزل إلى 60 دورة في الدقيقة، وجدنا أظهرت السقالات الانحياز عشوائيا أنتج أكبر سقالة يونيformity مقارنة electrospinning على طبق من ذهب جامع مسطحة.
وقد تم تحليل خصائص الأنسجة مجرى الهواء decellularized لتوفير التوجيه لمختلف تضاريس سقالة وضعت لثقافة كل مجرى الهواء من نوع الخلية. ألياف النانو Electrospun هي سقالة جذابة لتكرار هياكل الغشاء القاعدي نظرا لحجم المسام صغير ولكن المسامية الكلية العالية التي تسمح لزيادة نشر الأيض أثناء تقييد الحركة الخلوية. 9 حين تحقيق الاستفادة المثلى من المعلمات electrospinning، تم اختبار مجموعة من تركيزات PET ومعدلات التدفق. وقد تحققت أنحف الألياف باستخدام 6٪ حل وزن / PET المجلد، وتستخدم من قبل جماعات أخرى. ومع ذلك، كانت مستويات عالية من الديكور، وعدم الاتساق مشاكل مستمرة. المحاولات الأولى لإزالة الديكور شملت إضافة السطحي الموجبة، بروميد cetyltrimethylammonium (CTAB)، إلى حل لخفض التوتر السطحي، واختبار مصادر مختلفةمن PET. إضافة السطحي خفضت كمية من الديكور، ولكن ليس تماما. بعد محاولة عدد من المصادر التجارية الكريات PET، وكان يستخدم زجاجة المشروب الغذاء الصف PET، عن طريق تقطيع زجاجات المشروبات وحل هذه في DCM: محلول مذيب TFA. استخدام هذا كما نتج عن مصدر PET في زيادة الألياف التوحيد والحد من الألياف الديكور. عن طريق زيادة تركيز المحلول قليلا إلى 8٪ بالوزن / المجلد والحد من إبرة قطرها (18G إلى 23G) أنتجنا باستمرار ألياف النانو حرة عيب بقطر الألياف ما يقرب من 250 نانومتر. يمكن السقالات nanofiber Electrospun تكون الكهربائي بشكل كبير على مجموعة من مغزل صنع المناولة اليدوية من السقالات الصعبة. تم تحسين هذا عن طريق تخزين السقالات في رقائق الألومنيوم بعد الغزل وتمرغ في 70٪ IMS قبل الاستخدام. هذا يبدو للمساعدة في تبديد تهمة الكهربائي المتبقية تركت على منصة الاعدام من عملية electrospinning.
لتوفير أعلىographies على غرار microenvironments الفردية من أنواع الخلايا الهوائية الرئيسية الثلاث داخل جدار الشعب الهوائية التي واجهتها، تم تكييفها على بروتوكول electrospinning الأساسي لإنتاج ثلاثة السقالات فريدة من نوعها لهذه الأنواع من الخلايا: قبل electrospinning حلا منخفض PET التركيز ببطء، تم إنشاء ألياف النانو الانحياز بشكل عشوائي، على الذي كانت المصنفة الخلايا الظهارية (محاكاة RBM). قبل electrospinning حل PET تركيز أعلى بمعدل أسرع، تم إنشاء microfibers الانحياز بشكل عشوائي (إنتاج سقالة أكثر مسامية)، الى التي كانت المصنفة الخلايا الليفية (محاكاة منطقة شبه المخاطية مباشرة تحت RBM). قبل electrospinning حلا منخفض PET التركيز على سرعة عالية الدورية مغزل الانحياز ألياف النانو تم إنتاجها، على أي خلايا العضلات الملساء الموجه في الاتجاه الألياف، إنتاج ألواح الخلايا الانحياز.
زيادة أقطار الألياف تؤدي إلى زيادة حجم المسام، مما يسمح للمزيد من penetratio الخليةن إلى السقالات وذلك يساعد على خلق بيئة 3D الحقيقية. كانوا يعملون السقالات ستوكات للثقافة الخلايا الليفية في الدراسة للتأكد من أن الخلايا يقيمون على طائرات متعددة داخل سقالة. عن طريق زيادة تركيز PET إلى 30٪ بالوزن / المجلد، تم إنتاج ألياف PET مع متوسط قطرها 2.5 ميكرون. تم إنتاج ألياف أكبر قطرها (≈ 4 ميكرون) باستخدام محلول PET بالوزن / المجلد 35٪، ولكن تم فقدان سمك سقالة التوحيد، وكان التباين العالي بين الألياف الفردية واضح. وكانت المسام في سقالة ستوكات أكثر من 7 مرات أكبر من تلك التي تقاس في السقالات nanofiber (10.45 ميكرون مقابل 1.43 ميكرون على التوالي)، ولكن لا يزال البذر ثابت من الخلايا قدم اختراق الخلوي محدودة. تم تحسين هذا عن طريق بذر حيوي الخلايا باستخدام خلاط المداري، وهي طريقة ثبت أن تكون فعالة في السابق.
تم إنشاء السقالات nanofiber الانحياز كبير من قبل electrospinning 10٪وزن / PET حل المجلد على مغزل يدور في 2000 دورة في الدقيقة (≈ 440 م · دقيقة -1). وقد زاد تركيز PET من 8٪ إلى منع حدوث موجة تشبه التشكل عدم انتظام الألياف أظهرت بتركيزات أقل. على الرغم من الزيادة في تركيز، محاذاة الألياف انخفاض متوسط قطر الألياف (216 نانومتر مقابل 255 نانومتر، الانحياز مقابل عشوائي). سرعة عالية للمغزل رسم الألياف من قبل أن جفت من المرجح أن يسبب هذا التأثير. محاذاة الألياف أثرت على محاذاة الخلايا ASM، ولها أيضا تأثيرات فسيولوجية أخرى على الخلايا ASM التي اتسمت في أماكن أخرى 21.
القيد الرئيسي لهذا البروتوكول هو عدم القدرة على صورة الخلايا الحية على / في السقالات جعل الأولي خلية مرفق أو التمايز على مدى فترة زمنية طويلة من المستحيل تحديد من دون التضحية العينات. وهذا يعني حدوث معظم الأمثل بعد فترة ثقافة، أي إصلاحعينات جي ومن ثم قياس ما إذا كانت زراعة الخلايا ناجحة بعد ليس خلال زراعة الخلايا. ملاحظة تغير اللون في السقالات المحتضنة في alamarBlue (الأزرق إلى اللون الوردي) إلى خلايا موجودة وقابلة للحياة، ولكن ليست مثالية. Electrospinning البوليمرات أكثر شفافية مثل الجيلاتين يمكن أن تساعد في تصور الخلايا على السقالات. وelectrospinning من سقالة nanofibrous ضمن نموذجنا يسمح للتكرار RBM مجرى الهواء، تتكون بالمثل من ألياف النانو الكثيفة التي الخلايا الظهارية الموجودة. وقد سبق أن تبين أن خلايا هيكلية لا يمكن ترحيل من خلال سقالة nanofiber 22، على الرغم من أن الخلايا المناعية قادرة على (لا تظهر البيانات). في حين مفيد للزراعة من بين أنواع معينة من الخلايا على سطح 3D (مثل الظهارية وخلايا بطانة الأوعية الدموية)، وهذا منع الهجرة الخلية الهيكلية من خلال ألياف النانو قد تكون ضارة للزراعة من أنواع الخلايا الأخرى. كما العضلات الملساء غير قادرة على الهجرة من خلال الالبريد الانحياز nanofiber سقالة اجتمعنا في coculture ثلاثي الطبقات مع العضلات الملساء وطبقات الخلايا الليفية التي تواجه بعضها البعض (بدلا من السقالة الانحياز التي تفصل بين أنواع الخلايا اثنين). ومع أن هذا يسمح للخلايا ليكون في بدل قريبة، والدراسة الحالية لا يمكن أن يستنتج ما إذا كان نوع خلية واحدة (إما الليفية أو العضلات الملساء) سوف تتفوق على طبقة كاملة على مدى ثقافة أكثر لفترات طويلة. على الرغم من هذه القيود، وقد تم تطوير نموذج ثلاثي طبقة قابلة للحياة للجدار الشعب الهوائية، وتوفر بيئة بديلة للتحقيق في التفاعلات بين هذه الخلية أنواع متعددة. وقد تم مؤخرا نشر دراسة ثلاثي الطبقات مشابهة حيث كانت جزءا لا يتجزأ الليفية داخل الكولاجين أسطواني I هيدروجيل مع العضلات الملساء المصنف على السطح الخارجي والخلايا الظهارية في سطح اللمعية 17. الاستقرار الميكانيكي للالسقالات electrospun وضعت هنا من شأنها أن تسمح أنبوبي مماثل يبني يتم تشكيلها، ويبقى resea الحاليRCH تهدف داخل مجموعتنا. في حين ركزت الدراسة على مجرى الهواء، عدة أجهزة في الجسم حصة هذه الوحدة الهيكلية المخاطية الأساسية، ومن خلال تعديل المستأجرين سلط عليها الضوء في هذه الدراسة، ويمكن وضع مناهج مماثلة لأنسجة تحتوي على وحدة الغشاء القاعدي بما في ذلك الأوعية الدموية، المثانة و القرنية، حيث استخدمت الكولاجين أساس نماذج متعددة الطبقات.
Disclosures
The Authors have nothing to disclose.
Acknowledgements
The research leading to these AirPROM results has received funding from the European Union under grant agreement n° 270194.This work was also funded by the National Centre for the Replacement, Refinement, and Reduction of Animals in Research (NC3Rs), and the Engineering and Physical Research Centre (EPSRC) Doctoral Training Centre (DTC) in Regenerative Medicine, U.K.
Materials
| Name | Company | Catalog Number | Comments |
| Polyethylene terephthalate (PET) | Lucozade (GSK) bottles | N/A | Source of PET for electrospinning. Cut into small pieces and weigh out as necessary |
| Dichloromethane (DCM) | Solvent for PET | ||
| Trifluoroacetic acid (TFA) | Sigma | Solvent for PET | |
| Rotating Mandrel | Built in house | Used to collect electrospun fibres. By rotating at different speeds, fibres can be aligned or randomly oriented | |
| Syringe Pump | Harvard apparatus | used in the electrospinning process | |
| DMEM-F12 | Gibco | Culture medium for CALU3 cells | |
| DMEM | Gibco | Culture medium for HASM cells | |
| MEM | Gibco | Culture medium for MRC5 cells | |
| Antibiotic/ antimycotic solution | Gibco | Media supplement | |
| FCS | Gibco | Media supplement | |
| Orbital mixer (Orbital shake 503) | Stuart Scientific | For dynamic seeding of cells onto microfibre scaffolds | |
| Peristaltic Pump | Watson Marlow | For providing media flow through bioreactor | |
| 3DKube | Kiyatec | Bioreactor for 3D cell culture |
References
- Macchiarini, P., et al. Clinical transplantation of a tissue-engineered airway. Lancet. 372 (9655), 2023-2030 (2008).
- Song, J., Guyette, J., Gilpin, S. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature medicine. 19 (5), 646-651 (2013).
- Wenzel, S., Holgate, S. The mouse trap: it still yields few answers in asthma. American journal of respiratory and critical. 174 (11), 1171-1173 (2006).
- Zosky, G. R., Sly, P. D. Animal models of asthma. Clinical and experimental allergy journal of the British Society for Allergy and Clinical Immunology. 37 (7), 973-988 (2007).
- Bates, J. H. T., Rincon, M., Irvin, C. G. Animal models of asthma. American journal of physiology. Lung cellular and molecular physiology. 297 (3), L401-L410 (2009).
- Johansson, F., Carlberg, P., Danielsen, N., Montelius, L., Kanje, M. Axonal outgrowth on nano-imprinted patterns. Biomaterials. 27 (8), 1251-1258 (2006).
- Paik, I., et al. Rapid micropatterning of cell lines and human pluripotent stem cells on elastomeric membranes. Biotechnology and bioengineering. 109 (10), 2630-2641 (2012).
- Williams, C., et al. Aligned Cell Sheets Grown on Thermo-Responsive Substrates with Microcontact Printed Protein Patterns. Advanced Materials. 21 (21), 2161-2164 (2009).
- Schindler, M., et al. A synthetic nanofibrillar matrix promotes in vivo-like organization and morphogenesis for cells in culture. Biomaterials. 26 (28), 5624-5631 (2005).
- Schindler, M., et al. Living in Three Dimensions. Cell Biochemistry and Biophysics. 45 (14), 215-227 (2006).
- Ahmed, I., et al. Morphology, cytoskeletal organization, and myosin dynamics of mouse embryonic fibroblasts cultured on nanofibrillar surfaces. Molecular and Cellular Biochemistry. 301 (1-2), 241-249 (2007).
- Flemming, R., Murphy, C., Abrams, G. Effects of synthetic micro-and nano-structured surfaces on cell behavior. Biomaterials. 20, 573-588 (1999).
- Sun, T., et al. Development of a 3D Cell Culture System for Investigating Cell Interactions With Electrospun Fibers. Biotechnol. Bioeng. 97 (5), 1318-1328 (2007).
- Kim, D. -. H., Provenzano, P. P., Smith, C. L., Levchenko, A. Matrix nanotopography as a regulator of cell function. The Journal of cell biology. 197 (3), 351-360 (2012).
- Jeffery, P. K. Remodeling in Asthma and Chronic Obstructive Lung Disease. American Journal of Respiratory and Critical Care Medicine. 164 (10 pt 2), S28-S38 (2001).
- Jungebluth, P., et al. Tracheobronchial transplantation with a stem-cell-seeded bioartificial nanocomposite: a proof-of-concept study. Lancet. 378 (9808), 1997-2004 (2011).
- Miller, C., George, S., Niklason, L. Developing a tissue-engineered model of the human bronchiole. Journal of Tissue Engineering and Regenerative. (July), 619-627 (2010).
- West, A. R., et al. Development and characterization of a 3D multicell microtissue culture model of airway smooth muscle. American journal of physiology. Lung cellular and molecular physiology. 304 (1), L4-L16 (2013).
- Nesmith, A. P., Agarwal, A., McCain, M. L., Parker, K. K. Human airway musculature on a chip: an in vitro model of allergic asthmatic bronchoconstriction and bronchodilation. Lab on a chip. , (2014).
- Hadjizadeh, A., Ajji, A., Bureau, M. N. Nano/micro electro-spun polyethylene terephthalate fibrous mat preparation and characterization. Journal of the mechanical behavior of biomedical materials. 4 (3), 340-351 (2011).
- Morris, G., et al. Human airway smooth muscle maintain in situ cell orientation and phenotype when cultured on aligned electrospun scaffolds. American Journal of Physiology - Lung Cellular and Molecular Physiology. 307 (1), L38-L47 (1999).
- Morris, G. E., et al. A novel electrospun biphasic scaffold provides optimal three-dimensional topography for in vitro co-culture of airway epithelial and fibroblast cells. Biofabrication. 6 (3), 035014 (2014).
- Sell, S., et al. The Use of Natural Polymers in Tissue Engineering: A Focus on Electrospun Extracellular Matrix Analogues. Polymers. 2 (4), 522-553 (2010).
- Subbiah, T., Bhat, G. S., Tock, R. W., Parameswaran, S., Ramkumar, S. S. Electrospinning of nanofibers. Journal of Applied Polymer Science. 96 (2), 557-569 (2005).
- Dalton, P. D., et al. Electrospinning and additive manufacturing: converging technologies. Biomaterials Science. 1 (2), 171 (2013).
- Boland, E. D., Wnek, G. E., Simpson, D. G., Pawlowski, K. J., Bowlin, G. L. Tailoring tissue engineering scaffolds using electrostatic processing techniques: A study of poly(glycolic acid) electrospinning. Journal of Macromolecular Science-Pure and Applied Chemistry. 38 (12), 1231-1243 (2001).
- Stitzel, J. D., Bowlin, G. L., Mansfield, K., Wnek, G. E., Simpson, D. G. Electrospraying and electrospinning of polymers for biomedical applications. Poly(lactic-co-glycolic acid) and poly(ethylene-co-vinylacetate). Revolutionary Materials: Technology And Economics. 32, 205-211 (2000).
- Liu, W., Thomopoulos, S., Xia, Y. Electrospun nanofibers for regenerative medicine. Advanced healthcare materials. 1 (1), 10-25 (2012).
- Veleirinho, B. Solvent and concentration effects on the properties of electrospun poly (ethylene terephthalate) nanofiber mats. Journal of Polymer. , 460 (2008).
- Balguid, A., et al. Tailoring Fiber Diameter in Electrospun Poly(epsilon-Caprolactone) Scaffolds for Optimal Cellular Infiltration in Cardiovascular Tissue Engineering. Tissue Engineering Part A. 15 (2), 437-444 (2009).
- Shalumon, K. T., et al. Fabrication of three-dimensional nano, micro and micro/nano scaffolds of porous poly(lactic acid) by electrospinning and comparison of cell infiltration by Z-stacking/three-dimensional projection technique. IET nanobiotechnology / IET. 6 (1), 16-25 (2012).
- Thevenot, P., Nair, A., Dey, J., Yang, J., Tang, L. Method to Analyze Three-Dimensional Cell Distribution and Infiltration in Degradable Scaffolds. Tissue Engineering Part C-Methods. 14 (4), 319-331 (2008).
- Rose, J., et al. Gelatin-Based Materials in Ocular Tissue Engineering. Materials. 7 (4), 3106-3135 (2014).
- Liliensiek, S. J., Nealey, P., Murphy, C. J. Characterization of Endothelial Basement Membrane Nanotopography in Rhesus Macaque as a Guide for Vessel Tissue Engineering. Tissue Engineering Part A. 15 (9), (2009).
- Abrams, G. A., Murphy, C. J., Wang, Z. -. Y., Nealey, P. F., Bjorling, D. E. Ultrastructural basement membrane topography of the bladder epithelium. Urological research. 31 (5), 341-346 (2003).
- Abrams, G. A., Bentley, E., Nealey, P. F., Murphy, C. J. Electron Microscopy of the Canine Corneal Basement Membranes. Cells Tissues Organs. 170 (4), 251-257 (2002).
- Reichl, S., Bednarz, J., Muller-Goymann, C. Human corneal equivalent as cell culture model for in vitro drug permeation studies. British Journal of Ophthalmology. 88 (4), 560-565 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved