Method Article
התאמת תהליך Electrospinning לספק שלוש סביבות ייחודיות לTri-שכבתי
In This Article
Summary
Advancements in biomaterial technologies enable the development of three-dimensional multi-cell-type constructs. We have developed electrospinning protocols to produce three individual scaffolds to culture the main structural cells of the airway to provide a 3D in vitro model of the airway bronchiole wall.
Abstract
Electrospinning is a highly adaptable method producing porous 3D fibrous scaffolds that can be exploited in in vitro cell culture. Alterations to intrinsic parameters within the process allow a high degree of control over scaffold characteristics including fiber diameter, alignment and porosity. By developing scaffolds with similar dimensions and topographies to organ- or tissue-specific extracellular matrices (ECM), micro-environments representative to those that cells are exposed to in situ can be created.
The airway bronchiole wall, comprised of three main micro-environments, was selected as a model tissue. Using decellularized airway ECM as a guide, we electrospun the non-degradable polymer, polyethylene terephthalate (PET), by three different protocols to produce three individual electrospun scaffolds optimized for epithelial, fibroblast or smooth muscle cell-culture. Using a commercially available bioreactor system, we stably co-cultured the three cell-types to provide an in vitro model of the airway wall over an extended time period.
This model highlights the potential for such methods being employed in in vitro diagnostic studies investigating important inter-cellular cross-talk mechanisms or assessing novel pharmaceutical targets, by providing a relevant platform to allow the culture of fully differentiated adult cells within 3D, tissue-specific environments.
Introduction
תחום רפואת רגנרטיבית והנדסת רקמות מתקדם ב, עם פריצות דרך בקנה הנשימה וכליות התחדשות שני הישגים אחרונים ראויים לציון. ביו-חומרים שפותחו בהנדסת רקמות הופכים להיות נגישים יותר, עם הזדמנויות להעברת פרוטוקולים כגון למעבדות פחות מיוחדות. תחום אחד דרוך ליהנות באמצעות הגברת שימוש בביו-חומרים הוא באבחון מבחנה.
במחקרי מבחנה הן פלטפורמה חשובה לחקור מסלולי איתות התוך תאיים בתוך תא-סוגים בודדים, וסייעו להתוות מנגנוני pathophysiologies מחלה רב. מחקרים אלה בדרך כלל מסתמכים על תאים מסוג אחד להיות מתורבת כמו monolayer על פלסטיק בתרבית רקמה (TCP); משטח דו ממדים (2D) נוקשה הרבה פחות אלסטי ונקבובי יותר מתאי הסביבה (3D) תלת ממדים נחשפים בתוך רקמה או איבר. מודלים של בעלי החיים היו באופן מסורתי דוארmployed כדי לאשר השפעות שנמצאו במבחנה גם לתרגם לכל רקמה, ויכול לשמש גם כפלטפורמות פרה-קליניות לחקור מחלות בבני אדם. עם זאת, הבדלים בין-מינים לערער הסתמכות זו על מודלים של בעלי חיים בהבנה של מחלות אנושיות שלנו -. לדוגמא, הרבה הבנה של אסטמה מחלת ריאות מבוססת על מודל של עכברים למרות הבדלים המהותיים בין מצבו של האדם ומודל זה כולל מעט עדויות של חדירת תא תורן של צרור שריר חלק בדרכי הנשימה, או את היכולת להתפתחות מחלה ספונטנית בתוך החיה מודל 3,4. ישנם גם שיקולים אתיים בנוגע לשימוש במודלים של בעלי חיים, עם התקן "3Rs" של "החלפה, עידון, והפחתה" בניסויים בבעלי חיים שעודדו בבריטניה ובמדינות אחרות.
חלופה אטרקטיבית תהיה השחזור של רקמה אנושית במבנה יצירת מבחנהים כדי לחקור את טבע שיתוף הפעולה בין סוגי תאי אדם בוגרים ביחידה אחת. תאים קיימים במבנים רב-תאיים 3D בתוך רקמה, כל אחד במייקרו-סביבה ייחודית. Culturing של תאים על TCP מאפשר רק התרבות של monolayers התא, מסוגל לשכפל סביבה זו, או לספק את היכולת לתרבות רב-תא. קידום Biomaterials מספק ההזדמנות לפתח שני פלטפורמות 3D טבעיות וסינתטיות לתרבית תאים. ECM decellularized יכול לשמש לתרבית תאי 3D כאשר recellularized עם תא-סוגים אחרים, כוללים תאי גזע 1, לעומת זאת פרוטוקולים כאלה יכולים להיות מורכבים וזמן רב, עם הזמינות של רקמה מוגבלת ובעיקר ממקור לא אנושי. פרוטוקולים אחרים מאפשרים שליטה רבה יותר על הסביבה התאית נוצרה כגון nanoimprinting, בתצהיר ECM, טכנולוגיות וכו 'תא, או electrospinning. Electrospinning יוצר מחצלות ארוגים 3D נקבוביות של סיבים בקטרים הנעים בין ננומטר למיקרומטר, replicating ממדי ECM טבעיים. פיגומי electrospun יותר ויותר להיות מועסקים כפלטפורמות culturing תא 3D -. מניפולציה של הפרמטרים electrospinning מאפשרת שליטה מורכבת על מאפייני פיגום כגון גודל נקבובית, בקוטר סיבים, טופוגרפיה ויישור, וכימיה של פני השטח. שינויים של פרמטרים כגון הוכחו להשפיע הידבקות תא וצמיחה ישירות, כאשר תאים בתרבית בבידוד.
יתרונות אלה נוצלו במחקר הנוכחי כדי לאפשר culturing של סוגי תאים מרובים כמבנה רקמת 3D יחיד, באמצעות bronchiole בדרכי הנשימה כמבנה רקמת מודל 3D. קיר bronchiole מורכב משלושה אזורים עיקריים (איור 1). הרירית שבו תאי האפיתל בדרכי נשימה לשבת בממשק האוויר הנוזלי (עלי), ומספקים מחסום חשוב לסביבה החיצונית. הם מתגוררים בקרום במרתף רשתי (RBM), ECM בחוזקה קומפקטי כולל בעיקר collagen IV, perlecans, וlaminins. השכבה תת-ריריים נמצאת ישירות מתחת לרירית, אזור נקבובי יותר מורכב מסוגי תאים רבים, כולל fibroblasts, myofibroblasts וחדירה לויקוציטים בתנאי מחלה. לבסוף חבילות שריר החלק לעטוף את דרכי הנשימה בצורה סליל, והם מורכבים מגיליונות מיושרים של שרירים בדרכי נשימה חלקים (ASM). זה מצב ההתכווצות היחסי של שריר החלק ששולט טון בדרכי נשימה. התעסוקה של פיגומי electrospun במערכת הריאות שעד לאחרונה הייתה מוגבלת למטרות משובי; עם החלפת קנה הנשימה electrospun שהושתלה בהצלחה. בעוד מוצלח, טיפולים כאלה הם מוגבלים במספרים, והם התמקדו בקנה הנשימה בשל האופי הפשוט היחסי של הפונקציה של הרקמות. דוגמאות מוגבלת של דגמים בדרכי נשימה המשמשים לאבחון במבחנה קיימות, ומתמקדות בעיקר במדידות התכווצות שריר חלק,. לא רעיל ולאterephthalate פוליאתילן פולימר n-מתכלה (PET) כבר בעבר electrospun, והועסק במחקר הנוכחי על מנת להבטיח פיגומים מיוצרים יכול להיות מאוחסן במשך תקופות ארוכות ללא משפיל (ומאפשר להם לשמש "מהמדף"), וגם להיות מתאים לתרבית תאים יציבה על פני תקופות זמן ממושכות. מחקרים קודמים מהקבוצה שלנו הראו כי העסקת שלוש וריאציות של פרוטוקול electrospinning בסיסי, ניתן לייצר שלושה פיגומי electrospun PET פרט לספק טופוגרפיות אופטימליות לאפיתל דרכי הנשימה culturing, פיברובלסטים, ותאי שריר חלק בבידוד 21,22 וcoculture של דרכי הנשימה תאי האפיתל ופיברובלסטים 22. קוטר סיבים נמצא משפיע על הפונקציונליות אפיתל 22 מאוד, ויישור סיבים אפשר הדור של גיליונות מיושרים של שריר חלק 21. מחקרים אלו בוצעו באופן בלתי תלוי זה בזה בתנאים סטטיים. במחקר הנוכחי, differe אלהפיגומי NT, המכילים תאי אדם בוגרים מובחן באופן מלא כבר cocultured במשך שבוע אחד בALI בbioreactor זמין מסחרי כסעיף 3 ד לקיר בדרכי הנשימה, מתן מבחינה פיזיולוגית רלוונטי במודל מבחנה לחקור תגובות בין-תאיות בדרכי נשימה. בעוד פרוטוקול זה הוא באמצעות bronchiole בדרכי הנשימה כמערכת מודל, זה יכול להיות מותאם כפלטפורמה לcoculture 3D של יחידות הריריות מאיברים אחרים.
Protocol
תאי ASM עיקריים מאנשים שאינן אסתמה היו מבודדים מביופסיות הסימפונות בבית החולים גלנפילד (לסטר, בריטניה) כפי שתואר לעיל. המחקר אושר על ידי ועדת האתיקה Leicestershire וחולים נתנו את הסכמתם בכתב, הודיעה.
1. Electrospinning PET פיגומים (איור 2)
- הכן פתרון (10 מיליליטר) של הכיתה בקבוק משקה PET של 1: 1 dichloromethane (DCMro) - חומצת trifluoroacetic פתרון (TFA). ריכוזי PET של 8%, 30% ו -10% במשקל / נפח (כרך WT /) נדרשים לnanofiber, מיקרופייבר ומיושר פיגומי בהתאמה ולאחר מכן מערבבים O הפתרון / N ב RT עבור PET לפזר.
- מעבירים את פתרון PET לתוך מזרק ולצרף 23-G (לnanofiber) או 18-G (למיקרופייבר ומיושר) מחט למזרק ולמקם את המזרק לתוך משאבת מזרק ממונעת. ודא חוד המחט הוא הסתובב לתחתית.
- מקם את האמאndrel 15 סנטימטרים מקצה המחט, להבטיח את המחט הצביעו במרכז התוף.
- צרף את אספקת החשמל לקצה המחט עם קליפים תנין וקרקע mandrel (דרך שקע בננה) לכדור הארץ. הפעל את אספקת החשמל לmandrel ומהירות מוגדרת 60 סל"ד (שווה ערך לכ 13.2 מ '· דקות -1) לפיגומי nanofiber ומיקרופייבר. מהירות סט 2,000 סל"ד (שווה ערך לכ -440 מ '· דקות -1) פיגומים למיושרים.
- הגדר את משאבת המזרק לקצב זרימה של 0.5 מיליליטר · שעה -1 לפיגומי nanofiber אקראיים ומיושרים או 2.0 מיליליטר · שעה -1 לפיגומי מיקרופייבר. לאפשר המשאבה לרוץ עד הפתרון הנמתח מקצה המחט כדי להסיר כל אוויר במחט. אז לעצור את המשאבה.
- על משאבת המזרק, להגדיר את הנפח הכולל של פתרון ליגורש עד 2 מ"ל ולהתחיל את המשאבה.
- אספקת סט מתח עד 14 קילו וולט, ומתג על supp הכחly.
- Electrospin עד 2 מיליליטר של תמיסה כבר electrospun (4 שעות לnanofiber ופיגומים מיושרים, 1 שעה לפיגומי מיקרופייבר).
- חותך את הפיגום עם להב לאורך הרוחב של mandrel. זה מפיק גיליון 2D של פיגום בגודל של שטח פן mandrel (במקרה זה, 22 סנטימטרים X 11 סנטימטרים גיליון מלבני) יכול להיות קלופים שבזהירות את mandrel). אחסן את הפיגום בנייר אלומיניום כדי להפחית מטען אלקטרוסטטי).
הערה: פיגומי Biphasic מיוצרים על ידי רציף electrospinning פיגום nanofiber ישירות על גבי פיגום מיקרופייבר.
2. עיקור של פיגומים לפני השימוש בתרבית תאים
- מגיליון הפיגום, אגרוף החוצה דיסקים של פיגומי biphasic או מיושרים באמצעות עט ביופסיה 0.8 מ"מ קוטר ולהיצמד לאטם באמצעות דבק אקווריום שאינו רעיל.
- לעקר פיגומים באמצעות קרינת אולטרה סגולה למשך 30 דקות בכל צד של הפיגומים לפני הטבילה ב20% כרך O / כרך פתרון אנטיביוטי / antimycotic (2x10 5 מיליליטר יחידות -1 פניצילין G, 2,000 מיליליטר מ"ג -1 סולפט סטרפטומיצין ומיקרוגרם 500 מיליליטר -1 B amphotericin) / N ב 4 מעלות צלזיוס.
- לשטוף פיגומים עם PBS 3 פעמים, ולאחר מכן פיגומי חנות בצלחות גם TCP PBS ב 4 מעלות צלזיוס עד לשימוש.
3. קהילה בית-הספר תרבות מדיה הנייד
- תאי האפיתל התרבות CALU3 בתקשורת DMEM-F12 בתוספת סרום עגל עוברי 10% כרך / כרך (FCS), פתרון 2 ננומטר L- גלוטמין, כרך 1% / אנטיביוטיקה כרך / פתרון antimycotic (10,000 יחידות מיליליטר -1 פניצילין G, 100 מ"ג מיליליטר -1 סולפט סטרפטומיצין ו -25 מיליליטר מיקרוגרם -1 B amphotericin).
- תרבות תאי פיברובלסטים וASM MRC5 בתקשורת DMEM בתוספת סרום עגל עוברי 10% כרך / כרך (FCS), פתרון 2 ננומטר L- גלוטמין, כרך 1% / אנטיביוטיקה כרך / פתרון antimycotic (10,000 יחידות מיליליטר -1 פניצילין G, 100 מיליליטר מ"ג -1 סולפט סטרפטומיצין ו -25 מיליליטר מיקרוגרם -1 B amphotericin).
- שיתוף תרבויות תרבות תאי אפיתל-פיברובלסטים-ASM ב70:30 DMEM-F12: תערובת תקשורת DMEM.
4. זריעה של תאי פיברובלסטים ואפיתל על Biphasic פיגום
- בצלחת תרבית רקמה, להשרות את הפיגומים בתקשורת בתוספת-DMEM ולדגור על 37 מעלות צלזיוס במשך שעה 1 לפני זריעת תאים.
- הסר את המדיה בתוספת-DMEM, למקם את שלב מיקרופייבר של פיגום apically וזרע 1.5 x10 4 MRC5 תאי פיברובלסטים בμl 30 של תקשורת בתוספת-DMEM. להתסיס את צלחת על שייקר מסלולית לשעה 2, לפני שעזבת בחממה על 37 מעלות צלזיוס 5% CO 2 באוויר O / N.
- הפעל פיגום על כך שלב nanofiber של פיגום הפרצופים apically, 4 CALU3 תאי האפיתל 3.0 x10 זרע בμl 30 של מדיה-תוספת F12 DMEM על שלב nanofiber של הפיגום ודגירת FOr 2 שעות על 37 מעלות צלזיוס, 5% CO 2 באוויר לפני הצללה הפיגום ב70:30 DMEM-F12: O-מדיה בתוספת DMEM / N לפני העברה לbioreactor.
5. זריעה של תאי ASM על הפיגום מיושר
- בצלחת תרבית רקמה, להשרות את הפיגומים בתקשורת בתוספת-DMEM ודגירה עבור שעה 1 ב 37 מעלות צלזיוס לפני זריעת 2.5 x10 4 תאים ב -30 μl של תקשורת בתוספת-DMEM ודוגר במשך שעה 2 (37 מעלות צלזיוס, 5% CO 2 באוויר). לצלול פיגום בתמורה מדיה בתוספת-DMEM לחממה ולהשאיר O / N לפני ההקמה תלת-תרבות בbioreactor.
6. הגדרה-עד Tri-התרבות באמצעות מערכת bioreactor (איור 7)
- מניחים את אטם פיגום biphasic לתוך החריץ בתוך תא אחד עם שלב אפיתל פונה כלפי מעלה לתוך התא.
- מניחים את הפיגום מיושר מתחת לפיגום biphasic (ולכן הוא צמוד למילשלב crofiber של פיגום biphasic) ולנעול את שני תאים של bioreactor יחד.
- להרכיב שתי זרימת זלוף מעגלים מחוברים לשני מאגרים בינוניים (מדיה בתוספת-DMEM-F12 במאגר הפסגה, DMEM-F12 / מדיה בתוספת-DMEM במאגר בסיסי) ותקשורת משאבה סביב שני מעגלים בכ 0.1 מיליליטר / דקה באמצעות משאבה peristaltic (ממוחזרת 40 מיליליטר תקשורת דרך כל מעגל). בית כל חלקי המערכת בתוך חממה ב 37 מעלות צלזיוס, 5% CO 2 באוויר.
- אחרי שבוע אחד, להסיר את התקשורת מהאולם הפסגה, ותרבות תאי האפיתל בALI במשך שבוע נוסף לפני הניתוח.
תוצאות
תמונות מיקרוסקופ אלקטרונים סורק של רקמות בדרכי הנשימה decellularized או תמונות immunohistological מביופסיות בדרכי נשימה זיהו מאפיינים רצויים של ECM בדרכי הנשימה שרצינו להכניס לטופוגרפיות פיגום electrospun: מטריצת RBM ילידים מורכבת מסיבים כ 153 ננומטר ± 30.6 ננומטר (ממוצע ± SD n = 50 מדידות ) בקוטר (איור 3 א & 5A), בעוד שהמטריצה המקיפה את RBM היה יותר נקבובי בטבע (איור 3 ג). סעיפי immunohistological באמצעות חבילות שריר חלק להראות נוכחי ASM כגיליונות מיושרים של תאים 21 (איור 3E). מידע זה משמש כדי להנחות את המאפיינים הציגו לפיגומי electrospun. Mandrel מסתובב היה מסוגל לסובב ביציבות במהירויות גבוהות (> 2,000 סל"ד / 440 מ '· דקות -1) כדי לייצר פיגומים עם סיבים מיושרים. סיבוב mandrel האיטי (60 סל"ד 13.2 מ '· דקות -1) לא השפיעו על כיוון הסיבים, אבל מיוצר פיגומים עם עובי אחיד יותר מאשר כאשר electrospinning על צלחת סטטי. על ידי שינוי הפרמטרים electrospinning (ריכוז PET וקצב זרימת פתרון), ניתן היה ליצור סיבי פיגומים בקטרים של כמה מיקרומטרים או מאות ננומטרים (פרמטרים electrospinning מוצגים בטבלה 1).
סיבי electrospun בקטרים סיבים שווי ערך לסיבים טבעיים RBM (150 ננומטר) הופקו באמצעות פתרון PET 6%, אולם בריכוזים נמוכים כגון PET, ואגלי של הסיבים התרחשו (איור 4 א). זה בוטל על ידי הגדלת הריכוז של פתרון PET עד 8% שהניב nanofibers האחיד בעל קוטר של 255 ממוצע ננומטר ± 2.4 ננומטר (ממוצע ± SEM) וגודל נקבובית ממוצע של 1.43 מיקרומטר ± 0.02 מיקרומטר (4B דמויות, 5A & B). לelectrospin nanofibers היה צורך להקטין את גודל המחט מ -18 G ל -23 G, המאפשר זרימה איטית יותר שיעורי whilsלא שמירת מהירות זרימה גבוהה יותר והפחתת חסימת מחט, בעיה חוזרת עם המחט הגדולה יותר. כאשר electrospinning microfibers, עלייה בפתרון PET ל> 30% עופרת PET לחוסר האחידות בקוטר סיבים (איור 4F) בנוסף לחסימות מרובות בקצה המחט עקב הצמיגות הגבוהה פתרון. מחצלות מיקרופייבר אחידות בעל קוטר סיב ממוצע של 2.50 מיקרומטר ± 0.02 מיקרומטר (ממוצע ± SEM) וגודל נקבובית ממוצע של 10.45 ± 0.13 מיקרומטר מיקרומטר הופקו כאשר electrospinning 30% פתרון PET WT / כרך בקצב זרימה של 2 מ"ל / שעה -1 (האיורים 4F, 5A & B). electrospinning רציף של פיגום nanofiber ישירות על גבי פיגום מיקרופייבר (עדיין מחובר לmandrel) יצר פיגום biphasic (איור 3D). קטרי הסיבים הממוצע היו 280 ננומטר ± 20 ננומטר ו2.30 מיקרומטר ± 0.06 מיקרומטר לשלבי nanofiber ומיקרופייבר בהתאמה,דומה לממדים של פיגומי nanofiber ומיקרופייבר בודדים. בנוסף, העובי של פיגום biphasic היה דומה לסכום של פיגומי פרט nanofiber ומיקרופייבר (איור 5 ג). באמצעות הגדלת מהירות mandrel (2,000 סל"ד / 440 מ '· דקות -1), פיגומי ננו או מיקרופייבר מיושרים מאוד הופקו. פתרון PET WT / כרך 8% לא היה אופטימלי לייצור nanofibers מיושר וסיבים שהופקו בעלי מורפולוגיה כמו גל (איור 3F). עלייה של 10% PET ביטלה את האפקט הזה, אבל עדיין הביאה קוטר סיבים מופחת (216 ננומטר ± 2.2 ננומטר (ממוצע ± SEM)) בהשוואה לפיגומי nanofiber מיושר באופן אקראי. יישור סיבים חושבו על ידי קביעת הסטייה של הזווית של כל סיבים מזווית הסיבים הממוצעים. בפיגומי nanofiber מיושרים 79% מסיבים היו מיושרים (± 10 ° זווית סיבים ממוצעים) לעומת 10.2% של סיבים בscaff nanofiber מיושר באופן אקראיבני (איור 5D).
8% פיגום nanofiber שימש לשחזר RBM שבתאי האפיתל מתגוררים, ושמש לתמיכה בתרבות של תאי CALU3 (תא-קו אפיתל דרכי נשימה). 30% פיגום מיקרופייבר WT / כרך, להיות יותר נקבובי בטבע שימש לחקות את האזור תת-ריריים, והיה תרבותי עם MRC5 תאים (תאים-קו פיברובלסטים בדרכי נשימה). פיגום nanofiber מיושר 10% כרך / WT סיפק התייחסות טופולוגי כדי להבטיח יישור תא ASM כאשר בתרבית על הפיגום. כל שלושה סוגי התאים הראו עלייה בכדאיות כאשר בתרבית על הפיגומים האישיים שלהם על פני תקופה 2 בשבוע (איור 6 א), והביעה את חלבונים ספציפיים תאים מסוג לאחר תקופת התרבות 2 בשבוע (איור 6, 6 ג, ו6D). אפיון נוסף של אינטראקציות תא-פיגום בודדים דווח במקום אחר 21,. Electrospinning רציף של פיגום nanofiberעל פיגום מיקרופייבר מיוצר פיגום biphasic לcoculture של תאי האפיתל CALU3 ותאי פיברובלסטים MRC5 על שלבי nanofiber ומיקרופייבר בהתאמה. Culturing של שני תאים יחד בתנאי סטטי כבר דווח במקום אחר 22. עבודה נוספת שתנסה להוסיף שכבות תאים אחרות או להאריך פעמים culturing biphasic מעבר 2 שבועות בתנאים סטטיים נכשל (מידע לא מוצג). לתרבות מודל תלת-שכבתי על פני תקופה ארוכה, היינו זרימת זלוף bioreactor. CALU3 וMRC5 התאים היו זורעים על פיגום biphasic, ותאי ASM זורעים על פיגום מיושר, ושניהם היו בתרבית בנפרד עבור 2 ימים. שני הפיגומים אז נקנו יחד כדי ליצור מודל תלת-שכבה של הקיר בדרכי הנשימה בתוך bioreactor (איור 7). שני התאים היו perfused עם תקשורת במשך 7 ימים לפני תא אפיתל הפסגה היה התקשורת שלה הוסרה, ותאי אפיתל בתרבית בALI לעוד 7 ימים. פיגומים קבועים וגם מחולק ומוכתמים, או כל פיגומים היו immunostained עבור סמני תא ספציפי. סעיפים בתרבות תלת-השכבה הראו גרעין תא מופץ דרך כל שלוש השכבות של coculture (איור 8 ב). כאשר תאים היו immunostained עבור סמני תא ספציפי, תאי האפיתל מאוכלסים שלב nanofiber הפסגה כתא-שכבה ומחוברות ומוכתמות חיובי לcytokeratin (איור 8C), בשלב מיקרופייבר, fibroblasts מוכתם חיובי לS100A4 (איור 8D), ועל התאים מיושרים 10% ASM הפיגום מוכתמים חיובי לSM22α (8E איור), המצביעים על הישרדות טובה של כל תא מסוג בתוך מודל 3D של הקיר בדרכי הנשימה.
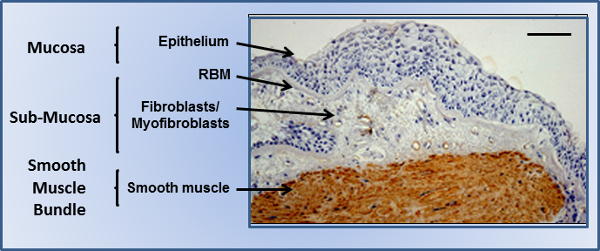
איור 1. bronchiole בדרכי הנשימה. ביופסית הסימפונות מחמורדרכי נשימה אסתמה מראה את האפיתל על הקרום במרתף רשתי (RBM), עם אזור submucosal הבסיסי מאוכלס בתאי mesenchymal, וחבילות שריר חלק מקיפות מאוכלסות בתאי שריר חלק מוכתמים עבור אלפא-אקטין שריר חלק (חום). בר סולם עולה 200 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
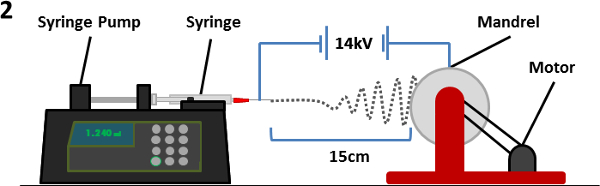
איור 2. סכמטי של ציוד electrospinning. מזרק המכיל את פתרון הפולימר / ממס (עם מחט מחוברת) ממוקם על משאבת מזרק מול mandrel. פוטנציאל חשמלי שנוצר בין סיבי המחט וmandrel גורם להיפלט מקצה המחט והופקדו על mandrel מסתובב. כסיבים עוברים דרך האטמוספרה,מתאדה הממס גורם בתצהיר של סיבים פולימריים על mandrel. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
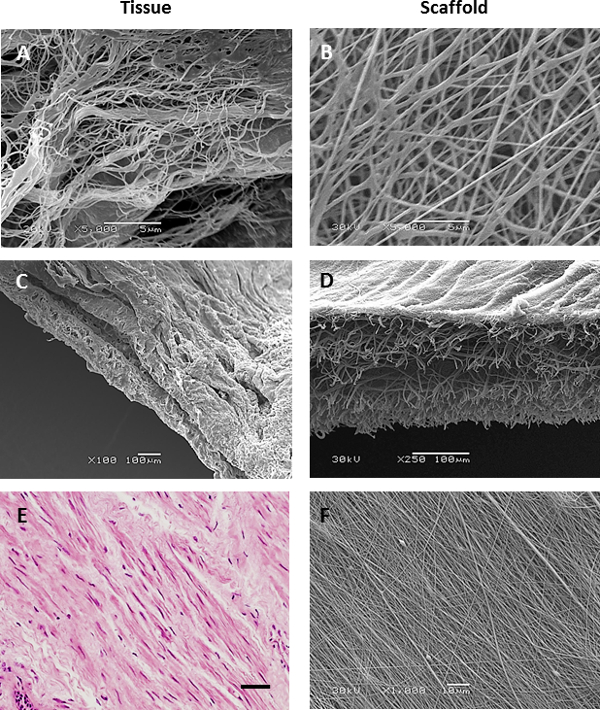
השוואת איור 3. פיגומי electrospun לECM דרכי הנשימה ילידים. תמונות מיקרוסקופ אלקטרונים סורק של קרום decellularized מרתף (), דרכי הנשימה decellularized bronchiole חתך (C) וסעיף היסטולוגית של צרור שריר חלק בדרכי נשימה (מוכתמת בhaematoxylin וeosin, בקנה מידה בר 40 מיקרומטר) (ה) בהשוואה לnanofiber (ב) biphasic (ד) ו- (פיגומי PET מיושרים F). אנא לחץ כאן לצפייהגרסה גדולה יותר של דמות זו.
פרמטרי 1. שולחן המשמשים לelectrospinning מיקרופייבר, nanofiber ומיושר פיגומים באופן אישי ועבור פיגום biphasic.

איור 4. שינוי בריכוזי PET משפיע מאפייני סיבים. תמונות מיקרוסקופ אלקטרונים סורק של פיגומי electrospun הסתחררו מ -6%, 8%, 10% (AC), 25%, 30% ו -35% (EG) פתרונות PET (WT / כרך) . כמו כן המוצגים פיגומים מיושרים מיוצרים מ -8% (ד) ו- 30% פתרונות PET (H) WT / כרך. הספירה צילמה בהגדלה 5,000X, EH צילם בהגדלה 1,000X. אנא לחץ כאן לצפייה גדולה יותרגרסה של נתון זה.
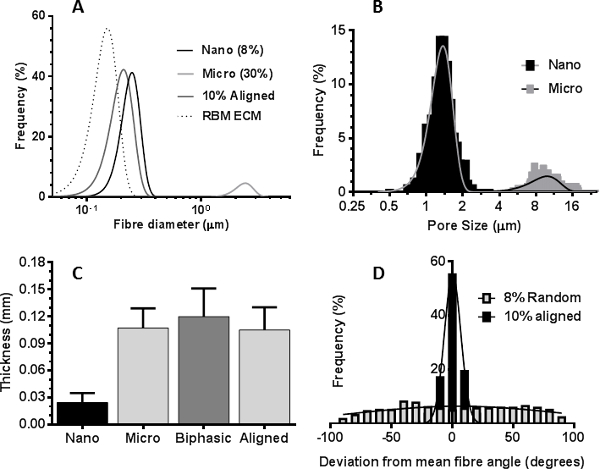
5. מאפייני דמותו של פיגומי PET electrospun. עקומות הפצה () מראה הפצת קוטר סיבים ממטריצת הקרום במרתף רשתי תאית (RBM ECM), פיגומי ננו ומיקרו-סיבים מיושרים באופן אקראי, ופיגום nanofiber מיושר. (ב) היסטוגרמה המציגה את התפלגות הגודל נקבובית יחסית בפיגומי ננו ומיקרו-סיבים. העובי הממוצע של nanofiber, מיקרופייבר, פיגומי biphasic ומיושרים (ג) (ממוצע ± סטיית תקן, n = 6). (ד) עלילת היסטוגרמה מראה את הסטייה מכיוון סיבים ממוצע בפיגומי nanofiber אקראיים או מיושרים ניתוח פיגום סיבים בוצע באמצעות תוכנת ImageJ. Pלחכור לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 6. התרבות של סוגי התאים הבודדים על הפיגומים הבודדים. () Assay תוצאות כדאיות תא alamarBlue לתאי ASM על פיגומים מיושרים, תאי CALU3 על פיגומי nanofiber וMRC5 תאים על פיגומי מיקרופייבר (ממוצע ± SEM, n = 3 20). תמונות מיקרוסקופ אלקטרונים סורק של nanofiber, מיקרופייבר ופיגומי סיבים מיושרים (B, C ו- D בהתאמה) ותמונות immunofluorescent של תאי CALU3 המוכתמים עבור E-cadherin (אדום), MRC5 תאים המוכתמים לvinculin (אדום) ותאי ASM מוכתמים לSM22α (אדום) כל על הפיגום מיוחד שלהם (E, F ו- G בהתאמה). Hoechst שימש להכתים גרעינים (כחול), סרגל קנה מידה מציין 40 &# 181;. מ 'אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
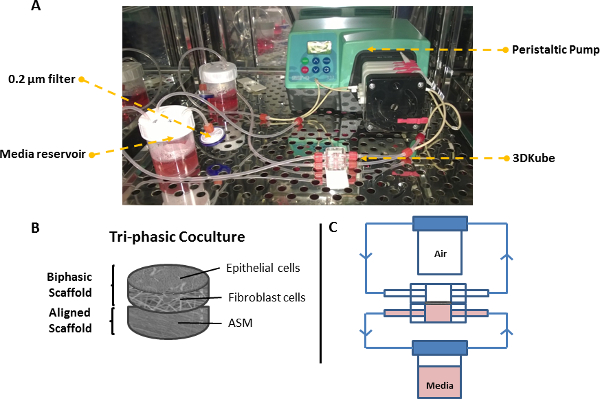
מערכת איור 7. זלוף לקיר בדרכי הנשימה מודל תלת-שכבה. תצלום () של כלי bioreactor מחובר למשאבת peristaltic ומאגרי מדיה 2x. סכמטי (ב) לפיגומים תלת-שכבתי. (ג) סכמטי של שני מעגלי bioreactor כאשר המודל של דרכי הנשימה מתקיים בממשק האוויר נוזלי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
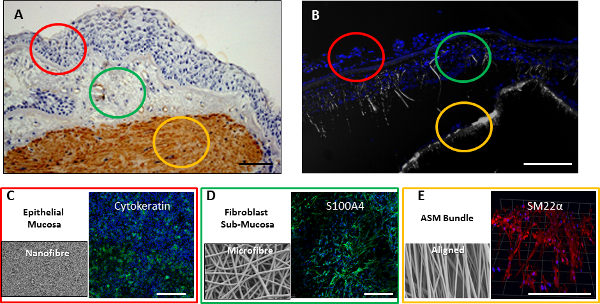
איור 8. 3 מלאים D קיר בדרכי הנשימה מודל. () ביופסית הסימפונות של קיר בדרכי נשימה עם השכבה הרירית המסומנת באדום, אזור submucosal מסומן בירוק, וצרור שריר החלק מסומן בזהב. סעיף (ב) דרך קיר בדרכי נשימה שכבתי תלת מורכב מפיגומי biphasic ומיושרים מאוכלסים באפיתל, פיברובלסטים ותאי שריר חלק קבועים לאחר coculture 2 שבועות. גרעין תא היו מוכתם בDAPI (כחול) עם החזרה פיגום (אפור) צילמה במקביל. פיגומים גם היו קבועים immunostained עבור סמנים ספציפיים תא לאחר 2 שבועות, עם תאי CALU3 המוכתמים עבור cytokeratin (ירוק) (ג), MRC5 תאים המוכתמים לS100A4 (ירוק) (ד), ותאי שריר חלק מוכתמים לSM22α (אדום) ( E). בר סולם עולה 200 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
התחת = "jove_content" FO: לשמור-together.within עמודים = "תמיד"> 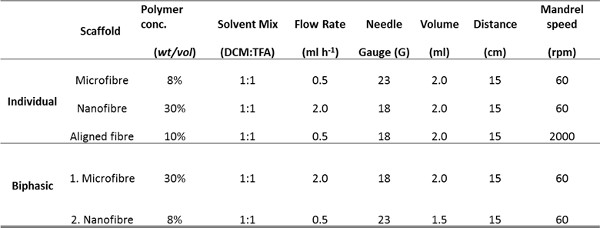
טבלת 1.
Discussion
יכולת electrospin סיבים פולימריים עם תכונות מבניות דומות לECM הטבעי הובילה לפולימרים רבים טבעיים או סינטטיים, או תערובות פולימר להיות electrospun לשחזר סביבות אלה,. מניפולציה של הפרמטרים התהליך (כולל בחירת פולימר, ריכוז פולימר,, מרחק קצה מחט ממס וטמפרטורה) יכול כל מאפייני פיגום ההשפעה; עם זאת כמה פרמטרים יכולים להיות השפעה גדולה יותר על מאפייני פיגום מאחרים 25,. כאשר שינוי קוטר סיבי PET, מצאנו את הפרמטרים המרכזיים להיות הריכוז של הפולימרים המשמש, בקצב שבי פתרון הפולימר היה electrospun, והקוטר של המחט. כאשר electrospinning סיבים מיושרים הפרמטרים המרכזיים הם שיטת הגבייה בשימוש (mandrel מסתובב), והמהירות שבה מסתובב mandrel. באמצעות הפחתת מהירות mandrel 60 סל"ד, שמצאנו את הפיגומים מיושרים באופן אקראי מיוצרים הראו חד פיגום גדול יותרformity לעומת electrospinning על צלחת שטוחה אספן.
המאפיינים של רקמה בדרכי הנשימה decellularized נותחו לספק הדרכה לטופוגרפיות פיגום השונות שפותחו לתרבות של כל תא מסוג של דרכי הנשימה. nanofibers electrospun הוא פיגום אטרקטיבי לשכפל מבני קרום במרתף בשל הגודל הקטן הנקבובית אך הנקבוביות כולל גבוהה המאפשר לדיפוזיה המטבוליט מוגברת תוך הגבלת תנועה סלולרית. 9 בעוד אופטימיזציה של פרמטרי electrospinning, טווח ריכוזים וספיקות PET נבדק. הסיבים הדקים ביותר הושגו באמצעות פתרון WT / PET כרך 6%, ששמש בעבר על ידי קבוצות אחרות. עם זאת, רמות גבוהות של חרוזים, וחוסר האחידות היו בעיות קבועות. ניסיונות ראשוניים להסיר את האגלים כללו הוספת שטח קטיוני, ברומיד cetyltrimethylammonium (CTAB), לפתרון להוריד את מתח הפנים, ובדיקת מקורות שוניםשל PET. התוספת של שטח הפחיתה את כמות חרוזים, אך לא באופן מלא. לאחר שניסיתי מספר המקורות מסחריים של כדורי PET, בקבוק משקה כיתה מזון לחיות מחמד היה בשימוש, על ידי חיתוך את בקבוקי משקאות והמסה אלה בDCM: פתרון ממס TFA. שימוש זה כמקור PET הביא לגידול באחידות סיבים וירידה באגלי סיבים. על ידי הגדלת ריכוז הפתרון מעט ל -8% WT / כרך וצמצום קוטר המחט (18G ל23G) שהפקנו באופן עקבי nanofibers פגם חופשי בקוטר סיבים של כ 250 ננומטר. פיגומי nanofiber electrospun יכולים להיות אלקטרוסטטי מאוד על גבייה מmandrel ביצוע טיפול ידני של הפיגומים קשים. זה היה שיפור על ידי אחסון הפיגומים בנייר אלומיניום אחרי ספינינג והשרייה ב- 70% IMS לפני השימוש. זה הופיע כדי לעזור להפיג את המטען אלקטרוסטטי השייר השאיר על הפיגום מתהליך electrospinning.
לספק עליוןographies דומה למייקרו-הסביבות הבודדים שנתקלה בם שלושה סוגי תאים בדרכי נשימה עיקריים בתוך הקיר בדרכי הנשימה, פרוטוקול electrospinning בסיסי הותאם לייצר שלושה פיגומים ייחודיים לסוגי התאים: על ידי electrospinning פתרון PET הריכוז נמוך לאט, nanofibers מיושר באופן אקראי נוצרו, על שתאי האפיתל היו זרע (מחקה את RBM). על ידי electrospinning פתרון PET ריכוז גבוה יותר בקצב מהיר יותר, microfibers מיושר באופן אקראי נוצרו (הפקת פיגום נקבובי יותר), שאליו fibroblasts היה זרע (מחקה את האזור תת-ריריים מייד מתחת לRBM). על ידי electrospinning פתרון PET הריכוז נמוך על מהירות גבוהה מסתובבת nanofibers mandrel מיושר הופקו, על שתאי שריר חלק חוקיים בכיוון הסיבים, הפקה מיושרות גיליונות של תאים.
קטרי סיבים הגדילו את יתרון לגודל נקבובית מוגבר, המאפשרים penetratio תא גדול יותרn לפיגומים וכך לסייע ביצירת סביבת 3D אמיתית,. פיגומי מיקרופייבר הועסקו לתרבות של fibroblasts במחקר על מנת להבטיח שהתאים התגוררו במטוסים מרובים בתוך הפיגום. על ידי הגדלת ריכוז PET 30% WT / כרך, סיבי PET עם קוטר ממוצע של 2.5 מיקרומטר הופקו. סיבים בקוטר גדול יותר (4 ≈ מיקרומטר) הופקו באמצעות 35% פתרון PET WT / כרך, אבל אחידות עובי הפיגום אבדה, ושונות גבוהות בין סיבים הבודדים היו ברורות. נקבוביות בפיגום מיקרופייבר היו מעל 7 פעמים יותר מאלה שנמדדו בפיגומי nanofiber (10.45 מיקרומטר לעומת 1.43 מיקרומטר בהתאמה), אך זריעה עדיין סטטי של תאים סיפקה חדירה סלולרית מוגבלת. זה השתפר באופן דינמי זריעת התאים באמצעות מיקסר מסלולית, שיטה הוכיחה את היעילות בעבר.
פיגומי nanofiber מיושרים מאוד נוצרו על ידי electrospinning 10%WT / פתרון PET כרך על mandrel מסתובב בסל"ד 2000 (440 מ '≈ · דקות -1). ריכוז PET הוגדל מ 8% כדי למנוע מורפולוגיה כמו גל-סדירה שסיבים הוצגו בריכוזים נמוכים יותר. למרות העלייה בריכוז, יישור הסיבים הקטין את הקוטר הממוצע סיבים (ננומטר לעומת 255 216 ננומטר, מיושר מול אקראי). המהירות הגבוהה של mandrel ציור הסיבים החוצה לפני שהם התייבשו עלולה לגרום לאפקט הזה. היישור של הסיבים השפיע על היישור של תאי ASM, ויש גם השפעות פיסיולוגיות אחרות על תאי ASM אשר מתאפיינים במקום אחר 21.
המגבלה העיקרית של פרוטוקול זה היא חוסר יכולת תאי חיים תמונה / בפיגומים עושים תא-עיקול או בידול ראשוני על פרק זמן ממושך ניתן לקבוע מבלי להקריב דגימות. משמעות הדבר הכי אופטימיזציה מתרחשת לאחר תקופת התרבות, כלומר, לתקןing דגימות ולאחר מכן מדידה אם תרבית תאים הייתה מוצלחת לאחר שלא במהלך תרבית תאים. התבוננות שינוי צבע בפיגומים מודגרות בalamarBlue (כחול לורוד) מצביעה על תאים בהווה ובבת קיימא, אבל לא אידיאלי. פולימרים שקופים יותר electrospinning כגון ג'לטין יכולים לסייע בחזותיים תאים על הפיגומים. Electrospinning של פיגום nanofibrous בתוך המודל שלנו אפשר את השכפול של RBM בדרכי הנשימה, באופן דומה המורכב מnanofibers הצפוף שבו תאי האפיתל מתגוררים. זה בעבר הוכח כי תאים מבניים לא יכולים להעביר דרך פיגום nanofiber 22, למרות שתאי מערכת חיסון יכולים (מידע לא מוצג). בעוד יתרון עבור culturing של תא-סוגים ספציפיים על משטח 3D (כגון אפיתל ותאי האנדותל), מניעת נדידת תאים מבנית זו דרך nanofibers עלולה להיות מזיקים לתרבית של סוגי תאים אחרים. כשריר חלק אינו יכול להעביר דרך הפיגום nanofiber דואר מיושר התאספנו coculture תלת-שכבתי עם שריר החלק ושכבות פיברובלסטים זה מול זה (בניגוד לפיגום מיושר המפריד בין שני סוגי התאים). אמנם זה מאפשר לתאים להיות הפרד קרוב, המחקר הנוכחי לא יכול להסיק אם סוג אחד של תאים (או פיברובלסטים או שריר חלק) היה לעקוף את כל השכבה על פני תקופה ממושכת יותר תרבות. למרות מגבלות אלה, מודל תלת-שכבת קיימא של הקיר בדרכי הנשימה פותח המספקת פלטפורמה חלופית לחקור את יחסי הגומלין בין תאים אלו סוגים מרובים. לאחרונה פורסם מחקר תלת-שכבתי דומה בי fibroblasts היו מוטבע בתוך קולגן גלילי אני הידרוג'ל עם שריר חלק זורעים על פני השטח החיצוניים ותאי האפיתל בשטח luminal 17. היציבות המכנית של פיגומי electrospun פיתחו כאן יאפשר צינור דומה בונה להיווצר, ונשארה resea נוכחיRCH שואף בקבוצה שלנו. בעוד המחקר התמקד בדרכי הנשימה, כמה איברים בגוף הנתח יחידה מבנית ברירית בסיסית זה, ובאמצעות שינוי הדיירים מודגשים במחקר זה, פלטפורמות דומות ניתן לפתח עבור רקמות המכילות יחידת קרום במרתף כוללים כלי דם, שלפוחית השתן ו הקרנית, שבו דגמים רב שכבתיים המבוססים קולגן להיות מועסקים.
Disclosures
The Authors have nothing to disclose.
Acknowledgements
The research leading to these AirPROM results has received funding from the European Union under grant agreement n° 270194.This work was also funded by the National Centre for the Replacement, Refinement, and Reduction of Animals in Research (NC3Rs), and the Engineering and Physical Research Centre (EPSRC) Doctoral Training Centre (DTC) in Regenerative Medicine, U.K.
Materials
| Name | Company | Catalog Number | Comments |
| Polyethylene terephthalate (PET) | Lucozade (GSK) bottles | N/A | Source of PET for electrospinning. Cut into small pieces and weigh out as necessary |
| Dichloromethane (DCM) | Solvent for PET | ||
| Trifluoroacetic acid (TFA) | Sigma | Solvent for PET | |
| Rotating Mandrel | Built in house | Used to collect electrospun fibres. By rotating at different speeds, fibres can be aligned or randomly oriented | |
| Syringe Pump | Harvard apparatus | used in the electrospinning process | |
| DMEM-F12 | Gibco | Culture medium for CALU3 cells | |
| DMEM | Gibco | Culture medium for HASM cells | |
| MEM | Gibco | Culture medium for MRC5 cells | |
| Antibiotic/ antimycotic solution | Gibco | Media supplement | |
| FCS | Gibco | Media supplement | |
| Orbital mixer (Orbital shake 503) | Stuart Scientific | For dynamic seeding of cells onto microfibre scaffolds | |
| Peristaltic Pump | Watson Marlow | For providing media flow through bioreactor | |
| 3DKube | Kiyatec | Bioreactor for 3D cell culture |
References
- Macchiarini, P., et al. Clinical transplantation of a tissue-engineered airway. Lancet. 372 (9655), 2023-2030 (2008).
- Song, J., Guyette, J., Gilpin, S. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature medicine. 19 (5), 646-651 (2013).
- Wenzel, S., Holgate, S. The mouse trap: it still yields few answers in asthma. American journal of respiratory and critical. 174 (11), 1171-1173 (2006).
- Zosky, G. R., Sly, P. D. Animal models of asthma. Clinical and experimental allergy journal of the British Society for Allergy and Clinical Immunology. 37 (7), 973-988 (2007).
- Bates, J. H. T., Rincon, M., Irvin, C. G. Animal models of asthma. American journal of physiology. Lung cellular and molecular physiology. 297 (3), L401-L410 (2009).
- Johansson, F., Carlberg, P., Danielsen, N., Montelius, L., Kanje, M. Axonal outgrowth on nano-imprinted patterns. Biomaterials. 27 (8), 1251-1258 (2006).
- Paik, I., et al. Rapid micropatterning of cell lines and human pluripotent stem cells on elastomeric membranes. Biotechnology and bioengineering. 109 (10), 2630-2641 (2012).
- Williams, C., et al. Aligned Cell Sheets Grown on Thermo-Responsive Substrates with Microcontact Printed Protein Patterns. Advanced Materials. 21 (21), 2161-2164 (2009).
- Schindler, M., et al. A synthetic nanofibrillar matrix promotes in vivo-like organization and morphogenesis for cells in culture. Biomaterials. 26 (28), 5624-5631 (2005).
- Schindler, M., et al. Living in Three Dimensions. Cell Biochemistry and Biophysics. 45 (14), 215-227 (2006).
- Ahmed, I., et al. Morphology, cytoskeletal organization, and myosin dynamics of mouse embryonic fibroblasts cultured on nanofibrillar surfaces. Molecular and Cellular Biochemistry. 301 (1-2), 241-249 (2007).
- Flemming, R., Murphy, C., Abrams, G. Effects of synthetic micro-and nano-structured surfaces on cell behavior. Biomaterials. 20, 573-588 (1999).
- Sun, T., et al. Development of a 3D Cell Culture System for Investigating Cell Interactions With Electrospun Fibers. Biotechnol. Bioeng. 97 (5), 1318-1328 (2007).
- Kim, D. -. H., Provenzano, P. P., Smith, C. L., Levchenko, A. Matrix nanotopography as a regulator of cell function. The Journal of cell biology. 197 (3), 351-360 (2012).
- Jeffery, P. K. Remodeling in Asthma and Chronic Obstructive Lung Disease. American Journal of Respiratory and Critical Care Medicine. 164 (10 pt 2), S28-S38 (2001).
- Jungebluth, P., et al. Tracheobronchial transplantation with a stem-cell-seeded bioartificial nanocomposite: a proof-of-concept study. Lancet. 378 (9808), 1997-2004 (2011).
- Miller, C., George, S., Niklason, L. Developing a tissue-engineered model of the human bronchiole. Journal of Tissue Engineering and Regenerative. (July), 619-627 (2010).
- West, A. R., et al. Development and characterization of a 3D multicell microtissue culture model of airway smooth muscle. American journal of physiology. Lung cellular and molecular physiology. 304 (1), L4-L16 (2013).
- Nesmith, A. P., Agarwal, A., McCain, M. L., Parker, K. K. Human airway musculature on a chip: an in vitro model of allergic asthmatic bronchoconstriction and bronchodilation. Lab on a chip. , (2014).
- Hadjizadeh, A., Ajji, A., Bureau, M. N. Nano/micro electro-spun polyethylene terephthalate fibrous mat preparation and characterization. Journal of the mechanical behavior of biomedical materials. 4 (3), 340-351 (2011).
- Morris, G., et al. Human airway smooth muscle maintain in situ cell orientation and phenotype when cultured on aligned electrospun scaffolds. American Journal of Physiology - Lung Cellular and Molecular Physiology. 307 (1), L38-L47 (1999).
- Morris, G. E., et al. A novel electrospun biphasic scaffold provides optimal three-dimensional topography for in vitro co-culture of airway epithelial and fibroblast cells. Biofabrication. 6 (3), 035014 (2014).
- Sell, S., et al. The Use of Natural Polymers in Tissue Engineering: A Focus on Electrospun Extracellular Matrix Analogues. Polymers. 2 (4), 522-553 (2010).
- Subbiah, T., Bhat, G. S., Tock, R. W., Parameswaran, S., Ramkumar, S. S. Electrospinning of nanofibers. Journal of Applied Polymer Science. 96 (2), 557-569 (2005).
- Dalton, P. D., et al. Electrospinning and additive manufacturing: converging technologies. Biomaterials Science. 1 (2), 171 (2013).
- Boland, E. D., Wnek, G. E., Simpson, D. G., Pawlowski, K. J., Bowlin, G. L. Tailoring tissue engineering scaffolds using electrostatic processing techniques: A study of poly(glycolic acid) electrospinning. Journal of Macromolecular Science-Pure and Applied Chemistry. 38 (12), 1231-1243 (2001).
- Stitzel, J. D., Bowlin, G. L., Mansfield, K., Wnek, G. E., Simpson, D. G. Electrospraying and electrospinning of polymers for biomedical applications. Poly(lactic-co-glycolic acid) and poly(ethylene-co-vinylacetate). Revolutionary Materials: Technology And Economics. 32, 205-211 (2000).
- Liu, W., Thomopoulos, S., Xia, Y. Electrospun nanofibers for regenerative medicine. Advanced healthcare materials. 1 (1), 10-25 (2012).
- Veleirinho, B. Solvent and concentration effects on the properties of electrospun poly (ethylene terephthalate) nanofiber mats. Journal of Polymer. , 460 (2008).
- Balguid, A., et al. Tailoring Fiber Diameter in Electrospun Poly(epsilon-Caprolactone) Scaffolds for Optimal Cellular Infiltration in Cardiovascular Tissue Engineering. Tissue Engineering Part A. 15 (2), 437-444 (2009).
- Shalumon, K. T., et al. Fabrication of three-dimensional nano, micro and micro/nano scaffolds of porous poly(lactic acid) by electrospinning and comparison of cell infiltration by Z-stacking/three-dimensional projection technique. IET nanobiotechnology / IET. 6 (1), 16-25 (2012).
- Thevenot, P., Nair, A., Dey, J., Yang, J., Tang, L. Method to Analyze Three-Dimensional Cell Distribution and Infiltration in Degradable Scaffolds. Tissue Engineering Part C-Methods. 14 (4), 319-331 (2008).
- Rose, J., et al. Gelatin-Based Materials in Ocular Tissue Engineering. Materials. 7 (4), 3106-3135 (2014).
- Liliensiek, S. J., Nealey, P., Murphy, C. J. Characterization of Endothelial Basement Membrane Nanotopography in Rhesus Macaque as a Guide for Vessel Tissue Engineering. Tissue Engineering Part A. 15 (9), (2009).
- Abrams, G. A., Murphy, C. J., Wang, Z. -. Y., Nealey, P. F., Bjorling, D. E. Ultrastructural basement membrane topography of the bladder epithelium. Urological research. 31 (5), 341-346 (2003).
- Abrams, G. A., Bentley, E., Nealey, P. F., Murphy, C. J. Electron Microscopy of the Canine Corneal Basement Membranes. Cells Tissues Organs. 170 (4), 251-257 (2002).
- Reichl, S., Bednarz, J., Muller-Goymann, C. Human corneal equivalent as cell culture model for in vitro drug permeation studies. British Journal of Ophthalmology. 88 (4), 560-565 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved