A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فك رموز والتصوير إمراض وحبال من
In This Article
Summary
Optically transparent zebrafish embryos are widely used to study and visualize in real time the interactions between pathogenic microorganisms and the innate immune cells. Micro-injection of Mycobacterium abscessus, combined with fluorescence imaging, is used to scrutinize essential pathogenic features such as cord formation in zebrafish embryos.
Abstract
Zebrafish (Danio rerio) embryos are increasingly used as an infection model to study the function of the vertebrate innate immune system in host-pathogen interactions. The ease of obtaining large numbers of embryos, their accessibility due to external development, their optical transparency as well as the availability of a wide panoply of genetic/immunological tools and transgenic reporter line collections, contribute to the versatility of this model. In this respect, the present manuscript describes the use of zebrafish as an in vivo model system to investigate the chronology of Mycobacterium abscessus infection. This human pathogen can exist either as smooth (S) or rough (R) variants, depending on cell wall composition, and their respective virulence can be imaged and compared in zebrafish embryos and larvae. Micro-injection of either S or R fluorescent variants directly in the blood circulation via the caudal vein, leads to chronic or acute/lethal infections, respectively. This biological system allows high resolution visualization and analysis of the role of mycobacterial cording in promoting abscess formation. In addition, the use of fluorescent bacteria along with transgenic zebrafish lines harbouring fluorescent macrophages produces a unique opportunity for multi-color imaging of the host-pathogen interactions. This article describes detailed protocols for the preparation of homogenous M. abscessus inoculum and for intravenous injection of zebrafish embryos for subsequent fluorescence imaging of the interaction with macrophages. These techniques open the avenue to future investigations involving mutants defective in cord formation and are dedicated to understand how this impacts on M. abscessus pathogenicity in a whole vertebrate.
Introduction
المتفطرة خراج هو الممرض الناشئة التي تسبب مجموعة واسعة من متلازمات سريرية على البشر. وتشمل هذه الالتهابات الجلدية فضلا عن الالتهابات الرئوية المزمنة، واجه معظمهم في المناعة ومرضى التليف الكيسي 1،2،3،4. M. يعتبر خراج أيضا بمثابة الرئيسية الأنواع المتفطرات سريع النمو المسؤولة عن عدوى المستشفيات وعلاجي المنشأ في البشر. وعلاوة على ذلك، أبرزت عدة تقارير حديثة إمكانية أن M. خراج يمكن أن يخترق حاجز الدم في الدماغ ويحفز الآفات الهامة في النظام العصبي المركزي (CNS) 5،6. على الرغم من كونه مزارع السريع، M. المعارض خراج أيضا العديد من الميزات المسببة للأمراض التي ترتبط تلك المتفطرة السلية، بما في ذلك القدرة على الصمت لسنوات داخل الهياكل حبيبية وتوليد الآفات الجبني في الرئتين 7. أكثر إثارة للقلق هو انخفاض صنsitivity من M. خراج للمضادات الحيوية، مما يجعل هذه الإصابات صعبة للغاية لعلاج مما يؤدي إلى معدل فشل كبير العلاجية 8،9. التهديد هاما من هذا النوع هو أساسا المقاومة الجوهرية لها للمضادات الحيوية، والتي هي مصدر قلق كبير في المؤسسات الصحية العامة 10 وموانع لزرع الرئة 11.
يعرض M. خراج ناعمة (S) أو الخام morphotypes (R) مستعمرة أن تؤدي إلى نتائج سريرية مختلفة. وعلى النقيض من سلالة S، R البكتيريا لديهم ميل لتنمو اقصاه الى اقصاه، مما أدى إلى حبل أو سلك يشبه هيكل 12،13. كشفت عدة دراسات مستقلة على أساس نماذج إما الخلوية أو الحيوان النمط الظاهري فرط الفوعة للR نمط شكلي 14،15. من الدراسات الوبائية، ومعظم الحالات الشديدة من M. الالتهابات الرئوية خراج يبدو أن تترافق مع المتغيرات R 16 والتي هي البديل الوحيد الذيفقد رأينا أن تستمر لسنوات في مضيف مصاب 3. يعتمد الفرق نمط شكلي على وجود (في S) أو الخسارة (في R) من glycopeptidolipids المرتبطة السطحية (GPL) 12. ولكن نظرا إلى القيود المتأصلة في النماذج الخلوية / الحيوانية المتوفرة حاليا تستخدم لدراسة M. عدوى خراج، معرفتنا بشأن الأحداث الفيزيولوجية المرضية للمتغيرات R أو S لا تزال غامضة. إصابة الفئران المناعية المختصة عبر الطرق الوريدية أو الهباء الجوي يؤدي إلى الاستعمار عابرة، التي تعوق استخدام الفئران لدراسة الالتهابات المستمرة وللفي الجسم الحي المخدرات اختبار الحساسية 17. لذلك، وتطوير نماذج حيوانية قابلة للتلاعب استجابة المضيف يمثل تحديا كبيرا. في هذا السياق، وضعت نماذج غير الثدييات من الإصابة مؤخرا، بما في ذلك ذبابة الفاكهة 18 التي توفر العديد من المزايا مثل التكلفة والسرعة والأخلاقي القبول سVER نموذج الفأر. كما تم استكشاف نموذج الزرد (دانيو rerio) العدوى إلى تصور، من خلال التصوير غير الغازية، والتقدم والتسلسل الزمني للM. عدوى خراج في الحيوانات الحية 19. الأهم من ذلك، تم تشكيل لإثبات المفهوم أيضا لإثبات مدى صلاحيته للفي الجسم الحي تقييم المضادات الحيوية ضد M. خراج 17،20.
الزرد وقد استخدمت على نطاق واسع خلال العقدين الماضيين لدراسة التفاعلات بين مختلف مسببات الأمراض والجهاز المناعي المضيف 21. نجاح متزايد من هذا النموذج الفقاريات بديل يعتمد على فرصا كبيرة وفريدة من نوعها أن الدافع والتحقق من صحة استخدامها من أجل فهم أفضل للعديد من الالتهابات الفيروسية والبكتيرية 19،22،23،24،25،26،27،28،29. خلافا لمعظم النماذج الحيوانية الأخرى والأجنة الزرد شفافة بصريا، مما يسمح للغير الغازية مضان التصوير 30. هذا HAقاد الى دراسة M. إصابة خراج الأجنة الزرد مع تفاصيل لم يسبق لها مثيل، وبلغت ذروتها مع وصف حبال خارج الخلية، التي تمثل مثالا على اللدونة المورفولوجية البكتيرية. يمثل حبال آلية جديدة لتخريب الجهاز المناعي وآلية رئيسية تعزيز التسبب في M. الحاد عدوى خراج 19.
ويصف هذا التقرير أدوات وأساليب جديدة باستخدام الجنين الزرد إلى فك الصفات الفيزيولوجية المرضية من M. خراج العدوى ودراسة التفاعلات الحميمة بين العصيات ونظام المناعة الفطري. أولا، بروتوكول microinjection مفصل يتضمن تجهيز اللقاح البكتيري، وإعداد الجنين، والإصابة في حد ذاتها، ويرد. طرق تكييفها خصيصا لتقييم M. الفوعة خراج عن طريق قياس معايير مختلفة، مثل بقاء المضيفة وعبء البكتيرية، ترد. وقد تم التركيز على كيفيةلمراقبة، وعلى مستوى الزمانية المكانية، ومصير وتطور العدوى واستجابة المضيف المناعية للM. خراج باستخدام المجهر الفيديو. وعلاوة على ذلك، للتحقيق في مساهمة ودور الضامة خلال M. خراج العدوى، وطرق لتوليد الضامة المنضب الأجنة (باستخدام النهج إما وراثيا أو بناء كيميائيا) موصوفة. وأخيرا، وبروتوكولات لتصور التفاعلات محددة موثقة الضامة أو العدلات باستخدام الأجنة ثابتة أو المعيشة.
والهدف من هذا التقرير هو تحفيز مزيد من الدراسات لتسليط الضوء من جديد إلى M. آليات الفوعة خراج وبخاصة دور حبال في إنشاء عملية العدوى الحادة وغير المنضبط.
Protocol
الإجراءات التجريبية الزرد يجب أن تتوافق مع الأنظمة المؤسسية والحكومية ذات الصلة. لهذه الدراسة، أجريت التجارب الزرد في مونبلييه جامعة، وفقا للمبادئ التوجيهية الاتحاد الأوروبي للتعامل مع الحيوانات المختبرية (http://ec.europa.eu/environment/chemicals/lab_animals/home_en.htm) والمعتمدة في إطار المرجعية CEEA-LR-13007.
1. إعداد الكواشف والمعدات Microinjection
- إعداد أسماك المياه عن طريق إذابة 0.06 ز فورية ملح البحر المحيط في 1 لتر ماء مقطر 31، ثم تعقيم لتعقيم (120 درجة مئوية لمدة 20 دقيقة) وتخزينها في 28.5 درجة مئوية لمدة تصل إلى 1 في الشهر.
- إعداد الميثيلين الأزرق حل عن طريق إذابة 1 غرام من الميثيلين الأزرق في 1 لتر ماء مقطر. إضافة 300 ميكرولتر من محلول أزرق الميثيلين في 1 لتر ماء السمك للحصول على أسماك المياه الزرقاء، ثم تعقيم لتعقيم وتخزينها في 28.5 درجة مئوية لمدة تصل إلى 1 في الشهر.
ملاحظة: additiعلى من الميثيلين الأزرق في أسماك المياه يمنع نمو العفن. - إعداد الفوسفات مخزنة المالحة (PBS)
- إعداد 10 X PBS حل الأسهم عن طريق إذابة 5.696 ز نا 2 هبو 4، 680 ملغ KH 2 PO 4، 969 ملغ بوكل و78.894 جم كلوريد الصوديوم في 1 لتر ماء مقطر وضبط درجة الحموضة إلى 7.0 مع حمض الهيدروكلوريك. للحصول على 1 X PBS، وتمييع 100 مل من محلول 10 X PBS في 900 مل من الماء المقطر والأوتوكلاف خلال 20 دقيقة في 120 درجة مئوية لتعقيم.
- إضافة 0.05٪ توين 80 للحصول على 1 X PBST وتخزينها في RT لمدة تصل إلى 1 سنة.
- إعداد الأوليك حمض سكر العنب الكاتلاز (OADC) تخصيب عن طريق إذابة 8.5 غرام كلوريد الصوديوم، و 50 غراما مصل بقري الزلال، 20 ز D-الجلوكوز، 40 ملغ الكاتلاز من الكبد البقري و 0.5 غرام من حمض الأوليك في 1 لتر ماء مقطر ثم تصفية تعقيم الحل و تخزينه في 4 درجات مئوية لمدة تصل إلى 6 أشهر.
- إعداد 100 مل من حمض methanesulfonic إيثيل 3-أمينوبنزوات (تريكين) حل سهم، عن طريق إذابة 400 ملغ tricaiمسحوق ني في 97.9 مل من الماء المقطر. إضافة 2.1 مل من 1 M تريس (الرقم الهيدروجيني 9) لضبط درجة الحموضة في 7.0 و تخزين الحل في -20 ° C.
- إعداد إبر الحقن microcapillary عن طريق سحب الشعيرات الدموية الزجاج البورسليكات (1MM OD X 0،78 ملم ID) باستخدام جهاز مجتذب micropipette مع الإعدادات التالية: ضغط الهواء 650؛ حرارة 999؛ سحب 50؛ سرعة 80؛ الساعة 200.
- يعد حل أجار 1.5٪ في أسماك المياه الزرقاء وتصب 25 مل من أجار ذابت في 100 ملم أطباق بتري. في الجزء العلوي من آغار ذاب، ضع قوالب محلية الصنع من أجل بصمة قنوات محددة. وتستخدم "V" قنوات على شكل لالأجنة الموقف في حين ان "U" على شكل تستخدم لبيض (الشكل 1) 31. مرة واحدة عزز، إزالة بعناية بصمة.
ملاحظة: تغطية أجار مع أسماك المياه الزرقاء لتجنب الجفاف وتخزينها في 4 درجة مئوية لمدة تصل إلى 2 أشهر.
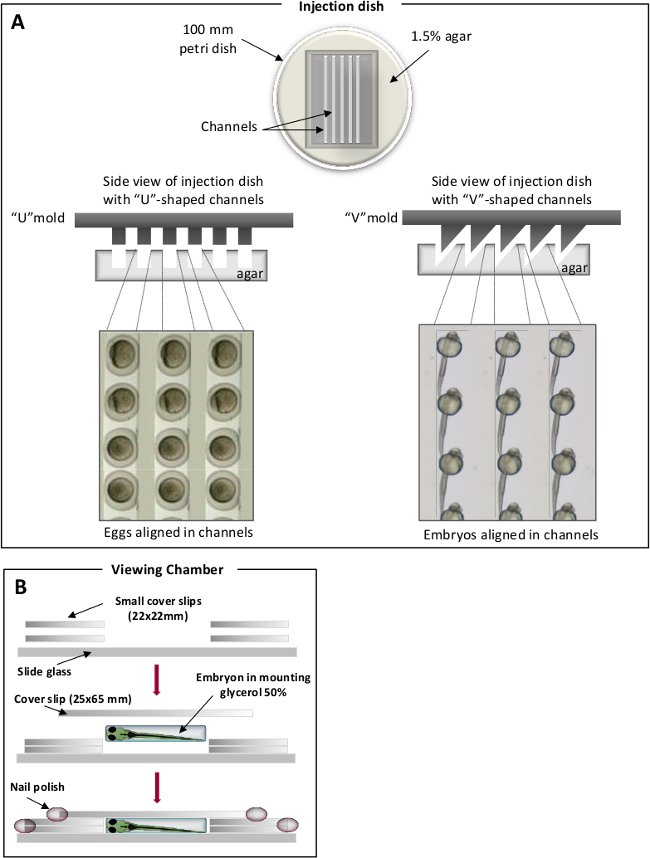
الشكل 1. غرف تحديد المواقع لحقن الزرد. (A) قنوات على شكل حرف U لبيض (اللوحة اليسرى) وقنوات على شكل حرف V لأجنة (اللوحة اليمنى). البيض الزرد / وضعت الأجنة في القنوات ومحاذاة على نفس المحور. (B) عرض غرف للمراقبة مجهرية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. إعداد وتخزين وM. خراج اللقاح
- M. ظروف النمو خراج
- لوحة من M. خراج من -80 ° C الأسهم الجلسرين على لأجار ميدلبروك 7H10 تحتوي على 10٪ من OADC و 0.5٪ الجلسرين (7H10 OADC) وتستكمل مع المضادات الحيوية المناسبة تبعا للعلامة المقاومة التي تحملها ناقلات ترميز البروتين الفلوري. احتضان لوحاتفي 30 درجة مئوية لمدة 4-5 أيام.
- التقاط مستعمرة المتفطرات مضان إيجابي وتلقيح 1 مل ميدلبروك 7H9 مرق تستكمل مع OADC، 0.2٪ الجلسرين، 0.05٪ توين 80 (7H9 OADC / T) مع المضادات الحيوية المطلوبة في 15 مل العقيمة أنبوب من البلاستيك. احتضان عند 30 درجة مئوية لمدة 1 أسبوع دون أن تهتز.
ملاحظة: توين 80 يقيد تراكمها وتجمع البكتيريا. - Resuspend وقبل الثقافة التي تم الحصول عليها في 2.1.2 في 50 مل ميدلبروك 7H9 OADC / T في 150 سم 2 القوارير زراعة الأنسجة إلى النهائي 0.1 OD 600 (المقابلة إلى حوالي 5.10 7 البكتيريا / مل)، واحتضان مرة أخرى في 30 درجة مئوية لمدة 4 أيام للحصول على ثقافة أضعافا مضاعفة النمو (OD 600 = 0،6-0،8).
ملاحظة: للحد من التثاقل، وخاصة من البديل الخام، ويجب أن لا تتجاوز حضانة 5 أيام. كلا الخيارين ناعمة وخشنة عرض معدل نمو مماثل.
- إعداد M. قائح خراج60؛
ملاحظة: نظرا لنزوع عال من الخام M. خراج لتشكيل مجاميع كبيرة، وإنتاج الحبال، ويقتضي الأمر علاجا محددا لتوليد قائح متجانسة وتسيطر الكمية قبل إبر دقيقة جدا في الأجنة. يتم تطبيق هذا العلاج أيضا لضمان سلاسة البكتيريا التي تنتج المجاميع، وإن كان بدرجة أقل من سلالة الخام.- حصاد الثقافات أضعافا مضاعفة النمو من 150 سم 2 القوارير زراعة الأنسجة بواسطة الطرد المركزي عند 4، 000 x ج لمدة 15 دقيقة في RT في أنبوب بلاستيكي 50 مل العقيمة و resuspend بيليه الجرثومي في 1 مل 7H9 OADC / T. قسامة 200 ميكرولتر من تعليق البكتيرية إلى 1.5 مل أنابيب microcentrifuge.
ملاحظة: العمل مع وحدات التخزين الصغيرة في 1 مل الحقن من الضروري الحصول على تعليق متجانسة إلى حد كبير. - تجانس تعليق البكتيرية بإبرة 26-G (15 صعودا وهبوطا متواليات)، يصوتن ثلاث مرات لمدة 10 ثانية (مع 10 فواصل ثانية بين كل صوتنة حد ذاتهاquence) باستخدام sonicator بالحمام المائي. إضافة 1 مل من 7H9 OADC / T ودوامة لفترة وجيزة. الطرد المركزي 3 دقيقة في 100 ز س.
- جمع بعناية التي تحتوي على المتفطرات supernatants لتجنب كتل وتجميع تعليق متجانسة في 50 مل العقيمة أنبوب من البلاستيك.
- تحقق بصريا عن وجود المجاميع البكتيرية المتبقية في نهاية المطاف.
ملاحظة: إذا المجاميع لا تزال موجودة، انتقل إلى خطوة إضافية الطرد المركزي في 100 x ج لمدة 2 دقيقة، وجمع طاف. - الطرد المركزي تعليق في 4000 x ج لمدة 5 دقائق، resuspend وبيليه في 200 ميكرولتر 7H9 OADC / T، والشروع في الحقن.
- تقييم تركيز بكتيريا النهائي من الطلاء التخفيفات التسلسلية (في 1 × PBST) على 7H10 OADC أجار والفرز مستعمرة (كفو) بعد 4 أيام الحضانة عند 30 درجة مئوية. CFUs ينبغي أن تحدد لكل دفعة جديدة.
- إعداد الأسهم قائح المجمدة عن طريق تخزين 5 مكل في -80 & #176؛ C.
ملاحظة: تقييم CFU من -80 ° C قسامات المجمدة هو سابق قبل تحديد العدد الدقيق للبكتيريا كما التجميد / الذوبان قد يؤثر على قابلية البكتيرية من اللقاح. هذه قائح المجمدة جاهزة لاستخدامها في حقن لاحقة. وبما أن جميع قسامات تحتوي على نفس العدد من كفو، فهي تسمح حقن البكتيريا بطريقة استنساخه من تجربة واحدة إلى أخرى.
- حصاد الثقافات أضعافا مضاعفة النمو من 150 سم 2 القوارير زراعة الأنسجة بواسطة الطرد المركزي عند 4، 000 x ج لمدة 15 دقيقة في RT في أنبوب بلاستيكي 50 مل العقيمة و resuspend بيليه الجرثومي في 1 مل 7H9 OADC / T. قسامة 200 ميكرولتر من تعليق البكتيرية إلى 1.5 مل أنابيب microcentrifuge.
- مراقبة الجودة اللقاح
ملاحظة: تلوين تسيل-نلسن (محدد لالمتفطرات) يمكن استخدامها لمقارنة جودة تعليق البكتيرية قبل وبعد الإجراءات التجانس هو موضح في 2.2.- بقعة وانتشرت قطرة واحدة من تعليق البكتيرية المتجانس على شريحة زجاجية واتركه حتى يجف تماما، إصلاح تشويه لمدة 30 دقيقة على الأقل على طبق ساخن لتعيين 65-70 درجة مئوية وصمة عار باستخدام بروتوكول تلطيخ تسيل-نلسن .
- مراقبة تشويه البكتيرية مع المجهر يستخدم 100الهدف X ومقارنتها مع مسحة من تعليق غير المجهزة البكتيري (الشكل 2).
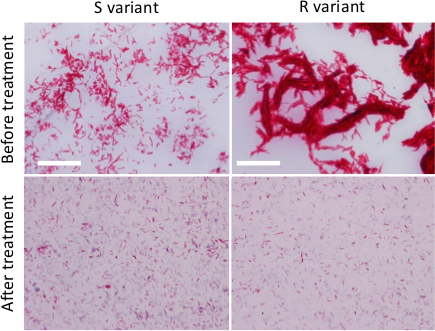
الشكل 2. إعداد فرقت M. قائح خراج. تلوين تسيل-نلسن من R أو S المتغيرات نمت على مرق المتوسطة قبل أي علاج (لوحات العليا) أو بعد العلاج (لوحات أقل) للحد من حجم وعدد من المجاميع المتفطرات (خطوات متتالية من غسول، صوتنة والصفق) . وقد لوحظت البكتيريا باستخدام المجهر مع 100 X النفط 1.4 الهدف NA APO). أشرطة النطاق: 20 ميكرون الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
3. إعداد الزرد الأجنة
- وضع البيض وجمع البيض الزرد
- قبل يوم واحد الصورةرهن، وتولد الزرد الكبار من خلال وضع 2 ذكور و 1 أنثى (عادة نسبة 2: 1 يسمح معدل الإخصاب الأمثل) في غرفة تربية، ويتكون من حوض للأسماك منفصل مع مجموعة سلة البيض 31.
ملاحظة: يتم استخدام سلال جمع البيض لحماية البيض من اكلتها من قبل الوالدين وتسهيل حصاد البيض. - في 1 HPF والبيض الحصاد والأجنة فقط وضعت بشكل صحيح في طبق بيتري 100 ملم مليئة 25 مل الأزرق أسماك المياه (بحد أقصى 100 الأجنة في الطبق) والاحتفاظ بها في 28.5 ° C. يتم تجاهل البيض غير المخصب.
- قبل يوم واحد الصورةرهن، وتولد الزرد الكبار من خلال وضع 2 ذكور و 1 أنثى (عادة نسبة 2: 1 يسمح معدل الإخصاب الأمثل) في غرفة تربية، ويتكون من حوض للأسماك منفصل مع مجموعة سلة البيض 31.
- إعداد الأجنة الزرد لحقن
- في حوالي 24 ساعة بعد الإخصاب (HPF)، dechorionate الأجنة مع ملاقط غرامة في طبق بيتري 100 ملم والاحتفاظ بها في 28.5 ° C.
- جمع 30-48 الأجنة HPF باستخدام ماصة ونقلها إلى "V" غرفة المواقع على شكل مليئة 25 مل من الماء السمك الذي يحتوي على 270 ملغ / L تريكين.وضع الأجنة بشكل صحيح في القنوات باستخدام أداة microloader طرف محلية الصنع (قص محلية الصنع محمل طرف الصغير) الأمثل للتلاعب الصغير أسهل.
ملاحظة: توجيه الجانب الظهري أسفل لحقن وريدية في الوريد الذيلية أو الجانب الظهري صعودا لحقن العضلات الذيل.
4. مايكرو حقن الداخلي
ملاحظة: الإجراء حقن الجزئي لM. خراج مشابه لتلك التي سبق وصفها لM. marinum الحقن 32. لتقييم التسلسل الزمني للM. عدوى خراج (البقاء على قيد الحياة، الحمل البكتيري، الحركي وخصائص العدوى)، ويفضل الحقن في الوريد الذيلية من 30 HPF الأجنة. لتصور تجنيد الخلايا المناعية، وتتم الحقن في مواقع محلية مثل في العضلات الذيل في 48 HPF الجنين.
- تمييع قيحة الفطرية في 1 X PBST (اعتمادا على عدد من كفو لأن تدار على النحو المحدد في الخطوة 2.2.6)، التي تحتوي على الفينول الأحمر 10٪ لتحقق حقن السليم.
- تحميل إبرة حقن microcapillary مع 5-10 ميكرولتر من اللقاح البكتيري باستخدام طرف microloader، ربط الإبرة microinjection في حامل micromanipulator ثلاثي الأبعاد المتصلة حاقن وقطع رأس إبرة مع ملاقط غرامة للحصول على فتح قطرها من 5-10 ميكرون.
- معايرة حجم الحقن عن طريق ضبط ضغط microinjection (20-50 باسكال) ومرة (0.2 ثانية).
ملاحظة: يتم معايرة حجم الحقن التي تتطلبها تقرير مرئي لقطر قطرات طرد في صفار البيض للجنين. - لحقن الوريد الذيلية، وضع الجنين مع الجانب البطني التي تواجه إبرة (كما هو موضح في القسم 3.2.2) ووضع وثيقة طرف الإبرة لافتتاح البولي التناسلي، واستهداف الوريد الذيلية، ودفع بلطف غيض من الإبرة في جنين حتى يثقب فقط caudآل منطقة الوريد. تقديم حجم المطلوب من إعداد البكتيرية، وعادة 1-3 NL تحتوي على حوالي 100 خلية / NL.
- للحقن العضلي، وضع الجنين مع الجانب الظهري التي تواجه إبرة (كما هو الحال في القسم 3.2.2)، ضع الإبرة على الجسيدة واحد وحقن كمية صغيرة (1 NL) من اللقاح.
ملاحظة: بالنسبة للحقن الوريد الذيلية، والتهابات في العضل أيضا تحديا لأداء. يجب توخي الحذر لتجنب الحمولة الزائدة التي قد تصيب الأنسجة المحيطة بها. - في نهاية إجراء الحقن، والسيطرة على حجم اللقاح عن طريق حقن نفس الحجم من تعليق البكتيرية في قطرة من PBST معقمة تليها طلاء على 7H10 OADC وعد CFU. يمكن حقنها حوالي 100 الأجنة بإبرة.
ملاحظة: نظرا لأن الخام M. قد يستمر خراج لتشكيل المجاميع في الإبرة، تحتاج الحقن الذي يتعين القيام به فورا بعد إعداد اللقاح. - نقل الجبهة الاسلامية للانقاذ المصابينح لوحات فردية في 24 جيدا تحتوي على 2 مل / أسماك المياه بشكل جيد واحتضان عند 28.5 درجة مئوية. حقن الأجنة مع 1-3 نيكولا لانغ 1 X PBST يمكن استخدام الضوابط.
- ويتم رصد العدوى الصحيح من البكتيريا الفلورية في الأجنة باستخدام مجهر مضان.
5. جيل من بلعم المنضب الأجنة
يستخدم استنزاف الانتقائي للالضامة من الأنسجة للتحقيق مساهمتها ودورها خلال العدوى: ملاحظة. لتصور استنزاف السليم الضامة، فمن المستحسن استخدام خط المعدلة وراثيا مع الضامة الفلورسنت، حيث يتم التعبير عن mCherry تحديدا تحت سيطرة بلعم MPEG1 المروج محددة 19.
- الإجراء استنادا ليبو-clodronate-
ملاحظة: يسمح إجراء يبو clodronate استنزاف الانتقائي للالضامة من الأنسجة (ولكن لا العدلات) 19. هذا المركب لا لا يغير من بقاء الأجنة ولا بالعربيةاملنخفسة سلامة البكتيريا. وقد تم الإبلاغ عن بروتوكول مفصلة لإعداد مغلفة الحويصلية clodronate سابقا 33.- في 24 HPF، dechorionate الأجنة ونقلها إلى "V" طبق حقن على شكل مملوءة بالماء الأسماك تستكمل مع تريكين للحفاظ على الأجنة في حالة تخدير وحتى نهاية الإجراء حقن، كما هو موضح في 3.2.2. توجيه الجانب الظهري أسفل.
- تحميل حقن إبرة microcapillary مع مغلفة الحويصلية clodronate (ليبو-clodronate)، وربط الإبرة microinjection في حامل micromanipulator ثلاثي الأبعاد، وقطع رأس إبرة مع ملاقط غرامة للحصول على قطر افتتاح غيض من 10 ميكرون.
- لمعايرة حجم الحقن، وضبط ضغط microinjection إلى 20 هكتوبسكال والوقت حقن إلى 0.2 ثانية. وضع وثيقة طرف الإبرة لافتتاح البولي التناسلي، واستهداف الوريد الذيلية، ودفع بلطف غيض من الإبرة فيالجنين حتى يثقب فقط المنطقة الوريد الذيلية وتسليم حجم المطلوب من الحل (2-3 NL، 3 مرات).
ملاحظة: تعليق ليبو clodronate لزجة جدا وينبغي vortexed قبل الحقن لتجنب عرقلة الأوعية الدموية وقتل الجنين. ومن الأهمية بمكان للشروع في عدة الحقن المتتالية من أحجام صغيرة. - نقل الأجنة في 100 ملم أطباق بتري تحتوي على أسماك المياه والاحتفاظ بها في 28.5 درجة مئوية حتى العدوى.
- السيطرة على نضوب السليم الضامة بواسطة المجهر الفلورسنت.
ملاحظة: أكمل استنزاف بلعم فعالة لمدة 4 أيام بعد تناوله-يبو clodoronate.
- الإجراء استنادا Morpholino-
- قبل يوم التبويض، وتولد الزرد الكبار من خلال وضع 2 ذكور و 1 أنثى مفصولة حاجز بلاستيكي في غرفة تربية.
- في اليوم التالي، ≈ 30 دقيقة بعد ذلك يتحول الضوء على في منشأة الزرد، وإزالة الجدار الذي يفصلالذكور والإناث. الانتظار لمدة 20 دقيقة بعد بداية وضع البيض لتحسين معدل الإخصاب. حصاد البيض وبطء التنمية من خلال نقلهم في طبق بتري 100 مم مملوءة بالماء البارد السمك الأزرق (4 درجات مئوية).
ملاحظة: السيطرة على وضع البيض هو أمر حاسم لتجاربه التي تستند morpholinos. Morpholinos لا يمكن حقنها في البيض يصل إلى مرحلة أربع خلايا. - جمع البيض باستخدام ماصة وإيداع البيض عليه في "U" على شكل حقن غرفة مملوءة بالماء البارد السمك الأزرق ومنع البيض في القنوات باستخدام أداة microloader طرف محلية الصنع.
- إعداد الحل PU.1 morpholino تحتوي على 10٪ من الفينول الأحمر، كما هو موضح سابقا (19). تحميل إبرة حقن microcapillary مع إعداد morpholino وربط الإبرة microinjection في حامل micromanipulator ثلاثي الأبعاد، ثم قطع رأس إبرة مع ملاقط غرامة لobtaiنا قطرها افتتاح غيض من 5-10 ميكرون.
- لمعايرة حجم الحقن، وضبط ضغط microinjection إلى 20-50 هكتوبسكال والوقت حقن إلى 0.2 ثانية. وضع طرف الإبرة على مقربة من البيض، ودفع بلطف غيض من الإبرة من خلال المشيمه داخل البويضة وتسليم حجم حل morpholino المطلوب، وعادة 3-5 NL.
- بعد حقن الصغرى، ونقل البيض في 100 مم طبق بتري في أسماك المياه واحتضان عند 28.5 درجة مئوية حتى يبدأ الإجراء العدوى.
- تحليل سليم (كاملة) نضوب الضامة في morphants PU.1 بواسطة المجهر الفلورسنت في 30-48 HPF.
ملاحظة: اعتمادا على تركيز حقن، morpholinos ص u.1 قد تؤثر أيضا على عدد من العدلات في وقت مبكر. لتأكيد استنزاف السليم الضامة دون تغيير عدد من العدلات، فمن المستحسن استخدام خط الزرد المعدلة وراثيا مزدوج مع الضامة الفلورسنت والعدلات (مع GFPالتعبير مدفوعة تحديدا من قبل المروج MPX) 19.
6. الجرثومي العبء الكمي
- تقرير كتبها كفو العد
- في نقطة الوقت المطلوب، وجمع مجموعات من الأجنة المصابة (5 في الشروط) في 1.5 مل أنابيب microcentrifuge (1 جنين / أنبوب)، البرد تخدير الأجنة عن طريق الحضانة على الجليد لمدة 10 دقيقة والموت ببطء باستخدام جرعة زائدة من تريكين (300- 500 ملغم / لتر)
- غسل الأجنة مع الماء المعقم مرتين والاستغناء لهم في أنبوب جديد، ليز كل جنين مع 2٪ تريتون X-100 المخفف في 1 X PBST باستخدام إبرة 26-G والتجانس تعليق حتى تحلل كامل. أجهزة الطرد المركزي لتعليق و resuspend بيليه في 1 X PBST مع توين ومطلي 80. التخفيفات المسلسل من الخليط على ميدلبروك 7H10 OADC وتستكمل مع BBL MGIT PANTA، على النحو الموصى به من قبل المورد 0.05٪.
ملاحظة: M. خراج كونها أكثر عرضة لهيدروكسيد الصوديوم المعاملهر من M. marinum، وإزالة التلوث من لست] الأسماك دون أن يؤثر ذلك M. ويمكن تحقيق النمو خراج بنجاح باستخدام المضادات الحيوية كوكتيل BBL MGIT PANTA. - احتضان لوحات لمدة 4 أيام في 30 ° C وعدد المستعمرات.
- تقرير من قبل الإسفار بكسل عدد (الشركة العامة للفوسفات) القياسات في الأجنة الحية
ملاحظة: لتحديد الأحمال البكتيرية عن طريق الانبعاثات مضان، يتم الحصول على صور المسلسل من الأجنة المصابة وكثافة مضان تقاس الشركة العامة للفوسفات (تحديد البكتيريا عن طريق تحليل الجزيئات) باستخدام ماكرو محلية الصنع وضعت لمجانية يماغيج. تحليل الجسيمات يتطلب صورة بالأبيض والأسود الثنائية التي تعتمد على مجموعة العتبة التي تسمح لتميز إشارة الفلورسنت من الاهتمام من الخلفية.- في نقطة الوقت المطلوب، tricain-تخدير الأجنة المصابة (5-10 في حالة) في 35 ملم أطباق بتري كما هو موضح في 3.2.2.
- إزالة المياه وsubmeRGE الأجنة وسطح الصحن كله مع 1٪ انصهار منخفضة نقطة الاغاروز في أسماك المياه، ثم محاذاة أفقيا الأجنة. تغطية الاغاروز طدت مع أسماك المياه التي تحتوي على تريكين.
- الحصول على صور مضان من جنين كامل باستخدام مجهر epifluorescence مع الهدف 10 X.
ملاحظة: إن الحصول على الصور مضان هو خطوة حاسمة لإجراء القياسات الشركة العامة للفوسفات. من المهم أن استخدام جهاز معايرة مع لجنة التحقيق معايرة الألوان. ضبط الوقت الأمثل التعرض للحصول على الخلفية الحد الأدنى من خلال الاستحواذ يمنع تشبع الإشارة. يجب أن تكون الصور في شكل شجار 8 بت. يتم الاحتفاظ إعدادات متطابقة طوال فترة التجربة لأغراض الكمية. - إزالة بعناية الاغاروز من الأجنة مع أداة microloader طرف محلية الصنع. هذه الأجنة يمكن أن تستخدم لتحليلات لاحقة إذا لزم الأمر. قبل تحديد مقدار الحمولة الجرثومية، كل صورة يجب أن جودة التحكم. لnalyze الصور وتحويل كثافة مضان في الشركة العامة للفوسفات في الأسماك، افتح مجانية يماغيج.
ملاحظة: تعكس قيمة الشركة العامة للفوسفات عبء البكتيرية كما هو موضح سابقا باستخدام M. marinum 34. - تحديد الحد الأدنى المطلوب لتحليل الصور باستخدام صورة لجنين غير مصاب (عدة أجنة السيطرة يمكن أن تستخدم للحصول على عتبة متوسط). الذهاب إلى صورة → → ضبط عتبة ثم قم بتحريك شريط التمرير السفلي في نافذة عتبة إلى اليمين حتى تصبح خلفية سوداء تماما (أي، للحصول على الخلفية يجب أن تكون على الصفر). تسجيل القيمة المقابلة.
- ضمن صورة J، فتح الماكرو الشركة العامة للفوسفات (ملف التكميلي) واتبع التعليمات: حدد موقع مجلد من الصور التي سيتم قياسها ومن ثم أدخل عتبة كما سبق تحديدها وانقر على "OK".
ملاحظة: الماكرو ينقص الخلفية تلقائيا. ثم يتم تطبيق العتبة. إشارات الفلورسنت هي هوية منذfied بعد تحليل الجزيئات. - نسخ ولصق البيانات من نافذة ملخص لعن البرنامج المطلوب لتحليل البيانات.
ملاحظة: على النقيض من طريقة تحديد كفو، وطريقة الشركة العامة للفوسفات هو غير الغازية ويسمح إعادة استخدام الأجنة للتحليلات لاحقة، والأهم، ورصد ديناميات / حركية عبء البكتيرية على أساس فردي. ولذا، ويسمح لخفض كبير في عدد الحيوانات، بالاتفاق مع القواعد الأخلاقية.
7. التصوير M. الأجنة المصابة abscessus-
- تصوير حي لM. عدوى خراج
- جبل الأجنة تخدير تريكين (انظر 3.2.2) في 1٪ انصهار منخفضة نقطة الاغاروز في 35 ملم طبق بتري قبل الملاحظات المجهر epifluorescence. استخدام طبق أسفل الزجاج لمقلوب المجهر متحد البؤر أو في واحدة شريحة تجويف الاكتئاب لتستقيم متحد البؤر المجهري. توجيه الجنين إلى الموضع المطلوب والغطاءالاغاروز طدت مع أسماك المياه التي تحتوي على تريكين.
- استخدام المجهر epifluorescence مع الهدف 10 X لاقتناء مضان ونقل صور متسلسلة للجنين كامل. بدلا من ذلك، استخدم المجهر متحد البؤر مع 40X 63X أو الأهداف التي تصور نشاط الخلايا المناعية بعد العدوى.
- التصوير ثابتة M. خراج إصابة الأجنة
- الموت ببطء الأجنة كما هو موضح في 6.1.1 ونقلها إلى 1.5 مل أنابيب الطرد المركزي الصغيرة وإصلاح الأجنة في بارافورمالدهيد 4٪ في 1 X PBST لمدة 2 ساعة على RT أو O / N عند 4 درجات مئوية. إزالة امتصاص العرق عن طريق غسل الأجنة مرتين مع 1 X PBST لمدة 10 دقيقة.
ملاحظة: للحفاظ على مضان والأجنة الثابتة يجب أن تكون محمية من الضوء. - للحفاظ على سلامة الأنسجة ومضان، يتم تحضين الأجنة تباعا في زيادة تركيز حلول الجلسرين (10، 20، 30، 40 و 50٪ المخفف في 1 X PBST)، ل10 دقيقة لكل حالة.
ويمكن تخزين الأجنة ثابت لعدة أشهر في 50٪ الجلسرين عند 4 درجة C: ملاحظة. - وضع الجنين جزءا لا يتجزأ من 50٪ الجلسرين في غرفة العرض (1B الشكل) 31.
- الصورة باستخدام 40X 63X أو أهداف على المجهر متحد البؤر.
- الموت ببطء الأجنة كما هو موضح في 6.1.1 ونقلها إلى 1.5 مل أنابيب الطرد المركزي الصغيرة وإصلاح الأجنة في بارافورمالدهيد 4٪ في 1 X PBST لمدة 2 ساعة على RT أو O / N عند 4 درجات مئوية. إزالة امتصاص العرق عن طريق غسل الأجنة مرتين مع 1 X PBST لمدة 10 دقيقة.
النتائج
على الرغم من مختلف المواقع التشريحية يمكن حقن 32، وغالبا ما يتم استخدام حقن الوريد الذيلية لتوليد العدوى النظامية للتحليلات لاحقة بما في ذلك التجارب البقاء على قيد الحياة، البكتيرية تقرير عبء، والنشاط البلعمة أو تشكيل الحبل. يتم استخدام الحقن في العضلات الذيل ...
Discussion
وقد ظهرت مؤخرا الزرد كنظام نموذج الفقاريات ممتازة لدراسة ديناميات عدوى بكتيرية باستخدام حقل واسع والتصوير متحد البؤر في الوقت الحقيقي 36. مزيج من تعليق المتفطرات تفرقوا (بروتوكول 2.2) جنبا إلى جنب مع أساليب الحقن الدقيقة (بروتوكول 4) يسمح التهابات استنساخه النظام...
Disclosures
The authors have nothing to disclose.
Acknowledgements
المؤلفون ممتنون لK. كيسا للمناقشات مفيدة وتوفير يبو-clodronate وL. راماكريشنان لهدية سخية من pTEC27 وpTEC15 التي تسمح التعبير عن tdTomato واسابي، على التوالي. هذا العمل جزءا من مشاريع وكالة البحوث الوطنية الفرنسية (ZebraFlam ANR-10-MIDI-009 وDIMYVIR ANR-13-BSV3-007-01) والبرنامج الإطاري السابع للجماعة الأوروبية (FP7-PEOPLE-2011-ITN) بموجب اتفاقية منحة لا. PITN-GA-2011-289209 لماري كوري للتدريب الأولي شبكة FishForPharma. كما نود أن نشكر جمعية غريغوري Lemarchal وVaincre لا Mucoviscidose (RF20130500835) لتمويل CM دوبونت.
Materials
| Name | Company | Catalog Number | Comments |
| BBL MGIT PANTA | BD Biosciences | 245114 | |
| Bovine Serum Albumin | Euromedex | 04-100-811-E | |
| Catalase from Bovine Liver | Sigma-Aldrich | C40 | |
| Difco Middlebrook 7H10 Agar | BD Biosciences | 262710 | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Oleic Acid | Sigma-Aldrich | O1008 | |
| Paraformaldehyde | Delta Microscopie | 15710 | |
| Phenol Red | Sigma-Aldrich | 319244 | |
| Tween 80 | Sigma-Aldrich | P4780 | |
| Agar | Gibco Life Technologie | 30391-023 | |
| Low melting agarose | Sigma-Aldrich | ||
| Instant Ocean Sea Salts | Aquarium Systems Inc | ||
| Borosilicate glass capillaries | Sutter instrument Inc | BF100-78-10 | 1 mm O.D. X 0.78 mm I.D. |
| Micropipette puller device | Sutter Instrument Inc | Flamming/Brown Micropipette Puller p-87 | |
| Microinjector | Tritech Research | Digital microINJECTOR, MINJ-D | |
| Tweezers | Sciences Tools inc | Dumont # M5S | |
| Microloader Tips | Eppendorf |
References
- Brown-Elliott, B. A., Wallace, R. J. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria. Clinical Microbiology Reviews. 15 (4), 716-746 (2002).
- Aitken, M. L., Limaye, A., et al. Respiratory outbreak of Mycobacterium abscessus subspecies massiliense in a lung transplant and cystic fibrosis center. American Journal of Respiratory and Critical Care Medicine. 185 (2), 231-232 (2012).
- Gilljam, M., Lindblad, A., Ridell, M., Wold, A. E., Welinder-Olsson, C. Molecular epidemiology of Mycobacterium abscessus, with focus on cystic fibrosis. Journal of Clinical Microbiology. 45 (5), 1497-1504 (2007).
- Roux, A. -. L., Catherinot, E., et al. Multicenter study of prevalence of nontuberculous mycobacteria in patients with cystic fibrosis in France. Journal of Clinical Microbiology. 47 (12), 4124-4128 (2009).
- Lee, M. -. R., Cheng, A., et al. CNS infections caused by Mycobacterium abscessus complex: clinical features and antimicrobial susceptibilities of isolates. The Journal of Antimicrobial Chemotherapy. 67 (1), 222-225 (2012).
- Talati, N. J., Rouphael, N., Kuppalli, K., Franco-Paredes, C. Spectrum of CNS disease caused by rapidly growing mycobacteria. The Lancet Infectious Diseases. 8 (6), 390-398 (2008).
- Medjahed, H., Gaillard, J. -. L., Reyrat, J. -. M. Mycobacterium abscessus: a new player in the mycobacterial field. Trends in Microbiology. 18 (3), 117-123 (2010).
- Griffith, D. E., Girard, W. M., Wallace, R. J. Clinical features of pulmonary disease caused by rapidly growing mycobacteria. An analysis of 154 patients. The American Review of Respiratory Disease. 147 (5), 1271-1278 (1993).
- Nessar, R., Cambau, E., Reyrat, J. M., Murray, A., Gicquel, B. Mycobacterium abscessus: a new antibiotic nightmare. The Journal of Antimicrobial Chemotherapy. 67 (4), 810-818 (2012).
- Sanguinetti, M., Ardito, F., et al. Fatal pulmonary infection due to multidrug-resistant Mycobacterium abscessus a patient with cystic fibrosis. Journal of Clinical Microbiology. 39 (2), 816-819 (2001).
- Griffith, D. E., Aksamit, T., et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. American Journal of Respiratory and Critical Care Medicine. 175 (4), 367-416 (2007).
- Howard, S. T., Rhoades, E., et al. Spontaneous reversion of Mycobacterium abscessus a smooth to a rough morphotype is associated with reduced expression of glycopeptidolipid and reacquisition of an invasive phenotype. Microbiology (Reading, England). 152 (Pt 6), 1581-1590 (2006).
- Chardi, A., Olivares, F., Byrd, T. F., Julián, E., Brambilla, C., Luquin, M. Demonstration of cord formation by rough Mycobacterium abscessus variants: implications for the clinical microbiology laboratory. Journal of Clinical Microbiology. 49 (6), 2293-2295 (2011).
- Byrd, T. F., Lyons, C. R. Preliminary characterization of a Mycobacterium abscessus mutant in human and murine models of infection. Infection and Immunity. 67 (9), 4700-4707 (1999).
- Catherinot, E., Clarissou, J., et al. Hypervariance of a rough variant of the Mycobacterium abscessus type strain. Infection and Immunity. 75 (2), 1055-1058 (2007).
- Catherinot, E., Roux, A. -. L., et al. Acute respiratory failure involving an R variant of Mycobacterium abscessus. Journal of Clinical Microbiology. 47 (1), 271-274 (2009).
- Bernut, A., Le Moigne, V., Lesne, T., Lutfalla, G., Herrmann, J. -. L., Kremer, L. In vivo assessment of drug efficacy against Mycobacterium abscessus using the embryonic zebrafish test system. Antimicrobial Agents and Chemotherapy. 58 (7), 4054-4063 (2014).
- Oh, C. -. T., Moon, C., Jeong, M. S., Kwon, S. -. H., Jang, J. Drosophila melanogaster for Mycobacterium abscessus infection. Microbes and Infection / Institut Pasteur. 15 (12), 788-795 (2013).
- Bernut, A., Herrmann, J. -. L., et al. Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), E943-E952 (2014).
- Dubée, V., Bernut, A., et al. β-Lactamase inhibition by avibactam in Mycobacterium abscessus. Journal of Antimicrobial Chemotherapy. 70 (4), 1051-1058 (2015).
- Torraca, V., Masud, S., Spaink, H. P., Meijer, A. H. Macrophage-pathogen interactions in infectious diseases: new therapeutic insights from the zebrafish host model. Disease Models Mechanisms. 7 (7), 785-797 (2014).
- Alibaud, L., Rombouts, Y., et al. A Mycobacterium marinum TesA mutant defective for major cell wall-associated lipids is highly attenuated in Dictyostelium discoideum and zebrafish embryos. Molecular Microbiology. 80 (4), 919-934 (2011).
- Clay, H., Volkman, H. E., Ramakrishnan, L. Tumor necrosis factor signaling mediates resistance to mycobacteria by inhibiting bacterial growth and macrophage death. Immunity. 29 (2), 283-294 (2008).
- Palha, N., Guivel-Benhassine, F., et al. Real-time whole-body visualization of Chikungunya Virus infection and host interferon response in zebrafish. PLoS pathogens. 9 (9), e1003619 (2013).
- Mostowy, S., Boucontet, L., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri with phagocytes and bacterial autophagy. PLoS pathogens. 9 (9), e1003588 (2013).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cellular Microbiology. 10 (11), 2312-2325 (2008).
- Van der Sar, A. M., Appelmelk, B. J., Vandenbroucke-Grauls, C. M. J. E., Bitter, W. A star with stripes: zebrafish as an infection model. Trends in Microbiology. 12 (10), 451-457 (2004).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O’Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infection and Immunity. 78 (4), 1495-1508 (2010).
- Levraud, J. -. P., Disson, O., et al. Real-time observation of Listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infection and Immunity. 77 (9), 3651-3660 (2009).
- Meijer, A. H., Spaink, H. P. Host-pathogen interactions made transparent with the zebrafish model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , (2007).
- Benard, E. L., van der Sar, A. M., Ellett, F., Lieschke, G. J., Spaink, H. P., Meijer, A. H. Infection of zebrafish embryos with intracellular bacterial pathogens. Journal of Visualized Experiments. (61), e3781 (2012).
- Van Rooijen, N., Sanders, A. Liposome mediated depletion of macrophages: mechanism of action, preparation of liposomes and applications. Journal of Immunological Methods. 174 (1-2), 83-93 (1994).
- Adams, K. N., Takaki, K., et al. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell. 145 (1), 39-53 (2011).
- Ramakrishnan, L. Looking within the zebrafish to understand the tuberculous granuloma. Advances in Experimental Medicine and Biology. 783, 251-266 (2013).
- Davis, J. M., Clay, H., Lewis, J. L., Ghori, N., Herbomel, P., Ramakrishnan, L. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17 (6), 693-702 (2002).
- Lamason, R. L., Mohideen, M. -. A. P. K., et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science (New York, NY). 310 (5755), 1782-1786 (2005).
- Renshaw, S. A., Loynes, C. A., Trushell, D. M. I., Elworthy, S., Ingham, P. W., Whyte, M. K. B. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC developmental biology. 7, 42 (2007).
- Takaki, K., Davis, J. M., Winglee, K., Ramakrishnan, L. Evaluation of the pathogenesis and treatment of Mycobacterium marinum in zebrafish. Nature Protocols. 8 (6), 1114-1124 (2013).
- Stoop, E. J. M., Schipper, T., et al. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Disease Models Mechanisms. 4 (4), 526-536 (2011).
- Carvalho, R., de Sonneville, J., et al. A high-throughput screen for tuberculosis progression. PloS One. 6 (2), e16779 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved