Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entschlüsselung und Imaging Pathogenese und Cording von
In diesem Artikel
Zusammenfassung
Optically transparent zebrafish embryos are widely used to study and visualize in real time the interactions between pathogenic microorganisms and the innate immune cells. Micro-injection of Mycobacterium abscessus, combined with fluorescence imaging, is used to scrutinize essential pathogenic features such as cord formation in zebrafish embryos.
Zusammenfassung
Zebrafish (Danio rerio) embryos are increasingly used as an infection model to study the function of the vertebrate innate immune system in host-pathogen interactions. The ease of obtaining large numbers of embryos, their accessibility due to external development, their optical transparency as well as the availability of a wide panoply of genetic/immunological tools and transgenic reporter line collections, contribute to the versatility of this model. In this respect, the present manuscript describes the use of zebrafish as an in vivo model system to investigate the chronology of Mycobacterium abscessus infection. This human pathogen can exist either as smooth (S) or rough (R) variants, depending on cell wall composition, and their respective virulence can be imaged and compared in zebrafish embryos and larvae. Micro-injection of either S or R fluorescent variants directly in the blood circulation via the caudal vein, leads to chronic or acute/lethal infections, respectively. This biological system allows high resolution visualization and analysis of the role of mycobacterial cording in promoting abscess formation. In addition, the use of fluorescent bacteria along with transgenic zebrafish lines harbouring fluorescent macrophages produces a unique opportunity for multi-color imaging of the host-pathogen interactions. This article describes detailed protocols for the preparation of homogenous M. abscessus inoculum and for intravenous injection of zebrafish embryos for subsequent fluorescence imaging of the interaction with macrophages. These techniques open the avenue to future investigations involving mutants defective in cord formation and are dedicated to understand how this impacts on M. abscessus pathogenicity in a whole vertebrate.
Einleitung
Mycobacterium abscessus ist eine aufstrebende Erreger, die ein breites Spektrum von Krankheitsbildern in den Menschen verursacht. Dazu gehören Hautinfektionen sowie schwere chronische Lungeninfektionen, vor allem bei immungeschwächten und Fibrose-Patienten 1,2,3,4 zystische aufgetreten. M. abscessus wird auch als Haupt schnell wachsenden Mykobakterienarten für nosokomiale und iatrogene Infektionen beim Menschen verantwortlich gemacht. Darüber hinaus hob mehrere jüngsten Berichten die Möglichkeit, daß M. abscessus kann die Blut-Hirn-Schranke zu überwinden und induzieren wichtig Läsionen im zentralen Nervensystem (CNS) 5,6. Obwohl er eine schnelle Bauer, M. abscessus Exponaten auch einige pathogene Eigenschaften, die denen von Mycobacterium tuberculosis verwandt sind, einschließlich der Fähigkeit, schwieg Jahren innerhalb granulomatöse Strukturen bleiben und käsige Läsionen in der Lunge 7 zu erzeugen. Noch alarmierender ist die geringe senlichkeit von M. abscessus gegen Antibiotika, wodurch diese Infektionen extrem schwierig zu behandeln, die zu einer signifikanten therapeutischen Ausfallrate 8,9. Die wichtige Bedrohung dieser Art ist vor allem seiner intrinsischen Resistenz gegen Antibiotika, die zu großer Besorgnis in der öffentlichen Gesundheitseinrichtungen 10 und einer Kontraindikation für eine Lungentransplantation 11 ist.
M. abscessus Displays glatt (S) oder rauhe (R) Kolonie Morphotypen, die unterschiedlichen klinischen Ergebnissen führen. Im Gegensatz zu dem S-Stamm haben R Bakterien eine Tendenz zu einem Ende zum anderen zunehmen, was zu einem Seil oder schnurartigen Struktur 12,13. Mehrere unabhängige Studien, die entweder auf Zell- oder Tiermodellen ergeben, die hyper-Virulenz Phänotyp der R Morphotyp 14,15. Aus epidemiologischen Studien, den schwersten Fällen von M. abscessus Lungeninfektionen scheinen mit R verbunden sein Varianten 16, die die einzige Variante ist, dasshat sich gezeigt, für viele Jahre in einem infizierten Wirt 3 bestehen. Die Morphotyp Unterschied beruht auf der Gegenwart (in s) oder Verlust (in F) des oberflächenassoziierten glycopeptidolipids (GPL) 12. Jedoch aufgrund der inhärenten Beschränkungen der derzeit verfügbaren zellularen / Tiermodelle verwendet, um M. studieren abscessus Infektion bleibt unser Wissen über die pathophysiologischen Ereignisse der R- oder S-Varianten im Dunkeln. Die Infektion von immunkompetenten Mäusen durch intravenöse oder Aerosol-Routen führt zu vorübergehenden Kolonisierung, behindern die Verwendung von Mäusen zu persistenten Infektionen und für die in vivo Arzneimittelempfindlichkeitsprüfung 17 zu studieren. Daher ist die Entwicklung von Tiermodellen offen für die Manipulation der Wirtsantwort ist eine große Herausforderung. In diesem Zusammenhang haben die Nicht-Säugetiermodellen der Infektion vor kurzem entwickelt worden, einschließlich Drosophila melanogaster 18, die mehrere Vorteile, wie beispielsweise Kosten, Geschwindigkeit und ethischen Akzeptanz o bietetn den Maus-Modell. Der Zebrafisch (Danio rerio) Modell der Infektion wurde ebenfalls untersucht, um sichtbar zu machen, durch nicht-invasive Bildgebung, das Fortschreiten und die Chronologie der M. abscessus Infektion in einem lebenden Tier 19. Wichtig ist, dass ein Proof of Concept auch gegründet, um seine Tauglichkeit für die in vivo-Antibiotikum, Einschätzungen gegen M. demonstrieren abscessus 17,20.
Der Zebrafisch wurden weit verbreitet in den letzten zwei Jahrzehnten verwendet, um die Wechselwirkungen zwischen verschiedenen Krankheitserregern und dem Immunsystem des Wirts 21 zu studieren. Der zunehmende Erfolg dieses alternativen Wirbeltiermodell stützt sich auf große und einzigartige Möglichkeiten, die motiviert und validiert seine Verwendung für ein besseres Verständnis der zahlreichen viralen und bakteriellen Infektionen 19,22,23,24,25,26,27,28,29. Wie die meisten anderen Tiermodellen gegenüberliegen, sind Zebrafischembryonen optisch transparent, so dass nicht-invasive Fluoreszenzbildgebung 30 ha. Dieses führte zu M. studieren abscessus infiziert Zebrafischembryonen mit beispiellosen Details, die ihren Höhepunkt mit der Beschreibung der extrazellulären Aufzeichnung, die ein Beispiel der bakteriellen morphologische Plastizität zu vertreten. Cording stellt einen neuen Mechanismus der Subversion des Immunsystems und einen Schlüsselmechanismus zur Förderung Pathogenese der akuten M. abscessus Infektion 19.
Dieser Bericht beschreibt neue Werkzeuge und Methoden unter Verwendung des Zebrafischembryo, um die pathophysiologischen Merkmale des M. entziffern abscessus Infektion und die intime Wechselwirkungen zwischen der Bazillen und das angeborene Immunsystem zu untersuchen. Zuerst wird ein detailliertes Protokoll, das die Mikroinjektion Verarbeitung des bakteriellen Inokulums Embryo Herstellung und Infektion per se beinhaltet, wird vorgestellt. Methoden spezifisch angepasst, um M. bewerten abscessus Virulenz durch Messung verschiedener Parameter, wie beispielsweise Wirts Überleben und bakterielle Belastung, werden vorgestellt. Ein besonderer Fokus liegt auf, wie angegebenzur Überwachung, in einem räumlich-zeitlichen Ebene das Schicksal und die Progression der Infektion und dem Wirtsimmunantwort auf M. abscessus mittels Videomikroskopie. Darüber hinaus, um den Beitrag und die Rolle von Makrophagen bei M. untersuchen abscessus Infektion, Methoden, um Makrophagen verarmten Embryonen (entweder genetically- oder chemisch basierte Ansätze) beschrieben zu erzeugen. Schließlich Protokolle, um die spezifischen Wechselwirkungen mit Makrophagen oder Neutrophile mit festen oder lebenden Embryonen dokumentiert sind zu visualisieren.
Das Ziel dieses Berichts ist es, weitere Untersuchungen anzuregen, neue Licht in M. vergossen abscessus Virulenzmechanismen und insbesondere die Rolle der Aufzeichnung in der Einrichtung einer akuten und unkontrollierte Infektionsprozess.
Protokoll
Zebrafisch experimentellen Verfahren müssen die relevanten institutionellen und staatlichen Vorschriften. Für die vorliegende Studie wurden Zebrafisch-Experimenten an der Universität Montpellier getan, nach EU-Richtlinien für den Umgang mit Labortieren (http://ec.europa.eu/environment/chemicals/lab_animals/home_en.htm) und unter dem Referenz zugelassen CEEA-LR-13007.
1. Vorbereitung der Reagenzien und Mikroinjektion Ausrüstung
- Bereiten Fischwasser durch Lösen von 0,06 g Instant Ocean Meersalz in 1 l destilliertem Wasser 31, dann im Autoklaven sterilisiert (120 ° C für 20 min) und lagern bei 28,5 ° C für bis zu 1 Monat.
- Bereiten Methylenblau-Lösung durch Auflösen von 1 g Methylenblau in 1 L destilliertem Wasser. Fügen Sie 300 ul Methylenblau-Lösung in 1 l Wasser, um Fische blaue Fische Wasser zu erhalten, dann Autoklaven bei 28,5 ° C für bis zu 1 Monat zu sterilisieren und zu lagern.
HINWEIS: Die additiauf Methylenblau in Fischwasser verhindert Schimmelbildung. - Herstellung von Phosphat-gepufferter Saline (PBS)
- Vorbereitung einer 10 X PBS-Stammlösung durch Auflösen von 5,696 g Na 2 HPO 4, 680 mg KH 2 PO 4, 969 mg KCl und 78,894 g NaCl in 1 l destilliertem Wasser und Einstellen des pH auf 7,0 mit HCl. Um 1 X PBS zu erhalten, zu verdünnen 100 ml der 10 X PBS-Lösung in 900 ml destilliertem Wasser und Autoklaven während 20 min bei 120 ° C zu sterilisieren.
- In 0,05% Tween 80 bis 1 x PBST erhalten und speichern, bei RT bis zu 1 Jahr.
- Vorbereitung Oleinsäure Dextrose Catalase (OADC) Anreicherung durch Auflösen von 8,5 g NaCl, 50 g Rinderserumalbumin, 20 g D-Glucose, 40 mg Katalase aus Rinderleber und 0,5 g Ölsäure in 1 l destilliertem Wasser, filtriere dann Sterilisieren der Lösung und im Kühlschrank bei 4 ° C für bis zu 6 Monate.
- Vorbereitung 100 ml Ethyl-3-aminobenzoat Methansulfonsäure (Tricaine) Stammlösung, die durch Auflösen von 400 mg tricaine Pulver in 97,9 ml destilliertem Wasser. Hinzuzufügen 2,1 ml 1 M Tris (pH 9), um den pH-Wert auf 7,0 einzustellen versetzt und die Lösung bei -20 ° C.
- Bereiten Sie die Mikrokapillare Injektionsnadeln durch Ziehen Borosilikatglas Kapillaren (1 mm OD X 0,78 mm ID) mit einer Mikropipette Abzieher Gerät mit den folgenden Einstellungen: Luftdruck 650; Erhitzen Sie 999; Ziehen Sie 50; Velocity 80; Zeit 200.
- Bereiten Sie eine 1,5% Agar-Lösung in blauen Fisch Wasser vermischen und 25 ml geschmolzenem Agar in 100 mm Petrischalen. Auf der Oberseite des geschmolzenen Agar, platzieren hausgemachten Formen, um bestimmte Kanäle prägen. "V" -förmigen Kanäle auf Position Embryonen verwendet werden, während der "U" -förmigen für Eier (1), 31 eingesetzt werden. Einmal verfestigt, entfernen Sie vorsichtig den Abdruck.
HINWEIS: Decken Sie die Agar mit blauen Fisch Wasser, um Austrocknung und Speicher für bis zu 2 Monaten zu vermeiden, bei 4 ° C.
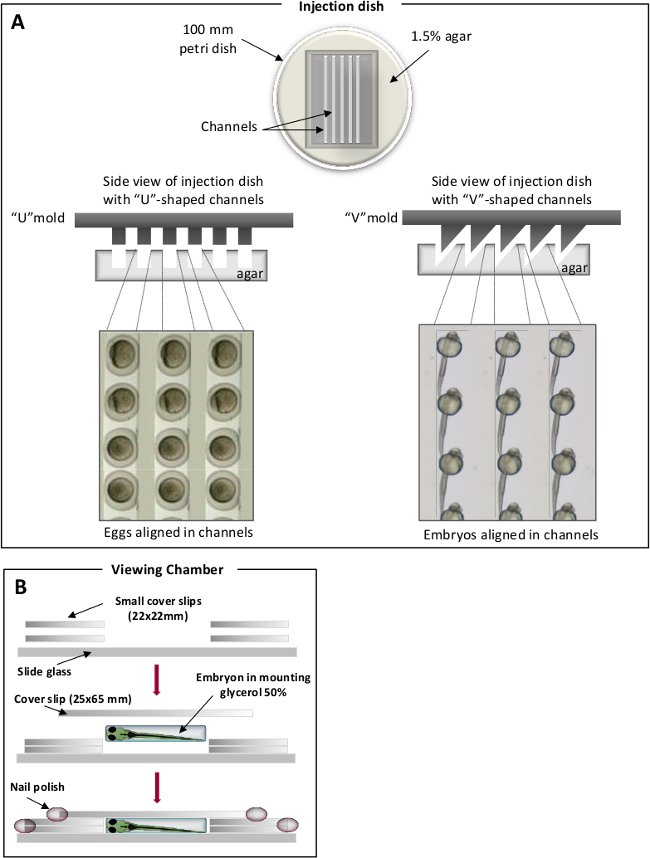
Abbildung 1. Positionierung Kammern zur Zebrafisch-Injektionen. (A) U-förmige Kanäle für Eier (linkes Bild) und V-förmige Kanäle für Embryonen (rechtes Bild). Zebrafisch-Eier / Embryonen werden in die Kanäle verlegt und entlang der gleichen Achse ausgerichtet sind. (B) Viewing Kammern zur mikroskopischen Beobachtung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
2. Herstellung und Lagerung des M. abscessus Inokulum
- M. abscessus Wachstumsbedingungen
- Teller aus M. abscessus aus einem -80ºC Glycerolstammlösung auf eine Middlebrook 7H10-Agar, der 10% OADC und 0,5% Glycerin (7H10 OADC) und mit dem entsprechenden Antibiotikum, je nach dem Resistenzmarker des Vektors, der das fluoreszierende Protein kodiert, durchgeführt wird, ergänzt. Die Inkubationbei 30 ° C für 4-5 Tage.
- Pick-up ein Fluoreszenz-positiven mykobakteriellen Kolonie und zu impfen 1 ml Middlebrook 7H9 Bouillon mit OADC ergänzt, 0,2% Glycerin, 0,05% Tween 80 (7H9 OADC / T) mit der erforderlichen Antibiotikum, das in einem 15 ml sterile Kunststoffröhrchen. Inkubation bei 30 ° C für 1 Woche ohne Schütteln.
HINWEIS: Tween 80 schränkt Klumpenbildung und Bakterienaggregation. - Resuspendieren in 2.1.2 erhaltenen Vorkultur in 50 ml Middlebrook 7H9 OADC / T in 150 cm 2 Gewebekulturflaschen auf eine endgültige OD 600 von 0,1 (entspricht ca. 5,10 7 Bakterien / ml) und Inkubation weiter bei 30 ° C für 4 Tage, um eine exponentiell wachsende Kultur (OD 600 = 0,6 bis 0,8) zu erhalten.
WICHTIG: Um Klumpenbildung zu minimieren, vor allem der Grobvariante, sollte Inkubationszeit 5 Tage nicht überschreiten. Sowohl glatte und raue Varianten zeigen eine ähnliche Wachstumsrate.
- Herstellung des M. abscessus Inokula60;
HINWEIS: Aufgrund der hohen Neigung der rauen M. abscessus um große Aggregate zu bilden und Schnüre zu produzieren, erforderlich ist eine besondere Behandlung, um eine homogene und quantitativ gesteuert Inokula vor der Mikroinjektion in Embryonen zu erzeugen. Diese Behandlung wird auch angewendet, um Bakterien, die Aggregate zu erzeugen, wenn auch in geringerem Ausmaß als der rauen Stamm glätten.- Ernte exponentiell wachsende Kulturen von 150 cm 2 Gewebekulturkolben durch Zentrifugation bei 4 000 g für 15 min bei RT in 50 ml sterile Kunststoffrohr und Resuspendieren der Bakterienpellet in 1 ml 7H9 OADC / T. Aliquot 200 ul Bakteriensuspensionen in 1,5 ml Mikrozentrifugenröhrchen.
HINWEIS: Arbeiten mit kleinen Volumina in 1 ml-Spritzen ist notwendig, um sehr homogene Suspensionen zu erhalten. - Homogenisieren der Bakteriensuspensionen mit einer 26-G-Nadel (15 up-and-down-Sequenzen), beschallen dreimal für 10 sec (bei 10 s Pausen zwischen jeder Beschallung SEquenz) mit einem Wasserbad Ultraschallgerät. 1 ml 7H9 OADC / T und kurz vortexen. Zentrifuge 3 min bei 100 x g.
- Sorgfältig sammeln die Mykobakterien-haltigen Überständen, um die Klumpen zu vermeiden und bündeln die homogene Suspensionen in einem 50 ml sterile Kunststoffröhrchen.
- Sichtprüfung auf das Vorhandensein von etwaigen verbliebenen bakteriellen Aggregate.
HINWEIS: Wenn Aggregate noch vorhanden sind, zu einer zusätzlichen Zentrifugationsschritt gehen bei 100 × g für 2 min, und sammeln Sie den Überstand. - Zentrifuge die Suspension bei 4.000 g für 5 min, das Pellet in 200 ul 7H9 OADC / T und zur Injektion.
- Beurteilung der abschließenden Bakterienkonzentration durch Plattieren serielle Verdünnungen (in 1 x PBST) auf 7H10-Agar OADC und Zählen koloniebildenden Einheiten (CFU) nach 4 Tagen Inkubation bei 30 ° C. KBE sollte für jede neue Charge bestimmt werden.
- Bereiten gefrorenen Inokula Aktien durch die Speicherung 5 ul Aliquots bei -80 & #176; C.
HINWEIS: Die Beurteilung der CFU -80ºC gefroren Aliquots ist eine Voraussetzung, um die genaue Anzahl der lebensfähigen Bakterien zu bestimmen, wie Einfrieren / Auftauen können bakterielle Lebensfähigkeit des Inokulums beeinflussen. Diese gefrorenen Inokula sind bereit, für nachfolgende Injektionen verwendet werden. Da alle Aliquots enthalten die gleiche Anzahl von CFU, erlauben sie die Injektion von Bakterien in einer reproduzierbaren Art und Weise von einem Experiment zum anderen.
- Ernte exponentiell wachsende Kulturen von 150 cm 2 Gewebekulturkolben durch Zentrifugation bei 4 000 g für 15 min bei RT in 50 ml sterile Kunststoffrohr und Resuspendieren der Bakterienpellet in 1 ml 7H9 OADC / T. Aliquot 200 ul Bakteriensuspensionen in 1,5 ml Mikrozentrifugenröhrchen.
- Inokulum Qualitätskontrolle
HINWEIS: Ziehl-Neelsen Färbung (spezifisch für Mykobakterien) verwendet, um die Qualität der Bakteriensuspensionen vor und nach der in 2.2 beschriebene Homogenisierungsverfahren zu vergleichen.- Spot und breitete ein Tröpfchen der homogenisierten Bakteriensuspension auf einen Objektträger und lassen Sie es vollständig trocknen, fixieren Sie die Abstrich für mindestens 30 Minuten auf einer heißen Platte auf 65-70 ° C und Flecken mit einem Ziehl-Neelsen-Färbung Protokoll eingestellt .
- Beachten Sie die bakteriellen Abstrich mit einem Mikroskop mit einer 100X Ziel und vergleichen mit einem Abstrich eines nicht verarbeiteten Bakteriensuspension (Abbildung 2).
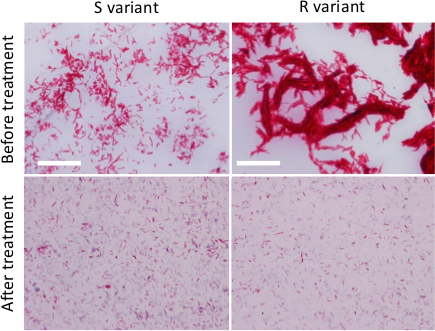
Abbildung 2. Herstellung dispergiert M. abscessus Inokula. Ziehl-Neelsen Färbung von R- oder S-Varianten auf Nährmedium vor jeder Behandlung (obere Felder) angebaut oder nach der Behandlung (untere Felder), um die Größe und Anzahl der mykobakteriellen Aggregate (aufeinanderfolgende Schritte Ausspritzen, Beschallung und Dekantieren) zu reduzieren . Die Bakterien wurden mit einem Mikroskop mit 100 X APO Öl 1,4 NA-Objektiv) beobachtet. Maßstabsbalken:. 20 & mgr; m Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
3. Vorbereitung Zebrafischembryonen
- Laich- und Sammeln Zebrabärblingeier
- Am Tag vor sPfändung, Rasse erwachsenen Zebrafisch, indem 2 Rüden und 1 Hündin (in der Regel ein 2: 1-Verhältnis ermöglicht eine optimale Befruchtungsrate) in eine Brutkammer, die aus einem separaten Aquarium mit einem Ei Sammelkorb 31.
HINWEIS: Eiersammlung Körbe werden verwendet, um die Eier aus, die von den Eltern gegessen zu schützen und zu erleichtern Ei Ernte. - Bei 1 HPF, Ernte Eier und nur richtig entwickelt Embryonen in einer 100 mm Petrischale mit 25 ml blaue Fisch Wasser (maximal 100 Embryonen pro Schale) und halten sie bei 28,5 ° C gefüllt. Nicht befruchtete Eier werden verworfen.
- Am Tag vor sPfändung, Rasse erwachsenen Zebrafisch, indem 2 Rüden und 1 Hündin (in der Regel ein 2: 1-Verhältnis ermöglicht eine optimale Befruchtungsrate) in eine Brutkammer, die aus einem separaten Aquarium mit einem Ei Sammelkorb 31.
- Herstellung von Zebrafischembryonen für Injektionszwecke
- Bei etwa 24 Stunden nach der Befruchtung (HPF), dechorionate die Embryonen mit feinen Pinzette in einer 100 mm Petrischale und halten sie bei 28,5 ° C.
- Sammeln Sie die HPF 30-48 Embryonen mit einer Pipette und Übertragung auf einen "V" -förmigen Positionierungskammer mit 25 ml Wasser, das Fisch 270 mg / L Tricaine gefüllt.Verlegen Sie die Embryonen richtig in den Kanälen mit einem hausgemachten Microloader tool (hausgemachte abgeschnitten Mikro loader Spitze) für eine einfachere Mikromanipulation optimiert.
HINWEIS: Richten Sie die Rückenseite nach unten zur intravenösen Injektion in die Schwanzvene oder der Rückenseite nach oben für Rückmuskel Injektionen.
4. Mikroinjektionsverfahren
HINWEIS: Die Mikroinjektionsverfahren für M. abscessus ist ähnlich zu dem zuvor beschriebenen für M. marinum Injektionen 32. Um die Chronologie der M. bewerten abscessus Infektion (Überleben, bakterielle Belastungen, kinetische und Eigenschaften der Infektion), sind Injektionen in die Schwanzvene von 30 HPF Embryonen bevorzugt. Die Rekrutierung von Immunzellen sichtbar zu machen, sind Injektionen in lokalisierten Websites getan wie in Schwanzmuskeln in 48 HPF Embryo.
- Verdünnt das mycobakterielle Inokulum in 1 X PBST (abhängig von der Anzahl der CFUwie in Schritt 2.2.6) bestimmt wird, die 10% roten Phenol, um eine ordnungsgemäße Injektion überprüfen, verabreicht werden.
- Legen Sie eine Mikrokapillare Injektionsnadel mit 5-10 & mgr; l der bakteriellen Impfstoff unter Verwendung eines Microloader Spitze, schließen Sie das Mikroinjektionsnadel in die Halterung der dreidimensionalen Mikromanipulator mit dem Injektor verbunden ist, und brechen Sie die Spitze der Nadel mit feinen Pinzette, um ein zu erhalten Öffnungsdurchmesser von 5-10 um.
- Kalibrieren der Einspritzmenge durch Einstellen der Mikroinjektionsdruck (20-50 hPa) und der Zeit (0,2 Sekunden).
HINWEIS: Die erforderliche Injektionsvolumen wird durch visuelle Bestimmung des Durchmessers eines Tropfens in den Dotter eines Embryos vertrieben kalibriert. - Für Schwanzveneninjektion, positionieren Sie den Embryo mit der ventralen Blick auf die Nadel (wie in Abschnitt 3.2.2 beschrieben) Seite und setzen Sie die Nadelspitze in der Nähe des urogenitalen Öffnung, zur Förderung der Schwanzvene, und drücken Sie vorsichtig die Spitze der Nadel in den Embryo bis sie gerade durchstößt die caudal Venenregion. Geben Sie die gewünschte Lautstärke der bakteriellen Zubereitung, in der Regel 1-3 nl mit jeweils etwa 100 KBE / nl.
- Für die intramuskuläre Injektion, positionieren Sie den Embryo mit Blick auf die Nadel (wie in Abschnitt 3.2.2) der Rückenseite, legen Sie die Nadel über einen Somiten und injizieren ein kleines Volumen (1 nl) Inokulum.
HINWEIS: Wie bei Schwanzvene Injektionen sind auch intramuskuläre Infektionen schwierig zu führen. Es muss darauf geachtet werden, um eine Überladung, die das umliegende Gewebe schädigen können, zu vermeiden. - Am Ende des Einspritzvorgangs sowie die Größe des Inokulums durch Injektion des gleichen Volumens an Bakteriensuspension in einem Tropfen steriler PBST, gefolgt von Plattieren auf 7H10 OADC und Zählen der CFU. Etwa 100 Embryonen können mit einer Nadel injiziert werden.
Hinweis: Da grobe M. abscessus können weiterhin Zuschlagstoffe in der Nadel zu bilden, müssen Injektionen unmittelbar nach der Herstellung der Impfkultur vorgenommen werden. - Übertragen Sie die infizierten fish einzeln in 24-Well-Platten mit 2 ml / Vertiefung Fischwasser und Inkubation bei 28,5 ° C. Embryos mit 1-3 nl 1 X PBST injiziert werden als Kontrollen verwendet werden.
- Ordnungsgemäße Infektion von fluoreszierenden Bakterien in Embryos wird mit einem Fluoreszenzmikroskop überwacht.
5. Generation von Makrophagen-Depleted Embryos
HINWEIS: Die selektive Abreicherung von Makrophagen aus dem Gewebe verwendet wird, um ihren Beitrag und die Rolle während der Infektion zu untersuchen. Um die richtige Erschöpfung der Makrophagen zu visualisieren, ist es empfehlenswert, eine transgene Linie mit fluoreszierenden Makrophagen, wo mCherry gezielt unter der Steuerung des Makrophagen spezifische MPEG1 Promotor 19 ausgedrückt verwenden.
- Lipo-Clodronat-basierte Verfahren
HINWEIS: Die Lipo-Clodronat Verfahren ermöglicht eine selektive Depletion von Makrophagen aus Geweben (aber keine Neutrophile) 19. Diese Verbindung hat weder verändern das Überleben der Embryonen noch affect die Integrität der Bakterien. Ein detailliertes Protokoll zur liposomenverkapseltem Clodronat vorzubereiten zuvor 33 gemeldet.- Bei 24 HPF, dechorionate die Embryonen und Übertragung auf einen "V" -förmigen Injektionsgericht mit Fisch Wasser mit Tricaine ergänzt, um die Embryonen in einem betäubten Zustand, bis zum Ende des Einspritzvorgangs zu erhalten, wie in 3.2.2 beschrieben, gefüllt. Orientierung der Rückenseite nach unten.
- Legen Sie eine Mikrokapillare Injektionsnadel mit liposomenverkapseltem Clodronat (Lipo-Clodronat), schließen Sie das Mikroinjektionsnadel in die Halterung der dreidimensionalen Mikromanipulator und brechen Sie die Spitze der Nadel mit einer feinen Pinzette, ein Trinkgeld Öffnungsdurchmesser von 10 um zu erhalten.
- Um das Einspritzvolumen zu kalibrieren, stellen Sie die Mikroinjektion Druck bis 20 hPa und der Einspritzzeit auf 0,2 sec. Legen Sie die Nadelspitze in der Nähe des urogenitalen Öffnung, zur Förderung der Schwanzvene, und drücken Sie vorsichtig die Spitze der Nadel in dieEmbryo, bis sie gerade durchstößt die Schwanzvene Region und liefern das gewünschte Volumen der Lösung (2-3 nl, 3 mal).
HINWEIS: Die Lipo-Clodronat Suspension ist sehr klebrig und sollte vor der Injektion verwirbelt werden, damit die Blockierung der Kreislauf-System und die Tötung des Embryos. Es ist entscheidend, um mehrere aufeinanderfolgende Injektionen von kleinen Volumina fortzufahren. - Übertragen Sie die Embryonen in 100 mm Petrischalen mit Fischwasser und halten sie bei 28,5 ° C, bis Infektion.
- Kontrollieren Sie die richtige Erschöpfung der Makrophagen durch Fluoreszenzmikroskopie.
HINWEIS: Vollständige Makrophagen-Depletion ist für 4 Tage nach Lipo-clodoronate Verwaltung.
- Morpholino-basierte Verfahren
- Am Tag vor dem Laichen Rasse erwachsenen Zebrafisch, indem 2 Rüden und 1 Hündin von einer Barriere aus Kunststoff in einem Brutraum getrennt.
- Am nächsten Tag ≈ 30 min nach, dass das Licht schaltet sich im Zebrafisch-Anlage, entfernen Sie die Barriere zwischenMännchen und Weibchen. Warten für etwa 20 min nach Beginn der Laich um die Befruchtungsrate zu optimieren. Ernten Sie die Eier und ihre Entwicklung zu verlangsamen, indem sie in einer 100 mm Petrischale mit kaltem blauer Fisch Wasser (4 ° C) gefüllt.
HINWEIS: Die Steuerung des Laich ist von entscheidender Bedeutung für die Morpholinos basierten Experimenten. Morpholino nur bis zu vier Zellen Stufe in die Eier injiziert werden. - Sammeln Sie die Eier mit einer Pipette und hinterlegen Sie die Eier, die in der "U" -förmigen Einspritzkammer mit kaltem blauer Fisch Wasser gefüllt und blockieren Sie die Eier in den Kanälen mit einem hausgemachten Microloader tool.
- Vorbereitung der PU.1 Morpholino Lösung, die 10% der roten Phenol, wie zuvor beschrieben 19. Legen Sie eine Mikrokapillare Injektionsnadel mit dem Morpholino Vorbereitung und schließen Sie das Mikroinjektionsnadel in die Halterung der dreidimensionalen Mikromanipulator, dann brechen Sie die Spitze der Nadel mit feinen Pinzette obtaina Spitzenöffnung Durchmesser von 5-10 & mgr; m.
- Um das Einspritzvolumen zu kalibrieren, stellen Sie die Mikroinjektion Druck auf 20-50 hPa und der Einspritzzeit auf 0,2 sec. Legen Sie die Nadelspitze in der Nähe der Eizelle und drücken Sie vorsichtig die Spitze der Nadel durch die Chorion in das Ei und liefern die gewünschte Morpholino Lösungsvolumen, typischerweise 3-5 nl.
- Nach der Mikroinjektion, übertragen Sie die Eier in eine 100 mm Petrischale in Fisch Wasser und Inkubation bei 28,5 ° C, bis die Infektion Prozedur beginnt.
- Analysieren Sie den richtigen (komplett) Erschöpfung der Makrophagen in PU.1 morphants durch Fluoreszenzmikroskopie bei 30-48 HPF..
HINWEIS: Je nach der injizierten Konzentration kann p u.1 Morpholinos auch die Zahl der frühen Neutrophilen beeinflussen. Um die richtige Erschöpfung der Makrophagen, ohne die Zahl der Neutrophilen zu bestätigen, ist es empfehlenswert, eine doppelt transgenen Zebrafisch-Linie mit fluoreszierenden Makrophagen und Neutrophile mit GFP verwenden (Ausdruck spezifisch durch die MPX-Promotor angetrieben) 19.
6. Bakterienlast Quantifizierung
- Bestimmung von CFU-Enumeration
- Bei dem gewünschten Zeitpunkt, zu sammeln Gruppen von infizierten Embryo (5 pro Bedingungen) in 1,5 ml Mikrozentrifugenröhrchen (1 Embryo / Röhrchen), Kryo-betäuben die Embryonen durch Inkubation auf Eis für 10 min und einschläfern mit einer Überdosis Tricaine (300- 500 mg / l)
- Zweimal waschen die Embryonen mit sterilem Wasser und verzichten sie in ein neues Röhrchen, lyse jeder Embryo mit 2% Triton X-100 in 1 X PBST mit einer 26-G-Nadel und homogenisieren die Aussetzung bis zur vollständigen Lyse verdünnt. Zentrifugieren Sie die Suspension und das Pellet in 1 X PBST mit 0,05% Tween 80 Serielle Verdünnungen der Homogenate werden auf Middlebrook 7H10 OADC plattiert und ergänzt mit BBL MGIT PANTA, wie vom Hersteller empfohlen.
HINWEIS: M. abscessus als anfälliger für NaOH treatment als M. marinum, Dekontamination von Fisch Lysaten ohne Beeinträchtigung M. abscessus Wachstum erfolgreich mit der BBL MGIT PANTA antibiotischen Cocktail erreicht werden. - Die Platten für 4 Tage Inkubation bei 30 ° C und die Zählung Kolonien.
- Bestimmung durch Fluoreszenz Pixel Count (FPC) Messungen in lebenden Embryonen
HINWEIS: Um die bakterielle Belastungen über Fluoreszenzemission zu bestimmen, werden Serienbilder von infizierten Embryonen erworben und Fluoreszenzintensität von FPC (Identifizierung von Bakterien durch Partikelanalyse) gemessen mit einem hausgemachten Makro für die ImageJ Freeware entwickelt. Ein Partikelanalyse erfordert eine binäre Schwarzweißbild, das auf einem Grenzbereich, die Unterscheidung des Fluoreszenzsignals von Interesse aus dem Hintergrund ermöglicht beruht.- Bei dem gewünschten Zeitpunkt, tricain-betäuben infizierten Embryonen (5-10 pro Bedingung) in 35 mm Petrischalen, wie in 3.2.2 beschrieben.
- Entfernen Sie Wasser und submerge die Embryonen und die gesamte Geschirroberfläche mit 1% niedrigschmelzender Agarose in Fisch Wasser, dann seitlich richten Sie die Embryonen. Decken Sie die erstarrte Agarose mit Fisch Wasser mit Tricaine.
- Erwerben Fluoreszenzbilder des gesamten Embryos mit einem Epifluoreszenz-Mikroskop mit einer 10 X Ziel.
HINWEIS: Die Fluoreszenz Bildaufnahme ist ein kritischer Schritt des FPC Messverfahren. Es ist wichtig, um einen kalibrierten Monitor mit einer Farbkalibrierung Sonde verwenden. Einstellen der optimale Zeitpunkt der Belichtung einen minimalen Hintergrund zu erhalten, während der Erfassung verhindert eine Sättigung des Signals. Bilder müssen in einem 8-Bit-TIFF-Format vorliegen. Identische Einstellungen werden während des gesamten Experiments für quantitative Zwecke gehalten. - Vorsichtig die Agarose aus den Embryos mit einem hausgemachten Microloader tool. Diese Embryonen können für nachfolgende Analysen verwendet werden, falls erforderlich. Vor der Quantifizierung der bakteriellen Belastung, jedes Bild wird Qualität gesteuert werden. EinAlysieren Sie die Bilder und die Fluoreszenzintensität zu konvertieren in FPC pro Fisch, öffnen Sie die ImageJ Freeware.
HINWEIS: Die FPC-Wert spiegelt die Bakterienlast wie zuvor mit M. gezeigt marinum 34. - Bestimmung der erforderlichen Schwelle für Bildanalyse unter Verwendung eines Bildes eines nicht-infizierten Embryo (mehrere Steuer Embryonen können verwendet werden, um einen mittleren Schwellenwert erhalten wird). Zum Bild → Stellen → Schwellwert und bewegen Sie den Schieberegler unten im Schwellenfenster nach rechts, bis der Hintergrund komplett schwarz (dh, um einen Hintergrund zu erhalten, sollte bei Null sein). Nehmen Sie den entsprechenden Wert.
- Im Bild J, öffnen Sie die FPC-Makro (Zusatz-Datei) und folgen Sie den Anweisungen: Suchen Sie den Ordner mit Bildern gemessen werden soll und geben Sie dann die Schwelle wie zuvor festgelegt und klicken Sie auf "OK".
HINWEIS: Das Makro subtrahiert automatisch den Hintergrund. Eine Schwelle wird dann angewandt. Floureszierendes Signale identifiziertim Anschluss an die Partikelanalyse Fied. - Kopieren und fügen Sie die Daten aus dem Übersichtsfenster auf die gewünschte Software für die Datenanalyse.
Anmerkung: Im Gegensatz zu den CFU-Bestimmungsverfahren ist die FPC-Methode nicht-invasiv und ermöglicht Wiederverwendung der Embryonen für die nachfolgende Analyse und, was wichtig ist, die Überwachung der Dynamik / Kinetik der bakteriellen Belastung auf einer individuellen Basis. Es ermöglicht daher, die Zahl der Tiere deutlich reduziert, in Übereinstimmung mit ethischen Regeln.
7. Imaging M. abscessus- infizierten Embryonen
- Live-Bildgebung von M. abscessus Infektion
- Halterung Tricaine narkotisiert Embryonen (siehe 3.2.2) in 1% niedrig schmelzender Agarose in einer 35 mm Petrischale vor Epifluoreszenzmikroskopie Beobachtungen. Verwenden Sie eine Bodenschale Glas für invertierten konfokalen Mikroskopie oder in einem Hohlraum Depressionen Rutsche für aufrechte konfokale Mikroskopie. Orientieren den Embryo in die gewünschte Position und Deckeldie erstarrte Agarose mit Fisch Wasser mit Tricaine.
- Verwenden ein Epifluoreszenz-Mikroskop mit einer 10 X Ziel für sequentielle Fluoreszenzerfassung und Transmissionsbilder des gesamten Embryos. Als Alternative kann ein konfokales Mikroskop mit 40-facher oder 63X Ziele, um die Aktivität von Immunzellen nach einer Infektion zu visualisieren.
- Imaging festen M. abscessus infizierten Embryonen
- Euthanize die Embryonen wie in 6.1.1 beschrieben und sie auf 1,5 ml Mikrozentrifugenröhrchen und fixieren Sie die Embryonen in 4% Paraformaldehyd in 1 X PBST für 2 h bei RT oder O / N bei 4 ° C. Paraformaldehyd zu entfernen durch Waschen der Embryos zweimal mit 1 X PBST 10 min.
WICHTIG: Um Fluoreszenz zu erhalten, muss festgelegt Embryonen vor Licht geschützt werden. - Um die Integrität der Gewebe und der Fluoreszenz zu erhalten, werden die Embryos nacheinander in steigender Glycerinkonzentration Lösungen (10, 20, 30, 40 und 50% in 1 X PBST verdünnt) inkubiert, für10 min pro Bedingung.
HINWEIS: Fest Embryonen können für mehrere Monate in 50% Glyzerin bei 4 ° C gelagert werden. - Lag der Embryo in 50% Glycerin in einer Sichtkammer (1B) 31 eingebettet.
- Bild mit 40X oder 63X Ziele auf einem konfokalen Mikroskop.
- Euthanize die Embryonen wie in 6.1.1 beschrieben und sie auf 1,5 ml Mikrozentrifugenröhrchen und fixieren Sie die Embryonen in 4% Paraformaldehyd in 1 X PBST für 2 h bei RT oder O / N bei 4 ° C. Paraformaldehyd zu entfernen durch Waschen der Embryos zweimal mit 1 X PBST 10 min.
Ergebnisse
Obwohl verschiedene anatomische Stellen injiziert 32 werden, sind Schwanzvene Injektionen oft verwendet, um eine systemische Infektion für spätere Analysen einschließlich Überlebensexperimente, bakterielle Belastung Bestimmung Phagozytoseaktivität oder Schnur Bildung zu erzeugen. Injektionen in die Schwanzmuskeln werden verwendet, um die Rekrutierung von Makrophagen an der Stelle der Injektion (3A) zu beurteilen. Zu untersuchen und zu vergleichen, die Virulenz von R- und S-Varianten von ...
Diskussion
Der Zebrafisch hat vor kurzem als eine ausgezeichnete Wirbeltiermodellsystem zur Untersuchung der Dynamik von bakteriellen Infektionen mit breiten Feld und konfokale Bildgebung in Echtzeit 36. Die Kombination aus verteilt mykobakteriellen Suspensionen (Protokoll 2.2) zusammen mit Mikro-Injektionsverfahren (Protokoll 4) ermöglicht reproduzierbare systemische Infektionen und eine spätere Überwachung und Visualisierung des Verlaufs der Infektion mit einem besonderen Fokus auf den bakteriellen Interaktionen mi...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Die Autoren danken K. Kissa für hilfreiche Diskussionen und für die Bereitstellung von Lipo-Clodronat und L. Ramakrishnan für die großzügige Gabe der pTEC27 und pTEC15, die die Expression tdTomato und Wasabi zu ermöglichen sind. Diese Arbeiten sind Teil der Projekte des Französisch National Research Agency (ZebraFlam ANR-10-MIDI-009 und DIMYVIR ANR-13-BSV3-007-01) und Siebte Rahmenprogramm der Europäischen Gemeinschaft (FP7-PEOPLE-2011-ITN) unter Finanzhilfevereinbarung Nr. PITN-GA-2011-289209 für die Marie-Curie Initial Training Network FishForPharma. Wir möchten auch die Vereinigung von Gregory Lemarchal und Vaincre La Mucoviscidose (RF20130500835) für die Finanzierung CM Dupont danken.
Materialien
| Name | Company | Catalog Number | Comments |
| BBL MGIT PANTA | BD Biosciences | 245114 | |
| Bovine Serum Albumin | Euromedex | 04-100-811-E | |
| Catalase from Bovine Liver | Sigma-Aldrich | C40 | |
| Difco Middlebrook 7H10 Agar | BD Biosciences | 262710 | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Sigma-Aldrich | A5040 | |
| Oleic Acid | Sigma-Aldrich | O1008 | |
| Paraformaldehyde | Delta Microscopie | 15710 | |
| Phenol Red | Sigma-Aldrich | 319244 | |
| Tween 80 | Sigma-Aldrich | P4780 | |
| Agar | Gibco Life Technologie | 30391-023 | |
| Low melting agarose | Sigma-Aldrich | ||
| Instant Ocean Sea Salts | Aquarium Systems Inc | ||
| Borosilicate glass capillaries | Sutter instrument Inc | BF100-78-10 | 1 mm O.D. X 0.78 mm I.D. |
| Micropipette puller device | Sutter Instrument Inc | Flamming/Brown Micropipette Puller p-87 | |
| Microinjector | Tritech Research | Digital microINJECTOR, MINJ-D | |
| Tweezers | Sciences Tools inc | Dumont # M5S | |
| Microloader Tips | Eppendorf |
Referenzen
- Brown-Elliott, B. A., Wallace, R. J. Clinical and taxonomic status of pathogenic nonpigmented or late-pigmenting rapidly growing mycobacteria. Clinical Microbiology Reviews. 15 (4), 716-746 (2002).
- Aitken, M. L., Limaye, A., et al. Respiratory outbreak of Mycobacterium abscessus subspecies massiliense in a lung transplant and cystic fibrosis center. American Journal of Respiratory and Critical Care Medicine. 185 (2), 231-232 (2012).
- Gilljam, M., Lindblad, A., Ridell, M., Wold, A. E., Welinder-Olsson, C. Molecular epidemiology of Mycobacterium abscessus, with focus on cystic fibrosis. Journal of Clinical Microbiology. 45 (5), 1497-1504 (2007).
- Roux, A. -. L., Catherinot, E., et al. Multicenter study of prevalence of nontuberculous mycobacteria in patients with cystic fibrosis in France. Journal of Clinical Microbiology. 47 (12), 4124-4128 (2009).
- Lee, M. -. R., Cheng, A., et al. CNS infections caused by Mycobacterium abscessus complex: clinical features and antimicrobial susceptibilities of isolates. The Journal of Antimicrobial Chemotherapy. 67 (1), 222-225 (2012).
- Talati, N. J., Rouphael, N., Kuppalli, K., Franco-Paredes, C. Spectrum of CNS disease caused by rapidly growing mycobacteria. The Lancet Infectious Diseases. 8 (6), 390-398 (2008).
- Medjahed, H., Gaillard, J. -. L., Reyrat, J. -. M. Mycobacterium abscessus: a new player in the mycobacterial field. Trends in Microbiology. 18 (3), 117-123 (2010).
- Griffith, D. E., Girard, W. M., Wallace, R. J. Clinical features of pulmonary disease caused by rapidly growing mycobacteria. An analysis of 154 patients. The American Review of Respiratory Disease. 147 (5), 1271-1278 (1993).
- Nessar, R., Cambau, E., Reyrat, J. M., Murray, A., Gicquel, B. Mycobacterium abscessus: a new antibiotic nightmare. The Journal of Antimicrobial Chemotherapy. 67 (4), 810-818 (2012).
- Sanguinetti, M., Ardito, F., et al. Fatal pulmonary infection due to multidrug-resistant Mycobacterium abscessus a patient with cystic fibrosis. Journal of Clinical Microbiology. 39 (2), 816-819 (2001).
- Griffith, D. E., Aksamit, T., et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. American Journal of Respiratory and Critical Care Medicine. 175 (4), 367-416 (2007).
- Howard, S. T., Rhoades, E., et al. Spontaneous reversion of Mycobacterium abscessus a smooth to a rough morphotype is associated with reduced expression of glycopeptidolipid and reacquisition of an invasive phenotype. Microbiology (Reading, England). 152 (Pt 6), 1581-1590 (2006).
- Chardi, A., Olivares, F., Byrd, T. F., Julián, E., Brambilla, C., Luquin, M. Demonstration of cord formation by rough Mycobacterium abscessus variants: implications for the clinical microbiology laboratory. Journal of Clinical Microbiology. 49 (6), 2293-2295 (2011).
- Byrd, T. F., Lyons, C. R. Preliminary characterization of a Mycobacterium abscessus mutant in human and murine models of infection. Infection and Immunity. 67 (9), 4700-4707 (1999).
- Catherinot, E., Clarissou, J., et al. Hypervariance of a rough variant of the Mycobacterium abscessus type strain. Infection and Immunity. 75 (2), 1055-1058 (2007).
- Catherinot, E., Roux, A. -. L., et al. Acute respiratory failure involving an R variant of Mycobacterium abscessus. Journal of Clinical Microbiology. 47 (1), 271-274 (2009).
- Bernut, A., Le Moigne, V., Lesne, T., Lutfalla, G., Herrmann, J. -. L., Kremer, L. In vivo assessment of drug efficacy against Mycobacterium abscessus using the embryonic zebrafish test system. Antimicrobial Agents and Chemotherapy. 58 (7), 4054-4063 (2014).
- Oh, C. -. T., Moon, C., Jeong, M. S., Kwon, S. -. H., Jang, J. Drosophila melanogaster for Mycobacterium abscessus infection. Microbes and Infection / Institut Pasteur. 15 (12), 788-795 (2013).
- Bernut, A., Herrmann, J. -. L., et al. Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), E943-E952 (2014).
- Dubée, V., Bernut, A., et al. β-Lactamase inhibition by avibactam in Mycobacterium abscessus. Journal of Antimicrobial Chemotherapy. 70 (4), 1051-1058 (2015).
- Torraca, V., Masud, S., Spaink, H. P., Meijer, A. H. Macrophage-pathogen interactions in infectious diseases: new therapeutic insights from the zebrafish host model. Disease Models Mechanisms. 7 (7), 785-797 (2014).
- Alibaud, L., Rombouts, Y., et al. A Mycobacterium marinum TesA mutant defective for major cell wall-associated lipids is highly attenuated in Dictyostelium discoideum and zebrafish embryos. Molecular Microbiology. 80 (4), 919-934 (2011).
- Clay, H., Volkman, H. E., Ramakrishnan, L. Tumor necrosis factor signaling mediates resistance to mycobacteria by inhibiting bacterial growth and macrophage death. Immunity. 29 (2), 283-294 (2008).
- Palha, N., Guivel-Benhassine, F., et al. Real-time whole-body visualization of Chikungunya Virus infection and host interferon response in zebrafish. PLoS pathogens. 9 (9), e1003619 (2013).
- Mostowy, S., Boucontet, L., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri with phagocytes and bacterial autophagy. PLoS pathogens. 9 (9), e1003588 (2013).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cellular Microbiology. 10 (11), 2312-2325 (2008).
- Van der Sar, A. M., Appelmelk, B. J., Vandenbroucke-Grauls, C. M. J. E., Bitter, W. A star with stripes: zebrafish as an infection model. Trends in Microbiology. 12 (10), 451-457 (2004).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O’Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infection and Immunity. 78 (4), 1495-1508 (2010).
- Levraud, J. -. P., Disson, O., et al. Real-time observation of Listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infection and Immunity. 77 (9), 3651-3660 (2009).
- Meijer, A. H., Spaink, H. P. Host-pathogen interactions made transparent with the zebrafish model. Current Drug Targets. 12 (7), 1000-1017 (2011).
- Westerfield, M. . The Zebrafish Book: A Guide for the Laboratory Use of Zebrafish (Danio Rerio). , (2007).
- Benard, E. L., van der Sar, A. M., Ellett, F., Lieschke, G. J., Spaink, H. P., Meijer, A. H. Infection of zebrafish embryos with intracellular bacterial pathogens. Journal of Visualized Experiments. (61), e3781 (2012).
- Van Rooijen, N., Sanders, A. Liposome mediated depletion of macrophages: mechanism of action, preparation of liposomes and applications. Journal of Immunological Methods. 174 (1-2), 83-93 (1994).
- Adams, K. N., Takaki, K., et al. Drug tolerance in replicating mycobacteria mediated by a macrophage-induced efflux mechanism. Cell. 145 (1), 39-53 (2011).
- Ramakrishnan, L. Looking within the zebrafish to understand the tuberculous granuloma. Advances in Experimental Medicine and Biology. 783, 251-266 (2013).
- Davis, J. M., Clay, H., Lewis, J. L., Ghori, N., Herbomel, P., Ramakrishnan, L. Real-time visualization of Mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17 (6), 693-702 (2002).
- Lamason, R. L., Mohideen, M. -. A. P. K., et al. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science (New York, NY). 310 (5755), 1782-1786 (2005).
- Renshaw, S. A., Loynes, C. A., Trushell, D. M. I., Elworthy, S., Ingham, P. W., Whyte, M. K. B. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108 (13), 3976-3978 (2006).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC developmental biology. 7, 42 (2007).
- Takaki, K., Davis, J. M., Winglee, K., Ramakrishnan, L. Evaluation of the pathogenesis and treatment of Mycobacterium marinum in zebrafish. Nature Protocols. 8 (6), 1114-1124 (2013).
- Stoop, E. J. M., Schipper, T., et al. Zebrafish embryo screen for mycobacterial genes involved in the initiation of granuloma formation reveals a newly identified ESX-1 component. Disease Models Mechanisms. 4 (4), 526-536 (2011).
- Carvalho, R., de Sonneville, J., et al. A high-throughput screen for tuberculosis progression. PloS One. 6 (2), e16779 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten