A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
السريع خطوة واحدة الأنزيمية توليف وجميع المائيه تنقية طرهالوز النظائر
In This Article
Summary
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Abstract
معدلة كيميائيا إصدارات طرهالوز، أو نظائرها طرهالوز، لها تطبيقات في علم الأحياء والتكنولوجيا الحيوية، وعلم الأدوية، وغيرها من المجالات. على سبيل المثال، استخدمت نظائرها طرهالوز تحمل علامات كشف للكشف عن المتفطرة السلية، ويمكن أن تكون لها تطبيقات مثل الدرن وكلاء التصوير التشخيصي. كما يجري متابعة الإصدارات مستقرة هيدروليكيا من طرهالوز نظرا لقدرتها على استخدام مثل المحليات غير السعرات الحرارية وكلاء والسلامة البيولوجية. وعلى الرغم من جاذبية هذا الصنف من المركبات لمختلف التطبيقات، لا تزال إمكاناتها التي لم تتحقق نظرا لعدم وجود مسار قوي لإنتاجها. هنا، ونحن التقرير بروتوكول مفصلة لخطوة واحدة التوليف biocatalytic السريع والفعال للنظائرها طرهالوز أن يتجاوز المشاكل المرتبطة التركيب الكيميائي. من خلال الاستفادة من انزيم بالحرارة طرهالوز سينسيز (TreT) من مستحرة متقلبة القضيم، يمكن نظائرها طرهالوز يكون generatإد في خطوة واحدة من نظائرها الجلوكوز والجلوكوز يوريدين ثنائي فسفات في ارتفاع العائد (إلى تحويل الكمي) في 15-60 دقيقة. بروتوكول تنقية غير الكروماتوغرافي بسيط وسريع، والذي يتألف من غسيل الكلى تدور والتبادل الأيوني، ويمكن أن يحقق العديد من نظائرها طرهالوز التركيز المعروفة في محلول مائي في اقل من 45 دقيقة. في الحالات التي لا يزال غير المتفاعل الجلوكوز التناظرية، وتنقية الكروماتوغرافي من الناتج التناظرية طرهالوز لا يمكن أن يؤديها. وعموما، فإن هذا الأسلوب "الخضراء" منصة biocatalytic لتوليف المعجل وتنقية نظائرها طرهالوز تتسم بالكفاءة ويمكن الوصول إليها من غير الكيميائيين. لتجسد تطبيق هذه الطريقة، نحن تصف بروتوكول لتركيب، كل المائية تنقية، وإدارة المستندة إلى طرهالوز انقر الكيمياء التحقيق إلى المتفطرات، والتي استغرق أقل من 1 ساعة وتمكين الكشف عن مضان من المتفطرات. في المستقبل، ونحن نتصور أن من بين أوراسكوم تليكوم القابضةإيه التطبيقات، ويمكن تطبيق هذا البروتوكول إلى التوليف السريع لتحقيقات على أساس طرهالوز لتشخيص السل. على سبيل المثال، لم تدم طويلا نظائرها المعدلة النويدات المشعة طرهالوز (على سبيل المثال، 18 طرهالوز F معدلة) يمكن استخدامها لطرائق التصوير السريرية المتقدمة مثل التصوير المقطعي الطبقي-انبعاث البوزيترون (PET-CT).
Introduction
طرهالوز هو ديساكهارايد متناظرة غير الحد تتكون من اثنين من الأنصاف الجلوكوز التي انضم اليهم 1،1-α، السندات α غليكوزيدية (الشكل 1A). في حين طرهالوز غائب من البشر والثدييات الأخرى، وجدت عادة في البكتيريا والفطريات والنباتات واللافقاريات 1. الدور الأساسي للطرهالوز في معظم الكائنات الحية هو حماية ضد الضغوط البيئية، مثل جفاف 1. وبالإضافة إلى ذلك، بعض مسببات الأمراض البشرية تتطلب طرهالوز لالفوعة، بما في ذلك السل المتفطرة المسببة للمرض السل، الذي يستخدم طرهالوز كوسيط من الحيوي خلية مغلف وبوصفها لبنة لبناء السكرية المناعية 2.
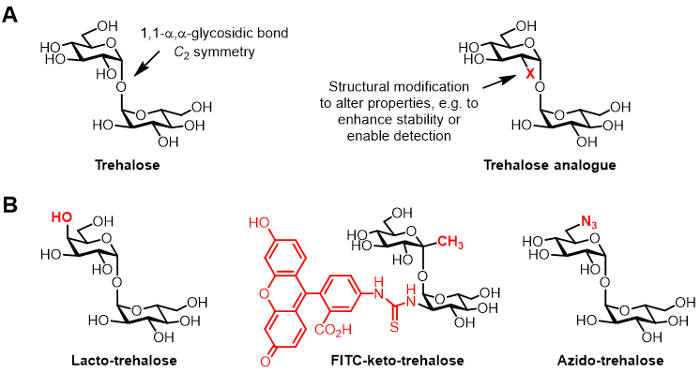
الشكل 1: طرهالوز ونظائرها طرهالوز. (A) هياكل من طرهالوز الطبيعي والتناظرية طرهالوز غير طبيعي، حيث X هو تعديل الهيكلي. (ب) أمثلة على نظائرها طرهالوز عنها في الأدبيات التي لها تطبيقات محتملة في biopreservation وbioimaging.
بسبب بنية فريدة من نوعها، والوظائف الفسيولوجية، وضعت طرهالوز اهتماما كبيرا للاستخدام في الحيوية (تكنو) منطقي والتطبيقات الطبية الحيوية 3. خصائص وقائية من طرهالوز لوحظ في nature- على سبيل المثال، القدرة ضرب بها للمساعدة في الحفاظ على الحياة في النباتات "القيامة" التي خضعت الجفاف الشديد 4 -have حفز الاستخدام الواسع النطاق في تطبيقات biopreservation. وقد استخدم طرهالوز للحفاظ على مجموعة واسعة من العينات البيولوجية، مثل الأحماض النووية والبروتينات والخلايا، والأنسجة 3. على سبيل المثال، يتم استخدام طرهالوز كمادة مضافة للاستقرار في عدد من المستحضرات الصيدلانية رقبعة هي على السوق، بما في ذلك العديد من الأجسام المضادة وحيدة النسيلة المضادة للسرطان 3. كذلك، يتم استخدام طرهالوز كمادة للتحلية في صناعة الأغذية، ويستخدم على نطاق واسع للحفاظ المنتج في كل من الصناعات الغذائية ومستحضرات التجميل. اعتماد طرهالوز لهذه الأنواع من التطبيقات التجارية كان محدودا في البداية بسبب عدم القدرة على الحصول على كميات كبيرة من طرهالوز النقي من مصادر طبيعية أو من خلال التوليف. ومع ذلك، تم مؤخرا بتطوير عملية الأنزيمية كفاءة لإنتاج الاقتصادي للطرهالوز من النشا، والتي حفزت استخدام التجاري الواسع 5.
كيميائيا تعديل مشتقات طرهالوز، المشار إليها هنا باسم نظائرها طرهالوز، اكتسبت اهتماما متزايدا لمختلف التطبيقات (هيكل عام هو مبين في الشكل 1A، أمثلة محددة من نظائرها طرهالوز هو مبين في الشكل 1B) 6. على سبيل المثال، شركة لاكتو-طرهالوز هو التناظرية طرهالوز مع واحدة من وحدات الجلوكوز في استبدال اللبن، وبالتالي مجموعتها الهيدروكسيل 4-موقف ديها تكوين فراغي مقلوب. شركة لاكتو-طرهالوز لديه نفس الخصائص استقرار كما طرهالوز لكن مقاوم للتحلل بفعل الإنزيمات في الأمعاء، مما يجعلها جذابة باعتباره غير السعرات الحرارية الغذائية المضافة 6 و 7.
مصلحتنا المجموعة في نظائرها طرهالوز يتعلق في المقام الأول إلى قيمتها بوصفها تحقيقات ومثبطات المتفطرة محددة. وضعت مجموعة باري وديفيس-كيتو طرهالوز التماثلية فلوريسئين مترافق، واسمه FITC-كيتو-طرهالوز، التي كانت تظهر لتسمية عملية الأيض جدار الخلية الحية من مرض السل م، مما كشف عن طريق مضان المجهر 8. تطوير المختبر Bertozzi أصغر azido-طرهالوز (TreAz) نظائرها التي يمكن تسمية عملية الأيض في جدار الخلية وتكون ديت لاحقاECTED باستخدام النقر كيمياء وتحليل مضان 9. وتشير هذه التطورات إلى إمكانية استخدام المجسات على أساس طرهالوز وكلاء التصوير التشخيصي لمرض السل. كما تم متابعة نظائرها طرهالوز باسم مثبطات م. السل بسبب قدرتها على تعطيل مسارات في البكتيريا التي لا غنى عنها لبقاء والفوعة 10 و 11 و 12.
وحتى الآن، فإن العقبة الرئيسية أمام تطوير نظائرها طرهالوز ل(تكنو) تطبيقات المنطقية والطبية الحيوية هي عدم وجود طرق الاصطناعية فعالة. وهما الطرق التقليدية لإنتاج نظائر طرهالوز تعتمد على التركيب الكيميائي (الشكل 2). ويتضمن أحد المسارات desymmetrization / تعديل طرهالوز الطبيعي، في حين ينطوي على الآخر بدءا من اللبنات أحادي السكاريد functionalized بشكل صحيح وأداء بالغليكوزيل الكيميائية لواقامة 1،1-α، السندات α غليكوزيدية. تلك الأساليب التي تم مؤخرا مناقشتها في مقالات المراجعة 13، 14، قد أثبتت فائدتها لإنجاز تركيب متعددة الخطوات كميات صغيرة من المنتجات الطبيعية التي تحتوي على طرهالوز المعقدة، مثل شحم سلفاتي-1 من السل م 15. ومع ذلك، كلا النهجين غير فعالة بشكل عام، تستغرق وقتا طويلا، لا يمكن الوصول إليها لغير الكيميائيين، وبالإضافة إلى ذلك، لا تعتبر أن تكون صديقة للبيئة. وبالتالي، لتجميع أنواع معينة من نظائرها طرهالوز، هذه الاستراتيجيات ليست مثالية.
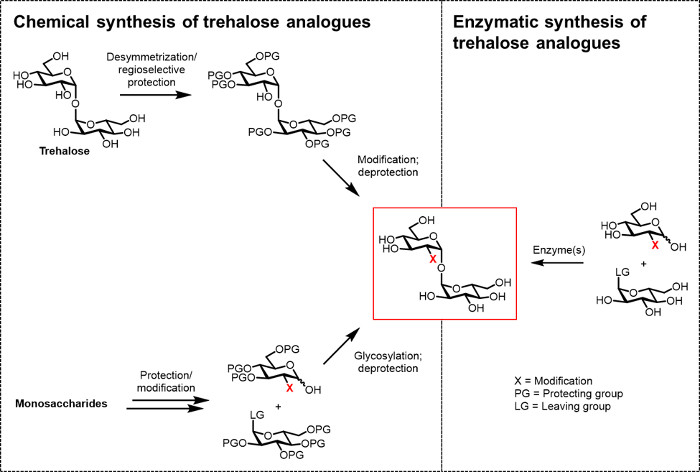
الشكل 2: النهج لتركيب طرهالوز التناظرية. نهج الكيميائية لتركيب طرهالوز التناظرية، كما هو موضح على اليسار، واستخدام إجراءات متعددة الخطوات التي تنطوي على بروتيك الصعبةخطوات نشوئها / deprotection، desymmetrization، و / أو بالغليكوزيل. التوليف الأنزيمية، كما هو موضح على اليمين، يستخدم إنزيم (ق) لتحويل stereoselectively بسيطة، ركائز غير المحمية إلى طرهالوز نظائرها في محلول مائي. بروتوكول الأنزيمية ذكرت هنا يستخدم إنزيم طرهالوز سينسيز (TreT) لتحويل نظائرها الجلوكوز وUDP الجلوكوز إلى نظائرها طرهالوز في خطوة واحدة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
سيكون طريقا biocatalytic فعالة لنظائرها طرهالوز تسهيل الإنتاج، والتقييم، وتطبيق هذه الفئة الواعدة من الجزيئات. في حين أن عملية الأنزيمية التجارية لإنتاج طرهالوز 5 ليست قابلة للتكيف مع توليف نظائرها لأنه يستخدم النشا باعتبارها الركيزة، وهناك مسار آخر السكروزالطرق في الطبيعة التي يمكن استغلالها لتخليق التناظرية طرهالوز. ومع ذلك، والبحث في هذا المجال، الذي استعرض مؤخرا 6، كان محدودا. استخدم تقرير واحد طريقة مستوحاة من الإشريكية القولونية طرهالوز التخليق الحيوى الطريق للوصول إلى التماثلية الفلورية طرهالوز واحد من المقابلة الفلوري الجلوكوز. ومع ذلك، فإن هذا النهج يتطلب نظاما ثلاثة الانزيم الذي الكفاءة وعمومية 8 محدودة. وثمة نهج آخر أنه قد تم استكشافها هو استخدام فسفوريلاز طرهالوز (TREP) في الاتجاه المعاكس، من حيث المبدأ يسمح للتوليف خطوة واحدة من نظائرها طرهالوز من نظائرها الجلوكوز وسكر 1-فوسفات 6 و 16 و 17. على الرغم من أن هذا النهج قد وعد في المستقبل، على حد سواء قلب والاحتفاظ TrePs لديها حاليا عيوب لتخليق التناظرية. على سبيل المثال، TrePs عكس ديك بة باهظهجزيء nsive المانحة (β-D-الجلوكوز 1-الفوسفات) وTrePs الاحتفاظ لديها ضعف عائدات التعبير انزيم / الاستقرار ومحدود الاختلاط الركيزة. وستكون هناك حاجة تحسينات كبيرة (على سبيل المثال، عن طريق الهندسة انزيم) قبل تركيب التناظرية بوساطة TREP-هو عملي.
في الوقت الحاضر، فإن النهج الأكثر عملية لتركيب الأنزيمية من نظائرها طرهالوز هو استخدام طرهالوز سينسيز (TreT) الإنزيم الذي يحول الجلوكوز ويوريدين ثنائي الفوسفات (UDP) -glucose إلى طرهالوز في خطوة واحدة 6. بلغنا مؤخرا استخدام مستحرة متقلبة القضيم TreT-انزيم بالحرارة وأحادي الاتجاه 18 -to تجميع نظائرها طرهالوز من نظائرها الجلوكوز وUDP الجلوكوز (الشكل 3) 19. هذا الانزيم يعمل فقط في اتجاه الاصطناعية ويتجنب مشكلة تدهور طرهالوز وجدت في نظام TREP. هذه خطوة واحدة رد فعل قد يزيد عدد الجياعد أن تكتمل في 1 ساعة، وتم الوصول إلى مجموعة واسعة من نظائرها طرهالوز في ارتفاع العائد (إلى> 99٪ وفقا لما يحدده عالية الأداء اللوني السائل (HPLC)) من ركائز الجلوكوز التناظرية المتاحة بسهولة (انظر الجدول 1 في ممثل النتائج الجزء).
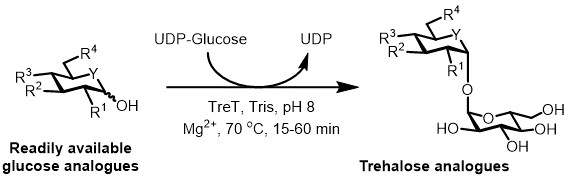
الشكل (3): تحفيز TreT التوليف خطوة واحدة من نظائرها طرهالوز. الانزيم TreT من القضيم T. يمكن أن تنضم stereoselectively نظائرها الجلوكوز المتاحة بسهولة وعن UDP الجلوكوز لتشكيل نظائرها طرهالوز في خطوة واحدة. R 1 -R 4 = متغير التعديل الهيكلي، على سبيل المثال azido-، fluoro-، ديوكسي، thio-، كيميائي فراغي، أو التعديلات النظائر. Y = متجانسة المتغيرة، على سبيل المثال الأكسجين أو الكبريت أو متجانسة المسمى isotopically.
هنا، ونحن نقدم الإعلانبروتوكول etailed لعملية التوليف TreT، بما في ذلك التعبير وتنقية TreT من كولاي، إلى أقصى حد TreT ظروف التفاعل، وتحسين طريقة تنقية التي نفذت تماما في المرحلة المائية. يتيح هذا البروتوكول تعديل التوليف المناسب والفعال وتنقية نظائرها طرهالوز متنوعة على نطاق شبه إعدادي (10-100 ملغ). نحن أيضا لشرح استخدام هذا البروتوكول لإعداد وإدارة التحقيق القائم على طرهالوز إلى المتفطرات في أقل من 1 ساعة، والتي مكنت من الكشف عن مضان السريع للخلايا المتفطرات.
Protocol
1. التعبير وتنقية TreT من TOP10 كولاي
ملاحظة: يرجى الاتصال المؤلفين لطلب TreT، معربا عن E. القولونية سلالة (pBAD TreT البلازميد، التي تحتوي على tret الجينات T. القضيم تحت سيطرة البروتين أراك، تتحول إلى TOP10 كولاي 19) واتفاق لنقل المواد المصاحبة . بروتوكول التالية عادة يعطي العائد البروتين من حوالي 4 ملغم / لتر.
- إعداد ثقافة 3 مل بين عشية وضحاها من TreT، معربا عن كولاي.
- خط TOP10 كولاي تحولت مع ناقلات التعبير pBAD-TreT على مرق استذابة (LB) لوحة آغار تحتوي على 100 ميكروغرام / مل الأمبيسلين.
- احتضان لوحة عند 37 درجة مئوية لمدة حوالي 48 ساعة.
- اختيار مستعمرة واحدة من لوحة وتطعيم 3 مل من LB المتوسطة السائل تحتوي على 100 ميكروغرام / مل الأمبيسلين في أنبوب الثقافة.
- وضع أنبوب في حاضنة تهتز عند 37 & #176؛ ج س 175 دورة في الدقيقة ليلة وضحاها.
- حمل تعبير البروتين في TreT، معربا عن كولاي.
- إضافة 750 مل رائع مرق تستكمل مع 100 ميكروغرام / مل الأمبيسلين إلى 2800 مل Fernbach قارورة الثقافة. نقل 1 مل مرق من القارورة إلى كفيت لاستخدامها لاحقا باعتبارها فارغة.
- إضافة ثقافة 3 مل بين عشية وضحاها ولدت في خطوة 1.1.4 إلى قارورة الثقافة، ثم ضع قارورة في حاضنة ويهز عند 37 درجة مئوية × 200 دورة في الدقيقة. فحص دوري الامتصاصية للثقافة في 600 نانومتر مقابل الفراغ التي تم جمعها في الخطوة 1.2.1.
- مرة واحدة الامتصاصية في 600 نانومتر تصل بين 0.5-1.0، لحث على التعبير TreT بإضافة 750 ميكرولتر من 1 M حل الارابينوز (1 ملي تركيز النهائي) للثقافة. العودة القارورة إلى حاضنة ويهز ليلا 37 درجة مئوية × 200 دورة في الدقيقة.
- بيليه وليز TreT، معربا عن الخلايا كولاي.
- نقل الثقافة إلى البولي بروبلين بottle وأجهزة الطرد المركزي لمدة 15 دقيقة في 4000 x ج في 4 درجات مئوية.
- تجاهل طاف وإعادة تعليق بيليه في 15 مل من الفوسفات مخزنة المالحة (PBS).
- نقل تعليق خلية إلى أنبوب مخروطي 50 مل وأجهزة الطرد المركزي لمدة 15 دقيقة في 4000 x ج في 4 درجات مئوية. تجاهل طاف وإما الشروع في الخلية تحلل (الخطوة 1.3.4) أو تخزين بيليه إلى أجل غير مسمى في -80 درجة مئوية.
- حل 1 مثبط البروتياز قرص صغير في 20 مل من غسل العازلة (50 ملي ناه 2 ص 4، 500 مم كلوريد الصوديوم، و 20 ملي إيميدازول، ودرجة الحموضة 8.0) في أنبوب مخروطي 50 مل.
- نقل غسل العازلة التي تحتوي على مثبطات الأنزيم البروتيني إلى أنبوب مخروطي يحتوي على بيليه. دوامة حتى بيليه هو إعادة تعليق.
- نقل إعادة علقت الخلايا إلى كوب 100 مل وليز خلايا صوتنة (تسلسل نبض 45 ثانية على، 45 ثانية قبالة مع وقت التشغيل من 2 دقيقة و 15 ثانية في اتساع 75 في المئة).
- نقل المحللة إلى أنبوب مخروطي 50 مل المعادنوأجهزة الطرد المركزي لمدة 60 دقيقة في 15000 x ج في 4 درجات مئوية.
- توضيح المحللة قبل المرور عبر حقنة مرشح 0،2-،45 ميكرومتر في أنبوب مخروطي 50 مل.
ملاحظة: تركيز نموذجي من المحللة التي تم الحصول عليها هي 100 ملغ / مل.
- تنقية TreT من E. المحللة خلية القولونية باستخدام بروتين سريع اللوني السائل (FPLC).
- إعداد FPLC مع عمود النيكل تقارب (5 مل حجم السرير). غسل العمود مع 10 مل من الماء منزوع الأيونات أو حتى عمود نظيفة من أي ملوثات. تتوازن العمود باستخدام 20 مل من غسل العازلة (50 ملي ناه 2 ص 4، 500 مم كلوريد الصوديوم، و 20 ملي إيميدازول، ودرجة الحموضة 8.0) بمعدل تدفق من 1 مل / دقيقة.
- تحميل المحللة (20 مل) تم الحصول عليها من الخطوة 1.3.8 على العمود وأزل البروتينات لازال مع غسل العازلة بمعدل تدفق من 1 مل / دقيقة حتى يصل الامتصاصية مستويات الخلفية (مطلوبة عادة 80-100 مل من غسل العازلة) .
- أزل صاحب الموسومة TreT باستخدام خطي زradient من شطف العازلة (50 ملي ناه 2 ص 4، 500 مم كلوريد الصوديوم، و 250 ملي ايميدازول، ودرجة الحموضة 8.0) 1-100٪ أكثر من 60 دقيقة في معدل التدفق من 1 مل / دقيقة. جمع 4 كسور مل حتى مزال TreT والامتصاصية يصل مستوى خط الأساس.
ملاحظة: عادة، يطلب 60 مل من شطف العازلة للأزل البروتين، والبروتين elutes في 60-100٪ النطاق شطف العازلة. تقريبا يتم الحصول على 10-15 مل من TreT نقية في شطف العازلة. - تحديد تركيز TreT عن طريق قياس الامتصاصية في 280 نانومتر ضد فارغة شطف العازلة.
- TreT الصرف في تريس (hydroxymethyl) aminomethane (تريس) العازلة غسيل الكلى.
- بعد إعداد أنابيب غسيل الكلى وفقا لتعليمات الشركة الصانعة، رئيس الوزراء من قبل الشطف بالماء منزوع الأيونات ثم عازلة تريس (50 ملي تريس، 300 مم كلوريد الصوديوم، ودرجة الحموضة 8.0).
- تحميل عينة TreT في أنابيب غسيل الكلى باستخدام حقنة وإبرة حادة. Dialyze بين عشية وضحاهاgainst 2 لتر من العازلة تريس.
- تحديد تركيز TreT عن طريق قياس الامتصاصية في 280 نانومتر ضد فارغة تم جمعها من غسل الغسيل الكلوي.
- نقل الحل TreT إلى أنبوب مخروطي 50 مل، والشروع في تركيب التناظرية طرهالوز (الخطوة 2) أو تخزين الإنزيم في 4 درجات مئوية.
ملاحظة: TreT هو بروتين بالحرارة. تم تخزين TreT العازلة في تريس في 4 درجات مئوية لعدة أشهر دون مراعاة خسائر كبيرة في النشاط.
2. خطوة واحدة توليف طرهالوز النظائر عن طريق TreT أنزيم
ملاحظة: يصف بروتوكول أدناه نطاق رد الفعل على أساس 4 حجم مل، والتي يمكن أن توفر ما يقرب من 15-30 ملغ من التناظرية طرهالوز اعتمادا على كفاءة التفاعل والوزن الجزيئي للمنتج. يمكن زيادتها مكونات رد فعل على الحصول على أكثر أو أقل التناظرية طرهالوز إذا رغبت في ذلك.
- إضافة التماثلية الجلوكوز (0.080 مليمول، وكتلة تعتمد على الوزن الجزيئي)، UDP الجلوكوز (0.160 مليمول، 97.6 ملغ)، وMgCl 2 (0.080 مليمول، 16.3 ملغ) إلى أنبوب مخروطي 15 مل. وتركيزات النهائية لهذه المكونات أن يكون 20 مم، 40 مم، و 20 مم، على التوالي.
- إضافة TreT في المخزن تريس (تم الحصول عليها من الخطوة 1.5.4)، وإذا لزم الأمر، حجم مناسب من العازلة تريس (50 ملي تريس، 300 مم كلوريد الصوديوم، ودرجة الحموضة 8.0) لتحقيق تركيز انزيم النهائي من 300 ميكروغرام / مل والنهائي حجم 4 مل. الماصة الخليط صعودا وهبوطا بلطف أو عكس الأنبوب إلى حل المواد الصلبة.
- احتضان رد الفعل عند 70 درجة مئوية مع اهتزاز عند 300 دورة في الدقيقة لمدة 1 ساعة، ثم وضع أنبوب على الجليد لتبريد.
3. تنقية طرهالوز النظائر من الخام خليط التفاعل الانزيمي
- قبل شطف وحدة تصفية الطرد المركزي (الاسمي حد الوزن الجزيئي (NWML) 10 كيلو دالتون) لإزالة أثر الجلسرين في الغشاء بإضافة 3 مل من الماء منزوع الأيونات إلى وحدة تصفية الطرد المركزي والطرد المركزي في 3000 x ج حتى يمر كل السائل من خلال فلترفي أنبوب (حوالي 20 دقيقة). كرر مرتين إضافية. إتمام هذه الخطوة مباشرة قبل أو أثناء عملية التفاعل (الخطوة 2.3).
- بعد تبريد خليط التفاعل الأنزيمي (تم الحصول عليها من الخطوة 2.3)، ونقل إلى وحدة تصفية الطرد المركزي تشطف مسبقا. شطف أنبوب تفاعل مع 1 مل من الماء منزوع الأيونات ونقل إلى وحدة تصفية الطرد المركزي. تكرار الشطف من الأنبوب رد فعل لاسترداد الحد الأقصى من المنتجات.
- أجهزة الطرد المركزي في وحدة تصفية الطرد المركزي في 3000 x ج حتى يمر كل السائل من خلال مرشح في أنبوب (حوالي 20 دقيقة). شطف الغرفة العليا من وحدة تصفية الطرد المركزي مع 3 مل من الماء منزوع الأيونات وأجهزة الطرد المركزي في 3000 x ج حتى يمر كل السائل من خلال مرشح في أنبوب (حوالي 20 دقيقة). تكرار الشطف لاسترداد الحد الأقصى من المنتجات.
- تجاهل مجلس الشيوخ وحدة تصفية الطرد المركزي. إضافة مختلط السرير راتنج التبادل الأيوني (3 ز) إلى الترشيح في الجزء السفلي من الأنبوب (المجلد الترشيح نموذجيأوميا هو 8-15 مل اعتمادا على عدد من يشطف). يقلب في درجة حرارة الغرفة لمدة 1 ساعة مع شريط مغناطيسي بسرعة كافية للحفاظ على الخرز الراتنج مع وقف التنفيذ في الحل.
- صب طاف وتصفية لإزالة الراتنج. إضافة 5 مل من الماء منزوع الأيونات لشطف الراتنج المتبقية. صب طاف وتصفية ذلك، والجمع بين ذلك مع حل المنتج من الصفق الأول. تكرار الشطف من الراتنج لاسترداد الحد الأقصى من المنتجات.
- تحليل رد فعل من جانب اللوني طبقة رقيقة (TLC) أو HPLC لتحديد ما إذا تم تحقيق التحول الكامل للالتماثلية الجلوكوز بدءا المادية للمنتج طرهالوز التناظرية. راجع الخطوة 4.1 لتحليل TLC وخطوة 4.2 لتحليل HPLC.
- إزالة المياه بالتجفيد أو التبخر الدوارة لإعطاء المنتج المجفف. إذا لوحظ لا مثيل الجلوكوز غير المتفاعل خلال TLC أو تحليل HPLC، وتنقية بواسطة اللوني غير ضرورية. وزن المنتج للحصول على yie رد فعلدينار وتنفيذ الرنين المغناطيسي النووي (NMR) الطيفي التحليل (الخطوة 4.3) لتأكيد هيكل المنتجات والنقاء.
- إذا لوحظ المتفاعل التماثلية الجلوكوز خلال تحليل TLC، فصلها عن التناظرية طرهالوز باستخدام عمود الحجم الاستبعاد.
- إعداد العمود 1 × 100 سم تحتوي على والإعلام P2 بولي أكريلاميد حجم حبة استبعاد منزوع الأيونات الماء المشبع خارج غرامة وفقا لتعليمات الشركة الصانعة.
ملاحظة: عمود حجم الإقصاء يمكن إعادة استخدامها بعد الغسيل مع الماء منزوع الأيونات. - إعادة حل ناتج التفاعل الأنزيمي المجففة (تم الحصول عليها من الخطوة 3.7) في 0.5 مل من الماء منزوع الأيونات. تطبيق حل المنتج إلى العمود استبعاد حجم يدويا أو باستخدام محول تدفق العمود. شطف القارورة التي تحتوي على الناتج الخام مع 0.5 مل مياه آخر منزوع الأيونات، وتحميله في عمود حجم الإقصاء.
- أزل المنتج مع الماء منزوع الأيونات بواسطة تدفق الجاذبية وجمع أجزاء من حوالي 2 مترحجم L.
- تحليل الكسور TLC (الخطوة 4.1). تجميع الكسور التي تحتوي النقي التناظرية طرهالوز.
- إزالة المياه بالتجفيد أو التبخر الدوارة لإعطاء المنتج المجفف. وزن المنتج للحصول على العائد رد فعل، والشروع في تحليل الرنين المغناطيسي (راجع الخطوة 4.3).
- إعداد العمود 1 × 100 سم تحتوي على والإعلام P2 بولي أكريلاميد حجم حبة استبعاد منزوع الأيونات الماء المشبع خارج غرامة وفقا لتعليمات الشركة الصانعة.
4. تحليل طرهالوز التماثلية المنتجات
- أداء طبقة رقيقة اللوني (TLC) تحليل رد فعل TreT.
ملاحظة: يمكن أيضا أن هذا الإجراء يمكن استخدامها لتحليل حجم كسور العمود الاستبعاد. قد يكون من الضروري أن تركز خليط التفاعل أو عمود الكسور السابقة لتحليل TLC لمراقبة تلطيخ مركب على لوحة TLC.- الممرات علامة على سطح لوحة TLC مع قلم رصاص وتطبيق الحليلة (ق) ومعيار ذات الصلة (ق) إلى الممرات المناسبة، بما في ذلك معيار التماثلية الجلوكوز، والمعيار طرهالوز التناظرية (إن وجدت)، وخليط التفاعل (أو الكسور التي تم جمعها من حجم البريدxclusion تنقية عمود)، وشارك في الحال. بعد تطبيق كل عينة إلى لوحة TLC، والسماح لوحة لتجف.
ملاحظة: للحصول على تحليل رد فعل، ويطبق عادة 2 ميكرولتر من العينة إلى لوحة TLC. - تطوير لوحة TLC باستخدام ن -butanol / الإيثانول / الماء منزوع الأيونات (5: 3: 2).
- تجفيف لوحة TLC المتقدمة، ثم تراجع في 5٪ H 2 SO 4 في الإيثانول (السكر وصمة عار) والحرارة على طبق ساخن على الإعداد عالية حتى يمكن تصور البقع التي تحتوي على السكر (عادة 5 دقائق).
- الممرات علامة على سطح لوحة TLC مع قلم رصاص وتطبيق الحليلة (ق) ومعيار ذات الصلة (ق) إلى الممرات المناسبة، بما في ذلك معيار التماثلية الجلوكوز، والمعيار طرهالوز التناظرية (إن وجدت)، وخليط التفاعل (أو الكسور التي تم جمعها من حجم البريدxclusion تنقية عمود)، وشارك في الحال. بعد تطبيق كل عينة إلى لوحة TLC، والسماح لوحة لتجف.
- لتحليل HPLC مخاليط رد فعل TreT باستخدام أي نظام HPLC قادرة على فصل وكشف عن الكربوهيدرات. ويشمل هذا البروتوكول فصل الكربوهيدرات باستخدام عمود HPLC أمينو والكشف باستخدام معامل الانكسار.
- إرفاق أمينو العمود (4.6 × 250 مم) التي تحتوي على الحرس قبل العمود إلى HPLC.
- تتوازن أمينو العمود مع 80٪ الأسيتونتريل في الماء منزوع الأيونات بمعدل تدفق 0.4 مل / دقيقة.
- تحميل الحل من ناتج التفاعل (أو معيار) على عمود أمينو.
- أزل المنتج (أو معيار) مع 80٪ الأسيتونتريل في الماء منزوع الأيونات بمعدل تدفق 0.4 مل / دقيقة ودرجة حرارة العمود من 50 درجة مئوية. عادة، وقت التشغيل المستخدم هو 40 دقيقة.
ملاحظة: يمكن أن يتم الكشف عن كل من مادة الجلوكوز التناظرية تبدأ والمنتج التناظرية طرهالوز بواسطة معامل الانكسار، رغم أن هناك طرقا أخرى مثل التبخر الكشف عن تشتت الضوء (ELSD) يمكن استخدامها. مستغلا ظروف وصفها، نظائرها الجلوكوز عادة أزل بين 10-15 دقيقة وطرهالوز نظائرها أزل بين 15-25 دقيقة.
- تحليل NMR من نظائرها طرهالوز تنقيته.
- حل التناظرية طرهالوز النقي في D 2 O (700 ميكرولتر) ونقل الحل إلى أنبوب الرنين المغناطيسي.
- الحصول على 1 H و 13 الأطياف C NMR وفقا لبروتوكولات منشأة NMR المناسبة.
معشوقة = "jove_title"> 5. تطبيق توليفها TreT-طرهالوز النظائر إلى الكشف عن مايكوباكتيريا
- تجميع وتنقية، وإدارة 6 TreAz لم اللخنية (Msmeg).
- إضافة 6 azido-6-ديوكسي غلوكوبيرانوز (6 GlcAz، 0.020 ملمول، 4.1 ملغ)، UDP الجلوكوز (0.040 مليمول، 24.4 ملغ)، وMgCl 2 (0.020 ملمول، 4.1 ملغ) إلى أنبوب مخروطي 15 مل.
- إضافة TreT في المخزن تريس (تم الحصول عليها من الخطوة 1.5.4) لتحقيق تركيز انزيم النهائي من 300 ميكروغرام / مل والحجم النهائي من 1 مل. الماصة الخليط صعودا وهبوطا بلطف أو عكس الأنبوب إلى حل المواد الصلبة.
- احتضان رد الفعل عند 70 درجة مئوية مع الهز لمدة 15 دقيقة.
- تمييع خليط التفاعل الأنزيمي مع 3 مل من الماء منزوع الأيونات وتحويلها إلى ما قبل غسلها وحدة تصفية الطرد المركزي (NMWL 10 كيلو دالتون). أجهزة الطرد المركزي وحدة التصفية في 3000 x ج حتى أكثر من السائل يمر عبر مرشح في أنبوب، ما يقرب من 10 دقيقة.
- عشر تخلصيالبريد الغرفة العليا من وحدة تصفية الطرد المركزي. إضافة مختلط السرير راتنج التبادل الأيوني (0.75 ز) إلى أنبوب ويقلب / هزة في درجة حرارة الغرفة لمدة 25 دقيقة. صب طاف وتصفية لإزالة الراتنج.
ملاحظة: خطوات 5.1.1-5.1.5 توفير محلول مائي من 6 azido-طرهالوز (6 TreAz) في حوالي 5 ملم التركيز في أقل من 1 ساعة. ويقدر تركيز 5 مم على أساس تحويل كمية من الركيزة لمنتج والتخفيف الذي يأخذ الأماكن خلال خطوات تنقية، على افتراض فقدان الحد الادنى من المنتج خلال هذه الخطوات. الحل يمكن أن يكون معقم تصفيتها قبل بالإضافة إلى عينة بيولوجية إذا رغبت في ذلك. - إضافة حجم مناسب من حل المنتج 6 TreAz إلى ثقافة سجل مرحلة من م. اللخنية (Msmeg)، وعادة لتحقيق وحدة الثقافة النهائي من 100-1،000 ميكرولتر وتركيز 6 TreAz النهائي ~ 25 ميكرومتر. احتضان الخلايا عند 37 درجة مئوية لمدة المبلغ المطلوب من الوقت، وعادة 60 دقيقة.
- أداء انقر الكيمياء لتصريف وfluorophore إلى الخلايا المسمى أزيد. في هذا البروتوكول، واستخدام المحفز النحاس و-أزيد آلكاين cycloaddition (CuAAC) لتقديم fluorophore إلى أزيدات سطح الخلية في Msmeg.
- الطرد المركزي الخلايا في 3900 x ج لمدة 5 دقائق، ثم غسل الخلايا مع برنامج تلفزيوني يحتوي على 0.5٪ ألبومين المصل البقري. كرر مرتين.
- إعادة تعليق الخلايا مكعبات في 4٪ شبه الفورمالديهايد في برنامج تلفزيوني لمعالجتها. بعد تفرخ لمدة 10 دقيقة، كرر الخطوة 5.2.1 لغسل الخلايا.
- اعادة تعليق الخلايا مكعبات في 138 ميكرولتر برنامج تلفزيوني.
- إضافة 3 ميكرولتر من 1 ملم حل سهم آلكاين-carboxyrhodamine 110 (آلكاين-488) في DMSO.
- إضافة 3 ميكرولتر من 60 ملي حل الأسهم الطازجة من أسكوربات الصوديوم في الماء منزوع الأيونات.
- إضافة 3 ميكرولتر من 6.4 ملي حل الأوراق المالية من تريس [(1-البنزيل-1H-1،2،3-triazol-4-YL) الميثيل] أمين (TBTA) في ثالثي -butanol / ثنائي ميثيل سلفوكسيد (DMSO) 4: 1.
- إضافة 3 & #956، L من 50 ملي حل الأوراق المالية من كبريتات النحاس 4 في الماء منزوع الأيونات.
- الماصة تعليق خلية صعودا وهبوطا، ثم احتضان في الظلام في درجة حرارة الغرفة لمدة 30 دقيقة.
- كرر الخطوة 5.2.1 لغسل الخلايا. إعادة تعليق الخلايا في 150 ميكرولتر برنامج تلفزيوني.
- لتحليل مضان الخلوي. في هذا البروتوكول، واستخدام المجهر مضان لتصور مضان الخلوي للMsmeg المسمى.
- إضافة 10 ميكرولتر من الخلايا البكتيرية مع وقف التنفيذ في برنامج تلفزيوني على شريحة المجهر ونشر طفيفة السائل إلى طبقة رقيقة باستخدام حافة ساترة. السماح للهواء الجاف في الظلام.
- إضافة 10 ميكرولتر من المتوسطة المتزايدة على عينة المجففة، ثم وضع غطاء ينزلق على عينة وتطبيق لاصق (على سبيل المثال، وطلاء الأظافر) إلى شل.
- صورة الشرائح باستخدام المجهر مضان في التكبير 100X.
النتائج
T. القضيم تم الحصول TreT من كولاي في العائد من حوالي 4 ملغ / لتر باستخدام تقنيات التعبير البروتين وتنقية القياسية. وكان من النيكل تقارب خطوة اللوني واحدة كافية لتنقية TreT من E. القولونية المحللة (يظهر أثر FPLC تمثيلي في الشكل 4). كما أن...
Discussion
نظائرها طرهالوز لديها القدرة على التأثير في مختلف المجالات، من الحفاظ على المواد الغذائية والأدوية لتشخيص وعلاج الالتهابات الجرثومية 6. طرق التركيب الكيميائي متعددة الخطوات الموجودة هي مفيدة لإنتاج نظائر طرهالوز معقدة مع مواقع متعددة من التعديل (على
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Materials
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
References
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved