Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрое Одношаговый ферментативный синтез и All-водный Очистка трегалозных Аналогов
В этой статье
Резюме
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Аннотация
Химически модифицированные версии трегалозы или трегалозных аналоги, применение в биологии, биотехнологии и фармацевтической науки, среди других областях. Например, трегалоза аналоги , несущие обнаруживаемые метки были использованы для выявления микобактерий туберкулеза и могут найти применение как туберкулез диагностических средств визуализации. Гидролитически стабильные версии трегалозы также преследуют из-за их потенциал для использования в качестве не-калорийность подсластителей и биозащитные агентов. Несмотря на привлекательность этого класса соединений для различных областей применения, их потенциал остается нереализованным из-за отсутствия надежного маршрута для их производства. Здесь мы приводим подробный протокол для быстрого и эффективного одностадийного биокаталитическом синтеза аналогов трегалозных, который обходит проблемы, связанные с химическим синтезом. Благодаря использованию термостабильный трегалоза - синтазы (Tret) фермент из Thermoproteus Tenax, аналоги трегалоза может быть Generatе изд в одну стадию из аналогов глюкозы и уридин дифосфат глюкозы с высоким выходом (до количественной конверсии) в пределах 15-60 мин. Простой и быстрый без хроматографического протокол очистки, который состоит из спин-диализа и ионного обмена, могут доставить много аналогов трегалозу известной концентрации в водном растворе в качестве лишь 45 мин. В тех случаях, когда все еще остается непрореагировавший аналог глюкозы, хроматографической очистки трегалозы аналогового продукта может быть выполнена. В целом, этот метод обеспечивает «зеленый» биокаталитической платформу для ускоренного синтеза и очистки аналогов трегалозных, который является эффективным и доступным для не-химикам. Чтобы проиллюстрировать применимость этого метода, мы опишем протокол для синтеза, все-водной очистки, а также введение трегалозной на основе клик химии зонда к микобактерий, все из которых заняло менее 1 час и позволило флуоресцентной детекции микобактерий. В дальнейшем мы предполагаем, что среди дрэр приложений, этот протокол может быть применен к быстрому синтезу трегалозы на основе зондов для диагностики туберкулеза. Например, короткоживущие аналоги радионуклид модифицированного трегалоза (например, 18 F-модифицированный трегалоза) могут быть использованы для продвинутых методов клинической визуализации , таких как позитронно - эмиссионная томография-компьютерной томографии (ПЭТ-КТ).
Введение
Трегалоза представляет собой симметричную невосстанавливающих дисахарид , состоящий из двух глюкозных остатков, которые соединены с помощью 1,1-a, α-гликозидной связи (фиг.1А). В то время как трегалоза отсутствует у людей и других млекопитающих, он встречается обычно у бактерий, грибов, растений и беспозвоночных животных 1. Основная роль трегалозы в большинстве организмов является защита от экологических стрессов, таких как высыханию 1. Кроме того, некоторые патогены человека требуют трегалозу вирулентности, в том числе туберкулеза , вызывающих микобактерий туберкулеза, который использует трегалозу в качестве медиатора биосинтеза клеточной оболочки и в качестве строительного блока для строительства иммуномодулирующих гликолипидов 2.
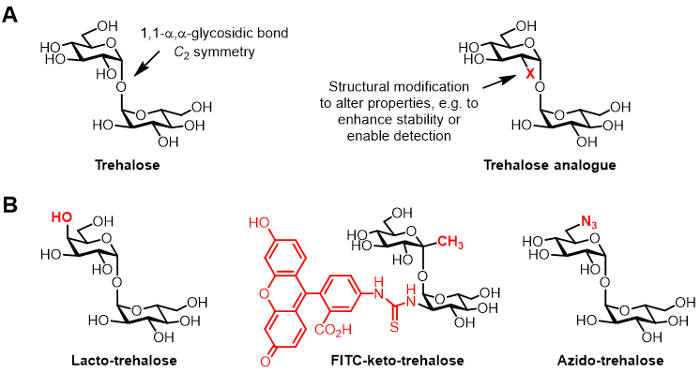
Рисунок 1: Трегалозы и трегалоза аналоги. (A) Структуры натурального трегалозы и неестественным трегалозной аналог, где Х представляет собой структурную модификацию. (B) Примеры аналогов трегалозных , описанных в литературе , которые имеют потенциальное применение в biopreservation и биоимиджинга.
Благодаря своей уникальной структуре и физиологических функций, трегалоза привлекла значительное внимание для использования в био (техно) логических и биомедицинских приложений 3. Защитные свойства трегалозы , наблюдаемого в например , природа - , его поразительная способность помогать поддерживать жизнь в «воскрешения» растений, которые подверглись крайнее обезвоживание 4 -Иметь стимулировало его широкое применение в biopreservation приложениях. Трегалозы использовался для сохранения широкого спектра биологических образцов, таких как нуклеиновые кислоты, белки, клетки, ткани и 3. Например, трегалоза используется в качестве стабилизирующей добавки в ряде фармацевтических тшляпы находятся на рынке, в том числе несколько противораковых моноклональных антител 3. Как хорошо, трегалоза используется в качестве подсластителя в пищевой промышленности, и он широко используется для сохранения продукта как в пищевой и косметической промышленности. Принятие трегалозы для этих типов коммерческих приложений был изначально ограничена невозможностью получить достаточные количества чистого трегалозы из природных источников или за счет синтеза. Тем не менее, недавно был разработан эффективный ферментативный процесс для экономичного производства трегалозы из крахмала, которое стимулировало его широкое коммерческое использование 5.
Химически модифицированные производные трегалозы, называемые здесь как аналоги трегалозу, приобрели все большее внимание для различных областей применения (общая структура , показанная на рисунке 1А; конкретные примеры аналогов трегалозных , показанных на рисунке 1В) 6, Например, лакто-трегалоза представляет собой трегалозу аналог с одним из ее звеньев глюкозы заменены галактозы, таким образом, его 4-положении гидроксильной группы имеет перевернутую стереохимическую конфигурацию. Лакто-трегалоза обладает теми же свойствами, что и стабилизирующие трегалозы , но устойчив к разложению под действием кишечных ферментов, что делает его привлекательным в качестве некалорийного пищевой добавки 6, 7.
Интерес нашей группы в аналогах трегалозных прежде всего относится к их стоимости в качестве микобактерий специфических зондов и ингибиторов. Группы Барри и Дэвис разработал флуоресцеина-конъюгированные кето-трегалоза аналог, названный ФИТЦ-кето-трегалозы, который был показан на метаболически маркировать клеточную стенку живых микобактерий туберкулеза, что позволяет его обнаружение с помощью флуоресцентной микроскопии 8. Лаборатория Bertozzi разработала меньший азидо-трегалозу (TreAz) аналоги, которые могут метаболически маркировать клеточную стенку, а затем быть Detected с использованием химических реактивов кнопкой мыши и флюоресцентного анализа 9. Эти достижения указывают на возможность использования трегалозу на основе зондов в качестве диагностических средств формирования изображений для туберкулеза. Аналоги трегалозы также преследовало в качестве ингибиторов микобактерий туберкулеза из - за их потенциала для разрушения путей в бактерии , которые имеют важное значение для жизнеспособности и вирулентности 10, 11, 12.
До сих пор главным препятствием на пути к разработке аналогов трегалозу для био (техно) логических и биомедицинских приложений является отсутствие эффективных методов синтеза. Две традиционные пути к производству аналогов трегалозу полагаются на химического синтеза (рисунок 2). Один маршрут включает в себя desymmetrization / модификации природных трегалозы, в то время как другая включает в себя, начиная с надлежащим образом функционализированных моносахарида строительных блоков и проведение химического гликозилирования кподделать 1,1-a, a-гликозидной связи. Эти подходы, которые недавно были обсуждены в обзорных статьях 13, 14, оказались полезными для реализации многоступенчатый синтез небольших количеств сложных трегалозных содержащих натуральные продукты, такие как sulfolipid-1 от микобактерий туберкулеза 15. Тем не менее, оба подхода, как правило, неэффективно, отнимает много времени, недоступных для не-химикам, и, кроме того, не считается экологически чистым. Таким образом, для синтеза некоторых типов трегалозных аналогов, эти стратегии не являются идеальными.
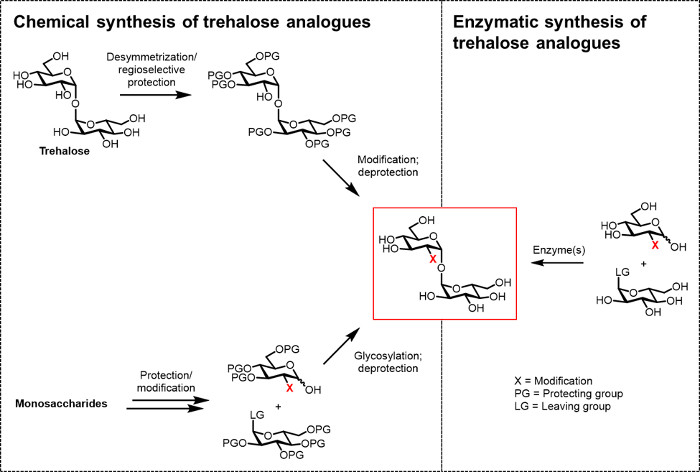
Рисунок 2: Подходы к трегалоза аналогового синтеза. Химические подходы к трегалоза аналогового синтеза, показанный на левой стороне, использовать многоэтапные процедуры, которые включают сложную ProtecТион / снятия защиты, desymmetrization, и / или гликозилирования шаги. Ферментативный синтез, показанный справа, использует фермент (ы) для стереоселективного преобразования простых, незащищенные субстратов трегалозных аналогов в водном растворе. Протокол ферментативный сообщаемые здесь используется трегалоза-синтазы (Tret) фермент для преобразования аналогов глюкозы и УДФ-глюкозы в аналоги трегалозных в одну стадию. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Эффективный биокаталитическая путь к трегалозных аналогам будет способствовать производству, оценки и применения этого перспективного класса молекул. В то время как коммерческий энзимный процесс для производства трегалозы 5 не адаптируется к синтезу аналогов , так как он использует крахмал в качестве субстрата, существуют другие биосинтетические путипути в природе, которые могут быть использованы злоумышленником для трегалозной аналогового синтеза. Тем не менее, исследования в этой области, который недавно был рассмотрен 6, носит ограниченный характер . В одном из докладов был использован метод , вдохновленный кишечной палочки трегалозной пути биосинтеза доступ к одному Фтор-трегалоза аналог из соответствующего фтор-глюкозы. Тем не менее, этот подход требует системой трех фермента , который имеет ограниченную эффективность и общностью 8. Другой подход , который был исследован, чтобы использовать трегалозу фосфорилазы (Trep) в обратном направлении, что , в принципе , позволяет одношагового синтеза аналогов трегалозных от аналогов глюкозы и глюкозо-1-фосфат 6, 16, 17. Хотя такой подход может иметь будущее обещание, оба инвертирование и удерживающие TrePs в настоящее время имеют свои недостатки для аналогового синтеза. Например, обращающие TrePs имеют непомерно EXPEонительных молекула-донор (β-D-глюкоза-1-фосфата) и фиксирующее TrePs имеют плохой выход экспрессии фермента / стабильность и ограниченную распущенность субстрата. Значительные улучшения (например, посредством фермента инженерии) будут необходимы прежде , чем TREP-опосредованной аналогового синтеза является практичным.
В настоящее время наиболее практичным подходом для ферментативного синтеза аналогов трегалозных является использование трегалоза - синтазы (Tret) фермент, преобразующий глюкозу и уридин дифосфат (UDP) , -глюкозы в трегалозу в одном шаге 6. Недавно мы сообщали об использовании Thermoproteus TENAX Tret-термостабильной и однонаправленной фермента 18 -в синтезировать аналоги трегалозу от аналогов глюкозы и UDP-глюкозы (Рисунок 3) 19. Этот фермент действует только в синтетическом направлении и позволяет избежать проблемы деградации трегалозы, обнаруженных в системе Trep. Это одна стадия реакции Клd быть завершена в течение 1 часа, и широкое разнообразие аналогов трегалозных были доступны с высоким выходом (до> 99% , как определено с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ)) из легко доступных аналоговых глюкозы подложках (см таблицу 1 в репрезентативных результатов раздел).
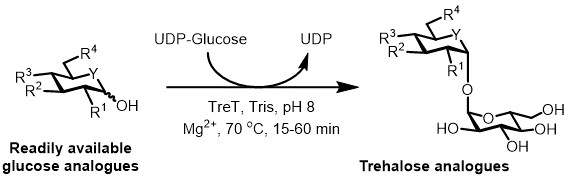
Рисунок 3: Tret катализируемой одностадийного синтеза аналогов трегалозных. Tret фермент из T. Tenax может стереоселективного присоединиться к легкодоступных аналоги глюкозы и УДФ-глюкозы с образованием аналогов трегалозы в одном шаге. R 1 -R 4 = Переменный структурная модификация, например azido-, фтор-, дезокси-, тио-, стереохимическая или изотопных модификаций этикеток; Y = переменная гетероатом, например, кислород или серу, или меченные изотопами гетероатомом.
Здесь мы предоставляем объявлениеetailed протокол для процесса синтеза Tret, в том числе экспрессии и очистки Tret из E.coli, оптимизированные Tret условия проведения реакции, и усовершенствованный способ очистки , который осуществляют полностью в водной фазе. Этот модифицированный протокол позволяет целесообразный и эффективный синтез и очистку разнообразных аналогов трегалозных на полупрепаративной шкале (10-100 мг). Мы также продемонстрировать использование этого протокола для подготовки и введения трегалозу на основе зонда для микобактерий менее чем за 1 час, что позволило быстрое обнаружение флуоресценции клеток микобактерий.
протокол
1. Экспрессия и очистка Tret от Top10 кишечной палочки
Примечание: Пожалуйста , свяжитесь с авторами , чтобы просить Tret-выражающую E.coli штамма (pBAD Tret плазмиду, содержащую ген Tret Т. Tenax под контролем белка AraC, трансформированного в Top10 E.coli , 19) и соглашение о передаче в сопроводительный материал , Следующий протокол обычно дает выход белка приблизительно 4 мг / л.
- Готовят 3 мл ночной культуры Tret экспрессирующих E.coli.
- Серия Top10 кишечной палочки , трансформированные вектором экспрессии , pBAD-Tret на лизогении бульона (LB) агар , содержащий 100 пластины мкг / мл ампициллина.
- Инкубируйте планшет при 37 ° С в течение приблизительно 48 часов.
- Выберите одну колонию из планшета и инокуляции 3 мл LB жидкой среде, содержащей 100 мкг / мл ампициллина, в культуральную пробирку.
- Поместите пробирку в шейкере инкубаторе при 37 & #176; C х 175 оборотов в минуту в течение ночи.
- Индуцируют экспрессию белка в Tret экспрессирующих E.coli.
- Добавить 750 мл Потрясающе бульоне с добавлением 100 мкг / мл ампициллина до 2,800 мл Фернбах культуральной колбе. Передача 1 мл бульона из колбы в кювету для последующего использования в качестве бланка.
- Добавьте ночной культуры 3 мл, генерируемой на этапе 1.1.4 в колбу культуры, а затем колбу помещают в инкубатор и встряхивают при температуре 37 ° С х 200 оборотов в минуту. Необходимо периодически проверять оптическую плотность культуры при 600 нм по сравнению с заготовкой, собранной на этапе 1.2.1.
- После того, как поглощение при 600 нм не достигнет между 0.5-1.0, индуцируют экспрессию Tret добавлением 750 мкл 1 М раствора арабинозы (конечная концентрация 1 мМ) в культуре. Возвращение колбу в инкубаторе и встряхивали в течение ночи при 37 ° С х 200 оборотов в минуту.
- Пелле и лизировать Tret-клетки , экспрессирующие E.coli.
- Перенести культуру в полипропиленовую бottle и центрифуги в течение 15 мин при 4000 х г при 4 ° С.
- Жидкость над осадком сливают и вновь приостановить осадок в 15 мл фосфатно-солевым буферным раствором (PBS).
- Передачи клеточной суспензии в 50 мл коническую пробирку и центрифугируют в течение 15 мин при 4000 х г при 4 ° С. Жидкость над осадком сливают и либо перейти к лизису клетки (этап 1.3.4) или хранить гранулы до бесконечности при -80 ° С.
- Растворите 1 ингибитор протеазы мини - таблетку в 20 мл промывочного буфера (50 мМ NaH 2 PO 4, 500 мМ NaCl, 20 мМ имидазола, рН 8,0) в 50 мл коническую пробирку.
- Перенести ингибитор протеазы, содержащей промывочный буфер в коническую пробирку, содержащую осадок. Вихревой до осадок ресуспендировали.
- Передача ресуспендировали клеток в мл химический стакан 100 и лизиса клеток с помощью ультразвуковой обработки (последовательность импульсов 45 секунд на 45 секунд от со временем выполнения 2 мин и 15 сек при амплитуде 75 процентов).
- Переносят лизат в коническую пробирку на 50 мл металлаи центрифуги в течение 60 мин при 15000 х г при 4 ° С.
- Разъяснение лизата путем пропускания через шприцевой фильтр 0.2-0.45 мкм в 50 мл коническую трубку.
Примечание: Типичная концентрация лизата, полученного составляет 100 мг / мл.
- Очищают Tret из E.coli клеточного лизата с помощью быстрой жидкостной хроматографии протеинов (FPLC).
- Настройка FPLC с колонкой никеля сродства (5 мл объем слоя). Промыть колонку с 10 мл деионизированной воды, или пока колонна чист от любых загрязнений. Равновесие колонку с 20 мл промывочного буфера (50 мМ NaH 2 PO 4, 500 мМ NaCl, 20 мМ имидазола, рН 8,0) при скорости потока 1 мл / мин.
- Загрузка лизат (20 мл), полученного на стадии 1.3.8 на колонку и элюции немаркированные белки с промывочным буфером при скорости потока 1 мл / мин, пока поглощение не достигнет фоновых уровней (как правило, 80-100 мл промывочного буфера требуется) ,
- Элюции His-меченый Tret при использовании линейного гRadient из буфера для элюции (50 мМ NaH 2 PO 4, 500 мМ NaCl, 250 мМ имидазола, рН 8,0) от 1-100% в течение 60 мин при скорости потока 1 мл / мин. Соберите 4 мл фракции до Tret не элюируют и оптическую плотность достигает исходного уровня.
Примечание: Как правило, 60 мл буфера для элюции необходимы для элюции белка, а белок элюируется в диапазоне 60-100% буфера для элюции. Примерно 10-15 мл чистого Tret в буфере для элюирования получают. - Определить концентрацию Tret путем измерения оптической плотности при 280 нм против буфера для элюции заготовки.
- Обмен Tret в трис (гидроксиметил) (Трис) буфер с помощью диализа.
- После приготовления диализной трубки в соответствии с инструкциями производителя, простое его промывкой деионизированной водой, а затем трис-буфером (50 мМ Трис, 300 мМ NaCl, рН 8,0).
- Загрузить образец Tret в диализную трубку с помощью шприца и тупую иглу. Диализировать ночиактивизируем 2 л буфера Трис.
- Определить концентрацию Tret путем измерения оптической плотности при 280 нм против заготовки, собранной из диализной промывки.
- Переносят раствор Tret в 50 мл коническую пробирку и перейти к трегалозной аналогового синтеза (этап 2) или хранить фермента при температуре 4 ° С.
Примечание: Tret представляет собой термостабильный белок. Tret хранилась в Трис-буфере при температуре 4 ° С в течение нескольких месяцев без соблюдения значительной потери активности.
2. Один шаг Синтез трегалозы Аналогов Использование Tret энзим
Примечание: Протокол ниже описывает шкалу реакции, основанна на 4 мл объема, который может поставить приблизительно 15-30 мг трегалозы аналога в зависимости от эффективности реакции и молекулярного веса продукта. Компоненты реакции можно масштабировать, чтобы получить более или менее трегалозу аналог, если это необходимо.
- Добавить аналог глюкозы (0,080 ммоль, масса будет зависеть от молекулярной массы), УДФ-глюкоза (0.160 ммоль, 97,6 мг), и MgCl 2 (0,080 ммоль, 16,3 мг) в 15 мл коническую пробирку. Конечные концентрации этих компонентов будет 20 мМ, 40 мМ, и 20 мМ соответственно.
- Добавить Tret в Трис-буфере (полученного на стадии 1.5.4) и, при необходимости, соответствующий объем раствора трис-буфера (50 мМ Трис, 300 мМ NaCl, рН 8,0) до конечной концентрации фермента 300 мкг / мл и окончательное объем 4 мл. Пипеткой смесь вверх и вниз, осторожно или инвертировать трубку, чтобы растворить твердые вещества.
- Инкубируйте реакции при 70 ° C при встряхивании со скоростью 300 оборотов в минуту в течение 1 часа, а затем поместите трубку на лед, чтобы охладить.
3. Очистка трегалозы аналогах из сырой реакционной смеси ферментативного
- Предварительное полоскание центробежный блок фильтра (номинальный предел молекулярной массы (NWML) 10 кДа) для удаления следов глицерина в мембране путем добавления 3 мл деионизированной воды к центробежному блока фильтра и центрифугирование при 3000 XG, пока вся жидкость не проходит через фильтрв пробирку (примерно 20 мин). Повторите еще два раза. Этот шаг следует непосредственно перед или во время реакции (шаг 2.3).
- После охлаждения ферментативной реакционной смеси (полученной на стадии 2.3), передать его на предварительно промывать блок центробежного фильтра. Ополосните реакционную трубу с 1 мл деионизованной воды и переноса в центробежном блок фильтра. Повторите промывание реакционной трубы для максимального извлечения продукта.
- Центрифуга центробежный блок фильтра при 3000 XG, пока вся жидкость не проходит через фильтр в трубку (примерно 20 мин). Промыть верхнюю камеру центробежного блока фильтра с 3 мл деионизированной воды и центрифуге при 3000 мкг, пока вся жидкость не проходит через фильтр в пробирку (примерно 20 мин). Повторить полоскание для максимального извлечения продукта.
- Отбросить верхнюю камеру центробежного фильтра. Добавить ФСД ионообменной смолы (3 г) к фильтрату в нижней части трубки (типичного фильтрата тумэ 8-15 мл в зависимости от числа полосканий). Смесь перемешивают при комнатной температуре в течение 1 ч с помощью магнитной мешалки со скоростью, достаточной для поддержания гранул смолы суспендируют в растворе.
- Слейте супернатант и фильтровать ее для удаления смолы. Добавляют 5 мл деионизированной воды для промывки оставшегося полимера. Слейте супернатант и фильтровать ее, сочетая его с раствором продукта из первого декантацией. Повторите промывание смолы для максимального извлечения продукта.
- Анализ хода реакции с помощью тонкослойной хроматографии (ТСХ) или высокоэффективной жидкостной хроматографии, чтобы определить, было ли достигнуто полное превращение аналога глюкозы исходного материала трегалоза аналогового продукта. См шаг 4.1 для анализа ТСХ и шаг за шагом 4.2 для анализа ВЭЖХ.
- Удалите воду путем лиофилизации или роторном испарителе с получением высушенного продукта. Если не вступивший в реакцию аналог глюкозы не наблюдалось во время ТСХ или ВЭЖХ-анализа, очистки с помощью хроматографии ненужно. Взвесьте продукт для получения реакции YieЛД и выполнять ядерного магнитного резонанса (ЯМР) спектроскопического анализа (этап 4.3), чтобы подтвердить структуру продукта и чистоту.
- Если непрореагировавший аналог глюкозы наблюдалась при анализе ТСХ, отделить его от трегалозной аналога с использованием колонки размера исключения.
- Подготовьте колонку с 1 х 100 см, содержащую деионизованной водой, насыщенной, тончайшая P2 полиакриламидном размер гранул исключения средства массовой информации в соответствии с инструкциями изготовителя.
Примечание: В столбце размера исключение может быть повторно использован после промывки деионизированной водой. - Повторно растворять высушенный ферментативный продукт реакции (полученный на стадии 3.7) в 0,5 мл деионизованной воды. Нанесите раствор продукта в вытеснительной колонке вручную или с помощью адаптера потока колонки. Ополосните флакон, содержащий сырой продукт с еще 0,5 мл деионизованной воды, и загрузить его в колонку размером исключения.
- Элюции продукт с деионизованной водой самотеком и собирают фракции примерно 2 мОбъем л.
- Анализ фракций с помощью тонкослойной хроматографии (этап 4.1). Объединяют фракции, содержащие чистый трегалозу аналог.
- Удалите воду путем лиофилизации или роторном испарителе с получением высушенного продукта. Взвесьте продукт, чтобы получить выход реакции и перейти к ЯМР-анализа (см шаг 4.3).
- Подготовьте колонку с 1 х 100 см, содержащую деионизованной водой, насыщенной, тончайшая P2 полиакриламидном размер гранул исключения средства массовой информации в соответствии с инструкциями изготовителя.
4. Анализ трегалозных Аналоговые продукты
- Выполните тонкослойной хроматографии (ТСХ) анализа реакции Tret.
Примечание: Эта процедура также может быть использована для анализа размера фракций столбцов исключения. Это может быть необходимо, чтобы сконцентрировать реакционную смесь или столбцов фракций перед анализом ТСХ наблюдать соединение окрашивание на пластине ТСХ.- Марк дорожки на поверхности пластины ТСХ с карандашом и применять аналит (ы) и соответствующий стандарт (ы) для соответствующих полос движения, в том числе глюкозы аналогового стандарта, трегалозы аналогового стандарта (если таковая имеется), реакционной смеси (или фракций, собранных из размер еочистка xclusion колонка), а также со-спот. После нанесения каждого образца на ТСХ-пластинку, дайте пластины высохнуть.
Примечание: Для анализа реакции, как правило, 2 мкл образца наносят на планшет ТСХ. - Разработка пластинки ТСХ с использованием смеси н - бутанола / этанол / деионизованной водой (5: 3: 2).
- Сушат развитую TLC пластину, а затем опустите ее в 5% H 2 SO 4 в этаноле (сахар пятна) и тепла на горячей плите на высокое значение до тех пор , содержащих сахар пятна не могут быть визуализированы (обычно 5 мин).
- Марк дорожки на поверхности пластины ТСХ с карандашом и применять аналит (ы) и соответствующий стандарт (ы) для соответствующих полос движения, в том числе глюкозы аналогового стандарта, трегалозы аналогового стандарта (если таковая имеется), реакционной смеси (или фракций, собранных из размер еочистка xclusion колонка), а также со-спот. После нанесения каждого образца на ТСХ-пластинку, дайте пластины высохнуть.
- Провести анализ с помощью ВЭЖХ реакционных смесей Tret с использованием любой системы ВЭЖХ , способный разделять и обнаруживать углеводы. Этот протокол включает в себя углеводный разделение с использованием колонки ВЭЖХ аминопропил и детектирование с использованием показателя преломления.
- Прикрепите аминопропил колонку (4,6 х 250 мм), содержащий предварительно защитной колонкой к высокоэффективной жидкостной хроматографии.
- Равновесие аминопропил колонку с 80% ацетонитрила в деионизированной воде при скорости потока 0,4мл / мин.
- Загрузите раствор продукта реакции (или стандарт) на колонку аминопропил.
- Элюирования продукта (или стандарт) с 80% ацетонитрила в деионизированной воде при скорости потока 0,4 мл / мин и температуре колонки 50 ° С. Как правило, время автономной работы используется 40 мин.
Примечание: Как аналог глюкозы исходный материал и трегалоза аналог продукт может быть обнаружен с помощью показателя преломления, хотя возможны и другие способы, такие как испарительного обнаружение рассеяния света (ELSD) можно было бы использовать. Использование описанных условиях глюкозы аналоги обычно вымывается между 10-15 мин и трегалоза аналогами вымывается в пределах 15-25 мин.
- ЯМР - анализ очищенных аналогов трегалозных.
- Растворите очищенный трегалозу аналог в D 2 O (700 мкл) и передать решение ЯМР трубки.
- Приобретать 1 H и 13 С ЯМР - спектров в соответствии с соответствующими протоколами по объекту ЯМР.
5. Применение Tret-синтезированных Трегалоза Аналогов к обнаружению микобактерий
- Обобщить, очищают, и управлять 6-TreAz к M. smegmatis (Msmeg).
- Добавить 6-азидо-6-дезокси глюкопиранозу (6-GlcAz, 0,020 ммоль, 4,1 мг), УДФ-глюкоза (0,040 ммоль, 24,4 мг), и MgCl 2 (0,020 ммоль, 4,1 мг) в 15 мл коническую пробирку.
- Добавить Tret в Трис-буфере (полученного на стадии 1.5.4) для достижения конечной концентрации фермента 300 мкг / мл и конечный объем 1 мл. Пипеткой смесь вверх и вниз, осторожно или инвертировать трубку, чтобы растворить твердые вещества.
- Инкубируйте реакции при 70 ° C при встряхивании в течение 15 мин.
- Развести ферментативной реакционной смеси с 3 мл деионизированной воды и перенести его на предварительно промытой блока центробежным фильтром (NMWL 10 кДа). Центрифуга блок фильтра при 3000 XG, пока большая часть жидкости не проходит через фильтр в трубку, примерно 10 мин.
- Выбросьте-йе верхняя палата центробежного фильтра. Добавить ФСД ионообменной смолы (0,75 г) в пробирку и перемешивать / дрожанием при комнатной температуре в течение 25 мин. Слейте супернатант и фильтровать ее для удаления смолы.
Примечание: Шаги 5.1.1-5.1.5 обеспечивают водный раствор 6-азидо-трегалоза (6-TreAz) приблизительно при 5 концентрации мМ менее чем за 1 час. Концентрация 5 мМ оценивается на основе количественного превращения субстрата в продукт и разведению, которое занимает места во время стадий очистки, при условии минимальной потери продукта в течение этих этапов. Раствор может быть стерильно фильтруют перед добавлением к биологическим образцом, при желании. - Добавьте соответствующий объем раствора продукта 6-TreAz в лог-фазы культуры M. smegmatis (Msmeg), как правило , для достижения конечного объема культуры в 100-1000 мкл и до конечной концентрации 6-TreAz из ~ 25 мкм. Инкубируйте клетки при 37 ° С в течение требуемого количества времени, обычно 60 мин.
- Выполнить нажмите химию к сопряженным флуорофор к азида меченых клеток. В этом протоколе, используют Cu-катализируемое азид-алкиновая циклоприсоединения (CuAAC) , чтобы доставить флуорофора клеточной поверхности азидов в Msmeg.
- Центрифуга клетки при 3,900 мкг в течение 5 мин, а затем промыть клетки с PBS, содержащим 0,5% бычьего сывороточного альбумина. Повторите два раза.
- Повторное приостановить осажденные клетки в 4% параформальдегид в PBS, чтобы исправить их. После инкубации в течение 10 минут, повторите шаг 5.2.1, чтобы промыть клетки.
- Повторное приостановить гранулированные клеток в 138 мкл PBS.
- Добавить 3 мкл 1 мМ исходного раствора алкина-carboxyrhodamine 110 (алкине-488) в ДМСО.
- Добавить 3 мкл свежеприготовленного 60 мМ исходного раствора аскорбата натрия в деионизированной воде.
- Добавить 3 мкл 6,4 мМ исходного раствора трис [(1-бензил-1H-1,2,3-триазол-4-ил) метил] амин (ТБТА) в трет - бутанола / диметилсульфоксид (ДМСО) 4: 1.
- Добавить 3 & #956; л из 50 мМ исходного раствора CuSO 4 в деионизированной воде.
- Пипеткой клеточной суспензии вверх и вниз, а затем инкубируют в темноте при комнатной температуре в течение 30 мин.
- Повторите шаг 5.2.1, чтобы промыть клетки. Повторное приостановить клетки в 150 мкл PBS.
- Провести анализ клеточного флуоресценции. В этом протоколе используют флуоресцентной микроскопии для визуализации клеточного флуоресценцию меченых Msmeg.
- Добавьте 10 мкл бактериальных клеток, суспендированных в PBS с предметного стекла микроскопа и слегка распространение жидкости в тонкий слой с помощью края покровным. Дайте высохнуть на воздухе в темноте.
- Добавить 10 мкл монтажной среды через высушенный образец, а затем поместите крышку скользит по образцу и нанести клей (например, лак для ногтей) для иммобилизации.
- Изображение слайды с помощью флуоресцентного микроскопа при 100-кратном увеличении.
Результаты
Т. TENAX Tret был получен из E.coli с выходом приблизительно 4 мг / л с использованием стандартных способов экспрессии белка и очистки. Один никеля сродства стадии хроматографии было достаточно , чтобы очистить Tret от кишечной палочки лизата (представитель FPLC тра?...
Обсуждение
Аналоги трегалозы имеют потенциал для воздействия на различные сферы, от сохранения пищевых продуктов и лекарственных средств для диагностики и лечения микробных инфекций 6. Существующие методы химического синтеза многоступенчатый полезны для получения сложных аналого...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Материалы
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
Ссылки
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены