Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hızlı Bir adım enzimatik sentezi ve Trehaloz Analoglarının All-sulu Arıtma
Bu Makalede
Özet
Trehalose analogues are emerging as important molecules for bio(techno)logical and biomedical applications. We describe an optimized protocol for enzymatically synthesizing and purifying trehalose analogues that is simple, efficient, fast, and environmentally friendly. Its application to the rapid production and administration of a probe for the detection of mycobacteria is demonstrated.
Özet
Kimyasal trehaloz veya trehaloz analogları sürümlerini değiştirilmiş, diğer alanlar arasında biyoloji, biyoteknoloji ve ilaç bilimi uygulamaları var. Örneğin, tespit etiketleri taşıyan trehaloz analoglan Mycobacterium tuberculosis tespit etmek için kullanılmıştır ve tüberküloz tanısal görüntüleme maddeleri gibi uygulamalar olabilir. trehalozun hidrolitik olarak kararlı versiyonları da bağlı kalorisiz tatlandırıcılar ve Bio koruyucu maddeler olarak kullanım için potansiyel takip edilmektedir. Çeşitli uygulamalar için bileşikler sınıfının itiraz rağmen, potansiyel nedeniyle bunların üretimi için güçlü bir yol olmadığı için tamamlanmamış kalır. Burada, kimyasal sentez ile ilgili sorunlarını ortadan trehaloz analoglarının hızlı ve etkili bir tek-aşamalı biyokatalitik sentezi için ayrıntılı bir protokol sunulmuştur. Thermoproteus Tenax gelen ısı ayarlı trehaloz sintaz (tRet) enzimini kullanarak, trehaloz analoglan generat olabilirEd glükoz analogları ve yüksek verimle üridin difosfat glukozdan tek bir aşamada (kantitatif dönüşüme kadar) 15-60 dakika içinde. sıkma diyaliz ve iyon değişim oluşur basit ve hızlı bir sigara kromatografik saflaştırma protokolü gibi az 45 dakika içinde sulu bir çözelti içinde bilinen konsantrasyonda bir çok trehaloz analoglarını sağlayabilir. reaksiyona girmemiş glükoz analoğu hala devam durumlarda, trehaloz analog ürününün kromatografik saflaştırması gerçekleştirilebilir. Genel olarak, bu yöntem olup, özelliği kimyagerler etkin ve erişilebilir hızlandırılmış sentezi ve trehaloz analogları saflaştırılması için bir "yeşil" biyokatalitik bir platform sağlar. Bu yöntemin uygulanabilirliği örnek için, sentez seyahati sulu arıtma bir protokol açıklar ve mikobakterilerin floresens az 1 saat sürdü ve etkinleştirilmiş her biri mikobakteriler için trehaloz-bazlı tıklama kimyası prob uygulanması. Gelecekte, oth arasında, o tasavvurUygulamalar er, bu protokol, tüberküloz teşhis için trehaloz-bazlı prob hızlı sentezi uygulanabilir. Böyle pozitron emisyon tomografisi-bilgisayarlı tomografi (PET-BT) olarak (örneğin, 18 F-modifiye trehaloz) ileri klinik görüntüleme yöntemleri için kullanılan olabilir Örneğin, kısa ömürlü radyonüklid modifiye trehaloz analogları.
Giriş
Trehaloz, bir 1,1-α, α-glikosidik bağ (Şekil 1A) ile bağlanmış iki glukoz gruplarından oluşan simetrik indirgeyici olmayan disakkarittir. Trehaloz, insan ve diğer memelilerde eksik olsa da, bakteri, mantar, bitki ve omurgasız 1 yaygın olarak bulunur. En organizmalarda trehaloz birincil rolü, kuruma 1 ile çevresel strese karşı korumaktır. Buna ek olarak, bazı insan patojenleri hücre kılıfı sentezi bir aracısı olarak ve bağışıklık glikolipitler 2 yapımı için bir yapı bloğu olarak trehaloz kullanan tuberculosis neden Mycobacterium tuberculosis dahil olmak üzere, hastalık oluşturma etkisi için trehaloz gerektirir.
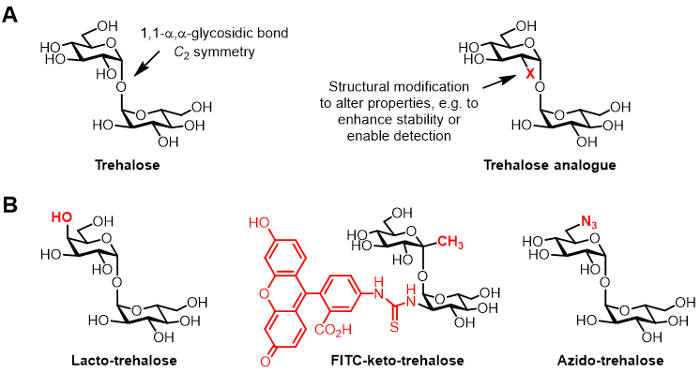
Şekil 1: Trehaloz, trehaloz analogları. (AX, yapısal değişiklik doğal trehaloz ve doğal olmayan bir trehaloz analog, bir) Yapıları. Bio ve bio potansiyel uygulamalara sahip literatürde trehaloz analogları (B) Örnekler.
Kendine özgü yapısı ve fizyolojik fonksiyonları, trehaloz mantıksal biyo (tekno) kullanım ve biyomedikal uygulamalarda 3 önemli dikkat çekti. Doğa-örneğin gözlenen trehaloz koruyucu özellikleri, çarpıcı yeteneği 4 sahibi olur Biyokoruma uygulamalarında geniş kullanım mahmuzlu aşırı dehidratasyon uğramıştır "diriliş" Bitkilerde yaşam sürdürebilmek yardımcı olur. Trehaloz, örneğin nükleik asitler, proteinler, hücre ve doku 3 arasındaki biyolojik örnekler, geniş bir dizi korumak için kullanılmıştır. Örneğin, trehaloz ilaç t sayısında bir stabilize edici katkı maddesi olarak kullanılırşapka birçok anti-kanser monoklonal antikorlar 3 olmak üzere, piyasada bulunmaktadır. Yanı sıra, trehaloz gıda sektöründe tatlandırıcı olarak kullanılır ve bu kapsamlı hem gıda ve kozmetik sanayiinde ürün korunması için kullanılır. Ticari Bu tür uygulamalar için trehaloz kabul ilk doğal kaynaklardan ya da sentez yoluyla saf trehaloz toplu miktarlarının elde edilmesi için yetersizlik ile sınırlıydı. Bununla birlikte, nişasta trehaloz ekonomik üretimi için etkin bir enzimatik proses son zamanlarda yaygın ticari kullanımı teşvik ettiği geliştirilmiştir 5.
6; kimyasal trehaloz değiştirilmiş türevleri, (Şekil 1B de gösterilen trehaloz analoglarının spesifik örnekleri, genel yapısı Şekil 1A'da gösterilen), çeşitli uygulamalar için giderek artan bir ilgi kazanmıştır, trehaloz analogları olarak adlandırılan. Örneğin, lakto-trehaloz böylece 4-pozisyonunda hidroksil grubu, bir ters stereokimyasal konfigürasyona sahiptir, galaktoz ile ikame onun glikoz birimleri ile bir trehaloz analogudur. Lacto-Trehaloz aynı stabilize edici özelliklere sahip fakat kalorisiz gıda katkı maddesi 6, 7 gibi cazip hale bağırsak enzimleri bozunmaya karşı dayanıklı olmaktadır.
trehaloz analogları Bizim Grubun faiz öncelikle mikobakteriler-spesifik problar ve inhibitörleri olarak değeri ile ilgilidir. Barry ve Davis grupları floresan mikroskobu 8 tarafından algılama sağlayan metabolik canlı M. tuberculosis hücre duvarını etiketlemek için gösterilen FITC-keto-trehaloz adında bir floresan konjuge keto-trehaloz analog, geliştirdi. BERTOZZI laboratuvar metabolik det olmak sonradan hücre duvarını etiket olabilir ve küçük azido-trehaloz (TreAz) analogları geliştirdiyansıtılmaktadır tıklama kimya ve floresan analizi 9 kullanarak. Bu gelişmeler, tüberküloz için tanısal görüntüleme maddeleri olarak trehaloz-dayanan problar kullanılarak olasılığına işaret etmektedir. Trehaloz analogları da canlılığı ve ölümcüllüğün 10, 11, 12 için gerekli olan bakteri yollarının bozmaya nedeniyle potansiyel M. tuberculosis inhibitörleri olarak takip edilmiştir.
Şimdiye kadar, biyo (tekno) mantıksal ve biyomedikal uygulamalar için trehaloz analogları geliştirmek için ana engel verimli sentetik yöntemlerin olmaması. Trehaloz analogları üreten iki geleneksel yolları kimyasal sentez üzerinde (Şekil 2) güveniyor. Diğer düzgün fonksiyonelleştirilmiş monosakkarit yapı taşları ile başlayan ve kimyasal glikosilasyonu kullanılmasını içermektedir ise bir rota, doğal trehalozun desymmetrization / modifikasyonunu içerir1,1-α, α-glikosidik bağ oluşturmak. En son derlemelerde 13, 14 tartışılmıştır Bu yaklaşımlar, M. tuberculosis 15 bu tür sulfolipid-1 gibi kompleks bir trehaloz içeren doğal ürünler, küçük miktarlarda çok adımlı bir sentez gerçekleştirilmesi için yararlı olduğu kanıtlanmıştır. Ancak, her iki yaklaşım olmayan kimyagerler genellikle zaman alıcı, verimsiz erişilemez ve buna ek olarak, çevre dostu olarak kabul edilmez. Bu nedenle, trehaloz analoglarının belirli türleri sentezlenmesi için, bu stratejiler ideal değildir.
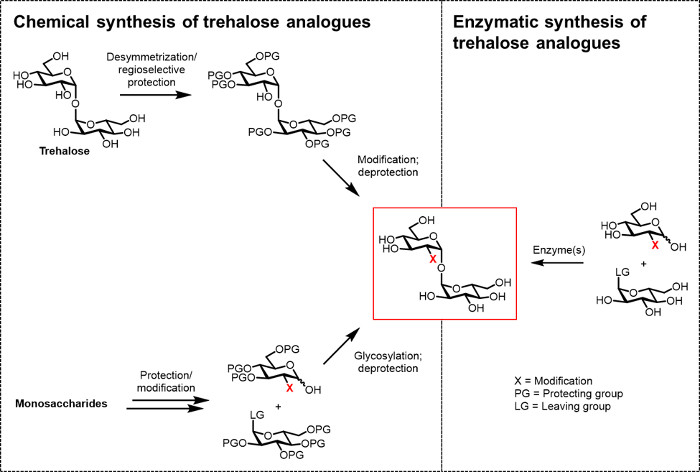
Şekil 2: trehaloz analog sentezi Yaklaşımlar. Kimyasal solda gösterilen, trehaloz analog sentezi yaklaşımlar, zor korumanız içeren çok adımlı prosedürleri kullanmakma / korumanın kaldırılması, desymmetrization ve / veya glikosilasyon adımları. sağda gösterilen enzimatik sentezi, stereoselektif olarak, sulu çözelti içinde analogları trehaloza basit korumasız substratlar dönüştürme enzim (ler) kullanır. Burada rapor enzimatik protokolü tek bir aşamada trehaloz analogları glikoz analogları ve UDP-glikoz dönüştürmek için bir trehaloz sintaz (tRet) enzimini kullanır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
trehaloz analogları etkin bir biyokatalitik rota moleküllerinin bu umut verici sınıfının üretim, değerlendirme ve uygulama kolaylaştıracaktır. Trehaloz üretimi 5 ticari enzimatik işlem, bir alt-tabaka olarak nişasta kullandığı için analoglarını sentez için uyumlu değildir, diğer biyosentetik yolu vardırtrehaloz analog sentezi için istismar edilebilir doğada yolları. Ancak, son zamanlarda 6 gözden geçirilmiştir, bu alanda, araştırma, sınırlı olmuştur. Bir rapor ilgili floro-glikoz tek floro-trehaloz analog ulaşmak için Escherichia coli trehaloz biyosentetik yolunun esinlenerek bir yöntem kullanılır. Bununla birlikte, bu yaklaşım, verimlilik ve genelliğini 8 sınırlı üç enzim sistemi gerektirir. Araştırılmış olan bir başka yaklaşım, ilke olarak glükoz analogları ve glükoz-1-fosfat 6, 16, 17 trehaloz analoglarının bir-adımlık sentez izin ters yönde, trehaloz fosforilaz (TREP) kullanmaktır. Bu yaklaşım, gelecekte söz var olsa da, her ikisi de eviren ve istinat TrePs şu anda analog sentezi için dezavantajları var. Örneğin, tersini TrePs yasaklı deneyimlerini varnsive verici molekül (β-D-glikoz 1-fosfat) ve tutma TrePs düşük enzim sentezleme verimler / kararlılık ve belirli alt-tabaka karışıklık sahiptir. (Enzim mühendisliği yoluyla, örneğin) önemli gelişmeler TREP-aracılı analog sentezi önce gerekli olacak pratik.
Şu anda, trehaloz analoglarının enzimatik sentezi için en pratik yaklaşım, kan şekeri ve üridin difosfat (UDP), tek bir aşama 6'da trehaloza -glükoz dönüştüren bir trehaloz sintaz (tRet) enzimi kullanılmasıdır. Son zamanlarda glükoz analogları ve UDP-glikoz (Şekil 3) 19 trehaloz analoglarını sentez -to Thermoproteus Tenax tRet-termostabil ve tek yönlü enzim 18 kullanımını bildirmiştir. Bu enzim sadece sentetik yönde çalışır ve TREP sisteminde bulunan trehaloz bozulması problemini önler. Bu tek-aşamalı bir reaksiyon coul1 saat içinde tamamlanması d ve hazır glükoz analoğu substratlar (Örnek Sonuçlar Tablo 1 den (yüksek performanslı sıvı kromatografisi (HPLC) ile tespit edildiği üzere>% 99 kadar) trehaloz analogları geniş bir çeşitliliği yüksek verimde erişilen Bölüm).
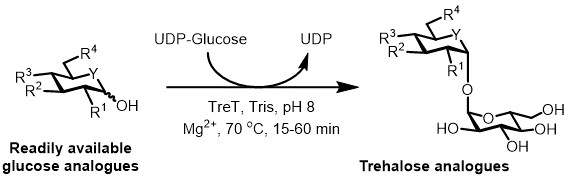
Şekil 3: trehaloz analoglarının tRet katalizörlü tek aşamalı sentezi. T. Tenax gelen Tret enzimi stereoselektif tek adımda trehaloz analogları oluşturmak için hazır glikoz analogları ve UDP-glikoz katılabilirsiniz. R1 -R4 dün = Değişken yapısal değişiklik, örneğin, azido, floro, deoksi, tiyo, stereokimyasal veya izotopik etiketli modifikasyon; Y, örneğin, oksijen ya da kükürt ya da izotopik olarak etiketlenmiş heteroatom değişken heteroatom, =.
Burada, biz reklamı sağlamaktRet reaksiyon koşulları optimize E.coli'den ekspresyonu ve tRet saflaştırılması dahil olmak üzere, tRet sentez işlemi için etailed protokol, ve sulu faz içinde tamamen gerçekleştirilir geliştirilmiş bir saflaştırma yöntemi. Bu modifiye protokol, yarı-preparatif skala (10-100 mg) üzerinde, çeşitli trehaloz benzerlerinin uygun ve verimli bir sentezi ve saflaştırılması sağlar. Biz de hazırlanması ve mikobakteri hücrelerin hızlı floresan algılama özellikli az 1 saat, mikobakterinin bir trehaloz tabanlı prob uygulanması için bu protokolün kullanımını göstermektedir.
Protokol
Top10 E.coli'den 1. Ekspresyonu ve Saflaştırılması tRet
NOT: Tret-ifade eden E. coli suşu istemek için yazarları irtibata geçiniz ve beraberindeki malzeme transferi anlaşması (Top10 E. dönüştü AraC proteinin kontrolü altında T. tenax tret geni içeren, pBAD Tret plazmid 19 coli) . Aşağıdaki protokol, tipik olarak, yaklaşık 4 mg / L'lik bir protein verimi verir.
- E. coli Tret ifade eden bir 3 mL gecede kültür hazırlayın.
- Bir lizojeni etsuyu (LB), 100 ug / ml ampisilin ihtiva eden agar plaka üzerine pBAD-tRet ifade vektörü ile transforme edilen bir çizgi Top10 E.coli.
- yaklaşık 48 saat boyunca 37 ° C'de inkübe plakası.
- plakadan tek bir koloni almak ve bir kültür tüpü içinde 100 ug / ml ampisilin içeren LB sıvı ortam 3 ml inoküle.
- 37 & # bir sallayarak inkübatör tüp yerleştirin176 C gecede 175 rpm x.
- E. coli tRet salgılayan protein ifadesini teşvik eder.
- Ekle 750 mL Terrific Broth 2.800 ml Fernbach kültürü şişesine 100 ug / ml ampisilin ile takviye edilmiştir. boş olarak, daha sonra kullanılmak üzere bir küvete şişeye transfer 1 ml suyu.
- Kültür şişeye aşama 1.1.4 üretilen 3 ml gecelik kültürden ekleyin, sonra bir kuluçka içine yerleştirilir ve 37 ° C x 200 rpm'de çalkalanır. Periyodik adım 1.2.1 toplanan boş karşı 600 nm kültürünün absorbansı kontrol edin.
- 0.5-1.0 arasında ulaşan 600 nm'de absorbans sonra, kültüre 1 M arabinoz çözeltisi (1 mM nihai konsantrasyon), 750 uL eklenmesiyle tRet ifadesini teşvik eder. inkübatör için şişeyi dönün ve x 200 rpm, 37 ° C'de gece boyunca çalkalanır.
- Pelet tRet-ifade eden E. coli hücreleri lize edildi ve.
- Bir polipropilen b kültürü aktarınottle ve 4 ° C'de 4000 x g'de 15 dakika boyunca santrifüje tabi tutun.
- Süpernatant atılır ve fosfat tamponlu tuz 15 mL (PBS) içinde pelet yeniden askıya.
- 4 ° C'de 4,000 x g'de 15 dakika boyunca 50 ml konik bir tüp ve santrifüj hücre süspansiyonu aktarın. Süpernatantı atın ve her iki lizis (adım 1.3.4) hücre veya -80 ° C'de süresiz pelet saklamak için devam edin.
- 50 ml konik bir tüp içinde, yıkama tamponu (50 mM NaH 2 PO 4, 500 mM NaCI, 20 mM imidazol, pH 8.0) içinde 20 mL 1 proteaz inhibitörü, mini tablet içinde çözülür.
- topaklarını içeren konik tüp proteaz inhibitörü ihtiva eden yıkama tamponu aktarın. pelet kadar Vorteks yeniden askıya alındı.
- (Yüzde 75 bir amplitüd 2 dakika ve 15 saniyelik bir çalışma süresi ile kapalı, 45 saniye ile 45 saniye arasında puls dizisi) 100 ml beher yeniden süspansiyon haline hücreleri aktarın ve sonikasyon ile hücrelerin lize.
- 50 ml metal konik tüp lizat aktarınve 4 ° C de 15,000 x g'de 60 dakika boyunca santrifüje tabi tutun.
- 50 ml konik bir tüp içine 0.2-0.45 um şırınga filtresinden geçirilerek lizat açıklık getirmektedir.
Not: Elde edilen lizat, tipik konsantrasyonu 100 mg / mL olduğunu.
- Hızlı protein sıvı kromatografi (FPLC) kullanılarak E. coli hücre lizatından tRet saflaştınlır.
- Bir nikel afinite kolonuna (5 ml yatak hacmi) ile FPLC ayarlayın. iyonu giderilmiş su 10 mL ya da sütun, kirletici maddelerden arınmış kadar sütun yıkayın. Yıkama tamponu 20 mL kullanılarak kolon dengeye (50 mM NaH 2 PO 4, 500 mM NaCl, 20 mM imidazol, pH 8.0), 1 mL / dakikalık bir akış hızında püskürtülür.
- kolona aşama 1.3.8 elde edilen lizat (20 mL) yükleyin ve absorbans, arka plan seviyeleri ulaşıncaya kadar 1 ml / dk'lık bir akış oranında yıkama tamponu ile etiketsiz proteinleri elüte (yıkama tamponu tipik olarak 80-100 ml gereklidir) .
- Zehir doğrusal gramı kullanılarak tRet His-etiketli1 ml / dk'lık bir akış hızında 60 dakika boyunca% 1-100 arasında elüsyon tamponu (50 mM NaH 2 PO 4, 500 mM NaCl, 250 mM imidazol, pH 8.0) radient. Tret yıkanan ve absorbans temel seviyeye ulaşana kadar 4 mL kesirler toplayın.
Not: Genellikle, elüsyon tamponu 60 ml protein elüt edilmesi için gerekli olan ve protein% 60-100 elüsyon tamponu aralığında elüt edilmektedir. Yaklaşık elüsyon tampon maddesi içinde saf tRet 10-15 ml elde edilir. - bir elüsyon tamponu boşluğa karşı 280 nm'de absorbans ölçülerek tRet konsantrasyonunu belirler.
- Tris Değişim tRet diyaliz ile (hidroksimetil) aminometan (TRIS) tamponu.
- üreticinin talimatlarına göre diyaliz tüpüne hazırladıktan sonra, iyonu giderilmiş su ve sonra Tris tamponu (50 mM Tris, 300 mM NaCI, pH 8.0) ile durulama Asal.
- Bir şırınga ve künt bir iğne kullanılarak diyaliz tüp içine Tret örnek yükleyin. gece boyunca diyalizTris tamponu 2 L aykırı.
- Diyaliz yıkama toplanan bir boşluğa karşı 280 nm'de absorbans ölçülerek tRet konsantrasyonunu belirler.
- 50 ml konik tüp Tret çözüm aktarın ve trehaloz analog sentezi (adım 2) devam ya da 4 ° C'de enzim saklayın.
Not: tRet termostabil bir proteindir. TRet aktivitesinde belirgin bir kayıp uygulanmaksızın birkaç ay boyunca 4 ° C sıcaklıkta Tris tamponu içinde saklandı.
TRet enzim kullanılarak Trehaloz Analoglarının 2. tek aşamalı sentezi
NOT: protokolü aşağıdaki reaksiyon verimliliği ve ürünün moleküler ağırlığına bağlı olarak trehaloz analoğunun yaklaşık 15-30 mg sağlayabilir 4 mL hacmine bağlı olarak bir reaksiyon ölçeği, tarif eder. reaksiyon bileşenleri istenirse daha fazla veya daha az trehaloz analog elde etmek için ölçeklenebilir.
- (0.080 mmol, kütle moleküler ağırlığına bağlıdır) glikoz analog ekleme, UDP-glikoz (0.15 ml konik bir tüp 160 mmol, 97.6 mg) ve (0.080 mmol MgCI2, 16.3 mg) eklenmiştir. Bu bileşenlerin son konsantrasyonları sırası ile 20 mM, 40 mM ve 20 mM olacaktır.
- gerektiğinde Tris tamponu uygun bir hacmi (50 mM Tris, 300 mM NaCI, pH 8.0), 300 ug / ml ve son bir son enzim konsantrasyonu elde etmek için, (aşama 1.5.4 de elde edilmiş) Tris tamponu tRet ekleyin ve 4 mL hacim. Pipetleyin Karışım yukarı ve aşağı yavaşça veya katıların çözünmesi için tüp ters.
- 1 saat süre ile 300 rpm'de çalkalanarak 70 ° C'de reaksiyon inkübe, daha sonra soğuması için buz üzerinde tüp yerleştirin.
Ham enzimatik tepkime karışımından Trehaloz Analoglarının 3. saflaştırılması
- Tüm sıvı filtre içinden geçinceye kadar santrifüj filtre ünitesine deiyonize su 3 mL ekleme ve 3000 x g'de santrifüj zar eser gliserol ayrılması için bir santrifüjlü filtre ünitesi (nominal moleküler ağırlık limitli (NWML), 10 kDa) ön-durulamatüpe (yaklaşık 20 dakika). iki ek kez tekrarlayın. hemen önce ya da reaksiyon (adım 2.3) sırasında bu adımı tamamlayın.
- (Adım 2.3 de elde edilmiş), enzimatik reaksiyon karışımı soğutulduktan sonra, önceden durulanmıştır santrifüj filtre birimine aktarmak. santrifüj filtre ünitesine iyonu giderilmiş su ve transfer 1 ml reaksiyon tüpü durulayın. ürünün maksimum geri kazanımı için reaksiyon tüpünün tekrarlayın durulama.
- Tüm sıvı tüpün (yaklaşık 20 dakika) içine filtreden geçer kadar 3.000 xg'de santrifüj filtre ünitesi santrifüj. Tüm sıvı borusu (yaklaşık 20 dakika) içine filtre geçene kadar 3,000 x g'de iyonu giderilmiş su ve santrifüj 3 mL santrifüj filtre ünitesinin üst bölmeyi durulayın. ürünün maksimum iyileşme için durulama tekrarlayın.
- Santrifüj filtre ünitesinin üst bölmeyi atın. Tüp (tipik süzülen madde hacim altındaki süzüntüye karma-yataklı iyon-değişim reçinesi (3 gr) ilaveume durulama sayısına bağlı olarak 8-15 ml) 'dir. çözeltisi içinde süspansiyon haline getirilmiş reçine boncuklarını tutmak için yeterli bir hızda Manyetik bir karıştırma çubuğuna sahip olan, 1 saat boyunca oda sıcaklığında karıştırılır.
- Süpernatantı Durusu ve reçine çıkarmak için filtre. Geri kalan reçine durulama iyonu giderilmiş suyun 5 mL ekleyin. süpernatant süzün ve birinci dekantasyon ürün çözeltisi ile birleştirerek, süzün. ürünün maksimum geri kazanımı için reçine tekrarlayın durulama.
- trehaloz analog ürünün başlangıç malzemesinin glükoz analoğu tam dönüşüm elde olup olmadığını belirlemek için ince katman kromatografisi (TLC) veya HPLC vasıtasıyla reaksiyonun analiz edin. TLC analizi için adım 4.1 ve HPLC analizi için 4.2 adım.
- kurutuldu ürün elde liyofilizasyon veya döner buharlaştırma ile suyun çıkarılması. tepkimeye girmemiş glükoz analoğu TLC ya da HPLC analizi sırasında gözlenmediğinde, kromatografi ile saflaştırma gereksizdir. Reaksiyon Yie elde etmek üzere ürün tartılırld ve nükleer manyetik rezonans gerçekleştirmek (NMR) spektroskopik analizi (adım 4.3) ürün yapısı ve saflığını teyit etmek.
- reaksiyona girmemiş glükoz analoğu TLC analizi gözlenen ise, bir ebat eksklüzyon kolonu kullanılarak trehaloz analog ayırın.
- üreticinin talimatlarına uygun olarak deiyonize suya doymuş, ekstra-ince P2 poliakrilamid kordon boyut dışlama ortam içeren 1 x 100 cm kolon hazırlanmıştır.
Not: ebat eksklüzyonlu kolon, iyonu giderilmiş suyla yıkandıktan sonra yeniden kullanılabilir. - Yeniden çözülür kurutuldu enzimatik tepkime ürünü iyonu giderilmiş su, 0.5 mL (adım 3.7 de elde edilmiş). El ile boyut dışlama sütununa veya bir sütun akış adaptör ile bir ürün çözeltisi uygulanır. deiyonize su bir başka 0.5 mL ham ürünü ihtiva şişeyi yıkayın ve boyut dışlama sütununa yüklemek.
- yerçekimi akışı ile, iyonu giderilmiş su ile ürün elde edilmiştir ve yaklaşık 2 m fraksiyonlarım toplamakL hacmi.
- TLC (adım 4.1) ile kesirler analiz edin. Saf trehaloz analog içeren kesirler Havuzu.
- kurutuldu ürün elde liyofilizasyon veya döner buharlaştırma ile suyun çıkarılması. Reaksiyon verimi elde etmek ve NMR analizi geçmek için ürünü tartılır (adım 4.3).
- üreticinin talimatlarına uygun olarak deiyonize suya doymuş, ekstra-ince P2 poliakrilamid kordon boyut dışlama ortam içeren 1 x 100 cm kolon hazırlanmıştır.
Trehaloz benzer ürünler 4. analizi
- TRet reaksiyon ince tabaka kromatografisi (TLC) analizi gerçekleştirebilir.
NOT: Bu prosedür, aynı zamanda ebat eksklüzyonlu kolon fraksiyonları analiz etmek için kullanılabilir. TLC plaka bileşik lekeleme gözlemlemek için TLC analizi öncesinde reaksiyon karışımı ya da sütun fraksiyonları konsantre gerekli olabilir.- Mark bir kalem ile TLC plakası yüzeyinde şeritleri ve toplanan uygun glikoz analog standart, trehaloz analog standart (varsa), reaksiyon karışımına dahil şerit, (ya da fraksiyonlara analit (ler) ve ilgili standart (lar) uygulanır boyut exclusion kolon saflaştırması), ve bir ko-Noktası. TLC plakasına her bir örnek uygulandıktan sonra, levha kurumaya bırakın.
Not: Reaksiyon analizi için numune tipik olarak 2 uL TLC plakasına uygulanır. - N-butanol / etanol / deiyonize su kullanılarak TLC plakası geliştirmek (5: 3: 2).
- Şeker içeren noktalar (genellikle 5 dakika) görüntülenebilir kadar sonra yüksek ayarda bir sıcak plaka üzerinde etanol (şeker leke) ve ısı% 5 H 2 SO 4 daldırın, geliştirilen TLC plakası kurutun.
- Mark bir kalem ile TLC plakası yüzeyinde şeritleri ve toplanan uygun glikoz analog standart, trehaloz analog standart (varsa), reaksiyon karışımına dahil şerit, (ya da fraksiyonlara analit (ler) ve ilgili standart (lar) uygulanır boyut exclusion kolon saflaştırması), ve bir ko-Noktası. TLC plakasına her bir örnek uygulandıktan sonra, levha kurumaya bırakın.
- Ayrılması ve karbonhidrat saptayabilen bir HPLC sistemi kullanılarak tRet Reaksiyon karışımlarının HPLC analizi yapın. Bu protokol kırılma indeksi kullanan bir aminopropil HPLC kolonu ve algılama kullanarak karbonhidrat ayrılmasını gerektirir.
- HPLC için bir ön-sütun guard içeren aminopropil sütunu (4.6 x 250 mm) takın.
- 0.4 bir akış oranında, deiyonize su içinde% 80 asetonitril ile aminopropil sütun dengeyemL / dakika.
- aminopropil kolonuna reaksiyon ürünü (veya standart) çözeltisi yerleştirin.
- 0.4 ml / dakikalık bir akış oranı ve 50 ° C kolon sıcaklığı deiyonize su içinde% 80 asetonitril ile ürün (veya standart) yıkayın. Tipik olarak, kullanılan çalışma süresi 40 dakikadır.
NOT: buharlaştırıcı ışık saçma tespiti (ELSD) gibi diğer yöntemler kullanılabilir, ancak glükoz analoğu başlangıç malzemesi ve trehaloz analog ürünün her ikisi de, kırılma endeksi ile tespit edilebilir. dk ve trehaloz analogları 15-25 dakika arasında Zehir 10-15 arasında tarif edilen koşullar kullanılarak, glikoz benzerleri genellikle Zehir.
- Saflaştınldı trehaloz analoglarının NMR analizi.
- D 2 O (700 uL) içinde arıtılmış trehaloz analog çözülür ve bir NMR tüpüne çözeltisi aktarın.
- 1 H NMR ve uygun tesisin protokollerine göre 13C NMR spektrumları elde edin.
5. Mikobakteriler Algılama Tret sentezlenmiş Trehaloz Analoglarının Uygulaması
- , Sentez arındırmak, ve M. smegmatis 6-TreAz (Msmeg) yönetmek.
- 15 ml konik bir tüp 6-azido-6-deoksi glukopiranoz (6-GlcAz, 0.020 mmol, 4.1 mg), UDP-glikoz (0.040 mmol, 24.4 mg) ve MgCl2 (0.020 mmol, 4.1 mg) eklenir.
- 300 ug / mL'lik bir son enzim konsantrasyonu 1 ml'lik bir nihai hacim elde etmek için (adım 1.5.4 de elde edilmiş) Tris tamponu tRet ekleyin. Pipetleyin Karışım yukarı ve aşağı yavaşça veya katıların çözünmesi için tüp ters.
- 15 dakika boyunca çalkalayarak 70 ° C 'de reaksiyon inkübe edin.
- iyonu giderilmiş su, 3 mL ile enzimatik tepkime karışımı seyreltik bir önceden yıkanmış, santrifüj, filtre ünitesinin (NMWL 10 kDa) aktarın. sıvının çoğu, yaklaşık tüp içine filtre üzerinden 10 dakika geçinceye kadar 3.000 xg'de filtre ünitesini santrifüj.
- Sil incisantrifüj filtre ünitesinin e üst bölme. 25 dakika için oda sıcaklığında tüp ve bir karıştırma / titremesi karma yataklı iyon-değişim reçinesi (0.75 g) ekleyin. Süpernatantı Durusu ve reçine çıkarmak için filtre.
Not: Adım 5.1.1-5.1.5 az 1 saat, yaklaşık 5 mM konsantrasyonda 6-azido-trehaloz (6-TreAz) sulu bir çözüm sağlar. 5 mM konsantrasyonu, ürünün alt tabaka kantitatif dönüşüm ve bu adımlar sırasında ürünün asgari seviyede kayıp varsayarak, saflaştırma adımları sırasında yer alır seyreltme göre tahmin edilir. Çözelti steril olarak filtrelenir, istenirse, bir biyolojik numuneye eklenmeden önce olabilir. - 100-1,000 uL nihai kültür hacmi ve 25 uM aralığında bir son 6-TreAz konsantrasyon elde etmek için, tipik olarak, M. smegmatis bir log-faz kültürünü (Msmeg) 6-TreAz ürün çözeltisinin uygun bir hacim. istenen süre, tipik olarak 60 dakika boyunca 37 ° C'de inkübe hücreleri.
- Azid etiketli hücrelere bir flüorofor konjuge için kimya tıklayın gerçekleştirin. Bu protokol, Msmeg hücre yüzeyi azidler bir florofor sağlamak için bakır ile katalize edilen azit-alkin sikloadisyon (CuAAC) kullanın.
- 5 dakika boyunca 3,900 x g'de santrifüjleyin hücreleri, ve daha sonra PBS,% 0.5 sığır serum albümini ihtiva eden hücreleri yıkayın. İki kez tekrarlayın.
- bunları düzeltmek için PBS içinde% 4 para-formaldehit pelet hücreleri yeniden askıya. 10 dakika süreyle kuluçkalandıktan sonra hücreler, yıkama adımı 5.2.1 tekrarlayın.
- 138 uL PBS içinde pelet hücreleri yeniden askıya.
- DMSO içinde alkin karboksirodamin 110 (Alkin-488) 'in bir 1 mM stok çözelti 3 mcL.
- iyonu giderilmiş su içinde sodyum askorbat taze hazırlanmış bir 60 mM stok solüsyonu 3 uL ekleyin.
- Tert-butanol / dimetilsülfoksit Tris [(1-benzil-1H-1,2,3-triazol-4-il) metil] amin (TBTA) içindeki bir 6.4 mM stok çözeltisi (DMSO) 3 mcL 4: 1 arasındadır.
- 3 & # ekle956; deiyonize su içinde CuSO 4 bir 50 mM stok solüsyonu ilave.
- Pipet Hücre süspansiyonu yukarı ve aşağı, daha sonra 30 dakika boyunca oda sıcaklığında karanlıkta inkübe edilir.
- Adımı tekrarlayın 5.2.1 hücreleri yıkamak için. 150 ul PBS hücrelerin yeniden askıya.
- Hücresel floresan analizi yapın. Bu protokol, etiketli Msmeg hücresel floresan görselleştirmek için floresan mikroskobu kullanın.
- Bir mikroskop lamı PBS içinde süspansiyon haline getirilmiş bakteri hücreleri 10 ul ekleyin ve hafifçe lamel kenarına kullanılarak ince bir tabaka halinde sıvı yayıldı. karanlıkta kuru hava için izin verin.
- Daha sonra yapıştırıcı kapak numunesi üzerinde kayıyor yerleştirin ve uygulamak, kurutulmuş numune üzerinde montaj orta 10 uL ekleyin (örneğin, oje) hareketsiz hale getirmek.
- Görüntü 100X büyütmede bir floresan mikroskop kullanılarak slaytlar.
Sonuçlar
T. Tenax tRet yaklaşık 4 mg, standart protein ekspresyonu ve saflaştırma teknikleri kullanılarak / L'lik bir verimle elde etmek üzere, E. coli 'den elde edilmiştir. Tek bir nikel afinite kromatografisi adım (a Örnek FPLC izleme Şekil 4'te gösterilmiştir), E. coli lizattan tRet saflaştırmak için yeterliydi. TRet sentez işlemi üzerindeki ilk yayında kurulmuş olarak, yeniden birleştirici T. Tenax tRet çeş...
Tartışmalar
Trehaloz analogları gıda ve ilaç korunması mikrobiyal enfeksiyonların 6 tanı ve tedavi, çeşitli alanları etkileme potansiyeline sahiptir. Mevcut çok basamaklı kimyasal sentez yöntemi (doğal karmaşık mikobakteriyel glikolipitler ortaya çıkan gibi) modifikasyon birden fazla site kompleks trehaloz analoglarını üretmek için de yararlıdır. Bununla birlikte, bu yöntemler, nispeten basit bir tekli ikame edilmiş trehaloz analogları 9, ...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was funded by a grant from the National Institutes of Health (R15 AI117670) to B.M.S and P.J.W, as well as a Cottrell College Scholar Award from the Research Corporation (20185) to P.J.W. L.M.M. was supported by a Provost's Fellowship from CMU.
Malzemeler
| Name | Company | Catalog Number | Comments |
| LB agar | Research Products International | L24021 | |
| Ampicillin sodium salt | Sigma Aldrich | A9518 | |
| Luria broth | Research Products International | L24045 | |
| Terrific Broth | Research Products International | T15050 | |
| L-(+)-Arabinose | Sigma Aldrich | A3256 | |
| Phosphate-buffered Saline | GE Healthcare | SH30256 | |
| Imidazole | Sigma Aldrich | I5513 | |
| Sodium chloride | BDH | BDH9286 | |
| Sodium phosphate, monobasic | Fisher Scientific | S374 | |
| Syringe filter, 0.45 µm | Fisher Scientific | 09719D | |
| Protease Inhibitor mini-tablets, EDTA-free | Thermo Scientific | 88666 | |
| HisTrap HP nickel affinity column, 5 mL | GE Healthcare | 17-5248-02 | |
| TRIS base ultrapure | Research Products International | T60040 | |
| Dialysis tubing, MWCO 12–14,000 | Fisher Scientific | 21-152-16 | |
| Glucose analogues | CarboSynth, Sigma Aldrich, Santa Cruz Biotechnology, American Radiolabeled Chemicals | Examples of vendors that offer numerous glucose analogues | |
| 6-Azido-6-deoxy glucopyranose (6-GlcAz) | CarboSynth | MA02620 | |
| UDP-Glucose | abcam Biochemicals | ab120384 | |
| Magnesium chloride hexahydrate | Fisher Scientific | M33 | |
| Amicon Ultra-15 centrifugal filter unit | EMD Millipore | UFC901008 | |
| Bio-Rex RG 501-X8 mixed-bed ion-exchange resin | Bio-Rad | 444-9999 | |
| Extra-Fine Bio-Gel P2 media | Bio-Rad | 150-4118 | |
| Glass-backed silica gel thin-layer chromatography plates | EMD Millipore | 1056280001 | |
| n-Butanol | Fisher Scientific | A399 | |
| Ethanol | Fisher Scientific | S25310A | |
| Sulfuric acid | Fisher Scientific | A300 | |
| Acetonitrile | EMD Millipore | AX0145 | |
| Deuterium oxide, 99.8% | Acros Organics | 351430075 | |
| Aminopropyl HPLC column | Sigma Aldrich | 58338 | |
| Bovine serum albumin | Sigma Aldrich | 5470 | |
| Para-formaldehyde | Ted Pella | 18505 | |
| Alkyne-488 | Sigma Aldrich | 761621 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Click Chemistry Tools | 1061 | |
| tert-Butanol | Sigma Aldrich | 360538 | |
| Dimethylsulfoxide | Sigma Aldrich | W387520 | |
| Copper(II) sulfate | Sigma Aldrich | C1297 | |
| Fluoromount-G mounting medium | Southern Biotechnology | 10001 |
Referanslar
- Elbein, A. D., Pan, Y. T., Pastuszak, I., Carroll, D. New insights on trehalose: a multifunctional molecule. Glycobiology. 13, 17-27 (2003).
- Tournu, H., Fiori, A., Van Dijck, P. Relevance of trehalose in pathogenicity: some general rules, yet many exceptions. PLoS Pathog. 9, 1003447 (2013).
- Ohtake, S., Wang, Y. J. Trehalose: Current use and future applications. J. Pharm. Sci. 100, 2020-2053 (2011).
- Adams, R. P., Kendall, E., Kartha, K. K. Comparison of free sugars in growing and desiccated plants of Selaginella lepidophylla. Biochem. Syst. Ecol. 18, 107-110 (1990).
- Kubota, M., Ohnishi, M. . Glycoenzymes. , (2000).
- Walmagh, M., Zhao, R., Desmet, T. Trehalose analogues: latest insights in properties and biocatalytic production. Int. J. Mol. Sci. 16, 13729-13745 (2015).
- Kim, H. -. M., Chang, Y. -. K., Ryu, S. -. I., Moon, S. -. G., Lee, S. -. B. Enzymatic synthesis of a galactose-containing trehalose analogue disaccharide by Pyrococcus horikoshii trehalose-synthesizing glycosyltransferase: Inhibitory effects on several disaccharidase activities. J. Mol. Catal. B: Enzym. 49, 98-103 (2007).
- Backus, K. M., et al. Uptake of unnatural trehalose analogs as a reporter for Mycobacterium tuberculosis. Nat. Chem. Biol. 7, 228-235 (2011).
- Swarts, B. M., et al. Probing the mycobacterial trehalome with bioorthogonal chemistry. J. Am. Chem. Soc. 134, 16123-16126 (2012).
- Rose, J. D., et al. Synthesis and biological evaluation of trehalose analogs as potential inhibitors of mycobacterial cell wall biosynthesis. Carbohydr. Res. 337, 105-120 (2002).
- Wang, J., et al. Synthesis of trehalose-based compounds and their inhibitory activities against Mycobacterium smegmatis. Bioorg. Med. Chem. 12, 6397-6413 (2004).
- Gobec, S., et al. Design, synthesis, biochemical evaluation and antimycobacterial action of phosphonate inhibitors of antigen 85C, a crucial enzyme involved in biosynthesis of the mycobacterial cell wall. Eur. J. Med. Chem. 42, 54-63 (2007).
- Sarpe, V. A., Kulkarni, S. S. Regioselective protection and functionalization of trehalose. Trends in Carbohydr. Res. 5, 8-33 (2013).
- Chaube, M. A., Kulkarni, S. S. Stereoselective construction of 1,1-alpha,alpha-glycosidic bonds. Trends in Carbohydr. Res. 4, 1-19 (2013).
- Leigh, C. D., Bertozzi, C. R. Synthetic studies toward Mycobacterium tuberculosis sulfolipid-I. J. Org. Chem. 73, 1008-1017 (2008).
- Chaen, H., et al. Efficient enzymatic synthesis of disaccharide, alpha-D-galactosyl-alpha-D-glucoside, by trehalose phosphorylase from Thermoanaerobacter brockii. J. Appl. Glycosci. 48, 135-137 (2001).
- Vander Borght, J., Soetaert, W., Desmet, T. Engineering the acceptor specificity of trehalose phosphorylase for the production of trehalose analogs. Biotechnol. Progr. 28, 1257-1262 (2012).
- Kouril, T., Zaparty, M., Marrero, J., Brinkmann, H., Siebers, B. A novel trehalose synthesizing pathway in the hyperthermophilic Crenarchaeon Thermoproteus tenax: the unidirectional TreT pathway. Arch. Microbiol. 190, 355-369 (2008).
- Urbanek, B. L., et al. Chemoenzymatic synthesis of trehalose analogues: rapid access to chemical probes for investigating mycobacteria. ChemBioChem. 15, 2066-2070 (2014).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise Huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew. Chem. Int. Ed. 41, 2596-2599 (2002).
- Tornøe, C. W., Christensen, C., Meldal, M. Peptidotriazoles on solid phase: [1,2,3]-triazoles by regiospecific copper(I)-catalyzed 1,3-dipolar cycloadditions of terminal alkynes to azides. J. Org. Chem. 67, 3057-3064 (2002).
- Kalscheuer, R., Weinrick, B., Veeraraghavan, U., Besra, G. S., Jacobs, W. R. Trehalose-recycling ABC transporter LpqY-SugA-SugB-SugC is essential for virulence of Mycobacterium tuberculosis. Proc. Natl. Acad. Sci. U. S. A. 107, 21761-21766 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır