A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المتعدد الوسائط التصوير ومنهاج Microendoscopy الطيفي الألياف الرزمة لغير الغازية،
In This Article
Summary
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Abstract
تمكن تقنيات microendoscopy الألياف حزمة الأخيرة تحليل غير الغازية من الأنسجة في الجسم الحي باستخدام تقنيات التصوير أو مزيج من تقنيات التحليل الطيفي. الجمع بين تقنيات التصوير والتحليل الطيفي إلى التحقيق بصري واحد قد تقدم تحليلا أكثر اكتمالا من صحة الأنسجة. في هذه المقالة، يتم الجمع بين اثنين من طرائق متباينة، والتصوير عالية الدقة مضان microendoscopy ومنتشر الطيفي الانعكاس، إلى التحقيق بصري واحد. عالية الدقة مضان microendoscopy التصوير هو أسلوب يستخدم لتصور الأنسجة القمية العمارة الصغرى، وعلى الرغم من أن معظمهم تقنية النوعية، وقد أثبتت التمايز في الوقت الحقيقي الفعال بين الأنسجة الورمية وغير الورمية. منتشر الانعكاس الطيفي هو الأسلوب الذي يمكن استخراج المعلمات الفسيولوجية الأنسجة بما في ذلك تركيز المحلية الهيموغلوبين، وتركيز الميلانين، وتشبع الأكسجين. توضح هذه المقالة مواصفات صequired لبناء مسبار الألياف البصرية، وكيفية بناء الأجهزة، ومن ثم يظهر أسلوب في الجسم الحي في جلد الإنسان. وكشف هذا العمل أن الأنسجة المعمارية الصغيرة، الكيراتينية الجلد قمي على وجه التحديد، يمكن أن يشترك المسجلة مع المعلمات الفسيولوجية المرتبطة بها. التحقيق الأجهزة والألياف حزمة المقدمة هنا يمكن أن يكون الأمثل إما جهاز محمول باليد أو بالتنظير متوافق للاستخدام في مجموعة متنوعة من أجهزة الجسم. هناك حاجة إلى بحوث سريرية إضافية لاختبار جدوى هذه التقنية لمختلف الحالات المرضية الظهارية.
Introduction
تقنيات حزمة ليفية microendoscopy تحليل عادة في الأنسجة الحية باستخدام تقنيات التصوير أو مزيج من تقنيات التحليل الطيفي. 1-3 أسلوب واحد التصوير هذه، وارتفاع القرار مضان microendoscopy، يمكن أن الصورة الأنسجة القمية المعمارية المصغرة لقرار الفرعية الخلوية في صغيرة ، مجال للرأي الميكروسكيل، وذلك باستخدام عامل تباين موضعي مثل بروفلافين، فلوريسئين، أو الحبر pyranine. 1،3-11 وقد أظهرت هذه الطريقة التصوير واعدة الأداء السريري في التفريق بين نوعي الأنسجة الطلائية المريضة وصحية في الوقت الحقيقي مع انخفاض بين المراقب تقلب 8 أحيانا، فإن المحققين استخدام البيانات مضان المجهر عالية الدقة لاستخراج الخصائص الكمية مثل الخلية وحجم النووي أو منطقة الغدة، ولكن هذا لا يزال تقنية نوعية في المقام الأول تستهدف تصور مورفولوجيا الأنسجة. 1،3،8- 10 من ناحية أخرى، وتقنيات التحليل الطيفي، مثلكما الطيفي الانعكاس منتشر، والتي تستهدف توفير المعلومات الأنسجة وظيفية واعدة أظهرت الأداء السريري في تحديد الكمية الآفات السرطانية في أعضاء متعددة. 2،12-15
لذلك، هناك حاجة لجهاز يدمج كلا النوعين من الطرائق التي يحتمل مزيد من خفض التباين بين المراقب، والحفاظ على التصور في الوقت الحقيقي من الأنسجة الهندسة الدقيقة، وتقديم تحليل أكثر اكتمالا من صحة الأنسجة. لتحقيق هذا الهدف، تم بناء أداة تستند مسبار المتعدد الوسائط الذي يجمع بين اثنين من أساليب في التحقيق من الألياف البصرية واحد: عالية الدقة microendoscopy مضان ودون منتشر الطيفي الانعكاس 11 هذا الأسلوب شارك في سجلات النوعية صور عالية الدقة من قمية مورفولوجيا الأنسجة (الخصائص الهيكلية) مع المعلومات الكمية الطيفية (خصائص وظيفية) من اثنين من أعماق الأنسجة متميزة بما في ذلك تركيز الهيموغلوبين المحلي ([هب])، وتركيز الميلانين ([ميل])، وتشبع الأكسجين (ساو 2). 11،12،16 تستخدم هذه الطريقة محددة الانعكاس الطيفي شبه منتشر اثنين من فصل المصدر للكشف عن (SDSS) لعينة اثنين من أعماق الأنسجة فريدة من نوعها لتوفير صورة أشمل للصحة الأنسجة عن طريق أخذ عينات وصولا الى الغشاء القاعدي وسدى النسيج الأساسي. 11
يتكون مسبار الألياف من الألياف المركزي صورة 1 مم القطر مع ما يقرب من 50،000 4.5 ميكرون عناصر الألياف قطر، قطر الكسوة من 1.1 ملم وقطرها طلاء الإجمالي 1.2 مم. وتحيط الألياف الصورة عن طريق خمسة 200 ميكرون الألياف قطر بأقطار الكسوة من 220 ميكرون. يقع كل الألياف 200 ميكرون المتعدد مسافة مركز إلى مركز من 864 ميكرون بعيدا عن مركز من الألياف الصورة. كل واحد من 200 ميكرون الألياف المتعدد هي 25 درجة على حدة. باستخدام أقصى 200 ميكرون الألياف متعددة مثل الألياف "مصدر"، وعشر إضافيري 200 ميكرون الألياف المتعدد والألياف "جمع"، هذه الهندسة بالضرورة يخلق ثلاثة مركز إلى مركز SDSS من 374 ميكرون، 730 ميكرون، 1051 ميكرون، و1،323 ميكرون. أرفقت نصائح الألياف في غلاف معدني اسطواني التي تحافظ على المسافات بين الألياف ثابت. قطر غلاف معدني أسطواني هو 3 مم. نهاية البعيدة (نحو التحقيق غيض من الألياف البصرية) لجنة التحقيق الألياف الضوئية هو 2 أقدام طويلة. ثم يفصل التحقيق في ستة الألياف الفردية منها في نهاية القريبة (نحو الأجهزة) وهو إضافية 2 أقدام طويلة، ليصل مجموع أطوالها إلى 4 أقدام. ويبين الشكل 1 تمثيل لجنة التحقيق من الألياف البصرية.

الشكل 1: الألياف البصرية تصميم التحقيق ويتكون المسبار من الألياف البصرية واحد من الألياف صورة 1 ملم وقطرها أربعة 200 ميكرون الألياف المتعدد. هذايظهر الرقم تمثيل (أ) نهاية سقف المعدني الذي يحد من هندسة الألياف في تلميح التحقيق لانتاج SDSS من 374، 730، و1،051 ميكرون فيما يتعلق أقصى 200 الألياف ميكرون المتعدد (مقياس شريط ≈ 1 مم)، (ب) والألياف التي مقيدة داخل غطاء معدني، والتي تبين النوى الألياف، الكسوة الألياف، وطلاء الألياف (مقياس شريط ≈ 1 مم)، (ج) ومادة البولي أميد تغليف الحماية حول الألياف (مقياس شريط ≈ 1 مم)، (د ) الطرف البعيد الانتهاء من التحقيق، مع قبضة الإصبع المعادن وكابل أسود واحد يحتوي على جميع الألياف (مقياس شريط ≈ 4 مم)، و (ه) صورة من الطرف البعيد لجنة التحقيق (مقياس شريط ≈ 4 مم). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
هذه الأجهزة المتعدد الوسائط وTECHNI المرتبطةكيو هو مزيج الأول من هذه الطرائق في تحقيق واحد، على الرغم من التقنيات الأخرى مجتمعة الهيكلية / وظيفية موجودة التي تجمع بين طرائق مختلفة. على سبيل المثال، والتصوير الطيفية يجمع بين التصوير واسعة المجال مع الهيموجلوبين والميلانين الخصائص الكمية، 17،18 وغيرها من التقنيات تم تطويرها التي تجمع بين التصوير المقطعي التماسك البصري (أكتوبر) مع تحليل بروتين تعبير الأنسجة، 19 على سبيل المثال لا الحصر. هذه التقارير المادة على إعداد الأجهزة المدمجة وسهلة لتنفيذ يستخدم مسبار الألياف الضوئية العام الذي يمكن أن يكون الأمثل لأغراض مختلفة بما في ذلك استخدام المنظار في الجهاز الهضمي السفلي والمريء أو التحقيق المحمولة للاستخدام في تجويف الفم والخارجيين وضع الجلد. 11،20
الأجهزة لهذه الأجهزة يتطلب على حد سواء الحصول على البيانات حسب الطلب ورمز مرحلة ما بعد المعالجة للحصول على منتشر الأطياف الانعكاس ومن ثم استخراج نظام القبول الناتجةالمعلمات الأنسجة متوسط ه الفسيولوجية بما في ذلك [هب]، [ميل]، وساو 2. بنيت رمز الحصول على البيانات المخصصة للسماح للشراء في وقت واحد من كاميرا (عالية الدقة مضان المجهر) ومطياف (لالطيفي الانعكاس منتشر). السائقون المتاحة من المواقع الصانعين للسماح للتكامل مع مجموعة متنوعة من لغات البرمجة في كثير من الأحيان. رمز مخصص مرحلة ما بعد المعالجة تستورد القيم امتصاص المسبقة في الجسم الحي [هب] و [ميل] 21 ثم يستخدم التحسين غير الخطية عملية تركيب وضعت في وقت سابق ان يخلق منحنى المجهزة من الأطياف. تم بناء 22 ومنحنى المجهزة عن طريق التقليل من χ 2 قيمة بينه وبين أطياف الخام وتحديد المعايير الفسيولوجية الأنسجة ([هب]، [ميل]، وساو 2) من منحنى المجهزة وبأقل χ 2 قيمة 22 الرمز يمكن تعديلها لتشملالامتصاص من حاملات أخرى أيضا، مثل الحبر pyranine خارجي المستخدمة هنا، حتى أن الهدف المعلمات الفسيولوجية تتأثر.
المؤشرات الفسيولوجية للصحة الأنسجة، مثل [هب]، [ميل]، وساو 2، ويمكن استخدام تقارير استجابة الورم للعلاج أو مؤشرات الأوعية الدموية المحلي والأوعية الدموية. 14،23 بما في ذلك دقة عالية ومضان microendoscopy طريقة يساعد دليل التحقيق التنسيب ويقدم المحققون مع صورة أكثر اكتمالا للعلاقة بين بنية الأنسجة الظهارية وظيفة. في هذه المقالة، وبناء وتطبيق microendoscope المتعدد الوسائط يوصف. 11
Access restricted. Please log in or start a trial to view this content.
Protocol
تم الحصول على موافقة لجنة المراجعة المؤسساتية (IRB # 15-09-149) من البرنامج الموضوعات البحوث الإنسانية في جامعة أركنساس لجميع جوانب هذه الدراسة. تم تنفيذ الأساليب المذكورة وفقا للمبادئ التوجيهية المعتمدة، وتم الحصول على الموافقة المسبقة من جميع المشاركين.
1. جمعية عالية الدقة الإسفار Microendoscopy القيد
ملاحظة: يمكن تصور الخطوات الموضحة لتجميع عالية الدقة مضان microendoscopy الطريقة في الشكل 2.
- وضع 470 نانومتر مزدوج اللون مرآة داخل قفص مكعب 30 ملم.
- الحصول على قفص مكعب 30 ملم وإزالة فلتر مزدوج اللون جبل.
- وضع مزدوج اللون مرآة 470 نانومتر في فلتر مزدوج اللون جبل.
- إعادة إدراج وتأمين فلتر مزدوج اللون جبل إلى داخل المكعب القفص.
- نعلق قفص قضبان الجمعية إلى قفص مكعب 30 ملم.
- آمنةأربعة قضبان التجمع قفص 1.5 بوصة إلى الأمام من المكعب القفص.
- تأمين أربعة قضبان 3.0 بوصة قفص التجمع إلى الجانب الأيمن من المكعب القفص.
- آمنة اثنين من قضبان 2.0 بوصة قفص التجمع قطريا على الجانب الأيسر من القفص مكعب.
- بناء / عدسة الجمعية أنبوب قفص اللوحة.
- الحصول على 1.0 بوصة الخيوط 30 ملم لوحة القفص وإرفاق الإجهاد حلقة الاحتفاظ الحرة إلى داخل لوحة القفص باستخدام خيوط المقدمة.
- المسمار في أنبوب عدسة 1.0 بوصة إلى الحلبة الاحتفاظ خالية من الإجهاد.
- إرفاق الثانية 1.0 بوصة مترابطة 30 لوحة مم القفص لأنبوب عدسة 1.0 بوصة وضبط حلقات الاحتفاظ القياسية بحيث لوحات قفص هما دافق.
- حرك / عدسة الجمعية أنبوب 1.0 بوصة قفص اللوحة على الجانب الأيسر من قفص مكعب 30 ملم.
- بناء مرآة الزاوية اليمنى جبل التجمع.
- الحصول على مرآة الزاوية اليمنى جبل وزيادة الأشعة فوق البنفسجية-1.0 بوصة مرآة الألومنيوم.
- وضع المؤتمر الوطني العراقي 1.0ح الأشعة فوق البنفسجية تعزيز مرآة الألومنيوم في المرآة جبل وتشديد.
- تأمين أربعة قضبان التجمع قفص 2.0 بوصة إلى الجزء الأمامي من مرآة جبل
- آمنة اثنين من قضبان 2.0 بوصة قفص التجمع قطريا على الجانب الأيمن من المكعب القفص.
- ربط مرآة الزاوية اليمنى جبل التجمع على الجانب الأيسر من أنبوب التجميع 1.0 بوصة لوحة قفص / عدسة عن طريق وضع قضبان التجمع قفص المعارضة من خلال فتحات كل من لوحة قفص 30 ملم.
- كاتب الموضوع ترجمة ض محور جبل من خلال 3.0 بوصة قضبان التجمع قفص على الجانب الأيمن من التجمع.
- إرفاق 10X عدسة الهدف الوني إلى ترجمة ض محور جبل.
- بناء 1.0 بوصة لوحة محول الألياف / س ص المحور عدسة الترجمة جبل التجمع.
- الحصول على جبل ترجمة س ص المحور و1.0 بوصة لوحة محول الألياف.
- تأمين 1.0 بوصة الألياف لوحة محول إلى س ص المحور عدسة الترجمة جبل.
- ر الشرائحكان 1.0 بوصة الألياف محول / س ص المحور عدسة الترجمة جبل التجمع أمام العدسة الشيئية.
- الحصول على اثنين من 0.5 بوصة طويلة، 1.0 بوصة أنابيب عدسة القطر، واحد 440/40 نانومتر ممر الموجة مرشح (فلتر الإثارة) واحدة 525/36 نانومتر ممر الموجة مرشح (فلتر الانبعاث).
- وضع كل مرشح داخل 0.5 بوصة طويلة، 1.0 بوصة أنبوب عدسة القطر، بحيث السهم على السطح الخارجي للمرشح يواجه الجانب من أنبوب العدسة مع المواضيع الخارجية.
- نعلق المرشحات للجمعية.
- الحصول على حلقتين الاحتفاظ القياسية.
- تأمين الفلاتر داخل 0.5 بوصة طويلة، وأنابيب 1.0 بوصة عدسة قطر مع حلقات الاحتفاظ القياسية.
- المسمار في أنبوب العدسة مع مرشح الإثارة إلى الجزء الأمامي من القفص المكعب 30 مم والمسمار في أنبوب العدسة مع مرشح الانبعاثات إلى المرآة الزاوية اليمنى جبل.
- المسمار في الأنبوب عدسة 0.5 بوصة مع مرشح الانبعاثات إلى أمام المرآة الزاوية اليمنى جبل.
- Obtaiن اثنين من 1.0 بوصة مترابطة 30 لوحات قفص ملم ووضعها أمام الأنابيب 0.5 بوصة طويلة، 1.0 بوصة عدسة قطر التي تحتوي على مرشحات.
- استخدام الايبوكسي أو لاصق قوي، إرفاق 455 نانومتر الصمام لوحة قفص متصلا مرشح الإثارة.
- الحصول على واحد 0.5 بوصة طويلة، 1.0 بوصة أنبوب عدسة القطر و1.0 بوصة الوني عدسة أنبوب صدرة مع طول بؤري 50 مم.
- ضع العدسة أنبوب داخل أنبوب العدسة بحيث يكون السهم على السطح الخارجي للعدسة يواجه الجانب من أنبوب العدسة مع المواضيع الخارجية.
- المسمار في عدسة أنبوب للجمعية.
- الحصول على حلقة واحدة الاحتفاظ القياسية.
- تأمين عدسة داخل 0.5 بوصة طويلة، 1.0 بوصة أنبوب العدسة قطر مع حلقة التثبيت القياسية.
- نعلق أنبوب العدسة مع عدسة أنبوب لوحة قفص اليسرى الأكثر.
- وضع لوحة قفص 30 ملم أمام 0.5 بوصة طويلة، 1.0 بوصة أنبوب قطره عدسة تحتوي على عدسة أنبوب.
- إرفاق الإجهاد حلقة الاحتفاظ الحرة إلى داخل لوحة قفص 30 ملم.
- إرفاق كاميرا USB أحادية اللون لوحة قفص مع الإجهاد حلقة الاحتفاظ مجانا.
- بناء الأجهزة بعد تصاعد البصرية.
- الحصول على أربعة حاملي 0.5 بوصة آخر، وأربع 0.5 بوصة المشاركات البصرية، وأربع قواعد التركيب.
- تأمين الوظائف البصرية 0.5 بوصة داخل حاملي آخر 0.5 بوصة.
- تأمين أصحاب ظيفة 0.5 بوصة على قواعد التركيب.
- المسمار في الأجهزة المتزايدة أربعة آخر البصرية لفتحات المسامير الموجودة تحت القفص المكعب 30 ملم، ومرآة الزاوية اليمنى جبل، لوحة قفص متصلا LED، ولوحة قفص متصلا الكاميرا.
- المسمار في أربعة منصب البصرية الأجهزة إما إلى اللوح البصرية أو الجدول البصرية متزايدة لإنهاء بناء عالية الدقة مضان microendoscopy الطريقة.
ftp_upload / 54564 / 54564fig2.jpg "/>
الشكل 2: يمكن بناؤها جمعية عالية الدقة مضان microendoscopy طريقة وطريقة عالية الدقة مضان microendoscopy من خلال بناء قذيفة من مكونات القطر الحجم 1.0 بوصة، مع عناية خاصة اتخذت في التعامل مع المرآة مزدوج اللون، عدسة موضوعية، الإثارة / مرشحات الانبعاثات، وعدسة أنبوب. الواجهات الزجاجية من هذه المكونات يجب التعامل بعناية باستخدام ورقة عدسة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. جمعية الفرعية المنتشرة القيد الانعكاس الطيفي
ملاحظة: يمكن تصور الخطوات الموضحة لتجميع طريقة الانعكاس الطيفي شبه منتشر في الشكل (3).
- الحصول على مصدر ضوء ساطع من الهالوجين، واستخدام الايبوكسي أو مادة لاصقة قوية، وتأمين threade 1.0 بوصةد 30 ملم لوحة قفص على الجبهة.
- تأمين أربعة قضبان التجمع قفص 3.0 بوصة لوحة القفص.
- إرفاق ترجمة ض محور جبل لقضبان التجمع القفص.
- المسمار في 20X الوني عدسة موضوعية لترجمة ض محور جبل.
- بناء الألياف لوحة محول / س ص المحور عدسة الترجمة جبل التجمع.
- الحصول على جبل ترجمة س ص المحور و1.0 بوصة الألياف لوحة محول.
- تأمين لوحة محول الألياف إلى س ص المحور عدسة الترجمة جبل.
- حرك 1.0 بوصة محول الألياف / س ص الترجمة جبل التجمع أمام العدسة الشيئية.
- بناء التجمع الذراع المحرك.
- الحصول على ذراع محرك الألومنيوم مبنية خصيصا واحد SMA لوحة محول الألياف.
- المسمار في لوحة محول الألياف (مع خيوط الخارجي) في الذراع الألومنيوم المحرك (مع خيوط الداخلي).
- إرفاق مبنية خصيصا الألومنيوم ذراع محرك محول إلى الذراع المحرك مع أربعة # 4-40 0.5 في مسامير.
- بناء المحرك / المحرك الجمعية السكنية ذراع / المحرك.
- الحصول على السكن الألومنيوم السيارات مبنية خصيصا وال 400 خطوة السائر المحركات.
- يصطف فتحات المسامير على السائر المحركات والإسكان السيارات ومن ثم تأمين مع أربعة # 4-40 مسامير 0.5 بوصة.
- تغذية قضيب السيارات الدورية للالسائر المحركات من خلال افتتاح الجمعية الذراع المحرك وتشديد المسمار تأمين على محول الذراع الألومنيوم المحرك.
- بناء التجمع التبديل البصرية.
- الحصول على التبديل البصرية الألومنيوم مبنية خصيصا وثلاث لوحات محول الألياف 1.0 بوصة.
- كاتب الموضوع لوحات محول في الثقوب الخيوط في التبديل البصرية.
- إرفاق الألومنيوم التبديل البصرية وجها لوحة مبنية خصيصا على التبديل البصرية مع أربعة مسامير # 4-40 0.5 بوصة.
- إرفاق المحرك / المحرك ذراع / محرك الجمعية السكنية لالتبديل البصرية عن طريق تغذية قضيب السيارات الدورية للالسائر المحركات من خلال ثقب المركزي رانه التبديل البصرية.
- الحصول على لوحة الدوائر الكهربائية وسائق السيارات السائر، ومن ثم وضع سائق السيارات السائر عبر الأخدود المركزي من اللوح.
- مراقبة التخطيطي الربط الكهربائي (الشكل 3، 2.12) للسائق السائر المحركات، 12 V إمدادات الطاقة، والسائر المحركات.
- ربط السائق السائر المحركات، 12 V إمدادات الطاقة، والمحركات السائر على النحو المحدد في مخطط الرسم البياني (الشكل 3، 2.12) لاستكمال بناء التبديل البصرية الآلية.
- المسمار في مكونات التبديل ومصدر ضوء ساطع من الهالوجين البصري إلى اللوح البصرية أو الجدول الضوئية قرب شيدت سابقا (الشكل 2، 1.24) عالية الدقة التجمع مضان microendoscopy.
- نعلق واحدة من نهاية 550 ميكرون، 0.22 NA كابل التصحيح إلى 1.0 بوصة لوحة محول الألياف للجمعية الذراع المحرك.
- نعلق على الطرف الآخر من 550 ميكرون، 0.22 NA التصحيح كابل للألياف الاتصالأو من مطياف USB.
- المسمار في الكابلات التحقيق خمسة البعيدة إلى 1.0 بوصة لوحات محول الألياف منها على الأجهزة لإنهاء الانتهاء من متعدد الوسائط عالية الدقة التصوير ودون منتشر الانعكاس الطيفي الألياف حزمة microendoscope.
- المسمار في 1 ملم المركزي كابل الألياف صورة قطر على لوحة محول الألياف 1.0 بوصة المذكورة في الخطوة 1.9.2.
- المسمار في أقصى 200 ميكرون كابل الألياف متعددة على لوحة محول الألياف 1.0 بوصة المذكورة في الخطوة 2.6.
- المسمار في 2 الثانية 200 ميكرون كابل الألياف متعددة إلى أقصى 1.0 بوصة محول الألياف تعلق على مصباح التنجستن الهالوجين المذكورة في الخطوة 2.9.2.
- المسمار في 3 الثالثة 200 ميكرون كابل الألياف متعددة إلى 1.0 بوصة لوحة محول الألياف الوسطى المذكورة في الخطوة 2.9.2.
- المسمار في كابل الألياف متعددة 4 ال 200 ميكرون إلى 1.0 بوصة لوحة محول الألياف أقصى اليمين المذكورة في الخطوة 2.9.2.

الرقم 3: جمعية طريقة الانعكاس الطيفي شبه منتشر في شبه منتشر الانعكاس الطيفي طريقة يمكن بناؤها باستخدام مصباح التنجستن الهالوجين الأساسي بالإضافة إلى عدسة موضوعية لتركيز الضوء من خلال الألياف تسليم 200 ميكرون المتعدد، ومطياف. بالإضافة إلى ذلك، التبديل البصرية الآلية مبنية خصيصا يمكن بناؤها ضمن مسار مصباح الألياف مطياف للتبديل بين كل SDS. المحققون باستخدام الطيف متعددة للحصول على من عدة SDSS يمكن تجاوز مكون التبديل البصرية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.3. معايرة الفرعية منتشر الانعكاس الطيفي القيد
ملاحظة: ويجب أن تكتمل ollowing الخطوات (القسم 3) قبل جمع البيانات الطيفية (القسم 4).
- بدوره على جميع مكونات الأجهزة، بما في ذلك نانومتر 455 الصمام، والنطاق العريض مصباح التنجستن الهالوجين، وكاميرا CMOS، مطياف USB، السائر المحركات، والمجلس التحكم في المحركات. ضمان مصراع على مصباح التنجستن الهالوجين مفتوح.
- إيقاف كافة الإضاءة المحيطة.
- فتح البرنامج الحصول على البيانات المخصصة.
- إبقاء أجهزة تشغيل لمدة 30 دقيقة لمصباح التوصل إلى درجة حرارة مناسبة وللضوضاء المتأصلة من مطياف لتحقيق الاستقرار.
- وضع 20٪ منتشر مستوى الانعكاس داخل فتح السفلي من، جهاز قياسي 3D معايرة المطبوعة مبنية خصيصا.
- وضع مسبار الألياف البصرية داخل أقصى اليسار فتحة من العرف، 3D المطبوعة الألياف حامل، أظهرت في الشكل (4). وأقصى اليسار فتحة إصلاح المسافة العمودية من التحقيق غيض من الألياف البصرية إلى مستوى الانعكاس على 2.1 ملم، وهو المرجعبعد timum التي يتم تكبير إشارة الوصول إلى مطياف لSDS الأولى من 374 ميكرون.
- ضبط التبديل البصرية الآلية لموقف اليسار أكثر من هذا القبيل أن مطياف متصل SDS الأولى من 374 ميكرون.
- ضبط الوقت التكامل إلى 500 مللي ثانية. يجب اختيار هذا الوقت التكامل حتى لا تشبع طيف ولكن الحفاظ على الوقت التكامل منخفضة عمليا.
- الحصول على الطيف، R ماكس، 374μm، بالنقر على "الحصول على الطيف" في البرنامج.
- إغلاق مصراع على مصباح التنجستن الهالوجين وتسجيل الطيف، R الظلام، 374μm، من الضوضاء في الخلفية، بالنقر على "اكتساب الطيف" في البرنامج. وبمجرد الحصول عليها، فتح مصراع مرة أخرى.
- وضع مسبار الألياف البصرية داخل فتحة أقصى اليمين من العرف، 3D المطبوعة الألياف حامل، أظهرت في الشكل (4)، وفتحة أقصى اليمين على إصلاح المسافة العمودية من الألياف سptic التحقيق تلميح إلى مستوى الانعكاس على 3.9 ملم، والتي هي المسافة المثلى التي يتم تكبير إشارة الوصول إلى مطياف لSDS الثاني من 730 ميكرون.
- ضبط التبديل البصرية الآلية إلى موقف وسط من هذا القبيل أن مطياف متصل SDS الثانية من 730 ميكرون.
- الحصول على الطيف، R ماكس، 730μm، بالنقر على "الحصول على الطيف" في البرنامج.
- إغلاق مصراع على مصباح التنجستن الهالوجين وتسجيل الطيف، R الظلام، 730μm، من الضوضاء في الخلفية، بالنقر على "اكتساب الطيف" في البرنامج.
- فتح مصراع مرة أخرى.

الرقم 4: معايرة طريقة الانعكاس الطيفي شبه منتشر لمعايرة ما قبل التجريبية، يجب وضع تلميح التحقيق الألياف الضوئية في مختلفمسافات المتعامدة من 20٪ مستوى الانعكاس منتشر اعتمادا على SDS. لتحقيق باستمرار هذه المسافات عمودي عبر كل التجارب، تم تصميم جهاز المعايرة القياسية (المقطع العرضي جهاز مبين في الفقرة (أ)) لاجراء التحقيق في المسافات الدقيقة من 20٪ مستوى الانعكاس منتشر. في هذا الإعداد معينة التحقيق الألياف الضوئية، ويظهر ضوء من مصباح التنجستن الهالوجين من خلال التبديل البصرية في فصل مصدر للكشف عن من (ب) 374 ميكرون و (ج) 730 ميكرون (مع محرك والمحرك الذراع إزالتها من مسار بصري للتوضيح). مسافات (د) 2.1 ملم ل374 ميكرون SDS، و (ه) 3.9 ملم ليطلب من 730 ميكرون SDS للمعايرة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.4. في فيفو Acquisitio البياناتن والبصرية استخراج الملكية من الجلد البشري
في هذا القسم، سيتم عرض تقنية microendoscope المتعدد الوسائط في الجسم الحي في جلد الإنسان.
- فتح البرنامج الحصول على البيانات الجمركية وضبط الوقت التكامل مطياف بالنقر على "الوقت التكامل" وضعه بحيث يكون نفس أثناء المعايرة، والذي كان 500 ميللي ثانية في هذه الحالة (الخطوة 3.8).
- تحديد منطقة من الجلد التي للحصول على البيانات، والتي قد تختلف عن تطبيق المحقق. في هذه الحالة، وقد تم اختيار الجلد رقيقة من الساعد كدليل.
- إذا احتوت منطقة الجلد والشعر، إزالة الشعر بشفرة الحلاقة المعقمة المتاح.
- الحصول على تمييز الأصفر القياسية، والذي يحتوي على الحبر pyranine، ووضع علامة طفيفة على منطقة الجلد الذي تم اختياره.
- تشغيل LED نانومتر 455 وإغلاق مصراع إلى مصباح التنجستن الهالوجين.
- وضع مسبار على اتصال لطيف مع الجلد.
- نقل التحقيق لجولة على المنطقة الملون من الأنسجة لعرض حية تغذية عالية الدقة العمارة القرنية قمي على نافذة عرض من البرنامج.
- تحديد وقت التعرض المناسب وزيادة، 150 ميللي ثانية و 10 كسب ديسيبل في هذه الحالة، لتجنب صورة التشبع، بالنقر على "وقت التعرض" و "كسب"، الكتابة في القيم المناسبة، ومن ثم النقر على "تطبيق إعدادات" في البرنامج واجهة.
- الحصول على صورة بالنقر على "اكتساب صورة" في واجهة البرنامج.
- مع الحفاظ على التحقيق في نفس الموقع صورة، وإيقاف LED 455 نانومتر، وفتح مصراع إلى مصباح التنجستن الهالوجين.
- ضبط التبديل البصرية الآلية لموقف اليسار بحيث مطياف متصل SDS الثانية من 374 ميكرون.
- الحصول على أطياف والأنسجة R، 374μm، بالنقر على "اكتساب الأطياف" في واجهة البرنامج.
- ضبط التبديل البصرية الآلية إلى موقف وسط هذه الفي مطياف متصل SDS الثانية من 730 ميكرون.
- الحصول على أطياف والأنسجة R، 730μm، بالنقر على "اكتساب الأطياف" في واجهة البرنامج.
- فتح البرامج المخصصة مرحلة ما بعد المعالجة.
- تشغيل البرنامج بعد تجهيز بالنقر على "تشغيل" وحدد صورة مضان عالية الدقة، أربعة معايرة الأطياف، واثنان في الجسم الحي أطياف من المجلد الذي تم حفظ البيانات عند المطالبة من قبل البرنامج.
ملاحظة: البرنامج مخصص يحصل على الانعكاس الحقيقي المطلق (R القيمة المطلقة، 374μm والبحث وتقاسم المنافع، 730μm) باستخدام المعادلات التالية.
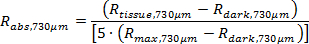
رمز مرحلة ما بعد المعالجة، كما هو موضح سابقا، بحساب منحنى المجهزة لالأطياف الانعكاس منتشر (المعادلات 1 و 2)، ثم DETErmines المعلمات الفسيولوجية الأنسجة بما في ذلك ([هب]، [ميل]، وساو 2). 11،22،24
Access restricted. Please log in or start a trial to view this content.
النتائج
وبعد هذا البروتوكول، والمحقق الحصول على صورة عالية الدقة في التركيز لموقع نسيج مع حقل كامل من رأي (الشكل 5). ويمكن رؤية الخطوط العريضة للخلايا إذا ملطخة بالحبر pyranine من تمييز الأصفر القياسية، في حين يمكن أن ينظر إلى نواة الخلية الفردية إذا مل...
Access restricted. Please log in or start a trial to view this content.
Discussion
والمتعدد الوسائط عالية الدقة التصوير ودون منتشر الانعكاس الطيفي microendoscope-حزمة ليفية ذكرت هنا يمكن أن يكون الأمثل واستخدامها من قبل المحققين لمجموعة متنوعة من التطبيقات بما في ذلك بالمنظار أو استخدام يده للدراسات الإنسان أو الحيوان. وبالتالي فإنه يوفر طريقة مرنة ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit - 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f = 50 mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor - 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno - R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard - Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver - Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12 V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
References
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett's esophagus. J Biomed Opt. 15, 026027(2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598(2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002(2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512(2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. Optical Absorption of Hemoglobin. , http://omlc.org/spectra/hemoglobin/ (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001(2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501(2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001(2012).
- Greening, G. J., James, H. M., Muldoon, T. J. Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , SPIE Spotlights. 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002(2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012(2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved