É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Multimodal Imaging and Platform microendoscopy Espectroscopia de fibra pacote para não-invasiva,
Neste Artigo
Resumo
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Resumo
Técnicas recentes microendoscopy fibra feixe permitir a análise não invasiva de tecido in vivo, utilizando quer técnicas de imagiologia ou uma combinação de técnicas de espectroscopia. Combinando técnicas de imagem e espectroscopia em uma única sonda óptica pode fornecer uma análise mais completa da saúde do tecido. Neste artigo, duas modalidades diferentes são combinados, imagens de alta resolução de fluorescência microendoscopy e espectroscopia de reflectância difusa, em uma única sonda óptica. De alta resolução de imagens de fluorescência microendoscopy é uma técnica utilizada para visualização de tecido apical micro-arquitetura e, embora na maior parte uma técnica qualitativa, demonstrou diferenciação em tempo real eficaz entre tecido neoplásico e não-neoplásica. espectroscopia de reflectância difusa é uma técnica que pode extrair parâmetros fisiológicos dos tecidos incluindo concentração local de hemoglobina, concentração de melanina, e saturação de oxigênio. Este artigo descreve as especificações de required para construir a sonda de fibra óptica, como construir a instrumentação, e, em seguida, demonstra a técnica in vivo sobre a pele humana. Este trabalho revelou que o tecido micro-arquitetura, queratinócitos da pele especificamente apicais, podem ser co-registadas com os seus parâmetros fisiológicos associados. A sonda de fibra e instrumentação-feixe aqui apresentado pode ser optimizado, quer como um dispositivo portátil ou endoscopicamente-compatível para uso numa variedade de sistemas de órgãos. investigação clínica adicional é necessário para testar a viabilidade desta técnica, para diferentes estados de doença epiteliais.
Introdução
Técnicas microendoscopy de fibra pacote normalmente analisar no tecido vivo usando ou técnicas de imagem ou uma combinação de técnicas de espectroscopia. 1-3 Uma tal técnica de imagem de alta resolução microendoscopy de fluorescência, pode imagem do tecido apical micro-arquitetura com resolução sub-celular em um pequeno , field-of-view microescala, utilizando um agente de contraste tópica, tais como proflavina, fluoresceína, ou tinta de piranina. 1,3-11 Esta modalidade de imagem mostrou promissor desempenho clínico em qualitativamente diferenciação entre tecido epitelial doentes e saudáveis em tempo real com baixo inter-observador variabilidade. 8 ocasionalmente, os investigadores irão utilizar os dados de microscopia de fluorescência de alta resolução para extrair características quantitativas, como celular e tamanho nuclear ou área da glândula, mas esta continua a ser uma técnica essencialmente qualitativa orientada para visualizar a morfologia dos tecidos. 1,3,8- 10 Por outro lado, as técnicas de espectroscopia, talcomo espectroscopia de reflectância difusa, são direcionados para fornecer informações de tecido funcional e têm se mostrado promissoras desempenho clínico em identificar quantitativamente lesões cancerosas em vários órgãos 2,12-15.
Por conseguinte, existe uma necessidade de um dispositivo que incorpora ambos os tipos de modalidades para, potencialmente, reduzir ainda mais a variabilidade inter-observadores, manter a visualização em tempo real de tecido de micro-arquitectura, e proporcionar uma análise mais completa da saúde do tecido. Para atingir esta meta, um instrumento baseado no sonda multimodal foi construído que combina duas modalidades em uma sonda única fibra óptica:. De alta resolução microendoscopy fluorescência e espectroscopia de reflectância sub-difusa 11 Este método de co-registros qualitativos imagens de alta resolução de apical morfologia do tecido (propriedades estruturais) com informações quantitativas espectral (propriedades funcionais) a partir de duas profundidades de tecido distintas, incluindo a concentração de hemoglobina local ([Hb]), a concentração de melanina ([Mel]) e saturação de oxigênio (SaO 2). 11,12,16 Esta sub-difusa modalidade de espectroscopia de reflectância específica usa duas separações fonte de detectores (SDSS) para provar duas profundidades de tecido exclusivos para fornecer uma visão mais abrangente da saúde do tecido por amostragem até a membrana basal e estroma tecido subjacente. 11
A fibra-sonda é constituída por uma fibra de imagem 1 mm de diâmetro central com aproximadamente 50000 4,5 uM elementos de fibra de diâmetro, um diâmetro do revestimento de 1,1 mm e um diâmetro de revestimento global de 1,2 mm. A fibra de imagem encontra-se rodeado por cinco fibras 200 um de diâmetro com um diâmetro de revestimento de 220 uM. Cada fibra multimodo 200 um situa-se a uma distância de centro a centro de 864 uM de distância a partir do centro da fibra de imagem. Cada um dos 200 fim são fibras multimodo 25 ° entre si. Usando o mais à esquerda fibra multimodo de 200 um como a fibra "fonte", eo th adicionalree 200 uM fibras multimodo como as fibras de "recolha", esta geometria cria necessariamente três centro-a-centro FDS de 374 uM, 730 uM, 1,051 uM, e 1,323 uM. As pontas de fibra são colocados em uma caixa metálica cilíndrica que mantém as distâncias entre as fibras constante. O diâmetro do invólucro de metal cilíndrica é de 3 mm. A extremidade distal (para a fibra óptica ponta da sonda) da sonda de fibra óptica é de 2 pés de comprimento. A sonda, em seguida, separa-se os respectivos seis fibras individuais na extremidade proximal (no sentido da instrumentação), que é um adicional de 2 pés de comprimento, para um comprimento total de 4 pés. A Figura 1 mostra uma representação da sonda de fibra óptica.

Figura 1:. Design de sonda de fibra óptica A sonda de fibra óptica é constituído por uma fibra de imagem 1 mm de diâmetro e 200 um de quatro fibras multimodo. esteA Figura mostra representações de (a) a tampa da extremidade de metal que restringe a geometria das fibras na ponta da sonda para se obter FDS de 374, 730, e 1051 uM no que respeita à 200 fibra uM multimodo mais à esquerda (Barra de escala ≈ 1 mM), (b) as fibras ser restringida dentro da tampa de metal, mostrando os núcleos de fibra, revestimento de fibra e revestimento de fibra (Escala bar ≈ 1 mm), (c) a poliamida invólucro de protecção em torno das fibras (Escala bar ≈ 1 mm), (d ) da ponta distal acabado da sonda, com o apoio para os dedos de metal e cabo único preto contendo todas as fibras (barra de escala ≈ 4 mm), e (e) uma imagem da ponta distal da sonda (barra de escala ≈ 4 mm). por favor clique aqui para ver uma versão maior desta figura.
Esta instrumentação multimodal e techni associadoQue é a primeira combinação destas modalidades dentro de uma única sonda, embora existam outras técnicas estruturais / funcionais combinados que combinar modalidades diferentes. Por exemplo, a imagem latente hiperespectral combina imagem de campo amplo com a hemoglobina e a melanina propriedades quantitativas, 17,18 e outras técnicas têm sido desenvolvidas que combinam tomografia de coerência óptica (OCT) com a análise de expressão de proteína de tecido, 19 para citar alguns. Este artigo apresenta uma configuração de instrumentação compacta e fácil de implementar, que utiliza uma sonda de fibra óptica em geral, que pode ser optimizado para vários fins, incluindo o uso endoscópica no tracto gastrointestinal inferior e do esófago ou como uma sonda de mão para uso na cavidade oral e colocação de pele externa. 11,20
O hardware para este instrumentação exige tanto de aquisição de dados personalizado e código de pós-processamento para adquirir espectros de reflectância difusa e, em seguida, extrair o volum resultantetecidos parâmetros fisiológicos média-e incluindo [Hb], [Mel], e SaO 2. O código de aquisição de dados personalizados foi construído para permitir a aquisição simultânea de uma câmera (para microscopia de fluorescência de alta resolução) e um espectrômetro (por espectroscopia de reflectância difusa). Drivers são muitas vezes disponível a partir de sites dos fabricantes para permitir a integração com uma variedade de linguagens de programação. O código personalizado pós-processamento importa um valores de absorção priori de in vivo [Hb] e [Mel] 21 e, em seguida, utiliza um processo de adaptação otimização não-linear desenvolvido anteriormente que cria uma curva ajustada dos espectros. 22 A curva ajustada é construído através da minimização do χ 2 valor entre si e os espectros cru e determinar os parâmetros fisiológicos dos tecidos ([Hb], [Mel], e São 2) a partir da curva ajustada e com o menor valor χ 2. 22 o código pode ser modificado para incluirabsorção de outros cromóforos, bem como a tinta de piranina exógeno utilizado aqui, de modo que os parâmetros fisiológicos alvo não são afectados.
Indicadores fisiológicos da saúde dos tecidos, tais como [Hb], [Mel], e SaO 2, pode ser usado como relatórios de resposta do tumor à terapia ou como indicadores da vascularização local e angiogénese. 14,23 Incluindo uma modalidade de alta resolução de fluorescência microendoscopy ajuda a colocação de sonda de guia e fornece investigadores com uma imagem mais completa da relação entre estrutura tecido epitelial e função. Neste artigo, construção e aplicação do microendoscope multimodal é descrito. 11
Access restricted. Please log in or start a trial to view this content.
Protocolo
aprovação Institutional Review Board (IRB # 15-09-149) foi obtido a partir do programa de assuntos Pesquisa em Seres Humanos da Universidade de Arkansas para todos os aspectos do estudo. Os métodos descritos foram realizados em conformidade com as orientações aprovados, e o consentimento informado foi obtido de todos os participantes.
1. Montagem do High-resolution Modalidade Fluorescência microendoscopy
Nota: Os passos descritos para a montagem do de alta resolução de fluorescência microendoscopy modalidade pode ser visualizado na Figura 2.
- Coloque um 470 nm Dichroic espelho dentro de um cubo gaiola 30 mm.
- Obter um cubo gaiola de 30 mm e remova a montagem de filtro dicróica.
- Coloque um espelho dicróico 470 nm no filtro dicróica montagem.
- Re-insert e seguro montagem de volta para dentro do cubo gaiola do filtro dicróica.
- Anexar gaiola de montagem Rods ao cubo gaiola 30 mm.
- Seguroquatro hastes 1,5 polegadas conjunto de gaiola para a frente do cubo gaiola.
- Fixe quatro hastes de montagem de gaiola de 3,0 polegadas para o lado direito do cubo gaiola.
- Seguras duas hastes de montagem gaiola 2,0 polegadas na diagonal do lado esquerdo do cubo gaiola.
- Criar um conjunto de tubo / Lens gaiola Plate.
- Obter uma rosca placa gaiola 30 milímetros 1,0 polegadas e anexar um estresse anel de retenção livre para o interior da placa gaiola usando a rosca fornecido.
- Parafuso em um tubo de lente de 1,0 polegadas para o anel de retenção sem stress.
- Anexar uma segunda 1,0 polegadas roscada 30 mm de placa gaiola para o tubo de lente de 1,0 polegadas e ajustar os anéis de retenção padrão de modo que as duas placas estão alinhadas gaiola.
- Deslize o conjunto do tubo / Lens 1,0 polegadas gaiola placa para o lado esquerdo do cubo gaiola 30 mm.
- Construir montar o espelho de ângulo direito de montagem.
- Obter um espelho em ângulo reto de montagem e um espelho de alumínio 1,0 polegadas UV-reforçada.
- Coloque o inc 1,0h UV-enhanced espelho de alumínio para o espelho de montagem e aperte.
- Fixe quatro 2.0 polegadas hastes de montagem de gaiola para a frente do espelho montagem
- Seguras duas hastes de montagem gaiola 2,0 polegadas na diagonal do lado direito do cubo gaiola.
- Conectar montar o espelho de ângulo recto conjunto para o lado esquerdo do conjunto de tubo gaiola placa de 1,0 polegadas / lente, colocando as hastes de montagem opostos gaiola através das respectivas aberturas da gaiola placa de 30 mm.
- Passe montar uma translação do eixo z através das hastes de montagem de gaiola 3.0 polegadas no lado direito do conjunto.
- Anexar uma lente objetiva acromática 10X à tradução eixo z montagem.
- Construir um / XY-eixos de 1,0 polegadas adaptador de fibra placa de lente de conversão conjunto de montagem.
- Obter um monte de translação dos eixos xy e uma placa de adaptador de fibra de 1,0 polegada.
- Garantir a fibra placa adaptadora de 1,0 polegadas no eixo xy lente tradução montagem.
- Deslize tele fibra / eixo xy adaptador de lente de tradução 1.0 polegadas conjunto de montagem na frente da lente objetiva.
- Obter dois, 1.0 polegadas tubos de 0,5 polegadas longas lente de diâmetro, um 440/40 nm de banda de filtro (filtro de excitação) e um 525/36 nm filtro de banda (filtro de emissão).
- Colocar cada filtro dentro de um 0,5 polegadas de comprimento, o tubo de lente de diâmetro de 1,0 polegadas, de modo a que a seta do lado de fora do filtro está voltada para o lado do tubo da lente com as roscas externas.
- Fixe os filtros para a montagem.
- Obter dois anéis de retenção padrão.
- Fixe os filtros dentro das 0,5 polegadas longos, tubos de lente de diâmetro de 1,0 polegadas com os anéis de retenção padrão.
- Enroscar o tubo de lente com o filtro de excitação para a frente do cubo gaiola 30 mm e parafuso no tubo de lente com o filtro de emissão para o espelho de ângulo recto montagem.
- Enroscar o tubo de lente de 0,5 polegadas com o filtro de emissão para a frente do espelho em ângulo recto montagem.
- obtin dois 1,0 polegadas com rosca 30 placas gaiola mm e colocá-los na frente dos tubos de 0,5 polegadas de comprimento, diâmetro da lente 1.0 polegadas contendo os filtros.
- Usando epoxi ou adesivo forte, anexar um LED 455 nm para a placa de gaiola ligada ao filtro de excitação.
- Obter um, tubo de lente de diâmetro de 1,0 polegadas 0,5 polegadas de comprimento e uma lente de tubo de gibão 1,0 polegadas acromática com distância focal de 50 mm.
- Colocar o tubo de lente no interior do tubo de lente de modo a que a seta do lado de fora da lente está voltada para o lado do tubo da lente com as roscas externas.
- Parafuso na lente tubo para a montagem.
- Obter um anel de retenção padrão.
- Fixe a lente dentro do, tubo de lente de diâmetro de 0,5 polegadas de comprimento 1.0 polegadas com o anel de retenção padrão.
- Fixe o tubo de lente com a lente tubo para a placa de gaiola mais à esquerda.
- Coloque uma placa de gaiola 30 mm à frente do tubo de lente de 0,5 polegada de comprimento, 1.0 polegadas de diâmetro que contém a lente do tubo.
- anexar uma estresse anel de retenção livre para o interior da gaiola placa de 30 mm.
- Anexar uma câmera monocromática USB para a placa de gaiola com o estresse anel de retenção livre.
- Construir os dispositivos de pós montagem ópticos.
- Obter quatro titulares 0,5 polegadas de correios, quatro 0,5 polegadas mensagens ópticos, e quatro bases de montagem.
- Garantir os postos ópticos 0,5 polegadas dentro dos detentores de postos de 0,5 polegadas.
- Fixe os detentores de postos de 0,5 polegadas para as bases de montagem.
- Aperte os dispositivos quatro post óptica de montagem até os orifícios localizados sob o cubo gaiola de 30 mm, montar o espelho de ângulo direito, a placa gaiola ligado ao LED, ea placa de gaiola ligado à câmara.
- Aparafusar os quatro o posto óptica montagem de dispositivos para tanto uma placa de ensaio óptico ou mesa óptica para terminar a construção da linha de alta resolução modalidade de fluorescência microendoscopy.
ftp_upload / 54564 / 54564fig2.jpg "/>
Figura 2:. Assembleia da de alta resolução modalidade de fluorescência microendoscopy A modalidade de alta resolução de fluorescência microendoscopy podem ser construídos através da construção de um escudo de componentes de 1,0 polegadas de tamanho de diâmetro-, com cuidado especial no manuseio do espelho dicróico, lente objetiva, excitação / filtros de emissão e lente do tubo. Superfícies de vidro destes componentes deve ser cuidadosamente manipulado usando papel de lente. Por favor clique aqui para ver uma versão maior desta figura.
2. Assembleia da Sub-difusa Modalidade refletância Spectroscopy
Nota: Os passos descritos para a montagem do sub-modalidade espectroscopia de reflectância difusa pode ser visualizado na Figura 3.
- Obter uma fonte de luz tungstênio-halogênio e, usando epoxy ou um adesivo forte, garantir um Threade 1,0 polegadasd 30 mm Placa de gaiola para a frente.
- Fixe quatro 3.0 polegadas hastes de montagem de gaiola para a placa de gaiola.
- Anexar montar uma translação do eixo z para as hastes de montagem de gaiola.
- Trocar uma lente objetiva acromática 20X à tradução eixo z montagem.
- Construir um / XY-eixo adaptador de fibra placa de lente de conversão conjunto de montagem.
- Obter um monte de translação dos eixos xy e uma fibra placa adaptadora 1,0 polegadas.
- Fixe a placa de adaptador de fibra no eixo xy lente tradução montagem.
- Deslize montar o 1.0 adaptador de fibra polegadas / xy-tradução de montagem na frente da lente objetiva.
- Construir o conjunto do braço motor.
- Obter o alumínio braço do motor custom-built e um SMA placa adaptador de fibra.
- Parafuso na placa de adaptador de fibra (com rosca externa) no braço do motor de alumínio (com rosca interna).
- Anexar o alumínio adaptador de braço do motor custom-built para o braço motor com quatro # 4-40 0,5 pol. Parafusos.
- Construir o conjunto da carcaça braço / motor motor / motor.
- Obter a carcaça do motor de alumínio custom-built eo motor de passo 400 passo.
- Alinhe os orifícios dos parafusos no motor de passo e carcaça do motor e fixe com quatro # 4-40 parafusos de 0,5 polegadas.
- Alimente a haste do motor de rotação do motor de passo através da abertura da montagem do braço do motor e aperte o parafuso de fixação no adaptador braço do motor de alumínio.
- Construir o conjunto do interruptor óptico.
- Obter o interruptor óptico de alumínio custom-built e três placas adaptadoras de fibra de 1,0 polegadas.
- Passe as placas adaptadoras nos orifícios rosqueados no interruptor óptico.
- Fixe a custom-built de alumínio interruptor óptico face-placa para o interruptor óptico com quatro parafusos # 4-40 0,5 polegadas.
- Fixe o conjunto da carcaça braço / motor motor / motor para o interruptor óptico, alimentando a haste do motor de rotação do motor de passo através do orifício central do tele interruptor óptico.
- Obter uma placa de circuito elétrico e controlador de motor de passo, em seguida, coloque o controlador de motor de passo do outro lado da ranhura central da placa de ensaio.
- Observar o esquema de ligação eléctrica (Figura 3, 2.12) para o controlador de motor passo a passo, a fonte de alimentação de 12 V, e o motor de passo.
- Ligue o controlador do motor de passo, a fonte de alimentação de 12 V, e motor de passo, tal como especificado no diagrama de circuito (Figura 3, 2,12) para completar a construção do interruptor óptico motorizada.
- Aparafusar o parâmetro componentes e fonte de luz tungstênio-halogênio óptico a uma placa de ensaio óptico ou mesa óptica próximo ao previamente construído (Figura 2, 1,24) de alta resolução de montagem de fluorescência microendoscopy.
- Anexar uma extremidade de um 550 mm, 0,22 NA cabo de rede para a placa de adaptador de fibra de 1,0 polegada da montagem do braço do motor.
- Conecte a outra extremidade do 550 mm, 0,22 NA cabo de rede para a fibra conectarou do espectrómetro USB.
- Aperte os cinco cabos das sondas distais às respectivas placas adaptadoras de fibra de 1,0 polegadas sobre a instrumentação para terminar a conclusão da imagem de alta resolução multimodal e sub-difusa espectroscopia de reflectância de fibra pacote microendoscope.
- Parafuso no cabo de fibra imagem 1 mm de diâmetro central para a placa de adaptador de fibra 1,0 polegadas mencionado na etapa 1.9.2.
- Parafuso no cabo de fibra multimodo mais à esquerda 200 mm na placa de adaptador de fibra 1,0 polegadas mencionado na etapa 2.6.
- Parafuso no cabo de fibra multimodo 2 nd 200 mm a mais à esquerda adaptador de fibra 1,0 polegadas ligado à lâmpada de tungsténio-halogéneo mencionado na etapa 2.9.2.
- Parafuso no cabo de fibra multimodo de 200 um 3º na placa de adaptação de fibra de 1,0 polegada meio mencionado na etapa 2.9.2.
- Parafuso no cabo de fibra multimodo 4 th 200 mm na placa de adaptador de fibra de 1,0 polegada mais à direita mencionado na etapa 2.9.2.

Figura 3:. Montagem do sub-difusa modalidade espectroscopia de reflectância A modalidade espectroscopia de reflectância sub-difusa podem ser construídas utilizando uma lâmpada de base de tungsténio-halogéneo acoplada a uma lente objectiva, para focar a luz através da fibra de entrega 200 um multimodo, e um espectrómetro. Além disso, um interruptor óptico motorizada custom-built pode ser construído dentro do caminho da lâmpada de fibra-espectrômetro para alternar entre cada SDS. Os investigadores que usam vários espectrômetros para adquirir a partir de múltiplos SDSs pode ignorar o componente interruptor óptico. Por favor clique aqui para ver uma versão maior desta figura.
3. A calibração do Sub-reflectância difusa Espectroscopia Modalidade
Nota: A fpassos epois (seção 3) deve ser concluída antes da coleta de dados espectrais (secção 4).
- Ligue todos os componentes da instrumentação, incluindo o LED 455 nm, banda larga lâmpada de tungsténio-halogéneo, câmera CMOS, espectrômetro USB, motor de passo, e placa de controle motor. Verifique se o obturador na lâmpada de tungsténio-halogéneo é aberta.
- Desligue toda a luz ambiente.
- Abra o software de aquisição de dados personalizado.
- Manter o equipamento funcionando por 30 min para a lâmpada atingir uma temperatura adequada e para o ruído inerente do espectrómetro para estabilizar.
- Coloque um padrão de reflexão difusa de 20% dentro da abertura inferior do, dispositivo padrão de calibração impressos 3D custom-built.
- Coloque a sonda de fibra óptica no interior da ranhura mais à esquerda do costume, 3D impressa fibra-titular, demonstrado na Figura 4. A ranhura mais à esquerda corrige a distância perpendicular a partir da ponta da sonda de fibra óptica para o padrão de reflexão a 2,1 mm, o que é a optimum distância em que o sinal que chega ao espectrómetro é maximizada para os primeiros de SDS de 374 uM.
- Ajustar o interruptor óptico motorizada para a posição mais à esquerda de modo a que o espectrómetro está ligado aos primeiros SDS de 374 uM.
- Defina o tempo de integração para 500 ms. Este tempo de integração devem ser escolhidos de modo a não saturar o espectrômetro, mas manter um tempo de integração praticamente baixa.
- Adquirir um espectro, R max, 374μm, clicando em "adquirir Spectrum" no software.
- Feche o obturador na lâmpada de tungsténio-halogéneo e gravar um espectro, R escuro, 374μm, de ruído de fundo, clicando em "Adquirir Spectrum" no software. Uma vez adquirido, abra o obturador uma vez.
- Coloque a sonda de fibra óptica no interior da ranhura mais à direita do costume, 3D impressa fibra-titular, demonstrado na Figura 4. A ranhura mais à direita fixa a distância perpendicular a partir da fibra-Optic ponta da sonda para o padrão de reflexão a 3,9 mm, o que representa a distância óptima na qual o sinal que chega ao espectrómetro é maximizada pela segunda SDS de 730 uM.
- Ajustar o interruptor óptico motorizada para a posição central de modo a que o espectrómetro é ligado ao segundo de SDS de 730 uM.
- Adquirir um espectro, R max, 730μm, clicando em "adquirir Spectrum" no software.
- Feche o obturador na lâmpada de tungsténio-halogéneo e gravar um espectro, R escuro, 730μm, de ruído de fundo, clicando em "Adquirir Spectrum" no software.
- Abra o obturador uma vez.

Figura 4:. A calibração do sub-modalidade espectroscopia de reflectância difusa Para a calibração pré-experimental, a ponta da sonda de fibra óptica deve ser colocado em diferentesdistâncias perpendiculares do padrão de reflexão difusa de 20%, dependendo da SDS. Para atingir consistentemente estas distâncias perpendiculares em todas as experiências, um dispositivo padrão de calibração foi desenhada (secção transversal do dispositivo mostrado em (a)), para manter a sonda no distâncias exactas do padrão de reflexão difusa de 20%. Nesta configuração específica da sonda de fibra óptica, a luz da lâmpada de tungsténio-halogéneo é mostrado através do comutador óptico em separações fonte de detectores de (b) 374 ^ m e (C) 730 pM (com o braço do motor eo motor removido do percurso óptico para maior clareza). Distâncias de (d) 2.1 mm para 374 mm SDS, e (e) 3,9 milímetros sejam necessários 730 mm SDS para a calibração. Por favor clique aqui para ver uma versão maior desta figura.
4. dados in vivo acquisition e Optical Propriedade Extração da pele humana
Nesta seção, a técnica microendoscope multimodal será demonstrada em in vivo de pele humana.
- Abra o costume software de aquisição de dados e ajustar o tempo de integração espectrômetro, clicando em "Tempo de Integração" e configurá-lo para que ele seja o mesmo que durante a calibração, que foi de 500 ms, neste caso (passo 3.8).
- Determinar a área da pele em que a aquisição de dados, que pode ser diferente na aplicação do investigador. Neste caso, a pele fina do antebraço foi escolhido como uma demonstração.
- Se a área de pele contém o cabelo, remover os pêlos com uma lâmina de barbear estéril descartável.
- Obter um marcador amarelo padrão, que contém tinta piranina, e levemente marcar a área de pele escolhida.
- Ligue o LED 455 nm e fechar o obturador para a lâmpada de tungstênio-halogênio.
- Coloque a sonda em contato suave com a pele.
- Mover a sonda umredonda sobre a área manchada de tecido para ver um feed de alta resolução ao vivo da arquitetura de queratinócitos apical na janela de visualização do software.
- Escolha um tempo de exposição adequado ganho, a 150 ms e 10 dB, neste caso, para evitar a saturação da imagem, clicando em "tempo de exposição" e "ganhar", digitar os valores apropriados, e em seguida clicar em "Aplicar configurações" no software interface.
- Adquirir uma imagem, clicando em "Adquirir imagem" na interface do software.
- Mantendo a sonda no mesmo local de imagem, desligue o LED 455 nm e abrir o obturador para a lâmpada de tungstênio-halogênio.
- Ajustar o interruptor óptico motorizada para a posição esquerda de modo a que o espectrómetro é ligado ao segundo de SDS de 374 uM.
- Adquirir espectros, tecido R, 374μm, clicando em "adquirir Spectra" na interface do software.
- Ajuste o interruptor óptico motorizada para a posição central tais thno espectrômetro é ligado ao segundo de SDS de 730 uM.
- Adquirir espectros, tecido R, 730μm, clicando em "adquirir Spectra" na interface do software.
- Abra o software personalizado de pós-processamento.
- Executar o software de pós-processamento, clicando em "Executar" e selecione a imagem de fluorescência de alta resolução, quatro espectros de calibração, e os dois in vivo espectros da pasta na qual os dados foram salvos quando solicitado pelo software.
NOTA: O software personalizado obtém o verdadeiro reflectância absoluta (R abs, 374μm e R abs, 730μm), utilizando as seguintes equações.
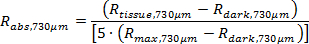
O código de pós-processamento, como descrito anteriormente, calcula uma curva ajustada aos espectros de reflectância difusa (das equações 1 e 2) e, em seguida, determines parâmetros fisiológicos dos tecidos incluindo ([Hb], [Mel], e São 2). 11,22,24
Access restricted. Please log in or start a trial to view this content.
Resultados
Seguindo este protocolo, o investigador irá obter uma imagem do local de tecido de alta resolução de focagem com o campo de visão completo (Figura 5). Esboços de células pode ser visto se coradas com tinta de piranina a partir de um marcador amarelo padrão, enquanto que os núcleos das células individuais podem ser vistas se marcadas com um corante, tal como proflavina. Após a aquisição espectral, o software de pós-processamento utiliza um conhecimen...
Access restricted. Please log in or start a trial to view this content.
Discussão
A imagem de alta resolução e multimodal microendoscope fibra feixe espectroscopia de reflectância difusa sub-relatada aqui pode ser optimizado e utilizado pelos investigadores para uma variedade de aplicações, incluindo o uso manual ou endoscópico para estudos em seres humanos ou animais. Assim, fornece um método flexível para visualização in vivo do tecido micro-arquitetura apical juntamente com medições de concentração de hemoglobina, concentração de melanina, e saturação de oxigênio ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit - 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f = 50 mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor - 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno - R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard - Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver - Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12 V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
Referências
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett's esophagus. J Biomed Opt. 15, 026027(2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598(2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002(2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512(2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. Optical Absorption of Hemoglobin. , http://omlc.org/spectra/hemoglobin/ (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001(2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501(2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001(2012).
- Greening, G. J., James, H. M., Muldoon, T. J. Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , SPIE Spotlights. 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002(2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012(2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados