Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мультимодальные и обработки изображений Спектроскопия Волоконно-расслоение Microendoscopy Платформа для неинвазивного,
В этой статье
Резюме
The assembly and use of a multimodal microendoscope is described which can co-register superficial tissue image data with tissue physiological parameters including hemoglobin concentration, melanin concentration, and oxygen saturation. This technique can be useful for evaluating tissue structure and perfusion, and can be optimized for individual needs of the investigator.
Аннотация
Последние методы microendoscopy волоконно-пучка позволяют неинвазивный анализ ткани в естественных условиях с использованием либо методов визуализации или комбинацию методов спектроскопии. Сочетание методов визуализации и спектроскопии в один оптический зонд может обеспечить более полный анализ здоровья ткани. В этой статье две разнородные формы сочетаются с высоким разрешением флуоресценции microendoscopy изображений и спектроскопии диффузного отражения, в один оптический датчик. Высокое разрешение флуоресценции microendoscopy изображений является метод, используемый для визуализации верхушечные ткани микроархитектура и, хотя в основном качественной техники, продемонстрировал эффективную дифференциацию в режиме реального времени между опухолевой и не опухолевой ткани. Диффузный отражательной спектроскопии является метод, который может извлечь ткани физиологических параметров, включая локальную концентрацию гемоглобина, концентрацию меланина, и насыщение кислородом. В данной статье описываются характеристики гequired для построения волоконно-оптический датчик, как строить измерительные приборы, а затем демонстрирует технику на коже человека в естественных условиях. Эта работа показала, что ткани микро-архитектуры, в частности, вершинные кератиноциты кожи, могут быть совместно зарегистрированы и связанные с ним физиологические параметры. Приборы и волоконно-пучка зонд, представленные здесь могут быть оптимизированы как или карманного компьютера или эндоскопически-совместимое устройство для использования в различных системах органов. Дополнительные клинические исследования необходимы для того, чтобы проверить жизнеспособность этой методики для различных эпителиальных болезненных состояний.
Введение
Волоконно-расслоение методы microendoscopy обычно анализируют в естественных условиях ткани с использованием либо методов визуализации или комбинацию методов спектроскопии. 1-3 Один из таких методов обработки изображений с высоким разрешением флуоресценции microendoscopy, может изображение верхушечные ткани микроархитектура с субклеточном разрешением в небольшой , микромасштабная поле-обзора, с использованием местного применения контрастного агента , такого как профлавина, флуоресцеин или pyranine чернил. 1,3-11 Этот механизм визуализации показал перспективные клинические показатели в качественно дифференцировать больных и здоровых эпителиальной ткани в режиме реального времени с низким между наблюдателями вариабельность. 8 Иногда исследователи будут использовать данные флуоресцентной микроскопии высокого разрешения для извлечения количественных функций , таких как клетки и размер ядра или железы области, но это по- прежнему в первую очередь качественная методика нацелена на визуализации морфологии тканей. 1,3,8- 10 с другой стороны, методы спектроскопии, такиев спектроскопии диффузного отражения, нацелены на предоставление информации функциональной ткани и показали перспективные клинические показатели в количественном отношении выявления раковых поражений во многих органах. 2,12-15
Таким образом, существует потребность в устройстве, включающего оба типа механизмов для потенциально дальнейшего снижения изменчивости между наблюдателями, поддерживать в реальном времени визуализации тканей микроархитектуры, а также обеспечить более полный анализ здоровья тканей. Для достижения этой цели, мультимодальный зонд на основе инструмент был построен , который сочетает в себе два условия в одном оптоволоконного зонда:. С высоким разрешением флуоресценции microendoscopy и суб-спектроскопии диффузного отражения 11 Этот метод со-регистрам качественные изображения с высоким разрешением верхушечных морфология ткани (структурные свойства) с количественной спектральной информации (функциональные свойства) из двух различных глубинах тканей, включая локальную концентрацию гемоглобина ([Hb]), концентрация меланина ([Мел]), и насыщение крови кислородом (SaO 2). 11,12,16 Эта специфическая модальность отражательной спектроскопии суб-диффузная использует два источника детектора разделений (SDSS) к образцу два уникальных глубины ткани , чтобы обеспечить более полную картину здоровья ткани путем отбора проб вплоть до базальной мембраны и стромы основной ткани. 11
Волокно-зонд состоит из центрального мм диаметра 1 изображения волокна с приблизительно 50 000 4,5 мкм элементов диаметром волокна, диаметром оболочки 1,1 мм и общим диаметром покрытия 1,2 мм. Изображение волокно окружено пятью 200 мкм волокон диаметра с диаметром оболочки 220 мкм. Каждый 200 мкм многомодового волокна расположена на расстоянии от центра до центра 864 мкм, вдали от центра волокна изображения. Каждый из многомодовых волокон 200 мкм 25 ° друг от друга. Используя крайний левый 200 мкм многомодового волокна в качестве "источника" волокна, а также дополнительный тысРЗЭ 200 мкм многомодового волокна как "коллекция" волокон, эта геометрия обязательно создает три центра до центра 374 карточки безопасности мкм, 730 мкм, 1,051 мкм и 1,323 мкм. Кончики волокна заключены в цилиндрический металлический корпус, который держит расстояния между константой волокон. Диаметр цилиндрического металлического корпуса составляет 3 мм. Дистальный конец (к волоконно-оптического зонда) волоконно-оптический зонд длиной 2 фута. Зонд затем разделяется на шесть соответствующих отдельных волокон на проксимальном конце ( по направлению к измерительной аппаратуры) , которая имеет длину еще 2 фута, для общей длиной 4 фута. На рисунке 1 показано представление волоконно-оптического зонда.

Рисунок 1:. Волоконно-оптический зонд дизайн Волоконно-оптический датчик состоит из одного мм диаметра 1 волокна изображения и четыре 200 мкм многомодовых волокон. Этарисунке показаны представления (а) торцевая крышка металл , который ограничивает геометрию волокон на конце зонда с получением SDSS 374, 730 и 1051 мкм по крайней левой мкм многомодового волокна 200 (Шкала бар ≈ 1 мм), (б) волокна будучи стесненными внутри металлического колпачка, показывая сердцевинами волокон, оболочки волокна и волокна покрытия (шкала бар ≈ 1 мм), (с) защитный полиамид оплетка вокруг волокон (шкала бар ≈ 1 мм), (г ) готовый дистальный наконечник зонда, с металлическим кончиком большого пальца и одного черного кабеля , содержащего все волокна (Масштаб бар ≈ 4 мм), и (е) картина дистального конца зонда (Масштаб бар ≈ 4 мм). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Это мультимодальный приборы и связанные с ними Techniдие первое сочетание этих условий в пределах одного зонда, хотя другие комбинированные структурные / функциональные методы существуют, которые сочетают различные методы. Например, гиперспектральных изображений сочетает в себе широкие поля визуализации с количественным гемоглобина и меланина свойствами, 17,18 и другие методы были разработаны , которые сочетают оптической когерентной томографии (ОКТ) с анализом экспрессии белка ткани, 19 , чтобы назвать несколько. В этой статье отчеты о компактном и удобном для реализации установки измерительных приборов, которая использует общий волоконно-оптический датчик, который может быть оптимизирован для различных целей, в том числе эндоскопического использования в нижней части желудочно-кишечного тракта и пищевода или в качестве переносного зонда для использования в ротовой полости и внешнее размещение кожи. 11,20
Аппаратные средства для этой аппаратуры требует как пользовательские сбора данных и код постобработки для получения диффузного спектров отражения и затем извлечь в результате Volumе усредненный ткани физиологические параметры , включая [Hb], [Мел] и SaO 2. Код сбора пользовательских данных был построен, чтобы обеспечить одновременное приобретение с камеры (для высокого разрешения флуоресцентной микроскопии) и спектрометр (для спектроскопии диффузного отражения). Водители часто можно найти на сайтах производителей, чтобы обеспечить интеграцию с различными языками программирования. Код таможенный пост-обработка импортирует априорных значений поглощение в естественных условиях [Hb] и [Мел] 21 , а затем использует ранее разработанный процесс подгонки нелинейной оптимизации , который создает подогнанную кривую спектров. 22 встроенна кривая построена путем минимизации χ 2 значение между собой и необработанного спектров и определение ткани физиологических параметров ([Hb], [Мел], и SAO 2) из подобранной кривой и с наименьшим х 2 значение. 22 код может быть изменен , чтобы включитьпоглощение из других хромофоров, а, например, как экзогенного pyranine чернила, используемые здесь, так что целевые физиологические параметры не изменяются.
Физиологические показатели здоровья ткани, такие как [Hb], [Мел] и SaO 2, могут быть использованы в качестве отчетов опухолевого ответа на терапию или в качестве индикаторов местного васкуляризации и ангиогенеза. 14,23 В том числе высокого разрешения флуоресценции microendoscopy модальности помогает размещение зонда руководство и обеспечивает следователям более полную картину взаимосвязи между структурой эпителиальной ткани и функции. В этой статье, строительства и применения мультимодальных microendoscope описана. 11
Access restricted. Please log in or start a trial to view this content.
протокол
утверждение совета Обзор Институциональная (IRB # 15-09-149) была получена из программы Субъекты исследовательского человека в Университете штата Арканзас по всем аспектам этого исследования. Описанные здесь методы были проведены в соответствии с утвержденными руководящими принципами, и информированное согласие было получено от всех участников.
1. Сборка высокого разрешения флуоресценция Microendoscopy модальности
Примечание: Изложенные этапы сборки высокого разрешения флуоресценции microendoscopy модальности можно визуализировать на рисунке 2.
- Поместите 470 нм дихроичное зеркало внутри клетки Куб 30 мм.
- Получают 30 мм клетку куб и удалить дихроичный держатель фильтра.
- Поместите 470 нм дихроичное зеркало в дихроичным держатель фильтра.
- Повторно вставьте и закрепите дихроичный держатель фильтра обратно в клетку куб.
- Приложить Кейджа Стержни Ассамблеи к клетке куба 30 мм.
- Безопасныйчетыре 1,5 дюйма клетка сборки стержней к передней части клетки куба.
- Закрепите четыре 3,0-дюймовый каркас сборки стержней к правой стороне клетки куба.
- Безопасные два 2,0-дюймовый каркас сборки стержней по диагонали на левой стороне клетки куба.
- Построить сетчатая пластина / Lens Tube в сборе.
- Получите 1,0 дюйма с резьбой 30 мм сетчатую пластину с и прикрепить беззаботным стопорное кольцо с внутренней стороны клетки пластины с помощью прилагаемого нарезание резьбы.
- Винт в 1,0 дюйма объектива трубки к свободной от стрессов стопорного кольца.
- Прикрепление второй 1,0 дюйма с резьбой 30 мм сетчатую пластину на 1,0 дюйма объектива трубку и настроить стандартные стопорные кольца таким образом, что две клетки пластины находятся на одном уровне.
- Вставьте 1,0 дюйма сетчатая пластина / Lens трубчатого узла на левой стороне клетки куба 30 мм.
- Построить правый угол зеркало крепление в сборе.
- Получить под прямым углом зеркало крепление и 1,0 дюйма УФ-Enhanced алюминиевого зеркала.
- Поместите 1.0 вклч UV с повышенной алюминиевое зеркало в зеркало крепление и затяните.
- Закрепите четыре 2,0 дюйма клетка сборки стержней к передней части зеркала крепления
- Безопасные два 2,0-дюймовый каркас сборки стержней по диагонали на правой стороне клетки куба.
- Подключение правый угол зеркало узел подвески на левой стороне сборки трубки на 1,0 дюйма сетчатая пластина / линзы, помещая противостоящие агрегат клетки стержней через соответствующие отверстия в обойме пластины 30 мм.
- Автор перевод Z-оси крепления через 3,0 дюйма клетка сборки стержней на правой стороне узла.
- Приложить 10X ахроматический объектив к оси перевода монтирования.
- Построить 1,0 дюйма адаптер волокна пластины / XY-оси линзы перевода крепление в сборе.
- Получить ху оси перевода и крепление 1,0 дюйма адаптер волокна пластины с.
- Закрепить 1,0 дюйма волокна переходную пластину в ху оси перевода объектива.
- Авто-тон 1,0 дюйма волокна адаптер / ху оси перевод байонет узел в передней части объектива.
- Получите два 0,5 дюйма длиной, 1,0 дюйма объектив диаметром трубы, один 440/40 нм полосовой фильтр (фильтр возбуждения) и один 525/36 нм полосовой фильтр (излучение).
- Поместите каждый фильтр внутри 0,5 дюйма длиной, 1,0 дюйма линзы диаметр трубки, таким образом, что стрелка на внешней стороне фильтра обращена к стороне трубы объектива с наружной резьбой.
- Прикрепите фильтры к сборке.
- Получить два стандартных стопорные кольца.
- Закрепите фильтры внутри на 0,5 дюйма длиной, 1,0 дюйма диаметр линзы трубок со стандартными фиксирующими кольцами.
- Заверните линзы трубки с фильтром возбуждения к передней части клетки куба 30 мм и привинтить в объективе трубки с фильтром излучения к прямоугольным зеркалом монтирования.
- Заверните 0,5 дюйма объектива трубки с фильтром излучения к передней части правого угла зеркала монтирования.
- Obtaiп два 1,0 дюйма с резьбой 30 мм корпусные пластины и поместите их перед 0,5 дюйма длиной, 1,0 дюйма диаметром объектива пробирки, содержащие фильтры.
- С помощью эпоксидной смолы или сильный клей, приложите 455 нм привело к сетчатую пластину, подключенного к фильтру возбуждения.
- Получите один 0,5 дюйма длиной, 1,0 дюйма объектива диаметром трубки и 1,0 дюйма ахроматический объектив дублет трубка с фокусным расстоянием 50 мм.
- Поместите пробирку линзы внутри объектива трубки таким образом, чтобы стрелка на внешней стороне линзы обращена к стороне объектива трубы с наружной резьбой.
- Винт в трубке объектива до сборки.
- Получить один стандартный стопорное кольцо.
- Закрепите объектив внутри 0,5 дюйма длиной, 1,0 дюйма линзы диаметром трубки со стандартным стопорным кольцом.
- Прикрепите трубку объектива с трубкой объектива до крайнего слева пластины клетки.
- Поместите 30 мм сетчатую пластину на перед 0,5 дюйма длиной, 1,0 дюйма диаметром объектива пробирку, содержащую трубки линзы.
- Прикрепление беззаботным стопорное кольцо к внутренней стороне пластины 30 короткозамкнутым мм.
- Приложить USB монохромную камеру к клетке пластины с беззаботным стопорного кольца.
- Построить оптические приборы пост монтажа.
- Получить четыре 0,5 дюйма пост держатели, четыре оптических сообщения 0,5 дюйма, а четыре монтажных оснований.
- Закрепить оптические сообщения 0,5 дюйма внутри на 0,5 дюйма пост держателей.
- Закрепите 0,5 дюйма пост держателей на монтажные оснований.
- Винтовой в четыре оптических пост монтажных устройств к резьбовыми отверстиями, расположенными под клеткой куба 30 мм, правый угол зеркало крепление, сетчатую пластину, соединенную с СИД, и сетчатую пластину, соединенную с камерой.
- Заверните четыре оптических пост для монтажа устройств либо к оптическому макете или оптическом столе, чтобы закончить строительство высокого разрешения флуоресценции microendoscopy модальности.
ftp_upload / 54564 / 54564fig2.jpg "/>
Рис . 2: Монтаж высокого разрешения флуоресценции microendoscopy модальности высокого разрешения флуоресценции microendoscopy модальность может быть построена путем создания оболочки компонентов диаметра размером 1,0 дюйма, с особой тщательность в обработке дихроичное зеркало, линза объектива, возбуждение / фильтры выбросов и объектив трубки. Стеклянные поверхности этих компонентов должны быть тщательно обработаны с помощью объектива бумагу. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
2. Сборка Суб-диффузной отражательной спектроскопии модальности
Примечание: Изложенные шаги по сборке механизма отражательной спектроскопии к югу-диффузная можно визуализировать на рисунке 3.
- Получить источник света вольфрам-галоген, и, с помощью эпоксидной смолы или сильный клей, обеспечить 1,0 дюйма threaded 30 мм сетчатая пластина на фронт.
- Закрепите четыре 3,0 дюйма клетка сборки стержней в сетчатую пластину.
- Прикрепление перевод ось г крепление к клетке сборки стержней.
- Винт в 20Х ахроматической линзы объектива к оси перевода монтирования.
- Построить волоконно-адаптер пластина / XY-оси линзы перевода крепление в сборе.
- Получить ху оси перевода монтирования и 1,0 дюйма волокна переходную пластину.
- Закрепите адаптер волокна пластину в ху оси перевода объектива.
- Передвиньте 1,0 дюйма волокна адаптер / ху-перевод узел подвески в передней части объектива.
- Сборка узла двигателя рычаг.
- Получить изготовленный на заказ алюминиевый мотор руку и одну SMA адаптер волокна пластины.
- Заверните адаптер волокна пластины (с наружной резьбой) в алюминиевый мотор руки (с внутренней резьбой).
- Прикрепите изготовленный на заказ алюминиевый адаптер двигателя кронштейн для двигателя руку с четырьмя # 4-40 0,5 дюйма. Винтами.
- Построить корпус кронштейна / двигатель в сборе двигатель / двигатель.
- Получить пользовательский встроенный алюминиевый корпус двигателя и шаговый двигатель 400 шагов.
- Выстроить отверстия для винтов на шаговый двигатель и корпус двигателя и закрепите с четырьмя # 4-40 0,5 дюйма винтами.
- Поток вращающегося двигателя шток шагового двигателя через отверстие узла двигателя рычага и затяните фиксирующий винт на адаптере рычага алюминиевого двигателя.
- Построить узел оптического переключателя.
- Получить пользовательский встроенный алюминиевый оптический переключатель и три 1,0 дюйма адаптер волокна пластины.
- Резьба адаптера пластин в резьбовые отверстия в оптическом коммутаторе.
- Прикрепите изготовленный на заказ алюминиевый оптический переключатель лицевой панелью на оптический коммутатор с четырьмя # 4-40 0,5 дюйма винтами.
- Прикрепите кронштейн / моторный узел корпуса двигателя / двигателя к оптическим переключателем путем подачи вращающегося двигателя шток шагового двигателя через центральное отверстие тон оптический переключатель.
- Получить электрическую печатную плату и драйвер шагового двигателя, а затем поместить драйвер шагового двигателя через центральную канавку макете.
- Соблюдайте электрическую схему подключения (рис 3, 2.12) для водителя шагового двигателя, 12 В блок питания и шаговый двигатель.
- Подключите драйвер шагового двигателя, 12 В источник питания и шаговый двигатель , как указано на схеме (рис 3, 2.12) для завершения строительства моторизованного оптического переключателя.
- Ввернуть оптических компонентов выключатель и источник света вольфрамовая галогенная к оптическому макете или оптическом столе вблизи ранее построенный (рис 2, 1,24) с высокой разрешающей способностью флуоресценции microendoscopy сборки.
- Прикрепите один конец 550 мкм, 0,22 NA соединительный кабель к 1,0 дюйма адаптера волокна пластины узла двигателя рычага.
- Подключите другой конец 550 мкм, 0,22 NA соединительный кабель к волокну подключитьили от USB-спектрометра.
- Винт в пяти дистальных кабелей зонда к соответствующим 1,0 дюйма адаптер волокна пластин на инструментовке, чтобы закончить завершение мультимодальных изображений с высоким разрешением и суб-спектроскопии диффузного отражения волоконно-расслоения microendoscope.
- Винт в центральной 1 мм диаметр изображения волокна кабеля к 1,0 дюйма адаптера волокна пластины, упомянутой в пункте 1.9.2.
- Винт в крайнем левом 200 мкм многомодового волокна кабеля к 1,0 дюйма адаптера волокна пластины, упомянутой в пункте 2.6.
- Заверните 2 - й 200 мкм кабеля многомодового волокна в крайнее левое 1,0 дюйма волокна адаптера , прикрепленного к вольфрамо-галогенной лампой , упомянутой в пункте 2.9.2.
- Ввернуть 3 - й 200 мкм кабеля многомодового волокна к средней 1,0 дюйма адаптера волокна пластины , упомянутой в пункте 2.9.2.
- Винт в кабеле на основе многомодового волокна с 4 - й 200 мкм в крайнее правое 1,0 дюйма адаптера волокна пластины , упомянутой в пункте 2.9.2.

Рисунок 3:. Монтаж модальности отражательной спектроскопии суб-диффузный Модальность суб-спектроскопии диффузного отражения может быть построена с использованием основного вольфрам-галогенные лампы , соединенный с линзой объектива для фокусировки света через 200 мкм многомодового доставки волокна и спектрометр. Кроме того, пользовательский встроенный моторизованный оптический переключатель может быть построен в пределах пути лампы волоконно-спектрометр, предназначенный для переключения между каждым SDS. Исследователи , использующие несколько спектрометров для получения из нескольких паспортов безопасности может обойти оптический компонент переключателя. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.3. Калибровка Суб-диффузной отражательной спектроскопии модальности
Примечание: пollowing шаги (раздел 3), должны быть завершены до спектрального сбора данных (раздел 4).
- Включите все компоненты приборов, в том числе 455 нм LED, широкополосным вольфрамо-галогенной лампы, CMOS камеры, USB-спектрометре, шаговым двигателем и панели управления двигателем. Убедитесь, что затвор на вольфрамо-галогенной лампы открыта.
- Выключите все окружающее освещение.
- Откройте программное обеспечение на заказ сбора данных.
- Держите оборудование работает в течение 30 мин для лампы достигают нужной температуры и присущего шума от спектрометра стабилизации.
- Поместите диффузное стандарт отражения 20% внутри нижнего отверстия заказного, 3D печатная калибровки стандартного устройства.
- Поместите волоконно-оптический датчик внутри крайнего левого слота обычая, 3D напечатаны волоконно-держатель, показано на рисунке 4. Крайний левый слот фиксирует перпендикулярное расстояние от волоконно-оптического зонда к стандарту отражательной способности на 2,1 мм, что является ормальных расстояние, в котором сигнал достигает спектрометра максимальна в течение первых SDS 374 мкм.
- Регулировка моторизованного оптический переключатель в левой позиции таким образом, чтобы спектрометр соединен с первым SDS 374 мкм.
- Установить время интеграции до 500 мс. На этот раз интеграция должна быть выбрана, чтобы не насыщать спектрометр, но поддерживать время практически низкой интеграции.
- Приобретают спектр, R макс, 374μm, нажав кнопку "Приобретать Spectrum" в программном обеспечении.
- Закройте затвор на вольфрамо-галогенной лампой и записывают спектр, R темный, 374μm, фонового шума, нажав кнопку "Приобретать Spectrum" в программном обеспечении. После приобретения, открыть затвор еще раз.
- Поместите волоконно-оптический датчик внутри крайний правый слот обычай, 3D напечатаны волоконно-держатель, показано на рисунке 4. Крайний правый слот фиксирует перпендикулярное расстояние от волоконно-оptic наконечник зонда к стандарту отражательной способности на 3,9 мм, что оптимальное расстояние, в котором сигнал достигает спектрометра максимальна для второй SDS 730 мкм.
- Регулировка моторизованного оптический переключатель в среднее положение таким образом, чтобы спектрометр соединен со вторым SDS 730 мкм.
- Приобретают спектр, R макс, 730μm, нажав кнопку "Приобретать Spectrum" в программном обеспечении.
- Закройте затвор на вольфрамо-галогенной лампой и записывают спектр, R темный, 730μm, фонового шума, нажав кнопку "Приобретать Spectrum" в программном обеспечении.
- Откройте затвор еще раз.

Рис . 4: Калибровка механизма отражательной спектроскопии суб-диффузная Для предварительной экспериментальной калибровки, волоконно-оптический наконечник зонда должен быть помещен в разноеперпендикулярные расстояния от 20% стандарта диффузного отражения в зависимости от SDS. Для того, чтобы последовательно достичь этих перпендикулярных расстояний во всех экспериментах, калибровка стандартное устройство было разработано (перекрестное устройство сечения , показанного на (а)) , чтобы удерживать датчик на точных расстояниях от стандарта на 20% диффузного отражения. В этом конкретном волоконно-оптической установки зонда, свет от вольфрамовой галогенной лампы показан через оптический переключатель на источник-детектор разделений (б) 374 мкм и (с) 730 мкм (с двигателя и его руку удалены из оптического пути для ясности). Расстояния (D) 2,1 мм для SDS 374 мкм, и (е) 3,9 мм для SDS 730 мкм требуются для калибровки. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.4. В Vivo данных Acquisitioп и оптического извлечения свойств из человеческой кожи
В этом разделе мультимодальный техника microendoscope будет продемонстрирована на коже человека в естественных условиях.
- Откройте специальное программное обеспечение для сбора данных и настроить время интегрирования спектрометра, нажав кнопку "Время интеграции" и установите его так, что он такой же, как во время калибровки, который был 500 мс в этом случае (шаг 3.8).
- Определить участок кожи, в которой для получения данных, которые могут отличаться по заявлению следователя. В этом случае, тонкая кожа предплечья была выбрана в качестве демонстрации.
- Если участок кожи содержит волосы, удалить волосы с одноразовой стерильной бритвой.
- Получить стандартный желтый маркер, который содержит pyranine чернила, и слегка отметить выбранный участок кожи.
- Включите нм LED 455 и закрыть затвор с вольфрамовой галогенной лампой.
- Поместите зонд в нежном контакте с кожей.
- Перемещение зондомкруглый на запятнанную область ткани для просмотра живого корма с высоким разрешением верхушечного архитектуры кератиноцитов на окне просмотра программного обеспечения.
- Выберите подходящее время экспозиции и усиления, 150 мс и 10 дБ усиления в этом случае, чтобы избежать насыщения изображения, нажав кнопку "Время экспозиции" и "Gain", введя в соответствующие значения, а затем нажмите кнопку "Применить настройки" в программном обеспечении интерфейс.
- Приобретать изображение, нажав кнопку "Image" Acquire в интерфейсе программного обеспечения.
- При сохранении зонда в том же месте изображения, выключите светодиод 455 нм и открыть затвор к вольфрамо-галогенной лампы.
- Регулировка моторизованного оптический переключатель в левое положение, таким образом, чтобы спектрометр соединен со вторым SDS 374 мкм.
- Приобретать спектры, R ткани, 374μm, нажав кнопку "Приобретать Spectra" в интерфейсе программного обеспечения.
- Отрегулируйте моторизованный оптический переключатель в среднее положение таких гона спектрометре соединен со вторым SDS 730 мкм.
- Приобретать спектры, R ткани, 730μm, нажав кнопку "Приобретать Spectra" в интерфейсе программного обеспечения.
- Откройте программное обеспечение на заказ постобработки.
- Запустите программное обеспечение постобработки, нажав кнопку "Выполнить" и выберите флуоресцентного изображения с высоким разрешением, четыре спектра калибровки, а два в естественных условиях спектры из папки , в которой данные были сохранены при запросе программного обеспечения.
ПРИМЕЧАНИЕ: специальное программное обеспечение получает истинное абсолютное отражательная способность (R абс, 374μm и R ABS, 730μm) с использованием следующих уравнений.
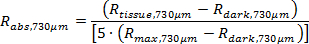
Код после обработки, как описано выше, вычисляет подогнанную кривую спектров диффузного отражения (уравнения 1 и 2), а затем Determines ткани физиологические параметры , включая ([Hb], [Мел] и SaO 2). 11,22,24
Access restricted. Please log in or start a trial to view this content.
Результаты
В соответствии с этим протоколом, следователь будет получить изображение высокого разрешения в фокусе участка ткани с полным полем зрения (рисунок 5). Контуры клеток можно увидеть, если окрашивали pyranine чернилами из стандартного желтого подсветки, в то время к...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мультимодальных изображений с высоким разрешением и суб-спектроскопии диффузного отражения волоконно-пучок microendoscope сообщили здесь могут быть оптимизированы и использоваться исследователями для различных применений, включая эндоскопические или портативного использования для ч...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This material is based on work supported by the National Institutes of Health (1R03-CA182052, 1R15-CA202662), the National Science Foundation Graduate Research Fellowship Program (G.G., DGE-1450079), the Arkansas Biosciences Institute, and the University of Arkansas Doctoral Academy Fellowship. Any opinions, findings, and conclusions or recommendations expressed in this material are those of the authors and do not necessarily reflect the views of the acknowledged funding agencies.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 30 mm Cage Cube with Dichroic Filter Mount | Thorlabs, Inc. | CM1-DCH | |
| 470 nm Dichroic Mirror (Beam Splitter) | Chroma Corporation | T470lpxr | |
| Cage Assembly Rod, 1.5", 4-Pack | Thorlabs, Inc. | ER1.5-P4 | |
| Cage Assembly Rod, 3.0", 4-Pack | Thorlabs, Inc. | ER3-P4 | |
| Cage Assembly Rod, 2.0", 4-Pack | Thorlabs, Inc. | ER2-P4 | |
| SM1-Threaded 30 mm Cage Plate | Thorlabs, Inc. | CP02 | |
| SM1 Series Stress-Free Retaining Ring | Thorlabs, Inc. | SM1PRR | |
| SM1 Lens Tube, 1.00" Thread Depth | Thorlabs, Inc. | SM1L10 | |
| Right-Angle Kinematic Mirror Mount | Thorlabs, Inc. | KCB1 | |
| 1" UV Enhanced Aluminum Mirror | Thorlabs, Inc. | PF10-03-F01 | |
| Z-Axis Translation Mount | Thorlabs, Inc. | SM1Z | |
| 10X Olympus Plan Achromatic Objective | Thorlabs, Inc. | RMS10X | |
| XY Translating Lens Mount | Thorlabs, Inc. | CXY1 | |
| SMA Fiber Adapter Plate with SM1 Thread | Thorlabs, Inc. | SM1SMA | |
| SM1 Lens Tube, 0.50" Thread Depth | Thorlabs, Inc. | SM1L05 | |
| 440/40 Bandpass Filter (Excitation) | Chroma Corporation | ET440/40x | |
| 525/36 Bandpass Filter (Emission) | Chroma Corporation | ET525/36m | |
| Quick Set Epoxy | Loctite | 1395391 | |
| 455 nm LED Light Housing Kit - 3-Watt | LED Supply | ALK-LH-3W-KIT | |
| 1" Achromatic Doublet, f = 50 mm | Thorlabs, Inc. | AC254-050-A | |
| Flea 3 USB Monochrome Camera | Point Grey, Inc. | FL3-U3-32S2M-CS | |
| 0.5" Post Holder, L = 1.5" | Thorlabs, Inc. | PH1.5 | |
| 0.5" Optical Post, L = 4.0" | Thorlabs, Inc. | TR4 | |
| Mounting Base, 1" x 2.3" x 3/8" | Thorlabs, Inc. | BA1S | |
| Long Lifetime Tungsten-Halogen Light Source (Vis-NIR) | Ocean Optics | HL-2000-LL | |
| 20X Olympus Plan Objective | Edmund Optics, Inc. | PLN20X | |
| Custom-Built Aluminum Motor Arm | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Arm Adaptor | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Motor Housing | N/A | N/A | Custom designed and built |
| Stepper Motor - 400 steps/revolution | SparkFun Electronics | ROB-10846 | Multiple suppliers |
| Custom-Built Aluminum Optical Fiber Switch | N/A | N/A | Custom designed and built |
| Custom-Built Aluminum Optical Fiber Switch Face-Plate | N/A | N/A | Custom designed and built |
| Arduino Uno - R3 | SparkFun Electronics | DEV-11021 | Multiple suppliers |
| Electronic Breadboard - Self-Adhesive | SparkFun Electronics | PRT-12002 | Multiple suppliers |
| EasyDriver - Stepper Motor Driver | Sparkfun Electronics | ROB-12779 | |
| 12 V, 229 mA Power Supply | Phihong | PSM03A | Multiple suppliers |
| Enhanced Sensitivity USB Spectrometer (Vis-NIR) | Ocean Optics | USB2000+VIS-NIR-ES | |
| 550 µm, 0.22 NA, SMA-SMA Fiber Patch Cable | Thorlabs, Inc. | M37L01 | |
| Custom-Built Fiber-Optic Probe | Myriad Fiber Imaging | N/A | |
| 20% Spectralon Diffuse Reflectance Standard | Labsphere, Inc. | SRS-20-010 | |
| Standard Yellow Highlighter | Sharpie | 25005 | Multiple suppliers, proflavine or fluorescein can be substituted |
Ссылки
- Muldoon, T. J., et al. Subcellular-resolution molecular imaging within living tissue by fiber microendoscopy. Opt Express. 15, 16413-16423 (2007).
- Rajaram, N., Reichenberg, J. S., Migden, M. R., Nguyen, T. H., Tunnell, J. W. Pilot clinical study for quantitative spectral diagnosis of non-melanoma skin cancer. Lasers Surg Med. 42, 716-727 (2010).
- Louie, J. S., Richards-Kortum, R., Anandasabapathy, S. Applications and advancements in the use of high-resolution microendoscopy for detection of gastrointestinal neoplasia. Clin Gastroenterol Hepatol. 12, 1789-1792 (2014).
- Chang, S. S., et al. High resolution microendoscopy for classification of colorectal polyps. Endoscopy. 45, 553-559 (2013).
- Muldoon, T. J., et al. Noninvasive imaging of oral neoplasia with a high-resolution fiber-optic microendoscope. Head Neck. 34, 305-312 (2011).
- Muldoon, T. J., et al. Evaluation of quantitative image analysis criteria for the high-resolution microendoscopic detection of neoplasia in Barrett's esophagus. J Biomed Opt. 15, 026027(2010).
- Prieto, S. P., Powless, A. J., Boice, J. W., Sharma, S. G., Muldoon, T. J. Proflavine Hemisulfate as a Fluorescent Contrast Agent for Point-of-Care Cytology. PLoS One. 10, e0125598(2015).
- Parikh, N., et al. In vivo diagnostic accuracy of high resolution microendoscopy in differentiating neoplastic from non-neoplastic colorectal polyps: a prospective study. Am J Gastroenterol. 109, 68-75 (2014).
- Shin, D., et al. Quantitative analysis of high-resolution microendoscopic images for diagnosis of esophageal squamous cell carcinoma. Clin Gastroenterol Hepatol. 13, 272-279 (2015).
- Prieto, S. P., et al. Qualitative and quantitative comparison of colonic microendoscopy image features to histopathology. Proc SPIE Int Soc Opt Eng. 9328, (2015).
- Greening, G. J., et al. Fiber-bundle microendoscopy with sub-diffuse reflectance spectroscopy and intensity mapping for multimodal optical biopsy of stratified epithelium. Biomed Opt Express. 6, 4934-4950 (2015).
- Rajaram, N., Gopal, A., Zhang, X., Tunnell, J. W. Experimental validation of the effects of microvasculature pigment packaging on in vivo diffuse reflectance spectroscopy. Lasers Surg Med. 42, 680-688 (2010).
- Spliethoff, J. W., et al. Monitoring of tumor response to cisplatin using optical spectroscopy. Transl Oncol. 7, 230-239 (2014).
- Chang, V. T., et al. Quantitative physiology of the precancerous cervix in vivo through optical spectroscopy. Neoplasia. 11, 325-332 (2009).
- Yu, B., Shah, A., Nagarajan, V. K., Ferris, D. G. Diffuse reflectance spectroscopy of epithelial tissue with a smart fiber-optic probe. Biomed Opt Express. 5, 675-689 (2014).
- Hennessy, R., Goth, W., Sharma, M., Markey, M. K., Tunnell, J. W. Effect of probe geometry and optical properties on the sampling depth for diffuse reflectance spectroscopy. J Biomedical Opt. 19, 107002(2014).
- Ghassemi, P., Travis, T. E., Moffatt, L. T., Shupp, J. W., Ramella-Roman, J. C. A polarized multispectral imaging system for quantitative assessment of hypertrophic scars. Biomed Opt Express. 5, 3337-3354 (2014).
- Vasefi, F., et al. Polarization-sensitive hyperspectral imaging in vivo: a multimode dermoscope for skin analysis. Sci Rep. 4, (2014).
- Winkler, A. M., Rice, P. F. S., Drezek, R. A., Barton, J. K. Quantitative tool for rapid disease mapping using optical coherence tomography images of azoxymethane-treated mouse colon. J Biomedl Opt. 15, 041512(2010).
- Bish, S. F., et al. Handheld Diffuse Reflectance Spectral Imaging (DRSi) for in-vivo characterization of skin. Biomed Opt Express. 5, 573-586 (2014).
- Prahl, S. A. Optical Absorption of Hemoglobin. , http://omlc.org/spectra/hemoglobin/ (1999).
- Rajaram, N., et al. Design and validation of a clinical instrument for spectral diagnosis of cutaneous malignancy. Appl Opt. 49, 142-152 (2010).
- Hennessy, R., Markey, M. K., Tunnell, J. W. Impact of one-layer assumption on diffuse reflectance spectroscopy of skin. J Biomed Opt. 20, 27001(2015).
- Rajaram, N., Nguyen, T. H., Tunnell, J. W. Lookup table-based inverse model for determining optical properties of turbid media. J Biomed Opt. 13, 050501(2008).
- Nichols, B. S., Rajaram, N., Tunnell, J. W. Performance of a lookup table-based approach for measuring tissue optical properties with diffuse optical spectroscopy. J Biomed Opt. 17, 057001(2012).
- Greening, G. J., James, H. M., Muldoon, T. J. Optical Phantoms: Diffuse and Sub-diffuse Imaging and Spectroscopy Validation. , SPIE Spotlights. 1-37 (2015).
- Karsten, A. E., Smit, J. E. Modeling and verification of melanin concentration on human skin type. Photochem Photobiol. 88, 469-474 (2012).
- Glennie, D. L., Hayward, J. E., Farrell, T. J. Modeling changes in the hemoglobin concentration of skin with total diffuse reflectance spectroscopy. J Biomed Opt. 20, 035002(2015).
- Lim, L., Nichols, B., Rajaram, N., Tunnell, J. W. Probe pressure effects on human skin diffuse reflectance and fluorescence spectroscopy measurements. J Biomed Opt. 16, 011012(2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены