A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
افتعال أشعة فوق البنفسجية فيس ورامان الطيفي المناعية منصة
* These authors contributed equally
In This Article
Summary
Nanoparticle-based optical probes have been designed as a vehicle for detecting antigens using Raman and UV-Vis spectroscopy. Here we describe a protocol for preparing such probes for a UV-Vis/Raman spectroscopy immunoassay in such a way to incorporate future multiplexing capabilities.
Abstract
تستخدم المناعية للكشف عن البروتينات بناء على وجود الأجسام المضادة المرتبطة بها. بسبب الاستخدام الواسع النطاق في مجال البحوث والسريرية، بنية تحتية كبيرة من الأدوات والمواد المناعية يمكن العثور عليه. على سبيل المثال، 96- و 384 جيدا هي لوحات البوليسترين المتاحة تجاريا ولها تصميم موحد لاستيعاب (أشعة فوق البنفسجية فيس) آلات التحليل الطيفي للأشعة فوق البنفسجية مرئية من مختلف المصنعين. وبالإضافة إلى ذلك، تتوفر مجموعة واسعة من المناعية، والعلامات الكشف، وكلاء عرقلة للتصاميم المناعية مخصصة مثل المقايسات المناعي المرتبط بالإنزيم (ELISA).
وعلى الرغم من البنية التحتية القائمة، ومجموعات ELISA القياسية لا تلبي كل الاحتياجات البحثية، الأمر الذي يتطلب تطوير المناعية الفردية، التي يمكن أن تكون مكلفة وتستغرق وقتا طويلا. على سبيل المثال، مجموعات ELISA لها مضاعفة منخفض (الكشف عن تحليلها أكثر من واحد في وقت واحد) قدرات لأنها تعتمد عادة على مضان أو عمودطرق orimetric للكشف. اللونية والتحليلات تستند الفلورسنت محدودة القدرات مضاعفة بسبب قمم الطيفية واسعة. في المقابل، أساليب تعتمد على التحليل الطيفي رامان لديها قدرة أكبر بكثير لمضاعفة بسبب قمم الانبعاثات الضيقة. ميزة أخرى لرامان الطيفي هو أن صحفيين رامان تجربة أقل بكثير photobleaching من من علامات الفلورسنت 1. وعلى الرغم من المزايا التي صحفيين رامان يكون على استخدام علامات الفلورسنت واللونية والبروتوكولات لافتعال المناعية أساس رامان محدودة. والغرض من هذه الورقة هو توفير بروتوكول لإعداد تحقيقات functionalized لاستخدام جنبا إلى جنب مع لوحات البوليسترين للكشف المباشر في التحاليل عن طريق تحليل أشعة فوق البنفسجية فيس ورامان الطيفي. سوف يسمح هذا البروتوكول الباحثين لاتخاذ نهج افعل ذلك بنفسك للكشف متعدد تحليلها في المستقبل مع الاستفادة من البنية التحتية سلفا.
Introduction
المناعية شطيرة نموذجية كشف بشكل غير مباشر وجود مستضد باستخدام اثنين من الأجسام المضادة. لا بد من الأجسام المضادة القبض على سطح صلب ويشكل مجمع الضد مستضد عندما تكون في القرب من المستضد المناسب. ثم يتم إدخال الأجسام المضادة كشف وبربط المستضد. بعد الغسيل، يتم الكشف عن / مستضد / بقايا معقدة الضد الضد والضد الكشف عن المسمى كما هو موضح في الشكل 1A. ويتم الكشف النموذجية التي كتبها كاشف الفلورسنت أو اللونية، والحد من مضاعفة إلى 10 التحاليل بسبب قمم الطيفية واسعة 2،3. في المقابل، النظم القائمة رامان بوجود قمم الانبعاثات أضيق بكثير مما أدى إلى تعزيز القدرات المتنوعة مع مصادر تدعي كشف في وقت واحد تصل إلى 100 التحاليل 2،3.
كثيرة مصادر الأدب المتاحة التي تغطي جوانب هامة تتعلق المناعية 4-6 مثل خطوة بخطوةتفاصيل لخلق مجموعات ELISA شخصية. للأسف، هذه البروتوكولات هي للكشف عن الفلورسنت أو اللونية، مما يحد من قدرة مضاعفة المناعية حسب الطلب. لتلبية هذه الحاجة، نقدم إجراءات مفصلة لافتعال أشعة فوق البنفسجية فيس / رامان المناعية التي نشرت سابقا 7 لالمناعي المباشر كما هو موضح في الشكل 1B.
ويشمل هذا البروتوكول تلفيق تحقيقات القائم على جسيمات متناهية الصغر من الذهب functionalized، هو موضح في الشكل (2). الإجراء لجعل تحقيقات / الأشعة فوق البنفسجية فيس رامان يبدأ ملزمة للصحفيين رامان على سطح جزيئات الذهب (AuNPs). ثم يتم functionalized وAuNPs مع الأجسام المضادة التي ترتبط مع البولي ايثيلين جلايكول (PEG). يتم حظر المتبقية مواقع ملزمة للAuNPs عن طريق الربط ميثوكسي ثيول البولي ايثيلين جلايكول (MPEG-SH) لAuNPs لمنع اللاحقة غير محددة وملزمة أثناء التحليل. يتم اختبار تحقيقات AuNP أعدها ملزمة لمستضداتثابت إلى آبار لوحة البوليسترين كما هو موضح في الشكل 1B. على غسل لوحة، تحقيقات AuNP يتم الكشف عنها باستخدام التحليل الطيفي للأشعة فوق البنفسجية فيس بينما تم الكشف للصحفيين رامان المرتبطة رامان الطيفي. الجمع بين البيانات أشعة فوق البنفسجية فيس ورامان الطيفي يوفر طريقتين من التحليلات، وتعزيز قدرات هذا المناعية.
Protocol
1. إعداد المخازن
- الفوسفات مخزنة المالحة (PBS)
- تمييع 50 مل من 10X برنامج تلفزيوني مع 450 مل HPLC المياه الصف لجعل تركيز برنامج تلفزيوني 1X. تصفية العقيمة الحل مع مرشح 0.22 ميكرون.
- حل تخزين في درجة حرارة الغرفة.
- إعداد تريس مخزنة المالحة + توين 20 (TBST)
- تمييع 50 مل من 10X تريس مخزنة المالحة (TBS) مع 450 مل HPLC المياه الصف لجعل تركيز 1X. إضافة 250 ميكرولتر من توين-20 0.05٪ (ت / ت) من توين-20. تصفية العقيمة الحل مع مرشح 0.22 ميكرون.
- تخزين في درجة حرارة الغرفة.
- إعداد مصل الزلال الإنسان (HSA) عرقلة الحل
- تزن 0.45 غرام من HSA إلى 15 مل من العقيمة التي تمت تصفيتها برنامج تلفزيوني 1X لجعل 3٪ ث / ت حل هائل سعيد أنعم. يذوب تماما حل دوامة حتى هائل سعيد أنعم.
- حل HSA تخزينها في 4 درجات مئوية.
ملاحظة: الأبقار مصل الزلالويمكن أيضا (BSA) أن تستخدم كحل حظر.
- إعداد مضاد للفيروسات الأجسام المضادة (PEG-أب) حل
ملاحظة: يجب أن يكون حل الأجسام المضادة خالية من الناقل أو استقرار البروتينات مثل جيش صرب البوسنة، التي من شأنها أن تتدخل في تفاعلات الاقتران من خلال التنافس على ن-hydroxysulfosuccinimide (NHS) مواقع الربط. إذا يأتي الأجسام المضادة في حل تريس أو عازلة الجلايسين، يجب أن يخضع لعملية الصرف عازلة لمنع الأمينات أو أملاح الأمونيوم من التدخل في رد فعل الاقتران NHS. إذا كان الضد هو في شكل مجفف بالتجميد، ويمكن معلق وفقا لتوصية الشركة الصانعة بتركيز 1-10 ملغ / مل.- عن الأجسام المضادة في منطقة عازلة تريس أو الجلايسين، نفذ تبادل عازلة ل100 ملي بيكربونات الصوديوم باستخدام عمود تحلية. استخدام المخزن المؤقت ملي 100 لرفع درجة الحموضة إلى ما يقرب من 8.5 لتسريع رد فعل الاقتران.
- هيدرات أورثو-بيرويل ثاني كبريتيد-PEG-NHS (OPSS-PEG-NHS) مع 100 ملي الصورةالكراهية بيكربونات إلى حجم 1 مل بتركيز 1 ملغ / مل أو أكثر.
ملاحظة: يجب أن يتم OPSS-PEG-NHS الطازجة واستخدامها داخل ما يقرب من 20 دقيقة. مجموعة NHS على OPSS-PEG-NHS لديه نصف عمر حوالي 20 دقيقة في محلول مائي عند درجة الحموضة 8.5. - إضافة OPSS-PEG-NHS إلى حل الأجسام المضادة في نسبة 2: 1 (PEG: الجسم المضاد) نسبة الاقتران لاستخدامها في عينات الاختبار. في أنبوب microcentrifuge منفصلة، إضافة OPSS-PEG-NHS في حل مستضد في نسبة 2: 1 الاقتران لاستخدامها لعنصر التحكم.
ملاحظة: 2: 1 نسبة تكتسب كفاءة تصريف 50٪. والهدف هو تسمية كل الأجسام المضادة مع سلسلة PEG واحد. في هذه الخطوة، والإفراط في وصفها هو أفضل مما كان في ظل وضع العلامات. استخدام المعادلة التالية لتحديد الكميات المناسبة من OPSS-PEG-NHS وحل الأجسام المضادة:
حيث V هو حجم، C هو تركيز أعرب في الجزيئات أوtibodies لكل مل. السفلية PEG وأب هي OPSS-PEG-NHS والأجسام المضادة، على التوالي. يجب أن يكون الحجم النهائي ما يقرب من 250 ميكرولتر. - احتضان حل PEG-أب في 4 درجة مئوية لمدة 8 ساعات أو طوال الليل. حل مخزن في aliquots من ما يقرب من 25 ميكرولتر العمل في -20 درجة مئوية للحد من دورات ذوبان التجميد والتأكد من استخدام أنابيب ملزمة منخفضة.
2. إعداد أشعة فوق البنفسجية فيس / رامان تحقيقات
- يعد حل AuNP عارية
- إعداد محلول 2 مل من AuNPs مع تركيز حوالي 1 × 10 11 الجسيمات لكل مليلتر.
- وإذا كان يحتاج إلى التركز في AuNPs، وملء المنخفضة أنابيب الطرد المركزي ملزمة مع 2000 ميكرولتر من الأسهم AuNP وأجهزة الطرد المركزي في 5000 x ج لمدة 20 دقيقة أو حتى طاف هو واضح. إزالة طاف قبل pipetting، والحرص على عدم تعكير صفو بيليه AuNP.
- الجمع بين الحلول AuNP المتبقية في أنبوب واحد وتقدير concentraنشوئها عن طريق الحصول على قياس الأشعة فوق البنفسجية فيس ومقارنة القيم لتركيزات يعرف هذا هو وجود علاقة خطية.
- إعداد محلول 2 مل من AuNPs مع تركيز حوالي 1 × 10 11 الجسيمات لكل مليلتر.
- تحديد رامان نسبة مراسل وضع العلامات المناسبة
- يعد حل يعملون لمراسل رامان الذائبة في الميثانول. وهذا التركيز أن تعتمد على مراسل المستخدمة. في هذا العمل، وإعداد يوديد 3،3'-diethylthiatricarbocyanine (مركز دبي) في حل العاملة من 200 ميكرومتر.
- على افتراض الحجم النهائي من 100 ميكرولتر لكل بئر، إضافة ما يكفي من حل مراسل العمل على كل بئر من الصف الأول من لوحة 96-جيدا بحيث مراسل رامان ستتراوح في التركيزات من 0.2 ميكرومتر إلى 10 ميكرومتر. إضافة ما يكفي من المياه HPLC الصف إلى كل هذا جيدا أن حجم 80 ميكرولتر. إضافة 20 ميكرولتر من AuNP لجعل كل بئر الحجم النهائي من 100 ميكرولتر لكل بئر. ومن الأمثلة في الجدول 1.
- قياس الأشعة فوق البنفسجية فيس أطياف من 400 إلى700 نانومتر باستخدام قارئ لوحة أشعة فوق البنفسجية فيس معمل. تركيز مناسب هو أعلى تركيز مع قمم المعرفة للأطياف الأشعة فوق البنفسجية فيس. تم العثور كرر الخطوة 2.2.2 إلى زيادة تركيزات حتى أعلى نسبة تركيز للصحفيين رامان إلى AuNPs.
ملاحظة: صبغ وشكل AuNP، حجم، والشركة المصنعة تؤثر على التركيز المناسب. ولذلك، فإن الخطوات المذكورة يجب تقييمها وتعديلها حسب المكونات المستخدمة. شارك هذا البروتوكول استخدام صبغة موجبة الشحنة. على هذا النحو، ملزم بين AuNP ومراسل وتحسنت باستخدام AuNPs سالبة الشحنة. وقد تم ذلك عن طريق استخدام سترات توج AuNPs. راجع قسم مناقشة لمزيد من التفاصيل.
- ملزمة مراسل رامان وPEG-أب لAuNP
- إعداد اثنين من 1.5 مل دفعات من AuNP ومراسل رامان في تركيز سبق تحديدها، والسماح للمراسل رامان لربط إلى AuNPs لمدة 30 دقيقة في درجة حرارة الغرفة.
- إضافة الجسم المضاد مضاد للفيروسات (PEG-أب) لدفعة واحدة من الحل مراسل AuNP ورامان لإنشاء 200: 1 نسبة الأجسام المضادة للجسيمات. وهذا الحل يكون لعينات الاختبار. في أنبوب microcentrifuge منفصلة، إضافة مستضد مضاد للفيروسات لدفعة أخرى من الحل مراسل AuNP ورامان في 200: 1 نسبة الأجسام المضادة للجسيمات لاستخدامها عنصر التحكم. احتضان الحلول لمدة 30 دقيقة في درجة حرارة الغرفة.
ملاحظة: إن نسبة الأجسام المضادة للجزيئات أن تكون محددة إلى AuNPs وصبغ المستخدمة، وينبغي أن يكون الأمثل لكل حالة على حدة. والهدف هنا هو الحصول على أعلى نسبة من الأجسام المضادة لتحقيقات AuNP لربط حين منع تجميع الجسيمات. استخدام المعادلة التالية لتحديد الكميات المناسبة لإضافة معا:
حيث V هو حجم، C هو تركيز أعرب في الجسيمات أو الأجسام المضادة لكل مل. الزعنفةيجب أن يكون حجم آل يقرب من 1.5 مل.
- كتلة المتبقية المواقع على سطح AuNP مع MPEG-SH.
- إعداد MPEG-SH عن طريق إذابة الصلبة ميثوكسي البولي ايثيلين جلايكول ثيول إلى تركيز 200 ميكرومتر باستخدام المياه. دوامة الحل حتى يذوب MPEG-SH تماما.
- إضافة MPEG-SH في 40،000: 1 نسبة إلى حل AuNP-PEG-أب في الخطوة 2.3. احتضان الحل في درجة حرارة الغرفة لمدة 10 دقيقة لضمان حظر المواقع المتبقية على جسيمات متناهية الصغر من الذهب. استخدام المعادلة التالية لتحديد الكميات المناسبة لإضافة معا:
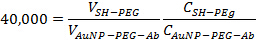
حيث V هو حجم، C هو تركيز أعرب في الجسيمات أو الأجسام المضادة لكل مل. يجب أن يكون الحجم النهائي ما يقرب من 1.5 مل.
- استعادة تحقيقات رامان functionalized.
- الجسيمات أجهزة الطرد المركزي في 5000 x ج لمدة 20 دقيقة في انخفاض ربط جأنابيب entrifuge أو حتى طاف هو واضح. إزالة طاف بواسطة pipetting الحرص على عدم تعكير صفو AuNPs.
- Resuspend والجسيمات مع 1 مل من محلول برنامج تلفزيوني 1X التي تم إجراؤها سابقا. تقدير تركيز AuNP بأخذ قياس الأشعة فوق البنفسجية فيس وحدة تخزين صغيرة من محلول (3 ميكرولتر) ومقارنة النتائج لقياسات من تركيز AuNP المعروفة. ضبط مستوى الصوت بحيث الحل النهائي لا يقل عن 1 × 10 11 الجسيمات لكل مليلتر.
- مخزن الحلول في 4 درجات مئوية حتى يتم استخدامه للfunctionalizing من لوحة المناعية. استخدام حلول في غضون أسبوع واحد.
| مجلدات لإضافة كل مكون (مل) | |||
| مركز دبي تركيز النهائي (ملم) | مركز دبي الحل العمل (200 ملم) | AuNP | ماء |
| 0.2 | 0.1 | 20 | 79.9 |
| 0.6 | 0.3 | 20 | 79.7 |
| 1 | 0.5 | 20 | 79.5 |
| 2 | 1.0 | 20 | 79 |
| 5 | 2.5 | 20 | 77.5 |
| 7 | 3.5 | 20 | 76.5 |
| 10 | 5.0 | 20 | 75 |
الجدول 1. مركز دبي تخفيف سبيل المثال. التخفيفات مختلفة من مركز دبي وأحجام المرتبطة بها من الاسهم مركز، أبرزها حل جسيمات متناهية الصغر من الذهب، والماء.
3. المناعية لوحة التحضير
- ربط مستضد المطلوب إلى لوحة المناعية.
- إعداد ما يكفي من المستضد المخفف (50 ميكروغرام / مل) لملء الآبار البوليسترين. دوامة الحل،وعلى الفور إضافة إلى حل للآبار لوحة. السماح للمستضد لربط لوحات لمدة 1 ساعة في درجة حرارة الغرفة.
- يغسل مستضدات غير منضم.
- إزالة حل مستضد الزائد عن طريق الإغراق الحل في وعاء التخلص منها وضرب لوحة ضد الطاولة مغطاة ورقة منشفة.
- إضافة TBST إلى الآبار لغسل السطح ثم إزالة غسل بنفس الطريقة كما ذكر سابقا. كرر هذه الخطوة مرتين أخريين.
- كتلة المتبقية مواقع الربط على لوحة لمنع غير محددة وملزمة.
- إضافة 70 ميكرولتر من HSA عرقلة الحل لكل بئر من لوحة واحتضان في درجة حرارة الغرفة لمدة 30 دقيقة.
- إزالة وشطف لوحة باستخدام نفس الإجراء على النحو المحدد في الخطوة 3.2. تغطية لوحة ومخزن الجافة في 4 درجات مئوية لتصبح جاهزة للاستخدام.
- Functionalize لوحة المناعية.
- إضافة 70 ميكرولتر من رانه سبر الجسيمات النانوية التي أعدت في القسم 2 إلى العمود الأول من لوحة 96-جيدا وتمييع الأعمدة التالية باستخدام 1: التخفيف المتسلسل 2. تسمح لوحة لاحتضان لمدة 1 ساعة على الأقل. يتم إعطاء مثال عن كيفية إعداد لوحة المناعية في الشكل (3).
- غسل لوحة مع TBST خمس مرات كما هو موضح في الخطوات 3.2، مع التأكد من التخلص من AuNPs بشكل مناسب. بعد غسل النهائي، إضافة 70 ميكرولتر من برنامج تلفزيوني 1X إلى كل بئر، وتغطي مع ختم اللوحة.
ملاحظة: يجب أن يكون عينات سيطرة واضحة. إذا غير محددة وملزمة حدث، فإن عينات الرقابة يجب لون مماثل لعينات الاختبار.
- حساسية فحص اختبار الأشعة فوق البنفسجية فيس ورامان الطيفي.
- لكل بئر، وقياس الأشعة فوق البنفسجية فيس أطياف تتراوح 400-700 نانومتر باستخدام قارئ لوحة أشعة فوق البنفسجية فيس معمل.
- باستخدام رامان المجهر المقلوب، والتركيز على الهدف على سطح البئر الذي يحتوي على تحقيقات AuNP. أوبتين أطياف رامان من البئر. جمع طائفة تتراوح بين 1800 سم -1 الى 400 سم -1. كرر هذه الخطوة لجميع الآبار.
- باستخدام برنامج الطيفي المناسب، نفذ أمر ال 11 تصحيح خط الأساس متعدد الحدود لأطياف رامان ونظام 3 الثالثة متعدد الحدود للأشعة فوق البنفسجية فيس الأطياف.
- باستخدام برنامج الطيفي المناسب، تطبيع رامان والأشعة فوق البنفسجية فيس الأطياف. تعيين الحد الأقصى القيمة إلى 1، وتوسيع نطاق كل القيم الأخرى وفقا لذلك. لتطبيع أطياف رامان، حدد البوليسترين ذروة فريدة من نوعها وضعه يساوي 1 وحجم كل القيم الأخرى وفقا لذلك.
- باستخدام برنامج الطيفي المناسب، نفذ ذروة التكامل لكل الطيف. لأطياف رامان، يجب أن تكون الذروة التي تمثل مراسل رامان في غائبا المنطقة من قمم البوليسترين. لأداء التكامل الذروة، تحديد حدود متكاملة لذروة المطلوب وتسجيل منطقة ذروة المطلوب لجميع العينات بما في ذلك الضوابط.
- رربعد التمديد متوسط ذروة مجال الاهتمام بوصفها وظيفة من سجل للتركيز AuNP مع أشرطة الخطأ لكل نقطة تشير إلى الانحراف المعياري المرتبطة بها. تناسب هذه النقاط المعايرة إلى منحنى اللوجستي 4-المعلمة.
- تحديد قيمة متوسط الفراغ عن طريق حساب متوسط منطقة ذروة الفائدة لعينة فارغة. تحديد الانحراف المعياري لهذه المناطق. هذا هو الانحراف المعياري من الفراغ.
- لنفس الذروة تحليلها في الخطوة السابقة، والعثور على الانحراف المعياري لتلك المنطقة الذروة لأدنى تركيز.
- حساب الحد من الحد فارغة والسفلي من الكشف على النحو المحدد في قسم النتائج الممثل. استخدام هذه القيم مع منحنيات 4PL المعايرة لتحديد LLOD من حيث تركيز AuNP.
النتائج
في هذه الدراسة، تم استخدام جزيئات الذهب 60 نانومتر لمطيافية أشعة فوق البنفسجية فيس. أشعة فوق البنفسجية فيس أطياف الامتصاص من جمعت 400-700 نانومتر والمناطق الذروة لكل تركيز AuNP تم تحديد استخدام البرمجيات مفتوحة المصدر التحليل الطيفي 8. قبل أن يبلغ ذروته التكامل، خضع ...
Discussion
في بروتوكول مفصلة، وهناك العديد من النقاط الحرجة للتصدي ل. قضية واحدة هي خيار مراسل رامان وجسيمات متناهية الصغر من الذهب. وعلى الرغم من كتابة البروتوكول يمكن تكييفها للاستخدام الفردي، تم استخدام رامان مراسل مركز دبي كمثال على ذلك. مركز دبي هو مراسل موجبة الشحنة و?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
This work was supported by a Research Catalyst Award from Utah State University. The authors would like to thank Annelise Dykes, Cameron Zabriskie, and Donald Wooley for their contributions.
Materials
| Name | Company | Catalog Number | Comments |
| 60 nm Gold Nanoparticle | Ted Pella, Inc. | 15708-6 | These are citrate capped gold nanoparticles. Please see Discussion for relationship between Raman reporter and AuNP surface charge and its imporance to proper selection of AuNP and/or Raman reporter. |
| Sodium Bicarbonate | Fisher Scientific | S233-500 | |
| Methanol | Pharmco-Aaper | 339000000 | |
| Tris Buffered Saline (10x) pH 7.5 | Scy Tek | TBD999 | |
| Bottle Top Filtration Unit | VWR | 97066-202 | |
| Tween 20 (polysorbate 20) | Scy Tek | TWN500 | Used as an emulsifying agent for washing steps. |
| Phosphate Buffered Saline 10x Concentrate, pH 7.4 | Scy Tek | PBD999 | |
| Protein LoBind Tube 2.0 ml | Eppendorf Tubes | 22431102 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Protein LoBind Tube 0.5 ml | Eppendorf Tubes | 22431064 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Microplate Devices UniSeal | GE Healthcare | 7704-0001 | Used for sealing and storing functionalized plates. |
| Assay Plate, With Low Evaporation Lid, 96 Well Flat Bottom | Costar | 3370 | |
| HPLC grade water | Sigma Aldrich | 270733-4L | |
| 3,3′-Diethylthiatricarbocyanine iodide (DTTC) | Sigma Aldrich | 381306-250MG | Raman reporter |
| mPEG-Thiol, MW 5,000 - 1 gram | Laysan Bio, Inc. | MPEG-SH-5000-1g | |
| OPSS-PEG-SVA, MW 5,000 - 1 gram | Laysan Bio, Inc. | OPSS-PEG-SVA-5000-1g | OPSS-PEG-SVA has an NHS end. |
| Mouse IgG, Whole Molecule Control | Thermo Fisher Scientific | 31903 | Antigen |
| Goat anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody | Thermo Fisher Scientific | 31164 | Antibody |
| Human Serum Albumin Blocking Solution | Sigma Aldrich | A1887-1G | Bovine serum albumin can be used instead. |
| Mini Centrifuge | Fisher Schientific | 12-006-900 | |
| UV-Vis Spectrophotometer | Thermo Scientific | Nanodrop 2000c | |
| UV-Vis Spectrophotometer | BioTek | Synergy 2 | |
| Desalting Columns | Thermor Scientific | 87766 | |
| In-house built 785 nm inverted Raman microscope unit | N/A | N/A | An inverted Raman microscope is best for proper focusing onto surface of the well plate. Otherwise a very low magnification will be used due to height of the 96-well plate. An in-house built system was used as it was cheaper than buying from a vendor. However, any commercially available inverted Raman microscope system can be used. |
References
- Israelsen, N. D., Hanson, C., Vargis, E. Nanoparticle properties and synthesis effects on surface-enhanced Raman scattering enhancement factor: an introduction. Sci. World J. , e124582 (2015).
- Wang, Y., Schlücker, S. Rational design and synthesis of SERS labels. Analyst. 138 (8), 2224-2238 (2013).
- Wang, Y., Yan, B., Chen, L. SERS tags: novel optical nanoprobes for bioanalysis. Chem. Rev. 113 (3), 1391-1428 (2013).
- . . The Immunoassay Handbook: Theory and applications of ligand binding, ELISA and related techniques. , (2013).
- Cox, K. L., Devanarayan, V., Kriauciunas, A., Manetta, J., Montrose, C., Sittampalam, S. Immunoassay Methods. Assay Guid. Man. , (2004).
- . . ELISA development guide. , (2016).
- Israelsen, N. D., Wooley, D., Hanson, C., Vargis, E. Rational design of Raman-labeled nanoparticles for a dual-modality, light scattering immunoassay on a polystyrene substrate. J. Biol. Eng. 10, (2016).
- Menges, F. . Spekwin32 - optical spectroscopy software. Version 1.72.1. , (2016).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Yu, X. Quantifying the Antibody Binding on Protein Microarrays using Microarray Nonlinear Calibration. BioTechniques. 54, 257-264 (2013).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin. Biochem. Rev. 29 (Suppl 1), S49-S52 (2008).
- . . EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline. 32. No 8, (2012).
- Leigh, S. Y., Som, M., Liu, J. T. C. Method for assessing the reliability of molecular diagnostics based on multiplexed SERS-coded nanoparticles. Plos One. 8 (4), e62084 (2013).
- Sinha, L. Quantification of the binding potential of cell-surface receptors in fresh excised specimens via dual-probe modeling of SERS nanoparticles. Sci. Rep. 5, 8582 (2015).
- Shi, W., Paproski, R. J., Moore, R., Zemp, R. Detection of circulating tumor cells using targeted surface-enhanced Raman scattering nanoparticles and magnetic enrichment. J. Biomed. Opt. 19, 056014 (2014).
- Xia, X., Li, W., Zhang, Y., Xia, Y. Silica-coated dimers of silver nanospheres as surface-enhanced Raman scattering tags for imaging cancer cells. Interface Focus. 3 (3), 20120092 (2013).
- McLintock, A., Cunha-Matos, C. A., Zagnoni, M., Millington, O. R., Wark, A. W. Universal surface-enhanced Raman tags: individual nanorods for measurements from the visible to the infrared (514-1064 nm). Acs Nano. 8 (8), 8600-8609 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved