このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
紫外可視およびラマン分光法イムノアッセイプラットフォームを製作
要約
Nanoparticle-based optical probes have been designed as a vehicle for detecting antigens using Raman and UV-Vis spectroscopy. Here we describe a protocol for preparing such probes for a UV-Vis/Raman spectroscopy immunoassay in such a way to incorporate future multiplexing capabilities.
要約
免疫アッセイは、関連する抗体の存在に基づいて、タンパク質を検出するために使用されます。そのため、研究と臨床現場での広範な使用の、免疫測定機器および材料の大規模なインフラを見つけることができます。例えば、96および384ウェルポリスチレンプレートは、市販されており、種々の製造業者からの紫外 - 可視(UV-Vis)で分光機を収容するために、標準的な設計を有します。また、このような酵素結合免疫吸着検定法(ELISA)などのカスタマイズされた免疫アッセイの設計のための免疫グロブリン、検出タグ、およびブロッキング剤の多種多様なご利用いただけます。
既存のインフラストラクチャにもかかわらず、標準的なELISAキットは、高価で時間がかかる可能性が個別のイムノアッセイの開発を必要とする、すべての研究の必要性を満たしていません。彼らは通常、蛍光またはCOLに依存するように例えば、ELISAキットは、低多重化(一度に複数の分析物の検出)機能を持っています検出のためのorimetric方法。比色や蛍光ベースの分析は、広いスペクトルのピークに起因する多重化機能が制限されています。対照的に、ラマン分光法に基づく方法は、狭い放射ピークのために多重化するためのはるかに高い能力を有します。ラマン分光法の別の利点は、ラマンレポーターは、蛍光タグ1よりも大幅に少ない光退色が発生することです。ラマンレポーターは、蛍光比色タグの上に持っていることを利点にもかかわらず、ラマンベースのイムノアッセイを製造するためのプロトコルは限られています。この論文の目的は、UV-Visの分析及びラマン分光法による分析物の直接検出のためのポリスチレンプレートと組み合わせて使用するために官能化プローブを調製するためのプロトコルを提供することです。このプロトコルは、事前に確立されたインフラストラクチャを活用しながら、研究者は、将来の多検体の検出のための日曜大工のアプローチを取ることができます。
概要
典型的なサンドイッチイムノアッセイは、間接的に二つの抗体を用いて抗原の存在を検出します。捕捉抗体は、固体表面に結合したときに適切な抗原に近接して抗体 - 抗原複合体を形成します。検出抗体は、次いで、導入された抗原に結合します。洗浄後、抗体/抗原/抗体複合体が残存し、 図1Aに示されたように標識した検出抗体によって検出されます。典型的な検出は、広いスペクトルのピーク2,3に起因する10の検体に多重化を制限し、蛍光または比色検出器によって行われます。これとは対照的に、ラマンベースのシステムには、最大100の検体2,3の同時検出を主張ソースで強化された多重化機能が得られはるかに狭い発光ピークを持っています。
このようなステップ・バイ・ステップとして6 -多くの文献情報源は、イムノアッセイ4に関連する重要な側面をカバーしているご利用いただけます詳細は、パーソナライズされたELISAキットを作成します。残念ながら、これらのプロトコルは、カスタマイズされた免疫アッセイの多重化能力を制限し、蛍光または比色検出のためのものです。この必要性に対処するために、我々は、 図1Bに示すように、直接イムノアッセイについて以前に公開され7 UV-可視/ラマンイムノアッセイを作製する詳細な手順を提示します。
このプロトコルは、図2に示した官能基化金ナノ粒子ベースのプローブの製造を含んでいる。ラマン/ UV-Visのプローブを作成する手順は、金ナノ粒子(AuNPs)の表面にラマンレポーターを結合することによって開始します。 AuNPsは、その後、ポリエチレングリコール(PEG)と関連している抗体を用いて官能化されます。 AuNPsの残りの結合部位は、分析の間の結合、その後の非特異を防止するAuNPsにメトキシポリエチレングリコールチオール(MPEG-SH)を結合することによってブロックされます。準備AuNPプローブは、抗原に結合することによってテストされます図1Bに示すように、ポリスチレンプレートのウェルに固定されています。関連ラマンレポーターは、ラマン分光法を用いて検出している間にプレートを洗浄すると、AuNPプローブは、紫外可視分光法を用いて検出されます。 UV-Visのラマンスペクトルデータを組み合わせることにより、この免疫アッセイの能力を強化、分析の2つのメソッドを提供します。
プロトコル
バッファーの調製
- リン酸緩衝生理食塩水(PBS)
- 1×PBS濃度を行うには450点mLのHPLC等級の水で10×PBS 50 mlで希釈しました。滅菌フィルター0.22μmのフィルターを用いて溶液。
- 室温で保存液。
- トリス緩衝生理食塩水+トゥイーン20(TBST)の調製
- 1倍濃度を作製するには450点mLのHPLC等級の水で10倍トリス緩衝生理食塩水(TBS)を50mlを希釈。 Tween-20を0.05%(v / v)のためのTween-20の250μLを加えます。滅菌フィルター0.22μmのフィルターを用いて溶液。
- 室温で保管してください。
- ブロッキング溶液ヒト血清アルブミン(HSA)の調製
- HSA溶液w / vの3%を作るために滅菌濾過した1×PBSの15ミリリットルにHSAの0.45グラムを計量。 HSAまでボルテックス溶液が完全に溶解されます。
- 4℃で保存HSA溶液。
注:ウシ血清アルブミン(BSA)は、ブロッキング溶液として使用することができます。
- PEG化抗体の作製(PEG-AB)ソリューション
注:抗体溶液は、N-ヒドロキシスクシンイミド(NHS)の結合部位について競合することによって結合反応を妨害するBSA、などの担体または安定化タンパク質から自由でなければなりません。抗体は、トリスまたはグリシン緩衝液中に来る場合は、NHSコンジュゲーション反応と干渉アミンまたはアンモニウム塩を防止するために、緩衝液交換を受けなければなりません。抗体は凍結乾燥形態である場合、それは1〜10ミリグラム/ mlの濃度で製造業者の推奨に従って再懸濁することができます。- トリスまたはグリシン緩衝液中の抗体を、脱塩カラムを使用して100mMの炭酸水素ナトリウムを緩衝液交換を行います。結合反応をスピードアップするために約8.5にpHを上げるために100mMのバッファを使用してください。
- 100 mMのsの水和物、オルトピリジルジスルフィド-PEG-NHS(OPSS-PEG-NHS)1mg / ml以上の濃度で1mlの容量に憎悪炭酸。
注:OPSS-PEG-NHSは、新たに作製し、約20分以内に使用すべきです。 OPSS-PEG-NHSのNHS基は、pH 8.5の水溶液中で、約20分の半減期を有します。 - 1の比(PEG:抗体)2で抗体溶液にOPSS-PEG-NHSを加える結合比は、試験サンプルのために使用されます。制御のために使用される1結合比:別個のマイクロ遠心管中で、2の抗原溶液にOPSS-PEG-NHSを加えます。
注2:1の比率は、50%の結合効率を仮定しています。目的は、1 PEG鎖で各抗体を標識することです。この工程では、過剰の標識の下の標識よりも良好です。 OPSS-PEG-NHSおよび抗体溶液の適切な量を決定するために、次の式を使用します。
Vは体積であり、Cは濃度の分子内で発現されますか1mlあたりtibodies。添字PEGおよびAbがそれぞれ、OPSS-PEG-NHSおよび抗体です。最終容量は約250μlのでなければなりません。 - 8時間または一晩4℃でPEG-Abのソリューションをインキュベートします。凍結融解サイクルを制限し、低結合管を使用することを確認するために-20℃で約25マイクロリットルのアリコートを作業に保管ソリューション。
2.準備紫外可視/ラマンプローブ
- 裸AuNP溶液を調製します
- ミリリットル当たり約1×10 11粒子の濃度でAuNPsの2ミリリットル溶液を調製します。
- AuNPsが集中する必要がある場合は、20分間または上清が透明になるまで5,000×gで2000株AuNPμlの遠心分離機で低結合遠心分離管を埋めます。 AuNPペレットを乱さないように注意しながら、ピペットで上清を取り除きます。
- 1チューブに残ったAuNPソリューションを組み合わせるとconcentraを推定UV-Visの測定値を取得し、これが線形関係であるとして知られている濃度に値を比較することによりる。
- ミリリットル当たり約1×10 11粒子の濃度でAuNPsの2ミリリットル溶液を調製します。
- 適切なラマンレポーター標識比を決定
- メタノールに溶解したラマンレポーターのワーキング溶液を調製します。この濃度は、使用されるレポーターに依存することになります。本研究では、200μMの作業溶液に3,3'- diethylthiatricarbocyanineヨウ化物(DTTC)を準備します。
- 各ウェル100μlの最終容量を仮定すると、ラマンレポーターは、0.2μM〜10μMの濃度の範囲でするような96ウェルプレートの最初の行の各ウェルに作業レポーターソリューションを十分に追加します。ボリュームが80μLであることを各ウェルなどに十分なHPLC等級の水を追加します。各ウェルごとに、100μlの最終容量をよく作ることにAuNPの20μLを加えます。例を表1に提供されます。
- UV-Visスペクトル400からのを測定しますプレート読み取り紫外可視分光光度計を用いて700nmで。適切な濃度は、UV-Visスペクトルのための明確なピークと最も高い濃度です。 AuNPsにラマンレポーターの最高濃度比まで濃度を増加で手順を繰り返し2.2.2が発見されました。
注:染料及びAuNPの形状、サイズ、および製造者は、適切な濃度に影響を与えます。したがって、記載された手順が使用されているコンポーネントに応じて評価し、変更しなければなりません。このプロトコルは、正に荷電した色素の使用を含みます。このように、AuNPとレポーターとの間の結合は、負に帯電しAuNPsを使用することによって改善されました。これは、クエン酸塩キャッピングさAuNPsを用いて行きました。詳細については、議論のセクションを参照してください。
- AuNPにラマンレポーターおよびPEG-ABを結合
- ラマンレポーターは、室温で30分間AuNPsに結合することを可能にする、以前に決定された濃度でAuNPとラマンレポーターの2 1.5ミリリットルのバッチを準備します。
- 粒子への抗体の1の比率:200を作成するためのAuNPとラマンレポーターソリューションの1バッチにPEG化された抗体(PEG-AB)を追加します。この溶液は、試験サンプルについてです。対照として使用する粒子への抗体の1:1の比の別々のマイクロ遠心チューブでは、200でAuNPとラマンレポーターソリューションの他のバッチにPEG化抗原を追加します。室温で30分間溶液をインキュベートします。
注:粒子に対する抗体の比率はAuNPsに固有となり、使用する色素や個々のケースのために最適化されるべきです。ここでの目的は、粒子の凝集を防止しつつに結合するAuNPプローブに対する抗体の最も高い割合を有することです。一緒に追加するには、適切な量を決定するために、次の式を使用します。
Vは体積であり、Cは濃度1mlあたり粒子または抗体で発現されます。フィンアルの容量は約1.5ミリリットルでなければなりません。
- mPEG-SHとAuNP表面上の残りのサイトをブロックします。
- 水を使用して、200μMの濃度に固体メトキシポリエチレングリコールチオールを溶解させることによってのmPEG-SHを準備します。 mPEG-SHが完全に溶解するまで溶液をボルテックス。
- ステップ2.3で行われたAuNP-PEG-Abの溶液に1比:40,000でのmPEG-SHを追加します。金ナノ粒子上の残りのサイトがブロックされていることを確認するために10分間、室温で溶液をインキュベートします。一緒に追加するには、適切な量を決定するために、次の式を使用します。
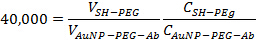
Vは体積であり、Cは濃度1mlあたり粒子または抗体で発現されます。最終容量は約1.5ミリリットルでなければなりません。
- 官能基化ラマンプローブを回復します。
- 低バインドCで20分間、5000×gで遠心分離した粒子entrifugeチューブ又は上清が透明になるまで。 AuNPsを乱さないように注意しながらピペットで上清を取り除きます。
- 以前に行われた1×PBS溶液1mlで粒子を再懸濁。少量の溶液(3μL)のUV-Visの測定を行うことにより、AuNP濃度を推定し、既知のAuNP濃度からの測定値に結果を比較します。最終溶液は、1mlあたり少なくとも1×10 11粒子であるように、音量を調整します。
- 4℃で保存ソリューションは、それが免疫アッセイプレートの官能化のために使用されるまで。 1週間以内のソリューションを使用してください。
| 各コンポーネントの追加するボリューム(ミリリットル) | |||
| DTTC最終濃度(mM)の | DTTC作業溶液(200 mM)の | AuNP | 水 |
| 0.2 | 0.1 | 20 | 79.9 |
| 0.6 | 0.3 | 20 | 79.7 |
| 1 | 0.5 | 20 | 79.5 |
| 2 | 1.0 | 20 | 79 |
| 5 | 2.5 | 20 | 77.5 |
| 7 | 3.5 | 20 | 76.5 |
| 10 | 5.0 | 20 | 75 |
表1 DTTC希釈例。DTTCの様々な希釈液と株式DTTC、金ナノ粒子溶液、および水の関連するボリューム。
3.免疫アッセイプレートの準備
- イムノアッセイプレートに所望の抗原に結合します。
- ポリスチレン井戸を満たすのに十分な希釈抗原(50μg/ ml)を準備します。 、解決策をVORTEXそして、すぐにプレートウェルにソリューションを追加します。抗原は、室温で1時間、プレートに結合することを可能にします。
- 結合していない抗原を洗い流します。
- 廃棄容器にソリューションをダンプし、紙タオルで覆われた卓上に対してプレートを押すことで、過剰な抗原溶液を除去します。
- 前述と同様に洗浄した後、表面を洗浄除去するために、ウェルにTBSTを追加します。このステップをさらに2回繰り返します。
- ブロックは、非特異的結合を防ぐために、プレート上の結合部位を残り。
- プレートの各ウェルにHSAブロッキング溶液70μLを加え、室温で30分間インキュベートします。
- 削除し、ステップ3.2で指定されたものと同じ手順を用いてプレートをすすぎます。さらに使用するまで4℃でプレートや店舗の乾燥をカバー。
- 免疫アッセイプレートを官能。
- トンの70μLを追加彼は、96ウェルプレートの最初の列に2節で作製したナノ粒子をプローブと1使用して、後続のカラムを希釈:2連続希釈を。プレートは、少なくとも1時間インキュベートすることができます。免疫アッセイプレートを準備する方法の例を図3に示されています。
- 適切AuNPsを処分することを確認して、ステップ3.2で説明するようにTBSTで5回プレートを洗浄します。最終洗浄の後、各ウェルに1×PBSの70μlを添加し、プレートシールでカバーしています。
注:コントロールサンプルは、明確にする必要があります。非特異的結合が発生した場合、対照試料は試験試料と同様の色を有することになります。
- 紫外可視およびラマン分光法による試験アッセイ感度。
- 各ウェルについて、UV-Visスペクトルプレート読み取り紫外可視分光光度計を用いて400〜700nmの範囲で測定。
- 倒立ラマン顕微鏡を用いて、AuNPプローブを有するウェルの表面上に目的の焦点を合わせます。オビ井戸のラマンスペクトルをTainの。 1800センチメートルから-1 400センチメートルまでの範囲のスペクトルを収集-1。すべてのウェルに、この手順を繰り返します。
- 適切なスペクトルソフトウェアを使用して、UV-Visスペクトルのためのラマンスペクトルのための第 11次多項式ベースライン補正、3次多項式を行います。
- 適切なスペクトルのソフトウェアを使用して、ラマン及びUV-Visスペクトルを正規化します。 1に最大値を設定し、それに応じて他のすべての値をスケール。ラマンスペクトルを標準化するために、ユニークなポリスチレンピークを選択し、等しく1に設定し、それに応じて他のすべての値をスケール。
- 適切なスペクトルソフトウェアを使用して、各スペクトルのピーク積分を実行。ラマンスペクトルについて、ラマンレポーターを示すピークは、ポリスチレンピークの領域不在でなければなりません。ピーク積分を実行するには、所望のピークの積分の境界を指定し、コントロールを含むすべてのサンプルについて所望のピーク面積を記録します。
- PLそれに関連する標準偏差を示す各点についてエラーバー付きAuNP濃度の対数の関数としての関心の平均ピーク面積をotの。 4パラメータロジスティック曲線にこれらのキャリブレーションポイントを取り付けます。
- ブランク試料のための目的のピークの面積を平均化することにより、ブランクの平均値を決定します。これらの領域の標準偏差を決定します。これは、ブランクの標準偏差です。
- 前のステップで分析同じピークについては、最低濃度のためにそのピーク面積の標準偏差を見つけます。
- 代表的な結果セクションに指定された検出のブランクと下限の限界を計算します。 AuNP濃度の点でLLODを決定するために、4PLの検量線で、これらの値を使用してください。
結果
この研究では、60nmの金粒子は、紫外可視分光法のために使用しました。 UV-Visのオープンソースのスペクトル分析ソフトウェア8を用いて決定した各AuNP濃度400 700に収集されたnmおよびピーク面積から吸収スペクトル。統合をピークに先立ち、収集されたスペクトルは、3点多項式フィットを使用して、ベースライン補正を行いました。ピーク面積は、 図4に示されているよ?...
ディスカッション
詳細なプロトコルでは、対処するためのいくつかの重要なポイントがあります。 1つの問題は、ラマンレポーターと金ナノ粒子の選択です。プロトコルは、個々の使用に適合するように書かれたが、ラマンレポーターDTTCを例として使用しました。 DTTCは、正に帯電したレポーターであり、負のクエン酸キャップ化AuNPsなどの表面に帯電するために特異的に結合します。このプロトコルは、正の...
開示事項
The authors declare that they have no competing financial interests.
謝辞
This work was supported by a Research Catalyst Award from Utah State University. The authors would like to thank Annelise Dykes, Cameron Zabriskie, and Donald Wooley for their contributions.
資料
| Name | Company | Catalog Number | Comments |
| 60 nm Gold Nanoparticle | Ted Pella, Inc. | 15708-6 | These are citrate capped gold nanoparticles. Please see Discussion for relationship between Raman reporter and AuNP surface charge and its imporance to proper selection of AuNP and/or Raman reporter. |
| Sodium Bicarbonate | Fisher Scientific | S233-500 | |
| Methanol | Pharmco-Aaper | 339000000 | |
| Tris Buffered Saline (10x) pH 7.5 | Scy Tek | TBD999 | |
| Bottle Top Filtration Unit | VWR | 97066-202 | |
| Tween 20 (polysorbate 20) | Scy Tek | TWN500 | Used as an emulsifying agent for washing steps. |
| Phosphate Buffered Saline 10x Concentrate, pH 7.4 | Scy Tek | PBD999 | |
| Protein LoBind Tube 2.0 ml | Eppendorf Tubes | 22431102 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Protein LoBind Tube 0.5 ml | Eppendorf Tubes | 22431064 | LoBind tubes prevent binding of proteins and AuNPs to surfaces of the tubes. |
| Microplate Devices UniSeal | GE Healthcare | 7704-0001 | Used for sealing and storing functionalized plates. |
| Assay Plate, With Low Evaporation Lid, 96 Well Flat Bottom | Costar | 3370 | |
| HPLC grade water | Sigma Aldrich | 270733-4L | |
| 3,3′-Diethylthiatricarbocyanine iodide (DTTC) | Sigma Aldrich | 381306-250MG | Raman reporter |
| mPEG-Thiol, MW 5,000 - 1 gram | Laysan Bio, Inc. | MPEG-SH-5000-1g | |
| OPSS-PEG-SVA, MW 5,000 - 1 gram | Laysan Bio, Inc. | OPSS-PEG-SVA-5000-1g | OPSS-PEG-SVA has an NHS end. |
| Mouse IgG, Whole Molecule Control | Thermo Fisher Scientific | 31903 | Antigen |
| Goat anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody | Thermo Fisher Scientific | 31164 | Antibody |
| Human Serum Albumin Blocking Solution | Sigma Aldrich | A1887-1G | Bovine serum albumin can be used instead. |
| Mini Centrifuge | Fisher Schientific | 12-006-900 | |
| UV-Vis Spectrophotometer | Thermo Scientific | Nanodrop 2000c | |
| UV-Vis Spectrophotometer | BioTek | Synergy 2 | |
| Desalting Columns | Thermor Scientific | 87766 | |
| In-house built 785 nm inverted Raman microscope unit | N/A | N/A | An inverted Raman microscope is best for proper focusing onto surface of the well plate. Otherwise a very low magnification will be used due to height of the 96-well plate. An in-house built system was used as it was cheaper than buying from a vendor. However, any commercially available inverted Raman microscope system can be used. |
参考文献
- Israelsen, N. D., Hanson, C., Vargis, E. Nanoparticle properties and synthesis effects on surface-enhanced Raman scattering enhancement factor: an introduction. Sci. World J. , e124582 (2015).
- Wang, Y., Schlücker, S. Rational design and synthesis of SERS labels. Analyst. 138 (8), 2224-2238 (2013).
- Wang, Y., Yan, B., Chen, L. SERS tags: novel optical nanoprobes for bioanalysis. Chem. Rev. 113 (3), 1391-1428 (2013).
- . . The Immunoassay Handbook: Theory and applications of ligand binding, ELISA and related techniques. , (2013).
- Cox, K. L., Devanarayan, V., Kriauciunas, A., Manetta, J., Montrose, C., Sittampalam, S. Immunoassay Methods. Assay Guid. Man. , (2004).
- . . ELISA development guide. , (2016).
- Israelsen, N. D., Wooley, D., Hanson, C., Vargis, E. Rational design of Raman-labeled nanoparticles for a dual-modality, light scattering immunoassay on a polystyrene substrate. J. Biol. Eng. 10, (2016).
- Menges, F. . Spekwin32 - optical spectroscopy software. Version 1.72.1. , (2016).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Yu, X. Quantifying the Antibody Binding on Protein Microarrays using Microarray Nonlinear Calibration. BioTechniques. 54, 257-264 (2013).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin. Biochem. Rev. 29 (Suppl 1), S49-S52 (2008).
- . . EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures; Approved Guideline. 32. No 8, (2012).
- Leigh, S. Y., Som, M., Liu, J. T. C. Method for assessing the reliability of molecular diagnostics based on multiplexed SERS-coded nanoparticles. Plos One. 8 (4), e62084 (2013).
- Sinha, L. Quantification of the binding potential of cell-surface receptors in fresh excised specimens via dual-probe modeling of SERS nanoparticles. Sci. Rep. 5, 8582 (2015).
- Shi, W., Paproski, R. J., Moore, R., Zemp, R. Detection of circulating tumor cells using targeted surface-enhanced Raman scattering nanoparticles and magnetic enrichment. J. Biomed. Opt. 19, 056014 (2014).
- Xia, X., Li, W., Zhang, Y., Xia, Y. Silica-coated dimers of silver nanospheres as surface-enhanced Raman scattering tags for imaging cancer cells. Interface Focus. 3 (3), 20120092 (2013).
- McLintock, A., Cunha-Matos, C. A., Zagnoni, M., Millington, O. R., Wark, A. W. Universal surface-enhanced Raman tags: individual nanorods for measurements from the visible to the infrared (514-1064 nm). Acs Nano. 8 (8), 8600-8609 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved