Method Article
أفقي جبل كامل: A معالجة الرواية والتصوير بروتوكول للثدي، ثلاثة-- الأبعاد الأنسجة عبر-- أقسام الجلد
In This Article
Summary
يقدم هذا العمل معالجة جديدة وبروتوكول التصوير لسميكة، ثلاثي الأبعاد الأنسجة المقطع العرضي التحليل الذي يتيح الاستغلال الكامل للطرائق التصوير متحد البؤر. هذا البروتوكول يحافظ على المستضد ويمثل نظاما قويا لتحليل الأنسجة الجلد وأنواع الأنسجة الأخرى يحتمل أن تكون.
Abstract
يمكن أن يكون تجهيز الأنسجة ذات الاهتمام لتوليد صورة المجهرية التي تدعم حجة علمية تحديا. الحصول على الصور المجهرية عالية الجودة لا تعتمد اعتمادا كليا على نوعية المجهر، ولكن أيضا على أساليب معالجة الأنسجة، والتي غالبا ما تنطوي على إجراءات حاسمة متعددة أو خطوات. وعلاوة على ذلك، أنواع الخلايا الوسيطة في الجلد والأنسجة الأخرى تمثل تحديا جديدا لإعداد الأنسجة والتصوير. هنا، نقدم عملية كاملة، من حصاد الأنسجة إلى المجهري. تقنية لدينا، ودعا "جبل كامل الأفقي،" هو أن المبتدئين يمكن أن تصبح بسرعة يتقن في والتي تسمح للحفاظ على مستضد والكشف في 60-300 ميكرون سميكة أقسام قطع مع ناظم البرد. أقسام من هذا سمك توفر تصور معزز من الأنسجة المعمارية المصغرة في بيئة ثلاثية الأبعاد. وبالإضافة إلى ذلك، بروتوكول يحفظ خلايا الوسيطة بطريقة تعزز جودة الصورة عندمامقارنة مع ناظم البرد القياسية أو أقسام البارافين، وبالتالي زيادة فعالية وموثوقية المناعية. ونحن نعتقد أن هذا البروتوكول سوف تستفيد جميع المختبرات التي تصور الجلد، وربما الأنسجة والأعضاء الأخرى.
Introduction
توفر ثورة معدات التصوير المجهري أدوات تصوير متطورة وعالية الدقة. ومع ذلك، عند الحصول على صورة مجهرية من المقطع العرضي الأنسجة ثلاثية الأبعاد كاملة (3D)، وإعداد العينات تحديات كبيرة ويمكن أن يكون العامل المحدد في تحديد جودة الصورة. كل خطوة منفصلة تستحق دراسة متأنية من أجل الحفاظ على مورفولوجيا الأنسجة واستضداد البروتينات المستهدفة، للحد من التحف التي يسببها التصنيع، وتحقيق أقصى قدر من جودة الصورة النهائية. على سبيل المثال، والتحليل التقليدي للجلد يتطلب صورة مع نظرة للبشرة والأدمة، مع بصيلات الشعر التي توجه بشكل صحيح، مما يسمح للتحليل التشريحي للمساهمة مقصورة الخلايا الجذعية في توازن الجلد 1 ، 2 . وهذا يتطلب تركيزا دقيقا على كيفية تضمين الجلد وقسمه. الأهم من ذلك، بصيلات الشعر يمكن أن يكون أكثر سمكامن 100 ميكرون، الذي يفوق كثيرا البارافين القياسية أو سمك القسم المجمدة، مما أدى إلى انخفاض مستوى التحليل مقارنة يتصاعد كله أو سميكة المقاطع العرضية 3 ، 4 ، 5 .
مجتمعة، كل خطوة من إعداد العينات للتحليل المجهري هو محدد حاسم من شأنها أن تؤثر على تحليل الصور. هنا، يتم تقديم بروتوكول معالجة الرواية لسميكة، 3D الأنسجة المقطع العرضي التحليل، الذي نسميه "جبل كامل الأفقي،". بروتوكول يحافظ للغاية مستضد وتمكن من الاستغلال الكامل للأقسام سميكة من الجلد باستخدام معدات التصوير مبائر القياسية. هذا هو دليل كامل لاستخدام الجلد للأنسجة سميكة تجهيز المقطع العرضي والتصوير، بما في ذلك حصاد الأنسجة و بارافورمالدهيد (بفا) - الحفاظ على الحفظ بالتبريد (الخطوة 1)، وتوليد 100 ميكرون سميكة الأنسجة المقاطع العرضية مع ناظم البرد 2)، و إمونوفلورزنت وسم تصاعد (الخطوات 3 و 4). النتائج ممثل مقارنة الصور متحد البؤر من اثنين متميزة تقنيات إعداد النسيجي - كريوسكتيونينغ الكلاسيكية وسميكة، 3D الأنسجة عبر المقسمة تسليط الضوء على مزايا "يتصاعد كله الأفقي" للمستخدم المحتمل لهذا البروتوكول.
Protocol
وكانت جميع التجارب على الحيوانات تخضع لموافقة أخلاقية المحلية وأداء بموجب شروط ترخيص وزارة الداخلية حكومة المملكة المتحدة.
1. حصاد الجلد و الحفظ بالتبريد
- الاستعدادات.
- إعداد واحد 100 ملم طبق الثقافة مع 25 مل من بفا 4٪ واثنين من أطباق الثقافة 100 ملم مع 25 مل من 1X الفوسفات مخزنة المالحة (بس).
- ملء قشر مستطيلة كريومولدز بعيدا بنسبة الثلثين مع الأمثل مجمع درجة حرارة القطع (أكتوبر).
- وضع لوحة معدنية، والتي يمكن وضعها في كريوبلوكس في خطوة لاحقة، في الفريزر -80 درجة مئوية.
- حصاد الجلد، التثبيت، الحفظ بالتبريد.
- كليب المنطقة الظهرية من جثة الحيوان مع ماكينة حلاقة كهربائية الجافة.
ملاحظة: في هذا المثال، استخدمت ما بعد الولادة يوم 21 ويلديب الفئران. - حصاد مجالات الاهتمام على الجلد.
ملاحظة: المنطقة الظهرية من الجلد الماوس ( الشكل 1 أ) يحتوي على أعلى نسبة من بصيلات الشعر التي متباعدة بشكل متساو ومحاذاة، والذي يسمح للتوجيه الأمثل ل سيكتيونينغ. إزالة الأنسجة غير الجلدية الكامنة ليست ضرورية ولكن يمكن أن يؤديها إذا لزم الأمر. - تقليم الجلد المقطوع إلى قطع مستطيلة من الحجم المناسب لتناسب في الجزء السفلي من كريومولد، مع الأخذ في اتجاهي نمو الحبوب بصيلات الشعر في الاعتبار.
ملاحظة: شرائح الجلد أصغر قد يكون من الأسهل للتعامل مع المبتدئين، لأنها أقل عرضة للتشابك أثناء الحضانة وعملية التركيب. المثال الموضح هنا هو ~ 1 سم 2 منطقة الجلد الظهري، الذي يناسب في 22 × 30 × 20 مم كريومولد ( الشكل 2A ). - إصلاح الجلد في درجة حرارة الغرفة في 25 مل من بفا 4٪ لمدة 10-30 دقيقة، وهذا يتوقف على سمك عينات الجلد ( الشكل 1B ).
- غسل عينات الجلد مرتين في 25 مل من برنامج تلفزيونيلمدة 5 دقائق على الأقل كل ( الشكل 1B ).
- داب عينات الجلد على منشفة ورقية لاستنزاف بعناية الأنسجة من برنامج تلفزيوني الزائدة، والتي يمكن أن تؤدي إلى تبلور أثناء عملية التجميد ويمكن أن تؤثر على نتائج كريوسكتيونينغ.
ملاحظة: لا يتطلب التدرج السكروز القياسية. ومع ذلك، قد يتم أيضا إدراج هذا في البروتوكول وفقا لتقدير المستخدم. - يكون على بينة من اتجاه بصيلات الشعر لكل عينة الجلد. استخدام المجهر تشريح للمساعدة البصرية (وخاصة أي شخص أداء البروتوكول لأول مرة). إدراج عينة الجلد في كريومولد أوكت مليئة وتوازن جميع مناطق الجلد مع أكتوبر عن طريق إزالة أي فقاعات الهواء تعلق على سطح الشعر قص باستخدام ملقط ( أرقام 2A و 2 B ).
- دفع الجلد إلى الجزء السفلي من أكتوبر شغل كتلة بحيث تقع دافق مع القاع.
ملاحظة: الجلد يمكن أن تكون موجهة في أي اتجاه، أs كما لوحظت الحبوب من بصيلات الشعر لإجراءات القطع المناسبة. سيتم إعادة توجيه كريومولدز عندما يتم إرفاق الكتل إلى ناظم البرد ل كريوسكتيونينغ. بمناسبة التوجه بصيلات الشعر على كريومولد، منذ هذه الخطوة يحدد التوجه اللاحق من قطع ناظم البرد. - نقل الأرانب المجردة على لوحة معدنية في الفريزر -80 درجة مئوية لتجنب العائمة والتفكك في الأنسجة.
- مراقبة عملية التجميد للحفاظ على اتجاه الجلد في الجزء السفلي من كريومولد، منذ فقاعات الهواء الغيب يمكن أن يسبب الجلد في الارتفاع إلى سطح كريومولد.
ملاحظة: كريومولدز مع الأنسجة المجمدة يمكن تخزينها لأكثر من سنة في -80 درجة مئوية، ويمكن إعادة استخدامها لأقسام إضافية.
- كليب المنطقة الظهرية من جثة الحيوان مع ماكينة حلاقة كهربائية الجافة.
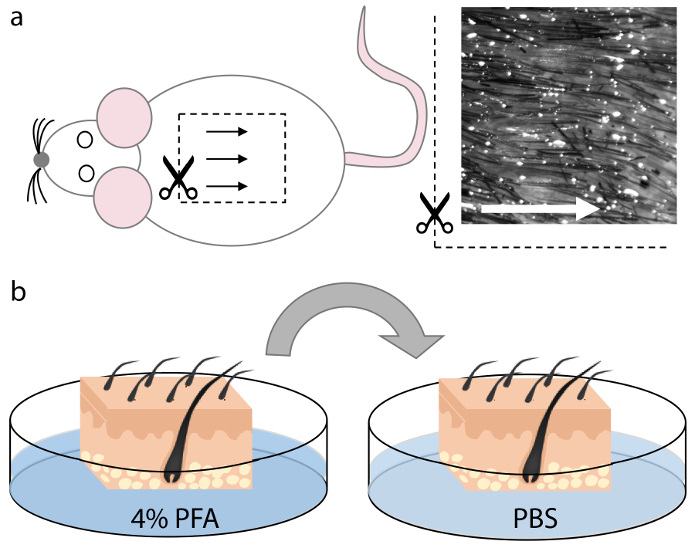
الشكل 1. حصاد وتثبيت الجلد الماوس.
( أ ) تم تحصين أنسجة الجلد من المنطقة الظهرانية من جثة الحيوان. بصيلات الشعر في هذه المنطقة متباعدة بشكل متساو ومحاذاة، وبالتالي تسمح للتوجيه الأمثل أثناء التقسيم، كما هو مبين من قبل الأسهم. ( ب ) بعد قطع المربعات من الحجم المناسب الذي يناسب في كريومولد، تم إصلاح أنسجة الجلد في بفا 4٪ لمدة 15 دقيقة وغسلها مرتين في برنامج تلفزيوني لمدة 5 دقائق لكل منهما. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
2. سميكة الأنسجة عبر-- سيكتيونينغ
- إعداد والتوجه الأنسجة لتركيب على ناظم البرد.
- إعداد طبق الثقافة 100 ملم مع 15 مل من برنامج تلفزيوني. وضعه على منطقة يمكن الوصول إليها بسهولة على ناظم البرد. وبالإضافة إلى ذلك، وإعداد لوحة 12 جيدا مع 2.5 مل من برنامج تلفزيوني لكل بئر. التسمية وفقا لعينات لتخزين طويلة الأجل من سيكتيونس عند 4 درجات مئوية. استخدام ملقط للتعامل مع الأقسام.
- ضبط درجة الحرارة من ناظم البرد إلى -20 درجة مئوية.
ملاحظة: درجة الحرارة يمكن أن تؤثر على تقسيمها، ولكن دليل جيد هو أن تبدأ في -20 درجة مئوية. - للحصول على أقسام ما يقرب من اثنين من بصيلات الشعر سميكة، وضبط ناظم البرد لقطع المقاطع 150 ميكرون سميكة.
ملاحظة: سمك القسم يمكن أن تختلف، اعتمادا على احتياجات المستخدم والقيود المفروضة على المجهر التي سيتم استخدامها للتحليل.
ملاحظة: اتجاه العينة أمر بالغ الأهمية للحصول على أقسام الجلد مع بصيلات الشعر في التوجه المناسب. ويتحقق ذلك عن طريق تركيب بشكل صحيح على كتلة البرد. تأكد من أن الطائرة القسم موازية لتوجيه بصيلات الشعر ( الشكل 2C ). كما ذكر سابقا، فإن التوجه الصحيح للطائرة القسم في عينة الجلد هو خطوة حاسمة لتحديد نوعية الصور التي سيتم الحصول عليها فيخطوة لاحقة.

الشكل 2. التضمين، الحفظ بالتبريد، والتجزئة.
( أ ) وضع علامة بصيلات الشعر (هف) الاتجاه على كريومولد، المشار إليها من قبل الأسهم السوداء، مهم للتوجه السليم أثناء كريوسكتيونينغ. ( ب ) يجب أن تتماشى مستوي القسم مع اتجاه بصيلات الشعر لتوليد المقاطع التي يبقى طول كامل بصيلات الشعر سليمة. ( ج ) قطعت المقاطع في اتجاه بصيلات الشعر التي أشارت إليها الأسهم السوداء على cryomold. ( د ) تم جمع المقاطع العرضية الأنسجة سميكة مع ملقط المعادن و ( ه ) نقلها إلى طبق الثقافة 100 ملم تحتوي على برنامج تلفزيوني 1X. ( و ) في درجة حرارة الغرفة، و بس يذوب بعيدا أوك.T. المركب الذي يحيط المقاطع العرضية الأنسجة سميكة، كما هو مبين من الأسهم البيضاء. ثم تطفو الأقسام بحرية في برنامج تلفزيوني. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- Cryosectioning.
- قطع قسم باستخدام ناظم البرد. استخدام ملقط لجمع أكتوبر الذي يحتوي على جزء جزءا لا يتجزأ من الجلد ( الشكل 2D ).
ملاحظة: استخدام ناظم البرد الذي يتيح حركة مستقلة والتكيف على طول X، Y، Z محاور لتحديد المواقع العينة الأمثل. وهذا يسمح لجيل من الأنسجة الانحياز عبر المقاطع المثالية. - نقل القسم من ناظم البرد في طبق الثقافة 100 ملم مليئة بس والاستمرار مع شريحة المقبل. لا جمع العينات على شريحة ( الشكل 2E ).
ملاحظة: في درجة حرارة الغرفة، فإن برنامج تلفزيوني تذوب بعيداأكتوبر، وترك شرائح الجلد التي هي سهلة للتعامل مع ملقط ( الشكل 2F ).
ملاحظة: قد تكون هناك حاجة برنامج تلفزيوني جديدة في طبق الثقافة 100 ملم بعد حل العديد من أقسام الأنسجة 100 ميكرون سميكة ويمكن تغييرها وفقا لذلك. - استخدام ملقط لنقل أقسام الجلد العائمة إلى جيدا المسمى جيدا في لوحة جيدا 12 مليئة 2.5 مل من برنامج تلفزيوني ( الشكل 3A ، يسار).
ملاحظة: عند 4 درجات مئوية، يمكن تخزين العينات لمدة يومين على الأقل. للتخزين على المدى الطويل من كتل أوكت التي تحتوي على الجلد بعد باجتزاء، وختم سطح القطع مع قطرة من أكتوبر الجديد بعد تجميد قطرة أكتوبر، والتفاف كتلة أكتوبر المستخدمة في بارافيلم ووضعه مرة أخرى في الفريزر -80 درجة مئوية .
- قطع قسم باستخدام ناظم البرد. استخدام ملقط لجمع أكتوبر الذي يحتوي على جزء جزءا لا يتجزأ من الجلد ( الشكل 2D ).
3. إمونوفلورزنت العلامات.
- إعداد المخزن المؤقت ي (بس تكملها 0.5٪ مسحوق الحليب الخالي من الدسم، 0.25٪ الأسماك الجيلاتين الجلد، و 0.5٪ تريتون X-100) في ليسt 2 h مقدما، كما هو موضح سابقا 5 .
ملاحظة: أزيد الصوديوم يمكن أن تضاف إلى ي العازلة للحفاظ على الأجسام المضادة للاستخدام المتكرر من العازلة تلطيخ. - تسمية 1.5 مل أنابيب ميكروسنتريفوج وإضافة 500 ميكرولتر من العازلة ي لكل أنبوب. استخدام ملقط بعناية لنقل شرائح الجلد من برنامج تلفزيوني في أنابيب منفصلة تحتوي على العازلة ي للحجب ( الشكل 3A ، يمين). تأكد من أن جميع شرائح الجلد مغمورة تماما. وضع أنابيب ميكروسنتريفوج على الروك رأي رأى في سرعات لا يزيد عن 10 التذبذبات في الدقيقة الواحدة، والتي لا ينبغي أن تعطل سلامة الأنسجة، لمدة 1 ساعة في درجة حرارة الغرفة.
ملاحظة: من الأهمية بمكان أن سرعة لا تتجاوز 10 التذبذبات في الدقيقة على الروك رأى المنشار، لأنها سوف تحفز صراعا.- في حين أنه من الممكن إضافة أكثر من شريحة واحدة في أنبوب ميكروسنتريفوج، لحفظ الأجسام المضادة، فقط وضع شريحة واحدة لكل أنبوب. لتقليل استخدام الأجسام المضادة، استخدم وحدة تخزينمن 250 ميكرولتر.
ملاحظة: إذا لزم الأمر، استبدال أنابيب ميكروسنتريفوج مع، على سبيل المثال، لوحات 96 جيدا. ومع ذلك، فإن وضع المقاطع العرضية الأنسجة سميكة إلى 1.5 مل أنابيب ميكروسنتريفوج يسمح للاختراق الأجسام المضادة الأكثر فعالية في الأنسجة بسبب تعزيز اضطراب السائل.
- في حين أنه من الممكن إضافة أكثر من شريحة واحدة في أنبوب ميكروسنتريفوج، لحفظ الأجسام المضادة، فقط وضع شريحة واحدة لكل أنبوب. لتقليل استخدام الأجسام المضادة، استخدم وحدة تخزينمن 250 ميكرولتر.
- تسمية منفصلة 1.5 مل أنابيب ميكروسنتريفوج لكل شريحة الجلد وإضافة 500 ميكرولتر من العازلة ي وكمية مناسبة من الأجسام المضادة الأولية. بعد 1 ساعة من عرقلة، ونقل شرائح الجلد في الأنابيب الطازجة التي تحتوي على الأجسام المضادة. احتضان شرائح في 4 درجات مئوية بين عشية وضحاها.
ملاحظة: في هذا المثال، تم استخدام الأجسام المضادة الأولية التالية: فيتس الجرذ CD49f المضادة لل الإنسان عند تركيز 1:50 والماعز المضادة للفأر / الفئران إنتغرين ألفا 8 بتركيز 1: 100. - في اليوم التالي، وإعداد اثنين منفصلة 1.5 مل أنابيب ميكروسنتريفوج تحتوي على 500 ميكرولتر من برنامج تلفزيوني في العينة. غسل شرائح الجلد مرتين لمدة 1 ساعة في تمبراتور الغرفةه.
- إعداد منفصلة 1.5 مل أنابيب ميكروسنتريفوج تحتوي على 500 ميكرولتر من العازلة ي مع التركيز المناسب للأجسام المضادة الثانوية المطبقة و 4 '، 6-دياميدينو-2-فينيليندول (دابي).
ملاحظة: الأجسام المضادة الثانوية المستخدمة في هذا المثال هي اليكسا فلور 488 حمار المضادة للفئران مفتش واليكسا فلور 555 حمار مفتش الماعز بمتركيز 1: 500. تم استخدام دابي بتركيز 1: 100. - نقل بعناية عينات الجلد في المخزن المؤقت ي، والذي يحتوي على الأجسام المضادة الثانوية و دابي، واحتضان شرائح الجلد في درجة حرارة الغرفة لمدة 1 ساعة في سرعة منخفضة على المدورة أو شاكر.
- تخزين شرائح في 4 درجات مئوية في المخزن المؤقت ي تحتوي على الأجسام المضادة الثانوية و دابي لمدة تصل إلى أربعة أيام، وربما أطول إذا أزيد الصوديوم أزيد تضاف إلى برنامج تلفزيوني.
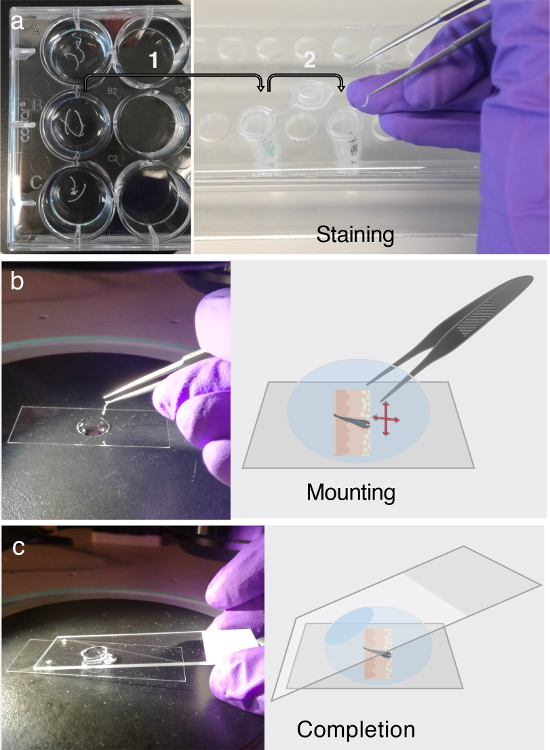
الشكل 3. إمونوفلورسكوضع العلامات و تصاعد.
( أ ) يمكن تخزين المقاطع العرضية للنسيج العائم في لوحات 12-جيدا لمدة يومين على الأقل عند 4 درجات مئوية. قبل إمونوفلورزنت (إف) وضع العلامات، ونقل الأنسجة المقاطع العرضية من الفائدة في أنابيب مل ميكروسنتريفوج 1.5 مل تحتوي على العازلة ي للحجب، كما هو مبين من قبل السهم 1. ل إف وضع العلامات، والتمسك الإجراء متعدد الخطوات المنصوص عليها في الخطوة 3. كل جزء من الخطوة 3 يتطلب نقل دقيق من المقاطع العرضية الأنسجة في أنابيب ميكروسنتريفوج الطازجة التي تحتوي على حل الأجسام المضادة الأولية، حل الأجسام المضادة الثانوية، أو غسل العازلة، والتي يشار إليها السهم 2. ( ب ) بعد وضع العلامات إف، يتم الكشف عن أقسام وتسطح في قطرة من الجلسرين، وذلك باستخدام مساعدة من المجهر تشريح. ( ج ) بمجرد المقطع العرضي الأنسجة بالارض تماما على الجزء السفلي من زلة الغطاء، ويستخدم شريحة المجهر العادية لتركيب القسم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التركيب للتصور المجهري
- قبل التصوير، ونقل شرائح الجلد لفصل أنابيب ميكروسنتريفوج تحتوي على 500 ميكرولتر من برنامج تلفزيوني لغسل الأجسام المضادة الثانوية و دابي.
- استخدام ماصة 1،000 ميكرولتر، ولكن قطع 0.5 سم الأولى من طرف ماصة لتمكين بيبتينغ السليم من الجلسرين اللزج للغاية. وضع ساترة 22 × 50 مم على خلفية مظلمة تحت المجهر تشريح ( الشكل 3B ).
- إضافة قطرة واحدة من 100٪ الجلسرين على زلة غطاء ( الشكل 3B ). نقل شريحة الجلد من أنبوب ميكروسنتريفوج على قطرة الجلسرين. استخدام المجهر تشريح والملقط وأشار إلى الاسترخاء بعناية شرائح الجلد التي هي كرة لولبية.
ملاحظة: كما يطفو شريحة في غليسيرول قطرة، فإنه يمكن أونتانغلد عن طريق اقناع الميل الطبيعي للنسيج للعودة إلى شكله الطبيعي. لا تجبر استقامة غير طبيعية من شريحة، لأن هذا يمكن أن يسبب تلف الأنسجة. - جبل الأنسجة مرة واحدة في كامل طول القسم الجلد موجهة بشكل صحيح ومسطحة على زلة الغطاء. استخدام شريحة المجهر العادية. هذه الخطوة سوف مزيد من تصويب شريحة الجلد.
ملاحظة: تجنب انحباس الهواء ( الشكل 3C ). - صورة في أقسام الجلد المثبتة على الجلسرين في غضون اليومين المقبلين.
ملاحظة: التخزين لفترات طويلة سوف تؤثر سلبا على الأنسجة وجودة التصوير. في هذا المثال، تم الحصول على جميع الصور مع المجهر متحد البؤر تستقيم باستخدام هدف 20X.
النتائج
للتأكيد على مزايا تقنية لدينا، قارنا لدينا سميكة، 3D الأنسجة عبر المقطع تقنية، "جبل كله الأفقي"، إلى أقسام المجمدة الكلاسيكية. تم قطع المقاطع الكلاسيكية المجمدة كما هو موضح سابقا 5 . لتوفير بنية بصرية للبشرة في الصور المجهرية تي، ونحن إمونوستيند ل إنتغرين ألفا -6 (Itga6)، وهو عنصر يرسى خلايا البشرة إلى الغشاء القاعدي الكامنة 6 . ونحن أيضا وصفت العضلات مقف البيلي (APM)، وهي المسؤولة عن انتصاب الشعر (المعروف أيضا باسم "صرخة الرعب")، مع إنتغرين ألفا 8 7. في المقاطع المجمدة الكلاسيكية، معظم بصيلات الشعر تصور مع Itga6 لم مقطوع على طول كامل، وتوليد بصيلات الشعر غير مكتملة في الغالب في القسم، بالمقارنة مع يتصاعد كله الأفقي ( الشكل 4A -4d ). المقاطع العرضية الأنسجة سميكة تجعل من الممكن الحصول على المزيد من طبقات Z مكدس مقارنة مع التقليدية 10 ميكرون المقاطع، مما يسمح للصورة 3D أكثر اكتمالا. هذا يصبح أكثر وضوحا عند دراسة سلامة أبمز، التي ترتبط مع بصيلات الشعر والغشاء السفلي المغطي. في كريوسكتيونس الكلاسيكية، كان جزء كبير من أبمس مجزأة ( الشكل 4A -4 د ). بالإضافة إلى ذلك، يتم الحفاظ على سلامة الأنسجة من حجرة تحت الجلد في يتصاعد كله الأفقي، بالمقارنة مع تدمير الخلايا الشحمية عندما تعلق كريوسكتيونس إلى الشرائح الزجاجية الدافئة، وهو قطعة أثرية تجميد ذوبان معروفة ( الشكل 4A -b ، مقارنة تحت الجلد المناطق) 8 .
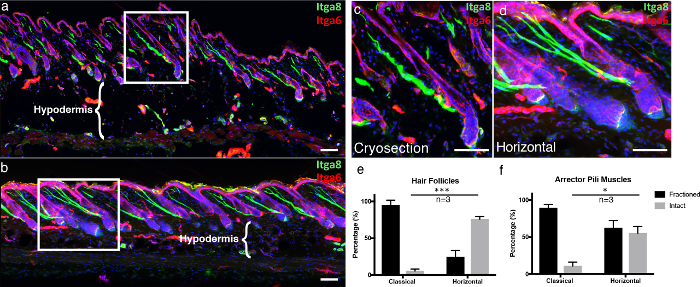
الشكل 4. موا أفقي كلهنت بالمقارنة مع كريوسكتيون الكلاسيكية.
( أ ) تم الحصول عليها بشكل كلاسيكي الجلد كريوسكتيونس 10 ميكرون سميكة و ( ب ) وصفت 100 ميكرون سميكة الأنسجة 3D المقاطع العرضية مع إنتغرين ألفا -6 (Itga6) و إنتغرين ألفا -8 (Itga8) لتصور مقصورة البشرة وعضلات المشيمة بيلي ، على التوالي. يتم تمثيل الصور من المقاطع العرضية الأنسجة سميكة كما الإسقاطات القصوى من كومة Z كبيرة. وتشير الأطر البيضاء إلى المناطق التي يتم تكبيرها، وعرضها في ( ج ) المقاطع الكلاسيكية و ( د ) الأفقي جبل كامل. ( ه ) تم تحديد بصيلات الشعر سليمة و ( و ) سليمة عضلات أركتور بيلي في كل من الكلاسيكية والأفقية كامل جبل أجزاء. وتشير الحانات مقياس 100 ميكرون. تم تمثيل البيانات كمتوسط ± خطأ قياسي للمتوسط (سيم). وقد تم تحديد جزء واحد لكل تكرار بيولوجي ( ن = 3). اختبار t بدون اختبار * P <0.05، *** P <0.0005. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
Disclosures
ويود المؤلفون أن يكشفوا أن نشر هذه المخطوطة تم تمويله من قبل شركة ثيرمو فيشر العلمية
Acknowledgements
يعترف المؤلفون الرعاية من الحرارية فيشر العلمية وشكرا مركز التصوير نيكون في كلية كينغز لندن للحصول على الدعم أثناء التقاط الصور متحد البؤر.
Materials
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
References
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved