Method Article
Горизонтальная целая гора: новый протокол обработки и обработки изображений для толстых, трехмерных поперечных сечений кожи
В этой статье
Резюме
Эта работа представляет собой новый протокол обработки и визуализации для толстого трехмерного анализа поперечного сечения ткани, который позволяет полностью использовать конфокальные методы визуализации. Этот протокол сохраняет антигенность и представляет собой надежную систему для анализа гистологии кожи и, возможно, других типов тканей.
Аннотация
Обработка ткани, представляющей интерес для создания микроскопического изображения, который поддерживает научный аргумент, может быть сложной задачей. Получение высококачественных микроскопических изображений не полностью зависит от качества микроскопа, но также от методов обработки тканей, которые часто включают в себя несколько критических действий или шагов. Кроме того, типы мезенхимальных клеток в коже и других тканях представляют собой новую проблему для подготовки и визуализации тканей. Здесь мы представляем полный процесс - от сбора ткани до микроскопии. Наша методика, называемая «горизонтальная целая гора», - это то, что новички могут быстро освоиться и что позволяет сохранять и обнаруживать антиген в срезах толщиной 60-300 мкм, разрезанных криостатом. Разделы этой толщины обеспечивают улучшенную визуализацию микроархитектуры ткани в трехмерной среде. Кроме того, протокол сохраняет мезенхимные клетки таким образом, который повышает качество изображения, когдаПо сравнению со стандартными секциями криостата или парафина, тем самым повышая эффективность и надежность иммуноокрашивания. Мы считаем, что этот протокол принесет пользу всем лабораториям, которые визуализируют кожу и, возможно, другие ткани и органы.
Введение
Революция микроскопического оборудования для визуализации обеспечивает сложные инструменты визуализации с высоким разрешением. Однако, приобретая микроскопическое изображение полного трехмерного (трехмерного) поперечного сечения ткани, подготовка образца представляет значительные проблемы и может быть ограничивающим фактором при определении качества изображения. Каждый отдельный шаг заслуживает тщательного рассмотрения, чтобы сохранить морфологию ткани и антигенность белков-мишеней, свести к минимуму вызванные обработкой артефакты и максимизировать конечное качество изображения. Например, традиционный анализ кожи требует изображения с учетом эпидермиса и дермы с правильно ориентированными волосяными фолликулами, позволяющими анатомический анализ вклада ячеек стволовых клеток в гомеостаз кожи 1 , 2 . Это требует тщательной концентрации на том, как кожа встроена и разделена. Важно отметить, что волосяные фолликулы могут быть толщеЧем 100 мкм, что значительно превышает стандартную толщину парафина или замороженного сечения, что приводит к более низкому стандарту анализа по сравнению со всеми креплениями или толстыми поперечными сечениями 3 , 4 , 5 .
Взятые вместе, каждый этап подготовки образца для микроскопического анализа является критическим фактором, который повлияет на анализ изображения. Здесь представлен новый протокол обработки для толстого анализа поперечного сечения трехмерной ткани, который мы называем «горизонтальным целым креплением». Протокол сильно сохраняет антигенность и позволяет полностью использовать толстые участки кожи, используя стандартное оборудование для конфокальной визуализации. Это полное руководство по использованию кожи для обработки и визуализации толстой ткани, включая сборку тканей и параформальдегида (PFA), криоконсервирование (этап 1), формирование поперечных сечений ткани толщиной 100 мкм с помощью криостата (стадия 2) И иммунофлуоресцентную маркировку и монтаж (этапы 3 и 4). Репрезентативные результаты сравнивают конфокальные изображения двух различных методов гистологической подготовки - классической криосекции и толстого поперечного сечения трехмерной ткани, что подчеркивает преимущества «горизонтальных целых монстров» для потенциального пользователя этого протокола.
протокол
Все эксперименты на животных были подвергнуты местному этическому одобрению и выполнялись в соответствии с лицензией Министерства внутренних дел Великобритании.
1. Уборка урожая и криоконсервация
- Препараты.
- Приготовьте одну 100-миллилитровую культуральную чашку с 25 мл 4% PFA и две 100-миллилитровые чашки для культивирования с 25 мл 1х забуференного фосфатом физиологического раствора (PBS).
- Заполните прямоугольные отслаивающиеся криомодели на две трети с оптимальным составом для резки (OCT).
- Поместите металлическую пластину, на которой криоблоки могут быть размещены на более поздней стадии, в морозильнике -80 ° C.
- Уборка кожи, фиксация и криоконсервация.
- Закрепите дорсальную область животного трупы сухой сухой электробритвой.
ПРИМЕЧАНИЕ. В этом примере использовали мышей дикого типа послеродового дня 21. - Урожай области интересов на коже.
ПРИМЕЧАНИЕ. Дорсомедиальный участок кожи мыши ( Рисунок 1a) содержит самый высокий процент волосяных фолликулов, которые равномерно распределены и выровнены, что обеспечивает оптимальную ориентацию для секционирования. Удаление основной не дермальной ткани не является необходимым, но может быть выполнено, если это необходимо. - Обрежьте собранную кожу на прямоугольные кусочки подходящего размера, чтобы вписаться в дно криомолда, принимая во внимание направленный рост зерна волосяного фолликула.
ПРИМЕЧАНИЕ. Меньшие участки кожи могут быть легче обрабатывать для новичков, так как они менее склонны к запутыванию во время процесса инкубации и монтажа. Пример, показанный здесь, представляет собой область дорсальной кожи размером ~ 1 см 2 , которая вписывается в криомодель размером 22 х 30 х 20 мм ( рис. 2а ). - Закрепите кожу при комнатной температуре в 25 мл 4% PFA в течение 10-30 минут, в зависимости от толщины образцов кожи ( рисунок 1b ).
- Промойте образцы кожи два раза в 25 мл PBSПо меньшей мере 5 минут каждый ( фиг. 1b ).
- Нанесите образцы кожи на бумажное полотенце, чтобы тщательно сливать ткань избыточного PBS, что может привести к кристаллизации во время процесса замораживания и может повлиять на результаты криосекции.
ПРИМЕЧАНИЕ. Стандартный градиент сахарозы не требуется. Однако это также может быть включено в протокол по усмотрению пользователя. - Имейте в виду ориентацию волосяных фолликулов для каждого образца кожи. Используйте рассекающий микроскоп для визуальной помощи (особенно для тех, кто впервые выполняет протокол). Вставьте образец кожи в криомольз, заполненный OCT, и уравновешите все области кожи с помощью OCT, удалив любые воздушные пузырьки, прикрепленные к поверхности подстриженных волос с помощью щипцов ( рис. 2а и 2b ).
- Надавите на кожу до нижней части блока, заполненного OCT, чтобы он лежал на одном уровне с нижней частью.
ПРИМЕЧАНИЕ. Кожа может быть ориентирована в любом направлении,Так как зернистость волосяного фолликула отмечена для правильной процедуры резания. Криомодели будут повторно ориентированы, когда блоки будут прикреплены к криостату для криосекции. Отметьте ориентацию волосяного фолликула на криомодели, так как этот шаг определяет последующую ориентацию разреза криостата. - Перенесите кромки на металлическую пластину в морозильнике -80 ° C, чтобы избежать плавания и вывиха ткани.
- Следите за процессом замораживания, чтобы поддерживать ориентацию кожи на дне криомолда, поскольку невидимые пузырьки воздуха могут привести к тому, что кожа поднимется к поверхности криоглуба.
ПРИМЕЧАНИЕ. Криомодели с замороженной тканью могут храниться более года при -80 ° C и могут быть повторно использованы для дополнительных разделов.
- Закрепите дорсальную область животного трупы сухой сухой электробритвой.
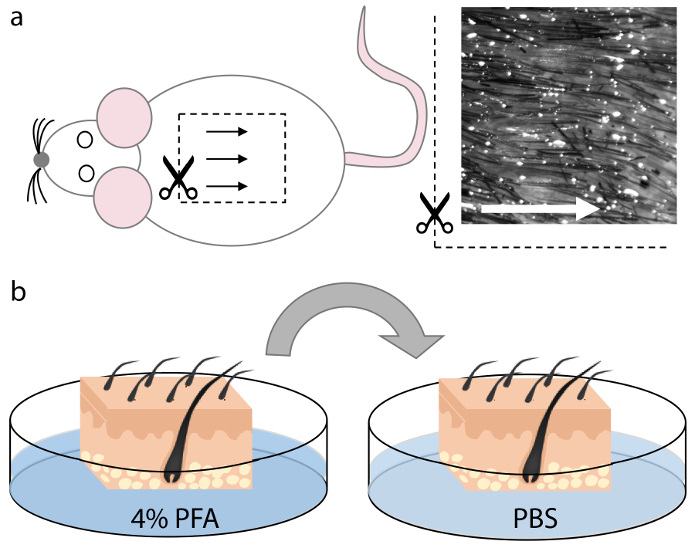
Рисунок 1. Сбор и фиксация кожи мыши.
(А) ткань кожи была собрана из дорсомедиальной области животного трупа. Волосяные фолликулы в этой области равномерно распределены и выровнены и поэтому обеспечивают оптимальную ориентацию во время секционирования, как показано стрелками. ( B ) После резки квадратов соответствующего размера, который вписывается в криомолью, ткань кожи фиксировали в 4% PFA в течение 15 мин и промывали два раза в PBS в течение 5 мин каждый. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Толстое поперечное сечение ткани
- Подготовка и ориентация ткани для установки на криостате.
- Приготовьте 100-миллилитровое блюдо с 15 мл PBS. Поместите его в легкодоступную область на криостате. Кроме того, подготовьте 12-луночный планшет с 2,5 мл PBS на лунку; Этикетка в соответствии с образцами для длительного храненияПри 4 ° С. Используйте щипцы для обработки секций.
- Отрегулируйте температуру криостата до -20 ° C.
ПРИМЕЧАНИЕ. Температура может повлиять на секционирование, но хорошее руководство должно начинаться при -20 ° C. - Чтобы получить участки примерно двух волосяных фолликулов, отрегулируйте криостат, чтобы отрезать участки толщиной 150 мкм.
ПРИМЕЧАНИЕ. Толщина секции может варьироваться в зависимости от потребностей пользователя и ограничений микроскопа, которые будут использоваться для анализа.
ПРИМЕЧАНИЕ. Ориентация образца имеет решающее значение для получения участков кожи с волосяными фолликулами в соответствующей ориентации. Это достигается путем правильной установки на блок криостата. Убедитесь, что плоскость сечения параллельна ориентации волосяного фолликула ( рисунок 2c ). Как упоминалось ранее, правильная ориентация плоскости сечения в образце кожи является решающим шагом для определения качества изображений, которые будут получены вБолее поздний шаг.

Рисунок 2. Внедрение, криоконсервация и секционирование.
(А) Маркировка направления волосяного фолликула (КВ) на криомодели, обозначенная черными стрелками, важна для правильной ориентации во время криосекции. ( B ) Плоскость сечения должна быть выровнена с ориентацией волосяного фолликула, чтобы генерировать участки, в которых полная длина волосяных фолликулов остается неповрежденной. ( C ) Секции были разрезаны на ориентацию волосяного фолликула, что было указано черными стрелками на cryomold. ( D ) Толстые поперечные сечения ткани собирали металлическими щипцами и ( e ) переносили в чашку культуры 100 мм, содержащую 1x PBS. ( F ) При комнатной температуре PBS растворяет OC.T. Соединение, которое окружает толстые поперечные сечения ткани, как показано белыми стрелками. Секции затем свободно плавают в PBS. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Cryosectioning.
- Вырежьте секцию с помощью криостата. Используйте щипцы для сбора OCT, который содержит встроенный кусок кожи ( рисунок 2d ).
ПРИМЕЧАНИЕ. Используйте криостат, который обеспечивает независимое перемещение и регулировку вдоль осей X, Y и Z для оптимального позиционирования образца. Это позволяет генерировать идеально выровненные поперечные сечения тканей. - Перенесите секцию из криостата в 100-миллилитровую культуральную чашку, заполненную PBS, и продолжайте следующий срез. Не собирайте образцы на слайде ( рисунок 2е ).
ПРИМЕЧАНИЕ. При комнатной температуре PBS растворяетсяOCT, оставляя срезы для кожи, которые легко обрабатываются с помощью щипцов ( рис. 2f ).
ПРИМЕЧАНИЕ. Свежее PBS может потребоваться в культуральной таре 100 мм после растворения многих участков ткани толщиной 100 мкм и может быть соответствующим образом изменено. - Используйте щипцы для переноса плавающих участков кожи в хорошо помеченную лунку на 12-луночном планшете, заполненном 2,5 мл PBS ( рис. 3а , слева).
ПРИМЕЧАНИЕ. При температуре 4 ° C образцы могут храниться не менее двух дней. Для длительного хранения защищающих кожу блоков OCT после секционирования запечатывайте режущую поверхность капелькой нового OCT. После замораживания капли OCT оберните использованный блок OCT в парафильм и поместите его обратно в морозильник -80 ° C ,
- Вырежьте секцию с помощью криостата. Используйте щипцы для сбора OCT, который содержит встроенный кусок кожи ( рисунок 2d ).
3. Иммунофлуоресцентная маркировка.
- Подготовьте буфер PB (PBS, дополненный 0,5% обезжиренным молочным порошком, 0,25% желатиновой кожи кожи и 0,5% Triton X-100) на листеT 2 h заранее, как описано ранее 5 .
ПРИМЕЧАНИЕ. Азид натрия может быть добавлен в буфер PB для сохранения антител для повторного использования окрашивающего буфера. - Нанесите 1,5 мл микроцентрифужные пробирки и добавьте 500 мкл PB-буфера на пробирку. Тщательно используйте щипцы для переноса срезов кожи из PBS в отдельные трубки, содержащие буфер PB для блокировки ( рис. 3a , справа). Убедитесь, что все ломтики кожи полностью погружены в воду. Поместите микроцентрифужные пробирки на смотровой рокер со скоростью не более 10 колебаний в минуту, что не должно нарушать целостность ткани в течение 1 часа при комнатной температуре.
ПРИМЕЧАНИЕ. Очень важно, чтобы скорость не превышала 10 колебаний в минуту на смотровом качалке, так как она вызывает запутывание.- Хотя можно добавить более одного среза на микроцентрифужную пробирку, чтобы сохранить антитела, поместите только один срез на пробирку. Чтобы уменьшить использование антител, используйте громкость250 мкл.
ПРИМЕЧАНИЕ. При необходимости замените микроцентрифужные пробирки, например, 96-луночными планшетами. Однако размещение толстых поперечных сечений ткани в 1,5-микронных центрифужных пробирках позволяет наиболее эффективно проникать в ткань из-за повышенного возмущения жидкости.
- Хотя можно добавить более одного среза на микроцентрифужную пробирку, чтобы сохранить антитела, поместите только один срез на пробирку. Чтобы уменьшить использование антител, используйте громкость250 мкл.
- Нанесите отдельные 1,5 мл микроцентрифужные пробирки для каждого среза кожи и добавьте 500 мкл буфера PB и соответствующее количество первичного антитела. Через 1 ч блокировки переместите ломтики кожи в свежеприготовленные пробирки, содержащие антитела. Инкубируйте ломтики при 4 ° С в течение ночи.
ПРИМЕЧАНИЕ. В этом примере использовались следующие первичные антитела: FITC-крыса с анти-человеческим CD49f в концентрации 1:50 и козьим антимышиным / крысиным интегрином альфа 8 при концентрации 1: 100. - На следующий день подготовьте две отдельные 1,5 мл микроцентрифужные пробирки, содержащие 500 мкл PBS на образец. Вымойте ломтики кожи два раза в течение 1 часа при комнатной температурее.
- Подготовьте отдельные 1,5 мл микроцентрифужные пробирки, содержащие 500 мкл PB-буфера с соответствующей концентрацией применимых вторичных антител и 4 ', 6-диамидино-2-фенилиндола (DAPI).
ПРИМЕЧАНИЕ. Вторичными антителами, используемыми в этом примере, являются Alexa Fluor 488 осел против крысы IgG и Alexa Fluor 555 осел против козьего IgG в концентрации 1: 500. DAPI использовали при концентрации 1: 100. - Осторожно переносите образцы кожи в буфер PB, который содержит вторичное антитело и DAPI, и инкубируйте срезы кожи при комнатной температуре в течение 1 часа с низкой скоростью на ротаторе или шейкере.
- Храните ломтики при 4 ° C в PB-буфере, содержащем вторичное антитело и DAPI, в течение четырех дней и, возможно, дольше, если в PBS добавляют азид натрия.
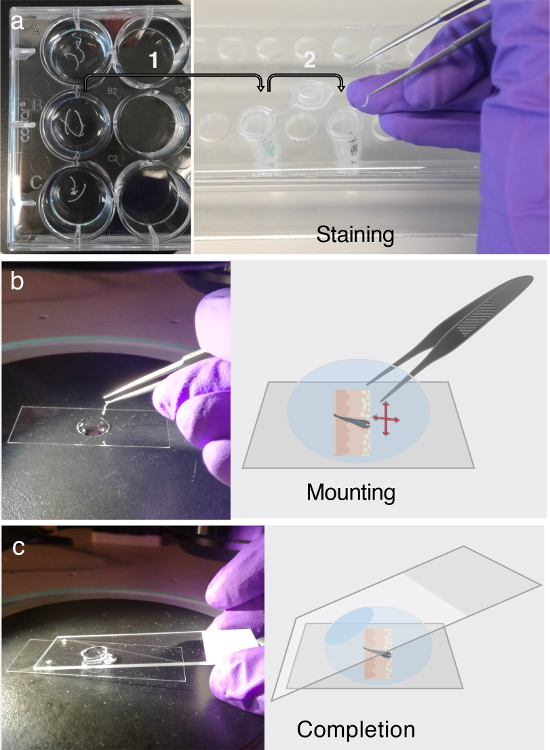
Рисунок 3. ИммунофлуоресцентМаркировки и монтажа.
(А) с плавающей ткани поперечные сечения могут быть сохранены в 12-луночных планшетах в течение по крайней мере двух дней при температуре 4 ° С. Перед иммунофлуоресцентной (IF) маркировкой переносите интересующие ткани поперечные сечения в 1,5 мл микроцентрифужные пробирки, содержащие PB-буфер для блокировки, как указано стрелкой 1. Для маркировки IF придерживайтесь многоступенчатой процедуры, разработанной на шаге 3. Каждый Часть этапа 3 требует тщательной передачи сечений ткани в свежеприготовленные микроцентрифужные пробирки, содержащие первичный раствор антитела, раствор вторичного антитела или промывочный буфер, который обозначен стрелкой 2. ( b ) После маркировки IF, Секции распутываются и сплющиваются в капельке глицерина с помощью рассекающего микроскопа. ( C ) После того, как поперечное сечение ткани полностью сплющено на дне крышки, для крепления секции используется обычный слайд микроскопа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Монтаж для микроскопической визуализации
- Перед визуализацией переносите срезы кожи на отдельные микроцентрифужные пробирки, содержащие 500 мкл PBS, чтобы смыть вторичные антитела и DAPI.
- Используйте пипетку объемом 1000 мкл, но срезайте первые 0,5 см наконечника пипетки, чтобы обеспечить правильную пипетирование высоковязкого глицерина. Поместите покровное стекло размером 22 x 50 мм на темный фон под рассекающим микроскопом ( рис. 3b ).
- Добавьте каплю 100% глицерина на крышку ( рис. 3b ). Перенесите срез кожи из микроцентрифужной трубки на каплю глицерина. Используйте рассекающий микроскоп и заостренные пинцеты, чтобы осторожно размотать кусочки кожи, которые свернуты.
ПРИМЕЧАНИЕ. Поскольку срез плавает в глиКерол, его можно распутать, уговорив естественную склонность ткани вернуться к нормальной форме. Не заставляйте неестественное выпрямление среза, так как это может привести к повреждению ткани. - Закрепите ткань, как только вся длина участка кожи правильно ориентирована и сплющена на обложке; Используйте обычный слайд микроскопа. Этот шаг будет дополнительно выпрямлять срез кожи.
ПРИМЕЧАНИЕ. Избегайте попадания воздуха ( рисунок 3c ). - Image В глицериновых срезах кожи в течение следующих двух дней.
ПРИМЕЧАНИЕ. Длительное хранение будет отрицательно влиять на качество ткани и изображения. В этом примере все изображения были получены с помощью вертикального конфокального микроскопа с использованием объектива 20x.
Результаты
Чтобы подчеркнуть преимущества нашей техники, мы сравнили нашу мощную технику поперечного сечения трехмерной ткани «горизонтальное целое крепление» с классическими замороженными средами. Классические замороженные срезы были отрезаны, как описано выше 5 . Чтобы обеспечить визуальную структуру эпидермиса на микроскопических изображениях, мы иммунизировали для интегрина альфа-6 (Itga6), который является компонентом, который прикрепляет эпидермальные клетки к основной подвальной мембране 6 . Мы также обозначили мышцу пиреальной артерии (APM), которая отвечает за пилоэрецию (также известную как «мурашки по коже»), с интегрином альфа-8 7 . В классических замороженных срезах большинство волосяных фолликулов, визуализированных с помощью Itga6, не были разделены по всей длине, генерируя преимущественно неполные волосяные фолликулы в разрезе по сравнению с горизонтальными целыми креплениями ( рис. 4a- 4d ). Толстые поперечные сечения тканей позволяют получить больше слоев Z-стеллажа по сравнению с обычными 10-мкм участками, что позволяет получить более полное трехмерное изображение. Это становится еще более очевидным при изучении целостности APM, которые связаны с волосяными фолликулами и надлежащей подвальной мембраной. В классических криосекциях большая часть APM была фракционирована ( рис. 4а- 4d ). Кроме того, целостность ткани гиподермального отделения сохраняется в горизонтальных целых горах по сравнению с разрушением адипоцитов, когда криосекции прикреплены к теплым стеклянным слайдам, что является хорошо известным артефактом замораживания-оттаивания ( рис. 4a -b , сравнивают гиподермальный регионы) 8.
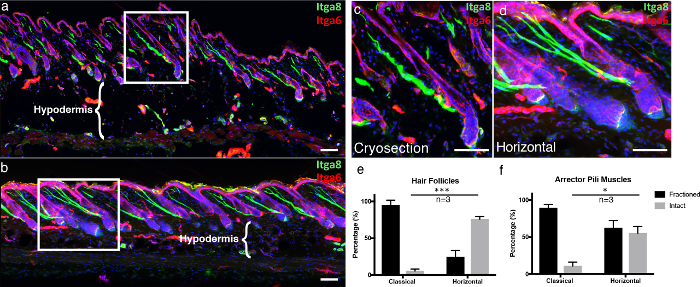
Рисунок 4. Горизонтальное целое моуNt по сравнению с классической криосистемой.
(А) Классический получена кожа криосрезов толщина 10 мкм и (б) 100 мкм толщины 3D ткани поперечных сечений были помечены интегриным альфа-6 (ИНТЕГРИН АЛЬФА-6) и интегрин альфа-8 (ИНТЕГРИН АЛЬФА-8) для визуализации эпидермального отсека и arrector пилей мышцы , Соответственно. Изображения толстых поперечных сечений ткани представлены как максимальные проекции большого Z-стека. Белые рамки обозначают области, которые увеличены, отображаются в ( c ) классическом и ( d ) горизонтальном сечении. ( Д ) Неиспользованные волосяные фолликулы и ( f ) цельные мышцы артериальной артерии были количественно определены как в классическом, так и в горизонтальном сечении. Шкалы шкалы указывают 100 мкм. Данные представлены как среднее значение ± стандартная ошибка среднего (SEM). Определялась одна секция на биологическую репликацию ( n = 3). Непарный t-тест * P <0,05, *** P <0,0005. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
Раскрытие информации
Авторы хотели бы сообщить, что публикация этой рукописи финансировалась компанией Thermo-Fisher Scientific Inc.
Благодарности
Авторы признают спонсорство от Thermo-Fisher Scientific и благодарны Nikon Imaging Center в Kings College London за поддержку при конфокальном захвате изображений.
Материалы
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
Ссылки
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены