Method Article
אופקי הר שלם: עיבוד רומן פרוטוקול הדמיה על רקמה עבה, תלת מימדי חתכים של העור
In This Article
Summary
עבודה זו מציגה עיבוד חדש פרוטוקול הדמיה לניתוח עבה, תלת ממדי ניתוח חתך המאפשר ניצול מלא של modocalities הדמיה confocal. פרוטוקול זה משמר אנטיגניות ומייצג מערכת חזקה לנתח היסטולוגיה העור וסוגים אחרים של רקמות אחרות.
Abstract
עיבוד רקמה של עניין כדי ליצור תמונה מיקרוסקופית התומכת טענה מדעית יכול להיות מאתגר. רכישת תמונות מיקרוסקופיות באיכות גבוהה אינה תלויה לחלוטין באיכות המיקרוסקופ, אלא גם בשיטות עיבוד הרקמות, אשר לעיתים קרובות כרוכות בפעולות קריטיות או צעדים רבים. יתר על כן, סוגי תאים mesenchymal בעור ורקמות אחרות מייצגים אתגר חדש עבור הכנת רקמות הדמיה. כאן, אנו מציגים תהליך שלם, מן הקציר רקמות למיקרוסקופ. הטכניקה שלנו, המכונה "הר שלם אופקית", הוא אחד כי טירונים יכולים להפוך במהירות בקיאים זה מאפשר שימור אנטיגן ו ב 60-300 מיקרומטר עבה חלקים לחתוך עם cryostat. חלקים של עובי זה מספק הדמיה משופרת של microarchitecture רקמות בסביבה תלת מימדי. בנוסף, הפרוטוקול משמר תאים mesenchymal באופן זה משפר את איכות התמונה כאשרלעומת קריסטוסט סטנדרטי או חלקים פרפין, ובכך להגדיל את היעילות והאמינות של immunostaining. אנו מאמינים כי פרוטוקול זה ייהנה כל המעבדות לדמיין את העור, ואולי רקמות אחרות ואיברים.
Introduction
המהפכה של ציוד הדמיה מיקרוסקופית מספקת עבור מכשירים מתוחכמים, ברזולוציה גבוהה הדמיה. עם זאת, בעת רכישת תמונה מיקרוסקופית של מלא תלת מימדית (3D) רקמות חתך, הכנת הדגימה מציג אתגרים משמעותיים יכול להיות הגורם המגביל בהגדרת איכות התמונה. כל צעד נפרד ראוי שיקול זהיר על מנת לשמר מורפולוגיה רקמות ואת האנטיגניות של חלבונים היעד, כדי למזער חפצים המושרה עיבוד, כדי למקסם את איכות התמונה הסופית. לדוגמה, ניתוח מסורתי של העור דורש תמונה עם נוף של האפידרמיס ודרמיס, עם זקיקי השיער כי הם בכיוון הנכון, המאפשר ניתוח אנטומי של תא תא תרומות תא העור הומאוסטזיס 1 , 2 . זה דורש ריכוז יסודי על איך העור מוטבע וחתך. חשוב לציין, זקיקי השיער יכול להיות עבה יותרמ -100 מיקרומטר, אשר עולה בהרבה על פרפין רגיל או עובי סעיף קפוא, וכתוצאה מכך תקן נמוך יותר של ניתוח לעומת mounts כולו או חתכים עבים 3 , 4 , 5 .
יחד, כל צעד של הכנת הדגימה לניתוח מיקרוסקופי הוא גורם מכריע שישפיע על ניתוח התמונה. כאן, פרוטוקול עיבוד חדשניים עבור עבה, 3D ניתוח חתך רוחב, אשר אנו מכנים "הר שלם אופקי", מוצג. הפרוטוקול משמר מאוד אנטיגניות ומאפשר ניצול מלא של חלקים עבים של העור באמצעות ציוד הדמיה confocal רגיל. זהו מדריך מלא לשימוש בעור לעיבוד רקמות עבה חתך הדמיה, כולל קציר הקציר ו paraformaldehyde (PFA), cryopreservation (שלב 1), הדור של 100 מיקרומטר עבה רקמות חתך עם cryostat (צעד 2), תיוג אימונופלורסנט הרכבה (שלבים 3 ו -4). תוצאות נציג להשוות תמונות confocal של שתי טכניקות הכנה היסטולוגית ברורה - cryosectioning קלאסית עבה, רקמות 3D חתך חתך, הדגשת היתרונות של "mounts אופקי שלם" עבור המשתמש הפוטנציאלי של פרוטוקול זה.
Protocol
כל הניסויים בבעלי חיים היו כפופים לאישור מוסרי מקומי וביצעו את תנאי רישיון משרד הפנים הבריטי.
1. קציר עור Cryopreservation
- הכנות.
- הכינו אחד 100 מ"מ צלחת תרבות עם 25 מ"ל של PFA 4% ושני 100 מ"מ מנות תרבות עם 25 מ"ל של 1x פוספט שנאגרו מלוחים (PBS).
- ממלאים cryomolds מלבני משם קילומטר על ידי שני שלישים עם אופטימלית חיתוך מתחם הטמפרטורה (אוקטובר).
- מניחים צלחת מתכת, שבו cryoblocks ניתן להציב בשלב מאוחר יותר, לתוך מקפיא -80 מעלות צלזיוס.
- קצירת עור, קיבוע, ו cryopreservation.
- קליפ באזור הגב של גוויית בעל חיים עם מכונת גילוח חשמלית יבשה.
הערה: בדוגמה זו, יום הולדת 21 יום wildtype עכברים היו בשימוש. - קציר את תחומי העניין על העור.
הערה: אזור dorsomedial של עור העכבר ( איור 1 א ') מכיל את האחוז הגבוה ביותר של זקיקי השיער הנמצאים במרווחים שווים וממוצעים, המאפשרים כיוון אופטימלי לקטע. הסרת רקמה לא עורית הבסיסית אינה הכרחית אבל ניתן לבצע אם נדרש. - חתוך את העור שנקטף לתוך חתיכות מלבניות בגודל המתאים כדי להתאים את החלק התחתון של cryomold, לוקח את הצמיחה כיוונית של הזקיקים זקיק השיער בחשבון.
הערה: פרוסות עור קטנות יותר יכול להיות קל יותר לטפל טירונים, שכן הם נוטים פחות להסתבך במהלך הדגירה ואת תהליך הרכבה. הדוגמה המוצגת כאן הוא ~ 1 ס"מ שטח 2 של עור הגב, אשר נכנס לתוך cryumold 22 x 30 x 20 מ"מ ( איור 2 א ). - תקן את העור בטמפרטורת החדר ב 25 מ"ל של PFA 4% עבור 10-30 דקות, בהתאם לעובי של דגימות העור ( איור 1 ב ).
- שטפו את דגימות העור פעמיים ב 25 מ"ל של PBSעבור לפחות 5 דקות כל אחד ( איור 1b ).
- טפטוף דגימות העור על מגבת נייר בזהירות לנקז את הרקמה של עודף PBS, אשר יכול לגרום התגבשות במהלך תהליך ההקפאה יכול להשפיע על תוצאות cryosectioning.
הערה: שיפוע סוכרוז סטנדרטי אינו נדרש. עם זאת, זה יכול להיות גם שולבו בפרוטוקול על פי שיקול דעתו של המשתמש. - להיות מודעים הכיוון של זקיקי השיער עבור כל מדגם העור. השתמש במיקרוסקופ לנתח עבור סיוע חזותי (במיוחד כל אחד מבצע את הפרוטוקול בפעם הראשונה). הכנס את דגימת העור לתוך cryumold אוקטובר OTC ו לאזן את כל האזורים של העור עם אוקטובר על ידי הסרת כל בועות אוויר המצורפת על פני השטח של השיער גזוז באמצעות מלקחיים ( תרשימים 2a ו 2b ).
- לדחוף את העור לתחתית בלוק מלא אוקטובר כך שהוא שוכב עם התחתונה.
הערה: ניתן לכוון את העור בכל כיוון, aכל עוד הדגן של זקיק השיער הוא ציין עבור הליכי חיתוך נאות. Cryomolds יהיה מחדש בכיוון כאשר בלוקים מחוברים cryostat עבור cryosectioning. סמן את האוריינטציה של זקיק השיער על cryomold, שכן צעד זה קובע את הכיוון הבא של לחתוך cryostat. - מעבירים את cryoblocks על צלחת מתכת במקפיא -80 מעלות צלזיוס, כדי למנוע צף נקע של הרקמה.
- לפקח על תהליך הקפאה כדי לשמור על אוריינטציה של העור בחלק התחתון של cryomold, מאז בועות אוויר בלתי נראה יכול לגרום לעור לעלות אל פני השטח של cryomold.
הערה: Cryomolds עם רקמה קפואה ניתן לאחסן במשך יותר משנה ב -80 מעלות צלזיוס וניתן לעשות בה שימוש חוזר עבור חלקים נוספים.
- קליפ באזור הגב של גוויית בעל חיים עם מכונת גילוח חשמלית יבשה.
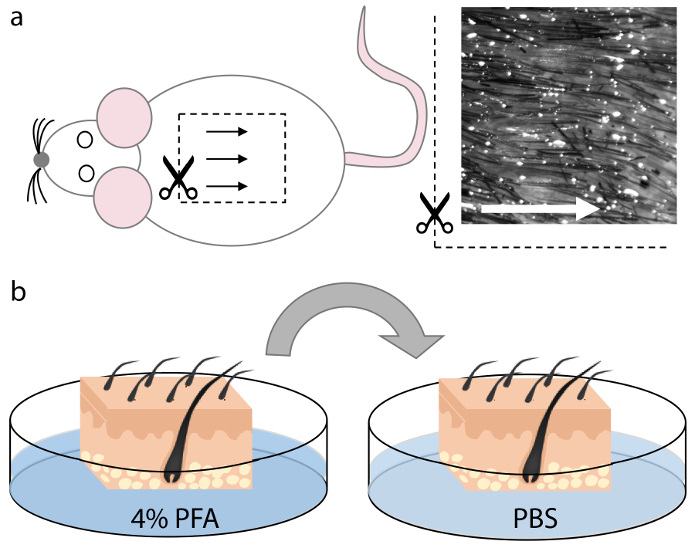
איור 1. קציר וקיבוע של עור העכבר.
( א ) רקמת העור נקטפה מן האזור dorsomedial של גופת החיה. זקיקי השיער באזור זה מחולקים באופן שווה וישרים ולכן מאפשרים כיוון אופטימלי במהלך חתך, כפי שמציינים החצים. ( ב ) לאחר חיתוך ריבועים בגודל המתאים שמתאים לתוך cryomold, רקמת העור היה קבוע PFA 4% במשך 15 דקות ושטף פעמיים ב PBS במשך 5 דקות כל אחד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
2. חתך עבה חתך
- הכנה אוריינטציה רקמות לעלות על cryostat.
- הכינו צלחת 100 מ"מ תרבות עם 15 מ"ל של PBS. מניחים אותו על אזור נגיש בקלות על cryostat. בנוסף, להכין צלחת 12 גם עם 2.5 מ"ל של PBS לכל טוב; תווית על פי דגימות לאחסון לטווח ארוך של SECtions ב 4 ° C. השתמש מלקחיים לטפל בקטעים.
- להתאים את הטמפרטורה של cryostat ל -20 מעלות צלזיוס.
הערה: הטמפרטורה יכולה להשפיע על חתך, אך מדריך טוב הוא להתחיל ב -20 ° C. - כדי להשיג מקטעים בערך שני זקיקי השיער עבה, להתאים את cryostat לחתוך חלקים 150 מיקרומטר עבה.
הערה: עובי סעיף יכול להיות מגוונות, בהתאם לצרכים של המשתמש ואת המגבלות של המיקרוסקופ שישמשו לניתוח.
הערה: הכיוון של המדגם הוא קריטי להשגת מקטעי עור עם זקיקי השיער בכיוון הנכון. זו מושגת על ידי הרכבה נכונה על בלוק cryostat. ודא כי המטוס קטע מקביל אוריינטציה שער זקיק ( איור 2 ג ). כאמור, הכיוון הנכון של מטוס החתך במדגם העור הוא צעד מכריע בקביעת איכות התמונות שיירכשוצעד מאוחר יותר.

איור 2. הטבעה, cryopreservation, וחתך.
( א ) מסמן את הזקיק (HF) לכיוון זקיק השיער על cryumold, מסומן על ידי החצים השחורים, חשוב עבור כיוון הנכון cryosectioning. ( ב ) מטוס החתך צריך להיות מיושר עם אוריינטציה של זקיק השיער כדי ליצור קטעים בהם אורכם המלא של זקיקי השיער נשאר שלם. ( ג ) קטעים נחתכו לפי אוריינטציה של זקיק השיער, אשר צוין על ידי החצים השחורים על קרימוולד. ( ד ) רקמות עבות חתכים נאספו עם מלקחיים מתכת ו ( ה ) הועברו לתוך צלחת 100 מ"מ תרבות המכיל 1x PBS. ( ו ) בטמפרטורת החדר, PBS ממיס את OC.T. המתחם המקיף את חתך רוחב עבה, כפי שצוין על ידי החצים הלבנים. הקטעים ואז לצוף בחופשיות PBS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
- קריוסקופינג.
- גזור קטע באמצעות cryostat. השתמש במלקחיים כדי לאסוף את אוקטובר המכיל את חתיכת מוטבע של העור ( איור 2 ד ).
הערה: השתמש בקריאוסטט המאפשר תנועה עצמאית והתאמה לאורך צירי X, Y ו- Z לקבלת מיקום אופטימלי של הדגימה. זה מאפשר את הדור של מיושר באופן אידיאלי חתך חתכים. - מעבירים את החלק מתוך cryostat לתוך צלחת 100 מ"מ תרבות מלא PBS ולהמשיך עם פרוסה הבאה. אין לאסוף את הדגימות בשקופית ( איור 2e ).
הערה: בטמפרטורת החדר, PBS יתמוסס משםאוקטובר, עוזב פרוסות העור כי הם קל להתמודד עם מלקחיים ( איור 2F ).
הערה: טריים PBS עשוי להיות נחוץ צלחת 100 מ"מ תרבות לאחר המסת סעיפים רקמות רבות 100 מיקרומטר עבה וניתן לשנות בהתאם. - השתמש מלקחיים להעביר את קטעי העור צף היטב מסומן היטב בצלחת 12 גם מלא 2.5 מ"ל של PBS ( איור 3 א , משמאל).
הערה: ב 4 ° C, דגימות ניתן לאחסן לפחות יומיים. עבור אחסון לטווח ארוך של בלוקים OCT המכילים עור לאחר חתך, לאטום את משטח חיתוך עם טיפה של אוקטובר טרי לאחר הקפאת טיפה אוקטובר, לעטוף את גוש בלוק בשימוש ב parafilm ומניחים אותו במקפיא -80 מעלות צלזיוס .
- גזור קטע באמצעות cryostat. השתמש במלקחיים כדי לאסוף את אוקטובר המכיל את חתיכת מוטבע של העור ( איור 2 ד ).
3. תיוג אימונופלורסנט.
- הכן את המאגר PB (PBS בתוספת 0.5% אבקת חלב רזה, 0.25% דגים דגים ג'לטין, 0.5% Triton X-100) ב leasT 2 שעות מראש, כפי שתואר לעיל 5 .
הערה: Azide נתרן ניתן להוסיף למאגר PB לשימור נוגדנים לשימוש חוזר של המאגר מכתים. - תווית 1.5 מ"ל microcentrifuge צינורות ולהוסיף 500 μL של חיץ PB לכל צינור. בזהירות להשתמש במלקחיים להעביר את פרוסות העור מן PBS לתוך צינורות נפרדים המכילים את המאגר PB לחסימה ( איור 3 א , מימין). ודא כי כל פרוסות העור הם שקוע לחלוטין. מניחים את צינורות microcentrifuge על נדנדה ראה במהירויות לא יותר מ 10 תנודות לדקה, אשר לא צריך לשבש את שלמות רקמות, במשך שעה 1 בטמפרטורת החדר.
הערה: זה קריטי כי המהירות אינה עולה על 10 תנודות לדקה על נדנדה ראה, שכן זה יהיה לגרום לסבך.- אמנם ניתן להוסיף יותר פרוסה אחת לכל צינור microcentrifuge, כדי לשמור נוגדנים, רק מקום אחד פרוסה לכל צינור. כדי להפחית את השימוש בנוגדן, השתמש באמצעי אחסוןשל 250 μL.
הערה: אם יש צורך, תחליף צינורות microcentrifuge עם, למשל, 96-גם צלחות. עם זאת, המיקום של רקמות עבות חתכים לתוך צינורות microcentrifuge 1.5 מ"ל מאפשר החדירה נוגדן יעיל ביותר לתוך הרקמה עקב הפרעות נוזלי משופר.
- אמנם ניתן להוסיף יותר פרוסה אחת לכל צינור microcentrifuge, כדי לשמור נוגדנים, רק מקום אחד פרוסה לכל צינור. כדי להפחית את השימוש בנוגדן, השתמש באמצעי אחסוןשל 250 μL.
- תווית נפרדים צינורות 1.5 מ"ל microcentrifuge עבור כל פרוסה העור ולהוסיף 500 μL של חיץ PB ואת הכמות המתאימה של נוגדן ראשוני. לאחר 1 שעות של חסימה, להעביר את פרוסות העור לתוך צינורות מוכנים טרי המכיל את הנוגדנים. דגירה פרוסות על 4 מעלות צלזיוס למשך הלילה.
הערה: בדוגמה זו, נוגדנים העיקריים הבאים שימשו: עכברוש FITC CD49f עכברוש בריכוז של 1:50 ו עז נגד עכבר / חולדה integr alpha 8 בריכוז של 1: 100. - למחרת, להכין שני צינורות 1.5 מ"ל microcentrifuge שונים המכילים 500 μL של PBS לכל מדגם. לשטוף את פרוסות העור פעמיים במשך 1 שעה בטמפרטורת החדרה.
- הכן נפרד 1.5 צינורות microcentrifuge מ"ל המכיל 500 μL של חיץ PB עם הריכוז המתאים של נוגדנים משני רלוונטי ו 4 ', 6-diamidino-2-phenylindole (DAPI).
הערה: נוגדנים משניים המשמשים בדוגמה זו הם Alexa פלואור 488 חמור נגד עכברוש IgG ו אלקסה פלואור 555 חמור אנטי עיזים IgG בריכוז של 1: 500. DAPI שימש בריכוז של 1: 100. - בזהירות להעביר את דגימות העור למאגר PB, המכיל את הנוגדן משני DAPI, ו דגירה של פרוסות העור בטמפרטורת החדר למשך שעה 1 במהירות נמוכה על rotator או שייקר.
- אחסן את פרוסות על 4 מעלות צלזיוס במאגר PB המכיל את הנוגדן משני DAPI במשך עד ארבעה ימים, ואולי יותר אם אזיד נתרן מתווסף PBS.
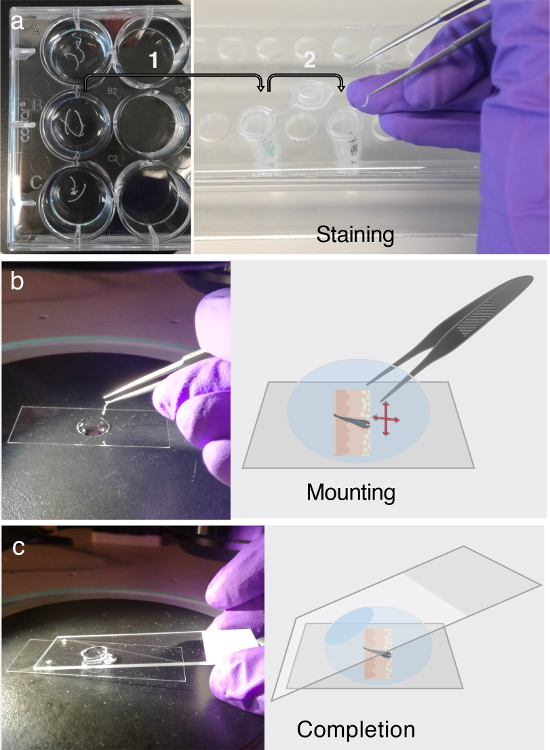
איור 3. Immunofluorescתיוג ent הרכבה.
( א ) רקמה צולבת חתכים ניתן לאחסן 12 צלחות גם במשך לפחות יומיים ב 4 ° C. לפני תיוג immunofluorescent (IF), להעביר את הרקמה חתכים של עניין לתוך צינורות microcentrifuge 1.5 מ"ל המכיל חיץ PB לחסימת, כפי שצוין על ידי חץ 1. עבור תיוג אם, לדבוק בהליך מרובה צעד מפורט על בשלב 3. חלק משלב 3 דורש העברה זהירה של רקמות חתכים לתוך צינורות microcentrifuge טרי מוכן המכיל פתרון נוגדן ראשוני, פתרון נוגדנים משני, או חיץ כביסה, אשר מסומן על ידי חץ 2. ( ב ) לאחר תיוג אם, סעיפים נפרמו ו שטוחה טיפה של גליצרול, תוך שימוש במיקרוסקופ לנתח. ( ג ) לאחר חתך רקמות לחלוטין משוטח על החלק התחתון של כיסוי להחליק, שקופית מיקרוסקופ רגיל משמש לעלות את החלק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. הרכבה עבור ויזואליזציה מיקרוסקופית
- לפני הדמיה, להעביר את פרוסות העור צינורות microcentrifuge נפרדים המכילים 500 μL של PBS לשטוף את הנוגדנים המשניים DAPI.
- השתמש 1000 μL pipet, אבל לחתוך את 0.5 ס"מ הראשון של קצה פיפטה כדי לאפשר pipetting הנכון של גליצרול צמיג מאוד. מניחים coverslip 22 x 50 מ"מ על רקע כהה תחת מיקרוסקופ לנתח ( איור 3 ב ).
- הוסף טיפה אחת של גליצרול 100% על כיסוי להחליק ( איור 3 ב ). מעבירים את פרוסת העור מן הצינור microcentrifuge על טיפות גליצרול. השתמש במיקרוסקופ לנתח ואת מלקחיים הצביע בזהירות כדי להסיר את פרוסות העור כי הם מכורבלים.
הערה: כמו פרוסה צף ב glyטיפה Cerol, זה יכול להיות untangled על ידי coaxing הנטייה הטבעית של הרקמה לחזור לצורה הרגילה שלה. אין לכפות את היישור הלא טבעי של הפרוסה, שכן זה עלול לגרום נזק לרקמה. - הרכיב את הרקמה פעם את כל אורך קטע העור מכוונת כראוי ו שטוח על כיסוי להחליק; להשתמש שקופיות מיקרוסקופ רגיל. צעד זה ימשיך ליישר את פרוסת העור.
הערה: הימנע מלכידת אוויר ( איור 3 ג ). - תמונה של גליצרול- mounted העור חלקים במהלך היומיים הקרובים.
הערה: אחסון ממושך ישפיע לרעה על הרקמה ועל איכות ההדמיה. בדוגמה זו, כל התמונות נרכשו עם מיקרוסקופ confocal זקוף באמצעות מטרה 20x.
תוצאות
כדי להדגיש את היתרונות של הטכניקה שלנו, השווה שלנו עבה, 3D רקמה חתך טכניקה, "הר שלם אופקי", כדי קטעים קפואים קלאסיים. קטעים קפואים קלאסיים נחתכו כפי שתואר לעיל 5 . כדי לספק מבנה חזותי של האפידרמיס בתמונות מיקרוסקופיות, אנו אימונו-איסטנט עבור אינטגרין אלפא -6 (Itga6), שהוא מרכיב המעגן את תאי האפידרמיס לקרום המרתף שבבסיס 6 . כמו כן, שרטטנו את שריר הפילי ארקטור (APM), שאחראי על פילוארקציה (הידוע גם בשם "צמרמורת"), עם אינטגרין אלפא-8 7 . בקטעים הקפואים הקלאסיים, רוב זקיקי השיער שנדמיינו עם Itga6 לא נחתכו לאורך כל אורך הדרך, ויצרו זקיקי שיער חסרים ברובם לכל סעיף, בהשוואה לרכיבי שיער אופקיים ( איור 4 א -4 ד) ). חתך רקמות עבות מאפשרים לרכוש יותר Z- מחסנית שכבות לעומת מקובל 10 מיקרומטר סעיפים, המאפשר תמונה 3D מלאה יותר. זה הופך להיות אפילו יותר בולט כאשר לומדים את השלמות של APMs, אשר קשורים עם זקיקי השיער ואת קרום המרתף מעל. ב cryosections קלאסית, חלק עצום של APMs היו חלק ( איור 4 א -4 ד ). בנוסף, שלמות רקמות של תא hypodermal נשמר אופקי שלם mounts, לעומת הרס של adipocytes כאשר cryosections מחוברים שקופיות זכוכית חמה, אשר ידועה להקפיא-הפשרת חפץ ( איור 4a- b , להשוות את המזרק 8 ).
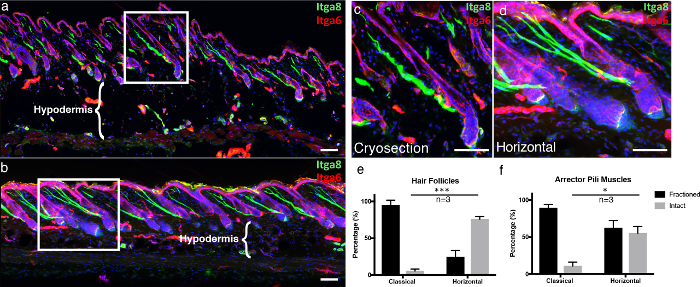
איור 4. mou אופקי שלםNt לעומת קריאוסקציה קלאסית.
( א ) התקבלו באופן קלאסי cryosections העור 10 מיקרומטר עבה ו ( ב ) 100 מיקרומטר עבה 3D רקמות חתכים היו מסומנים עם integrin אלפא -6 (Itga6) ו integrin alpha-8 (Itga8) כדי לדמיין את תא האפידרמיס ואת שרירי פיילי arrector , בהתאמה. התמונות של חתכים עבים רקמות מיוצגים כמו תחזיות מקסימלית של ערימת Z גדולה. המסגרות הלבנות מציינות את האזורים המורחבים, המוצגים ב ( ג ) החלקים הקלאסיים ( d ) האופטיים. ( ה ) זקיקי שיער שלמים ו ( f ) שרירי פילי שלם arrector היו לכמת בשני קטעים קלאסיים ואופקיים הר שלם. פסי סולם מצביעים על 100 מיקרומטר. הנתונים מיוצגים כ ממוצע ± שגיאת תקן של ממוצע (SEM). סעיף אחד לכל משכפל ביולוגי ( n = 3) היה לכמת. מבחן לא מסונכרן * P <0.05, *** P <0.0005. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
Disclosures
המחברים מבקשים לגלות כי פרסום כתב היד הזה מומן על ידי Thermo-Fisher Scientific Inc.
Acknowledgements
המחברים מכירים בחסות תרמו-פישר סיינטיפיק ומודים למרכז ההדמיה של ניקון בקינגס קולג 'בלונדון לתמיכה במהלך רכישת תמונות קונפוקאליות.
Materials
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
References
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved