Method Article
الجمع بين المواد الكيميائية العابرة للربط والطيف الكتلي لمجمعات البروتين سليمة لدراسة الهندسة المعمارية لتجميعات فرعية متعددة البروتين
In This Article
Summary
الهندسة المعمارية لمجمعات البروتين ضروري لوظيفتها. الجمع بين مختلف التقنيات الجماعية والمطيافيه أثبتت أنها قوية لدراسة تلك الجمعية. توفر البروتوكولات العابرة للربط الكيميائي وأصلي الكتلي، وتبين كيف أن هذه التقنيات التكميلية تساعد على توضيح بنية تجميعات فرعية متعددة البروتين.
Abstract
تتفاعل البروتينات مع يغاندس على شكل الجمعيات نشاطا وحيوية والاضطلاع بمختلف الوظائف الخلوية. ولتوضيح هذه التفاعلات أمرا أساسيا لفهم العمليات الخلوية. ومع ذلك، العديد من البروتين المجمعات التجميعات الحيوية ولا يمكن الوصول إليها باستخدام تقنيات الهيكلية التقليدية. الكتلي يسهم في التحقيق الهيكلية لهذه الجمعيات، ولا سيما أن الجمع بين مختلف التقنيات الجماعية والمطيافيه يسلم قيمة ثاقبة على الترتيب الهيكلي.
في هذه المقالة، نحن وصف التطبيق ومزيج من اثنين من التقنيات والمطيافيه جماعية متكاملة، هي العابرة للربط الكيميائية مقترنة بالطيف الكتلي وأصلي الطيف الكتلي. العابرة للربط الكيميائي يشمل الربط التساهمي من الأحماض الأمينية بالقرب من باستخدام الكواشف الكيميائية. بعد الهضم مع البروتياز، cross-linked دي-الببتيدات يتم تحديدها بواسطة الطيف الكتلي والبروتين التفاعلات بين المواقع اكتشفت. الكتلي الأصلية من ناحية أخرى هو تحليل للتجميعات البروتين سليمة في مرحلة الغاز مطياف كتلة. فإنه يكشف عن البروتين ستويتشيوميتريس، فضلا عن تفاعلات البروتين ويجند. ولذلك تسليم كلا تقنيات المعلومات التكميلية في بنية البروتين-يجند التجميعات والجمع بينهما أثبت قوية في الدراسات السابقة.
Introduction
وأصبح التحقيق الهيكلية للتجميعات البروتين أهمية خاصة لفهم العمليات الخلوية. ونتيجة لذلك، العديد من تقنيات قد تم تطوير وتحسين في علم الأحياء الهيكلية1. ومع ذلك، هذه التقنيات في بعض الأحيان محدودة في تطبيقها بسبب الحجم أو المرونة أو عدم تجانس البروتين المجمعات قيد التحقيق. ويمكن التعامل مع هذه التحديات الكتلي، ولذلك، برز كأداة قوية في علم الأحياء الهيكلية2،3،،من45. أكبر ميزة الكتلي، غير أن القدرة على تحديد البروتينات حتى في الخلائط المعقدة وغير متجانسة6لا لبس فيه. وتحقيقا لهذه الغاية، يتم عادة هضم البروتينات مع اندوبروتيناسيس والخليط الببتيد الناتجة مفصولة بواسطة كروماتوغرافيا سائلة والتيد مباشرة إلى مطياف كتلة. الببتيد الجماهير يتقرر فيما بعد والسلائف الأيونات يتم تحديدها من أجل مزيد من تجزؤ الببتيدات. ثم يتم تعريف البروتينات بواسطة الببتيد البحث والمناظرة بلغة الجماهير ضد قاعدة معروفة. لا يسمح هذا الإجراء تحديد الببتيدات/البروتينات ولكن أيضا على التعديلات بوستترانسلاشونال التي تسبب تحول شامل من الببتيدات السلائف والايونات جزء يحمل التعديل7. وتستند بعض تقنيات كثيرة في هيكلية الكتلي هذا المبدأ4،8. على سبيل المثال، وصف تقنيات مثل الهيدروجين الديوتريوم تبادل9،10،11،استراتيجيات وضع العلامات الكيميائية12، أو الهيدروكسيل جذرية القدم الطباعة13،14 ، تعطي أفكاراً في إمكانية الوصول إلى السطح من البروتينات في ظل ظروف معينة.
أسلوب آخر (الكيميائية) العابرة للربط التي تشمل الربط التساهمي من الأحماض الأمينية بالقرب من خلال مجموعات وظيفية. لهذا، هي الكواشف الكيميائية أو كواشف الأشعة فوق البنفسجية أكتيفاتابل الأحماض الأمينية العاملين15،16. بعد العابرة للربط، وعادة ما يتم تحلل البروتينات مع البروتياز و cross-linked di-الببتيدات يتم تحليلها بواسطة السائل إلى جانب اللوني الكتلي. ومع ذلك، يتطلب تحديد المنتجات العابرة للربط بقاعدة بيانات البحث، استخدام البرمجيات المتخصصة التي سلسلة الببتيد تسلسل مختلف البروتينات ومناطق متباينة17،،من1819. استخدام المواد الكيميائية كروسلينكيرس يتميز بأنه يمكن أن تستخدم لمجمع البروتين تقريبا كل الاهتمام ولا تتطلب إدماج أحماض الأمينية أكتيفاتابل الأشعة فوق البنفسجية، التي يمكن أن تتحقق فقط عند التعبير عن بروتين الفائدة في الخلايا المضيفة. على هذا النحو، العابرة للربط هو أداة مرنة واستخدمت بنجاح في العديد من الدراسات الهيكلية ل التجميعات البروتين كبيرة حتى20.
الكتلي من مجمعات البروتين سليمة (تسمى في بعض الأحيان 'أصلية' الطيف الكتلي)، من ناحية أخرى، ينطوي على تحليل البروتينات سليمة والبروتين المجمعات دون التحلل المائي في الببتيدات. أنها تكشف عن تشكيل وعدم التجانس، stoichiometry، الطوبولوجيا وفرعية لتفاعلات البروتين المجمعات،من21إلى22. في تركيبة مع التنقل أيون، يسمح الكتلي الأصلية زيادة العزم على تشكيل23،24. وهذا يجعلها أداة قوية للتحقيق الهيكلية للبروتين المجمعات التي يصعب تقييمها بالأساليب الهيكلية التقليدية. مع ذلك، يتطلب أصلي الكتلي تحليل المخازن المؤقتة التي تحافظ على تفاعلات البروتين غير التساهمية خلال التأين اليكتروسبراي. ويتم ذلك عادة باستخدام المخازن المؤقتة مائي، متقلبة مثل خلات الأمونيوم25. وباﻹضافة إلى ذلك، تعديلات أداة ضرورية لمنع الانفصال من خلال الانتقال إلى مرحلة الغاز مطياف كتلة26. يطبق في هذه الطريقة، حللت العديد من مجمعات البروتين (كبير). ومن أمثلة مثيرة للإعجاب الدراسات ريبوسوم سليمة27أو ATP سينثاسيس28أو29من الفيروسات.
مجموعة أصلية الطيف الكتلي والعابرة للربط نجاحا خاصة في الدراسات السابقة. على سبيل المثال، ستويتشيوميتريس المجمعات والوصيفة، بما في ذلك ديمر Hsp70 غير متوقع، يمكن الحصول عليها من تجارب الكتلي من المجمعات البروتين سليمة، بينما العابرة للربط الكيميائية كشفت عن ترتيبات للبروتينات في التجميعات30،31. وفي دراسة مختلفة، درست آثار التعديلات بوستترانسلاشونال على سليمة ATP synthase معقدة. قدمت أصلي الكتلي ثاقبة استقرار البروتينات المعقدة في وجود أو عدم وجود الفسفرة أو أسيتيليشن32،33. ثم كشف استراتيجية cross-linking مقارن34 التغييرات conformational من البروتين المعقدة ظروف مختلفة.
هنا، نحن نقدم البروتوكولات لتحديد البروتين الكتلي والعابرة للربط (المواد الكيميائية)، وأصلي الكتلي، بما في ذلك تحليل البيانات وتفسيرها (الشكل 1). المزيج من التكميلية النتائج المتحصل عليها من هذه الأساليب مع مساعدة مجمعين البروتين تتسم جيدا هو أظهر35. لدينا بروتوكول يمكن تطبيقها على أي تجميع البروتين الذي يمكن تنقيته في النقاء وتركيز معينة. النهج المتبع في بعض الحالات المحدودة بتحليل البيانات من البيانات، أيحجم قاعدة البيانات العابرة للربط يعمل، الذي يحدد مساحة البحث المطلوب والوقت. وباﻹضافة إلى ذلك، التحقق اليدوي من الصلات المحددة المطلوبة في كثير من الأحيان وكذلك يقلل من الإخراج. الكتلي الأصلية يقتصر معظمها نوعية العينة، مثلاً، ومخازن و adducts المستخدمة أثناء تنقية وإمكانية تبادل لهم من مخازن مائي ومتقلبة. ومع ذلك، قد مجمعات البروتين المنقي للتحليل الهيكلي عادة الجودة المطلوبة لتحليل ناجحة مع البروتوكولات لدينا.
Protocol
1-تنقية البروتين المجمعات
- تعد البروتينات المعقدة وفقا للبروتوكولات القياسية الأمثل.
ملاحظة: البروتوكول يتضح هنا مع مجمع RvB1/B2 من ثيرموفيلوم Chaetomium و synthase فوسفات كاربامويل (CPS) من الإشريكيّة القولونية. تم تنقية RvB1/B2 و CPS ك وصف36،37. ويتطلب كل البروتين المعقدة بروتوكولا تنقية فردية. تعديل البروتوكول تبعاً لذلك. ينبغي أن تستخدم مخازن خالية من أمين مثل الفوسفات مخزنة المالحة (PBS) أو حمض 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic (حبيس) للمواد الكيميائية العابرة للربط. يستعاض عن المخزن المؤقت أثناء تنقية إذا كان ذلك ممكناً.
تنبيه: لا تنطبق أية أساليب أو الكواشف التي تخل بالجمعية الأصلية من البروتين المعقدة.
2. تحديد البروتين الجماعي القائم على قياس الطيف الكتلي
-
التفريد هلام
ملاحظة: تتوفر أنظمة مختلفة جل وكل مختبر يستخدم برنامج الإعداد الخاص به. ضبط الشروط وفقا لنظام جل. ارتداء القفازات ومعطف مختبر في جميع أنحاء البروتوكول كما كراتين من بين الملوثات الأكثر شيوعاً في تحليل والمطيافيه الجماعية.- تطبيق 7.5 المخزن المؤقت للعينة 4 x ميليلتر وعامل تخفيض 10 x ميليلتر 3 (التركيز النهائي 50 مم ديثيوثريتول (DTT)) إلى 20 عينة البروتين ميليلتر. استخدام 10 ميكرون CPS أو 2.5 ميكرون RvB1/B2. زيادة ونقصان لأسفل لمدة 1 دقيقة في 16,200 ز × والحرارة لمدة 10 دقائق عند 70 درجة مئوية.
ملاحظة: عند استخدام نظام جل مختلفة ضبط الكميات المطلوبة، ودرجة حرارة التدفئة. - تحضير هلام تدرج 4-12% للتفريد. تمييع المخزن المؤقت تشغيل 20 مرة مع المياه وملء قاعة التفريد. استخدام 2-حمض اثانيسولفونيك (N-morpholino) (MES) المخزن المؤقت للبروتينات للوزن الجزيئي الأصغر (كاتشين 2-200) و 3-حمض بروبانيسولفونيك (N-morpholino) (والمماسح) المخزن المؤقت للبروتينات الكبيرة (كاتشين 14-200). إضافة مضادات الأكسدة مل 0.5 إلى الدائرة الداخلية.
ملاحظة: عند استخدام نظام جل مختلفة إعداد المخزن المؤقت قيد التشغيل والهلام وفقا لبروتوكولات الشركة المصنعة. - تحميل علامة مناسبة من بروتين (ملطخة مسبقاً، أونستينيد، مختلفة الأحجام الجزيئية) في تجويف الأولى وتحميل عينات البروتين في تجاويف المتبقية.
- منفصلة من البروتينات لمدة 35 دقيقة (MES) أو 50 دقيقة (والمماسح) 200 V.
ملاحظة: ضبط الأوقات التفريد والجهد لجل مختلف النظم. - وصمة عار للعصابات البروتين، نقل الهلام في جل تلطيخ مربع وتغطي الهلام مع أخذ المياه القائمة تلطيخ الحل. تبني بين عشية وضحاها، وفي درجة حرارة الغرفة على شاكر جل أفقي.
- ديستين الهلام بالاستعاضة عن حل المصبوغة بالمياه. كرر هذه الخطوة عدة مرات (حوالي 3-5 مرات) حتى تظهر الخلفية هلام واضحة.
- تطبيق 7.5 المخزن المؤقت للعينة 4 x ميليلتر وعامل تخفيض 10 x ميليلتر 3 (التركيز النهائي 50 مم ديثيوثريتول (DTT)) إلى 20 عينة البروتين ميليلتر. استخدام 10 ميكرون CPS أو 2.5 ميكرون RvB1/B2. زيادة ونقصان لأسفل لمدة 1 دقيقة في 16,200 ز × والحرارة لمدة 10 دقائق عند 70 درجة مئوية.
-
الهضم في جل
ملاحظة: لتفادي التلوث، استخدام المذيبات الصف [هبلك] في جميع أنحاء البروتوكول الهضم ولجميع الخطوات التالية (أي، التحليل الشامل والمطيافيه). إعداد جميع الحلول قبل الاستخدام والمياه filtrate وبيكربونات الأمونيوم.- قطع العصابات البروتين التي هي تصور بأخذ الأزرق وصمة عار من الجل باستخدام مشرط. قطع بعناية نطاقات البروتين إلى قطع صغيرة من حوالي 1 مم × 1 مم. شطف مشرط مع المياه بين عصابات مختلفة من البروتين. أغسل العصابات هلام مع الماء والاسيتو الانيتريل (ACN).
- تخفيض سندات الميثيل مع DTT، الكيلات بقايا السيستين مع إيودواسيتاميدي، وكما سبق ذكره هضم البروتينات مع التربسين38؛ عادة ما يتم استخدام إنزيم: بروتين نسبة 01:20 تصل إلى 1: 100. استخدام بيكربونات الأمونيوم 100 ملم خلال بروتوكول الهضم.
- استخراج الببتيدات في خطوتين.
- أولاً احتضان القطع هلام مع بيكربونات الأمونيوم وتزاول، وجمع المادة طافية المحتوية على الببتيد. وثانيا، احتضان القطع هلام مع حمض الفورميك 5% (v/v)، وتزاول. احتضان لمدة 15 دقيقة في كل خطوة. الجمع بين كلا سوبيرناتانتس. جاف الببتيدات المستخرجة من تبخر المذيبات في فراغ للطرد مركزي.
ملاحظة: يمكن تخزين الببتيدات المجففة في-20 درجة مئوية لعدة أشهر.
- أولاً احتضان القطع هلام مع بيكربونات الأمونيوم وتزاول، وجمع المادة طافية المحتوية على الببتيد. وثانيا، احتضان القطع هلام مع حمض الفورميك 5% (v/v)، وتزاول. احتضان لمدة 15 دقيقة في كل خطوة. الجمع بين كلا سوبيرناتانتس. جاف الببتيدات المستخرجة من تبخر المذيبات في فراغ للطرد مركزي.
-
السائل إلى جانب اللوني الكتلي
- حل الببتيدات المجففة في حمض الفورميك ACN/0.1% 2%. يذوب الببتيدات في حمام سونيكيشن 2-3 دقيقة وتدور إلى أسفل في أجهزة الطرد مركزي في 16,200 س ز عن 30 دقيقة نقل العينات في قارورة أوتوسامبلير.
ملاحظة: ضبط حجم وفقا لمقدار البروتين. لعصابات أخذ الملون جيدا نستخدم 20 ميليلتر. - ضخ 5 ميليلتر العينة إلى نظام نانو-LC-MS/MS باستخدام في أوتوسامبلير. تحميل الخليط الببتيد على عكس مرحلة C18 عمود قبل (C18، 150 ميكرومتر الهوية، 2 سم، وحجم المسام ميكرومتر 5) تحلية وتركز الببتيدات على الإنترنت.
- استخدام حمض الفورميك 0.1% (v/v) المرحلة المتنقلة A وحمض الفورميك ACN/0.1% (v/v) 80% المحمول المرحلة باء منفصلة الببتيدات في عمود C18 عكس مرحلة تحليلية (C18, 75 ميكرون الهوية، 50 سم، حجم المسام 3 ميكرومتر) استخدام رج ب 4-80% (التي تحتوي على حمض الفورميك 0.1 ٪) في 300 nL/ دقيقة أكثر من 65 دقيقة.
ملاحظة: يتم استخدام مصدر أيون نانوسبراي لنقل الببتيدات التيد مطياف كتلة. - استخدام شروط مللي ثانية (نموذجي): رش جهد 1.6 كيلو فولت؛ الشعرية درجة حرارة 250 درجة مئوية؛ الاصطدام تطبيع الطاقة من 30. تعمل مطياف الشامل في الوضع تعتمد على البيانات.
- الحصول على مرض التصلب العصبي المتعدد الأطياف في محلل الشامل (مثلاً، أوربيتراب) (350−1 m/z، 600) مع قرار من 70,000 وهدفا تحكم الربح تلقائي من 3 × 106. حدد 20 الأيونات الأكثر كثافة لتجزئة مشاريع التنمية البشرية هدف مراقبة كسب تلقائي 1 × 105. بشكل حيوي تستبعد مسبقاً بتحديد أيونات لاستبعاد س. 30 منفردة اتهم الأيونات وكذلك الأيونات مع الدولة رسوم غير معترف بها.
ملاحظة: تم إجراء المعايرة الداخلية من أطياف الشامل استخدام الشامل خيار قفل39.
- حل الببتيدات المجففة في حمض الفورميك ACN/0.1% 2%. يذوب الببتيدات في حمام سونيكيشن 2-3 دقيقة وتدور إلى أسفل في أجهزة الطرد مركزي في 16,200 س ز عن 30 دقيقة نقل العينات في قارورة أوتوسامبلير.
-
البحث في قاعدة البيانات
ملاحظة: هناك برامج مختلفة متاحة للبحث في قاعدة البيانات. ماكسكوانت40، على سبيل المثال، متاحة بحرية.- تحويل ملفات.raw-.mgf--الملفات باستخدام أداة تحويل بكستراكت (http://pfind.ict.ac.cn/downloads.html).
- إجراء بحث قاعدة البيانات باستخدام معايير بحث نموذجي: قاعدة البيانات، سويسبروت؛ الببتيد التسامح الشامل، 10 جزء في المليون؛ بلغة التسامح الشامل، دا 0.5؛ إنزيم, التربسين؛ مواقع الانقسام وغاب، 2؛ التعديلات متغيرة، كارباميدوميثيليشن (سيستين) وأكسدة (ميثيونين).
ملاحظة: تغيير معلمات البحث وفقا لإعدادات التجريبية. - تفقد نتيجة البحث قاعدة البيانات. تقييم درجة البروتين، وعدد من الببتيدات المحددة، عشرات الببتيد، ودقة الشامل؛ إرجاع تغطية تسلسل البروتين التغطية المحددة.
ملاحظة: على كل محرك البحث خوارزمية التهديف الفردية. تقييم الببتيد سجل النظام بنوعية الأطياف الشامل جنبا إلى جنب ولاحظ. يجب أن تظهر الإشارات الرئيسية من طائفة جيدة سلسلة أيون (كامل) للتحقق من الببتيد التي تم تحديدها. عادة ما تكون النتيجة الببتيد القائم على الاحتمال، أينقاط الببتيد مقياس لكيفية تسلسل الببتيد المحددة مطابقة الطيف التي يتم الحصول عليها. نقاط البروتين عادة ما تكون مشتقة من عشرات الببتيد، ويستخدم لترتيب بروتين في قائمة بروتينات التي تم تحديدها.
3-الطيف الكتلي لمجمعات البروتين سليمة (أصلي الكتلي)
- إعداد بواعث المغلفة بالذهب للتأين اليكتروسبراي
- استخدم ساحبة ميكروبيبيتي لإعداد بواعث نانوفلوو من الزجاج الشعيرات الدموية كما هو موضح سابقا25،41. استخدام البورسليكات الشعيرات الدموية قطر داخلي 0.78 مم.
ملاحظة: قبل تغيير المعلمات من أجل سحب الإبرة، تلميح الشكل والحجم يمكن تعديلها وتعديل للعينة. الشعيرات الدموية مع سمك الجدار وقطرها الداخلي مختلفة متاحة. - معطف الزجاج الشعيرات الدموية مع مواد موصلة (مثلاًأو الذهب أو البلاديوم)؛ ومن الشائع استخدام المغطى الرش توليد بلازما الذهب. اتبع إرشادات الشركة المصنعة للحصول على طلاء ذات نوعية جيدة.
ملاحظة: يجب أن يكون الطلاء كافية للحصول على رذاذ مستقرة عند تطبيق الفولتية الشعرية المشتركة (انظر أدناه).
- استخدم ساحبة ميكروبيبيتي لإعداد بواعث نانوفلوو من الزجاج الشعيرات الدموية كما هو موضح سابقا25،41. استخدام البورسليكات الشعيرات الدموية قطر داخلي 0.78 مم.
- إعداد نموذج لأصلي الطيف الكتلي
ملاحظة: الأملاح، والمنظفات، أو كميات كبيرة من الجلسرين لا تتوافق مع تاين اليكتروسبراي. ولذلك، يتم تبادل المخزن المؤقت تنقية بعازل مائي، ومتقلبة. ويشيع استخدام خلات الأمونيوم 200 ملم. استخدام حجم الاستبعاد تدور الأعمدة أو أجهزة ultrafiltration ل exchange المخزن المؤقت. وفي بعض الحالات، قد تتأثر الاستقرار معقدة أو النشاط exchange المخزن المؤقت. تقييم الأطياف الشامل بعناية والتحقق من نشاط المجمع. إضافة العوامل المساعدة أو المضافات إلى تحليل المخزن المؤقت، إذا لزم الأمر.- استخدام حجم الاستبعاد تدور أعمدة لتبادل سريع في المخزن المؤقت. إزالة المخزن المؤقت التخزين باستخدام الطرد المركزي في 1,000 س ز وتجاهل 4 درجة مئوية للحد الأدنى 1 التدفق من خلال. أغسل ثلاث مرات بإضافة 500 خلات الأمونيوم 200 ملم في ميليلتر، متبوعاً بالطرد المركزي. تحميل 20 ميليلتر من العينة البروتين على العمود والطرد المركزي ب 000 1 × ز و 4 درجة مئوية لمدة 4 دقائق.
ملاحظة: يجب أن يكون تركيز البروتين المعقدة 1-10 ميكرومتر. الإجراء الذي يمكن أن يتكرر إذا مكونات غير طيارة لا تزال تخل التحليل. - لتركيز العينة البروتين وتبادل المخزن المؤقت في نفس التجربة استخدام مرشحات الطرد المركزي. استخدام غشاء ترشيح المسام حجم 50% أصغر من حجم البروتينات تم تحليلها.
- نقل العينة البروتين في جهاز الترشيح وإضافة خلات الأمونيوم 200 ملم. وتدور إلى أسفل في 15,000 س ز تجاهل التدفق من خلال. إضافة خلات الأمونيوم 200 ملم، وكرر الطرد المركزي. كرر هذه الخطوة عدة مرات. اتبع تعليمات الشركة المصنعة من أجل سرعة الطرد المركزي. إجراء الطرد المركزي في 4 درجات مئوية.
تنبيه: بروتينات الغشاء تميل إلى أن يعجل في غشاء الجهاز عامل التصفية.
- نقل العينة البروتين في جهاز الترشيح وإضافة خلات الأمونيوم 200 ملم. وتدور إلى أسفل في 15,000 س ز تجاهل التدفق من خلال. إضافة خلات الأمونيوم 200 ملم، وكرر الطرد المركزي. كرر هذه الخطوة عدة مرات. اتبع تعليمات الشركة المصنعة من أجل سرعة الطرد المركزي. إجراء الطرد المركزي في 4 درجات مئوية.
- استخدام حجم الاستبعاد تدور أعمدة لتبادل سريع في المخزن المؤقت. إزالة المخزن المؤقت التخزين باستخدام الطرد المركزي في 1,000 س ز وتجاهل 4 درجة مئوية للحد الأدنى 1 التدفق من خلال. أغسل ثلاث مرات بإضافة 500 خلات الأمونيوم 200 ملم في ميليلتر، متبوعاً بالطرد المركزي. تحميل 20 ميليلتر من العينة البروتين على العمود والطرد المركزي ب 000 1 × ز و 4 درجة مئوية لمدة 4 دقائق.
- التحليل الشامل والمطيافيه مجمعات البروتين سليمة
ملاحظة: هناك أنواع مختلفة من المطيافات جماعي من الشركات المصنعة المختلفة التي يمكن تعديلها لأصلي الكتلي، مثلاً، الرباعي (س-ToF) وقت الطيران مطيافات الشامل أو مطيافات الشامل أوربيتراب. تم تنفيذ البروتوكول، المذكورة أدناه على صك Q ToF.- ضع الشعرية المغلفة بالذهب في حامل الشعرية وملء شعري مع 1-4 ميليلتر من عينة البروتين. فتح غيض الإبرة الملاقط.
- الاتصال صاحب الشعرية مع مصدر نانو-اليكتروسبراي وضبط الموضع الشعرية. ضع نصيحة شعري في 0.5-1.5 سم إلى الفوهة مخروط. استخدام غاز نانوفلوو 80-150 لتر في الساعة للبدء الرش وضبط تدفق الغاز للحفاظ على رذاذ مستقرة.
- ضبط معلمات في اللحن-الصفحة الصك Q ToF. شروط انطلاق نموذجية: الشعرية الجهد، 1.50 كيلو فولت؛ مخروط الجهد، 80 الخامس؛ الطاقة الترددات اللاسلكية العدسة 1، 80 الخامس؛ الطاقة الاصطدام، 20 الخامس؛ الفتحة 3، 13.6 ضد تعديل هذه المعلمات للحصول على الأطياف جماعية جيدة. بدء شراء عن طريق النقر فوق الزر "الحصول على" والجمع بين العديد من الأشعة قدر الإمكان للحصول على مجموعة أسلحة جيدة.
ملاحظة: أننا نوصي بالجمع بين المسح على الأقل 100.
- الكتلي جنبا إلى جنب لمجمعات البروتين سليمة
- الحصول على الطيف الشامل كما هو موضح أعلاه (بروتوكول القسم 3.3). اختر أيون السليفة بروتين معقدة.
- تغيير من مرض التصلب العصبي المتعدد في وضع MS/MS في الحصول على الملف. تعيين التحديد MS/MS للسلائف الكتلة.
- البدء في الحصول على الطاقة منخفضة الاصطدام. الجمع بين عدة بمسح (مسح حوالي 20) للتحقق من تحديد السلائف الصحيح الشامل. زيادة طاقة الاصطدام حتى تنأى بالبروتين المعقدة. للحصول على الجمع بين طائفة أسلحة جيدة فحص 500 على الأقل.
ملاحظة: قد جردت المجمعات أحياناً كثافة منخفضة. الجمع بين مسح أكبر عدد ممكن قد يؤدي إلى زيادة نسبة القرار والإشارات إلى الضجيج.
- الانفصال في حل من مجمعات البروتين سليمة
ملاحظة: للتبصر إضافية في تفاعلات البروتين داخل مجمعات البروتين، يمكن إجراء الانفصال في الحل.- إعداد عينة البروتين كما هو موضح أعلاه (القسم 3.2). إضافة المذيبات للعينة البروتين أو تغيير درجة الحموضة إلى أيوناتها مجمعات سليمة في المجمعات الفرعية. المذيبات النموذجية هي الميثانول، والكحول، وتزاول؛ تغيير درجة حموضة خلات الأمونيوم قبل إضافة محلول الأمونيا أو حمض الخليك. الحصول على الأطياف الشامل كما هو موضح أعلاه (الفرعان 3.3 و 3.4).
- تختلف كمية المذيب أو الرقم الهيدروجيني النطاق لإنشاء المجمعات الفرعية المختلفة. بشكل عام، كمية المذيب هو 5-50% (تركيز النهائية) ومجموعة نموذجية الأس الهيدروجيني 4-9. تبدأ بتركيز منخفض من المذيبات (5%) أو تغييرات طفيفة في درجة الحموضة واكتساب طائفة جماعي (انظر القسم 3.3).
- زيادة كمية المذيب أو تغيير درجة الحموضة تدريجي حتى يتم إنشاء المجمعات الفرعية في الحل. الحصول على الأطياف الشامل لتحليل المجمعات الفرعية.
- معايرة البيانات
ملاحظة: يتم معايرة أطياف الجماعية المكتسبة خارجياً باستخدام الحل (منظمة التضامن المسيحي الدولية) يوديد السيزيوم.- حل 100 مغ منظمة التضامن المسيحي الدولية في 1 مل من الماء.
- الحصول على طيف شامل من منظمة التضامن المسيحي الدولية. وتختلف الطاقة الاصطدام للحصول على مجموعات منظمة التضامن المسيحي الدولية على نفس النطاق m/z كالبروتين المعقدة تحليله أعلاه.
تنبيه: منظمة التضامن المسيحي الدولية بسرعة رواسب في طرف باعث ويلوث المخروط. اكتساب فقط كالعديد من مسح كما هو مطلوب للحصول على طائفة كافية. إزالة الباعث من المصدر عند الانتهاء. - جعل ملف معايرة باستخدام الطيف الجماعية المكتسبة وهو ملف مرجعي منظمة التضامن المسيحي الدولية.
- تطبيق معايرة أطياف الجماعية المكتسبة.
تنبيه: معايرة الأطياف الشامل قد يكون تغيير دائم للبيانات الخام. إذا كانت هناك حاجة إلى الأطياف غير محسوبة، إجراء نسخة احتياطية من الملف.
- تجهيز البيانات وتحليلها
ملاحظة: هناك العديد من أدوات البرمجيات متاحة بحرية لتحليل البيانات الأصلية الأطياف الشامل؛ على سبيل المثال، مسن42 أو أونيديك43. ويصف البروتوكول أدناه تحليل البيانات يدوياً مع مساعدة البرمجيات الصك، فضلا عن استخدام مسن للعينات المعقدة. هذا البرنامج مناسبة تماما لتحليل الأطياف أسلحة معقدة. اتبع الإرشادات المتوفرة على الإنترنت لاستخدام البرنامج (http://massign.chem.ox.ac.uk/).- لتحليل البيانات، على نحو سلس الأطياف بضبط معلمات التنعيم. Centroid الأطياف بضبط معلمات. حساب الجماهير معقدة من قمم متجاورة اثنين من البروتين المعقدة ' ذروة المغلف باستخدام أداة من أدوات البرمجيات.
تنبيه: تجانس مكثفة جداً قد يتسبب في فقدان البيانات (مثلاً، فقدان يغاندس منضم). - لمزيد من التحليل مع مسن42، إنشاء قائمة ذروة الطيف الشامل. لينيريزي نقاط البيانات من الطيف وسلس. استخدام مختلف أدوات البرمجيات لتعيين البروتين المجمعات، وحساب تركيبة معقدة، أو محاكاة مغلفات ذروة المعقدة.
- لتحليل البيانات، على نحو سلس الأطياف بضبط معلمات التنعيم. Centroid الأطياف بضبط معلمات. حساب الجماهير معقدة من قمم متجاورة اثنين من البروتين المعقدة ' ذروة المغلف باستخدام أداة من أدوات البرمجيات.
4-المواد الكيميائية العابرة للربط المتقارنة "قياس الطيف الكتلي"
ملاحظة: هناك العديد من استراتيجيات cross-linking المتاحة. وهنا يصف لنا استخدام سبرات مكررا (سولفوسوكسينيميديل) (BS3)، رد الفعل أمين كروسلينكير الذي يستخدم عادة لدراسة تفاعلات البروتين البروتين.
- حل مغ 1.43 BS3 في 100 ميليلتر المياه لإعداد حل أسهم 25 مم.
ملاحظة: الكواشف الأخرى مثل ديسوكسينيميديل سوبيراتي (DSS) ليست للذوبان في الماء، وعادة ما يتم حله في ثنائي ميثيل سلفوكسيد ([دمس]). وتتوفر أيضا بعض كروسلينكيرس في أشكال المسمى نظير الثقيلة. إدماج نظائر الثقيلة يولد أزواج الذروة من الببتيدات دي cross-linked في مرض التصلب العصبي المتعدد الأطياف، مما يساعد أثناء تقييم البيانات. عند استخدام خلطات المسمى كروسلينكيرس، وتعد حلول الأسهم من كلا الخيارين ومختلطة 1:1.
تنبيه: لتفادي التفكك للبروتين المجمعات من [دمس]، هو إعداد والمخفف بالماء أو المخزن المؤقت قبل رد فعل cross-linking حلاً أسهم مركزة بشكل كبير. - إضافة BS3 إلى البروتين المعقدة. استخدام كميات مختلفة من BS3 تتراوح بين 0.5-5 ملم لتحديد تركيز كروسلينكير الأمثل. احتضان الخلائط رد الفعل عند 25 درجة مئوية ح 1 في ثيرموميكسير. استخدام المواد الهلامية المتدرجة 4-12%، وأداء الحزب الديمقراطي الصربي صفحة لتقييم نتائج العابرة للربط (انظر الشكل 2 على سبيل مثال).
ملاحظة: يتم التوصل إلى تركيز BS3 الأمثل عند أعلى نطاقات البروتين الوزن الجزيئي، والتي تكون غير مرئية في عنصر التحكم غير الصليب مرتبطة، يتم الحصول عليها من خلال الحزب الديمقراطي الصربي صفحة مفارز واحد بينما لا تزال مرئية (الشكل 2). - كرر رد فعل cross-linking مع تركيز BS3 الأمثل. احتضان الخلائط رد الفعل عند 25 درجة مئوية ح 1 في ثيرموميكسير.
ملاحظة: بعض مجمعات البروتين ليست مستقرة في درجة حرارة الغرفة. يمكن أيضا إجراء رد فعل كروسلينكينج على الجليد؛ ومع ذلك، وقت رد الفعل يحتاج إلى تعديل. -
إخماد رد فعل كروسلينكينج بإضافة أمين المخزن المؤقت (مثلاً50-100 ملم تريس المخزن المؤقت، ودرجة الحموضة 7.5، التركيز النهائي) أو القيام بهطول الأمطار الإيثانول لإزالة أي كاشف cross-linking المتبقية.
- إضافة المياه أو المخزن المؤقت إلى خليط التفاعل للوصول إلى وحدة تخزين نهائي 200 ميليلتر. إضافة 600 ميليلتر المثلج الإيثانول و 20 م 3 ميليلتر خلات الصوديوم، درجة الحموضة 5.3. مزيج دقيق واحتضان في-20 درجة مئوية ح 2 أو بين عشية وضحاها.
ملاحظة: بدلاً من ذلك، البروتينات يمكن أن تكون عجلت في 80 درجة مئوية لمدة 30 دقيقة، أو في نيتروجين سائل. - وتدور إلى أسفل في 16,200 س ز 4 درجات مئوية عن 30 دقيقة بعناية إزالة المادة طافية.
- أغسل بيليه مع 1 مل المثلج الإيثانول 80% (v/v). وتدور إلى أسفل في 16,200 س ز 4 درجات مئوية عن 30 دقيقة بعناية إزالة المادة طافية. جاف بيليه في فراغ للطرد مركزي.
- إضافة المياه أو المخزن المؤقت إلى خليط التفاعل للوصول إلى وحدة تخزين نهائي 200 ميليلتر. إضافة 600 ميليلتر المثلج الإيثانول و 20 م 3 ميليلتر خلات الصوديوم، درجة الحموضة 5.3. مزيج دقيق واحتضان في-20 درجة مئوية ح 2 أو بين عشية وضحاها.
- أداء الحزب الديمقراطي الصربي صفحة البروتينات cross-linked. قطع العصابات جل وهضم البروتين في الجل كما هو موضح أعلاه (الفرعان 2-1 و 2، 2).
ملاحظة: يمكن أيضا إجراء الهضم في الحل، ولكن عادة ما يتطلب خطوات انفصال إضافية (مثلاً، حجم الاستبعاد اللوني من الببتيدات هضمها). -
تنفيذ السائل إلى جانب اللوني الكتلي كما هو موضح أعلاه (الفرع 2-3). كما أن الببتيدات cross-linked عادة انخفاض وفيرة، تطبيق الاختلافات التالية في تحليل والمطيافيه جماعية لزيادة العمق التحليلي للعينة cross-linked.
- استخدام التدرجات أطول خلال الفصل اللوني السائل (مثلاً، 90 دقيقة بدلاً من 65 دقيقة، انظر أعلاه).
- استبعاد الببتيدات مشحون مضاعفاً من تجزئة مشاريع التنمية البشرية.
ملاحظة: الببتيدات مشحونة بمضاعفة هي عادة داخلها-المشتركة-ربط الببتيدات ("حلقة الببتيدات" أو متقاطعة "اكتب 1"). - عند استخدام خلطات المسمى الكواشف العابرة للربط، استخدم الخيار "ذروة الانتقاء" أثناء التحليل، أي، يتم تشغيل تجزئة مشاريع التنمية البشرية بوجود أزواج ذروة تعريف الاختلاف الشامل في الأطياف الشامل.
ملاحظة: الخيار "الانتقاء الذروة" قد لا تتوفر على كل مطياف كتلة.
- استخدام طقطقة البرنامج18 لتحديد هوية الببتيدات دي cross-linked. استخدام قواعد البيانات المصغرة لتحديد الهوية. معلمات البحث نموذجية: صك الأطياف، مشاريع التنمية البشرية؛ إنزيم, التربسين؛ كحد أقصى. مواقع الانقسام وغاب، 3؛ التعديلات متغير، أكسدة (ميثيونين) وكارباميدوميثيليشن (سيستين)؛ كروسلينكير، BS3؛ أدنى طول الببتيد، 4؛ كحد أقصى. طول الببتيد، 100؛ الحد الأدنى الببتيد الجماهيري، دا 400؛ كحد أقصى. كتلة الببتيد، 10,000 دا؛ فرانكلين روزفلت، 1%.
ملاحظة: عند استخدام خلطات المسمى كروسلينكيرس، يجب أن يتم تكوين هذه الزيادة الجماعية الناجمة عن الرابط. وهناك أيضا برامج أخرى تستخدم عادة لتحديد قياس، مثلاً، إكسكويست17، ماسماتريكس19، أو إكسلينككس15. - تقييم نتائج البحث قاعدة بيانات نوعية من الأطياف التجزؤ. يجب أن تظهر أطياف مقبولة من الصلات أيون سلسلة من كلا الببتيدات (على الأقل 4 أيونات متجاورة) بنسبة الإشارة إلى الضوضاء معقولة.
ملاحظة: عند استخدام خلطات المسمى الكواشف العابرة للربط، يمكن استخدام أزواج الذروة في مرض التصلب العصبي المتعدد الأطياف كعنصر تحكم نوعية إضافية. - إذا لزم الأمر، تصور النتائج cross-linking في شبكات التفاعل البروتين باستخدام أدوات البرمجيات (مثلاً، إكسفيس، إكسينيت). استخدام شريط المؤامرات أو دائرية المؤامرات للتصور لتفاعلات البروتين.
ملاحظة: كل أدوات البرمجيات متاحة بحرية على ملقم ويب. اتبع تعليمات مفصلة على المواقع الخاصة بكل منها (https://xvis.genzentrum.lmu.de/ و http://crosslinkviewer.org/).
النتائج
التحليل الهيكلي للبروتينات والمجمعات وهي تشكل شرطا أساسيا لفهم وظيفتها. ويساهم الكتلي كثيرا التحقيق الهيكلية في ذلك فإنه يمكن تطبيقها على تقريبا كل مجمع للفائدة بغض النظر عن حجم أو عينة من عدم التجانس. نحن مثالاً على البروتوكول باستخدام مجمعين البروتين تتسم جيدا؛ أولاً، هترو-دوديكامير RvB1/B2 من ثيرموفيلوم جيم ، والثانية، ومجلة الأحوال الشخصية المعقدة من كولايهترو-أوكتاميريك.
أولاً، نحن تحديد مكونات البروتين من المجمعات اثنين. ولهذا الغرض، تم فصل البروتينات بالحزب الديمقراطي الصربي صفحة (الشكل 2) وتم قطع العصابات جل من الجل. بعد الهضم-جيل من البروتينات، خليط الببتيد تم تحليلها بواسطة السائل إلى جانب اللوني الكتلي والجماهير الببتيد ويفتت تعرضوا للبحث في قاعدة البيانات. اتباع سير العمل هذا، حددنا جميع مفارز البروتين من المجمعات اثنين بثقة عالية، أي، لوحظ عدد كبير من الببتيدات الببتيد معقول عشرات مما أسفر عن تغطية تسلسل عالية لجميع وحدات البروتين (1 الجدول ).
ثم قمنا بتحليل سليمة RvB1/B2 المعقدة بأصلي الطيف الكتلي (الشكل 3A). وكشفت الطيف الشامل الأنواع اثنين، أحدهما في حوالي 8,000 m/z وأنواع أخرى في حوالي الساعة 11,000-12,000 m/z. الجماهير المحسوبة لهذه الأنواع تناظر الحلقة3 3(RvB2) هيكساميريك (RvB1) (حوالي 310 كاتشين) ودوديكاميريك الحلبة المزدوجة (RvB1)6(RvB2)6 (حوالي 620 كاتشين). تظهر سلسلة ذروة كل اثنين من السكان؛ وهذه تأتي من خليط مفارز RvB2 صاحب معلم ومعلم في المجمعات. بنية بلورية لمجمع RvB1/B2 سابقا الحصول على36 ويبين ترتيب المزدوج-الحلبة (الشكل 3B). ولذلك يؤكد ستويتشيوميتري دوديكامير سليمة الطيف الشامل الأصلية وعلاوة على ذلك يكشف عن مجمع الفرعية مستقرة. وبالإضافة إلى ذلك، يتم تعريف السكان القائمة حاليا.
لتحديد مواقع التفاعل البروتين في مجمع RvB1/B2، كيميائيا تصميمهما المجمع المنقي مع كروسلينكير BS3. أولاً نحن تيتراتيد مبلغ BS3 أثناء عملية التفاعل cross-linking لتحديد تركيز الأمثل. BS3 هو أمين على حدة وتساهمي روابط سلاسل الجانب يسين، فضلا ن-تيرميني للبروتينات. وأعقب كروسلينكينج رد فعل الحزب الديمقراطي الصربي صفحة (الشكل 2A). وأظهرت المجمع غير مرتبطة عبر مفارز RvB1 و RvB2. إضافة BS3 إلى خليط رد فعل بسبب الروابط التساهمية من البروتينات الناتجة في نطاقات البروتين في الوزن الجزيئي أعلى. هلام مخزونات النشر الاستراتيجي يبين أن كميات متزايدة من BS3 تسفر عن كميات أعلى من الأنواع cross-linked بينما خفضت مفارز مرتبطة عبر غير البروتين. ثم قطع العصابات البروتين من الجل ويتبع البروتوكول المذكور أعلاه لتحديد مواقع التفاعل البروتين. ويرد طيف مثال من دي cross-linked-الببتيد (الشكل 3). يظهر الطيف أيون y سلسلة من الببتيدات كلا يؤكد هذا التفاعل البروتين. وفي المجموع، حصلنا على 14 تفاعلات البروتين، بما في ذلك أربعة من الصلات بين الوحدات الفرعية RvB1 و RvB2 وهما الصلات بين نسختين من RvB2 (الجدول 2). هي تصور النتائج من BS3 العابرة للربط في شبكة تفاعل (الشكل 3D) تبين التفاعلات داخل الجزيئية فضلا عن التفاعلات بين الوحدات الفرعية المختلفة. الصلات داخل الجزيئي تشير إلى أن أمثال مفارز RvB1 و RvB2 بطريقة أن المجالات الطرفي ن وج بالقرب. ملاحظة، أن التفاعلات الجزيئية داخل لا يمكن تمييزها من التفاعلات الجزيئية بين فرعية نفسه في هذه الحالة. ولوحظت أيضا الصلات بين الجزيئية بين وحدتين فرعيتين. هذه، يمكن تصور الصلات بين الجزيئية اثنين بين RvB1 و RvB2 في بنية التحقق من صحة النهج الذي كروسلينكينج. الصلات بين جزيئية أخرى تقع في حلقات مرنة وغير مضمنة في بنية بلورية. كما حددنا الصلات اثنين في RvB2 التي تحتوي على تسلسلات الببتيد نفسه. لا لبس فيه يمكن تصنيف هذه الصلات ما بين الجزيئية كما أنها يجب أن تنبع من نسختين من نفس البروتين (3D الشكل). لدينا تجارب cross-linking تكشف مواقع التفاعل البروتين داخل المجمع ولكن أيضا داخل مفارز البروتين توفير ثاقبة على الترتيب الهيكلي الذي يمكن أن تؤكده أيضا بنية بلورية القائمة (الشكل 3B).
وكان مجمع البروتين الثاني الذي درسنا CPS. وكشفت الطيف الشامل الأصلي (الشكل 4 أ) ثلاثة مجمعات البروتين بين 6,000 و 12000 m/z. مجمع أكبر من 640 كاتشين يناظر سليمة هترو-أوكتامير. المجمعات الأصغر تمثل اثنين من المجمعات الفرعية؛ ديمر مفارز CPS الصغيرة والكبيرة (160 كاتشين) وهترو-تيترامير التي تحتوي على نسختين من كل وحدة فرعية (كاتشين 320). تسليم هذه المجمعات الفرعية الأولى ثاقبة الجمعية البروتين؛ أي، مفارز كبيرة وصغيرة في الاتصال المباشر (كما كشفت عنها هترو-ديمر) وتيترامير قد يكون نتاج dimers اثنين. للحصول على مزيد من المعلومات حول هذا الترتيب الهيكلي في مجلة الأحوال الشخصية سليمة المعقدة، أجرينا جنبا إلى جنب الكتلي (MS/MS) هترو-أوكتامير وهترو-تيترامير. وفي كلتا الحالتين، فرعية صغيرة لفصلها عن السلائف مما يشير إلى أن وحدة فرعية صغيرة تقع في محيط الجمعية العامة (الشكل 4 باء). في الواقع، فرعية صغيرة هامشية في الهيكل (الشكل 4) كريستال المتاحة44.
وأجرى أيضا العابرة الكيميائية للربط باستخدام كروسلينكير BS3. استخدام كميات متزايدة، تعززت الروابط التساهمية من مفارز CPS. وبعد الهضم البروتينات والتحليل من الببتيدات كما هو موضح أعلاه، تم الحصول على العديد من تفاعلات البروتين داخل وحدة فرعية كبيرة وقياس واحد في وحدة فرعية صغيرة (الجدول 2). وباﻹضافة إلى ذلك، مماثلة لمجمع RvB1/B2، وجدنا اثنين الصلات بين الجزيئية بين نسختين فرعية CPS كبيرة. ضع هذه الصلات وحدتين فرعيتين الكبيرة التي تواجه بعضها البعض في الجانبين ج--المحطة الطرفية. وفي دراسة سابقة، الجمع بين الكتلي الهيكلية و35من النمذجة الحاسوبية، حددنا ثلاثة تفاعلات إضافية في وحدة فرعية كبيرة التي على الأرجح تنبع من واجهة نسختين فرعية كبيرة يصادق عليها بنية بلورية والنموذج التي تم الحصول عليها (الشكل 4 و الجدول 2). تسمح هذه التفاعلات ترتيب صميم CPS معقدة تتألف من أربع وحدات فرعية كبيرة. ومع ذلك، لوحظت لا الصلات بين وحدة فرعية بين الوحدات الفرعية الكبيرة والصغيرة. بفحص بنية بلورية المتاحة (الشكل 4)، يصبح من الواضح أن سطح التفاعل بين لب تيتراميريك من المجمع، ويتألف من وحدة فرعية كبيرة، ومفارز صغيرة هامشية صغيرة جداً، مما قد يفسر غياب التفاعلات بين وحدة فرعية. هذا ما يؤكده الكتلي الأصلية التي أظهرت أن وحدة فرعية صغيرة تنأى بسهولة من مجمعات سليمة الأكثر احتمالاً بسبب واجهة ملزمة صغيرة. ومع ذلك، تسمح تفاعلات البروتين في مجلة الأحوال الشخصية المعقدة جنبا إلى جنب من العابرة للربط الكيميائي وأصلي الكتلي الفائتة على الترتيب الهيكلي (الشكل 4).
أخذت معا، المزيج من أصلي الطيف الكتلي والعابرة الكيميائية للربط مقترنة بالهوية الجماعية والمطيافيه من الببتيدات cross-linked، يسمح إعادة الترتيب الهيكلي لمجمعات مثال على حد سواء. بينما العابرة للربط الكيميائية كشفت عن ترتيب مفارز البروتين، على سبيل المثال أن التفاعلات بين RvB1 و RvB2، أو داخل لب تيتراميريك من مجلة الأحوال الشخصية الأصلية الكتلي تسليم ستويتشيوميتريس البروتين من المجمعات سليمة و سوبكومبليكسيس سائدة. في حالة مجلة الأحوال الشخصية، التي يمكن ملاحظة لا تفاعلات بين الجزيئية بين وحدتين فرعيتين بالعابرة للربط الكيميائي، تقترح الكتلي الأصلي أن كل وحدة فرعية كبيرة يتفاعل مع وحدة فرعية صغيرة واحدة (الشكل 4). جنبا إلى جنب الكتلي اقترح موقع طرفية فرعية صغيرة في المجمع وواجهة صغيرة بين الوحدات الفرعية على حد سواء.
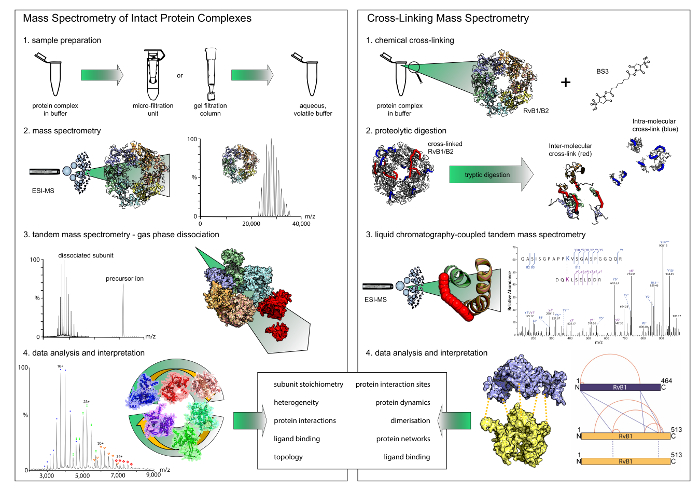
رقم 1: سير العمل الأصلي الطيف الكتلي والعابرة للربط- كلا أساليب تقديم نتائج تكميلية. بينما يكشف الكتلي الأصلي ستويتشيوميتريس ونماذج التفاعل، العابرة للربط يعطي رؤى في مواقع التفاعل البروتين داخل المجمعات. ملاحظة أن العابرة للربط الكيميائية إلا يكشف عن التفاعلات الثنائية. (أ) الخطوة الأولى في الطيف الكتلي الأصلي هو exchange المخزن المؤقت إلى المخزن مؤقت للتقلب ومائي باستخدام وحدات تصفية أو هلام الترشيح الأعمدة. ثم يكشف الكتلي من المجمعات البروتين سليمة على ستويتشيوميتري. في تجارب الكتلي جنبا إلى جنب، يتم فصل الوحدات الطرفية. (ب) العابرة للربط الكيميائي، هي المحتضنة البروتين المعقدة مع كاشف كروسلينكينج. هي يهضم البروتينات cross-linked ثم إلى الببتيدات التي يتم تحليلها في وقت لاحق بالسائل إلى جانب اللوني الكتلي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
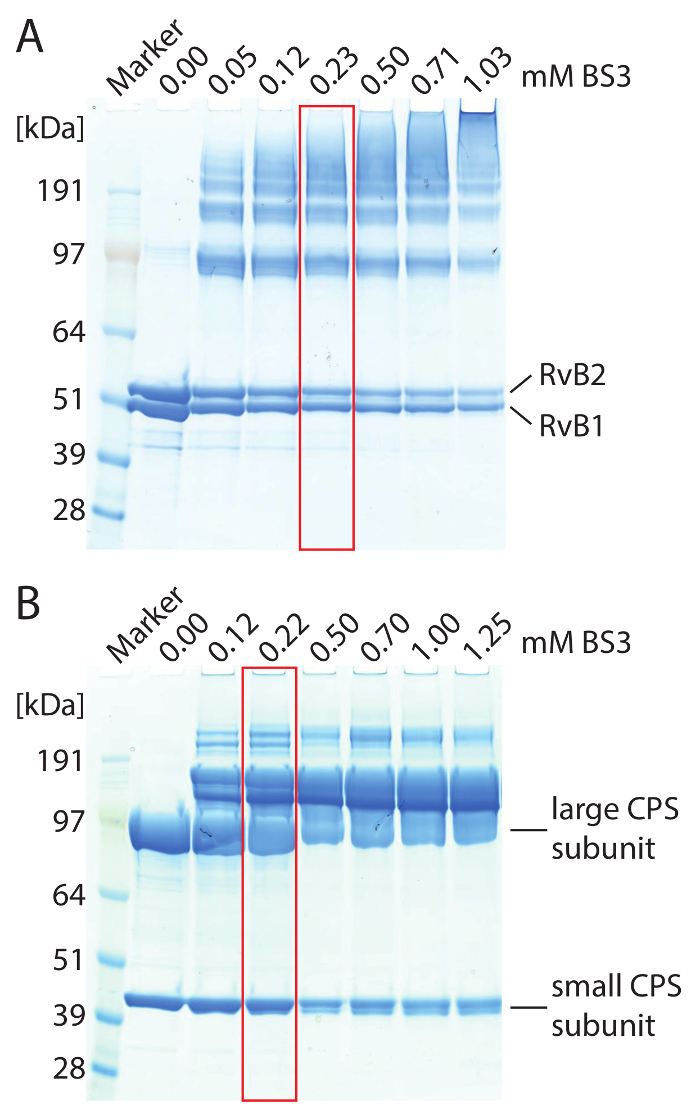
رقم 2: الحزب الديمقراطي الصربي صفحة من تصميمهما RvB1/B2 (A) ومجلة الأحوال الشخصية (ب) مجمعات. (أ) 2.5 ميكرون RvB1/B2 تم تحميل كل جل لين. وقد تفاوتت تركيز BS3. يظهر عدم-الصليب-يرتبط RvB1/B2 مفارز البروتين اثنين في حوالي 50 كاتشين. بسبب إضافة BS3 الروابط التساهمية من مفارز البروتين الناتج في نطاقات البروتين في ارتفاع الوزن الجزيئي. وتزداد كمية الأنواع cross-linked مع تركيزات أعلى BS3. الظروف المثلى العابرة للربط المميز (أحمر). (ب) 10 ميكرون CPS حملت كل جل لين. (كاتشين 90) الكبيرة والصغيرة (كاتشين 40) يتم الحصول على مفارز CPS. بسبب إضافة BS3 الروابط التساهمية من مفارز البروتين الناتج في نطاقات البروتين في ارتفاع الوزن الجزيئي. الظروف المثلى العابرة للربط المميز (أحمر). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
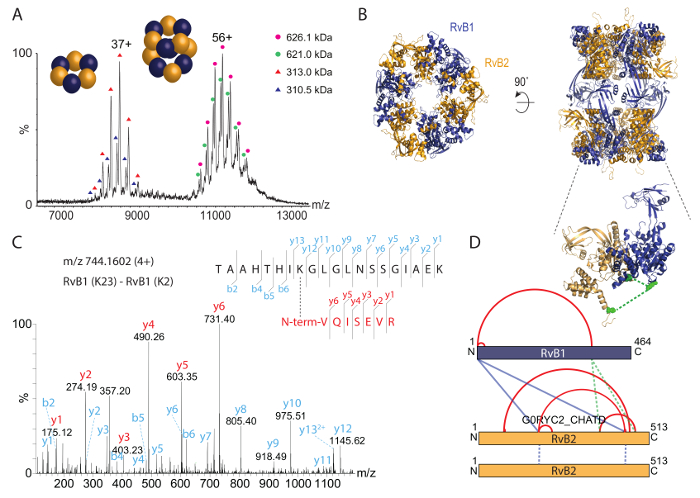
الشكل 3: الأصلي الطيف الكتلي والكيميائية العابرة للربط من RvB1/B2 المعقدة. (أ) الطيف الشامل الأصلية يكشف عن نوعين من RvB1/B2؛ سليمة دوديكامير (أي،6(RvB2) (RvB1)6) في حوالي الساعة 11,000 إلى 12,000 m/z hexameric الدائري (RvB1)3(RvB2)3 في حوالي الساعة 8,000 m/z. إظهار كلا من الأنواع اثنين السكان الناتجة عن RvB2 صاحب معلم ومعلم. وقد تم تعديل الطيف من35. ويرد هيكل (ب) الكريستال RvB1/B2 (PDB معرف 4WVY). تشكيل مفارز اثنين من حلقات hexameric التناوب RvB1 و RvB2. (ج) تجزئة مجموعة دي-الببتيد cross-linked. ن-محطة RvB1 تم cross-linked مع K23 من RvB1. وتم الحصول على سلسلة y-أيون لكلا الببتيدات (أحمر وأزرق). (د) داخل وبين بروتين التفاعلات التي تم الحصول عليها في مجمع RvB1/B2. داخلها بعد الروابط المشتركة تظهر باللون الأحمر، إينتيركروسلينكس تظهر باللون الأزرق. يظهر الإدراج الصلات بين الجزيئية اثنين بين الوحدات الفرعية RvB1 و RvB2 التي يمكن تصور في بنية بلورية (الأخضر، إدراج). تظهر التفاعلات التي تنشأ من نسختين RvB2 كالخطوط المنقطة الزرقاء. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
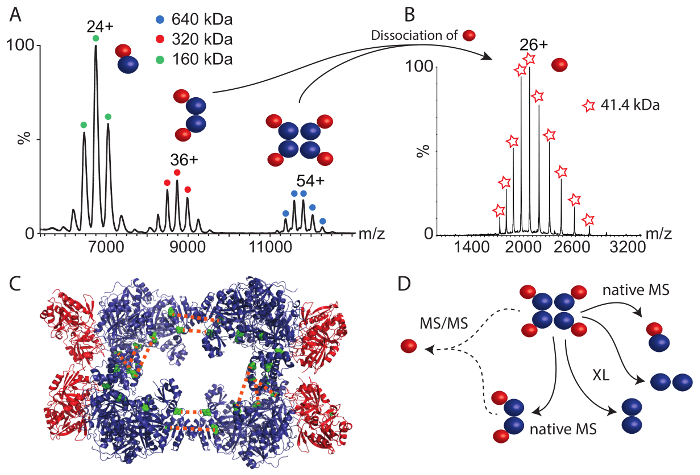
الشكل 4: أصلي الطيف الكتلي والعابرة للربط الكيميائية للبارافينات المكلورة. (أ) الطيف الشامل الأصلية من مجلة الأحوال الشخصية يظهر ثلاثة مجمعات. هترو-ديمر (كاتشين 160)، هترو-تيترامير (320 كاتشين) وهترو-أوكتامير (كاتشين 640). وقد تم تعديل الطيف من35. (ب) الكتلي جنبا إلى جنب تيتراميريك وأوكتاميريك CPS معقدة كشفت تفكك فرعية CPS الصغيرة. ويرد هيكل (ج) الكريستال للبارافينات المكلورة (PDB معرف 1BXR). مفارز كبيرة تشكل نواة تيتراميريك ومفارز صغيرة تقع في محيط المجمع. يتم إظهار الصلات بين الجزيئية بين نسختين من وحدة فرعية كبيرة (أخضر). (د) التفاعلات بين الوحدات الفرعية CPS الكبيرة والصغيرة. كشفت سوبكومبليكسيس الكتلي الأصلية وتشير إلى موقع طرفية فرعية صغيرة. الكيميائية متقاطعة تشير إلى الترتيبات في لب تيتراميريك من مجلة الأحوال الشخصية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
الجدول 1: قاعدة بيانات نتائج البحث- تم تحديد البروتينات السائلة إلى جانب اللوني الكتلي والبحث في قاعدة البيانات. أسماء البروتين، الانضمام إلى عدد، والوصف، فضلا عن البروتين تعطي الجماعية. يتم سرد نقاط البروتين وعدد من الأطياف الملحوظ في البروتين وعدد تسلسل الببتيد الملاحظة. يتم سرد الببتيدات الخمسة مع أعلى الدرجات الببتيدات التميمة لكل وحدة فرعية البروتين. اضغط هنا لتحميل هذا الملف.
الجدول 2: لاحظ متقاطعة في RvB1/B2 و CPS. يتم إعطاء الوحدات الفرعية للمجمعات وبقايا cross-linked. نوع قياس (داخل أو بين الجزيئية) كشف من تداخل الببتيد تسلسل أو دراسة سابقة35. اضغط هنا لتحميل هذا الملف.
Discussion
يتم توفير بروتوكولات للتحليل الهيكلي الشامل القائم على قياس الطيف الكتلي لمجمعات البروتين وحدة فرعية متعددة. اثنين من التقنيات، المبينة في البروتوكول، معظمهم من تسليم النتائج التكميلية ومؤهلة جيدا لاكتساب نظرة ثاقبة الترتيبات الهيكلية داخل البروتين (-يجند) المجمعات التي يصعب من الدراسة من خلال تقنيات الهيكلية التقليدية. يسلم أصلي الكتلي ثاقبة ستويتشيوميتريس البروتين، فضلا عن تفاعلات البروتين بتحليل سوبكومبليكسيس ونماذج التفاعل مستقرة. العابرة للربط، من ناحية أخرى، تعطي معلومات عن مواقع الاتصال المباشر. اعتماداً على كروسلينكير المستخدمة، درجة معينة من مرونة يمكن أو ينبغي أن تدرج في التحليل.
البروتوكولات المتوفرة عموما سهلة لتنفيذ ولا تستغرق وقتاً طويلاً. بروتوكول كامل يمكن تنفيذها في غضون أسبوع واحد، ويمكن تطبيقها على مجمعات البروتين كلها تقريبا، على الرغم من أن كمية معينة من البروتين المعقد مطلوب لنجاح التحليل. إعداد عينة بسيطة ولا تتطلب على وجه التحديد البروتين المنقي المجمعات. بيد أن مأزق مشترك واحد تلوث العينة أثناء إعداد العينات لتحديد البروتين الشامل القائم على قياس الطيف الكتلي. وتشمل هذه الملوثات في معظم الحالات كراتين التي تنشأ من الغبار أو الجلد أو الشعر. ولذلك، الإضافية مثل ارتداء القفازات والمعاطف مختبر، فيلتراتينج المخازن المائية، واستخدام المذيبات عالية النقاء الحرص أثناء إعداد العينات لتحديد البروتين الشامل القائم على قياس الطيف الكتلي. عادة ما يتم إدخال البروتينات تلويث الأخرى مثل المحرمين أثناء تنقية البروتين، مثلاً، عند استخدام العلامات تقارب. وفي هذه الحالات، تنقية البروتين ينبغي تحسين، على سبيل المثال عن طريق زيادة خطوات الغسيل. على أي حال، تحديد التلوث البروتين في العينة بسهولة أثناء البحث قاعدة البيانات بحذف عامل التصفية التصنيف (أيالبحث ضد البروتينات من جميع الأنواع). إلا إذا كان يلاحظ بعض الببتيدات (أي، على تغطية منخفضة بروتين يمكن الحصول عليها)، على الرغم من أن عينة كافية متوفرة، قد يكون من الضروري استخدام بروتيناز مختلفة أثناء الهضم. بشكل عام ينتج التربسين عددا كافياً من الببتيدات؛ ومع ذلك، في بعض الحالات مثل البروتينات الغشاء أو المجالات غشاء من البروتينات، هو تخفيض عدد مواقع الانقسام تريبتيك وانزيمات أخرى تستهدف مسعور الأحماض الأمينية أفضل خيار.
من حيث الأجهزة، مطلوب صك تم تعديل لا سيما الكتلي الأصلي الذي يحتفظ بتفاعلات غير التساهمية أثناء التحويل إلى الغاز-المرحلة. قد أدخلت العديد من أنواع الصك، بما في ذلك الصكوك Q ToF وأوربيتراب. بينما معدلة Q ToF مطيافات الشامل متوفرة تجارياً الكتلي الأصلية منذ عدة سنوات، إلا في الآونة الأخيرة وأدخلت هذا الأخير وفي معظم الحالات تتطلب التعديل المتخصصة45. ومع ذلك، تطبيق الصكوك ذات الدقة العالية يسمح بدراسة الربط يغاندس متعددة وعلى التقدير الكمي46،47 وواعدة بالنسبة للتطبيقات المستقبلية.
تحديد cross-linked di-الببتيدات من السائل إلى جانب اللوني الكتلي، يمكن تطبيق الإجراءات القياسية مع قليل من التعديلات. ومع ذلك، البحث قاعدة البيانات عاملاً يحد من البرمجيات المتخصصة يمكن نادراً ما تتعامل مع قواعد البيانات الكبيرة، وانخفاض قواعد البيانات التي تحتوي على وحدات البروتين من المجمعات مطلوبة. الدراسات الحديثة المستخدمة كروسلينكيرس قياس الطيف الكتلي كليفابل جماعية تستهدف تفاعلات البروتين في الخلية بأكملها ليساتيس48،49. استخدام كروسلينكيرس الكيميائية التي تجزئ في تجارب الكتلي جنبا إلى جنب معظمهم غلة الببتيدات الخطي (تعديل بواسطة كروسلينكير)، التي يمكن تحديدها بمزيد من التجزؤ وقاعدة بيانات البحث من الببتيدات الخطي، وهذا يقلل البحث في الزمان والمكان البحث الحاسوبية. ومع ذلك، لإجراء هذه التجارب، محلل شامل فخ أيون أو مطياف كتلة مختلطة مع اعتراض أيون مطلوب. بشكل عام، كما إيجابيات كاذبة مسألة هامة، أطياف الجماعية من الببتيدات cross-linked يتم غالباً التحقق من صحة يدوياً بنوعية هذه الأطياف جزء يمتد وقت تحليل البيانات هائلة. تطوير أنظمة التهديف قوية يمكن تطبيقها دون مزيد من خطوات التحقق من صحة ثم التطبيقات المستقبلية المحتملة. طريقة واحدة لتحسين تحليل البيانات، والحد من عدد إيجابيات كاذبة هو الأخذ بحسابات معدل اكتشاف كاذبة وتطبيقها على مجموعات البيانات50العابرة للربط.
وبصفة عامة، يمكن أن تستكمل الأساليب الموصوفة هنا مع مزيد من تقنيات الطيف الكتلي (مثلاً، التساهمي وسم) زيادة الناتج من التحليل. ويمكن بسهولة تنفيذ التعديلات والتحسينات البروتوكولات الأخرى. على هذا النحو المقارن العابرة للربط34 كشف النقاب عن التغييرات كونفورماشونال في الجمعية البروتين. مزيد من التطورات في أصلي الكتلي في الوقت الحاضر يسمح تحليل غشاء بروتينات51،52 وتفاعلاتها مع الدهون28،52،،من5354 . التطورات الجديدة من المطيافات أسلحة عالية الدقة لأصلي الكتلي قد مدد في التطبيق وملزم يجند، مثلاً، ملزمة للدهون لبروتينات الغشاء، والآن يمكن أن تدرج في التحليل45، 46-بالاقتران مع نهج النمذجة الحاسوبية، هذه التقنيات يمكن تسليم النماذج الهيكلية متفاوتة القرار55. إذا كانت لا توجد هياكل الكريستال متوفرة للوحدات الفرعية المعقدة أو واحدة سليمة، يمكن أن يحقق الكتلي الأولى ثاقبة تفاعلات البروتين والطوبولوجيا من المجمع غير معروف. اعتماداً على التقنيات المستخدمة والنتائج المحققة، نماذج منخفضة الدقة من المجمع غير معروف ويمكن الحصول على56،،من5758. إذا كانت تتوفر هياكل الكريستال أو نماذج التماثل، يمكن أن تسفر عن المعلومات الهيكلية التي وردت من الطيف الكتلي نماذج حتى قرب أصلي-59.
بالمقارنة مع غيرها من التقنيات الهيكلية، الطيف الكتلي مزية أن فإنه يتطلب كميات منخفضة عينة، فإنه يمكن التعامل مع العينات غير متجانسة ولا ينطبق على مجمعات البروتين من حجم غير محدود. وبالإضافة إلى ذلك، يسمح الكتلي للتحقيق في نظم البروتين الحيوي. عادة ما يتم تحليل مختلف قطاعات السكان من البروتين أو البروتين المعقدة الموجودة في الحل معا وذلك، خلافا مع التقنيات الهيكلية الأخرى التي تتطلب الاختيار لفئات معينة من السكان، والتشكلات جميع الاحتفاظ بها خلال التحليل ويتم تقييمه في تجربة واحدة. النهج العابرة للربط الكمي قد أدخل مؤخرا34،،من6061 وتبشر بالخير للمستقبل تطبيقات تصف التغييرات conformational تحت ظروف مختلفة.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر زملائنا لإجراء مناقشات مفيدة. ونشكر أيضا شليتشتينج إيلمي وبيتر كارل هوفنر لتوفير البروتين المجمعات. نحن نعترف بتمويل من الوزارة الاتحادية للتعليم والبحوث (الفدرالية، زيك برنامج، 03Z22HN22)، صناديق التنمية الإقليمية الأوروبية (عفر، ZS/2016/04/78115) وهالة-فيتنبرغ MLU شخص وتمويل من مؤسسة ويلكوم ترست (109854/658 Z/15/Z) إلى أ فب
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals, Reagents, Consumables | |||
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma Aldrich | H4034 | buffer |
| Acetic acid | Sigma Aldrich | 695092 | pH |
| Acetonitrile Optima LC/MS | Fisher Chemicals | A955-1 | solvent |
| Amicon Ultra centrifugal devices (different MWCO) | Millipore | i.e. UFC500396 | buffer exchange, concentration |
| Ammonium acetate solution | Sigma Aldrich | A2706 | native MS |
| Ammonium bicarbonate | Sigma Aldrich | 9830 | in-gel digestion |
| Ammonium solution | Sigma Aldrich | 9859 | pH |
| Bis(Sulfosuccinimidyl)suberate-d0 (BS3-d0) | Thermo Scientific | 21590 | cross-linker |
| Bis(Sulfosuccinimidyl)suberate-d4 (BS3-d4) | Thermo Scientific | 21595 | cross-linker |
| Caesium iodide | Sigma Aldrich | 203033 | calibration |
| Calcium chloride | Sigma Aldrich | C5670 | in-gel digestion |
| Capillaries (1.0 OD × 0.78 ID × 100 L mm) | Harvard Apparatus | 30-0038 | native MS |
| Disuccinimidyl suberate (DSS) | Thermo Scientific | 21655 | cross-linker |
| DL-Dithiothreitol | Sigma Aldrich | D5545 | in-gel digestion |
| DMSO (dimethyl sulfoxide) | Sigma Aldrich | D8418 | solvent |
| Ethanol | Fisher Chemicals | BP2818 | solvent |
| Formic acid Optima LC/MS | Fisher Chemicals | A117-50 | solvent supplement |
| Instant Blue Coomassie staining solution | expedeon | ISB1L | staining solution for gel electrophoresis |
| Invitrogen NuPAGE 4-12% Bis-Tris gels (1 mm, 10 well) | life technologies | NP0323BOX | gel electrophoresis |
| Iodoacetamide | Sigma Aldrich | I1149 | In-gel digestion |
| Isopropyl alcohol, HPLC grade | Fisher Chemicals | P750717 | solvent |
| Methanol | Fisher Chemicals | A456-212 | solvent |
| Micro BioSpin 6 columns | BioRad | 732-6222 | buffer exchange |
| NuPAGE Antioxidant | invitrogen | NP0005 | running buffer, gel electrophoresis |
| NuPAGE LDS Sample Buffer (4 ×) | invitrogen | NP0007 | sample loading buffer (non-reducing) for gel electrophoresis |
| NuPAGE MES SDS Running buffer | life technologies | NP0001 | gel electrophoresis |
| NuPAGE MOPS SDS Running buffer | life technologies | NP0001 | gel electrophoresis |
| NuPAGE Sample Reducing Agent (10 ×) | invitrogen | NP0004 | reducing Agent for gel electrophoresis |
| PBS - phosphate buffered saline | Sigma Aldrich | P4417 | buffer |
| SeeBlue Plus2 Prestained Standard Protein Marker | invitrogen | LC5925 | prestained Protein Marker for gel electrophoresis |
| Sodium acetate | Sigma Aldrich | S2889 | ethanol precipitation |
| Tris(hydroxymethyl)aminomethane (Tris) | Sigma Aldrich | 252859 | buffer |
| Trypsin | Sigma Aldrich | TRYPSEQ-RO (11418475001) | in-gel digestion |
| Vivaspin centrifugal devices (different MWCO) | Sartorius | i.e. VS0101 | buffer exchange, concentration |
| Water for HPLC | Sigma Aldrich | 270733-2.5L-M | solvent |
| Name | Company | Catalog Number | Comments |
| Instruments | |||
| Centrifuge Heraeus Fresco 21, bench-top centrifuge | Thermo Scientific | 75002425 | |
| Flaming / Brown Micropipette puller Model P-1000 | Sutter Instruments | P-1000 | |
| Gelelectrophoresis chamber Xcell SureLock MiniCell | Invitrogen | EI0001 | |
| Gold Coater Quorum Q150R S | Quorum Technologies Ltd. | Q150RS | |
| Horizontal gel shaker Rotamax 120 T | Heidolph Instruments | 544-41200-00 | |
| Q-TOF Ultima mass spectrometer, MS Vision high mass upgrade | Waters (Micromass) | - | |
| reversed-phase C18 analytical column Acclaim PepMap (C18, 75 mm I.D., 50 cm, 3 mm pore size) | Thermo Scientific | 164570 | |
| reversed-phase C18 pre-column (C18, 150 mm I.D., 2 cm, 5 mm pore size) | Thermo Scientific | 164213 | |
| scalpel | Fisher Scientifc | 10463989 | |
| SpeedVac SPD121P vacuum centrifuge | Thermo Scientific | SPD121DP-230 | |
| Thermomixer C | Eppendorf | 5382000015 | |
| Tweezers AA | Sigma Aldrich | Z680184-1EA | |
| Ultrasonic cleaner USC-TH, sonication bath | VWR | 142-0084 | |
| UltiMate Dionex 3000 nano-LC system, coupled to Q-Exactive plus hybrid mass spectrometer (nano-ESI source) | Thermo Scientific | 0726030+ | |
| Name | Company | Catalog Number | Comments |
| Software, Software Tools, Database search | |||
| Mascot | www.matrixscience.com | ||
| Massign | http://massign.chem.ox.ac.uk | ||
| MassLynx | Micromass | ||
| MassMatrix | Xu, H. J Proteome Res. 9 (2010) | ||
| MaxQuant | Cox, J. Nat. Biotechn. 26 (2008) | ||
| pLink | Yang, B. Nat Methods 9 (2012) | ||
| pXtract conversion tool | http://pfind.ict.ac.cn/downloads.html | ||
| UniDec | Marty, M.T. Anal. Chem. 87 (2015) | ||
| XCalibur | Thermo Scientific | ||
| XiNET | http://crosslinkviewer.org | ||
| XLinkX | Liu, F. Curr Op Struct Biol 35 (2015) | ||
| xQuest | Rinner, O. Nat Methods 5 (2008) | ||
| Xvis | https://xvis.genzentrum.lmu.de |
References
- Campbell, I. D. Timeline: the march of structural biology. Nat Rev Mol Cell Biol. 3 (5), 377-381 (2002).
- Liko, I., Allison, T. M., Hopper, J. T., Robinson, C. V. Mass spectrometry guided structural biology. Curr Opin Struct Biol. 40, 136-144 (2016).
- Robinson, C. V. From molecular chaperones to membrane motors: through the lens of a mass spectrometrist. Biochem Soc Trans. 45 (1), 251-260 (2017).
- Lossl, P., van de Waterbeemd, M., Heck, A. J. The diverse and expanding role of mass spectrometry in structural and molecular biology. EMBO J. 35 (24), 2634-2657 (2016).
- Wang, L., Chance, M. R. Protein Footprinting Comes of Age: Mass Spectrometry for Biophysical Structure Assessment. Mol Cell Proteomics. 16 (5), 706-716 (2017).
- Steen, H., Mann, M. The ABC's (and XYZ's) of peptide sequencing. Nat Rev Mol Cell Biol. 5 (9), 699-711 (2004).
- Olsen, J. V., Mann, M. Status of large-scale analysis of post-translational modifications by mass spectrometry. Mol Cell Proteomics. 12 (12), 3444-3452 (2013).
- Schmidt, C., Robinson, C. V. Dynamic protein ligand interactions--insights from MS. FEBS J. 281 (8), 1950-1964 (2014).
- Marcsisin, S. R., Engen, J. R. Hydrogen exchange mass spectrometry: what is it and what can it tell us?. Anal Bioanal Chem. 397 (3), 967-972 (2010).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Leitner, A., Lindner, W. Current chemical tagging strategies for proteome analysis by mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci. 813 (1-2), 1-26 (2004).
- Leitner, A., Lindner, W. Chemistry meets proteomics: the use of chemical tagging reactions for MS-based proteomics. Proteomics. 6 (20), 5418-5434 (2006).
- Kiselar, J. G., Chance, M. R. Future directions of structural mass spectrometry using hydroxyl radical footprinting. J Mass Spectrom. 45 (12), 1373-1382 (2010).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chem Rev. 107 (8), 3514-3543 (2007).
- Liu, F., Heck, A. J. Interrogating the architecture of protein assemblies and protein interaction networks by cross-linking mass spectrometry. Curr Opin Struct Biol. 35, 100-108 (2015).
- Rappsilber, J. The beginning of a beautiful friendship: cross-linking/mass spectrometry and modelling of proteins and multi-protein complexes. J Struct Biol. 173 (3), 530-540 (2011).
- Rinner, O., et al. Identification of cross-linked peptides from large sequence databases. Nat Methods. 5 (4), 315-318 (2008).
- Yang, B., et al. Identification of cross-linked peptides from complex samples. Nat Methods. 9 (9), 904-906 (2012).
- Xu, H., Hsu, P. H., Zhang, L., Tsai, M. D., Freitas, M. A. Database search algorithm for identification of intact cross-links in proteins and peptides using tandem mass spectrometry. J Proteome Res. 9 (7), 3384-3393 (2010).
- Leitner, A., Faini, M., Stengel, F., Aebersold, R. Crosslinking and Mass Spectrometry: An Integrated Technology to Understand the Structure and Function of Molecular Machines. Trends Biochem Sci. 41 (1), 20-32 (2016).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Goth, M., Pagel, K. Ion mobility-mass spectrometry as a tool to investigate protein-ligand interactions. Anal Bioanal Chem. , (2017).
- Uetrecht, C., Rose, R. J., van Duijn, E., Lorenzen, K., Heck, A. J. Ion mobility mass spectrometry of proteins and protein assemblies. Chem Soc Rev. 39 (5), 1633-1655 (2010).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Sobott, F., Hernandez, H., McCammon, M. G., Tito, M. A., Robinson, C. V. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- Rostom, A. A., et al. Detection and selective dissociation of intact ribosomes in a mass spectrometer. Proc Natl Acad Sci U S A. 97 (10), 5185-5190 (2000).
- Zhou, M., et al. Mass spectrometry of intact V-type ATPases reveals bound lipids and the effects of nucleotide binding. Science. 334 (6054), 380-385 (2011).
- Uetrecht, C., et al. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Morgner, N., et al. Hsp70 forms antiparallel dimers stabilized by post-translational modifications to position clients for transfer to Hsp90. Cell Rep. 11 (5), 759-769 (2015).
- Schmidt, C., Beilsten-Edmands, V., Robinson, C. V. The joining of the Hsp90 and Hsp70 chaperone cycles yields transient interactions and stable intermediates: insights from mass spectrometry. Oncotarget. 6 (21), 18276-18281 (2015).
- Schmidt, C., Beilsten-Edmands, V., Mohammed, S., Robinson, C. V. Acetylation and phosphorylation control both local and global stability of the chloroplast F1 ATP synthase. Sci Rep. 7, 44068 (2017).
- Schmidt, C., et al. Comparative cross-linking and mass spectrometry of an intact F-type ATPase suggest a role for phosphorylation. Nat Commun. 4, 1985 (2013).
- Schmidt, C., Robinson, C. V. A comparative cross-linking strategy to probe conformational changes in protein complexes. Nat Protoc. 9 (9), 2224-2236 (2014).
- Schmidt, C., et al. Surface Accessibility and Dynamics of Macromolecular Assemblies Probed by Covalent Labeling Mass Spectrometry and Integrative Modeling. Anal Chem. 89 (3), 1459-1468 (2017).
- Lakomek, K., Stoehr, G., Tosi, A., Schmailzl, M., Hopfner, K. P. Structural basis for dodecameric assembly states and conformational plasticity of the full-length AAA+ ATPases Rvb1 · Rvb2. Structure. 23 (3), 483-495 (2015).
- Mareya, S. M., Raushel, F. M. A molecular wedge for triggering the amidotransferase activity of carbamoyl phosphate synthetase. Biochemistry. 33 (10), 2945-2950 (1994).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem. 68 (5), 850-858 (1996).
- Olsen, J. V., et al. Parts per million mass accuracy on an Orbitrap mass spectrometer via lock mass injection into a C-trap. Mol Cell Proteomics. 4 (12), 2010-2021 (2005).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Kirshenbaum, N., Michaelevski, I., Sharon, M. Analyzing large protein complexes by structural mass spectrometry. J Vis Exp. (40), (2010).
- Morgner, N., Robinson, C. V. Massign: an assignment strategy for maximizing information from the mass spectra of heterogeneous protein assemblies. Anal Chem. 84 (6), 2939-2948 (2012).
- Marty, M. T., et al. Bayesian deconvolution of mass and ion mobility spectra: from binary interactions to polydisperse ensembles. Anal Chem. 87 (8), 4370-4376 (2015).
- Thoden, J. B., Wesenberg, G., Raushel, F. M., Holden, H. M. Carbamoyl phosphate synthetase: closure of the B-domain as a result of nucleotide binding. Biochemistry. 38 (8), 2347-2357 (1999).
- Rose, R. J., Damoc, E., Denisov, E., Makarov, A., Heck, A. J. High-sensitivity Orbitrap mass analysis of intact macromolecular assemblies. Nat Methods. 9 (11), 1084-1086 (2012).
- Gault, J., et al. High-resolution mass spectrometry of small molecules bound to membrane proteins. Nat Methods. 13 (4), 333-336 (2016).
- Mehmood, S., et al. Mass spectrometry captures off-target drug binding and provides mechanistic insights into the human metalloprotease ZMPSTE24. Nat Chem. 8 (12), 1152-1158 (2016).
- Kaake, R. M., et al. A new in vivo cross-linking mass spectrometry platform to define protein-protein interactions in living cells. Mol Cell Proteomics. 13 (12), 3533-3543 (2014).
- Liu, F., Rijkers, D. T., Post, H., Heck, A. J. Proteome-wide profiling of protein assemblies by cross-linking mass spectrometry. Nat Methods. 12 (12), 1179-1184 (2015).
- Walzthoeni, T., et al. False discovery rate estimation for cross-linked peptides identified by mass spectrometry. Nat Methods. 9 (9), 901-903 (2012).
- Barrera, N. P., Di Bartolo, N., Booth, P. J., Robinson, C. V. Micelles protect membrane complexes from solution to vacuum. Science. 321 (5886), 243-246 (2008).
- Barrera, N. P., et al. Mass spectrometry of membrane transporters reveals subunit stoichiometry and interactions. Nat Methods. 6 (8), 585-587 (2009).
- Laganowsky, A., et al. Membrane proteins bind lipids selectively to modulate their structure and function. Nature. 510 (7503), 172-175 (2014).
- Marcoux, J., et al. Mass spectrometry reveals synergistic effects of nucleotides, lipids, and drugs binding to a multidrug resistance efflux pump. Proc Natl Acad Sci U S A. 110 (24), 9704-9709 (2013).
- Politis, A., Schmidt, C. Structural characterisation of medically relevant protein assemblies by integrating mass spectrometry with computational modelling. J Proteomics. , (2017).
- Hall, Z., Politis, A., Robinson, C. V. Structural modeling of heteromeric protein complexes from disassembly pathways and ion mobility-mass spectrometry. Structure. 20 (9), 1596-1609 (2012).
- Pukala, T. L., et al. Subunit architecture of multiprotein assemblies determined using restraints from gas-phase measurements. Structure. 17 (9), 1235-1243 (2009).
- Politis, A., et al. Topological models of heteromeric protein assemblies from mass spectrometry: application to the yeast eIF3:eIF5 complex. Chem Biol. 22 (1), 117-128 (2015).
- Politis, A., et al. A mass spectrometry-based hybrid method for structural modeling of protein complexes. Nat Methods. 11 (4), 403-406 (2014).
- Fischer, L., Chen, Z. A., Rappsilber, J. Quantitative cross-linking/mass spectrometry using isotope-labelled cross-linkers. J Proteomics. 88, 120-128 (2013).
- Yu, C., et al. Developing a Multiplexed Quantitative Cross-Linking Mass Spectrometry Platform for Comparative Structural Analysis of Protein Complexes. Anal Chem. 88 (20), 10301-10308 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved