Method Article
جيل بسيطة من ثقافة عالية الغلة المستحث الخلايا العصبية من الخلايا الليفية الجلد الكبار البشرية
In This Article
Summary
إعادة برمجة الخلايا العصبية مباشرة تولد الخلايا العصبية التي تحافظ على سن بداية الخلية الجسمية. وهنا يصف لنا أسلوب واحد متجهة إلى توليد المستحث الخلايا العصبية من الخلايا الليفية الجلد التي تم الحصول عليها من الجهات المانحة البشرية الكبار.
Abstract
الخلايا العصبية المستحث (iNs)، منتج خلايا جسدية تحويلها مباشرة إلى الخلايا العصبية، هي وسيلة للحصول على الخلايا العصبية المشتقة من المريض من الأنسجة التي يمكن الوصول إليها بسهولة. من خلال هذا الطريق، يمكن الحصول على الخلايا العصبية الناضجة في غضون بضعة أسابيع. هنا، يمكننا وصف بروتوكول خطوة واحدة بسيطة وسريعة للحصول على الوظائف من الخلايا الليفية الجلد التي تم الحصول عليها عن طريق خزعة عينات من المانحين الكبار البشرية. نحن شرح كل خطوة من العملية، بما في ذلك الحفاظ على الخلايا الليفية الجلد، إجراءات تجميد بناء مخزون من خط الخلية، زرع الخلايا لإعادة برمجة، فضلا عن شروط الثقافة أثناء عملية التحويل. وبالإضافة إلى ذلك، يصف لنا إعداد الزجاج كوفيرسليبس للتسجيلات الكهربية وظروف طلاء على الأمد الطويل والأسفار تنشيط الخلية الفرز (نظام مراقبة الأصول الميدانية). نحن أيضا لتوضيح أمثلة على النتائج المتوقعة. البروتوكول الموصوفة هنا من السهل لتنفيذ ويمكن اشتقاق الليفية التطبيقية للبشرية من جلد الإنسان عينة من المرضى الذين يعانون من مختلف التشخيصات المختلفة والإعمار. ينشئ هذا البروتوكول على كمية كافية من الأدوات التي يمكن استخدامها لمجموعة واسعة من التطبيقات الطبية الحيوية، بما في ذلك النمذجة المرض وفحص المخدرات، والتحقق من صحة الهدف.
Introduction
تطوير علاجات فعالة لاضطرابات عصبية أعيقت بمحدودية الوصول إلى خلايا المخ البشري المعيشة إجراء الدراسات الميكانيكية والاختبارات الوظيفية. عن عقد من الزمان، هذا الوضع تغير جذريا مع تطوير المستحثة pluripotent الخلايا الجذعية (إيبسكس) تكنولوجيا1،2. هذا، جنبا إلى جنب مع فهم أفضل لآليات التمايز العصبية التي تحدث أثناء التنمية البشرية الطبيعية، قد سمح لتوليد المخططات العصبية محددة ومتنوعة من مواد محددة المريض والمرض. مع هذه المواد، من الممكن الآن لدراسة آليات داخل الخلايا الكامنة وراء الأمراض العصبية وإمكانات مركبات مختلفة للتخفيف من حدة تلك السمات المرضية3.
بينما كانت إيبسكس الثورية في مجال علم الأعصاب، عيب رئيسي واحد من هذه الخلايا أن يتم مسح التوقيع الشيخوخة أثناء عملية إعادة برمجة في مثل هذه طريقة أن العصبية شبابها لا يحتفظ بالثغرة الأمنية المرتبطة الشيخوخة4،،من56. قد ينتهي هذا ميزة معينة من الخلايا العصبية التي تنتج في انتقاده لأتصدى جوانب كثيرة من تتالي المسببة للمرض داخل الخلايا، وبخاصة في حالة الأمراض التي كبر السن عامل خطر هام.
مباشرة في إعادة برمجة العصبية هي تقنية حيث يتم تحويل خلية جسدية مباشرة إلى بدون المرور عبر pluripotent المتوسط المرحلة. وهذا يسمح للجيل السريع للخلايا العصبية البشرية في المختبر يمكن أن المريض وأمراض معينة. من الخصائص الرائعة لإعادة برمجة المباشر هو أن يتم الاحتفاظ بسن بداية الخلية المانحة، ومع ذلك، زيادة تعرضها لعمليات الشيخوخة مثل الإنتاج للأكسدة4،7. كنتيجة لذلك، الوظائف من المرضى الذين يعانون من الأمراض العصبية المرتبطة بالشيخوخة، مثل مرض الزهايمر ومرض باركنسون، أيضا مناسبة لمجموعة واسعة من التطبيقات الطبية الحيوية بما في ذلك مرض النمذجة، وفحص فحوصات، دراسات علم السموم والمخدرات .
هو التحذير الرئيسي الذي حال دون وظائف من المرضى الذين يعانون من اضطرابات الأعصاب التي تستخدم على نطاق واسع أنها ليست سهلة لإعادة برمجة، وهذا يصبح أكثر صعوبة مع التوسع الخلايا الليفية. نتيجة لذلك لم يتحقق توليد في الخلايا في الكميات اللازمة لهذه الأنواع من التطبيقات حتى الآونة الأخيرة فقط8. الآن قمنا بتطوير طريقة بسيطة لإعادة برمجة الخلايا الليفية من المانحين أي سن بطريقة فعالة جداً. هذا الأسلوب يجمع بين التعبير القسري عن عوامل النسخ العصبية Ascl1 و Brn2 ضربة قاضية قامع البروتين إسكات RE1 النسخ عامل (بقية) باستخدام ناقل واحد. هنا، نحن تصف الخطوات المختلفة مما يؤدي إلى توليد الوظائف المحولة من الخلايا الليفية الجلد فحص من كبار المانحين.
Protocol
الليفية الجلدية الكبار التي تم الحصول عليها من العيادات بحوث مرض باركنسون ومرض هنتنغتون في مركز جون جيست فإن "إصلاح الدماغ" (كامبريدج، المملكة المتحدة) والمستخدمة في إطار الموافقة الأخلاقية المحلية (REC 09/H0311/88). للحصول على مزيد من التفاصيل المتعلقة بإجراء أخذ العينات خزعة الجلد، راجع مرجع8.
1. إعداد الخلايا الليفية الجلد لإعادة برمجة
- باستخدام خلية الآلي ذوبان النظام أو حمام مائي 37 درجة مئوية، ذوبان الجليد الليفية الجلدية البشرية الكبار (أهدفس) ولوحة 200,000 كل قارورة T75 (العد مع عداد الآلي خلية) في 10 مل متوسطة تنتجها الخلايا الليفية (انظر الجدول 1) عند 37 درجة مئوية في شركة 5%2.
- إجراء تغيير كامل متوسطة مع المتوسط تنتجها الخلايا الليفية في اليوم التالي.
- قم بتغيير كل 3 – 4 أيام حتى تصل إلى الخلايا كونفلوينسي 95% المتوسطة تنتجها الخلايا الليفية.
ملاحظة: سوف تحتوي على قارورة المتلاقية واحد تقريبا 1,000,000 الخلايا. يمكن أن تجمد في أهدفس لبناء مخزون خط الخلية (القسم 2) أو مباشرة إعادة مطلي جاهزة لإعادة البرمجة (الفرع 3).
2-تجميد الخلايا الليفية الجلد
- ضع حاوية تجميد معدل التحكم في مربع مع الجليد أو في الثلاجة على 4 درجة مئوية.
- فصل الخلايا مع التربسين 0.05% (1.5 مل كل قارورة T75) عند 37 درجة مئوية لمدة 3-5 دقائق.
- إضافة تنتجها الخلايا الليفية المتوسطة (التي تحتوي على مصل بقرى الجنين (FBS)) لتحييد التربسين (3 مل كل تدفق كل قارورة T75) وجمع الخلايا المنفصلة في أنبوب 15 مل بطرد الخلايا في قارورة مرتين.
- عد الخلايا باستخدام العداد الآلي الخلية؛ تجميد (مستحسن) أهدفس 500,000 تقريبا كل قنينة.
- زيادة ونقصان لأسفل الخلايا في 400 غرام x لمدة 5 دقائق.
- ريسوسبيند بيليه الخلية في 1 مل من تجميد المتوسطة (انظر الجدول 1)، ونقل في أنبوب المبردة. وضع الأنابيب مباشرة في الحاوية معدل الخاضعة للتجميد.
- تخزين معدل التي تسيطر عليها تجميد الجهاز في-80 درجة مئوية بين عشية وضحاها. في اليوم التالي، نقل الأنابيب إلى ثلاجة-140 درجة مئوية وتخزينها إلى حين الحاجة.
3-طلاء لإعادة برمجة (1 يوم)
ملاحظة: من المستحسن استخدام طلاء جيلاتين لإجراء التجارب على المدى القصير (تصل إلى 30 يوما)؛ وبدلاً من ذلك، من المستحسن لإجراء التجارب على المدى الطويل لبدء على بولي-L-ornithine، فيبرونيكتين وطلاء laminin (PFL).
- 60 دقيقة قبل الطلاء أهدفس لإعادة برمجة، معطف صفيحة 24-جيدا مع الجيلاتين 0.1% (250 ميليلتر في البئر) واحتضان عند 37 درجة مئوية.
- نضح المتوسطة تنتجها الخلايا الليفية في أهدفس. أغسل مرة واحدة مع دببس. فصل الخلايا مع التربسين 0.05% (1.5 مل كل قارورة T75) عند 37 درجة مئوية لمدة 3-5 دقائق.
- إضافة المتوسطة تنتجها الخلايا الليفية لتحييد التربسين (3 مل كل تدفق كل قارورة T75) وجمع الخلايا المنفصلة في أنبوب 15 مل بطرد الخلايا في قارورة مرتين.
- وتدور أسفل الخلايا في 400 غرام x للحد الأدنى 5 تجاهل المادة طافية، ريسوسبيند بيليه الخلية في 1 مل متوسطة تنتجها الخلايا الليفية.
- عد الخلايا باستخدام عداد الآلي خلية (لضمان شيك تحويل ذات نوعية جيدة هو بقاء الخلية أعلى من 90% مع تريبان الأزرق تلطيخ).
- 24-كذلك لوحة كاملة، إعداد تعليق الخلايا 1,320,000 في 13.2 مل تنتجها الخلايا الليفية المتوسطة إلى تحقيق وقف 100,000 خلايا/مل من المتوسطة (أو خلايا/بئر 55,000 في ميليلتر 550 تنتجها الخلايا الليفية متوسطة مضروبة في عدد الآبار اللازمة).
- نضح الجيلاتين من اللوحة ويغسل مرتين مع دببس. إضافة 500 ميليلتر من تعليق خلية لكل بئر واحتضان بين عشية وضحاها في 37 درجة مئوية في شركة 5%2.
4-الفيروسية تنبيغ (يوم 0)
ملاحظة: يتطلب العمل مع جزيئات لينتيفيرال الفئة 2 المعدات واستخدام عامل لتحييد الفيروس. ارتداء أزواج مزدوجة من قفازات ينصح أيضا بشدة.
- الاحماء 13.2 مل تنتجها الخلايا الليفية المتوسطة إلى 37 درجة مئوية.
- ذوبان الجليد ناقل لينتيفيرال التي تحتوي على عوامل النسخ Ascl1 و Brn2 مع دبوس الشعر القصير هما الكشف (شرنا) استهداف بقية في درجة حرارة الغرفة.
ملاحظة: تشير إلى مرجع8؛ تتوفر البناء، في مستودع بلازميد. لمزيد من التفاصيل المتعلقة بإجراء لإنتاج lentiviruses، يرجى الرجوع إلى مرجع9. - إضافة حجم اللازمة لينتيفيروس لتصيب أهدفس في تعدد العدوى (وزارة الداخلية) من 20 إلى المتوسط دون أي القدرة على توصيل.
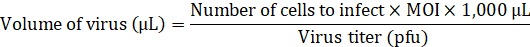
- استبدال المتوسطة في لوحة 24-جيدا مع المتوسطة تنتجها الخلايا الليفية التي تحتوي على ناقل لينتيفيرال (500 ميليلتر في البئر) واحتضان بين عشية وضحاها في 37 درجة مئوية في 5% CO2.
- في اليوم التالي، استبدال المتوسطة في الآبار جديدة تنتجها الخلايا الليفية المتوسطة دون ناقل لينتيفيرال.
ملاحظة: المتوسط يعتبر المعدية لمدة 7 أيام، وعلى هذا النحو، ينبغي استخدام الحماية الكافية وإجراءات المناولة خلال الأسبوع الأول بعد توصيل الفيروسية.
5-الحفاظ على تحويل الخلايا
ملاحظة: بمجرد بدء تحويل الخلايا معرضة للرفع؛ تأخذ الرعاية على تلميح اللوحة واستخدام ماصة ميليلتر 1,000 عند إزالة وسائل الإعلام لتجنب الخلايا فصل.
- في يوم 3، إزالة المتوسطة تنتجها الخلايا الليفية وإضافة 500 ميليلتر من وقت مبكر تحويل الخلايا العصبية المتوسطة (انظر الجدول 1).
- مرتين إلى ثلاث مرات في أسبوع، تأخذ بها 225 ميليلتر متوسطة القديمة من البئر وإضافة في 250 ميليلتر من الطازجة المتوسطة تحويل الخلايا العصبية المبكرة.
- في يوم 18، إزالة كافة المتوسطة من كل بئر واستبدال مع 500 ميليلتر من تأخر تحويل الخلايا العصبية المتوسطة (انظر الجدول 1).
- وتواصل تغيير نصف المتوسط أعلاه مع تأخر تحويل الخلايا العصبية المتوسطة كل 2 – 3 أيام حتى يوم 25 أو نقطة نهاية التجربة (الشكل 1A).
ملاحظة: إذا لم يتم مطلي خلايا في كل بئر للتجربة، سد الآبار فارغة مع برنامج تلفزيوني أو الماء منع تبخر العلني للمتوسطة وتقليل التباين بين الآبار.
| تركز الأسهم | تركيز العمل | |
| المتوسطة تنتجها الخلايا الليفية | ||
| متوسطة القاعدية | N/A | N/A |
| البنسلين/ستربتوميسين | 10,000 U/mL | 100 مغ/مل |
| FBS | N/A | 10 ٪ |
| تجميد المتوسطة | ||
| المتوسطة تنتجها الخلايا الليفية | N/A | 45% |
| FBS | N/A | 45% |
| [دمس] | N/A | 10 ٪ |
| بداية تحويل الخلايا العصبية المتوسطة (الفرنسية) | ||
| متوسطة التمايز العصبية | N/A | N/A |
| البنسلين/ستربتوميسين | 10,000 U/mL | 100 مغ/مل |
| CHIR99021 | 10 ملم | 2 ميكرومتر |
| س-431542 | 20 مم | 10 ميكرومتر |
| رأس | 100 ميكروغرام/مل | 0.5 ميكروغرام/مل |
| LDN 1931189 | 10 ملم | 0.5 ميكرومتر |
| جيش فيتنام الشعبي | م 1 | 1 مم |
| LM 22A4 | 20 مم | 2 ميكرومتر |
| جدنف | 20 ميكروغرام/مل | 2 نانوغرام/مليلتر |
| NT3 | 10 ميكروغرام/مل | 10 نانوغرام/ميليلتر |
| مخيم db | 50 مم | 0.5 مم |
| تحويل الخلايا العصبية المتأخرة المتوسطة (لنم) | ||
| متوسطة التمايز العصبية | N/A | N/A |
| البنسلين/ستربتوميسين | 10,000 U/mL | 100 مغ/مل |
| LM 22A4 | 20 مم | 2 ميكرومتر |
| جدنف | 20 ميكروغرام/مل | 2 نانوغرام/مليلتر |
| NT3 | 10 ميكروغرام/مل | 10 نانوغرام/ميليلتر |
| مخيم db | 50 مم | 0.5 مم |
| المخزن المؤقت لنظام مراقبة الأصول الميدانية | ||
| حبس 1 x [الكالسيوم والمغنيسيوم،-الفينول الأحمر] | N/A | N/A |
| مرض التصلب العصبي المتعدد. | N/A | 1% |
| دنيز | N/A | 0.05% |
الجدول 1: تكوين لاستخدام وسائل الإعلام المختلفة- وصف كامل لتكوين لجميع وسائل الإعلام بحاجة في هذا البروتوكول بما في ذلك المتوسط تنتجها الخلايا الليفية، وتجميد المتوسطة، وتأخر تحويل الخلايا العصبية المتوسطة وأوائل تحويل الخلايا العصبية متوسطة والمخزن المؤقت لنظام مراقبة الأصول الميدانية.
6-زجاج كوفيرسليبس للتسجيلات الكهربية
ملاحظة: من المستحسن ارتداء معطف مختبر، نظارات واقية، ومضاعفة القفازات وإتمام جميع الأعمال في غطاء دخان. هذا البروتوكول مقتبس من 10.
- ضع كوفيرسليبس الزجاج في الجزء السفلي من صحن الزجاج دون تداخل.
- إضافة مختبر العامة المنظفات إلى غمر كل من كوفيرسليبس دون تجاوز المخاطرة أثناء الهز (حوالي 30 مل) التنظيف. ضع على شاكر مدارية سرعة بطيئة ح 2.
- أغسل ست مرات (30 دقيقة في كل) مع يعقم المياه.
- إضافة الإيثانول 95% ح 2.
- إزالة الإيثانول وانتظر حتى كوفيرسليبس جافة.
- الجاف لمرة واحدة، ونقل كوفيرسليبس في كوب زجاج وإضافة حمض النيتريك 70% حتى مغمورة في كوفيرسليبس.
- ضع الكأس الزجاج في حمام سونيكاتور لمدة 60 دقيقة.
- إزالة حمض النيتريك وتغسل ثلاث مرات مع يعقم المياه.
تنبيه: دائماً إضافة حمض إلى المياه، ابدأ بطريقة أخرى حول هذا يمكن أن يؤدي إلى رد فعل عنيف. - إزالة قدر الماء من الكأس قدر الإمكان، وإضافة تركيز حامض الهيدروكلوريك (HCI) حتى مغمورة في كوفيرسليبس؛ دوامة الكأس وتغطي مع الفيلم البارافين.
- Sonicate لمدة 60 دقيقة (50-60 هرتز، 30 ث).
- إزالة قدر HCI من كوفيرسليبس قدر الإمكان، ومكان إلى بن مناسبة لنفايات. شطف مع يعقم المياه مرتين.
- تأخذ كوفيرسليبس من غطاء محرك السيارة وشطف 20 مرة (أو أكثر) مع يعقم المياه حتى يتم إزالة كافة HCI.
- الجاف لمرة واحدة، ووضع كوفيرسليبس في العقيمة 24-جيدا لوحات.
- وضع اللوحات تحت الأشعة فوق البنفسجية (الأشعة فوق البنفسجية) الخفيفة بين عشية وضحاها. وفي اليوم التالي كوفيرسليبس تكون جاهزة للاستخدام.
ملاحظة: إذا كانت تستخدم الزجاج كوفيرسليبس، من المستحسن استخدام الطلاء PFL. ببساطة ضع ساترة واحد في كل بئر من صفيحة 24-جيدا (باستخدام الملقط المعقم) واتبع البروتوكول النحو المبين أدناه.
7-PFL طلاء لثقافة طويلة الأجل
- معطف لوحة 24-جيدا مع بولي-L-أورنيثيني (500 ميليلتر في البئر) وترك بين عشية وضحاها في 37 درجة مئوية في شركة 5%2.
- نضح بولي-L-أورنيثيني وانتظر حتى يتم الجافة ما يكفي على شكل قطرات على رأس.
- جعل قطره (حوالي 60 ميليلتر) من لامينين في مركز كل جيدا وتنتشر لتغطي كامل سطح ساترة. يغادر إلى 45 دقيقة عند 37 درجة مئوية في 5% CO2ح 2.
- تغسل ثلاث مرات مع دببس.
- إضافة فيبرونيكتين (500 ميليلتر في البئر) وترك بين عشية وضحاها في 37 درجة مئوية في شركة 5%2.
- أغسل مرة واحدة مع دببس قبل إضافة الخلايا.
ملاحظة: يمكن استخدام الطلاء PFL لفترة طويلة الأجل الثقافات من الوظائف (ما يزيد على 100 يوم)، على الرغم من أن موت الخلية التدريجي المتوقع من يوم 30.
8-نظام مراقبة الأصول الميدانية
ملاحظة: لإعادة لوحة الخلايا بعد نظام مراقبة الأصول الميدانية فرز إعداد لوحة المغلفة PFL 48 h مقدما. يمكن فرز الخلايا باستخدام جسم جزيء (نكام) التصاق خلايا العصبية من يوم 20 فصاعدا بعد توصيل.
- قم بإزالة الوسائط مع ماصة 1,000 ميليلتر (لا تغسل لتجنب فصل الخلايا).
- إضافة خلية الناي بعامل (250 ميليلتر في البئر)، وإجازة لمدة 10 – 20 دقيقة حتى رفع الخلايا، وتعويم كخلايا مفردة.
- وخلال هذا الوقت إعداد المخزن المؤقت نظام مراقبة الأصول الميدانية.
- تريتوراتي برفق مع ماصة 1,000 ميليلتر. إذا بقيت بعض كتل، احتضان فترة أطول قليلاً.
- وبمجرد الحصول على تعليق خلية مفردة، إزالته من البئر ووضع في أنبوب 1.5 مل.
- تدفق من البئر مرتين مع تأخر تحويل الخلايا العصبية المتوسطة ومكان في أنبوب 1.5 مل نفسه.
- زيادة ونقصان لأسفل في 400 غرام x لمدة 5 دقائق وتجاهل المادة طافية.
- ريسوسبيند بيليه الخلية في 200 ميليلتر من المخزن المؤقت لنظام مراقبة الأصول الميدانية.
- زيادة ونقصان لأسفل الخلايا في 400 غرام x لمدة 5 دقائق وتجاهل المادة طافية.
- كرر الخطوتين 8.8 و 8.9 مرتين.
- ريسوسبيند بيليه الخلية في 50 ميليلتر من نظام مراقبة الأصول الميدانية المخزن المؤقت الذي يحتوي على البشرية من جسم CD56 (نكام) بتركيز 01:50 لمدة 15 دقيقة على الجليد. حماية من الضوء.
- زيادة ونقصان لأسفل الخلايا في 400 غرام x لمدة 5 دقائق.
- ريسوسبيند في المخزن المؤقت لنظام مراقبة الأصول الميدانية ميليلتر 200 لغسل وتدور أسفل الخلايا في ز 400 x لمدة 5 دقائق.
- كرر الخطوة 8.13.
- ريسوسبيند في 200 ميليلتر من نظام مراقبة الأصول الميدانية المخزن المؤقت الذي يحتوي على يوديد propidium (PI؛ 10 ميكروغرام/مل). فرز نكام الإيجابية (iNs) والخلايا (لايف) السلبية PI استخدام نظام مراقبة الأصول الميدانية بواسطة النابضة استناداً إلى مستوى كثافة الأسفار من عينات التحكم التي كانت غير ملطخة بجسم نكام أو PI.
- جمع الخلايا إيجابية نكام في أنبوب يحتوي على تأخر تحويل الخلايا العصبية المتوسطة.
- عد الخلايا باستخدام العداد الآلي الخلية وإعادة لوحة الخلايا في كثافة عالية (50,000 الخلايا/سم2) في أواخر المتوسطة تحويل الخلايا العصبية في صحن PFL المغلفة.
- وتواصل تغيير نصف المتوسط 2-3 مرات في أسبوع مع تأخر تحويل الخلايا العصبية المتوسطة حتى نهاية التجربة (الشكل 1A).
النتائج
وينبغي تغيير واضح في مورفولوجيا الخلايا مرئية من اليوم فصاعدا 5 (الشكل 1B). بعض موت الخلية المتوقع بعد توصيل الفيروسية، على الرغم من عدم علنا. من كل بئر في صفيحة 24-كذلك ينبغي أن يتوقع عائد مجموع خلية من خلايا 20,000 40,000 يوم 25، منها حوالي نصف ينبغي قد أصبحت الخلايا العصبية. من المهم ملاحظة أن الغلة والنقاء يمكن أن تختلف عبر خط الخلية، وكذلك مع دفعات الدولة وفيروس المرض.
وسيعبر عن الخلايا علامات العصبية الأكثر القياسية بما في ذلك MAP2 وتأو (الشكل 1) في يوم 25 بالإضافة إلى المعرض مورفولوجيا الخلايا العصبية ناضجة. فمن الممكن الحصول على محض في السكان بالقيام بنظام مراقبة الأصول الميدانية استناداً إلى علامة نكام (انظر مراجع8،11). الخلايا يمكن بعد ذلك أن تكون أما إعادة مطلي على طلاء ثلاثية PFL (انظر المرجع10) أو المجمدة مباشرة للتحليلات الجزيئية البيولوجية.
إذا لم يتم فرز الخلايا، الفلورة وسم مع MAP2 أو تاو ينبغي إجراء عمليات لتحديد الخلايا المحولة بنجاح والمسمى يشترك مع البروتين للفائدة.

رقم 1: تطور عملية التحويل مرور الوقت- (أ) الجدول الزمني للتجربة وخريطة لبناء حزم في لينتيفيروس المستخدمة لإعادة برمجة الليفية الجلدية البشرية الكبار. كل سهم أسود يمثل تغييرا في متوسط. (ب) مرحلة الممثل التباين الصور التي تصور التغييرات في مورفولوجيا الخلايا أثناء عملية التحويل بين اليوم 0 يوم 22 (كما هو مبين في الركن الأيمن العلوي من كل فريق). صور أخذت في مجهر تباين مرحلة استخدام الهدف X 10. (ج) صورة الفلورة تاو و MAP2 مزدوجة تلطيخ في توصيل ما بعد 35 يوما. كانت ثابتة في 4% بارافورمالدهيد الخلايا وبيرميبيليزيد مع 0.1% تم حظرها تريتون في دببس للخلايا 10 كحد أدنى لمدة 30 دقيقة في حل مصل 5% في دببس. الأجسام المضادة التي كانت مخففة في عرقلة الحل وتطبيقها بين عشية وضحاها في 4 درجات مئوية. مترافق Fluorophore الأجسام المضادة الثانوية المخفف في عرقلة الحل وتطبيقه لكانت كونتيرستينيد الخلايا 2 حاء مع DAPI لمدة 15 دقيقة ثم يغسل 3 مع دببس. صور أخذت في مجهر مقلوب الأسفار استخدام هدف X 20. تغيير حجم أشرطة = 100 ميكرومتر (ب، ج). المختصرات: الفرنسية: متوسط الخلايا العصبية المبكرة؛ LNM: متوسطة العصبية المتأخرة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
هذا ناقل خطوة واحدة/واحدة إعادة برمجة أسلوب يوفر طريقة فعالة الحصول على الوظائف من الخلايا الليفية الكبار البشرية. الليفية الكبار البشرية عادة أكثر صعوبة لسرية من الخلايا الليفية الجنينية، مع دراسات محدودة سبق الإبلاغ عن كفاءات لحوالي 5-10%12،13. ومع ذلك، من الممكن مع هذا البروتوكول الجديد تحقيق عائد العصبية (تقاس ك MAP2 + خلايا) من حوالي 50%8. بالإضافة إلى ذلك، يمكن استخدام لدينا بروتوكول على الخلايا الليفية الجلدية التي قد تم باساجيد عدة مرات دون فقدان كفاءة التحويل. حتى الآن لقد استخدمنا خلايا باساجيد يصل إلى 14 مرة دون الكشف عن أي انخفاض في كفاءة التحويل. أيضا، ليس هناك فرق في إعادة برمجة الكفاءة في أيدينا مع الخلايا الليفية من الجهات المانحة عمر بين 52 و 87. لمزيد من التفاصيل عن العمر والمرض من خطوط الخلايا الأخرى مع هذا بناء اختبار راجع مرجع8. كما أفادت دراسات أخرى لا فرق في كفاءة تحويل استخدام بروتوكول قائم على لينتيفيرال والصغيرة جزيء محسنة مع المانحين بين 0 و 89 عاماً4. وعلاوة على ذلك، تم الإبلاغ عن انطباق متسقة مع ميرنا على إعادة برمجة الخلايا العصبية في الخلايا الليفية من جميع الإعمار، مع المانحين بين 0 و 86 سنة7. من خلال هذا الطريق، يمكن الحصول على الخلايا العصبية الناضجة في حوالي 12 – 15 أسبوعا في المختبر أو حوالي 8 أسابيع بعد زرع في فيفو8. وهذا مفيد لأنه يعطي إمكانية الوصول إلى كل من المرض والمريض إضافية بشرية معينة من الأنسجة التي يمكن الوصول إليها بسهولة. على الرغم من أن هذا البروتوكول لا تتسم بالكفاءة، فإنه سوف لا تعطي عائد العصبية 100%، وعلى هذا النحو مطلوب خطوة تنقية باستخدام نظام مراقبة الأصول الميدانية على سبيل المثال.
أن الخطوة الأكثر أهمية ضمن هذا البروتوكول توصيل الفيروسية (المادة 4 من البروتوكول). من الأهمية بمكان أن عيار الفيروس الدقيق، بالإضافة إلى وجود مطلي دقة عدد أهدفس للتحويل. عيار الموصى به للاستخدام مع هذا البروتوكول بين 4 × 108 و 4 × 109. لا توصي استخدام عيار من أي شيء أقل من 1 × 108 كإضافة كميات كبيرة من الفيروس سوف تكون سامة للخلايا. وعلاوة على ذلك، الليفية تبدأ في سرية للوظائف سوف تصبح أكثر هشاشة وعرضه لرفع. من الضروري أن يكون لطيف عند تغيير وسائل الإعلام لا للإزعاج الخلايا كثيرا. يمكن أن يتم ذلك عن طريق إزالة السوائل ببطء مع 1,000 ماصة ميليلتر. أخيرا، عندما الطلاء لإعادة برمجة (القسم 3 من البروتوكول) من المهم التأكد من عدد سكان صحية تنتجها الخلايا الليفية قبل بداية تجربة؛ يدل على ذلك بقاء خلية أعلى من 90% تلطيخ تريبان الأزرق. ينبغي دائماً أن باساجيد أهدفس قبل أن تصل إلى 95% كونفلوينسي.
إذا لم يكن هناك موت الخلية ملحوظ قبل توصيل الفيروسية، لا تبدأ التحويل: الاختيار المزدوجة أن بقاء الخلية أكثر من 90 في المائة، وأن كانت هناك أية مشاكل مع طلاء اللوحة. من المتوقع أن يكون مقدار صغير من موت الخلايا بعد توصيل الفيروسي، ولكن هذا لا ينبغي كبيرة. في هذه الحالة، تأكيد البذر دقيقة 50,000 أهدفس/جيدا والتحقق من عيار الفيروس. إذا لم يكن هناك تناقض ملحوظ بين الآبار أثناء عملية التحويل، تحقق أولاً من أن كل بئر يحتوي على مبلغ مساو من وسائل الإعلام ولم يحدث التبخر العلني في الحواف (إذا كان يمكن إضافة الوسائط الإضافية اللازمة للآبار حافة). بدلاً من ذلك، راجع الخطوة 4، 4، وضمان الاختلاط المناسبة لتعليق متجانسة عند ترانسدوسينج. من الأهمية بمكان إضافة لينتيفيروس إلى المتوسط أولاً، قبل إضافة هذا إلى الآبار. إضافة lentivirus مباشرة في الآبار سيزيد تقلب إلى بئر ومن المرجح أيضا أن تكون سامة للخلايا. وأخيراً، تحقق دائماً من أن المتوسط هو استعد إلى 37 درجة مئوية قبل إضافة إلى الخلايا.
ويشمل هذا البروتوكول المقاطع الاختيارية لظروف طلاء لفترة طويلة الأجل الثقافة للوظائف، ونظام مراقبة الأصول الميدانية الفرز لزيادة نقاء الخلايا العصبية. للتجارب التي ترغب في التحقيق في التوصيف الوظيفي للوظائف، أدرج أيضا على بروتوكول لإعداد كوفيرسليبس الزجاج للكهربية. تم إعداد بروتوكول التحويل هنا للاستخدام مع لوحة 24-جيدا؛ إذا رغبت في ذلك وهذا يمكن تعديلها إلى 6-12، 48-، لوحة 96-جيدا أو قوارير. وفي هذه الحالة، يرجى ضبط كافة وحدات التخزين على مساحة اللوحة أو قارورة استخدمت.
هذا البروتوكول يستخدم التعبير القسري Ascl1 و Brn2 في تركيبة مع ضربة قاضية بقية كافة حزم في واحد ناقل واحد8 لتوليد وظائف من النمط الظاهري الخلايا العصبية عموم. الجيل من أي أنواع فرعية الدبقية مع هذا الأسلوب، ومع ذلك، لم تقييم. وهكذا يلزم هذا الأسلوب يمكن تعديلها للاستخدام مع عوامل أخرى إعادة برمجة للحصول على نوع فرعي محدد من الخلايا العصبية. إعادة برمجة مباشرة سابقا أظهر إمكانية توليد الخلايا العصبية الحركية والخلايا العصبية الحسية، فوتوريسيبتورس، سترياتال الخلايا العصبية الشوكية المتوسطة وتتميز الخلايا العصبية10،14. سيكون هذا مفيداً عند التحقيق في الأمراض العصبية في فرعي الخلايا العصبية المحددة التي تتأثر بشكل تفضيلي، على سبيل المثال مرض باركنسون وتتميز الخلايا العصبية.
حتى وقت قريب جداً، تكنولوجيا إعادة برمجة العصبية المباشرة لا تسمح بإنتاج الأدوات بطريقة موحدة وفعالة-إلى مستوى ما مطلوب لعلم السموم والمخدرات فحص فحوصات على نطاق واسع. هذا أسلوب جديد فعال جداً ويمكن استخدامها في الخلايا الليفية التي تم باساجيد مرات عديدة، مثل أن يقوم بإزالة هذه القيود ويفتح لمجموعة واسعة من الدراسات، ليس فقط في جهاز العصبي الإنسان، ولكن أيضا في نظام يمكن أن المريض محددة الآن. بساطة هذا النهج يجعل هذه التكنولوجيا في الوصول لأية مجموعات الراغبين في إجراء دراسات مماثلة داخلية ويمكن بسهولة استخدامها ليس فقط للتطبيقات الطبية الحيوية واسعة النطاق، مثل الكشف عن المخدرات وفحوصات علم السموم، بل أيضا لدعم البيانات المستمدة من النماذج الحيوانية وعينات الأنسجة البشرية بعد الوفاة .
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ونحن نشكر ماري Vejgården بيرسون للمساعدة التقنية. البحوث المؤدية إلى هذه النتائج قد تلقت تمويلاً من "مؤسسة الخلايا الجذعية نيويورك"، مجلس البحوث الأوروبية ضمن "البرنامج الإطاري السابع" للاتحاد الأوروبي: إصلاح الخلايا الجذعية العصبية FP/2007-2013 (رقم 602278) والمنحة المنسق لا. 30971، "مجلس البحوث السويدية" (منح اتفاق 521-2012-5624، 2016-00873 و 70862601/باجاديليكو)، مؤسسة باركنسون السويدية (باركينسونفوندين)، ومجال البحوث الاستراتيجية في مولتيبارك جامعة لوند (البحوث المتعددة التخصصات في مرض باركنسون). جانيل دروين-اويليه معتمد من قبل معاهد كندية لبحوث صحية (استوفوا) زمالة (#358492)، وروجر باركر معتمد بمنحه "مركز NIHR للبحوث الطبية الحيوية" جامعة من كمبريدج/أدينبروكي في المستشفى. مالين بارمار هو "محقق روبرتسون مؤسسة الخلايا الجذعية من نيويورك". شيلبي شريجليي يمول من برنامج الاتحاد الأوروبي أفق 2020 (H2020-مسكاً-أي تي-2015) تحت ماري كوري Skłodowska شبكة التدريب المبتكر واتفاق المنحة رقم 676408.
Materials
| Name | Company | Catalog Number | Comments |
| Cell Lines | |||
| Adult human dermal fibroblasts | [C2 passage #7] Donor was a 67 year old female. Cells obtained from the Parkinson’s Disease Research and Huntington’s disease clinics at the John van Geest Centre for Brain Repair (Cambridge, UK). | ||
| Reagents for Fibroblast Culture, Transduction and Conversion | |||
| Dulbecco's phosphate-buffered saline (DPBS) [-CaCl2, -MgCl2] | Gibco | 14190094 | |
| Trypsin-EDTA [0.5%] | Gibco | 15400-054 | Dilute to 0.05% in DPBS. |
| Virkon (agent used to neutralize virus) | Viroderm | 7511 | Dilute to 1% solution with warm water. |
| Milli-Q Water | Millipore | ||
| Basal medium - Dulbecco’s Modified Eagle Medium (DMEM) + GlutaMax | Gibco | 61965059 | |
| Penicillin/Streptomycin [10,000 U/mL] | Gibco | 15140-122 | |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | |
| CryoMACS® dimethyl sulfoxide (DMSO) 10 | Miltenyi | 170-076-303 | |
| Neural differentiation medium - NDiff 227 | Takara-Clontech | Y40002 | |
| LM-22A4 | Tocris | 4607 | Dilute 10 mg in 1450 µL DMSO. Stock concentration: 20 mM. |
| Glial cell line-derived neurotrophic factor (GDNF) [recombinant human] | R&D systems | 212-GD-010 | Dilute 10 ug in 500 µL 0,1% BSA in DPBS. Stock concentration: 20 µg/mL. |
| NT3 [recombinant human] | R&D systems | 267-N3-025 | Dilute 25 µg in 2,5 mL 0,1% BSA in DPBS. Stock concentration: 10 µg/mL. |
| db-cAMP | Sigma Aldrich | D0627 | Dilute 1 g in 40,7 mL Milli-Q water. Filter and make 500 µL aliquots or stock tubes of 10 mL. Stock concentration: 50 mM. |
| CHIR99021 | Axon | 1386 | Dilute 2 µg in 429,8 µL DMSO. Stock concentration: 10 mM. |
| SB-431542 | Axon | 1661 | Dilute 5 mg in 595 µL DMSO. Stock concentration: 20 mM. |
| Noggin [recombinant human] | Miltenyi | 130-103-456 | Dilute 100 µg in 100 µL of Milli-Q water + 900 µL 0,1% BSA in DPBS. Stock concentration: 100 µg/mL. |
| LDN-193189 | Axon | 1509 | Dilute 2 mg in 360 µL DMSO. Stock concentration: 10 mM. |
| Valproic acid sodium salt (VPA) | Merck Millipore | 676380 | Dilute 5 g in Milli-Q water to acheive a stock concentration of 1 M. CAUTION: Avoid ingestion, contact with skin, and breathing dust formation. |
| Reagents for Coatings | |||
| Gelatin | Sigma Aldrich | G2500 | Dilute to 0.1% in Milli-Q water. |
| Poly-L-ornithine | Sigma Aldrich | P3655 | Dissolve in Milli-Q water. Use at 15µg/mL. |
| Fibronectin | ThermoFisher Scientific | 33010-018 | 2 mL of Milli-Q water + 70 µL 0,25 M NaOH. Use at 5 µg/mL. |
| Laminin | ThermoFisher Scientific | 23017-015 | Store at -80°C. Thaw on ice, keep cool and aliquot 30 µL. Use at 5 µg/mL. |
| Reagents for Fluorescence Activated Cell Sorting | |||
| Cell dissociation agent - Accutase (Stem Pro) | ThermoFisher Scientific | A1110501 | |
| Hanks' Balanced Salt Solution (HBSS) 1X [-calcium, -magnesium, - phenol red] | ThermoFisher Scientific | 14175-046 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | Use at 1% concentration for Anti-Human CD56 (NCAM). |
| DNAase | Sigma Aldrich | DN-25 | Use at 0.05% concentration. |
| Anti-Human CD56 (NCAM) Antibody [Mouse] | BD Pharmingen | 555518 | Use at 1 : 50. |
| Propidium iodide | Sigma Aldrich | P4170 | Dilute to 1mg/mL in PBS and keep sterile. Use at 1:1000 to achieve a concentration of 10µg/mL. |
| Reagents for Glass Coverslips | |||
| Autoclaved deionized water | |||
| Alconox detergent | Sigma Aldrich | Z273228 | |
| Ethanol 95% | |||
| Nitric Acid | Sigma Aldrich | 438073-M | CAUTION: Concentrated nitric acid is highly corrosive, and its vapours are potentially harmful. |
| Concentrated hydrochloric acid (HCI) | CAUTION: Concentrated hydrochloric acid is highly corrosive, and its vapours are potentially harmful. | ||
| Reagents for Immunocytochemistry | |||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin |
| Triton X-100 | Fisher Scientific | 10254640 | Use at a concentration of 0.1%. |
| Serum [Donkey] | Merck Millipore | S30-100ML | |
| Anti-MAP2 Antibody [Chicken] | Abcam | ab5392 | Use at a concentration of 1 : 5,000. |
| Tau HT7 Monoclonal Antibody [Mouse] | ThermoFisher Scientific | MN1000 | Use at a concentration of 1 : 500. |
| Cy3 Anti-Chicken Antibody [Donkey] | Jackson ImmunoResearch | 703-165-155 | Use at a concentration of 1 : 400. |
| Alexa Fluor488 Anti-Mouse Antibody [Donkey] | Jackson ImmunoResearch | 715-545-150 | Use at a concentration of 1 : 400. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| Equipment | |||
| T75 flask [Nunclon Delta Surface] | ThermoFisher Scientific | 156499 | |
| 24-well plate [Nunc] | ThermoFisher Scientific | 142485 | |
| 1.5 mL polypropylene tube | Sigma Aldrich | Z336769 | |
| 15 mL falcon tube | Sarstedt | 62.554.502 | |
| 50 mL falcon tube | Sarstedt | 62.547.254 | |
| CryoPure tube 1.6 mL | Sarstedt | 72.380 | |
| Pippette controller | For pipetting volumes 1-25 mL. | ||
| Sterile serological pipettes: 5, 10 and 25 mL | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Adjustable volume pipettors: 5, 20, 200, and 1,000 µL | |||
| Sterile pipette tips | For pipetting volumes of 0.5 - 1,000 µL. | ||
| Glass coverslips | NeuVitro | GG-12-1.5-oz | #1.5 thickness, 12mm diameter, 0.5oz, CE certified, fit 24 well plates. |
| Glass dish | Approximately 150mm diameter. | ||
| Glass beaker | Make sure to have an appropriate size beaker for the sonicator bath available. Water from the sonicator bath should not overflow into the glass beaker. | ||
| Parafilm M | VWR | ||
| ThawSTAR Automated Cell Thawing System | BioCision | BCS-601 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | |
| Cell counting chambers [50 slides] and trypan blue [0.4%] | ThermoFisher Scientific | C10228 | For use with Countess II Automated Cell Counter. |
| CoolCell Cell LX Controlled-rate Freezing Container | Biocision | BCS-405 | |
| Laminar flow hood | |||
| Humidified 5% CO2 37 °C incubator | |||
| Centrifuge | Suitable for 1,5, 15 and 50 mL tubes. | ||
| Orbital shaker | |||
| Sonicator - Bransonic Model B200 cleaner | Sigma Aldrich | Z305359 | Frequency = 50-60Hz, Amplitude = 30 Watts |
| FACS Aria III cell sorter | BD Pharmingen | ||
| Phase contrast microscope | Olympus | CKX31 | |
| Inverted fluorescence microscope | Leica | DMI6000 B |
References
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17, 170-182 (2016).
- Mertens, J., et al. Directly Reprogrammed Human Neurons Retain Aging-Associated Transcriptomic Signatures and Reveal Age-Related Nucleocytoplasmic Defects. Cell Stem Cell. 17, 705-718 (2015).
- Hashizume, O., et al. Epigenetic regulation of the nuclear-coded GCAT and SHMT2 genes confers human age-associated mitochondrial respiration defects. Sci Rep. 5, 10434 (2015).
- Lapasset, L., et al. Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes Dev. 25, 2248-2253 (2011).
- Huh, C. J., et al. Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. Elife. 5, (2016).
- Drouin-Ouellet, J., et al. REST suppression mediates neural conversion of adult human fibroblasts via microRNA-dependent and -independent pathways. EMBO Mol Med. , (2017).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat Protoc. 1, 241-245 (2006).
- Richner, M., Victor, M. B., Liu, Y., Abernathy, D., Yoo, A. S. MicroRNA-based conversion of human fibroblasts into striatal medium spiny neurons. Nat Protoc. 10, 1543-1555 (2015).
- Lau, S., Rylander Ottosson, D., Jakobsson, J., Parmar, M. Direct neural conversion from human fibroblasts using self-regulating and nonintegrating viral vectors. Cell Rep. 9, 1673-1680 (2014).
- Pfisterer, U., Wood, J., Nihlberg, K., Hallgren, O., Bjermer, L., Westergren -Thorsson, G., Lindvall, O., Parmar, M. Efficient induction of functional neurons from adult human fibroblasts. Cell Cycle. 10, 3311-3316 (2011).
- Caiazzo, M., Dell'Anno, M. T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., Sotnikova, T. D., Menegon, A., Roncaglia, P., Colciago, G., Russo, G., Carninci, P., Pezzoli, G., Gainetdinov, R. R., Gustincich, S., Dityatev, A., Broccoli, V. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476, 224-227 (2011).
- Masserdotti, G., Gascón, S., Götz, M. Direct neuronal reprogramming: learning from and for development. Development. 143, 2494-2510 (2016).
- Pereira, M., Pfisterer, U., Rylander, D., Torper, O., Lau, S., Lundblad, M., Grealish, S., Parmar, M. Highly efficient generation of induced neurons from human fibroblasts that transplantation into the adult rat brain. Sci Rep. 4, 6330 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved