Method Article
דור פשוטה של תרבות תשואה גבוהה של נוירונים המושרה מ Fibroblasts עור מבוגר
In This Article
Summary
התכנות עצביים ישיר יוצרת הנוירונים זה לשמור על הגיל לתא ההתחלה סומטיים. כאן, אנו מתארים שיטה המבוססת על וקטורים יחיד לייצר נוירונים המושרה fibroblasts עורי שהושג מתורמים האנושי למבוגרים.
Abstract
המושרה נוירונים (iNs), התוצר של תאים סומטיים המרה ישירות נוירונים, הם דרך להשגת נוירונים נגזר החולה מרקמות כי הוא נגיש בקלות. דרך זו, ניתן להשיג נוירונים בוגרים עניין של כמה שבועות. כאן, אנו מתארים את פרוטוקול בשלב אחד פשוטה ומהירה להשיג תוספות של עורי fibroblasts מושגת באמצעות דגימות ביופסיה מתורמים האנושי למבוגרים. נוכל להסביר כל שלב של התהליך, לרבות קיום עורי fibroblasts, הליך ההקפאה לבנות מלאי של הקו הסלולרי, זריעה של התאים עבור התכנות, כמו גם התנאים תרבות במהלך תהליך ההמרה. בנוסף, אנו מתארים את הכנת coverslips זכוכית דקה הקלטות אלקטרופיזיולוגיות, לטווח ארוך תנאים ציפוי של התא פלורסצנטיות מופעל מיון (FACS). אנחנו גם להמחיש דוגמאות לתוצאות צפויות. הפרוטוקול המתואר כאן הוא קל לביצוע, fibroblasts יישומית האדם הנגזרות ביופסיות עור מחולים עם אבחנות שונות בגילאים שונים. פרוטוקול זה מייצר כמות מספקת של תוספות אשר יכול לשמש עבור מגוון רחב של יישומים ביו-רפואית, כולל המידול מחלת, והתרופות הקרנה היעד אימות.
Introduction
פיתוח תכליתי טיפולים עבור הפרעות נוירולוגיות יש כבר הקשו על ידי גישה מוגבלת לתאי המוח האנושי חי כדי לבצע מחקרים מכניסטית, מבחני פונקציונלי. לפני כעשור, מצב זה השתנה באופן קיצוני עם התפתחות pluripotent המושרה תא גזע (iPSCs) טכנולוגיה1,2. זה, בשילוב עם הבנה טובה יותר של המנגנונים העצביים בידול המתרחשים במהלך ההתפתחות האנושית הרגילה, אפשרה לדור של תת עצביים מוגדרים ומגוונים מן החומר הספציפי החולה ומחלות. עם חומר כזה, עכשיו זה אפשרי ללמוד מנגנונים תאיים שבבסיס את הפוטנציאל של תרכובות שונות כדי להקל על אלה תכונות פתולוגיים3ומחלות נוירולוגיות.
בעוד iPSCs היה מהפכני בתחום של מדעי המוח, אחד החיסרון העיקרי של תאים אלה הוא כי החתימה שלהם הזדקנות נמחק במהלך תהליך התיכנות בצורה כזאת, כי נוירון מחודש לא שומרים על הפגיעות המשויך הזדקנות4,5,6. תכונה מיוחדת זו של הנוירונים המיוצרים שבסופו ביקורתי על היבטים רבים של המפל פתוגניים תאיים, במיוחד במקרה של מחלות אשר בגיל מבוגר הינו גורם סיכון חשוב recapitulating.
ישיר התכנות עצבית היא טכנולוגיה שבו תאים סומטיים מומר ישירות ב מבלי לעבור דרך pluripotent ביניים הבמה. דבר זה מאפשר יצירה מהירה של נוירונים אנושיים במבחנה ניתן גם למטופל וגם מחלות ספציפיות. מאפיין יוצא דופן אחת של התכנות ישירה היא גיל התחלת מהתא התורם נשמר, עם זה, כדי הזדקנות תהליכים כגון הפגיעות שלו גדל הייצור של סטרס חמצוני4,7. כתוצאה מכך, תוספות של חולים עם מחלות נוירולוגיות הקשורים עם הזדקנות, כמו אלצהיימר, פרקינסון, מתאימים היטב למגוון רחב של יישומים ביו כולל מחלת דוגמנות, סמים הקרנת מבחני, ומחקרים טוקסיקולוגיה .
אזהרה הראשי זה מנעה הארצי של חולים עם הפרעות ניווניות בשימוש נרחב הוא כי הם אינם קלים לתכנת, זה הופך להיות קשה עוד יותר עם התרחבות fibroblasts. כתוצאה מכך, דור של תאים בכמויות הדרושות עבור סוגים אלה של יישומים לא הושגה עד לאחרונה רק8. עכשיו פיתחנו שיטה פשוטה לתכנת fibroblasts מתורמים בכל גיל בצורה יעילה מאוד. שיטה זו משלבת ביטוי מאולץ של גורמי שעתוק עצביים Ascl1 ו- Brn2 עם נוק-אאוט של מדכא. שבולם חלבון להשתיק RE1 שעתוק הגורם (השאר) באמצעות וקטור יחידה. כאן, אנו מתארים את השלבים השונים שהובילו הדור של תוספות שהומרו מהעור fibroblasts ביופסיה מתורמים קשישים.
Protocol
Fibroblasts עורי למבוגרים היו המתקבל המרפאות למחקר מחלת פרקינסון, מחלת הנטינגטון במרכז ג'ון ואן גיסט לתיקון המוח (קיימברידג ', בריטניה) ומשמשת תחת אישור מוסרי המקומית (REC 09/H0311/88). לקבלת פרטים אודות ההליך דגימה ביופסיה של העור, ראה הפניה8.
1. הכנה של העור Fibroblasts התכנות
- באמצעות תא אוטומטיות מפשיר מערכת או באמבט מים 37 ° C, להפשיר את הבוגרים fibroblasts עורי אנושי (aHDFs), צלחת 200,000 לכל T75 הבקבוק (ספירה עם מונה הניתן תא אוטומטיות) ב- 10 מ"ל של פיברובלסט בינוני (ראה טבלה 1) ב- 37 מעלות צלזיוס ב 5% CO2.
- לבצע שינוי בינונית בינונית פיברובלסט ביום הבא.
- לשנות את המדיום פיברובלסט כל 3-4 ימים עד התאים מגיעים confluency 95%.
הערה: הבקבוק confluent אחד יכיל כ 1,000,000 תאים. AHDFs שיכול להיות קפוא כדי לבנות של המניות של הקו הסלולרי (סעיף 2) או ישירות מחדש מצופה מוכן עבור התכנות (סעיף 3).
2. הקפאה של העור Fibroblasts
- במקום מיכל הקפאה בקצב מבוקר בתוך קופסה עם קרח או במקרר-4 מעלות צלזיוס.
- מביצועם התאים עם 0.05% טריפסין (1.5 מ"ל לכל T75 הבקבוק) ב 37 מעלות צלזיוס למשך 3-5 דקות.
- הוסף בינוני פיברובלסט (מכיל סרום שור עוברית (FBS)) כדי לנטרל את טריפסין (3 מ"ל פלאש לכל T75 הבקבוק) ולאסוף התאים מנותקת בשפופרת 15 מ"ל על ידי שטיפה את התאים הבקבוקון פעמיים.
- לספור את התאים באמצעות הדלפק תא אוטומטית; ההקפאה (מומלץ) aHDFs כ 500,000 לכל מבחנה.
- ספין למטה התאים ב 400 g x במשך 5 דקות.
- Resuspend בגדר תא ב 1 מ"ל של מדיום קפוא (ראה טבלה 1) והעברת לתוך הצינור ההקפאה. מניחים את הצינורות ישירות לתוך המיכל הקפאה בקצב מבוקר.
- אחסן את קצב מבוקרת קפוא המנגנון ב-80 מעלות צלזיוס למשך הלילה. למחרת, העברת הצינורות ל-140 מעלות צלזיוס מקפיא ולאחסן עד שהוא נדרש.
3. ציפוי עבור התכנות (יום − 1)
הערה: מומלץ להשתמש ציפוי הג'לטין לניסויים לטווח קצר (עד 30 ימים); לחלופין, לניסויים לטווח ארוך מומלץ להתחיל בפולי-L-ornithine, fibronectin וציפוי laminin (PFL).
- 60 דקות לפני ציפוי של aHDFs עבור התכנות, מעיל צלחת 24-ובכן עם ג'לטין 0.1% (250 µL טוב), דגירה ב 37 º C.
- האחות המדיום פיברובלסט על aHDFs. לשטוף פעם עם DPBS. מביצועם התאים עם 0.05% טריפסין (1.5 מ"ל לכל T75 הבקבוק) ב 37 מעלות צלזיוס למשך 3-5 דקות.
- הוסף פיברובלסט בינוני לנטרל את טריפסין (3 מ"ל פלאש לכל T75 הבקבוק) ולאסוף את התאים מנותקת בשפופרת 15 מ"ל על ידי שטיפה את התאים הבקבוקון פעמיים.
- ספין למטה התאים ב 400 g x עבור 5 דק להשליך תגובת שיקוע ולאחר resuspend בגדר תא ב 1 מ"ל של פיברובלסט בינוני.
- לספור את התאים באמצעות מונה הניתן תא אוטומטיות (כדי להבטיח צ'ק. המרת באיכות טובה הכדאיות תא מעל 90% עם trypan blue מכתימה).
- בשביל צלחת מלאה 24-. טוב, הכינו השעיה של תאים 1,320,000 ב- mL 13.2 פיברובלסט בינוני כדי להשיג השעיה של 100,000 תאים למ"ל בינוני (או תאים/באר 55,000 µL 550 בינוני פיברובלסט מוכפל מספר בארות הדרושים).
- האחות הג'לטין מהצלחת, לשטוף פעמיים עם DPBS. להוסיף 500 µL של התליה תא מכל קידוח, דגירה בין לילה ב- 37 מעלות צלזיוס ב 5% CO2.
4. נגיפי התמרה חושית (יום 0)
הערה: עבודה עם חלקיקים lentiviral דורש ציוד קטגוריה 2 השימוש של סוכן כדי לנטרל. את הוירוס. מומלץ מאוד גם לובש זוגי זוגות של כפפות.
- לחמם 13.2 מיליליטר פיברובלסט בינוניים עד 37 מעלות צלזיוס.
- הפשרת וקטור lentiviral המכיל את גורמי שעתוק Ascl1 ו- Brn2 עם סיכת ראש קצר שני RNAs (shRNA) מיקוד לנוח בטמפרטורת החדר.
הערה: עיין להפנות8; הבונה זמינה במאגר פלסמיד. לפרטים על ההליך כדי לייצר lentiviruses נא לפנות להפנות9. - הוסף את אמצעי האחסון הדרושים של lentivirus כדי להדביק את aHDFs-ריבוי של זיהום (MOI) של 20 המדיום ללא כל משפרי התמרה חושית.
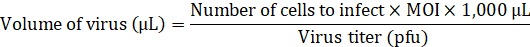
- להחליף את המדיום בצלחת 24-ובכן פיברובלסט בינוני המכיל את הווקטור lentiviral (500 µL טוב), דגירה בין לילה ב- 37 מעלות צלזיוס ב 5% CO2.
- למחרת, החלף המדיום בבארות פיברובלסט טריים בינונית ללא וקטור lentiviral.
הערה: המדיום הוא נחשב זיהומיות במשך 7 ימים, ככזה, הגנה נאותה ופרוצדורות טיפול יש להשתמש במהלך השבוע הראשון לאחר התמרה חושית ויראלי.
5. תחזוקה של תאי המרה
הערה: לאחר ההמרה מתחילה תאים רגישים הרמה; לטפל כדי עצה את הצלחת והשתמש על פיפטה µL 1,000 בעת הסרת המדיה כדי להימנע תאים ניתוק.
- יום 3, להסיר המדיום פיברובלסט ולהוסיף 500 µL בינוני עצביים המרה מוקדמת (ראה טבלה 1).
- פעמיים או שלוש פעמים בשבוע, להוציא 225 µL של המדיום הישן מן הבאר, תוספת 250 µL טרי בינוני עצביים המרה מוקדמת.
- ביום 18, להסיר את כל של המדיום מכל קידוח ולהחליף עם 500 µL בינוני ההמרה עצביים מאוחר (ראה טבלה 1).
- להמשיך לשנות חצי של המדיום כמו מעל בינונית ההמרה עצביים מאוחר כל 2-3 ימים עד יום 25 או קצה של הניסוי (איור 1 א').
הערה: אם התאים הם לא מצופה היטב כל לניסוי, מלא בארות ריק עם PBS או מים כדי למנוע אידוי עבירה של המדיום ולצמצם את הווריאציה בין בארות.
| ריכוז מניות | ריכוז העבודה | |
| פיברובלסט בינוני | ||
| הבסיס בינוני | N/A | N/A |
| פניצילין/סטרפטומיצין | 10,000 U/mL | 100 מ"ג/מ"ל |
| FBS | N/A | 10% |
| הקפאת בינוני | ||
| פיברובלסט בינוני | N/A | 45% |
| FBS | N/A | 45% |
| דימתיל סולפוקסיד | N/A | 10% |
| המרה עצביים מוקדם בינוני (ENM) | ||
| בידול עצבי בינוני | N/A | N/A |
| פניצילין/סטרפטומיצין | 10,000 U/mL | 100 מ"ג/מ"ל |
| CHIR99021 | 10 מ מ | 2 מיקרומטר |
| SB-431542 | 20 מ מ | 10 מיקרומטר |
| הראש | µg 100/mL | µg 0.5/mL |
| -כעבור שנה--1931189 | 10 מ מ | 0.5 מיקרומטר |
| VPA | 1 מ' | 1 מ מ |
| LM-22A4 | 20 מ מ | 2 מיקרומטר |
| GDNF | µg 20/mL | 2 ng/mL |
| NT3 | µg 10/mL | 10 ng/µL |
| db-מחנה | 50 מ מ | 0.5 מ מ |
| המרה עצביים מאוחר בינוני (LNM) | ||
| בידול עצבי בינוני | N/A | N/A |
| פניצילין/סטרפטומיצין | 10,000 U/mL | 100 מ"ג/מ"ל |
| LM-22A4 | 20 מ מ | 2 מיקרומטר |
| GDNF | µg 20/mL | 2 ng/mL |
| NT3 | µg 10/mL | 10 ng/µL |
| db-מחנה | 50 מ מ | 0.5 מ מ |
| מאגר FACS | ||
| HBSS 1 x [סידן, מגנזיום, - פנול אדום] | N/A | N/A |
| BSA | N/A | 1% |
| DNAase | N/A | 0.05% |
טבלה 1: הרכב של התקשורת השונים בשימוש. תיאור מלא של ההרכב על כל אמצעי התקשורת הדרושים פרוטוקול זה כולל פיברובלסט בינוני, הקפאת בינוני, בינוני עצביים המרה מוקדמת, לאחר ההמרה עצביים בינוני ו FACS מאגר.
6. coverslips זכוכית דקה להקלטות אלקטרופיזיולוגיות
הערה: מומלץ ללבוש חלוק מעבדה, משקפי מגן, כפפות כפול של להשלים את כל העבודות בשכונה fume... פרוטוקול זה הוא ממאמרו של 10.
- הצב coverslips זכוכית דקה בתחתית צלחת זכוכית ללא חפיפה.
- להוסיף כללי מעבדה ניקוי דטרגנט להטביע את כולם coverslips מבלי להסתכן גלישה במהלך רועד (כ- 30 מ"ל). מניחים על גבי שאכר מסלולית במהירות איטית במשך שעתיים.
- לשטוף שש פעמים (30 דקות כל אחד) עם בלוק מים יונים.
- הוספת אתנול 95% עבור 2 h.
- הסר האתנול והמתן עד coverslips יבשים.
- פעם יבש, להעביר את coverslips לתוך גביע זכוכית ולהוסיף חומצה חנקתית 70% עד coverslips טובע.
- מניחים את הספל זכוכית למקלחת sonicator עבור 60 דקות.
- הסר את חומצה חנקתית, לשטוף שלוש פעמים עם מים יונים בלוק.
התראה: תמיד להוסיף חומצה למים, לא להיפך, כמו זה יכול להוביל לתגובה אלימה. - להסיר כמה שיותר מים כשהספל ככל האפשר ולהוסיף חומצה הידרוכלורית מרוכזת (HCI) עד coverslips טובע; מערבולת את הספל ולכסות עם סרט פרפין.
- Sonicate עבור 60 דקות (50-60 הרץ, 30 W).
- להסיר כמה שיותר HCI coverslips ככל האפשר, המקום לתוך סל פסולת מתאים. לשטוף עם מים יונים בלוק פעמיים.
- קח על coverslips מחוץ למכסה, לשטוף 20 פעמים (או יותר) עם מים יונים בלוק עד כל HCI יוסר.
- פעם יבש, מקום coverslips לוחות 24-ובכן סטרילי.
- מקם את הצלחות אולטרה סגול (UV) אור בן לילה. למחרת coverslips מוכנים לשימוש.
הערה: אם נעשה שימוש coverslips זכוכית דקה, מומלץ להשתמש הציפוי PFL. פשוט למקם את אחד coverslip כל טוב של צלחת 24-היטב (באמצעות מלקחיים סטרילי), לפי התקנון להלן.
7. PFL ציפוי לתרבות לטווח ארוך
- מעיל לצלחת 24-ובכן עם פולי-L-ornithine (500 µL טוב) ולהשאיר ללילה ב 37 ° C 5% CO2.
- וארוקן את פולי-L-ornithine, לחכות עד שיהיה מספיק יבש טופס טיפות על העליונה.
- להפוך טיפת (כ-60 µL) laminin במרכז של כל טוב ופרש לכסות את המשטח כולו של coverslip. יוצאים h 2 45 min ב- 37 מעלות צלזיוס ב 5% CO2.
- לשטוף שלוש פעמים עם DPBS.
- הוסף fibronectin (500 µL טוב), להשאיר למשך הלילה ב- 37 מעלות צלזיוס ב 5% CO2.
- לשטוף פעם עם DPBS לפני הוספת תאים.
הערה: ציפוי PFL יכול לשמש זמן המונח תרבויות של In (מעל 100 ימים), למרות מות תאים פרוגרסיבי הוא צפוי מיום 30.
8. FACS
הערה: על צלחת מחדש את התאים לאחר FACS מיון להכין צלחת מצופים PFL 48 שעות מראש. ניתן למיין תאים באמצעות תאי העצבים אדהזיה נוגדן מולקולה (NCAM), מיום 20 ואילך בעקבות התמרה חושית.
- להסיר את התקשורת עם פיפטה 1,000 µL (לא לשטוף כדי להימנע תאים ניתוק).
- הוסף תא בריא הסוכן (250 µL טוב), להשאיר למשך 10 – 20 דקות עד התאים, תניף ו לצוף כמו תאים בודדים.
- במהלך תקופה זו להכין את המאגר FACS.
- Triturate בעדינות עם פיפטה 1,000 µL. אם נשארים כמה גושים, דגירה קצת יותר זמן.
- לאחר השעיה תא בודד מתקבל, להסיר אותו מן הבאר ולמקם לתוך צינור 1.5 מ.
- לרוקן הבאר פעמיים עם בינוני ההמרה עצביים מאוחר והמקום לתוך הצינור 1.5 mL אותו.
- ספין למטה-400 g x עבור 5 דקות וזורקים את תגובת שיקוע.
- Resuspend בגדר תא ב 200 µL מאגר FACS.
- ספין למטה התאים ב 400 g x עבור 5 דקות וזורקים את תגובת שיקוע.
- חזור על שלבים 8.8 ו- 8.9 פעמיים.
- Resuspend בגדר תא ב- 50 µL FACS מאגר המכיל נוגדנים אנושיים CD56 (NCAM)-ריכוז של 1:50 למשך 15 דקות על קרח. להגן מפני אור.
- ספין למטה התאים ב 400 g x במשך 5 דקות.
- Resuspend במאגר FACS µL 200 לשטוף את ספין למטה התאים ב 400 x g למשך 5 דקות.
- חזור על שלב 8.13.
- Resuspend ב µL 200 FACS מאגר המכיל propidium יודיד (PI; 10 µg/mL). למיין את NCAM חיובי (iNs) ותאים PI שלילי (חיים) באמצעות FACS gating מבוסס על קרינה פלואורסצנטית האינטנסיביות של דגימות הבקרה היו מוכתמים עם נוגדנים NCAM או PI.
- איסוף התאים חיובי NCAM בשפופרת המכיל מאוחר עצביים המרה בינוני.
- לספור את התאים באמצעות, מונה תא אוטומטיים ו צלחת מחדש את התאים ב צפיפות גבוהה (50,000 תאים/cm2) במדיום ההמרה עצביים מאוחר בקערה PFL מצופה.
- להמשיך לשנות חצי של המדיום 2-3 פעמים בשבוע מאוחר ההמרה עצביים בינונית עד הקצה הניסוי (איור 1 א').
תוצאות
שינוי ברור מורפולוגיה התא צריך להיות גלוי מיום 5 ואילך (איור 1B). מות תאים מסוימים אמנם צפוי לאחר התמרה חושית ויראלי, לא בגלוי. מכל קידוח לתוך צלחת 24-ובכן תשואה בתא סכום של 20,000-40,000 תאים אמור להיות צפוי ביום 25, מתוכם כמחצית צריכה להפוך נוירונים. חשוב לציין כי התשואה וטוהר יכול להשתנות על פני תאים בטור, כמו גם עם מחלת המדינה ווירוסים אצוות.
התאים מבטאים סמנים עצביים הכי סטנדרטי כולל MAP2 וטאו (איור 1C) ביום 25 בנוסף מפגין מורפולוגיה עצביים בוגרת. זה אפשרי לקבל טהור באוכלוסיה על-ידי ביצוע FACS המבוסס על סמן NCAM (ראו הפניות8,11). התאים יכולים לאחר מכן להיות גם מחדש מצופה על ציפוי טריפל PFL (ראה התייחסות10) או ישירות קפוא עבור ניתוחים למערכות ביולוגיות.
אם התאים לא ממוינים, immunofluorescence תיוג עם MAP2 או טאו צריך להיות שבוצעה כדי לזהות את התאים שהומרו בהצלחה ומוענקת משותפת החלבון עניין.

איור 1: האבולוציה של ההמרה בתוך לאורך זמן. ציר הזמן של הניסוי, מפה של הבונה בחבילה של lentivirus נהגה לתכנת מחדש את הבוגרים fibroblasts עורי אנושי (A). כל חץ שחור מייצג שינוי בינוני. (B) שלב נציג חדות תמונות המתארות את השינויים במורפולוגיה של תאים במהלך תהליך ההמרה בין יום 0 עד יום 22 (כפי שמצוין על הפינה הימנית העליונה של כל לוח). התמונות צולמו על מיקרוסקופ לעומת זאת שלב באמצעות המטרה X 10. (ג) Immunofluorescence דימוי טאו, MAP2 זוגי מכתים-התמרה חושית שלאחר יום 35. התאים היו קבוע ב- 4% paraformaldehyde ו- permeabilized עם 0.1% Triton ב- DPBS עבור 10 דקות תאים נחסמו למשך 30 דקות בפתרון סרום 5% ב- DPBS. הנוגדנים היו מעורבבת עם חסימת פתרון, חלה בן לילה ב 4 º C. Fluorophore מצומדת נוגדנים משניים היו מעורבבת עם חסימת פתרון ומוחלים על ה 2 תאים היו counterstained עם דאפי למשך 15 דקות ולאחריו 3 מנקי עם DPBS. התמונות צולמו על מיקרוסקופ פלורסצנטיות הפוכה באמצעות המטרה X 20. גודל ברים = 100 מיקרומטר (B, C). קיצורים: ENM: בינוני עצביים מוקדם; LNM: בינוני עצביים מאוחר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
וקטור זה one-step/one התכנות שיטת מספק דרך יעילה להשיג תוספות של האדם fibroblasts למבוגרים. האדם fibroblasts למבוגרים הם בדרך כלל הרבה יותר קשה כדי להמיר מאשר fibroblasts עוברית, עם המחקרים מוגבלת קודם לכן דיווח על היעילות של 5-10%12,13. עם זאת, עם פרוטוקול חדש זה אפשרי להשיג תשואה עצביים (נמדד כתאים MAP2 +) של 50%8. בנוסף, פרוטוקול שלנו יכול לשמש על עורי fibroblasts זה יש כבר passaged מספר פעמים מבלי לאבד את היעילות של ההמרה. עד כה השתמשנו תאים passaged עד 14 פעמים ללא זיהוי כל ירידה ביעילות ההמרה. כמו כן, אין שום הבדל ב התכנות יעילות בידיים שלנו עם fibroblasts מתורמים בגיל בין 52 ל- 87. לפרטים נוספים על גיל, מחלות של שורות תאים אחרים שנבדקו עם המבנה הזה, ראה הפניה8. מחקרים אחרים דיווחו גם אין הבדל יעילות ההמרה באמצעות פרוטוקול מבוסס על lentiviral וקטנים מולקולה בעלת משופרת עם תורמים בין 0 ל- 89 שנים4. יתר על כן, ישימות עקבית עם מבוססי miRNA התכנות עצביים דווח ב fibroblasts בני כל הגילאים, תורמים בין 0 לבן 867. דרך זו, ניתן להשיג נוירונים בוגרים כ 12-15 שבועות במבחנה או 8 שבועות בעקבות השתלת ויוו8בקירוב. זה יתרון כי זה נותן גישה המחלה והן החולה תוספות אנושי ספציפי מרקמות כי הוא נגיש בקלות. פרוטוקול זה אמנם יעילה, הוא לא יפיק תשואה עצביים 100%, כך נדרש צעד טיהור באמצעות FACS למשל.
השלב הקריטי ביותר בתוך פרוטוקול זה הוא ויראלי התמרה חושית (פרוטוקול סעיף 4). זה הכרחי כי כייל וירוס הוא מדויק, בנוסף יש מצופה מספר מדויק של aHDFs עבור המרה. כייל נוגדנים מומלץ לשימוש עם פרוטוקול זה הוא בין 4 x 108 ו 4 x 109. כייל של משהו מתחת עונה 1 פרק 108 לא להיות מומלץ להשתמש כמו הוספת כמויות גדולות של וירוס יהיה רעיל לתאים. יתר על כן, כאשר fibroblasts מתחיל חשאי כדי תוספות הם יהפכו רגישים הרמת וחלשים יותר. זה חיוני כדי להיות עדין בעת שינוי התקשורת כדי לא להפריע יותר מדי את התאים. ניתן לבצע זאת על-ידי הסרת את הנוזלים באיטיות עם פיפטה 1,000 µL. לבסוף, כאשר ציפוי עבור התכנות (פרוטוקול בסעיף 3) זה חשוב לוודא אוכלוסיה בריאה פיברובלסט לפני תחילת הניסוי; זה מציינים הכדאיות תא של מעל 90% עם trypan blue מכתים. תמיד צריך להיות passaged את aHDFs לפני שהגיע confluency 95%.
אם יש מוות של תאים מורגש לפני התמרה חושית ויראלי, לא מתחילים המרה: שח כפול כי הכדאיות תא היא מעל 90%, כך שלא היו בעיות עם ציפוי של הצלחת. הוא צפוי יש כמות קטנה של מוות של תאים בעקבות התמרה חושית ויראלי, עם זאת, זה לא צריך להיות משמעותי. במקרה זה, לאשר זריעה מדויקת של 50,000 aHDFs/טוב, לבדוק כייל את הוירוס. אם קיים חוסר עקביות מורגש בין הבארות במהלך ההמרה, בדוק תחילה כי כל טוב מכיל כמות שווה של מדיה, אידוי עבירה אינה מתרחשת בקצוות (אם ניתן להוסיף מדיה נוסף הכרחי הבארות edge). לחלופין, בדוק שלב 4.4, ולהבטיח ערבוב המתאים עבור השעיה הומוגנית כאשר transducing. חשוב להוסיף את lentivirus למדיום קודם, לפני הוספת את זה לתוך הבארות. הוספת ישירות lentivirus לתוך הבארות יגדל השתנות טוב עד טוב והוא גם עלולים להיות רעילים לתאים. לבסוף, בדוק תמיד כי המדיום הוא חימם את 37 ° C לפני הוספת תאים.
פרוטוקול זה כולל מקטעים אופציונליים עבור תנאים ציפוי לתרבות לטווח ארוך של FACS מיון כדי להגדיל את טוהר עצביים והתבניות. לניסויים המבקשים לחקור את אפיון פונקציונלי של In, עבור הכנה של coverslips זכוכית דקה אלקטרופיזיולוגיה פרוטוקול גם היה כלול. פרוטוקול ההמרה כאן מוגדר לשימוש עם צלחת 24-טוב; אם רצונך בכך זה ניתן לשנות ל 6, 12, 48-, 96-ובכן צלחת או מבחנות. במקרה זה, אנא התאם כל אמצעי האחסון פני השטח של הלוח או הבקבוק מנוצל.
פרוטוקול זה משתמש ביטוי מאולץ של Ascl1 ו- Brn2 בשילוב עם מנוחה נוקאאוט כל ארוזים אחד וקטור יחידה8 ליצירת תוספות של הפנוטיפ פאן עצבית. הדור של כל סוגי גליה בשיטה זו, עם זאת, יש לא להיות מוערך. שיטה זו ולכן צריכים להיות שונה לשימוש עם גורמים אחרים התיכנות כדי לקבל סוג של נוירונים ספציפיים. התכנות ישירה בעבר הראו את האפשרות לייצר מוטורי לגלוקוז, החישה הניריונים, photoreceptors, נוירונים קוצני בינוני striatal ו10,של נוירונים דופאמין14. זה יהיה מועיל, כשחוקרים מחלות נוירולוגיות איזה סוג עצביים מסוימים מעדיפים מושפעות, למשל מחלת פרקינסון, נוירונים דופאמין.
עד לאחרונה, ישיר טכנולוגיה התיכנות עצבית לא התירו לייצור של תוספות בצורה סטנדרטית ויעיל — לרמה הנדרשת עבור רעלים וסמים הקרנת מבחני בקנה מידה גדול. שיטה חדשה זו יעילה מאוד והוא יכול לשמש על fibroblasts זה יש כבר passaged פעמים רבות, כך זה עכשיו מסיר הגבלות אלה, נפתח עבור מגוון רחב של מחקרים, לא רק במערכת העצבים האנושית, אלא גם במערכת שניתן לחולה ספציפי. את הפשטות של גישה זו הופך את הטכנולוגיה בתוך נגישים עבור כל קבוצות המבקשים לבצע מחקרים דומים שבאתר ואת יכולה בקלות לשמש לא רק עבור יישומים ביו בקנה מידה גדול, כגון והתרופות הקרנה, מבחני רעלים, אלא גם לתמיכה נתונים נגזר מודלים של בעלי חיים, דגימות רקמה אנושית אחרי המוות .
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים מארי פרסון Vejgården לקבלת סיוע טכני. המחקר שהוביל את התוצאות הללו קיבלה מימון קרן תאי גזע בניו-יורק, המועצה האירופית למחקר תחת תכנית המסגרת השביעית של האיחוד האירופי: FP 2007-2013 נוירו תאי גזע (מספר 602278) ותיקון הסכם גרנט ERC אין. 30971, המועצה למחקר השבדי (להעניק הסכם 521-2012-5624, 2016-00873 ו- 70862601 / Bagadilico), פרקינסון שבדי קרן (Parkinsonfonden), לבין אזור מחקר אסטרטגי-Multipark אוניברסיטת לונד (מחקר רב תחומי ב מחלת פרקינסון). ג'אנל דראון-Ouellet נתמך על-ידי התחברות קנדי מוסדות של הבריאות מחקר (CIHR) (#358492), רוג'ר בארקר הוא נתמך על ידי מענק NIHR מרכז מחקר ביו-רפואי לבית החולים האוניברסיטה של קיימברידג/Addenbrooke של. מלין Parmar הוא חוקר רוברטסון ניו יורק קרן תאי גזע. שלבי Shrigley ממומן על ידי האיחוד האירופי אופק 2020 התכנית (H2020-MSCA-ITN-2015) תחת מארי הספרותמוזאון רשת הדרכה חדשניות וגרנט הסכם מס 676408.
Materials
| Name | Company | Catalog Number | Comments |
| Cell Lines | |||
| Adult human dermal fibroblasts | [C2 passage #7] Donor was a 67 year old female. Cells obtained from the Parkinson’s Disease Research and Huntington’s disease clinics at the John van Geest Centre for Brain Repair (Cambridge, UK). | ||
| Reagents for Fibroblast Culture, Transduction and Conversion | |||
| Dulbecco's phosphate-buffered saline (DPBS) [-CaCl2, -MgCl2] | Gibco | 14190094 | |
| Trypsin-EDTA [0.5%] | Gibco | 15400-054 | Dilute to 0.05% in DPBS. |
| Virkon (agent used to neutralize virus) | Viroderm | 7511 | Dilute to 1% solution with warm water. |
| Milli-Q Water | Millipore | ||
| Basal medium - Dulbecco’s Modified Eagle Medium (DMEM) + GlutaMax | Gibco | 61965059 | |
| Penicillin/Streptomycin [10,000 U/mL] | Gibco | 15140-122 | |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | |
| CryoMACS® dimethyl sulfoxide (DMSO) 10 | Miltenyi | 170-076-303 | |
| Neural differentiation medium - NDiff 227 | Takara-Clontech | Y40002 | |
| LM-22A4 | Tocris | 4607 | Dilute 10 mg in 1450 µL DMSO. Stock concentration: 20 mM. |
| Glial cell line-derived neurotrophic factor (GDNF) [recombinant human] | R&D systems | 212-GD-010 | Dilute 10 ug in 500 µL 0,1% BSA in DPBS. Stock concentration: 20 µg/mL. |
| NT3 [recombinant human] | R&D systems | 267-N3-025 | Dilute 25 µg in 2,5 mL 0,1% BSA in DPBS. Stock concentration: 10 µg/mL. |
| db-cAMP | Sigma Aldrich | D0627 | Dilute 1 g in 40,7 mL Milli-Q water. Filter and make 500 µL aliquots or stock tubes of 10 mL. Stock concentration: 50 mM. |
| CHIR99021 | Axon | 1386 | Dilute 2 µg in 429,8 µL DMSO. Stock concentration: 10 mM. |
| SB-431542 | Axon | 1661 | Dilute 5 mg in 595 µL DMSO. Stock concentration: 20 mM. |
| Noggin [recombinant human] | Miltenyi | 130-103-456 | Dilute 100 µg in 100 µL of Milli-Q water + 900 µL 0,1% BSA in DPBS. Stock concentration: 100 µg/mL. |
| LDN-193189 | Axon | 1509 | Dilute 2 mg in 360 µL DMSO. Stock concentration: 10 mM. |
| Valproic acid sodium salt (VPA) | Merck Millipore | 676380 | Dilute 5 g in Milli-Q water to acheive a stock concentration of 1 M. CAUTION: Avoid ingestion, contact with skin, and breathing dust formation. |
| Reagents for Coatings | |||
| Gelatin | Sigma Aldrich | G2500 | Dilute to 0.1% in Milli-Q water. |
| Poly-L-ornithine | Sigma Aldrich | P3655 | Dissolve in Milli-Q water. Use at 15µg/mL. |
| Fibronectin | ThermoFisher Scientific | 33010-018 | 2 mL of Milli-Q water + 70 µL 0,25 M NaOH. Use at 5 µg/mL. |
| Laminin | ThermoFisher Scientific | 23017-015 | Store at -80°C. Thaw on ice, keep cool and aliquot 30 µL. Use at 5 µg/mL. |
| Reagents for Fluorescence Activated Cell Sorting | |||
| Cell dissociation agent - Accutase (Stem Pro) | ThermoFisher Scientific | A1110501 | |
| Hanks' Balanced Salt Solution (HBSS) 1X [-calcium, -magnesium, - phenol red] | ThermoFisher Scientific | 14175-046 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | Use at 1% concentration for Anti-Human CD56 (NCAM). |
| DNAase | Sigma Aldrich | DN-25 | Use at 0.05% concentration. |
| Anti-Human CD56 (NCAM) Antibody [Mouse] | BD Pharmingen | 555518 | Use at 1 : 50. |
| Propidium iodide | Sigma Aldrich | P4170 | Dilute to 1mg/mL in PBS and keep sterile. Use at 1:1000 to achieve a concentration of 10µg/mL. |
| Reagents for Glass Coverslips | |||
| Autoclaved deionized water | |||
| Alconox detergent | Sigma Aldrich | Z273228 | |
| Ethanol 95% | |||
| Nitric Acid | Sigma Aldrich | 438073-M | CAUTION: Concentrated nitric acid is highly corrosive, and its vapours are potentially harmful. |
| Concentrated hydrochloric acid (HCI) | CAUTION: Concentrated hydrochloric acid is highly corrosive, and its vapours are potentially harmful. | ||
| Reagents for Immunocytochemistry | |||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin |
| Triton X-100 | Fisher Scientific | 10254640 | Use at a concentration of 0.1%. |
| Serum [Donkey] | Merck Millipore | S30-100ML | |
| Anti-MAP2 Antibody [Chicken] | Abcam | ab5392 | Use at a concentration of 1 : 5,000. |
| Tau HT7 Monoclonal Antibody [Mouse] | ThermoFisher Scientific | MN1000 | Use at a concentration of 1 : 500. |
| Cy3 Anti-Chicken Antibody [Donkey] | Jackson ImmunoResearch | 703-165-155 | Use at a concentration of 1 : 400. |
| Alexa Fluor488 Anti-Mouse Antibody [Donkey] | Jackson ImmunoResearch | 715-545-150 | Use at a concentration of 1 : 400. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| Equipment | |||
| T75 flask [Nunclon Delta Surface] | ThermoFisher Scientific | 156499 | |
| 24-well plate [Nunc] | ThermoFisher Scientific | 142485 | |
| 1.5 mL polypropylene tube | Sigma Aldrich | Z336769 | |
| 15 mL falcon tube | Sarstedt | 62.554.502 | |
| 50 mL falcon tube | Sarstedt | 62.547.254 | |
| CryoPure tube 1.6 mL | Sarstedt | 72.380 | |
| Pippette controller | For pipetting volumes 1-25 mL. | ||
| Sterile serological pipettes: 5, 10 and 25 mL | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Adjustable volume pipettors: 5, 20, 200, and 1,000 µL | |||
| Sterile pipette tips | For pipetting volumes of 0.5 - 1,000 µL. | ||
| Glass coverslips | NeuVitro | GG-12-1.5-oz | #1.5 thickness, 12mm diameter, 0.5oz, CE certified, fit 24 well plates. |
| Glass dish | Approximately 150mm diameter. | ||
| Glass beaker | Make sure to have an appropriate size beaker for the sonicator bath available. Water from the sonicator bath should not overflow into the glass beaker. | ||
| Parafilm M | VWR | ||
| ThawSTAR Automated Cell Thawing System | BioCision | BCS-601 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | |
| Cell counting chambers [50 slides] and trypan blue [0.4%] | ThermoFisher Scientific | C10228 | For use with Countess II Automated Cell Counter. |
| CoolCell Cell LX Controlled-rate Freezing Container | Biocision | BCS-405 | |
| Laminar flow hood | |||
| Humidified 5% CO2 37 °C incubator | |||
| Centrifuge | Suitable for 1,5, 15 and 50 mL tubes. | ||
| Orbital shaker | |||
| Sonicator - Bransonic Model B200 cleaner | Sigma Aldrich | Z305359 | Frequency = 50-60Hz, Amplitude = 30 Watts |
| FACS Aria III cell sorter | BD Pharmingen | ||
| Phase contrast microscope | Olympus | CKX31 | |
| Inverted fluorescence microscope | Leica | DMI6000 B |
References
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17, 170-182 (2016).
- Mertens, J., et al. Directly Reprogrammed Human Neurons Retain Aging-Associated Transcriptomic Signatures and Reveal Age-Related Nucleocytoplasmic Defects. Cell Stem Cell. 17, 705-718 (2015).
- Hashizume, O., et al. Epigenetic regulation of the nuclear-coded GCAT and SHMT2 genes confers human age-associated mitochondrial respiration defects. Sci Rep. 5, 10434 (2015).
- Lapasset, L., et al. Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes Dev. 25, 2248-2253 (2011).
- Huh, C. J., et al. Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. Elife. 5, (2016).
- Drouin-Ouellet, J., et al. REST suppression mediates neural conversion of adult human fibroblasts via microRNA-dependent and -independent pathways. EMBO Mol Med. , (2017).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat Protoc. 1, 241-245 (2006).
- Richner, M., Victor, M. B., Liu, Y., Abernathy, D., Yoo, A. S. MicroRNA-based conversion of human fibroblasts into striatal medium spiny neurons. Nat Protoc. 10, 1543-1555 (2015).
- Lau, S., Rylander Ottosson, D., Jakobsson, J., Parmar, M. Direct neural conversion from human fibroblasts using self-regulating and nonintegrating viral vectors. Cell Rep. 9, 1673-1680 (2014).
- Pfisterer, U., Wood, J., Nihlberg, K., Hallgren, O., Bjermer, L., Westergren -Thorsson, G., Lindvall, O., Parmar, M. Efficient induction of functional neurons from adult human fibroblasts. Cell Cycle. 10, 3311-3316 (2011).
- Caiazzo, M., Dell'Anno, M. T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., Sotnikova, T. D., Menegon, A., Roncaglia, P., Colciago, G., Russo, G., Carninci, P., Pezzoli, G., Gainetdinov, R. R., Gustincich, S., Dityatev, A., Broccoli, V. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476, 224-227 (2011).
- Masserdotti, G., Gascón, S., Götz, M. Direct neuronal reprogramming: learning from and for development. Development. 143, 2494-2510 (2016).
- Pereira, M., Pfisterer, U., Rylander, D., Torper, O., Lau, S., Lundblad, M., Grealish, S., Parmar, M. Highly efficient generation of induced neurons from human fibroblasts that transplantation into the adult rat brain. Sci Rep. 4, 6330 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved