Method Article
Sencilla generación de una cultura de alto rendimiento de las neuronas inducidas de fibroblastos de piel humana adulta
En este artículo
Resumen
Reprogramación neuronal directa genera neuronas que mantienen la edad de la partida de la célula somática. Aquí, describimos un método único basado en vectores para generar neuronas inducidas de fibroblastos dérmicos obtenidos de donantes humanos adultos.
Resumen
Inducida por las neuronas (iNs), el producto de las células somáticas convertido directamente a las neuronas, son una forma de obtener neuronas paciente derivados de tejido que es fácilmente accesible. Por esta vía, las neuronas maduras se pueden obtener en cuestión de unas semanas. Aquí, describimos un protocolo sencillo y rápido de un solo paso para obtener iNs de fibroblastos dérmicos obtenidos mediante biopsias de adultos donantes humanos. Explicamos cada paso del proceso, incluyendo el mantenimiento de los fibroblastos dérmicos, el procedimiento de congelación para la construcción de un stock de la línea celular, siembra de las células para la reprogramación, así como las condiciones de cultivo durante el proceso de conversión. Además, se describe la preparación de vidrio cubreobjetos para grabaciones electrofisiológicas y condiciones a largo plazo de la capa celular de fluorescencia activada (FACS) de clasificación. También ilustran ejemplos de los resultados a esperar. El protocolo descrito aquí es fácil de realizar y pueden ser aplicadas al ser humano los fibroblastos derivados procedentes de biopsias de piel humana de pacientes con diversos diagnósticos diferentes y edades. Este protocolo genera una cantidad suficiente de iNs que se puede utilizar para una amplia gama de aplicaciones biomédicas, incluyendo enfermedad modelado, detección de drogas y validación del objetivo.
Introducción
Desarrollo de tratamientos eficaces para los trastornos neurológicos se han visto obstaculizados por el acceso limitado a las células del cerebro humano vivas para realizar estudios mecanísticos y análisis funcionales. Sobre hace una década, esta situación cambió radicalmente con el desarrollo de pluripotentes inducidas (iPSCs) de la célula de vástago tecnología1,2. Esto, combinado con una mejor comprensión de los mecanismos de diferenciación de los nervios que ocurre durante el desarrollo normal humano, ha permitido la generación de definido y diversos subtipos neuronales de material específico de paciente y enfermedad. Con ese material, ahora es posible estudiar mecanismos intracelulares subyacente a enfermedades neurológicas y el potencial de los diferentes compuestos para aliviar esas características patológicas3.
Aunque iPSCs han sido revolucionarios en el campo de la neurociencia, uno de los principales inconvenientes de estas células es que su firma de envejecimiento se borra durante el proceso de reprogramación de tal manera que la neurona rejuvenecida no conserva la vulnerabilidad asociada a envejecimiento de4,5,6. Esta característica particular de las neuronas que se producen puede terminar siendo crítico para recapitular muchos aspectos de la cascada patógeno intracelular, particularmente en el caso de que la vejez es un factor de riesgo importante de enfermedades.
Directo reprogramación neural es una tecnología donde una célula somática se convierte directamente en un de sin pasar por un pluripotentes paso intermedio. Esto permite la rápida generación de las neuronas humanas en vitro que puede ser paciente y enfermedad específica. Una característica notable de reprogramación directa es que la edad a partir de la célula donante se mantiene, y con eso, su vulnerabilidad a los procesos del envejecimiento tales como aumento de la producción de estrés oxidativo4,7. Como resultado, iNs de pacientes con enfermedades neurológicas asociadas con el envejecimiento, tales como la enfermedad de Alzheimer y enfermedad de Parkinson, son ideales para una amplia gama de aplicaciones biomédicas, incluyendo la enfermedad de modelado, análisis y estudios de Toxicología de la detección de drogas .
La salvedad principal que ha impedido iNs pacientes con enfermedades neurodegenerativas ser ampliamente utilizados es que no son fáciles de programar, y esto se vuelve aún más difícil con la expansión de los fibroblastos. Como resultado, generación de células en cantidades necesarias para este tipo de aplicaciones no ha conseguido hasta hace poco8. Ahora hemos desarrollado un método sencillo para reprogramar fibroblastos de donantes de cualquier edad de una manera muy eficiente. Este método combina la expresión forzada de los factores de transcripción neuronal Ascl1 y Brn2 con una caída del represor proteína RE1-silenciamiento del factor de transcripción (resto) usando un vector único. Aquí, describimos los diferentes pasos que conducen a la generación de iNs convertidos a partir de una biopsia de donantes mayores de fibroblastos de la piel.
Protocolo
Fibroblastos dérmicos adultos fueron obtenidos de las clínicas de investigación de la enfermedad de Parkinson y la enfermedad de Huntington en el centro de John van Geest para reparación cerebral (Cambridge, Reino Unido) y bajo aprobación ética local (REC 09/H0311/88). Para obtener más información sobre el procedimiento de toma de muestras de biopsia de la piel, véase referencia8.
1. preparación de fibroblastos de la piel para reprogramación
- Usando una célula automatizada descongelar sistema o un baño de agua de 37 ° C, descongelar los fibroblastos dérmicos humanos adultos (aHDFs) y 200.000 cada frasco T75 (cuenta con un contador de células automatizado) en 10 mL de medio de fibroblastos de la placa (ver tabla 1) a 37 ° C en 5% CO2.
- Realizar un cambio de medio completo con medio del fibroblasto en el día siguiente.
- Cambiar el medio de fibroblastos cada 3 – 4 días hasta que las células alcanzan confluencia de 95%.
Nota: Un frasco confluente contiene aproximadamente 1.000.000 células. La aHDFs puede ser congelado para construir un stock de la línea celular (sección 2) o directamente a plateado listo para reprogramar (sección 3).
2. congelación de los fibroblastos de la piel
- Colocar un recipiente congelación de tasas de control en una caja con hielo o en nevera a 4 ° C.
- Disociar las células con 0.05% tripsina (1,5 mL cada frasco T75) a 37 ° C durante 3 – 5 minutos.
- Añadir medio del fibroblasto (contiene suero bovino fetal (FBS)) para neutralizar la tripsina (3 mL por color cada frasco T75) y recoger las células separadas en un tubo de 15 mL por lavado las células en el frasco dos veces.
- Contar las células usando el contador de células automatizado; congelación (recomendado) aHDFs aproximadamente 500.000 por vial.
- Desactivación de las células a 400 x g durante 5 minutos.
- Resuspender el precipitado de células en 1 mL de medio de congelación (véase tabla 1) y la transferencia en el tubo criogénico. Colocar los tubos directamente en el recipiente de congelación de velocidad controlada.
- Almacenar el tipo controlado de congelación aparatos a-80 ° C durante la noche. Al día siguiente, transferir los tubos a un congelador de-140 ° C y almacenar hasta que se necesite.
3. recubrimiento para la reprogramación (día −1)
Nota: Se recomienda utilizar una capa de gelatina para los experimentos a corto plazo (hasta 30 días); Alternativamente, para experimentos de largo plazo se recomienda empezar en un poly-L-ornitina, fibronectina y laminina (PFL) capa.
- 60 min antes de la aHDFs para la reprogramación, la galjanoplastia recubrir una placa de 24 pocillos con 0.1% gelatina (250 μL/pocillo) e incubar a 37 ° C.
- Aspire el medio del fibroblasto en la aHDFs. Lavar una vez con DPBS. Disociar las células con 0.05% tripsina (1,5 mL cada frasco T75) a 37 ° C durante 3 – 5 minutos.
- Añadir medio del fibroblasto para neutralizar la tripsina (3 mL por color cada frasco T75) y recoger las células separadas en un tubo de 15 mL por lavado las células en el frasco dos veces.
- Desactivación de las células a 400 x g por 5 min descartar sobrenadante y resuspender el precipitado de células en 1 mL de medio de fibroblastos.
- Contar las células usando un contador de células automatizado (para asegurar un control de conversión de buena calidad que la viabilidad de las células es superior a 90% con azul de tripán tinción).
- Para una placa de 24 pocillos completa, preparar una suspensión de 1.320.000 células en 13,2 mL de medio de fibroblastos para lograr una suspensión de 100.000 células/mL de medio (o 55.000 células/pozo en 550 μl de medio de fibroblasto multiplicado por el número de pozos necesarios).
- Aspirar la gelatina de la placa y lavar dos veces con DPBS. Agregar 500 μl de la suspensión de células a cada pozo e incubar durante la noche a 37 ° C en 5% CO2.
4. transducción de señales viral (día 0)
Nota: Trabajo con partículas lentivirales requiere equipo de categoría 2 y el uso de un agente para neutralizar el virus. Usar doble pares de guantes es también muy recomendable.
- Calentamiento de 13,2 mL de medio de fibroblasto a 37 ° C.
- Descongelar un lentivirales vector que contiene los factores de transcripción Ascl1 y Brn2 con horquilla corta dos RNAs (shRNA) dirigidos a reposo a temperatura ambiente.
Nota: Consulte la referencia8; la construcción está disponible en un repositorio de plásmido. Para obtener más información sobre el procedimiento para producir lentiviruses consulte referencia9. - Añadir el volumen necesario de lentivirus para infectar a la aHDFs en multiplicidad de infección (MOI) de 20 al medio sin cualquier potenciadores del transducción.
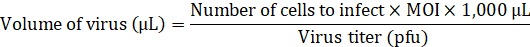
- Sustituir el medio de la placa de 24 pocillos por medio de fibroblastos que contiene el vector lentivirales (500 μL/pocillo) e incubar durante una noche a 37 ° C en 5% CO2.
- Al día siguiente, reemplace el medio en los pozos por medio del fibroblasto fresco sin el vector lentivirales.
Nota: El medio se considera infeccioso durante 7 días y como tal, una protección adecuada y procedimientos de manipulación deben usarse durante la primera semana después de transducción viral.
5. mantenimiento de las células de conversión
Nota: Una vez que comienza la conversión de células son susceptibles a la elevación; Tenga cuidado incline la placa hacia arriba y utilizar una pipeta μL 1.000 al retirar los medios de comunicación para evitar que las células separar.
- El día 3, retire el medio del fibroblasto y agregar 500 μl de medio de conversión neuronal temprana (véase tabla 1).
- Dos o tres veces a la semana, sacar 225 μL de medio viejo del pozo y agregar en 250 μl de medio fresco de conversión neuronal temprano.
- El día 18, quite todo el medio de cada pozo y reemplácelo con 500 μl de medio de conversión neuronal tardía (véase tabla 1).
- Continuar a la mitad del medio como arriba con fines medio de conversión neuronal cambia cada 2 – 3 días hasta el día 25 o punto final del experimento (figura 1A).
Nota: Si las células no se platean en cada pozo para el experimento, llene vacíos pozos con PBS o agua para evitar la evaporación abierta del medio y minimizar la variación entre pozos.
| Concentración stock | Concentración de trabajo | |
| Medio del fibroblasto | ||
| Medio basal | N / A | N / A |
| Penicilina/estreptomicina | 10.000 U/mL | 100 mg/mL |
| FBS | N / A | 10% |
| Medio de congelación | ||
| Medio del fibroblasto | N / A | 45% |
| FBS | N / A | 45% |
| DMSO | N / A | 10% |
| Medio de conversión neuronal temprana (ENM) | ||
| Medio de diferenciación de los nervios | N / A | N / A |
| Penicilina/estreptomicina | 10.000 U/mL | 100 mg/mL |
| CHIR99021 | 10 mM | 2 ΜM |
| SB-431542 | 20 mM | 10 ΜM |
| Noggin | 100 μg/mL | 0,5 μg/mL |
| LDN-1931189 | 10 mM | 0,5 ΜM |
| VPA | 1 M | 1 mM |
| LM-22A4 | 20 mM | 2 ΜM |
| GDNF | 20 μg/mL | 2 ng/mL |
| NT3 | 10 μg/mL | 10 ng/μl |
| dB-campo | 50 mM | 0,5 mM |
| Medio de conversión neuronal tardía (LNM) | ||
| Medio de diferenciación de los nervios | N / A | N / A |
| Penicilina/estreptomicina | 10.000 U/mL | 100 mg/mL |
| LM-22A4 | 20 mM | 2 ΜM |
| GDNF | 20 μg/mL | 2 ng/mL |
| NT3 | 10 μg/mL | 10 ng/μl |
| dB-campo | 50 mM | 0,5 mM |
| Tampón FACS | ||
| HBSS 1 x [- calcio, magnesio, - rojo de fenol] | N / A | N / A |
| BSA | N / A | 1% |
| ADNasa | N / A | 0.05% |
Tabla 1: composición de los diferentes medios. Descripción completa de la composición de todos los medios necesarios en el presente Protocolo entre medio del fibroblasto, medio, medio de conversión neuronal temprana, finales neuronal conversión media y tampón FACS de congelación.
6. vidrio cubreobjetos para grabaciones electrofisiológicas
Nota: Se recomienda usar una bata de laboratorio, gafas, doble guantes y completar todos los trabajos en una campana de humos. Este protocolo es adaptado de 10.
- Coloque el cubreobjetos de vidrio en la parte inferior de un plato de cristal sin traslapo.
- Añadir general laboratorio limpieza detergente para sumerja el cubreobjetos sin riesgo de derrame durante la sacudida (aproximadamente 30 mL). Colocar en un agitador orbital a baja velocidad por 2 h.
- Lavar seis veces (30 minutos) con agua desionizada en autoclave.
- Añadir etanol al 95% durante 2 h.
- Eliminar el etanol y espere hasta que el cubreobjetos están secos.
- Una vez seco, transfiera el cubreobjetos en un vaso de vidrio y Añadir ácido nítrico del 70% hasta que el cubreobjetos están sumergidas.
- Coloque el vaso de vidrio en un baño sonicador durante 60 minutos.
- Eliminar el ácido nítrico y lavar tres veces con agua desionizada en autoclave.
PRECAUCION: Siempre agregar ácido al agua, nunca al revés como esto puede conducir a una reacción violenta. - Quite tanta agua desde el vaso como sea posible y Añadir ácido clorhídrico concentrado (HCl) hasta que se sumergieron el cubreobjetos; Agitar el vaso y cubrir con la película de parafina.
- Someter a ultrasonidos durante 60 min (50 – 60 Hz, 30 W).
- Quite tanta HCI cubreobjetos como sea posible y el lugar en un cubo de basura adecuado. Enjuague con agua desionizada en autoclave dos veces.
- Tomar el cubreobjetos de la campana y aclare 20 veces (o más) con agua desionizada esterilizado hasta que se quite de la HCI.
- Una vez seca, coloque un cubreobjetos estériles placas de 24 pocillos.
- Coloque las placas debajo de ultravioleta (UV) luz durante la noche. Al día siguiente el cubreobjetos están listos para usar.
Nota: Si se utilizan el vidrio cubreobjetos, se recomienda utilizar la capa del PFL. Simplemente coloque un cubreobjetos en cada pocillo de una placa de 24 pocillos (con pinzas estériles) y seguir el protocolo siguiente.
7. PFL capa para la cultura a largo plazo
- Cubrir la placa de 24 pozos con poli-L-ornitina (500 μL/pocillo) y dejar toda la noche a 37 ° C en 5% CO2.
- Aspire la poly-L-ornitina y espere hasta que esté suficientemente seco para formar gotas en la parte superior.
- Hacer una gota (aproximadamente 60 μL) de la laminina en el centro de cada uno así y extender para cubrir toda la superficie del cubreobjetos. Dejar 2 h 45 min a 37 ° C en 5% CO2.
- Lavar tres veces con DPBS.
- Añadir a fibronectina (500 μL/pocillo) y dejar toda la noche a 37 ° C en 5% CO2.
- Lavar una vez con DPBS antes de añadir las células.
Nota: La capa del PFL puede utilizarse para largo plazo culturas del iNs (más de 100 días), aunque la muerte celular progresiva es de esperarse desde el día 30.
8. FACS
Nota: Para volver a las células de la placa después de FACS clasificación prepara una placa revestida de PFL 48 h con antelación. Las células se pueden ordenar usando un anticuerpo de molécula (NCAM) de adhesión celular neuronal desde el día 20 a partir después de transducción de señales.
- Quitar los medios de comunicación con una pipeta de 1000 μl (no lavar para evitar el desprendimiento de las células).
- Añadir célula disociando agente (250 μL/pocillo), dejar durante 10 – 20 min hasta que la elevación de las células y flotan como células individuales.
- Durante este tiempo preparar el tampón FACS.
- Triturate suavemente con una pipeta de 1000 μl. Si quedan algunos grumos, incubar un poco más.
- Una vez que se obtiene una suspensión unicelular, sacar del pozo y coloque en un tubo de 1,5 mL.
- Ras el bien dos veces con medio de conversión neuronal tardía y el lugar en el mismo tubo de 1,5 mL.
- Desactivación a 400 x g durante 5 min y descarte el sobrenadante.
- Resuspender el precipitado de células en 200 μL de tampón FACS.
- Desactivación de las células a 400 x g durante 5 min y descarte el sobrenadante.
- Repetir dos veces los pasos 8.8 y 8.9.
- Resuspender el precipitado de células en 50 μl de tampón FACS que contiene anticuerpo humano CD56 (NCAM) en una concentración de 1:50 para 15 minutos en hielo. Proteger de la luz.
- Desactivación de las células a 400 x g durante 5 minutos.
- Resuspender en 200 μL de tampón FACS para lavar y desactivación de las células a 400 x g durante 5 minutos.
- 8.13 repetir el paso.
- Resuspender en 200 μL de tampón FACS que contiene yoduro de propidio (PI; 10 μg/mL). Ordenar los NCAM positivo (iNs) y PI negativo (en vivo) las células mediante el control basado en el nivel de intensidad de fluorescencia de las muestras de control que no fueron manchados con el anticuerpo NCAM o PI FACS.
- Recoger las células positivas de NCAM en un tubo que contiene medio de conversión neuronal tardía.
- Contar las células usando un contador de células automatizado y volver a la placa las células en una alta densidad (50.000 células/cm2) en medio de conversión neuronal tardía en un plato cubierto de PFL.
- Continuar a la mitad del medio de cambio 2 – 3 veces por semana con medio de conversión neuronal tardía hasta el punto final del experimento (figura 1A).
Resultados
Un claro cambio en la morfología de la célula debe ser visible desde el día 5 hacia adelante (figura 1B). La muerte de algunas células es de esperarse después de transducción viral, aunque no abiertamente. De cada pozo en una placa de 24 pocillos debe esperarse un rendimiento total de la célula de 20.000-40.000 células por día 25, de los cuales aproximadamente la mitad tendría que haber sido las neuronas. Es importante tener en cuenta que el rendimiento y la pureza pueden variar a través de la línea celular, así como con lotes estado y virus de la enfermedad.
Células que expresan marcadores neuronales más estándares incluyendo MAP2 y TAU (figura 1) en día 25 además de exponer una morfología neuronal madura. Es posible obtener un puro de población haciendo FACS basado en el marcador de NCAM (ver referencia8,11). Las células se pueden después de eso o volver a platear en triple capa de PFL (ver referencia10) o directamente congelados para análisis biomolecular.
Si las células no están ordenadas, inmunofluorescencia etiquetado con MAP2 o TAU debe ser realizado para identificar las células con éxito se puede convertir y etiquetado junto con la proteína de interés.

Figura 1: evolución de la conversión en con el tiempo. (A) línea de tiempo del experimento y mapa de la construcción en un lentivirus utilizada para reprogramar los fibroblastos dérmicos humanos adultos. Cada flecha negra representa un cambio de medio. Imágenes de contraste de fase representativa de (B) que representan los cambios en la morfología de las células durante el proceso de conversión entre el día 0 a día 22 (como se indica en la esquina superior derecha de cada panel). Imágenes fueron tomadas en un microscopio de contraste de fase con el objetivo de X 10. (C) imagen de inmunofluorescencia de una TAU MAP2 doble coloración y en la transducción posterior al día 35. Las células fueron fijadas en paraformaldehído al 4% y permeabilized con 0,1% Triton en DPBS 10 minutos células fueron bloqueados por 30 min en una solución de 5% de suero de DPBS. Los anticuerpos fueron diluidos en solución de bloqueo y aplicados durante la noche a 4 ° C. Anticuerpos secundarios conjugados fluoróforo diluidos en solución de bloqueo y aplica para las células 2 h. fueron contratinción con DAPI por 15 min, seguido de 3 lavados con DPBS. Imágenes fueron tomadas en un microscopio de fluorescencia invertido utilizando el objetivo 20 X. Barras de escala = 100 μm (B, C). Abreviaturas: ENM: medio neuronal temprana; LNM: medio neuronal tardía. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este vector de one-step/una reprogramación método proporciona una manera eficiente de obtener iNs de fibroblastos humanos adultos. Fibroblastos humanos adultos son normalmente más difíciles encubierta que fibroblastos fetales, con pocos estudios previamente informes de eficiencia de aproximadamente 5-10%12,13. Sin embargo, con este nuevo protocolo es posible alcanzar un rendimiento neuronal (medido como MAP2 + células) de aproximadamente 50%8. Además, nuestro protocolo puede utilizarse en fibroblastos dérmicos que han sido pasados varias veces sin perder eficiencia de conversión. Hasta ahora hemos utilizado células pasadas hasta 14 veces sin detectar cualquier disminución en la eficiencia de conversión. Además, no hay diferencias en eficacia en nuestras manos con fibroblastos de donantes de edad entre 52 y 87 de reprogramación. Para más detalles sobre la edad y la enfermedad de otras líneas celulares con esta construcción véase referencia8. Otros estudios también no han reportado ninguna diferencia en la eficiencia de conversión con un protocolo mejorado de molécula basada en lentivirales y pequeño donantes entre 0 y 89 años4. Además, aplicabilidad coherente con reprogramación neuronal basada en miRNA se ha divulgado en los fibroblastos de todas las edades, con los donantes entre 0 y7de 86 años. Por esta vía, las neuronas maduras se pueden obtener en aproximadamente 12-15 semanas en vitro o aproximadamente 8 semanas después del trasplante en vivo8. Esto es una ventaja porque da acceso a la enfermedad y paciente iNs humano específico del tejido que sea fácilmente accesible. Aunque este protocolo es eficiente, no va a producir un 100% de rendimiento neuronal, y como tal se requiere un paso de purificación usando FACS por ejemplo.
El paso más crítico dentro de este protocolo es la transducción viral (Protocolo de la sección 4). Es crucial que el título del virus es preciso, además tener plateado un número exacto de aHDFs para la conversión. La concentración recomendada para su uso con este protocolo es de 4 x 108 a 4 x 109. Utilizando un título de cualquier cosa por debajo de 1 x 108 no se recomienda como agregar grandes cantidades de virus será tóxicos para las células. Por otra parte, como los fibroblastos comienzan a encubierta a iNs será más frágil y susceptible a la elevación. Es esencial para ser suave al cambiar los medios de comunicación que no para molestar demasiado a las células. Esto puede hacerse quitando el líquido lentamente con una pipeta μL 1.000. Finalmente, cuando el recubrimiento para la reprogramación (Protocolo, artículo 3) es importante garantizar una población sana del fibroblasto antes de comenzar un experimento; Esto es indicado por una viabilidad celular de sobre el 90% con tinción de azul de tripano. El aHDFs siempre debe ser pasados antes de llegar a la confluencia del 95%.
Si hay muerte de la célula sensible antes de transducción viral, no comience la conversión: comprobar que la viabilidad de las células es superior al 90% y que no había ningún problema con la capa de la placa. Se espera que una pequeña cantidad de la muerte celular después de transducción viral, sin embargo, esto no debería ser significativo. En este caso, confirmar la correcta siembra de 50.000 aHDFs/pozo y Compruebe la concentración de virus. Si hay incoherencia notoria entre pozos durante la conversión, primero Verifique que cada pozo contiene la misma cantidad de medios de comunicación y evaporación abierta no ocurre en los bordes (si necesarios medios adicionales pueden añadirse a los pozos de borde). Alternativamente, verifique paso 4.4 y asegurar una mezcla apropiada para una suspensión homogénea cuando transductoras. Es fundamental agregar el lentivirus al medio en primer lugar, antes de Agregar esto en los pocillos. Directamente añadir lentivirus en los pozos aumentará la variabilidad de pozo a pozo y también es probable que sea tóxico para las células. Por último, compruebe siempre que el medio es calentado a 37 ° C antes de agregar a las células.
Este protocolo incluye secciones opcionales para condiciones de capa para largo plazo cultivo de iNs y FACS clasificación para aumentar la pureza neuronal. Para los experimentos para investigar la caracterización funcional de iNs, un protocolo para la preparación de vidrio cubreobjetos para electrofisiología también se ha incluido. El protocolo de conversión aquí está configurado para utilizar con una placa de 24 pozos; Si lo desea este puede ser modificado a un 6, 12, 48, placa de 96 pocillos o frascos. En este caso, favor de ajustar todos los volúmenes a la superficie de la placa o frasco utilizado.
Este protocolo utiliza la expresión forzada de Ascl1 y Brn2 en combinación con una caída de resto todo empaquetado en un solo vector8 generar iNs de un fenotipo neuronal de pan. La generación de cualquier subtipos gliales con este método, sin embargo, no ha sido evaluado. Este método así tendría que ser modificado para su uso con otros factores de reprogramación para obtener a subtipo neuronas específicas. La reprogramación directa ha demostrado previamente la posibilidad de generar las neuronas motoras, neuronas sensoriales, fotorreceptores, neuronas espinosas medianas estriada y de10,de las neuronas dopaminérgicas14. Esto será beneficioso al investigar enfermedades neurológicas en qué subtipo neuronal específica son afectados preferentemente, para ejemplo de Parkinson y las neuronas dopaminérgicas.
Hasta hace poco, tecnología reprogramación neural directa no permitían la producción de iNs de manera estandarizada y eficiente, a un nivel que se requiere para toxicología y análisis a gran escala de detección de drogas. Este nuevo método es muy eficiente y puede ser utilizado en los fibroblastos que han pasados muchas veces, que ahora elimina estas restricciones y se abre para una amplia gama de estudios, no sólo en un sistema neuronal humano, sino también en un sistema que puede ser paciente específico. La sencillez de este enfoque hace que la tecnología en accesible para cualquier grupo que deseen realizar estudios similares en y se puede utilizar fácilmente para aplicaciones biomédicas a gran escala, como la detección de drogas y los análisis de toxicología, pero también para apoyar datos derivados de modelos animales y humanos post mortem muestras de tejido.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Marie Persson Vejgården para asistencia técnica. La investigación conduce a estos resultados ha recibido financiación de la Fundación de células madre de Nueva York, el Consejo Europeo de investigación bajo el séptimo programa marco de la Unión Europea: FP/2007-2013 Neuro células madre reparación (Nº 602278) y el acuerdo de subvención del CEI no. 30971, el Consejo Sueco de investigación (conceder acuerdo 521-2012-5624, 2016-00873 y 70862601 / Bagadilico), Fundación de Parkinson sueca (Parkinsonfonden) y el área estratégica de investigación en Lund Universidad Multipark (investigación multidisciplinaria en Enfermedad de Parkinson). Janelle Drouin-Ouellet es apoyado por una beca de los institutos canadienses de investigación de salud (CIHR) (#358492), y Roger Barker es apoyado por una subvención del centro de investigación biomédica NIHR a la Universidad de Cambridge/Hospital Addenbrooke. Malin Parmar es un investigador de Nueva York células madre Fundación Robertson. Shelby Shrigley es financiado por la Unión Europea horizonte 2020 programa (H2020-MSCA-ITN-2015) bajo la red de formación innovadora de Marie Skłodowska-Curie y Grant acuerdo no. 676408.
Materiales
| Name | Company | Catalog Number | Comments |
| Cell Lines | |||
| Adult human dermal fibroblasts | [C2 passage #7] Donor was a 67 year old female. Cells obtained from the Parkinson’s Disease Research and Huntington’s disease clinics at the John van Geest Centre for Brain Repair (Cambridge, UK). | ||
| Reagents for Fibroblast Culture, Transduction and Conversion | |||
| Dulbecco's phosphate-buffered saline (DPBS) [-CaCl2, -MgCl2] | Gibco | 14190094 | |
| Trypsin-EDTA [0.5%] | Gibco | 15400-054 | Dilute to 0.05% in DPBS. |
| Virkon (agent used to neutralize virus) | Viroderm | 7511 | Dilute to 1% solution with warm water. |
| Milli-Q Water | Millipore | ||
| Basal medium - Dulbecco’s Modified Eagle Medium (DMEM) + GlutaMax | Gibco | 61965059 | |
| Penicillin/Streptomycin [10,000 U/mL] | Gibco | 15140-122 | |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | |
| CryoMACS® dimethyl sulfoxide (DMSO) 10 | Miltenyi | 170-076-303 | |
| Neural differentiation medium - NDiff 227 | Takara-Clontech | Y40002 | |
| LM-22A4 | Tocris | 4607 | Dilute 10 mg in 1450 µL DMSO. Stock concentration: 20 mM. |
| Glial cell line-derived neurotrophic factor (GDNF) [recombinant human] | R&D systems | 212-GD-010 | Dilute 10 ug in 500 µL 0,1% BSA in DPBS. Stock concentration: 20 µg/mL. |
| NT3 [recombinant human] | R&D systems | 267-N3-025 | Dilute 25 µg in 2,5 mL 0,1% BSA in DPBS. Stock concentration: 10 µg/mL. |
| db-cAMP | Sigma Aldrich | D0627 | Dilute 1 g in 40,7 mL Milli-Q water. Filter and make 500 µL aliquots or stock tubes of 10 mL. Stock concentration: 50 mM. |
| CHIR99021 | Axon | 1386 | Dilute 2 µg in 429,8 µL DMSO. Stock concentration: 10 mM. |
| SB-431542 | Axon | 1661 | Dilute 5 mg in 595 µL DMSO. Stock concentration: 20 mM. |
| Noggin [recombinant human] | Miltenyi | 130-103-456 | Dilute 100 µg in 100 µL of Milli-Q water + 900 µL 0,1% BSA in DPBS. Stock concentration: 100 µg/mL. |
| LDN-193189 | Axon | 1509 | Dilute 2 mg in 360 µL DMSO. Stock concentration: 10 mM. |
| Valproic acid sodium salt (VPA) | Merck Millipore | 676380 | Dilute 5 g in Milli-Q water to acheive a stock concentration of 1 M. CAUTION: Avoid ingestion, contact with skin, and breathing dust formation. |
| Reagents for Coatings | |||
| Gelatin | Sigma Aldrich | G2500 | Dilute to 0.1% in Milli-Q water. |
| Poly-L-ornithine | Sigma Aldrich | P3655 | Dissolve in Milli-Q water. Use at 15µg/mL. |
| Fibronectin | ThermoFisher Scientific | 33010-018 | 2 mL of Milli-Q water + 70 µL 0,25 M NaOH. Use at 5 µg/mL. |
| Laminin | ThermoFisher Scientific | 23017-015 | Store at -80°C. Thaw on ice, keep cool and aliquot 30 µL. Use at 5 µg/mL. |
| Reagents for Fluorescence Activated Cell Sorting | |||
| Cell dissociation agent - Accutase (Stem Pro) | ThermoFisher Scientific | A1110501 | |
| Hanks' Balanced Salt Solution (HBSS) 1X [-calcium, -magnesium, - phenol red] | ThermoFisher Scientific | 14175-046 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | Use at 1% concentration for Anti-Human CD56 (NCAM). |
| DNAase | Sigma Aldrich | DN-25 | Use at 0.05% concentration. |
| Anti-Human CD56 (NCAM) Antibody [Mouse] | BD Pharmingen | 555518 | Use at 1 : 50. |
| Propidium iodide | Sigma Aldrich | P4170 | Dilute to 1mg/mL in PBS and keep sterile. Use at 1:1000 to achieve a concentration of 10µg/mL. |
| Reagents for Glass Coverslips | |||
| Autoclaved deionized water | |||
| Alconox detergent | Sigma Aldrich | Z273228 | |
| Ethanol 95% | |||
| Nitric Acid | Sigma Aldrich | 438073-M | CAUTION: Concentrated nitric acid is highly corrosive, and its vapours are potentially harmful. |
| Concentrated hydrochloric acid (HCI) | CAUTION: Concentrated hydrochloric acid is highly corrosive, and its vapours are potentially harmful. | ||
| Reagents for Immunocytochemistry | |||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin |
| Triton X-100 | Fisher Scientific | 10254640 | Use at a concentration of 0.1%. |
| Serum [Donkey] | Merck Millipore | S30-100ML | |
| Anti-MAP2 Antibody [Chicken] | Abcam | ab5392 | Use at a concentration of 1 : 5,000. |
| Tau HT7 Monoclonal Antibody [Mouse] | ThermoFisher Scientific | MN1000 | Use at a concentration of 1 : 500. |
| Cy3 Anti-Chicken Antibody [Donkey] | Jackson ImmunoResearch | 703-165-155 | Use at a concentration of 1 : 400. |
| Alexa Fluor488 Anti-Mouse Antibody [Donkey] | Jackson ImmunoResearch | 715-545-150 | Use at a concentration of 1 : 400. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| Equipment | |||
| T75 flask [Nunclon Delta Surface] | ThermoFisher Scientific | 156499 | |
| 24-well plate [Nunc] | ThermoFisher Scientific | 142485 | |
| 1.5 mL polypropylene tube | Sigma Aldrich | Z336769 | |
| 15 mL falcon tube | Sarstedt | 62.554.502 | |
| 50 mL falcon tube | Sarstedt | 62.547.254 | |
| CryoPure tube 1.6 mL | Sarstedt | 72.380 | |
| Pippette controller | For pipetting volumes 1-25 mL. | ||
| Sterile serological pipettes: 5, 10 and 25 mL | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Adjustable volume pipettors: 5, 20, 200, and 1,000 µL | |||
| Sterile pipette tips | For pipetting volumes of 0.5 - 1,000 µL. | ||
| Glass coverslips | NeuVitro | GG-12-1.5-oz | #1.5 thickness, 12mm diameter, 0.5oz, CE certified, fit 24 well plates. |
| Glass dish | Approximately 150mm diameter. | ||
| Glass beaker | Make sure to have an appropriate size beaker for the sonicator bath available. Water from the sonicator bath should not overflow into the glass beaker. | ||
| Parafilm M | VWR | ||
| ThawSTAR Automated Cell Thawing System | BioCision | BCS-601 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | |
| Cell counting chambers [50 slides] and trypan blue [0.4%] | ThermoFisher Scientific | C10228 | For use with Countess II Automated Cell Counter. |
| CoolCell Cell LX Controlled-rate Freezing Container | Biocision | BCS-405 | |
| Laminar flow hood | |||
| Humidified 5% CO2 37 °C incubator | |||
| Centrifuge | Suitable for 1,5, 15 and 50 mL tubes. | ||
| Orbital shaker | |||
| Sonicator - Bransonic Model B200 cleaner | Sigma Aldrich | Z305359 | Frequency = 50-60Hz, Amplitude = 30 Watts |
| FACS Aria III cell sorter | BD Pharmingen | ||
| Phase contrast microscope | Olympus | CKX31 | |
| Inverted fluorescence microscope | Leica | DMI6000 B |
Referencias
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17, 170-182 (2016).
- Mertens, J., et al. Directly Reprogrammed Human Neurons Retain Aging-Associated Transcriptomic Signatures and Reveal Age-Related Nucleocytoplasmic Defects. Cell Stem Cell. 17, 705-718 (2015).
- Hashizume, O., et al. Epigenetic regulation of the nuclear-coded GCAT and SHMT2 genes confers human age-associated mitochondrial respiration defects. Sci Rep. 5, 10434 (2015).
- Lapasset, L., et al. Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes Dev. 25, 2248-2253 (2011).
- Huh, C. J., et al. Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. Elife. 5, (2016).
- Drouin-Ouellet, J., et al. REST suppression mediates neural conversion of adult human fibroblasts via microRNA-dependent and -independent pathways. EMBO Mol Med. , (2017).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat Protoc. 1, 241-245 (2006).
- Richner, M., Victor, M. B., Liu, Y., Abernathy, D., Yoo, A. S. MicroRNA-based conversion of human fibroblasts into striatal medium spiny neurons. Nat Protoc. 10, 1543-1555 (2015).
- Lau, S., Rylander Ottosson, D., Jakobsson, J., Parmar, M. Direct neural conversion from human fibroblasts using self-regulating and nonintegrating viral vectors. Cell Rep. 9, 1673-1680 (2014).
- Pfisterer, U., Wood, J., Nihlberg, K., Hallgren, O., Bjermer, L., Westergren -Thorsson, G., Lindvall, O., Parmar, M. Efficient induction of functional neurons from adult human fibroblasts. Cell Cycle. 10, 3311-3316 (2011).
- Caiazzo, M., Dell'Anno, M. T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., Sotnikova, T. D., Menegon, A., Roncaglia, P., Colciago, G., Russo, G., Carninci, P., Pezzoli, G., Gainetdinov, R. R., Gustincich, S., Dityatev, A., Broccoli, V. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476, 224-227 (2011).
- Masserdotti, G., Gascón, S., Götz, M. Direct neuronal reprogramming: learning from and for development. Development. 143, 2494-2510 (2016).
- Pereira, M., Pfisterer, U., Rylander, D., Torper, O., Lau, S., Lundblad, M., Grealish, S., Parmar, M. Highly efficient generation of induced neurons from human fibroblasts that transplantation into the adult rat brain. Sci Rep. 4, 6330 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados