A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم الواجهة متشابك لخلايا تي البشرية الأولية من الدم والأنسجة اللمفاوية
In This Article
Summary
ويصف البروتوكول تقنية لدراسة قدرة خلايا تي البشرية [بولكلونل] أولية على شكل متشابك واجهات استخدام بليرس الدهن مستو. نحن نستخدم هذه التقنية لإظهار القدرة على تشكيل المشبك التفاضلية للبشرية من خلايا تي الأولية المستمدة من العقد الليمفاوية والدم المحيطي.
Abstract
وكان الفهم الحالي لديناميات والسمات الهيكلية لواجهات متشابك تي خلية مصممة إلى حد كبير من خلال استخدام بليرس مستو المدعومة من الزجاج و في المختبر-استنساخ خلايا تي المشتقة أو خطوط1،2 ،،من34. كيفية تطبيق هذه النتائج على الخلايا تي البشرية الأولية المعزولة من الدم أو اللمفاوية الأنسجة غير معروف، جزئيا بسبب صعوبات كبيرة في الحصول على عدد كاف من الخلايا لتحليل5. هنا علينا أن نعالج هذا من خلال تطوير أسلوب استغلال الشرائح التدفق متعدد القنوات لبناء بليرس الدهن المستوية التي تحتوي على جزيئات تفعيل والالتصاق. وتشجع ارتفاع منخفض للشرائح تدفق الترسيب السريع الخلية من أجل مزامنة المرفقات الخلية: بلير، مما يسمح للباحثين لدراسة دينامية تشكيل واجهة متشابك والحركية من الإفراج عن حبيبات. نقوم بتطبيق هذا النهج في تحليل واجهة متشابك من عدد قليل من 104 إلى 105 الابتدائي cryopreserved تي الخلايا المعزولة من العقد الليمفاوية (LN) والدم المحيطي (الجريدة الرسمية). وتكشف النتائج أن أسلوب بلير الدهن مستو رواية تمكن دراسة الخصائص الفيزيائية لخلايا تي البشرية الأولية المستمدة من الدم والأنسجة في سياق الصحة والمرض.
Introduction
المعرفة العلمية بالسمات الهيكلية لخلايا تي المناعية الاشتباكات العصبية وارتباطها بالنشاط الوظيفي لخلايا تي تم إنشاؤها أساسا من دراسة خطوط الخلايا واستنساخ المشتقة من الجريدة الرسمية. بقدر ما تتصل هذه النتائج الأولية تي الخلايا التي تم الحصول عليها من الدم أو الأنسجة اللمفاوية البشرية ما زال غير واضح، كما الواجهات متشابك من خلايا تي المقيمين في الأنسجة اللمفاوية وغيرها لا قد تم تحليلها حتى الآن. الأهم من ذلك، توحي البيانات الناشئة أن خلايا تي المقيم في الأنسجة والمستمدة من الجهاز الليمفاوي قد اختلافات كبيرة في النمط الظاهري والنشاط الوظيفي مقارنة بتلك التي في الجريدة الرسمية6،7. هذا وقد وطدت كذلك الحاجة إلى فهم أفضل ميزات واجهة متشابك تي خلية في خلايا تي البشرية الأساسية.
وتحقيقا لهذه الغاية، قمنا بتطوير نهج مقياس مصغر رواية استغلال بليرس دهن صلب الشرائح تدفق الأقنية تمكننا من إجراء تصوير واجهات تي-خلية/بلير مع أقل من 105 الابتدائي تي الخلايا المعزولة من الجريدة الرسمية البشرية و LN. يسمح هذا الأسلوب الرواية دراسة الخصائص الفيزيائية الأساسية البشرية تي خلية واجهات متشابك من أجل نموذج أفضل وفهم التفاعلات في فيفو خلية خلية.
Protocol
أجريت هذه الدراسة وفقا "إعلان هلسنكي". تم الحصول على الموافقة الخطية من جميع المشاركين، وعينات الدم والعقدة الليمفاوية قد تم الحصول عليها بالموافقة من "مجلس المراجعة المؤسسية" في جامعة بنسلفانيا (809316 # الكندي، مجلس الهجرة واللاجئين # 815056). وكانت جميع البشر البالغين. وقدمت عينات دم الحبل السري يرجى المخاض والولادة من قسم التوليد وأمراض النساء في جامعة توماس جيفرسون. جميع العينات التي تم إلغاء تحديدها.
1-عزل خلايا CD4 خلايا+ تي لتحليل صورة
-
ذوبان الجليد قاسمة 1 مل يحتوي على 107 المجمدة المحيطية وحيدات النوى خلايا الدم (ببمكس) أو الخلايا وحيدات النوى العقدة الليمفاوية (لنمكس) من العينات التي تم جمعها. في غطاء عقيمة، إضافة الخلايا المذابة إلى 9 مل ربمي تكملة مع البنسلين/ستربتوميسين والجلوتامين.
- سينتريفوجاتي الخلايا لمدة 10 دقيقة في 300 x ز في 4 درجات مئوية، نضح المادة طافية، وريسوسبيند الخلايا في 5 مل ربمي المكملة التي تحتوي على 10% FBS (المتوسطة كاملة). احتضان الخلايا بين عشية وضحاها في حاضنة2 CO في 37 درجة مئوية.
- وفي اليوم التالي تنقية خلايا CD4 خلايا+ ر بفرز إيمونوماجنيتيك السلبية باستخدام مجموعة أدوات متوفرة تجارياً وفقا لتعليمات الشركة المصنعة.
- لقياس عدد خلايا CD4 طازجة المنقي+ تي الخلايا، مزيج 5 ميليلتر من تعليق خلية مع حجم متساو لحل تريبان الأزرق. تحميل هيموسيتوميتير مع خلية-تريبان الأزرق المخلوط وعد الخلايا الحية داخل 5 أقسام هيموسيتوميتير.
- أن متوسط عدد الخلايا وتحديد عدد الخلايا في تعليق خلية الأصلي: عدد الخلايا/1 مل = متوسط العدد × 2 × 104. إذا كان العدد الإجمالي للخلايا المعزولة صغير جداً، استخدام الخلايا كما هو بدون عد.
- الطرد المركزي الخلايا في 300 x ز لمدة 10 دقائق وريسوسبيند لهم في مخزن مؤقت مقايسة (20 مم حبيس ودرجة الحموضة 7.4، 137 مم كلوريد الصوديوم ومم 2 غ2هبو4، 5 ملم د-الجلوكوز، 5 ملم بوكل، 1 مم مجكل2، 2 مم كاكل2والبومين المصل البشري 1%) في 105 < /c13 > ميليلتر الخلايا/50 أو أقل، والحفاظ الخلايا عند 4 درجة مئوية (من أجل ح 1 – 2) حتى جاهزة للاستخدام في التجارب.
- التخلص من جميع النفايات البيولوجية وفقا للمبادئ التوجيهية ذات الصلة المؤسسية.
- إذا كان المطلوب كمحتوى خلية تحكم، إعداد الخلايا التائية CD8 المنشط من دم الحبل السري ببمك، ومكان 107 خلايا في 5 مل متوسطة كاملة في قارورة ثقافة T25 مغطاة بخليط أجسام المضادة CD3 ومكافحة CD28 في 10 ميكروغرام/مل و 1 ميكروغرام/مل ، على التوالي.
- في اليوم التالي، إزالة خلايا الدم الحبل المنشط قارورة، وغسلها x 1 مع الطازجة إكمال المتوسطة، وتوسيع نطاق الخلايا حضور المؤتلف إيل-2 (100 U/mL) لمدة أسبوعين.
- تنقية CD8 دم الحبل السري+ تي الخلايا عن طريق فرز إيمونوماجنيتيك السلبية باستخدام مجموعة المتاحة تجارياً وفقا لتعليمات الشركة المصنعة. عد الخلايا وتبادل وسائل الإعلام إلى المخزن المؤقت المقايسة كما هو موضح في الخطوات 1.3 – 1.6 لقانون الجنسية و PB CD8+ تي الخلايا.
2-عناصر لإعداد بليرس الدهن مستو
- إعداد نوع 3 الدهنية كما هو موضح في مكان آخر من5: (أ) 0.4 مم دوبك (1، 2-ديوليويل-sn-جليسيرو-3-phosphocholine) الدهنية، (ب) 0.4 مم دوبك الدهنية المحتوية على 33% مول الكلاب-جاتا (1، 2-ديوليويل-sn-جليسيرو-3-[(N-(5- أمينو-1-كاربوكسيبينتيل) حمض إيمينودياسيتيك) سوكسينيل] (ملح الأمونيوم)) الدهون، (ج) 0.4 مم دوبك الدهنية التي تحتوي على 4 mol % بيوتينيل-كاب-PE (1، 2-ديوليويل-sn-جليسيرو-3-فوسفوثانولاميني-N-(كاب بيوتينيل) (ملح الصوديوم)).
-
إعداد 5% الكازين الحل كما هو موضح سابقا5.
- حل 5 غم مسحوق الكازين في 100 مل الماء عالي النقاوة وإضافة 350 ميليلتر من هيدروكسيد الصوديوم 10 أمتار. يحرك كل شيء على محرض مغناطيسية عادية بسرعة بطيئة طبقاً لمقياس متاح، في درجة حرارة الغرفة ح 2، وبعد ذلك بين عشية وضحاها في 4 درجات مئوية. ضبط درجة الحموضة إلى 7.3 وأولتراسينتريفوجي الحل بالنسبة ح 2 في 100,000 ز x عند 4 درجة مئوية. تصفية المادة طافية مع عامل تصفية عقيمة 0.22 ميكرومتر وتخزين الحل في مختبرين في-80 درجة مئوية.
تنبيه: حل هيدروكسيد الصوديوم يمكن أن تسبب الحروق الكيميائية وقد حمل عمي دائم عند الاتصال بالعيون. استخدام القفازات المطاطية وملابس السلامة وحماية العين عند التعامل مع هذه المادة الكيميائية أو إيجاد حلول لها.
- حل 5 غم مسحوق الكازين في 100 مل الماء عالي النقاوة وإضافة 350 ميليلتر من هيدروكسيد الصوديوم 10 أمتار. يحرك كل شيء على محرض مغناطيسية عادية بسرعة بطيئة طبقاً لمقياس متاح، في درجة حرارة الغرفة ح 2، وبعد ذلك بين عشية وضحاها في 4 درجات مئوية. ضبط درجة الحموضة إلى 7.3 وأولتراسينتريفوجي الحل بالنسبة ح 2 في 100,000 ز x عند 4 درجة مئوية. تصفية المادة طافية مع عامل تصفية عقيمة 0.22 ميكرومتر وتخزين الحل في مختبرين في-80 درجة مئوية.
-
التسمية الأضداد المضادة CD3 مع البيوتين إنتاج جزيئات الأجسام المضادة أحادية-بيونيلاتيد مع نهج الموصوفة سابقا8.
- تعد حلاً من البيوتين--PEO4--دائرة الصحة الوطنية في ثنائي ميثيل سلفوكسيد ([دمس]) في 0.1 مغ/مل. إضافة ميليلتر 3.7 الحل البيوتين--PEO4--دائرة الصحة الوطنية إلى 1 مغ جسم في 0.5 مل من الفوسفات مخزنة المالحة (PBS) التي تحتوي على بيكربونات الصوديوم 100 مم.
- احتضان هذا الخليط ح 2 في درجة حرارة الغرفة. تعد حلاً إستر "أليكسا فلور 488 دائرة الصحة الوطنية" في 10 ملغ/مل في [دمس]. إضافة حل إستر "أليكسا فلور 488 دائرة الصحة الوطنية" إلى جسم المسمى من قبل البيوتين--PEO4--دائرة الصحة الوطنية في فائض مولى إذ.
- احتضان الخليط عن 1 ساعة في درجة حرارة الغرفة مع التحريك البطيء على محرض مغناطيسية عادية. فصل الصبغة غير منضم باستخدام حجم الاستبعاد اللوني.
- تحديد تركيز الأجسام المضادة عن طريق قياس الكثافة البصرية للحل جسم في 280 نانومتر (280). قياس الكثافة الضوئية للأجسام المضادة المسماة في 577 نانومتر (577).
- تحديد نسبة الصبغة لجسم باستخدام المعادلة التالية:
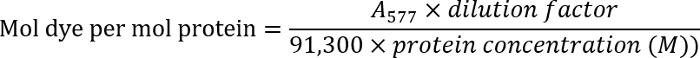
ملاحظة: العثور على تفاصيل إضافية في البروتوكول الخاص بالشركة المصنعة.
-
التعبير عن بروتين المتكاملة-1 القابلة لذوبان المؤتلف في نظام تعبير المورفولوجية كما هو موضح سابقا3،4،،من910.
- استنساخ، مع ترميز كدنا، اكتودومين المتكاملة-1 في التعبير المورفولوجية ناقلات pMT/V5-صاحب مع عاملاً ميتالوثيونين إيندوسيبلي لإنتاج بروتين المؤتلف إلحاق مع له العلامة6 في نهاية ج--المحطة الطرفية.
- شارك ترانسفيكت الخلايا S2 مع بلازميد يحتوي على الناتج في المتكاملة-1 وناقل تعبير G418. حدد ترانسفيكتانتس مستقرة باستخدام وسائل الإعلام المورفولوجية شنايدر تستكمل مع 10% مصل العجل الجنين (FCS) و 0.5 ملغ/مل من G418 لمدة 3 أسابيع. توسيع نطاق الخلايا في المتوسط خالية من المصل الحشرات والحث على تعبير بروتين مع 0.5 مم CuSO4 د 3.
- تركز x 10 طافية الثقافة ودياليزي ضد برنامج تلفزيوني عن طريق مركز تدفق عرضية كما هو موضح سابقا11.
- تطبيق ثقافة مركزة طافية على عمود يحتوي على سيفاروسي مع جسم [مونوكلونل] مكافحة--المتكاملة-1 تساهمي المعطل تداولها والوت منضم المتكاملة-1 مع 50 مم جليكاين عازلة، الأس الهيدروجيني 3.0. تحييد بروتين المتكاملة-1 الوتيد مع عازلة تريس م 2، الرقم الهيدروجيني 8.0 فورا.
- دياليزي المواد الوتيد ضد برنامج تلفزيوني، pH 8.0 وإضافة المواد دياليزيد عمود يحتوي على ني-جاتا [اغروس]. الوتي 1 المتكاملة القابلة للذوبان مع ايميدازول 200 ملم، pH 8.0. دياليزي المواد الوتيد ضد المخزن مؤقت برنامج تلفزيوني، pH 8.0.
- قم بتسمية المنقي المتكاملة-1 مع إستر Cy5 دائرة الصحة الوطنية وفقا لتعليمات الشركة المصنعة.
ملاحظة: أفضل نسبة الصبغة للبروتين النهائي هو 1:1.
- إنتاج القوات المسلحة البوروندية شظايا من جسم CD107a المضادة بغراء الهضم وتطهير القوات المسلحة البوروندية الشظايا بالتبادل الأيوني اللوني كما هو موضح سابقا3. تسمية القوات المسلحة البوروندية وشظايا مع إستر "أليكسا فلور 568 المستشفيات" وفقا لتعليمات الشركة المصنعة.
3-تشكيل بليرس الدهن مستو المدعومة من الزجاج
- تحضير حلاً البيرانا حمضية طازجة بخلط 140 مل من حمض الكبريتيك و 60 مل من بيروكسيد الهيدروجين 30%. أغسل كوفيرسليبس الزجاجية للشرائح تدفق مغطس لهم في حل حامض البيرانا عن 30 دقيقة عقد ساترة زجاجية مع البولي بروبلين من نوع مقص ملقط.
تنبيه: حل البيرانا مؤكسد قوي للغاية. تذكر أن ارتداء نظارات السلامة أو نظارات أو درع قلق جنبا إلى جنب مع قفازات مطاطية سميكة في جميع الأوقات أثناء التعامل مع الحل. تعمل فقط مع الحل البيرانا تحت غطاء دخان. تجنب التدفئة أو نقلهم، أو تهتز لها في أي وقت أثناء الاستخدام، كما أنها قد تنفجر. جمع النفايات البيرانا في زجاجة زجاج مع ثقب المحتوية على الرصاص. الاتصال "لجنة السلامة المؤسسية" حول استغلال النفايات السليم. -
أشطف كوفيرسليبس غسلها 7 x بالماء عالي النقاوة بنقلهم تسلسلياً في قنينة تحتوي على المياه العذبة. مجموعة كوفيرسليبس الرطب جانبا للسماح للمياه المتبقية لفة قبالة الزجاج النظيفة، تاركين الزجاج الجافة.
- وبدلاً من ذلك، استخدام تلميح ماصة يعلق على فراغ مضخة بعناية إزالة قطرات الماء المتبقي من كوفيرسليبس.
- في هود العقيمة، القيام بتخفيف الدهون المختلفة لإنتاج مزيج الحويصلية لصنع بليرس. أولاً، الجمع بين 37 ميليلتر من دوبك الدهنية و 3 ميليلتر من بيوتينيل-كاب-PE الدهنية. وثانيا، مزيج ميليلتر 14 من الدهنية دوبك و 15 ميليلتر من الكلاب-جاتا الدهنية. ثالثا، إضافة 1 ميليلتر من المزيج الأول إلى 29 ميليلتر من مزيج الثانية لاختلاق الخليط النهائي الحويصلية.
-
في هود العقيمة، إعداد مساحة عمل مع كوفيرسليبس جافة قريبة من. الكوة ميليلتر 2 من خليط الحويصلية النهائي (راجع الخطوة 3، 3) تحديداً في وسط قناة شريحة لاصقة. فورا وبدقة متناهية محاذاة ساترة نظيفة وجافة مع الشريحة والسفلي بلطف ساترة على الجانب لزجة من الشريحة.
- إذا كان إعداد أكثر من شريحة واحدة، العمل على شريحة واحدة في كل مرة منذ الخليط الحويصلية يتبخر سريعاً. اقلب الشريحة واستخدام الطوق الخارجي للبولي بروبلين من نوع مقص ملقط لتطبيق ضغط لطيف على الاتصال الطرفية من ساترة مع الشريحة، مع التأكد من أن زلة موصول محكم للشريحة للحيلولة دون تسرب.
ملاحظة: لا تضغط ضد قنوات الشريحة لتجنب كسر أو تكسير ساترة. - اقلب الشريحة مرة أخرى ووضع علامة على موقف بلير شكلت، الذي يبدو وكأنه قطره بين ساترة والشريحة القناة، برسم نقاط 4 مع علامة دائمة حول بلير من ناحية الشريحة الخارجية للجمعية.
- إذا كان إعداد أكثر من شريحة واحدة، العمل على شريحة واحدة في كل مرة منذ الخليط الحويصلية يتبخر سريعاً. اقلب الشريحة واستخدام الطوق الخارجي للبولي بروبلين من نوع مقص ملقط لتطبيق ضغط لطيف على الاتصال الطرفية من ساترة مع الشريحة، مع التأكد من أن زلة موصول محكم للشريحة للحيلولة دون تسرب.
- قبل حقن سائل في القناة الأولى، تعيين منفذ واحد للقناة كميناء دخول والأخرى كميناء الخروج والحفاظ على هذه التسمية في جميع أنحاء هذه التجربة.
- لتجنب تكوين فقاعات، إدراج نهاية طرف بيبيت مباشرة بمنفذ الدخول للقناة. ملء قنوات الشريحة ببطء مع 50 ميليلتر من الحارة (على الأقل غرفة درجة الحرارة) الإنزيم المخزن المؤقت (راجع الخطوة 1.5 لتكوين المخزن المؤقت).
- تعد حلاً كلوريد نيكل ثنائي 0.5 متر. ذوبان الجليد قاسمة 2 مل من حل الكازين في حمام مائي عند 37 درجة مئوية لمدة 30 دقيقة وتكميله بمحلول كلوريد نيكل بتركيز نهائي 200 ميكرومتر.
- أغسل بليرس الحقن 100 ميليلتر من الحل الكازين في ميناء الدخول للقناة الأولى وثم فورا إزالة 100 ميليلتر من ميناء الخروج على الشريحة بواسطة بيبيتينج. كتلة بليرس مع نفس الحل بحقن 100 ميليلتر من الحل الكازين في ميناء الدخول لكل قناة وتفرخ الشريحة لمدة 45 دقيقة في درجة حرارة الغرفة.
- ذوبان الجليد مختبرين البروتينات6 وستريبتافيدين Cy5-ICAM-1-له. الجمع بين البروتينات في المخزن المؤقت للمقايسة بتركيز نهائي 2 ميكروغرام/مل كل. الطرد المركزي الحل لمدة 30 دقيقة 000 20 شخص × ز و 4 درجة مئوية لإزالة أي المجاميع.
- إزالة بقية الحل حظر من ميناء الخروج من القناة الشريحة بواسطة بيبيتينج. حقن 100 ميليلتر من الحل الذي يتضمن المتكاملة-1 وستريبتافيدين في منفذ الإدخال.
- احتضان الشريحة لمدة 45 دقيقة في درجة حرارة الغرفة. إزالة أي فائض من حل البروتين من ميناء الخروج. أغسل بيلايير 2 x عن طريق الحقن 100 ميليلتر من المخزن المؤقت بالانزيم في ميناء الدخول للقناة الأولى ثم إزالة 100 ميليلتر من ميناء الخروج فورا.
- تضعف جسم المضادة CD3 أليكسا-فلور-488-المسمى بالمخزن المؤقت المقايسة بتركيز نهائي 2 ميكروغرام/مل. حقن 100 ميليلتر من الحل جسم بمنفذ إدخال الشريحة وتبني عليه لمدة 45 دقيقة في درجة حرارة الغرفة. إزالة أي فائض من حل البروتين من ميناء الخروج. أغسل بلير 2 x مع 100 ميليلتر من المخزن المؤقت بالانزيم كما هو الحال في الخطوة 3.11.
4-تصوير تفاعل خلايا T مع Bilayer مستو
-
يسخن المرحلة والهدف من مجهر التأمل الداخلي [كنفوكل] أو مجموع الأسفار (TIRF) حتى يتم اكويليبراتيد درجة الحرارة عند 37 درجة مئوية. إعداد الشريحة مع bilayer(s) شأن مرحلة ساخنة. الانتقال المرحلة إلى موضع مناسب وفقا لعلامات الحبر والتركيز على بلير توظف الأسفار جزيئات المسمى قبرصي المتكاملة-1.
- استخدم هدفا X 61 للمجهر [كنفوكل]، أو هدفا X 100 للمجهر TIRF، مع إعدادات عامل التصفية المناسب.
-
الحبيبية للإفراج عن التصوير بالفحص المجهري TIRF، إضافة CD107a مكافحة أليكسا-فلور-568-المسمى شظايا جسم القوات المسلحة البوروندية إلى تعليق الخلية بتركيز 4 ميكروغرام/مل نهائي قبل حقن الخلايا في موانئ الدخول.
- ريسوسبيند CD4 استعداد+ تي الخلايا المعزولة من الجريدة الرسمية أو قانون الجنسية أو الحبل الدم وحقن 50 ميليلتر من تعليق خلية في ميناء دخول القناة الشريحة التي تحتوي على بيلايير.
- اختر أرقام الحقول المطلوبة والصور سجل لكل حقل 1 × كل 2 دقيقة لمدة 30 دقيقة بعد الحقن.
- استغلال القنوات الخفيفة، ونيون مشرق الميدان، ينعكس (488 أليكسا و Cy5) المجهر [كنفوكل] للحصول على الصور. استخدام وضع TIRF للأسفار أليكسا-فلور-488 واليكسا-فلور-568، وويديفيلد للأسفار Cy5، فضلا عن تصوير مشرق الميدانية، في المجهر TIRF.
5. تحليل الصورة
- تحليل الصور المكتسبة باستخدام البرمجيات المناسبة. مراقبة مورفولوجيا الخلايا في الصور الخفيفة المنقولة واستبعاد متفاوت وتلف واضح أو خلايا أبوبتوتيك من التحليل. تدرج في التحليل فقط تلك الخلايا التي تتفاعل منتجة مع بلير السطح (أي، الخلايا تتراكم fluorescence أليكسا-فلور-488 (الأجسام المضادة CD3) في الواجهة).
- تحديد حجم منطقة التصاق الخلية في 20 دقيقة بعد بدء التفاعل بيلايير الخلية.
ملاحظة: منطقة الالتصاق هو منطقة مظلمة وضعت في واجهة الخلية--بلير على التدخل انعكاس الصور مجهرية (IRM). - مراقبة أي تراكم Cy5--المتكاملة-1 الأسفار وتشكيل من تقاطع الدائري بجزيئات قبرصي-المتكاملة-1 منفصلة في واجهة الخلية--بلير. إذا شكلت المتراكمة المتكاملة-1 الجزيئات تقاطع الدائري التصاق في صور متتالية اثنين على الأقل، تسمى هذه الخلايا كالخلايا النامية طرفية supramolecular تفعيل كتلة (بسماك)12.
- تقييم الإصدار الحبيبية بقياس كثافة fluorescence أليكسا-فلور-568 في واجهة الخلية تي-بيلايير على الأسفار الخلفية خارج منطقة الاتصال بالقرب من الخلية. تعيين الخلايا التي تحتوي على نسبة من أليكسا-فلور-568 إشارة إلى خلفية على الأقل 1.3 كخلايا ديجرانولاتينج.
النتائج
أولاً، نحن مقارنة هيكل متشابك الواجهة التي شكلتها المنشط CD8 المشتقة من دم الحبل السري+ تي الخلايا المعرضة للدهن بيلاييرس بني أما التدفق واسع النطاق التقليدي في أنظمة الخلية (انظر الجدول للمواد لمزيد من التفاصيل)1 ،2،
Discussion
رواية الأسلوب الموصوفة هنا يستخدم مماثلة الكواشف اللازمة لبناء بليرس مستو في خلية تدفق التقليدية5 ويمكن تطبيقها بنجاح على القيام بتصوير الخلية تي البشرية الأولية – بلير واجهات3،4 ،15. الأسلوب يقدم تخفيضاً كبيرا في استخدام ج?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وأيد هذا العمل بمنحه R01AI118694 المعاهد الوطنية للصحة لمايكل ر. بيتس، التي تشمل جائزة الفرعي 566950 إلى يوري سيكوليف. ونحن نشكر "سيدني كيميل سرطان مركز بيويماجينج الموارد المشتركة" لدعمهما الممتاز.
Materials
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
References
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved