Method Article
استخدام البروتينات الانصهار المؤتلف في منصة فحص حوزتي فلورسنت وما ريناتوريشن في جل
In This Article
Summary
وهنا، نقدم الإجراءات المفصلة من منصة الفحص حوزتي وضعت مؤخرا الاستفادة من الطرفي ن هيكساهيستيديني/مالتوس-ملزمة البروتين ونيون ركائز المؤتلف تنصهر البروتين تعلق على سطح النيكل-نيتروتراياكتيك حمض [اغروس] المغناطيسي الخرز. ويرد أيضا تحليل العينات المقايسة مفصولة بالصوديوم دوديسيل كبريتات-polyacrylamide هلام التفريد في جل لاحقة.
Abstract
البروتياز هي الإنزيمات دراسة مكثفة بسبب أدوارها الأساسية في عدة مسارات البيولوجي للكائنات الحية والمرضية؛ ولذلك، فأهداف هامة من المخدرات. قمنا بتطوير منصة المغناطيسي [اغروس]--حبة--على أساس مقايسة لتحقيق نشاط بروتيوليتيك، التي تستند إلى استخدام ركائز البروتين الانصهار المؤتلف. من أجل التدليل على استخدام هذا النظام المقايسة، يرد بروتوكول على سبيل مثال نوع فيروس نقص المناعة البشرية 1 (فيروس نقص المناعة البشرية-1) البروتياز. منصة عرض المقايسة يمكن الاستفادة من كفاءة في توصيف البيوكيميائية من البروتياز، بما في ذلك قياس نشاط الإنزيم في الطفرات، الحركية أو إعاقة أو الدراسات النوعية، وأنها قد تكون مناسبة للفائق فحص الركيزة أو يمكن أن تتكيف مع سائر الإنزيمات بروتيوليتيك.
في هذا النظام المقايسة، ركائز التطبيقية تحتوي على الطرفي ن هيكساهيستيديني (له6) وعلامات البروتين (MBP) ملزمة مالتوس، مواقع الانقسام للتبغ أحفر البروتياز فيروس نقص المناعة البشرية-1، الفيروس (الإجمالية) وبروتين فلوري ج--المحطة طرفية. يمكن أن تنتج كفاءة في خلايا الإشريكيّة القولونية ركائز وتنقيتها بسهولة باستخدام الخرز المطلي-تشيلاتي-نيكل (ني). أثناء الفحص، والانقسام بروتيوليتيك من ركائز تعلق حبة يؤدي إلى الإفراج عن شظايا الانقسام الفلورسنت، والتي يمكن أن تقاس فلوريميتري. بالإضافة إلى ذلك، يمكن تحليل ردود فعل الانقسام بالصوديوم دوديسيل كبريتات-polyacrylamide هلام التفريد (الحزب الديمقراطي الصربي صفحة). كما يتم وصف بروتوكول ريناتوريشن في جل مكونات المقايسة، كما ريناتوريشن الجزئي للبروتينات الفلورية يمكن الكشف عنها على أساس الوزن الجزيئي والأسفار.
Introduction
الإنزيمات proteolytic ينتمون إلى المجموعات الإنزيم الأكثر كثافة التحقيق نظراً لأهميتها في الأيضية والتطبيقات الصناعية، كذلك. دورهم الرئيسي في الأمراض الفيروسية، وتنظيم تخثر، سرطان الدم والقلب والأوعية الدموية وأمراض الأعصاب يجعل البروتياز أهداف بارزة في مجال اكتشاف الأدوية. ولذلك، وصف مفصل لخصوصية الركيزة ومثبط توصيفها حوزتي (PR) من اهتمام محوري ويفضل أن يؤديها فحوصات الكيمياء الحيوية سريعة وفعالة من حيث التكلفة، وقوى1،2، 3.
في الوقت الحاضر، هي الغالبية العظمى من فحوصات في المختبر حوزتي المطبقة في مجال اكتشاف الأدوية للتنميط مجمع متجانسة، فلوري المستندة إلى الببتيد، والفائق الفحص (HTS)-منصات متوافقة4. وعلاوة على ذلك، الببتيدات المسمى ليست مناسبة لفحص المكتبة فقط، ولكن كما أنها توفر أدوات عظيمة لتحديد الإنزيم معلمات الحركية على ركائز المحدد. وفي حالات أخرى، حيث وضع العلامات من الركازة من غير الممكن، فحوصات المستندة إلى الفصل قد توفر حلاً ممكناً لتقييم الخصائص الحركية لردود الفعل proteolytic3.
عموما، تستند حوزتي في المختبر فحوصات على استخدام نوعين من الركازة: قصيرة الببتيدات أو بروتينات كاملة. وتطبق في هذه الحالات، حيث الانقسام وتسلسلات ببتيد قصيرة تعكس خصائص الانقسام بما فيه الكفاية، بالأساليب القياسية التالية: (ط) دراسة ركازات البروتين القياسية مثل الأنسولين المؤكسد ب-سلسلة، (ثانيا) اختبار ركائز المتاحة تجارياً من البروتياز الأخرى، (ثالثا) فحص مكتبات الببتيد الاصطناعية والمسمى فلوريسسينتلي تم إنشاؤها بواسطة الكيمياء التوافيقيه، أو (رابعا) باستخدام الطرق الوراثية، على سبيل المثال، البيولوجية عرض تكنولوجيات5، 6. بالإضافة إلى التصنيف التقليدي، منصات رواية أخرى متاحة أيضا لتوليد الركازة (مثلاً، تشكيل المستمدة من البروتين الببتيد المكتبات7 أو الأنواع الفرعية الخاصة الأساليب الوراثية، مثل الانصهار المؤتلف ركائز أساس البروتين8،9،10،،من1112).
جميع الأنواع المذكورة أعلاه الركيزة وفحوصات المزايا والقيود الخاصة بها، ووضع مقايسة صيغ الجمع و/أو تحسين مزايا المنصات المعروفة لا تزال في الطلب. هنا يمكننا وصف بروتوكول مقايسة المستندة إلى فصل مبطلات فلورسنت، الذي يستخدم ركائز المؤتلف. تتكون هذه البروتينات الانصهار6 والعلامات MBP تنصهر إلى موقع انقسام وتحكم العلاقات العامة الإجمالية، التي تبعتها تسلسل الركيزة للفائدة التي ترتبط ارتباطاً مباشرا بروتين ج-طرفية فلورسنت (FP) (الشكل 1A). يمكن أن يؤديها استنساخ تسلسل الحمض النووي الترميز لموقع انقسام من الفائدة في الكاسيت 'الاستنساخ' بفعل عملية ربط واحدة إلى بلازميد التعبير، التي قد تم خطيا مسبقاً بتقييد اندونوكليسيس.
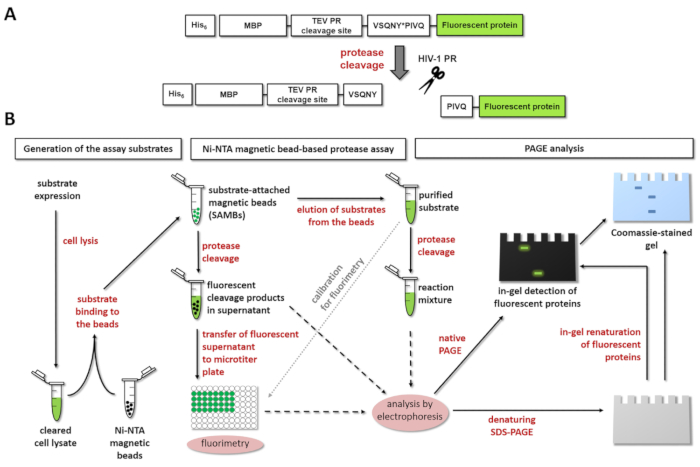
رقم 1: مبدأ المقايسة حوزتي الفلورسنت. يظهر البروتياز (A) التمثيل التخطيطي من الركازة فلورسنت والانقسام حسب النوع 1 من فيروس نقص المناعة البشرية (فيروس نقص المناعة البشرية-1). يشير السهم إلى موقف الانقسام داخل تسلسل الموقع الانقسام مصفوفة/قفيصه حوزتي فيروس نقص المناعة البشرية-1 (فسقني * بيفق). (ب) فلوري ركائز يمكن استخدامها لتحليل التفاعلات إنزيم المقايسة المغناطيسي على أساس حبة ني-الإدارة الوطنية للسياحة، وجل polyacrylamide التفريد، كذلك، كما هو مبين في الرسم التخطيطي لسير العمل. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
على الرغم من أن فحوصات proteolytic استخدام البروتين المؤتلف مماثلة الركازات المحتوية على علامة تقارب وموقع انقسام proteolytic فلورسنت بروتين يكون الفعل قد وصف9،،من810، والنظام قدم هنا وتعتزم دمج وتحسين المزايا لهذه الأساليب. فارق هام أن ركائز البروتين الانصهار في هذا المنبر الإنزيم مجهزة MBP تعزيز القابلية للذوبان بروتين13 وتحتوي على موقع انقسام والسيطرة للحد من الفقر TEV. وعلاوة على ذلك، تحتوي ركائز البروتينات الفلورية الجيل الجديد، وهي مستقرة جداً وقد شكل أحادي لمنع التراكم الركازة. بالإضافة إلى تطبيق أشكال mTurquoise2 و mApple تنصهر14المنشورة سابقا، هنا نعرض أيضا تعزيز النتائج نظراً لاستخدام الركيزة التوليفية التي تحتوي على أحادي علامة نيون بروتين فلوري الصفراء (مييفب). بموجب هذا إثبات توافق النظام مع غيرها من البروتينات الفلورية، وتمثل بعض الأنواع العامة للنتائج التي يمكن اكتسابها من خلال فحص البروتياز.
يتم التعبير عنها في الخلايا BL21(DE3) كولاي البروتينات الانصهار المؤتلف وتستخدم كركائز للانزيم في حمض نيكل-نيتروتراياكتيك (ني-الإدارة الوطنية للسياحة)-المغلفة المغناطيسي [اغروس]-حبة-المرفقة بالنموذج. منتجات الانقسام الطرفي ج حررتها حوزتي الفائدة من سطح حبة إلى المادة طافية على الانقسام. بعد فصل المادة طافية (التي تحتوي على الإنزيم ومنتجات الانقسام) عن الخرز المغناطيسية، يمكن أن تقاس الأسفار لتحديد خصائص الإنزيم الانقسام. على النقيض من الأساليب الموصوفة سابقا، في منظومة المقدمة هنا، مبالغ الركيزة ومنتجات الانقسام الطرفي ج فريد كمياً استناداً إلى إجراء معايرة الركازة مفصلة. يمكن أن تدعم نظام مقايسة الحزب الديمقراطي الصربي صفحة تحليل عينات الفحص؛ يمكن تطبيق مجموعة مرئيات في جل فلورسنت لاحقة فورا بعد التفريد أو بعد ريناتوريشن في جل مكونات الفلورسنت نونديناتوريد والتشويه والتحريف، على التوالي14.
المرونة والهيكل للكاسيت 'الاستنساخ' تسمح إدراج كفاءة من حيث وقت وتكاليف من مجموعة متنوعة واسعة من التسلسلات في بنية، وهكذا، يعزز توليد مكتبات الركيزة. نظراً لجميع خطوات الفحص الآلي و HTS-متوافق مع، النظام يمكن أن تكون جاذبية خاصة، على سبيل المثال، مبطلات خصوصية القياسات والدراسات الطفرات، أو أنها قد أيضا فعالية ستستخدم لفحص مثبطات البروتياز الصناعية و/أو تطوير العقاقير المضادة للفيروسات، كذلك.
يمكن تحديد معلمات الحركية إنزيم (كالقط، كم) بواسطة المقايسة القائم على الفصل بين البلدان المتقدمة النمو؛ لذلك، قد يكون مناسباً لإجراء قياسات حركية إنزيم الفردية، مثل دراسات الوقت بالطبع، وتعتمد على الركيزة، وتثبيط. وهذا يثبت أن ركائز البروتين الانصهار المؤتلف توفير بدائل جيدة لركائز أوليجوبيبتيدي الاصطناعية المستخدمة في كثير من الأحيان، ونظرا للتشابه عالية على ركائز بوليبروتين، وهي تمثل تحدث بشكل طبيعي التفاعلات إنزيم-الركيزة أكثر دقة.
Protocol
1-توليد والبلازميدات التعبير الترميز الركيزة
- لينيريزي بلازميد التعبير FP-MBP بديست صاحب6من باتشي وني اندونوكليسيس قيود. لتوليد بديست صاحب6-MBP-FP، انظر Bozóki et al.14.
- إضافة 1,500-2,000 ميكروغرام ل صاحب بديست6-MBP-FP التعبير بلازميد، 2 ميليلتر من كل من الهيئة وتقييد ني اندونوكليسيس، 10 ميليلتر من 10 x العازلة (انظر الجدول للمواد)، والمياه خالية من نوكلاس (نفو) إلى 100 ميليلتر في أنبوب ميكروسينتريفوجي.
- احتضان الخليط رد الفعل عند 37 درجة مئوية ح 1.
- إضافة 20 ميليلتر من 6 × الأرجواني الحمض النووي تحميل صبغ إلى خليط رد فعل وفصل المنتجات الانقسام بالتفريد، استخدام 1% [اغروس] هلام. تطبيق سلم الحمض النووي 1 كيلو بايت كمعيار.
- شطف الجل لمدة 15 دقيقة في 20 مل من المخزن المؤقت (40 مم تريس، 20 ملم حمض الخليك، 1 مم يدتا، الأس الهيدروجيني 8.5) تاي ميليلتر 20 تحتوي على الحل سيبر الخضراء والمكوس فرقة بلازميد خطية من [اغروس] هلام، استخدام أداة حادة.
ملاحظة: حين ينير الهلام بالظلام--القراءة أزرق ترانسيلوميناتور (دربت)، يظهر بلازميد FP-MBP بديست صاحب خطية6كعصابة متميزة ومشرقة في حوالي 7-8 كيلو بايت. - تنقية بلازميد التعبير خطية من جل شريحة باستخدام مجموعة أدوات استخراج جل وفقا لإرشادات الشركة المصنعة.
- إدراج تسلسل الركازة بلازميد التعبير FP-MBP بديست صاحب خطية6.
- يصلب قدما (إعادة توجيه)، وعكس (REV) كولاي اليغنوكليوتيد كودون الأمثل كبسولة تفجير الترميز للتسلسل الركيزة للفائدة.
ملاحظة: سوف يحيط كبسولة تفجير ملدنة بها نهايات متماسكة تناظر باشي ونهيي endonuclease قيود الانقسام ومواقع (الشكل 2).- ميكس 150 نانوغرام من بلازميد التعبير خطية مع 200 نانوغرام من إعادة توجيه و 200 نانوغرام اليغنوكليوتيد REV الإشعال في 0.2 مل تفاعل البوليميراز المتسلسل (PCR) أنبوب وضبط مستوى الصوت إلى 17 ميليلتر بإضافة نفو.
- احتضان هذا الخليط عند 65 درجة مئوية لمدة 2 دقيقة، ومن ثم، عند 4 درجة مئوية لمدة 2 دقيقة على الأقل.
- إجراء إدخال كبسولة تفجير الملدن في بلازميد خطية بربط.
- إضافة 2 ميليلتر من T4 ليجاسى المخزن المؤقت (10 x) و 1 ميليلتر من ليجاسى T4 إلى خليط يحتوي على بلازميد خطية والإشعال ملدنة.
- احتضان الخليط ربط في 16 درجة مئوية ح 16.
- يصلب قدما (إعادة توجيه)، وعكس (REV) كولاي اليغنوكليوتيد كودون الأمثل كبسولة تفجير الترميز للتسلسل الركيزة للفائدة.

الشكل 2 : الإشعال اليغنوكليوتيد الترميز لانشقاق proteolytic الموقع التسلسل. الإشعال إلى الأمام وعكس ترميز في فسقني * تسلسل الموقع الانقسام بيفق من فيروس نقص المناعة البشرية-1 "العلاقات العامة." بعد الصلب كبسولة تفجير اليغنوكليوتيد تكميلية، يحتوي الحمض النووي المزدوج-الذين تقطعت بهم السبل قصيرة نهايات لزجة، المقابلة لمن اندونوكليسيس تقييد باشي وني. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- تحويل 100 ميليلتر من الخلايا المختصة BL21(DE3) قبل 5 ميليلتر من خليط ربط وانتشار الخلايا على مرق (رطل) ليسوجيني أجار لوحات تتضمن الأمبيسلّين.
ملاحظة: سيتم البروتينات الفلورية في نفس الإطار القراءة المفتوحة مع العلامات الانصهار الطرفي ن إلا بعد ربط نجاح. أيام قليلة بعد التحول، سوف تظهر المستعمرات (التي تحتوي على بلازميد التعبير الترميز لموقع الانقسام تم إدراجها للفائدة) الأسفار مرئية مع، أو حتى بدون استخدام دربت. - إعداد المخزون والغليسيرول من المستعمرات يصور.
- أغسل مستعمرة منفصلة في أنبوب 50 مل أجهزة الطرد مركزي التي تحتوي على 5 ميليلتر رطل متوسطة تحتوي على الأمبيسلّين (في تركيز نهائي من 100 ميكروغرام/مل).
- احتضان في 37 درجة مئوية ح 8 بينما تهتز باستمرار عند 220 دورة في الدقيقة؛ ثم حصاد الخلايا باستخدام الطرد المركزي في 1,000 س ز لمدة 5 دقائق في درجة حرارة الغرفة.
- بلطف تعليق الخلايا الموجودة في 1 مل حل والغليسيرول 80 ٪ (المخفف بالماء المقطر) وإضافة 500 ميليلتر من 10 مم مجكل2 الحل إلى التعليق.
- نقل التعليق إلى أنبوب تجميد وتخزين المخزونات في-70 درجة مئوية.
- التحقق من تسلسل بلازميد الذي تم إنشاؤه من خلال تسلسل الحمض النووي.
- إضافة 10 ميليلتر والغليسيرول المخزون (إعداد في الخطوة 1، 7) إلى 5 مل من رطل المتوسطة التي تحتوي على 100 ميكروغرام/مل الأمبيسلّين في أنبوب الطرد مركزي 50 مل.
- احتضان التعليق في 37 درجة مئوية ح 16 بينما تهتز باستمرار عند 220 دورة في الدقيقة؛ ثم حصاد الخلايا باستخدام الطرد المركزي في 2,000 س ز لمدة 10 دقائق في 4 درجات مئوية.
- عزل بلازميد التعبير من بيليه الخلية قبل مينيبريب بلازميد كيت (انظر الجدول للمواد) وفقا لإرشادات الشركة المصنعة، واستخدام بلازميد المنقي لتسلسل الحمض النووي.
ملاحظة: للتسلسل، 5 '-جاتجاجكككتجااجاكجكجكاج-3' (إلى الأمام)-جكاجكجاتاجتججتاكجك 5 '-3' يمكن استخدام كبسولة تفجير اليغنوكليوتيد (عكس).
2-التعبير عن ركائز نيون
- إعداد ثقافة كاتب.
- إضافة 10 ميليلتر والغليسيرول المخزون (إعداد في الخطوة 1، 7) إلى 5 مل من رطل المتوسطة التي تحتوي على 100 ميكروغرام/مل الأمبيسلّين في أنبوب الطرد مركزي 50 مل.
- احتضان التعليق في 37 درجة مئوية ح 15 بينما تهتز باستمرار 220 لفة في الدقيقة.
- نقل ثقافة البكتيرية (5 مل) إلى 50 مل متوسطة رطل الطازجة التي تحتوي على 100 ميكروغرام/مل الأمبيسلّين في قارورة Erlenmeyer عقيم 500 مل.
- تنمو الخلايا في 37 درجة مئوية امتصاص 0.6-0.8 في 600 الطول موجي نانومتر، بينما تهتز باستمرار 220 لفة في الدقيقة.
ملاحظة: إذا كان علاج التتراسيكلين لتطبيقها في الخطوة 2، 5، من غير المستحسن زراعة الخلايا لامتصاص أكثر من 0.6 في 600 نانومتر. - إضافة الأيزوبروبيل β-د-1-ثيوجالاكتوبيرانوسيدي (إيبتج) إلى تركيز 1 مم النهائي للحث على التعبير البروتين.
- إذا لم يتم تطبيق علاج التتراسيكلين، احتضان ثقافة ح 3 في 37 درجة مئوية بينما تهتز باستمرار 220 لفة في الدقيقة ويستمر في البروتوكول مع الخطوة 2.6. إذا تم تطبيق علاج التتراسيكلين، تستمر في البروتوكول مع الخطوات 2.5.1-2.5.3.
ملاحظة: قد يكون بعض من قوة حماية المنشآت التي تنتجها خلايا كولاي وقتاً أطول في نضج (انظر الأعمال السابقة)17من16،؛ في هذه الحالات، يمكن أن يكون القبض العلاج التتراسيكلين، وترجمة البروتين اختيارياً بغية زيادة الغلة الفلورسنت الحل الركازة.- احتضان تعليق خلية ح 2 في 37 درجة مئوية بينما تهتز باستمرار عند 220 دورة في الدقيقة؛ ثم، إضافة إلى حل التتراسيكلين (بتركيز نهائي 200 ميكروغرام/مل).
- احتضان ثقافة الخلية وفقا للوقت نضج البروتين الفلورسنت الاختيار عند 37 درجة مئوية، بينما تهتز باستمرار 220 لفة في الدقيقة.
- نقل 2 x 25 مل ثقافة لتنظيف أنابيب الطرد المركزي 50 مل وحصاد الخلايا باستخدام الطرد المركزي في س 4,000 ز لمدة 15 دقيقة في 4 درجات مئوية.
- تجاهل المادة طافية وتخزين الكريات الخلايا البكتيرية في-70 درجة مئوية على الأقل ح 1.
ملاحظة: تظهر الخلايا التي تحتوي على ركائز الفلورسنت أعرب fluorescence مرئية مع، أو حتى بدون استخدام دربت.
3. تعطيل الخلية
- ضع بيليه خلية مجمدة في الجليد والسماح لها بالذوبان لمدة 15 دقيقة.
- إضافة 2 مل من تحلل المخزن المؤقت (50 مم نة2بو4، 300 مم كلوريد الصوديوم، ايميدازول 10 ملم، 0.05% 20 توين، درجة الحموضة 8) إلى بيليه وتعليق الخلايا.
- إضافة 10 ميليلتر من فلوريد فينيلميثانيسولفونيل الطازجة (بمسف) مبطلات المانع الحل (8.7 ملغ/مل، الذائبة في الإيثانول) إلى التعليق.
- إضافة 2 مغ ليسوزيمي و 20 وحدة من الدناز إلى التعليق وتعلق عليه.
- احتضان تعليق على الجليد لمدة 15 دقيقة، ودوامه من حين لآخر.
- نقل 2 × 1 مل التعليق إلى 1.5 مل ميكروسينتريفوجي أنابيب و sonicate أن الإيقاف لمدة 3 دقيقة، في جولات 10 ق من سونيكيشن و 5 s ليستريح.
- الطرد المركزي هذه الأنابيب في 10,000 س ز لمدة 20 دقيقة في درجة حرارة الغرفة؛ بعد ذلك، إزالة المادة طافية الفلورسنت (مسح الخلايا البكتيرية ليستي) بعناية من كل أنبوبة وتحويلها إلى أنابيب ميكروسينتريفوجي جديدة.
ملاحظة: مسح ليساتيس التي تحتوي على الركازة الفلورسنت إظهار fluorescence مرئية مع، أو حتى بدون استخدام دربت ويمكن تخزينها عند 4 درجة مئوية لمدة تصل إلى أسبوعين. عدم تجميد ذلك. ليساتيس المطهرة يمكن أن تستخدم مباشرة لإعداد نموذج في حوزتي المقايسة (انظر الفرع 4-1) أو يمكن أن تستخدم أيضا لتنقية الركازة (راجع الخطوة 4.5.1).
4-ني-جاتا المغناطيسي على أساس حبة مبطلات الإنزيم
ملاحظة: نظراً لمرونة منصة الفحص، فإنه يمكن أن يكون الأمثل للعديد من أنواع مختلفة من الدراسات. لهذا السبب، ونظرا إلى اختلاف في معدل نشاط الإنزيمات للاختيار، بعض البارامترات المقايسة (حيث أنه تتم الإشارة إليها) لا يمكن وصفه بصراحة ولكن بحاجة إلى أن يكون الأمثل للأهداف الفردية والتصميم التجريبي. كتوجيه، تتم الإشارة إلى المعلمات لبعض أنواع الدراسات في خطوات معينة.
- إعداد نموذج
- جيل من الركازة تعلق الخرز المغناطيسي
- مكان (انظر الجدول للمواد) مغلقة 2 مل منخفضة-بروتين-ربط أنبوب ميكروسينتريفوجي تتضمن الجديدة أو المعاد تدويره (انظر الفرع 4، 7) حبات المغناطيسي [اغروس] ني-الإدارة الوطنية للسياحة في مركز مغناطيسي جسيمات (MPC).
ملاحظة: مقدار تعليق حبة التطبيقية أن تعيين استناداً إلى التصميم التجريبي. استخدمنا 1 مل من محلول حبة المغناطيسي (5%، v/v) في كل تجربة. - قد عصا الخرز على الجدار و/أو في غطاء أنبوب ميكروسينتريفوجي؛ ولذلك، تشغيل لجنة الاحتكارات والأسعار رأسا في كل اتجاه للتأكد من أن يتم جمع كل من الخرز.
- إزالة المادة طافية وتجاهل ذلك.
- أغسل الخرز التي تحلل المخزن المؤقت.
- إضافة 1.8 مل من المخزن المؤقت لتحلل الخرز وإزالة أنبوب مغلق من لجنة الاحتكارات والأسعار.
- تعليق الخرز في الأنبوب بالهز و/أو تحول الأنابيب رأسا حتى تكون العينة متجانسة تماما.
- ضع الأنبوب مرة أخرى إلى لجنة الاحتكارات والأسعار وتحويلها رأسا لجمع الخرز.
- فتح الأنبوب وتجاهل المادة طافية.
- إضافة 1.0-1.8 مل من تم مسحها ليساتي (أعد في الخطوة 3، 7) الخرز وإزالة الأنبوب من لجنة الاحتكارات والأسعار.
- تشغيل أنبوب مغلق رأسا حتى الخرز متجانسة تماما وتدوير الأنبوب ببطء المدورة في درجة حرارة الغرفة لمدة 30 دقيقة.
- وضعه في لجنة الاحتكارات والأسعار، وإزالة الخلية الممسوحة ليستي من الخرز ومن الغطاء.
ملاحظة: الخلية الممسوحة ليساتي لا يجوز تجاهلها أو حفظها لاستخدامها مرة أخرى (راجع الملاحظة بعد الخطوة 3، 7). - إضافة 1% 20 توين (pH 7) لتعلق الركازة المغناطيسي الخرز (سامبس).
ملاحظة: تظهر سامبس fluorescence مرئية مع، أو حتى بدون استخدام دربت.
- مكان (انظر الجدول للمواد) مغلقة 2 مل منخفضة-بروتين-ربط أنبوب ميكروسينتريفوجي تتضمن الجديدة أو المعاد تدويره (انظر الفرع 4، 7) حبات المغناطيسي [اغروس] ني-الإدارة الوطنية للسياحة في مركز مغناطيسي جسيمات (MPC).
- الغسيل سامبس
- ضع الأنبوب مع تعليق سامب إلى لجنة الاحتكارات والأسعار، وتجاهل المادة طافية.
- أغسل سامبس 3 x مع كل المخزن المؤقت: ط) 1.8 مل من 1% 20 توين (pH 7)؛ ثانيا) 1.8 مل من المخزن المؤقت للغسيل (50 ملم نة2بو4، 300 مم كلوريد الصوديوم، ايميدازول 5 مم، 0.05% 20 توين، الأس الهيدروجيني 7)؛ ثالثا) 1.8 مل من الانقسام والمخزن المؤقت (50 ملم نة2بو4، 300 مم كلوريد الصوديوم، 0.05% 20 توين، ودرجة الحموضة 7).
ملاحظة: لإجراء الغسيل، راجع الخطوة 4.1.1.4. المخزن المؤقت الانقسام وقد تتغير وفقا لاحتياجات تجريبية، ولكن من المستحسن للتحقق من دليل الخرز ني-جاتا المغناطيسي لتحديد التوافق.
- إعداد الحل الأسهم سامب
- إضافة حاجز انقسام إلى سامبس غسلها لإنشاء حل أسهم سامب.
ملاحظة: بعد إضافة المخزن المؤقت، لا يهز أو تشغيل الأنبوب رأسا. حجم المخزن المؤقت الانقسام الذي يعتمد على تصميم التجارب الفردية ويجب احتساب استناداً إلى عدد حبات مغناطيسية (راجع الخطوة 4.1.1.1) وعلى وحدات التخزين التي ستستخدم في خطوة 4.1.4.2. لأنابيب 2 مل، هو حجم التطبيقية تصل إلى 1,900 ميليلتر (انظر الجدول 1). كثافة الحل الأسهم سامب حبة المغناطيسي الموصى بها هي 2%-10% (v/v).نوع الدراسة حجم المخزن المؤقت للانقسام (ميليلتر) S-تعتمد على القياسات (الشكل 4) 1600 الوقت بالطبع القياسات (التين 5A) 1600 دراسة تثبيط (التين 5B) 1900 دراسة الاعتماد على درجة الحموضة (الشكل 6) 1400
الجدول 1: حجم المخزن المؤقت الانقسام والمستخدمة في إعداد الحل سامب الأسهم في أنواع مختلفة من القياسات. - إزالة أنبوب مغلق من لجنة الاحتكارات والأسعار. استخدم الحل سامب الأسهم مباشرة أو تخزينها عند 4 درجة مئوية لمدة تصل إلى 24 ساعة.
- إضافة حاجز انقسام إلى سامبس غسلها لإنشاء حل أسهم سامب.
- جيل عينات الفحص استخدام الحل الأسهم سامب
ملاحظة: تفاصيل هذا الجزء التحليل تعتمد بشدة على تصميم التجارب الفردية (نموذج أنواع مبينة في الجدول 2).نوع العينة وتلاحظ رد فعل عينة (R) -يستخدم لتقييم خصائص الانقسام
-يحتوي على الإنزيم والركازة في المخزن المؤقت للانقسامالركيزة عينة فارغة (ب) -تستخدم لتقييم الانفصال من الركازة عفوية (راجع الخطوة 4.6.2)
--يتضمن فقط الركيزة في المخزن المؤقت للانقسامنموذج عنصر تحكم الركازة (ج) -لتركيز الركيزة ديتيمينينج (راجع الخطوة 4.6.3)
--يتضمن فقط الركيزة في المخزن المؤقت شطف
الجدول 2: نموذج أنواع الفحص المغناطيسي على أساس حبة حوزتي ني-الإدارة الوطنية للسياحة.- إعداد 2 مل أنابيب ميكروسينتريفوجي منخفضة البروتين-ملزم لعينات الفحص.
ملاحظة: كما يمكن استخدام أخرى منخفضة البروتين ملزمة والمنتجات البلاستيكية. استخدام أنابيب مستديرة أو مسطحة القاع لضمان حرية حركة سامبس. انظر العدد الموصى به من الأنابيب في الجدول 3.نوع الدراسة R ب ج S-تعتمد على القياسات (الشكل 4) 5 5 2 الوقت بالطبع القياسات (التين 5A) 6 6 2 دراسة تثبيط (التين 5B) 7 7 1 دراسة الاعتماد على درجة الحموضة (الشكل 6) 5 5 1
الجدول 3: عدد من أنابيب ميكروسينتريفوجي مل 2 المطلوبة لكل نوع من أنواع العينات في الدراسات أظهرت. - تعليق الحل سامب الأسهم حتى التجانس ونقل كمية الركازة يتم تحليلها في ردود الفعل فورا في قنينات العينات. الحجم الموصى به هو 25-300 ميليلتر، ولكن أن يكون تعيين وفقا للتصميم التجريبي الفردية (الجدول 4).
ملاحظة: تحقق من إذا تم قياس جميع سامبس في الجزء السفلي من الأنابيب. سامبس يجوز التمسك بجدار الأنبوبة، التي يمكن أن تشوه نتائج الفحص. إذا كانت أحجام مختلفة قياس تسلسلياً، تبدأ اليقوتينج مع حجم أعلى ومحاولة تقليل التغير من الممصات و/أو نصائح ماصة.نوع الدراسة R ب ج S-تعتمد على القياسات (الشكل 4) 25 – 50 – 100 – 150 – 250 25 – 50 – 100 – 150 – 250 25 الوقت بالطبع القياسات (التين 5A) 25 25 25 دراسة تثبيط (التين 5B) 120 120 120 دراسة الاعتماد على درجة الحموضة (الشكل 6) 100 100 100
الجدول 4: قياس حجم الحل سامب في قارورة عينة من كل نوع العينة في الدراسات أظهرت. - وضع أنابيب العينات التي تحتوي على تعليق سامب الكوتيد إلى لجنة الاحتكارات والأسعار وطفيفة نقل لجنة الاحتكارات والأسعار ذهابا وإيابا.
- بعناية إزالة المادة طافية من سامبس وتجاهل ذلك.
- إزالة الأنابيب من لجنة الاحتكارات والأسعار، وإضافة حجم رد فعل المخزن المؤقت (الاحتياطي الانقسام أو شطف [100 مم يدتا، 0.05% 20 توين، ودرجة الحموضة 7]) محسوب بعناية إلى سامبس.
ملاحظة: حساب حجم المخزن المؤقت وفقا للتصميم التجريبي الفردية (الجدول 5). لأنابيب 2 مل، والحجم النهائي الموصى به من رد فعل خليط (حجم المخزن المؤقت لإضافتها في هذه الخطوة رد فعل + حجم الحل المراد إضافتها في الخطوة 4.2.3) 50-150 ميليلتر. تأكد من جميع سامبس يتم غسلها في المخزن المؤقت الذي تم إضافتهم. المخزن المؤقت شطف يستخدم بدلاً من الانقسام والمخزن المؤقت في حالات العينات التحكم (ج) الركيزة. لإجراء دراسة تثبيط، ينصح المانع اختيار المراد إضافتها في هذه الخطوة.نوع الدراسة حجم المخزن المؤقت الذي رد فعل (ميليلتر) S-تعتمد على القياسات (الشكل 4) المخزن المؤقت لانشقاق ميليلتر 68 الوقت بالطبع القياسات (التين 5A) المخزن المؤقت لانشقاق ميليلتر 68 دراسة تثبيط (التين 5B) الأسهم 67.3 ميليلتر الانقسام المخزن المؤقت + مثبط ميليلتر 0.7 الحل * دراسة الاعتماد على درجة الحموضة (الشكل 6) ميليلتر 69.5 الانقسام المخزن المؤقت * *
الجدول 5: حجم المخزن المؤقت لرد الفعل في الدراسات أظهرت. * أمبرينافير تم حلها في ثنائي ميثيل-سلفوكسيد؛ حلول الأسهم أمبرينافير (تتراوح بين 1 نانومتر بتركيزات 1 ميكرومتر) وطبقت لدراسة المثبطة (انظر الشكل 5 (ب)). * * الرقم الهيدروجيني للمخزن المؤقت الانقسام والتطبيقية وتراوحت pH 6.0-8.5. - إغلاق أغطية الأنابيب. الآن جاهزة للفحص العينات.
ملاحظة: يمكن تخزين العينات عند 4 درجة مئوية لمدة تصل إلى 24 ساعة، ولكن التخزين لا ينطبق إلا إذا كان استخدام الحل الأسهم سامب فورا بعد الإعداد (راجع الخطوة 4.1.3.2).
- إعداد 2 مل أنابيب ميكروسينتريفوجي منخفضة البروتين-ملزم لعينات الفحص.
- جيل من الركازة تعلق الخرز المغناطيسي
- الشروع في ردود فعل بروتيوليتيك
- إعداد الحل إنزيم proteolytic وفقا لاحتياجات التجريبية.
ملاحظة: من المستحسن استخدام المخزن مؤقت انقسام إلى حل و/أو تمييع الإنزيم. وقد نشرت البروتوكولات لتنقية فيروس نقص المناعة البشرية-114 و "الحد من الفقر الإجمالية"18 سابقا. - تعيين ثيرموشاكير معدل الانفعالات (600 لفة في الدقيقة) ودرجة حرارة الحضانة (الجدول 6).
نوع الدراسة حضانة درجة الحرارة (درجة مئوية) S-تعتمد على القياسات (الشكل 4) 37 الوقت بالطبع القياسات (التين 5A) 37 دراسة تثبيط (التين 5B) 37 دراسة الاعتماد على درجة الحموضة (الشكل 6) 30
الجدول 6: درجة حرارة الحضانة تطبيقها في دراسة مختلف أنواع- لفيروس نقص المناعة البشرية-1 "العلاقات العامة"، ينصح 37 درجة مئوية، في حين ينصح 30 درجة مئوية للعلاقات العامة TEV. - إضافة حل الإنزيم إلى عينات رد فعل لتهيئة ردود الفعل بروتيوليتيك.
ملاحظة: في حالة الركازة فارغة (ب) والعينات ج، إضافة الانقسام المخزن المؤقت (الإنزيم المخزن المؤقت) وشطف المخزن المؤقت، على التوالي. وحدة التخزين تحسب وفقا للاحتياجات الفردية التجريبية (الجدول 7). لأنابيب 2 مل، وهو الحجم النهائي الموصى به من رد فعل خليط (حجم المخزن المؤقت رد الفعل بإضافته في الخطوة 4.1.4.5 + حجم الحل المراد إضافتها في هذه الخطوة) 50-150 ميليلتر.نوع الدراسة حجم المخزن المؤقت المخزن المؤقت/شطف الحل/إنزيم إنزيم (ميليلتر) S-تعتمد على القياسات (الشكل 4) 2 الوقت بالطبع القياسات (التين 5A) 2 دراسة تثبيط (التين 5B) 2 دراسة الاعتماد على درجة الحموضة (الشكل 6) 0.5
الجدول 7: حجم الإنزيم الحل/الإنزيم المخزن المؤقت المخزن المؤقت/شطف إضافتها أثناء التهيئة لعينات الفحص في حالة أن الدراسات أظهرت. - إثارة الخرز بعناية عن طريق تحريك بلطف الأنابيب، ووضع الأنابيب مباشرة إلى ثيرموشاكير الفعل تهتز.
ملاحظة: إنهاء عينة اليدوي (انظر الفرع 4-3) يأخذ وقتاً أطول من البدء؛ ومن ثم، يوصي بتأخير مسجلة من 2 دقيقة على الأقل بين المبدئية ردود الفعل. - احتضان هذه العينات وفقا للتصميم التجريبي (الجدول 8).
نوع الدراسة حضانة مرات (دقيقة) S-تعتمد على القياسات (4A التين) 7 S-تعتمد على القياسات (التين 4B) 120 الوقت بالطبع القياسات (التين 5A) 0 – 2، 5 – 5 – 10 – 15 – 20 دراسة تثبيط (التين 5B) 10 دراسة الاعتماد على درجة الحموضة (الشكل 6) 60
الجدول 8: حضانة مرات المطبقة على عينات الفحص في القياسات المختلفة.
- إعداد الحل إنزيم proteolytic وفقا لاحتياجات التجريبية.
- التعاون تيرمينردود الفعل بروتيوليتيك
- أخذ العينة من شاكر، 30 ثانية قبل نهاية الحضانة، وأنها تدور على وجه السرعة.
- ضع الأنبوب إلى لجنة الاحتكارات والأسعار، والسماح لها الوقوف لمدة 15 ثانية، والتحرك قليلاً لجنة الاحتكارات والأسعار ذهابا وإيابا.
- فتح الغطاء ونقل المادة طافية بعناية للوحة أو أنبوب جديد.
ملاحظة: لا تلمس الخرز مركزة مع تلميح الماصة. قد تظهر المادة طافية جمع العينات ج وعينات البحث والتطوير مع درجة عالية من الانقسام والأسفار مرئية مع، أو حتى بدون استخدام دربت.
- كشف فلوري
- نقل 2 × 30 ميليلتر من supernatants عينة المنفصلين إلى ميكروسكوبية نصف المساحة سوداء.
- قياس الأسفار استخدام عوامل التصفية المناسبة الإثارة والانبعاثات.
ملاحظة: قياس fluorescence الأساسي المخزن المؤقت للانقسام وشطف المخزن المؤقت، كذلك. تصفية تركيبات الحاجة إلى اختيار استناداً إلى قياس البروتين الفلورسنت (الجدول 9).بروتين فلوري عوامل الإثارة (nm) عوامل الانبعاثات (nm) mTurqiouse2 355/40 460/25 مييفب 544/15 590/10 mApple 544/15 590/10
الجدول 9: عوامل الإثارة والانبعاثات المستخدمة للكشف عن مختلف البروتينات الفلورية.
- معايرة
ملاحظة: لإنشاء منحنيات المعايرة في خطوة 4.6.1، قيم الكثافة الأسفار من الانقسام--أو شطف-المخزن المؤقت-حل حاجة ركائز المنقي بتركيزات مختلفة قياس.- تنقية ركائز الفلورسنت.
ملاحظة: لتنقية أو سامبس عينات الركازة (ب) فارغة بعد يمكن أن تجمع المقايسة حوزتي سامب جديد تعليق يمكن أيضا إعداد (انظر الفرعين 4.1.1 و 4.1.2).- ضع أنبوب مع سامبس أوقف في 1 مل من الانقسام والمخزن المؤقت (2%-10%؛ v/v) إلى لجنة الاحتكارات والأسعار، وجمع الخرز المغناطيسي عن طريق تحويل لجنة الاحتكارات والأسعار رأسا في كل اتجاه.
- فتح الأنبوب وإزالة المخزن المؤقت الانقسام، وكلاهما من الأنبوب والغطاء.
- إزالة الأنبوب من لجنة الاحتكارات والأسعار، وإضافة 400-600 ميليلتر من شطف المخزن المؤقت إلى سامبس.
- ببطء تدوير الأنبوبة المغلقة مع المدورة في درجة حرارة الغرفة لمدة 5 دقائق.
- ضع الأنبوب إلى لجنة الاحتكارات والأسعار، وجمع الخرز عن طريق تحويل لجنة الاحتكارات والأسعار رأسا.
- إزالة المادة طافية المحتوية على الركازة الفلورسنت سليمة المنقي (النذرة) ونقلها إلى أنبوب ميكروسينتريفوجي منخفضة البروتين-ملزمة جديدة.
ملاحظة: يظهر النذرة fluorescence مرئية بوضوح مع، أو حتى بدون استخدام دربت.
- إجراء الصرف الموازية المخزن المؤقت باستخدام جهازين ultrafiltration 0.5 مل ك 10.
- قياس حجم نصف النذرة استعداد (200-300 ميليلتر) في كل جهاز أولترافيلتراتيون.
- وبعد في كل خطوة الطرد المركزي، تمييع النذرة تتركز في أجهزة ultrafiltration الثاني شطف المخزن والمخزن المؤقت للانقسام، والأول على التوالي.
- بعد الانتعاش، وضبط العينات مركزة حلها في مخازن مختلفة على نفس وحدة التخزين، بين 120-200 ميليلتر.
ملاحظة: الآن محتوى البروتين من الركازة المخزن المؤقت--حل الانقسام متطابقة إلى الركيزة المخزن المؤقت--حل شطف؛ ولذلك، ليس من الضروري تحديد البروتين محتوى واحد الأخير في خطوة 4.5.3، إذا كانت الطريقة المستخدمة لقياس تركيز البروتين يتداخل مع يدتا.
- تحديد محتوى البروتين ركائز حل أما في المخزن المؤقت شطف أو انشقاق عن طريق قياس امتصاص في 280 نانومتر.
ملاحظة: كما يمكن استخدام أساليب أخرى (مثل برادفورد أو بيسينتشونينيك الحمضية (اتفاق التعاون الأساسي) فحوصات) قياس تركيز البروتين، ولكن يلزم التدخل الممكنة مع يدتا (موجودة في المخزن المؤقت شطف) أو امتصاص من الركازة نيون نظرت. محتوى البروتين أولية للحل الركيزة التي يمكن تطبيقها في خطوة 4.5.4 ينصح بما بين 0.4 2.0 مغ/مل من أجل توليد معايرة منحنى في طائفة مناسبة. انظر الجدول 10 معاملات الانقراض.الركيزة الوزن الجزيئي
(دا)معامل الانقراض
(م-1 سم-1، في 280 nm المقاسة في الماء)وقال6-MBP-فسقني * بيفق-mTurquoise2 72101.7 96845 وقال6-MBP-كارفل * أيام-mTurquoise2 72042.7 95355 وقال6-MBP-فسقني * بيفق-مييفب 72367.1 94325 وقال6-MBP-فسقني * بيفق-mApple 72145.9 105200
الجدول 10: الأوزان الجزيئية ومعاملات الانقراض من ركائز البروتين الانصهار الفلورسنت المؤتلف مختلفة. - إعداد إضعاف مسلسل ذات شقين في خطوات ثمانية على الأقل، كل من شطف-ومن الحلول الانقسام--المخزن المؤقت-حل الركازة، استخدام شطف أو الانقسام المخزن المؤقت للتخفيف، على التوالي.
- نقل 30 ميليلتر لكل نقطة تمييع ميكروسكوبية نصف المساحة سوداء.
- قياس الأسفار مع فلوريميتير، استخدام الإعداد تطبيقها في خطوة 4.4.2.
ملاحظة: قياس الأسفار الأساسية الانقسام وشطف المخزن المؤقت.
- تنقية ركائز الفلورسنت.
- التقييم الفحص
- رسم منحنيات المعايرة.
- حساب التركيز (في ملم) من الحلول الركازة النقية (المستخدمة في الخطوة 4.5.4)، استناداً إلى تحديد في الخطوة 4.5.3 محتوى البروتين.
- تصحيح قيم الكثافة النسبية الفلورية (رفو) النقاط تمييع المسلسل بالقيم الأساسية رفو المخزن المؤقت تمييع التطبيقية (المخزن المؤقت الانقسام أو شطف المخزن المؤقت).
- ارسم القيم رفو المصوبة ضد المولى تركز ركائز المنقي الانقسام--أو شطف-المخزن المؤقت-حل وتؤدي انحدار خطي (قوة اعتراض إلى الصفر).
ملاحظة: قيمة2 R (˃0.97) تشير إلى ارتباط خطي جيدة بين الأسفار وتركيز البروتين الفلورسنت. وفي هذه الحالة، يمكن استخدام الميل لخط الانحدار لتقدير تركيز مكونات الإنزيم في نطاق النظر في الخطوات 4.6.2 و 4.6.3. توزيع النقطة الأخطاء والبيانات التجريبية قد يؤثر على موثوقية المعايرة؛ وهكذا، يمكن تنفيذ إجراء تقييم رسومية مع المساعدة من التكبير في الرسوم البيانية (كما هو مبين في الشكل 3)، من أجل التحقق من ما إذا كانت تتأثر بالبيانات R2 وقيم المنحدر.
- حساب كمية المنتج الانقسام الفلورسنت ج-الطرفية في عينات رد فعل.
- تصحيح القيم رفو كل عينة البحث والتطوير مع قيم رفو العينة ب المقابلة.
- حساب تركيز المنتج الانقسام (في مم) في عينات رد فعل بقسمة المصوبة منحنى القيم رفو بمنحدر معايرة الانقسام-المستندة إلى المخزن المؤقت (راجع الخطوة 4.6.1.3).
- حساب تركيز الركازة التطبيقية في عينات رد فعل.
- تصحيح القيم رفو العينة ج مع قيمة رفو المخزن المؤقت شطف الأساسية.
- حساب تركيز الركيزة الوتيد (في مم) في supernatants العينة ج بتقسيم تلك المصوبة منحنى القيم رفو بمنحدر معايرة شطف-المستندة إلى المخزن المؤقت (راجع الخطوة 4.6.1.3).
- تحديد تركيز الركازة (في مم) الحل الأسهم سامب المستخدمة لإنشاء نماذج التحليل في الخطوة 4.1.4.2، استناداً إلى المعادلة التالية:
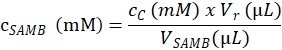
هنا، هو جسامب تركيز مولى الحل الأسهم سامب أعدت في قسم 4.1.3؛ جج هو التركيز المولى للركيزة التيد في العينة ج المحسوبة في الخطوة 4.6.3.3؛ Vr هو حجم الخليط رد فعل تم إنشاؤها بواسطة إضافة رد فعل المخزن المؤقت في الخطوة 4.1.4.5 وإنزيم المخزن المؤقت في خطوة 4.2.3.؛ و الخامسسامب حجم الحل سامب الأسهم في العينة ج (الخطوة 4.1.4.2). - حساب التركيز المولى لركائز في كل عينة البحث والتطوير استناداً إلى التركيز المولى سامب الأسهم الحل (في مم) وفقا للحجم (في ميليلتر) تقاس في كل أنبوبة عينة رد فعل على الخطوة 4.1.4.2.
- القيام بمعالجة البيانات.
ملاحظة: تحليل البيانات يعتمد على الهدف من هذه التجربة. ويظهر شريط الفيديو مثال لتجهيز البيانات لدراسة حركية تعتمد على الركازة على فيروس نقص المناعة البشرية-1 "العلاقات العامة" استخدام له6-MBP-فسقني * الركيزة بيفق-mTurquoise2. وتحسب من عدد شظايا الانقسام الطرفي ج قيم السرعة الأولية ورسم مقابل تركيز الركازة التطبيقية. يتم تحديد معلمات الحركية بتحليل انحدار غير خطية ميكايليس-مينتين.
- رسم منحنيات المعايرة.
- إعادة تدوير الخرز المغناطيسي
ملاحظة: بعد تنفيذ مقايسة، الخرز المغناطيسي [اغروس] يمكن جمعها وإعادة تدويرها.- جمع الخرز المغناطيسية المستخدمة مع لجنة الاحتكارات والأسعار، وتجاهل المادة طافية.
- تغسل الخرز مع 1.8 مل من المخازن المؤقتة التالية، بالترتيب نظراً: تجديد المخزن المؤقت (0.05% 20 توين، 0.5 M هيدروكسيد الصوديوم)، تجديد المخزن المؤقت ب (0.05% 20 توين)، تجديد المخزن المؤقت (0.05% 20 توين، 100 مم يدتا، درجة الحموضة 8)، تجديد المخزن المؤقت ب، تجديد المخزن المؤقت د ( 0.05% 20 توين، 100 ملم نزو4، درجة الحموضة 8)، تجديد المخزن المؤقت ب، وتجديد المخزن المؤقت ه (0.5% 20 توين، 30% إيثانول، الأس الهيدروجيني 7).
ملاحظة: لإجراء الغسيل، راجع الخطوة 4.1.1.4.
- تغسل الخرز مع 1.8 مل من المخازن المؤقتة التالية، بالترتيب نظراً: تجديد المخزن المؤقت (0.05% 20 توين، 0.5 M هيدروكسيد الصوديوم)، تجديد المخزن المؤقت ب (0.05% 20 توين)، تجديد المخزن المؤقت (0.05% 20 توين، 100 مم يدتا، درجة الحموضة 8)، تجديد المخزن المؤقت ب، تجديد المخزن المؤقت د ( 0.05% 20 توين، 100 ملم نزو4، درجة الحموضة 8)، تجديد المخزن المؤقت ب، وتجديد المخزن المؤقت ه (0.5% 20 توين، 30% إيثانول، الأس الهيدروجيني 7).
- تخزين الخرز المعاد تدويرها في تجديد المخزن المؤقت ه في 4 درجات مئوية.
- جمع الخرز المغناطيسية المستخدمة مع لجنة الاحتكارات والأسعار، وتجاهل المادة طافية.
5. تحليل صفحة
-
إعداد نموذج
ملاحظة: بعد إجراء الفحص المغناطيسي على أساس حبة ني-الإدارة الوطنية للسياحة، يمكن أن تحلل supernatants المقايسة بالصفحة. وفي هذه الحالة، تخطي الخطوات 5.1.1 و 5.1.2. ومع ذلك، من الممكن أيضا لتحليل الحل ركائز الفلورسنت المنقي و/أو شظايا الانقسام بعد الهضم بالحل مع حوزتي من الفائدة. في هذه الحالة، يستمر في البروتوكول مع الخطوة 5.1.1.- إعداد حل المنقي الركازة الفلورسنت وفقا للخطوة 4.5.1.
- إجراء الهضم في الحل.
- تبادل شطف المخزن المؤقت مع المخزن المؤقت للانقسام في الجهاز أولترافيلتريشن 0.5 مل 10 ك وقاسمه العينات ليكون هضمها إلى 1.5 مل ميكروسينتريفوجي الأنابيب.
ملاحظة: لتحليل صفحة، ونحن الكوتيد 68 ميليلتر من كل الركازة، ولكن عدد أنابيب العينة وحجم الحل الركيزة لتكون الكوتيد يمكن أن يكون الأمثل وفقا لتصميم التجارب الفردية. - إضافة حل الإنزيم للعينات.
ملاحظة: لتحليل صفحة، طبقنا 2 ميليلتر من فيروس نقص المناعة البشرية-1 "العلاقات العامة"، أعدت كما وصفها14من Bozóki et al.، ولكن يمكن تحسين الحجم وفقا لتصميم التجارب الفردية. من المستحسن استخدام المخزن المؤقت للانقسام إلى حل و/أو تمييع الإنزيم. - احتضان هذه العينات وفقا للتصميم التجريبي.
ملاحظة: لتحليل صفحة، نحن المحتضنة الخليط رد فعل لمدة 45 دقيقة في 37 درجة مئوية، ولكن فترة الحضانة ودرجة الحرارة تحتاج إلى تعيين وفقا للتصميم التجريبي. - إنهاء رد فعل عن طريق إجراء خطوة 5.1.3.
- تبادل شطف المخزن المؤقت مع المخزن المؤقت للانقسام في الجهاز أولترافيلتريشن 0.5 مل 10 ك وقاسمه العينات ليكون هضمها إلى 1.5 مل ميكروسينتريفوجي الأنابيب.
- إعداد النموذج للصفحة.
ملاحظة: قد تكون مستعدة العينات المحتوية على الركازة الفلورسنت للصفحة نونديناتورينج أو بواسطة أسلوب يشوه. لاستخدام نونديناتورينج أو يشوه شروط، اتبع الخطوة 5.1.3.1 أو 5.1.3.2، على التوالي.- إعداد عينة نونديناتوريد: مزيج 30 ميليلتر من العينة مع ميليلتر 6 من 6 × نونديناتورينج عينة-تحميل المخزن المؤقت (300 ملم تريس، والغليسيرول 20%, 0.05% بروموفينول الأزرق، الأس الهيدروجيني 6.8).
- إعداد عينة التشويه والتحريف: مزيج 30 ميليلتر من العينة مع ميليلتر 6 من 6 × يشوه عينة-تحميل المخزن المؤقت (300 تريس، والغليسيرول 20%, 0.05% 100 مم بروموفينول الأزرق، 12% الحزب الديمقراطي الصربي، β-mercaptoethanol, الأس الهيدروجيني 6.8 ملم)، والحرارة في العينات من 95 درجة مئوية لمدة 10 دقائق.
-
تحليل الحزب الديمقراطي الصربي صفحة
ملاحظة: بشكل اختياري، إذا فقط نونديناتوريد (أعد الخطوة 5.1.3.1) عينات تحليلها، صفحة أصلية يمكن أيضا إجراء. وفي هذه الحالة، تخطي القسم 5.3.- إعداد الحزب الديمقراطي الصربي-polyacrylamide هلام (جل التراص استخدام فصل 14 في المائة و 4 في المائة) وملء الخزان بالتفريد المخزن المؤقت (2.5 ملم تريس، 19.2 مم جليكاين، الحزب الديمقراطي الصربي 0.01 ٪).
- إضافة العينات (أعد الخطوة 5.1.3.1 أو 5.1.3.2) إلى الآبار من جل polyacrylamide وإجراء التفريد في 120 V الجهد.
- إزالة كاسيت جل من وحدة التشغيل ووضع الجل في خزان غسيل.
ملاحظة: عينات نونديناتوريد مرئية بالفعل في الهلام، حتى بالعين المجردة أو دربت.
-
ريناتوراتيون في جل والكشف عن البروتينات الفلورية
ملاحظة: لكشف البروتينات الفلورية في عينات التشويه والتحريف (أعد الخطوة 5.1.3.2) على دربت، يحتاج الحزب الديمقراطي الصربي إلى أن تغسل من الجل، بشكل جزئي ريناتوري البروتينات.- إضافة ~ 100 مل ماء المقطر للجل وشطف الجل على الأقل لمدة 30 دقيقة.
ملاحظة: لتحسين إزالة مخزونات النشر الاستراتيجي، استبدال الماء كل 10 دقائق، أو شطف يصل إلى 60 دقيقة. - تصور البروتينات الفلورية باستخدام دربت، أو بالتصوير بالأشعة فوق البنفسجية.
- إضافة ~ 100 مل ماء المقطر للجل وشطف الجل على الأقل لمدة 30 دقيقة.
-
أخذ التقليدية تلطيخ الهلام
- وصمة عار الهلام مع صبغ "أخذ الأزرق الرائعة" أن تصور البروتينات نونفلوريسسينت.
النتائج
الشكل 1A يظهر بنية تخطيطية من الركازة الممثل البروتين المؤتلف الفلورسنت التي يمكن معالجتها بواسطة فيروس نقص المناعة البشرية-1 "العلاقات العامة" في تسلسل الموقع الانقسام محددة لها. ويمثل الشكل 1B إنتاج الركازة وتطبيقاتها الممكنة في حوزتي معبراً، بما في ذلك الفحص المغناطيسي على أساس حبة ني-الإدارة الوطنية للسياحة و/أو صفحة.
للحصول على بيانات موثوق بها عن طريق فلوريميتري، مطلوب إجراء معايرة، بغية تحديد كميات ركائز الفلورسنت ومنتجات الانقسام. لذلك، بحاجة إلى قياس قيم الكثافة الأسفار من ركائز مختلفة في ظروف مختلفة من المخزن المؤقت وتحتاج إلى أن تكون مرتبطة ارتباطاً تركزاتها في نطاق تركيز جزيئي (الشكل 3). يمكن تطبيق القيم المنحدر من منحنيات المعايرة لتحديد المبالغ من ركائز ومنتجات الانقسام في عينات الفحص. على منحدرات منحنيات المعايرة مستقلة تسلسل الموقع الانقسام وإدراجها في ركائز (الجدول 11) ويمكن أن تستخدم لإجراء سلسلة من ركائز تنصهر إلى نفس النوع من البروتين الفلورسنت. يتم عرض التكبير في الرسوم البيانية لجميع الانحدارية الخطية، توسيع نطاقات تركيز أقل، وكذلك (الشكل 3). من المهم ملاحظة أن المعايرة تحتاج إلى إجراء بعناية لأن توزيع سليم لنقاط البيانات المطلوبة لمعايرة موثوقة. لهذا السبب، يتم تطبيق تمييع التسلسلية ذات شقين لإعداد العينات للمعايرة، نظراً لأن قيمة2 R يشير إلى علاقة جيدة بين تركيز البروتين الفلورسنت والأسفار إلا إذا كان عدد كاف من نقاط البيانات وقد استخدمت لتغطية نطاق التركيز الكامل. وعلاوة على ذلك، عاليا على أخطاء تجريبية يمكن أن يؤثر على دقة المعايرة؛ وهكذا، إجراء تقييم رسومية خطوط الانحدار قد يلزم أيضا.
يمكن أن يؤديها مجموعة من القياسات الانزيمية المقايسة مبطلات، بما في ذلك دراسة تأثير تركيز الركازة على سرعة رد الفعل (الشكل 4 أ). بالانحدار غير الخطية، يمكن استخدام البيانات لتحديد معلمات الحركية إنزيم (مثلاً، و الخامسماكس كم). وقف حبة غير كافية والتشتت وإنهاء رد فعل غير مناسب قد يسبب نتائج دون المستوى الأمثل (الشكل 4 باء)، التي ليست مناسبة لحساب القيم الحركية إنزيم موثوق بها.
يمكن تحديد تبعية لتشكيل المنتج في الوقت المحدد بواسطة الإنزيم (الشكل 5A) (مثلاً، من خلال الاستفادة المثلى المعلمات رد فعل الانقسام). يمكن أيضا أن يكون نشاط إنزيم حضور المانع التحقيق (الشكل 5B) لتحديد تركيز إنزيم نشط وثابت المثبطة. باستخدام نفس المنهجية، آثار مثبطات أخرى يمكن أيضا يكون صاحبها المقايسة.
والرزن حوزتي مفيد عند التحقيق في آثار الأس الهيدروجيني على نشاط الإنزيم، كذلك. ويمثل الشكل 6A اعتماد نشاط إنزيم على درجة الحموضة بمثال العلاقات العامة TEV، الذي يبلغ مداه الأس الهيدروجيني أمثل على نطاق واسع (pH 6-9). إذا كان هو درس الاعتماد على درجة الحموضة من نشاط إنزيم (أو الإنزيمات بعد أمثل الأس الهيدروجيني حمضية حاجة إلى قياس)، من الضروري أن نعتبر أن ملزمة تقارب من ركائز المؤتلف الخرز قد تكون مقيدة في الأس الهيدروجيني الحمضية قليلاً. قد يؤدي تفكك مرتفعة من ركائز من الخرز (الشكل 6B) تشويها لنتائج الفحص. من أجل النظر في الانفصال الركازة عفوية من الخرز، القيم المقاسة لعينات رد فعل بحاجة إلى تصويب تلك العينات ب.
يبين الشكل 7 أن البروتينات الفلورية نونديناتوريد يمكن أن تكون متباينة في جل استناداً إلى ألوانها، استخدام تضوء الضوء الأزرق (الشكل 7 أ). إذا كان من الضروري تحديد الأوزان الجزيئية الشظايا ركائز/الانقسام، يشوه ظروف يمكن أيضا استخدام إعداد عينة، لأنه يمكن أن يكون جزئيا ريناتوريد في الهلام البروتينات الفلورية، ويمكن الكشف عنها بواسطة الأشعة فوق البنفسجية الإضاءة (الشكل 7) أو عن طريق أخذ تلطيخ (الشكل 7). المنتجات الانقسام ج--المحطة الطرفية فقط إذا كان يتم تحليل عينات البحث والتطوير، هي مرئية (الشكل 7)، بينما لا تزال متمسكة بالخرز شظايا الانقسام الطرفي ن وركائز أونكليفيد. في بعض الأحيان، البروتينات قد تكون جزئيا التشويه والتحريف على الرغم من استخدام الشروط نونديناتورينج (الشكل 7)، وفي حين أكثر وفرة البروتينات نونديناتوريد، أشكال التشويه والتحريف أيضا قابلة للكشف في العينة. هذه الظاهرة لا تؤثر على الكشف عن انشقاق proteolytic ولكنه يحتاج إلى النظر في حالة قياس كثافة كمية العينات نونديناتوريد.
على الرغم من أن يتم إظهار الوصف التفصيلي فقط مقايسة 2 مل-المستندة إلى أنبوب، التحليل يمكن تكييفها لنظام المستندة إلى لوحة 96-جيدا (الشكل 8)، الذي سبق تم اختبارها بنجاح في المختبر (غير معروضة). تنسيق لوحة تكييف 96-جيدا متوافقة تماما مع فلوريميتريك وتحليلات الغرواني الكهربي، كذلك، والبيانات التي تم الحصول عليها يمكن أيضا تقييم يستند إلى الأساليب الموصوفة في هذه الورقة.
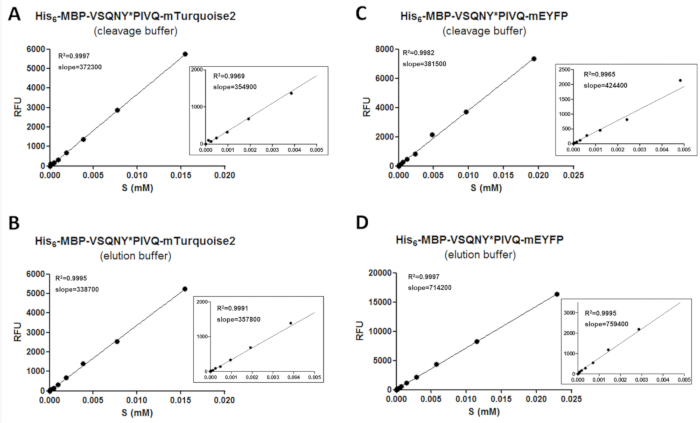
الشكل 3 : منحنيات المعايرة. أظهر منحنيات المعايرة الركازة الممثل مع مثال اثنين من ركائز المؤتلف تنصهر فيها مختلف العلامات الفلورية ج-الطرفية: (A و B) له6-MBP-فسقني * بيفق-mTurquoise2 و (C و د ) له6-MBP-فسقني * بيفق-مييفب. التكبير في الأرقام كما تظهر لتمثيل الانحدار الخطي من نقاط البيانات في 0-0.005 مم الركازة نطاق التركيز. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
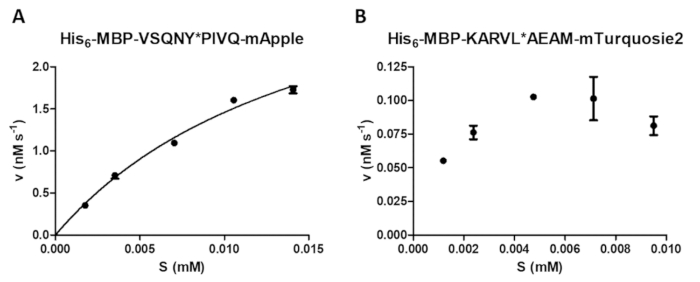
الشكل 4 : تحديد معلمات الحركية الإنزيم. وأجريت قياسات الحركية تعتمد على الركيزة بفيروس نقص المناعة البشرية-1 "العلاقات العامة" (بتركيز نشط نهائي 41.2 nM). قيم السرعة الأولية كانت تآمرت ضد تركيز الركازة، وتم إجراء تحليل انحدار غير خطية ميكايليس-مينتين. أشرطة الخطأ تمثل SD (n = 2). يتم عرض النتيجة المثلى الممثل (A) A مع مثال له6-MBP-فسقني * mApple بيفق الانصهار البروتين الركازة. كما يتم عرض النتيجة الأمثل الممثل (ب) له6-MBP-كارفل * الركيزة أيام-mTurquoise2، حيث كان الإعداد لتركيزات الركيزة الصحيحة إشكالية بسبب تجانس غير كافية لحل الأسهم سامب ، بينما كان سببها أخطاء عالية نسبيا إنهاء رد فعل غير مناسب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
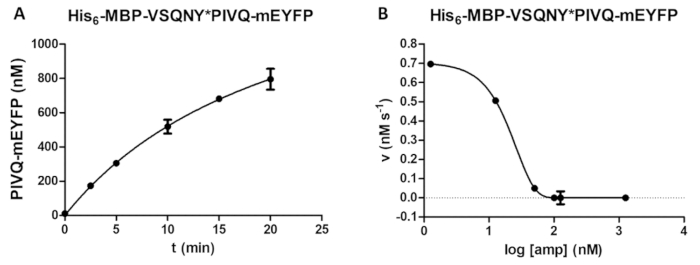
الشكل 5 : دراسة دورة الوقت والمثبطة. (A) وقال 6-MBP-فسقني * بيفق-مييفب كان المشقوق الانصهار المؤتلف البروتين الركازة (بتركيز نهائي مم 0.00326) بفيروس نقص المناعة البشرية-1 "العلاقات العامة" (بتركيز نشط نهائي 41.2 nM)، وتم قياس الإفراج عن فلوري بيفق-مييفب proteolytic الشظايا إلى إجراء تحليل للوقت بالطبع. وأجريت القياسات في خمس نقاط زمنية مختلفة. أشرطة الخطأ تمثل SD (n = 2). (ب) له6-MBP-فسقني * مييفب بيفق كالركيزة (في 0.0015 ملم) لتحديد تأثير المثبطة أمبرينافير على نشاط "العلاقات العامة" فيروس نقص المناعة البشرية-1 (بمجموع تركيز 163.8 nM). بالتآمر ويمكن تقييم البيانات، نصف تركيز المثبطة القصوى (IC50) وتركيز نشاط إنزيم (تركيز نشط نهائي من 41.2 nM) لفيروس نقص المناعة البشرية-1 "العلاقات العامة" التطبيقية يمكن أيضا حساب استناداً إلى تثبيط المنحنى. أشرطة الخطأ تمثل SD (n = 3). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
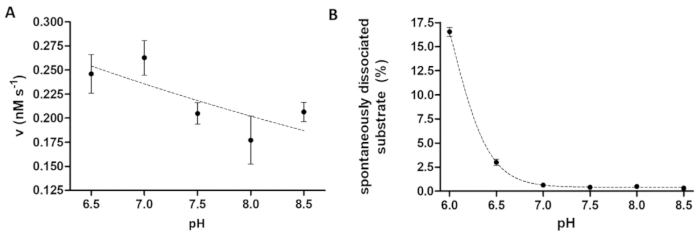
الرقم 6 : دراسة الاعتماد على نشاط إنزيم والانفصال الركازة العفوية على الأستاذ (A) له6-MBP-فسقني * الركيزة بيفق-mTurquoise2 (في 0.033 مم) استخدمت لقياس نشاط الإنزيم TEV العلاقات العامة (بتركيز مجموع نهائي 91.42 nM) في المخزن المؤقت للانقسام وتعيين الرقم الهيدروجيني مختلفة، بين المجموعة من 6.5-8.5. أشرطة الخطأ تمثل SD (n = 2). البيانات المرسومة قد سبق نشرة14. (ب) استناداً إلى قيم الكثافة النسبية الفلورسنت عينات فارغة الركازة، تفارق عفوية له6-MBP-فسقني * درس الركيزة بيفق-mTurquoise2 (0.033 مم) من الخرز المغناطيسي باستخدام المخزن المؤقت للانقسام مع pH مختلفة، بين 6.0 8.5. البيانات المرسومة قد سبق نشرة14. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
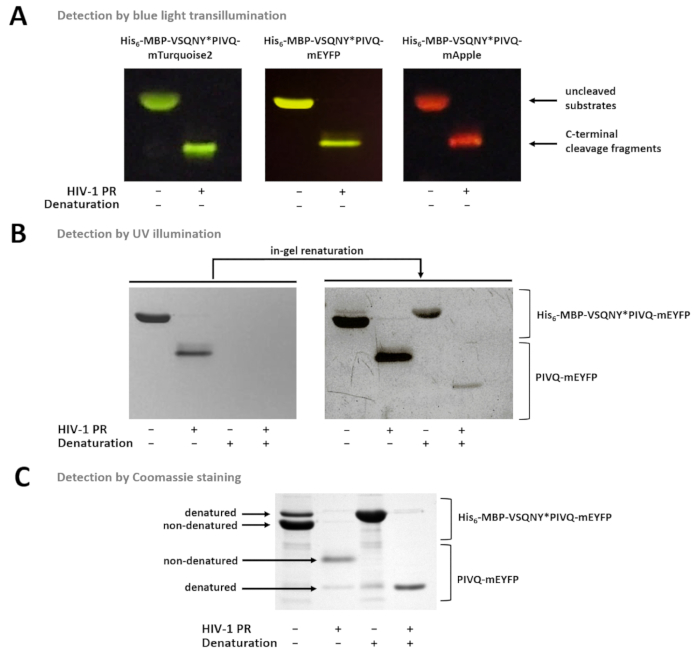
الشكل 7 : الكشف عن البروتينات في الهلام بطرق مختلفة- أونكليفيد (A)، وكانت تصور ركائز البروتين يهضم فيروس نقص المناعة البشرية-1 "العلاقات العامة" الانصهار بعد إعداد عينة نونديناتورينج بالأزرق تضوء الخفيفة بعد الحزب الديمقراطي الصربي صفحة. وكان يؤديها رد فعل الانقسام والهضم بالحل. (ب) مباشرة بعد الصفحة، البروتينات نونديناتوريد فقط يمكن يمكن اكتشافها في الجل بإضاءة الأشعة فوق البنفسجية، بينما بعد إزالة مخزونات النشر الاستراتيجي، البروتينات الفلورية التشويه والتحريف سابقا أصبحت جزئيا ريناتوريد وقابلة للاكتشاف. جرى إعداد العينات من سوبيرناتانتس الفحص المغناطيسي على أساس حبة ني-الإدارة الوطنية للسياحة. (ج) أخذ تلطيخ يمكن أن تستخدم أيضا للكشف عن البروتين، وبعد ريناتوريشن في جل. الحزب الديمقراطي الصربي-موجودة في جل-قد تسبب تمسخ الجزئي للبروتين الأصلي، ولكن في العينات الأصلية، وأشكال نونديناتوريد أكثر وفرة. جرى إعداد العينات من سوبيرناتانتس الفحص المغناطيسي على أساس حبة ني-الإدارة الوطنية للسياحة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 8 : 96-جيدا المستندة إلى لوحة تكييف منهاج المقايسة. (أ) التحليل يمكن أن يؤديها ليس فقط في أنابيب 2 مل ولكن في آبار لوحة 96-جيدا، وكذلك. هنا نعرض التمثيل التخطيطي لتطبيق الفحص دراسة خصوصية حوزتي وهمية باستخدام سلسلة من ركائز نيون، التي قد تحتوي على البرية من نوع (wt) أو المتحولة (موت-1 إلى موت-4) تسلسل الموقع الانقسام. للتعامل مع الخرز المغناطيسي، مركز جسيمات مغناطيسية متوافقة 96-جيدا (MPC) لاستخدامها في التجارب. كافة وحدات التخزين المشار إليها تتعلق ببئر واحدة. لمقارنة كفاءة الانقسام ركائز مختلفة، يمكن تقييم تحويل الركازة من النسبة المئوية للركيزة-فارغة-تصحيح رفو القيم العينات رد فعل، النظر في القيم رفو الركيزة-فارغة-تصحيح ذات الصلة الركيزة عينات مراقبة 100. (ب) بعد فلوريميتري، supernatants المنفصلين عن ذويهم من التحليل يمكن أيضا أن تحلل عينات من الصفحة، ومكونات البروتين الفلورسنت يمكن تحليلها مباشرة أو بعد-جيل ريناتوراتيون في حالة نونديناتورينج ويشوه عينة إعداد، على التوالي. ثلاثة أنواع مختلفة بالانزيم عينة تتجلى أيضا في كل شخصية: ج = التحكم الركازة، ب = الركازة فارغة، والبحث والتطوير = رد فعل. عينات مراقبة الركيزة في المخزن المؤقت شطف، بينما الركيزة فارغة وعينات رد فعل في المخزن المؤقت للانقسام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| المخزن المؤقت | بروتين فلوري | CV % من المنحدرات (%) |
| شطف | mTurquoise2 | 6.04 |
| الانقسام | 9.11 | |
| شطف | mApple | 10.92 |
| الانقسام | 12.68 |
الجدول 11: معامل التباين (CV %) قيم المنحدرات من منحنيات المعايرة الركيزة. لاختبار ما إذا كانت الأسفار ركائز البروتين المؤتلف تعتمد على الموقع المدرج الانقسام، معايرات أجريت سلسلة من ركائز تنصهر فيها mApple و mTurquoise2 (ستة متغيرات لكل منهما، يتضمن الموقع الانقسام مختلفة تسلسل مبطلات فيروس نقص المناعة البشرية-1)، سواء في المخازن المؤقتة شطف والانقسام. وجدنا أن CV % قيم المنحدرات هي تحت 15% في جميع الحالات، مما يعني ضمناً أن معايرة الركازة واحدة يمكن أن تستخدم لتقييم القياسات المختلفة التي يؤديها الركازة المتغيرات التي تحتوي على علامة نيون نفسها.
Discussion
بسبب التحقيقات المكثفة الصناعية والأكاديمية للإنزيمات بروتيوليتيك والطلب المستمر على منصات المقايسة حوزتي المتوافقة مع HTS سريعة وبأسعار معقولة تبعاً لذلك، قمنا بتطوير حوزتي فلورسنت المستندة إلى حبة المغناطيسي المقايسة. التحليل يستند إلى استخدام الانصهار المؤتلف البروتينات التي يمكن أن تكون بدائل مبتكرة لركائز الببتيد الاصطناعية تستخدم على نطاق واسع.
في تنسيق التحليل المتقدمة، هي معطلة ركائز البروتين الانصهار إلى أسطح حبات شيﻻت المغلفة ني [اغروس] مغنطيسية. المرفق الركازة توفرها N--المحطة الطرفية له علامة تقارب6 من البروتين الانصهار، الذي هو تنصهر فيها مباشرة إلى علامة MBP بغية تيسير قابلة للطي وتحسين قابلية الذوبان في الماء من الركازة13. MBP متبوعاً حوزتي من الفائدة ومواقع الانقسام TEV العلاقات العامة. السابقة قد تخدم كموقع انقسام وتحكم في الفحص، بينما هذا الأخير يمكن معالجته بواسطة مبطلات التحقيق. موقع الانقسام وقابلة للتبادل؛ يمكن إدراج تسلسل دسدنا قصيرة الترميز لموقع الانقسام من الفائدة في مرنة 'كاسيت الاستنساخ' من بلازميد التعبير بربط. تحتوي على بروتينات الانصهار المؤتلف علامة البروتينات فلورية العالية مستقرة وأحادي في ج-المحطة، التي تمكن من كشف نقطة نهاية الانقسام ج-الطرفية إنزيم المحررة، فلورسنت المنتجات الإفراج عنها عند الانقسام بروتيوليتيك ( الشكل 1A). ركائز سليمة الفلورسنت المنقي حلها في مخازن مختلفة تستخدم أيضا للمعايرة لتقييم تركيزات المولى من ركائز ومنتجات الانقسام. وبالإضافة إلى ذلك، بعد فلوريميتري، مكونات الإنزيم يمكن تحليلها بالحزب الديمقراطي الصربي صفحة، كذلك. كلا أصلي (نونديناتوريد) والبروتينات الفلورية التشويه والتحريف يمكن تصور في الهلام، مباشرة بعد التفريد أو بعد اللاحقة في جل ريناتوريشن، على التوالي. هذا إضافية في الإجراء مع تقليدية "أخذ الأزرق الرائعة" تلطيخ-قد يكون يمكن استخدام التركيبة كفاءة لتحقق نتائج الفحص (الشكل 1B).
إجراء المقايسة يتكون من خطوات بسيطة وسهلة لتنفيذ في تنسيق صغيرة الحجم التي قد تكون مناسبة تماما لبيئة تلقائي الفائق. ومع ذلك، بشكل مستقل من القيام التحليل أما يدوياً أو باستخدام نظام التشغيل الآلي للمكاتب، الأجزاء التالية من الفحص تعتبر أمرا حاسما، وتحتاج إلى عناية خاصة أثناء تنفيذ الإجراء. ط) التجانس الحل حبة المغناطيسي. يجب أن تستخدم حلاً حبة مغناطيسية متجانساً في جميع أنحاء المقايسة، سواء في تنقية وغسل الخطوات. خاصة، بقوة موثوقية فحوصات حوزتي يعتمد على اليقوتينج بشكل صحيح الحلول الأسهم المرفقة بالركيزة حبة المغناطيسي (سامب). من أجل زيادة فعالية تعليق والتشتت، يوصي بتعيين تركيز حبة بين 2% و 10% (v/v). أثناء إعداد نموذج، الاستخدام المخازن المؤقتة وتستكمل مع المنظفات النطاق (مثل X-100 تريتون أو 20 توين) يصل إلى 2% قد ينخفض أيضا انضمام الخرز المغناطيسية على الأسطح البلاستيكية. يمكن تجنبها من الخرز التمسك بجدران قنينات العينات إذا طبقت المعلقات حبة بعناية لقيعان قنينة بدلاً من على جدران أنابيب العينة. تجانس الخرز المغناطيسي أثناء عملية التفاعل الأنزيمي أمر بالغ الأهمية أيضا، ويمكن ضمان استمرار اهتزاز العينات 600 لفة في الدقيقة أثناء الحضانة. حبات متناثرة بشكل صحيح في تقريب أو مغلوطاً والمنتجات البلاستيكية، بينما لا ينصح باستخدام قارورة الخامس-السفلي. يمثل نتيجة الأمثل الناجمة عن حبة غير لائق التجانس في الشكل 4B. ثانيا) إنهاء عينات رد فعل. وهناك ميزة أخرى للأسلوب أن رد الفعل الأنزيمي يمكن أن تنتهي دون استخدام المعالجة الحرارية تمسخ أو أي عوامل كيميائية يحتمل أن تدخل15. يمكن أن يتم الإنهاء ببساطة عن طريق فصل الخرز المغناطيسي من رد فعل المخلوط باستخدام مركز جسيمات مغناطيسية تقليدية. بينما يحتوي المخزن المؤقت إزالة رد فعل الإنزيم النشط والمنتجات الانقسام الفلورسنت ج--المحطة الطرفية التي تم إنشاؤها، ركائز أونكليفيد لا تزال تعلق الخرز. نظراً لوجود إنزيم نشط في المخزن المؤقت لرد الفعل، يحتاج الإجراء الفاصل الذي سيتم تنفيذه بعناية للكشف عن نقطة النهاية موثوق بها. قبل وضع قنينات العينات إلى مركزات، يوصي بأن تطبق الطرد المركزي تدور قصيرة. بعد وضع الأنابيب في مركزات، توفر على الأقل 15 ثانية الخرز التي سيتم جمعها. قد تسهل حركة طفيفة في الفاصل ذهابا وإيابا جمع الخرز. يرجى النظر، أثناء فصل يدوياً المؤداة، الإنهاء عادة ما يستغرق وقتاً أطول من الشروع في ردود الفعل. ولذلك ينصح تأخير حوالي 2 دقيقة مسجلة بين المبدئية إذا نفس الوقت الحضانة يجب أن تطبق على جميع العينات.
مبدأ المقايسة proteolytic وصف بسيط نسبيا؛ ومع ذلك، براعة النظام مكفول بموجب هيكل الركازة مرنة ومستقرة. قد تكون محدودة الأمثل المقايسة الفردية إلا بتوافق الخرز تقارب مع الشروط المطبقة، الكواشف والمواد المضافة. الاتفاق مع البروتوكول الشركة المصنعة على، كما وجدنا أن ملزمة تقارب من ركائز للسطوح حبة ني-جاتا يضعف إلى حد كبير على درجة الحموضة ≤ 6.515. لذلك، من المستحسن تطبيق الركازة عينات فارغة موازية للعينات رد فعل، ويتطلب معدل تفكك الركازة العفوية التي سينظر فيها خلال تقييم النتائج.
في تلك الحالات، حيث لا يمكن إجراء فحوصات المستندة إلى حبة المغناطيسي بسبب استخدام مكونات حبة-متوافق أو درجة حموضة منخفضة، يمكن أيضا تطبيق الهضم في حل من ركائز المؤتلف المنقي. وفي هذه الحالات، يمكن تحليل الخلائط رد فعل بالتفريد، ويمكن تصور البروتينات في جل استناداً إلى البروتوكول بوصفه. للتحقيق في نشاط proteolytic، الهضم في الحل والكشف في جل من البروتينات قد يكون أيضا أدوات بديلة من فلوريميتري. بدعة نظام الركيزة مصممة هو تطبيق خطوة ريناتوريشن في جل بعد يشوه صفحة الحزب الديمقراطي الصربي. بينما البروتينات الفلورية (نونديناتوريد) الأصلية الاحتفاظ بهم الأسفار أثناء التفريد، هو إلغاء الملكية الفلورسنت عند تمسخ (الشكل 7). ومع ذلك، يمكن استرداد الأسفار البروتينات التشويه والتحريف جزئيا بإزالة مخزونات النشر الاستراتيجي من الجل. وهكذا، يجعل فصل بين مكونات رد الفعل باستخدام شروط يشوه القائم على الأسفار، بل تحديد أساس الوزن الجزيئي ممكن. ميزة أخرى للكشف في جل الفلورسنت مقارنة لتحليل هلام الملطخة بأخذ أن البروتينات الفلورية (أصلية أو ريناتوريد) يمكن تحديدها بسهولة في جل استناداً إلى هذه الأسفار (انظر الشكل 7). قد يكون هذا مهم إذا كان يتم تنفيذ الانقسام وردود الفعل في العينات المحتوية على ملوثات نونفلوريسسينت أو بروتينات عالية تشبه الأوزان الجزيئية لبعضها البعض.
فحوصات حوزتي استخدام ركائز مصممة على نحو مماثل قد تم بالفعل سبق نشرة9،،من810، وعلى الرغم من أن الموقع الانقسام والاهتمام بالحالات التي كانت تقع بين علامة تقارب أيضا الفلورسنت البروتين، منظومة التحليل المقدم هنا ليس فقط تكرار الأفكار التي توصف ولكن يجمع بين مزايا مختلفة من المنصات السابقة وأيضا يكمل لهم مع إدخال مزيد من التحسينات: ط) الاستفادة من شريك الانصهار MBP، ثانيا) وجود العلاقات العامة TEV التحكم الانقسام وموقع، ثالثا) استخدام FPs أحادي هندسيا حديثا، ورابعاً) تطبيق إجراء المعايرة الركازة فريدة من نوعها. المقايسة نفسها خاصة صممت لتكون مفيدة لأنزيم خصوصية والدراسات الحركية في آمنة وطريقة فعالة من حيث الوقت والتكاليف، دون الحاجة إلى أجهزة باهظة الثمن. الأسلوب الذي يهدف إلى أن يكون أداة ملائمة وميسورة التكلفة لأغراض البحوث الصناعية والأكاديمية على حد سواء. نظراً لمرونة الكاسيت 'الاستنساخ' من بلازميد التعبير، قد يكون النظام مناسب لتوليد سريعة وغير مكلفة لمكتبات الركازة المؤتلف. الفحص الموصوفة هنا أداة مجدية لتنفيذ الركيزة خصوصية، إنزيم الطفرات، وتثبيط الدراسات وأيضا، أن توفر أداة بديلة لأداء حركية إنزيم. منصة الفحص (من اضطراب الخلايا البكتيرية في تحديد معالم الحركية) يمكن أن تتكيف مع بيئة المستندة إلى HTS والتشغيل الآلي للمكاتب، ويحتمل أن تكون، قد تطبق في فحص مثبطات البروتياز الصناعية و/أو العقاقير المضادة للفيروسات التنمية. وباﻹضافة إلى ذلك، تكييف المقايسة ل proteolysis التنافسية أيضا في المستقبل نطاق المختبر. في هذه مقايسة تنافسية، اثنين مختلفة كل ركائز المحتوية على موقع انقسام مختلفة تنصهر فيها مختلفة ج-طرفية فلورسنت علامة-هي يقصد بها لاستخدامها في وقت واحد في نفس الانقسام ورد الفعل للتحقيق في تفضيل درس إنزيم لمتواليات هدف معين. وعلاوة على ذلك، استخدام نموذج المقايسة تكييف لوحة 96-جيدا (الشكل 8) هو أيضا يجري الأمثل لفحص الطفرات باستخدام سلسلة من ركائز مع الانقسام وتعديل تسلسل الموقع في حالة البروتياز سيستين.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا العمل كان يدعمها المشروع "فريق فارمبروت" جنوب-2-3-2-15-2016-00044 جزئيا، وأيضا، بتمويل من "برنامج التميز المؤسسي في التعليم العالي" من الوزارة من القدرات البشرية في هنغاريا، في إطار برنامج التكنولوجيا الحيوية المواضيعية من جامعة ديبريسين. الكتاب ممتنون للأعضاء في "مختبر الكيمياء للفيروسات الرجعية" للمساعدة العلمية أثناء وضع المقايسة وأيضا على صبرهم خلال تصوير الفحص (خاصة على نوربرت كاساي، "كريستينا" Joóné Matúz وتولدي فاندا، منظمة الصحة العالمية هي التي تظهر في خلفية الفيديو). الكتاب أيضا أود أن أقول الخاص بفضل جيديون ريختر Plc.، لا سيما أن الدكتور زولتان Urbányi للسماح بعمل Beáta Bozóki في قسم الكيمياء الحيوية والبيولوجيا الجزيئية كباحث ضيف. الكتاب تود أيضا أن يمدد امتنانهم جيورجي Zsadányi، Tőgyi بلازس، Pöstényi بلازس و Király زولتان من الوسائط المتعددة ومركز التعلم التقني لجامعة ديبريسين للمساعدة الفنية في الصوت والفيديو الإنتاج.
Materials
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
References
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved