Method Article
השימוש פיוז'ן רקומביננטי חלבונים פלטפורמה Assay פרוטאז פלורסנט, Renaturation שלהם בג'ל
In This Article
Summary
כאן, אנו מציגים את ההליך מפורט של פלטפורמה assay פרוטאז שפותחו לאחרונה ניצול N-מסוף hexahistidine/מלטוז-מחייב חלבון ותערובות פלורסנט התמזגו חלבון רקומביננטי המחובר למשטח של ניקל-nitrilotriacetic חומצה agarose מגנטי חרוזים. גם מוצג ניתוח בג'ל עוקבות של הדגימות assay המופרדות על-ידי נתרן גופרתי-לזיהוי dodecyl בג'ל.
Abstract
פרוטאזות הם אנזימים למד באופן אינטנסיבי בשל התפקידים החיוניים שלהם מספר מסלולים ביולוגיים של אורגניזמים חיים, פתוגנזה; לכן, הם מטרות תרופה חשובה. פיתחנו פלטפורמה מגנטי agarose חרוז-מבוססת על שיטת החקירה של פעילות הפרוטאוליטי, אשר מבוססת על השימוש של סובסטרטים חלבון רקומביננטי פיוז'ן. כדי להדגים את השימוש במערכת זו assay, פרוטוקול מוצג על הדוגמה של סוג וירוס הכשל החיסוני האנושי (HIV-1) 1 פרוטאז. פלטפורמת assay הציג יכול להיות מנוצל ביעילות איפיון ביוכימי של פרוטאזות, כולל מדידות פעילות האנזים מוטגנזה מכוונת, קינטי, עיכוב או ירידה לפרטים מחקרים, והוא עשוי להיות מתאים עבור תפוקה גבוהה המצע הקרנה או שעשוי להיות מותאם אנזימים הפרוטאוליטי אחרים.
במערכת זו assay, סובסטרטים יישומית מכילה N-מסוף hexahistidine (שלו6) ותגים חלבון (MBP) מחייב מלטוז, המחשוף אתרים בחברת טבק לחרוט וירוס (אס), HIV-1 פרוטאזות חלבון פלואורסצנטי C-מסוף. מצעים יכול להיות מיוצר ביעילות בתאים Escherichia coli וטיהרו בקלות באמצעות חרוזים מצופים - chelate - ניקל (Ni). במהלך וזמינותו, מוביל המחשוף הפרוטאוליטי של סובסטרטים צמוד-חרוז שחרורו של שברי ביקוע פלורסנט, אשר נמדד על ידי fluorimetry. בנוסף, ניתן לנתח תגובות ביקוע על ידי נתרן dodecyl סולפט-לזיהוי בג'ל (מרחביות-עמוד). עבור renaturation בג'ל של רכיבים assay פרוטוקול מתוארת גם, כפי renaturation חלקית של חלבונים פלורסנט מאפשרת גילוי שלהם מבוסס על משקל מולקולרי זריחה.
Introduction
אנזימים הפרוטאוליטי שייכים לקבוצות אנזים ובדוקים באופן אינטנסיבי ביותר בשל חשיבותם מסלולים מטבוליים, יישומים תעשייתיים, כמו גם. תפקיד המפתח שלהם מחלות ויראליות, ויסות קרישת, סרטן הדם, הלב וכלי הדם מחלות ניווניות גורם פרוטאזות מטרות הבולטים בתחום גילוי תרופות. לכן, אפיון מפורט היחודיות המצע פרופיל מעכב הפרוטאז (PR) עניין מרכזי ויש רצוי מתבצע על ידי מבחני הביוכימי מהירים, חסכוניים, חזקים1,2, 3.
כיום, הרוב המכריע של מבחני פרוטאז במבחנה מיושם בתחום גילוי סמים עבור יצירת פרופילים מורכבים הן הומוגניות, פלורסנט מבוססת על פפטיד, תפוקה גבוהה ההקרנה (HTS)-פלטפורמות תואם4. יתר על כן, פפטידים שכותרתו אינם מתאימים להקרנה הספרייה בלבד, אך הם גם מציעים כלים נהדרים הקביעה של אנזים פרמטרים קינטי סובסטרטים שנבחרו. במקרים אחרים, שבהם תיוג של המצע אינה אפשרית, מבחני המבוססות עשויה לספק פתרון אפשרי כדי להעריך את מאפייני תגובות הפרוטאוליטי3קינטי.
באופן כללי, מבחני פרוטאז במבחנה מבוססים על השימוש בשני סוגי המצע: קצר פפטידים או כל החלבונים. במקרים אלה, בהם המחשוף של רצפים קצרים פפטיד משקפות את המאפיינים המחשוף מספיק, חלים סטנדרטי לנקוט בגישות הבאות: (א) בחינת סובסטרטים חלבון סטנדרטית כמו אינסולין מחמצנים B-שרשרת, (ii) בדיקות מצעים זמינים מסחרית של פרוטאזות אחרים, (iii) הקרנה ספריות פפטידים סינתטיים ומתויגים fluorescently שנוצר על ידי כימיה קומבינטורית, או (iv) תוך שימוש בשיטות גנטיות, למשל, ביולוגית להציג טכנולוגיות5, 6. מלבד הסיווג קונבנציונאלי, פלטפורמות הרומן אחרות זמינים גם לדור המצע (למשל, היווצרות של ספריות נגזר פרוטאום פפטיד7 או תתי סוגים מיוחדים בשיטות גנטיות, כמו הפיוז'ן רקומביננטי חלבון מבוססת סובסטרטים8,9,10,11,12).
כל סוגי המצע הנ ל מבחני יש יתרונות ומגבלות משלהם, פיתוח פורמטים assay המשלב ו/או לשפר את היתרונות של פלטפורמות מוכרות הוא עדיין ביקוש. כאן נתאר פרוטוקול להצפנה וזמינותו המבוססות פרוטאז פלורסנט, אשר מנצל סובסטרטים רקומביננטי. חלבונים אלה פיוז'ן מורכב שלו6 ו- MBP תגיות התמזגו המחשוף שליטה באתר של אס ציבור, אשר מלווה את רצף המצע עניין המחובר ישירות C-מסוף חלבון פלואורסצנטי (FP) (איור 1 א'). השיבוט של רצף ה-DNA קידוד אתר המחשוף עניין לתוך 'בקלטת שיבוט' יכול להתבצע על ידי תגובת מצדו יחיד לתוך פלסמיד הביטוי, אשר יש כבר לליניארית בעבר על ידי הגבלת endonucleases.
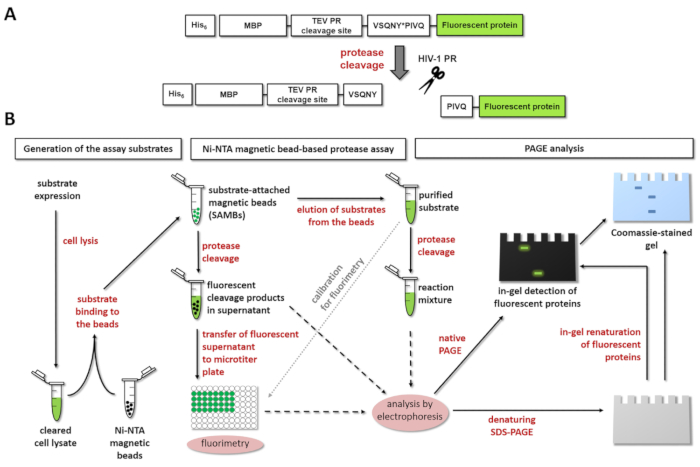
איור 1: עקרון וזמינותו פרוטאז פלורסנט. (א) ייצוג סכמטי של מצע פלורסנט, המחשוף שלה על ידי וירוס הכשל החיסוני האנושי סוג 1 (HIV-1) פרוטאז מוצג. החץ מציין את מיקום המחשוף בתוך הרצף באתר מטריקס/capsid המחשוף של פרוטאז HIV-1 (VSQNY * PIVQ). (B) פלורסנט סובסטרטים יכול לשמש כדי לנתח אנזים תגובות וזמינותו מגנטית מבוססת על חרוז Ni-נ ועל ידי לזיהוי בג'ל, וכן, כפי שמוצג בדיאגרמה של זרימת העבודה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
אף על פי מבחני הפרוטאוליטי שימוש דומה חלבון רקומביננטי סובסטרטים המכילות תג קירבה אתר הפרוטאוליטי המחשוף, יש חלבון פלואורסצנטי כבר תוארו8,9,10, המערכת הציגו כאן בכוונת לשלב ולשפר על היתרונות של שיטות אלה. הבדל חשוב הוא סובסטרטים חלבון פיוז'ן פלטפורמה זו assay מצוידים MBP מכיל אתר המחשוף הבקרה עבור אס PRs ולשפר מסיסות חלבון13 . יתר על כן, מצעים מכילים חלבונים פלורסנט דור חדש, אשר יציב מאוד, יש טופס monomeric כדי למנוע צבירת המצע. מלבד היישום שפורסמו בעבר mTurquoise2 - ו מאפל-התמזגו טפסים14, כאן אנו גם מראים התוצאות ניתנה על ידי שימוש מצע רקומביננטי המכיל של monomeric משופרת תגית פלורסנט צהובות חלבון פלואורסצנטי (mEYFP). בזאת אנו מדגימים את התאימות של המערכת עם חלבונים אחרים פלורסנט, מייצגים כמה סוגים כלליים של התוצאות ניתן לרכוש באמצעות וזמינותו פרוטאז.
החלבונים פיוז'ן רקומביננטי מבוטאים בתאים BL21(DE3) e. coli ו משמשים סובסטרטים וזמינותו בחומצה ניקל-nitrilotriacetic (Ni-נ)-מצופה מגנטי-agarose-חרוז-מצורף טופס. C-מסוף המחשוף המוצרים הם משוחררת מהמשטח חרוז לתוך תגובת שיקוע על המחשוף ע י פרוטאז עניין. לאחר ההפרדה של תגובת שיקוע (מכיל את האנזים והמוצרים המחשוף) של החרוזים מגנטי, ניתן למדוד את קרינה פלואורסצנטית כדי לקבוע את המאפיינים המחשוף של האנזים. בניגוד השיטות שתוארו, במערכת המובאים כאן, הכמויות של המצע ומוצרים המחשוף C-מסוף הן באופן ייחודי לכמת בהתבסס על הליך הכיול המצע מפורט. מערכת assay ייתמכו על-ידי ניתוח מרחביות-דף של הדגימות assay; פריט חזותי בג'ל פלורסנט הבאים ניתן להחיל מיד לאחר אלקטרופורזה או לאחר את renaturation בג'ל המרכיבים nondenatured, שפגע בסימני פלורסנט, בהתאמה14.
הגמישות ואת המבנה של "בקלטת שיבוט" לאפשר של הכנסה זמן - ו וחסכוניים של מגוון רחב של רצפי לתוך הבונה ומקדמת, לפיכך, הדור של ספריות המצע. מאז כל השלבים assay אוטומציה ו HTS-תואם, המערכת יכולה להיות אטרקטיביים במיוחד, למשל, פרוטאז ירידה לפרטים מדידות, מחקרים מוטגנזה מכוונת, או זה עשוי גם להיות יעיל מנוצל להקרנה מעכב פרוטאז תעשייתי ו/או פיתוח תרופה קוטלת נגיפים, גם כן.
אנזים פרמטרים קינטי (kהחתול, Km) יכול להיקבע על ידי וזמינותו המבוססות מפותחות; לכן, זה עשוי להיות מתאים לביצוע מדידות קינטי אנזים בודדים, כגון המחקרים זמן כמובן תלויי-המצע, עיכוב. זה מוכיח כי סובסטרטים חלבון רקומביננטי פיוז'ן לספק חלופות טובות סובסטרטים שימוש תכוף oligopeptide סינתטי, בשל דמיון גבוהה שלהם מצעים polyprotein, שהם מייצגים את באופן טבעי אנזים-סובסטרט אינטראקציות באופן מדויק יותר.
Protocol
1. דור של פלסמידים ביטוי המצע-קידוד
- Linearize את pDest לו6- MBP-FP ביטוי פלסמיד מאת endonucleases הגבלה פאצי, NheI. לדור של pDest לו6- MBP-FP, ראה Bozóki et al.14.
- להוסיף 1,500-2,000 µg של pDest לו6- MBP-FP ביטוי פלסמיד, 2 µL כל של פאצי, NheI הגבלה endonucleases, µL 10 מאגר x 10 (ראה טבלה של חומרים), ומים ללא נוקלאז (בא ל) כדי µL 100 צינור microcentrifuge.
- דגירה תערובת התגובה ב 37 ° C עבור 1 h.
- להוסיף 20 µL של 6 x דנ א סגול בטעינת צבע לתערובת התגובה ולהפריד את המחשוף המוצרים על ידי אלקטרופורזה, באמצעות ג'ל agarose 1%. להחיל סולם הדנ א 1 kB כסטנדרט.
- לשטוף את ג'ל למשך 15 דקות ב- 20 מ של טה מאגר (40 מ"מ טריס, חומצה אצטית 20 מ מ 1 מ"מ EDTA, pH 8.5) המכיל µL 20 בפתרון SYBR ירוק, לסלק את הלהקה של פלסמיד ליניארית מחוץ הג'ל agarose, בעזרת כלי חד.
הערה: בעת מאירה את הג'ל על-ידי transilluminator כחול כהה-קריאה (DRBT), פלסמיד - MBP-FP ליניארית pDest לו6מופיע בתור להקה דיסקרטית ובהיר -בסביבות 7-8 kB. - לטהר את פלסמיד ביטוי ליניארית של הפרוסה ג'ל באמצעות ערכת חילוץ ג'ל על פי הוראות היצרן.
- הכנס את רצף המצע לתוך פלסמיד הביטוי pDest לו ליניארית6- MBP-FP.
- Anneal פארווערטס (FWD), הפוכה (REV) e. coli הממוטבים codon לנוקלאוטידים קידוד הרצף המצע של עניין.
הערה: תחל annealed יותקף בקצותיה מלוכדת המתאים פאצי NheI endonuclease הגבלת המחשוף ואתרים (איור 2).- תערובת 150 ng של הביטוי ליניארית פלסמיד עם 200 ng FWD ו 200 ng של oligonucleotide REV תחל ב 0.2 מ"ל תגובת שרשרת פולימראזית (PCR) צינור ולכוונן את העוצמה כדי 17 µL על-ידי הוספת בא ל.
- דגירה התערובת ב 65 מעלות צלזיוס למשך 2 דקות, לאחר מכן, ב 4 מעלות צלזיוס למשך לפחות 2 דקות.
- לבצע החדרת תחל annealed לתוך פלסמיד ליניארית על ידי מצדו.
- להוסיף תערובת המכילה את פלסמיד ליניארית, תחל annealed את 2 µL T4 ליגאז מאגר (10 x) ו- µL 1 של T4 ליגאז.
- דגירה התערובת מצדו ב 16 ° C עבור 16 h.
- Anneal פארווערטס (FWD), הפוכה (REV) e. coli הממוטבים codon לנוקלאוטידים קידוד הרצף המצע של עניין.

איור 2 : לנוקלאוטידים קידוד למחשוף הפרוטאוליטי באתר רצף. תחל ואחורה לקודד את VSQNY * PIVQ המחשוף האתר רצף של HIV-1 PR... לאחר ריפוי משלימים לנוקלאוטידים, קצר כפול גדילי הדנ א מכיל קצוות דביקים, המקביל לזה של פאצי, NheI endonucleases ההגבלה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- שינוי צורה µL 100 BL21(DE3) תאים המוסמכת על ידי 5 µL תערובת מצדו ולהפיץ את התאים על פלטות אגר של מרק (ליברות) lysogeny המכיל אמפיצילין.
הערה: החלבונים פלורסנט תהיה באותה מסגרת קריאה פתוחה עם התגים פיוז'ן N-מסוף רק לאחר מצדו מוצלחת. כמה ימים לאחר השינוי, המושבות (המכיל את פלסמיד ביטוי קידוד האתר שנוספו המחשוף של ריבית) יראה פלורסצנטיות גלוי עם או אפילו ללא שימוש של DRBT. - להכין מלאי גליצרול מן המושבות מתוארים.
- רחץ מושבה דיסקרטית לתוך שפופרת צנטרפוגה 50 מ ל, המכיל 5 µL ליברות בינוני המכיל אמפיצילין (ב ריכוז הסופי של µg 100/mL).
- דגירה זה ב 37 מעלות צלזיוס במשך 8 שעות תוך כדי טלטול ברציפות ב 220 סל"ד; לאחר מכן, לקצור את התאים על ידי צנטריפוגה ב x 1000 g למשך 5 דקות בטמפרטורת החדר.
- בעדינות להשעות את התאים 1 מ"ל של 80% פתרון גליצרול (מדולל עם מים מזוקקים) ולהוסיף 500 µL 10 מ מ MgCl2 פתרון ההשעיה.
- להעביר את המתלים צינור מקפיא ולאחסן את המניות ב-70 מעלות צלזיוס.
- לאמת את רצף פלסמיד שנוצר על ידי רצפי DNA.
- להוסיף 10 µL של המניה גליצרול (להכין בשלב 1.7) מ ל LB בינוני המכיל אמפיצילין µg/mL 100 בשפופרת צנטרפוגה 50 מ.
- דגירה ההשעיה ב 37 מעלות צלזיוס במשך 16 שעות תוך כדי טלטול ברציפות ב 220 סל"ד; לאחר מכן, לקצור את התאים על ידי צנטריפוגה ב x 2,000 g 10 דקות ב 4 º C.
- לנתק פלסמיד ביטוי מן בגדר תא על-ידי miniprep פלסמיד קיט (ראה טבלה של חומרים) לפי הוראות היצרן ולהשתמש את פלסמיד מטוהרים של רצפי DNA.
הערה: עבור רצף, 5'-GATGAAGCCCTGAAAGACGCGCAG-3' (קדימה), 5-GCAAGGCGATTAAGTTGGGTAACGC-3' (הפוכה) לנוקלאוטידים עשוי לשמש.
2. הבעת סובסטרטים פלורסנט
- הכינו את התרבות starter.
- להוסיף 10 µL של המניה גליצרול (להכין בשלב 1.7) מ ל LB בינוני המכיל אמפיצילין µg/mL 100 בשפופרת צנטרפוגה 50 מ.
- דגירה ההשעיה ב 37 ° C עבור 15 h תוך טלטול ברציפות ב 220 סל"ד.
- להעביר את התרבות חיידקי (5 מ"ל) 50 מ של טרי בינוני LB המכיל אמפיצילין µg/mL 100 בבקבוקון Erlenmeyer סטרילי 500 מ"ל.
- לגדול התאים ב 37 מעלות צלזיוס ספיגת של 0.6-0.8-600 ננומטר אורך גל, תוך כדי טלטול ברציפות ב 220 סל"ד.
הערה: אם טטרציקלין טיפול מיושמות בשלב 2.5, לא מומלץ לגדל את התאים ספיגת של יותר מ 0.6-600 ננומטר. - להוסיף איזופרופיל β-D-1-thiogalactopyranoside (IPTG) הריכוז הסופי של 1 מ מ לזירוז ביטוי חלבון.
- אם לא הוחל טיפול טטרציקלין, דגירה התרבות של h 3 ב 37 מעלות צלזיוס תוך טלטול ברציפות ב 220 סל"ד ולהמשיך את הפרוטוקול עם צעד 2.6. אם הוחל טיפול טטרציקלין, המשך הפרוטוקול עם שלבים 2.5.1-2.5.3.
הערה: כמה FPs המיוצר על ידי e. coli תאים שיש זמן ההבשלה ארוך יותר (ראה עבודה קודמות)16,17; במקרים אלה, התרגום חלבונים יכולים באופן אופציונלי להיעצר על-ידי הטיפול טטרציקלין, על מנת להגדיל את התשואה פלורסנט של הפתרון המצע.- דגירה התליה תא עבור 2 h ב 37 מעלות צלזיוס תוך טלטול ברציפות ב 220 סל"ד; לאחר מכן, להוסיף פתרון טטרציקלין (ב ריכוז סופי של 200 µg/mL).
- דגירה של תרבית תאים לפי זמן ההבשלה של החלבון הניאון של בחירה ב 37 מעלות צלזיוס, תוך כדי טלטול ברציפות ב 220 סל"ד.
- העברת 2 x 25 מ של התרבות כדי לנקות צינורות צנטריפוגה 50 מ ל ולקצור את התאים על ידי צנטריפוגה ב 4,000 x g למשך 15 דקות ב 4 º C.
- למחוק את תגובת שיקוע ולאחסן את כדורי תא החיידק ב-70 מעלות צלזיוס במשך לפחות שעה.
הערה: תאים המכילים את סובסטרטים פלורסנט ביטוי להראות גלוי זריחה עם או אפילו ללא שימוש DRBT.
3. תא שיבוש
- המקום בגדר תא קפוא בקרח ולתת לו להפשיר למשך 15 דקות.
- להוסיף 2 מ של מאגר פירוק (50 מ מ2PO NaH4, 300 מ"מ NaCl, imidazole 10 מ מ, 0.05% Tween 20, pH 8) בגדר, להשעות את התאים.
- להוסיף 10 µL של פתרון מעכב פרוטאז phenylmethanesulfonyl הטרי-פלואוריד (PMSF) (8.7 מ"ג/מ"ל, מומס באתנול) ההשעיה.
- להוסיף 2 מ"ג ליזוזים ויחידות 20 DNase ההשעיה, הפקתו.
- דגירה התליה על קרח במשך 15 דקות, מערבולת זה מעת לעת.
- 2 x 1 מ"ל של ההשעיה להעביר צינורות microcentrifuge 1.5 mL ו sonicate את המתלים למשך 3 דקות, סיבובים של 10 s של sonication ו- 5 s של נח.
- Centrifuge הצינורות ב x 10,000 g למשך 20 דקות בטמפרטורת החדר; לאחר מכן, להסיר את תגובת שיקוע פלורסנט (שנוקה חיידקי תא lysate) בקפידה כל שפופרת, להעביר אותו צינורות microcentrifuge חדש.
הערה: lysates שנוקה המכיל את המצע פלורסנט להראות גלוי זריחה עם או אפילו ללא שימוש DRBT, ניתן לאחסן ב 4 ° C עד 2 שבועות. לא תקפיא את התמונה Lysates שנוקה יכול להיות מנוצל ישירות עבור הכנת הדוגמא ב וזמינותו פרוטאז (ראו סעיף 4.1) או גם יכול לשמש עבור טיהור המצע (ראה שלב 4.5.1).
4. Ni-נ פרוטאז מגנטית מבוססת על חרוז assay
הערה: בשל הגמישות של פלטפורמת assay, זה ניתן למטב בסוגים רבים ומגוונים של מחקרים. מסיבה זו, עקב ההבדל בשיעור פעילות של האנזימים של בחירה, חלק מהפרמטרים assay (איפה זה מסומן) שאי אפשר לתאר במפורש אבל צריך להיות מותאם אישי מטרות, תכנון ניסויים. כמו הדרכה, הפרמטרים של סוגים מסוימים של מחקרים מסומנים בהשלבים מסוים.
- הכנת הדוגמא
- דור של המצע-attached beads מגנטי
- המקום סגור mL 2 נמוך-חלבון-מחייב (ראה טבלה של חומרים) microcentrifuge שפופרת המכילה חדש או ממוחזר (ראו סעיף 4.7) Ni-נ agarose מגנטי חרוזי concentrator חלקיקים מגנטיים (MPC).
הערה: הסכום של ההשעיה חרוז יישומית הוא יוגדר בהתבסס על הנבחנים. השתמשנו 1 מ"ל של פתרון חרוז מגנטי (5%, וי/v)-בכל ניסוי. - חרוזים עשויים להישאר לקיר ו/או למכסה של הצינור microcentrifuge; לכן, הפוך את MPC בכל כיוון כדי לוודא כי כל החרוזים נאספים.
- הסר את תגובת שיקוע, למחוק אותו.
- לשטוף את החרוזים על ידי פירוק מאגר.
- 1.8 מ של פירוק מאגר להוסיף החרוזים ולהסיר את הצינור סגור MPC.
- להשעות את החרוזים בצינור על ידי טלטול או שבות הצינורות הפוך עד המדגם היא הומוגנית לחלוטין.
- למקם את הצינור בחזרה MPC ולהפוך אותו הפוך כדי לאסוף את החרוזים.
- פתח הצינור וזורקים את תגובת שיקוע.
- מ 1.0-1.8 ל שנוקה lysate (להכין בשלב 3.7) להוסיף החרוזים ולהסיר את הצינורית MPC.
- הפוך את הצינור סגור עד החרוזים הומוגנית לחלוטין, לאט לסובב את הצינור על ידי מסובב בטמפרטורת החדר למשך 30 דקות.
- למקם את זה MPC ולהסיר התא lysate את החרוזים ומן את המכסה.
הערה: התא lysate ייתכן שנמחקו או לשמור אותה עוד יותר לשימוש (ראה ההערה לאחר שלב 3.7). - להוסיף 1% Tween 20 (pH 7) המצע-attached beads מגנטי (SAMBs).
הערה: SAMBs להראות גלוי זריחה עם או אפילו ללא שימוש DRBT.
- המקום סגור mL 2 נמוך-חלבון-מחייב (ראה טבלה של חומרים) microcentrifuge שפופרת המכילה חדש או ממוחזר (ראו סעיף 4.7) Ni-נ agarose מגנטי חרוזי concentrator חלקיקים מגנטיים (MPC).
- רחיצת SAMBs
- למקם את הצינור עם המתלה SAMB MPC וזורקים את תגובת שיקוע.
- לשטוף את SAMBs 3 x עם כל מאגר: mL 1.8 i) של 1% Tween 20 (pH 7); ii) mL 1.8 מאגר כביסה (50 מ מ2PO NaH4300 מ"מ NaCl, 5 מ מ imidazole, 0.05% Tween 20, pH 7); iii) 1.8 מ של פצילות מאגר (50 מ"מ NaH2PO4, 300 מ"מ NaCl, 0.05% Tween 20, pH 7).
הערה: תהליך הכביסה, ראה שלב 4.1.1.4. המאגר המחשוף עשוי להשתנות בהתאם לצרכים ניסיוני, אבל מומלץ לבדוק את המדריך של חרוזים מגנטי Ni-נ לקביעת התאימות.
- הכנה של הפתרון מניות SAMB
- להוסיף מאגר המחשוף SAMBs שטף כדי ליצור פתרון מניות SAMB.
הערה: לאחר התוספת של המאגר, לא ללחוץ או הפוך את הצינור. היקף המאגר המחשוף תלוי הנבחנים בודדים, חייב להיות מחושב בהתבסס על מספר beads מגנטי (ראה שלב 4.1.1.1) ועל אמצעי האחסון כדי לשמש בשלב 4.1.4.2. עבור צינורות 2 מ"ל, שאמצעי האחסון השימושית עד 1,900 µL (ראה טבלה 1). הצפיפות חרוז מגנטי המומלצת של הפתרון מניות SAMB הוא 2% - 10% (v/v).סוג המחקר נפח של פצילות מאגר (µL) מדידות תלויי-S (איור 4) 1600 מדידות זמן-קורס (תאנה 5A) 1600 עיכוב המחקר (תאנה 5B) 1900 pH התלות המחקר (איור 6) 1400
טבלה 1: נפח המאגר המחשוף המשמש כדי להכין את הפתרון SAMB מניות ב סוגים שונים של מדידות. - הסר את הצינור סגור MPC. השתמש הפתרון מניות SAMB מיד או לאחסן אותו ב 4 ° C עבור עד 24 שעות.
- להוסיף מאגר המחשוף SAMBs שטף כדי ליצור פתרון מניות SAMB.
- דור של הדגימות assay באמצעות הפתרון מניות SAMB
הערה: הפרטים של חלק זה של וזמינותו תלויות חריפה בודדים הנבחנים (דוגמה סוגי מוצגות בטבלה מס ' 2).סוג המדגם הערות התגובה מדגם (R) -משמש להערכת מאפייני המחשוף
-מכיל את האנזים והן את המצע במאגר המחשוףהמצע מדגם ריק (B) -משמש להערכת המצע ספונטנית דיסוציאציה (ראה שלב 4.6.2)
-מכיל רק את המצע במאגר המחשוףהמצע שליטה לדוגמה (C) -ריכוז המצע detemining (ראה שלב 4.6.3)
-מכיל רק את המצע במאגר • תנאי
טבלה 2: לטעום סוגי וזמינותו פרוטאז מגנטית מבוססת על חרוז Ni-נ. ת.- להכין 2 מ"ל של צינורות microcentrifuge נמוך-חלבון-מחייב הדגימות וזמינותו.
הערה: חלבון נמוכה אחרים מחייב משטיחים פלסטיק עשוי גם לשמש. השתמש צינורות עגול או שטוח-למטה כדי להבטיח את התנועה החופשית של SAMBs. ראה את מספר המומלצים של צינורות בטבלה3.סוג המחקר R B C מדידות תלויי-S (איור 4) 5 5 2 מדידות זמן-קורס (תאנה 5A) 6 6 2 עיכוב המחקר (תאנה 5B) 7 7 1 pH התלות המחקר (איור 6) 5 5 1
טבלה 3: מספר צינורות microcentrifuge mL 2 נדרש עבור כל סוג הדגימה במחקרים הפגינו. - להשעות את הפתרון מניות SAMB עד הומוגניות ולהעביר כמות המצע שינותח בתגובות מיד לתוך הבקבוקונים מדגם. אמצעי האחסון המומלץ הוא 25-300 µL, אבל זה יש לקבוע לפי הדגם ניסיוני בודדים (טבלה 4).
הערה: לבדוק אם כל SAMBs נמדדו בתחתית של הצינורות. SAMBs עשויים לדבוק הקיר של הרכבת התחתית, אשר יכולה לעוות את התוצאות וזמינותו. אם אמצעי אחסון שונים ניתן למדוד באופן רציף, להתחיל aliquoting עם נפח הגבוהה ולנסות לצמצם את השינוי פיפטות ו/או פיפטה טיפים.סוג המחקר R B C מדידות תלויי-S (איור 4) 25 – 50 – 100-150 – 250 25 – 50 – 100-150 – 250 25 מדידות זמן-קורס (תאנה 5A) 25 25 25 עיכוב המחקר (תאנה 5B) 120 120 120 pH התלות המחקר (איור 6) 100 100 100
טבלה 4: נפח של הפתרון SAMB נמדד הבקבוקונים מדגם של כל סוג הדגימה במחקרים הפגינו. - למקם את צינורות מדגם המכיל את המתלים SAMB aliquoted לתוך MPC ולהעביר מעט את MPC אחורה וקדימה.
- בזהירות להסיר את תגובת שיקוע SAMBs וזורקים אותו.
- להסיר את הצינורות MPC ולהוסיף את עוצמת התגובה מאגר (מחשוף או • תנאי מאגר [100 מ מ EDTA, 0.05% Tween 20, pH 7]) מחושב בקפידה SAMBs.
הערה: לחשב את עוצמת הקול של מאגר לפי הדגם ניסיוני בודדים (טבלה 5). עבור צינורות 2 מ"ל, הנפח הסופי מומלץ של תערובת התגובה (הנפח של המאגר התגובה שיש להוסיף בשלב זה + הנפח של הפתרון ניתן להוסיף בשלב 4.2.3) היא 50-150 µL. לוודא כי כל SAMBs נשטפים שנוספו למאגר. • תנאי המאגר משמש במקום המחשוף מאגר במקרים של דגימות הבקרה (ג) המצע. במחקר עיכוב, החומר המדכא של הבחירה מומלץ להוסיף בשלב זה.סוג המחקר נפח של המאגר התגובה (µL) מדידות תלויי-S (איור 4) מאגר פצילות 68 µL מדידות זמן-קורס (תאנה 5A) מאגר פצילות 68 µL עיכוב המחקר (תאנה 5B) 67.3 מאגר פצילות µL + 0.7 µL מעכב במניה פתרון * pH התלות המחקר (איור 6) 69.5 µL המחשוף מאגר * *
טבלה 5: עוצמת התגובה מאגר במחקרים והפגינו. * Amprenavir נפתרה ב דימתיל סולפוקסיד; פתרונות מניות amprenavir (החל מ- 1 ננומטר ריכוזי 1 מיקרומטר) הוחלו למחקר מעכבות (ראה איור 5B). * * ה-pH של מאגר יישומי המחשוף נע בין pH 6.0-8.5. - סגור את המכסים של הצינורות. עכשיו הדגימות מוכנים וזמינותו.
הערה: ניתן לאחסן את הדגימות ב 4 ° C עבור עד 24 שעות, אך האחסון ישימה רק אם הפתרון מניות SAMB שימש מיד לאחר ההכנה (ראה שלב 4.1.3.2).
- להכין 2 מ"ל של צינורות microcentrifuge נמוך-חלבון-מחייב הדגימות וזמינותו.
- דור של המצע-attached beads מגנטי
- חניכה של תגובות הפרוטאוליטי
- הכינו את האנזים הפרוטאוליטי הפתרון לצרכים ניסיוני.
הערה: מומלץ להשתמש מאגר המחשוף להמיס ו/או לדלל את האנזים. פרוטוקולים ולטיהור HIV-114 ו- PRs אס18 פורסמו בעבר. - הגדר של thermoshaker את קצב עצבנות (600 סל ד) ואת בטמפרטורת דגירה (טבלה 6).
סוג המחקר בטמפרטורת דגירה (° C) מדידות תלויי-S (איור 4) 37 מדידות זמן-קורס (תאנה 5A) 37 עיכוב המחקר (תאנה 5B) 37 pH התלות המחקר (איור 6) 30
טבלה 6: טמפרטורות הדגירה להחיל סוגי מחקר שונים. עבור ציבור HIV-1, 37 מעלות צלזיוס מומלץ, בזמן 30 ° C מומלצת PR. אס - הוסף את הפתרון אנזים הדגימות תגובה עבור אתחול הפרוטאוליטי תגובות.
הערה: במקרה של המצע ריק (B) ודוגמאות C, מוסיפים המחשוף מאגר (אנזים מאגר) • תנאי מאגר, בהתאמה. אמצעי האחסון יש לחשב בהתאם לצרכים ניסיוני בודדים (טבלה מס ' 7). עבור צינורות 2 מ"ל, הנפח הסופי מומלץ של תערובת התגובה (הנפח של המאגר התגובה הוסיף בשלב 4.1.4.5 + הנפח של הפתרון ניתן להוסיף בשלב זה) הוא µL 50-150.סוג המחקר נפח של המאגר • מאגר/תנאי פתרון/אנזים אנזים (µL) מדידות תלויי-S (איור 4) 2 מדידות זמן-קורס (תאנה 5A) 2 עיכוב המחקר (תאנה 5B) 2 pH התלות המחקר (איור 6) 0.5
טבלה 7: נפח המאגר • מאגר/תנאי פתרון/אנזים אנזים נוסף בעת האתחול של הדגימות assay במקרה של המחקרים הפגינו. - לעורר את החרוזים בקפידה על-ידי העברת הצינורות בעדינות, מניחים הצינורות מייד thermoshaker כבר חזק.
הערה: לאחר סיום דגימה ידנית (ראה סעיף 4.3) לוקח יותר זמן מאשר הקבלה; לכן, עיכוב רשום לפחות 2 דקות מומלץ בין חנוכת של התגובות. - דגירה בדגימות לפי הדגם ניסיוני (טבלה 8).
סוג המחקר הדגירה פעמים (דקות) מדידות תלויי-S (תאנה 4A) 7 מדידות תלויי-S (תאנה 4B) 120 מדידות זמן-קורס (תאנה 5A) 0 – 2.5 – 5 – 10 – 15 – 20 עיכוב המחקר (תאנה 5B) 10 pH התלות המחקר (איור 6) 60
טבלה 8: הדגירה פעמים שהוחל הדגימות assay במידות שונות.
- הכינו את האנזים הפרוטאוליטי הפתרון לצרכים ניסיוני.
- Terminהתקדמ התגובות הפרוטאוליטי
- להוציא את הדגימה ניעור, כוהנים 30 s בסוף הדגירה, ולסובב את זה מיד.
- במקום הצינור אל MPC, ומשהים 15 s, מעט להזיז את MPC אחורה וקדימה.
- פתח את המכסה, להעביר את תגובת שיקוע בקפידה צלחת או צינור חדש.
הערה: אל תיגע החרוזים מרוכז עם קצה פיפטה. תגובת שיקוע שנאספו של C דוגמאות ודוגמאות R עם רמה גבוהה של פצילות עשוי להראות גלוי זריחה עם או אפילו בלי השימוש DRBT.
- זיהוי פלורסנט
- להעביר 2 x 30 µL של supernatants הדגימה מופרדים microplate חצי-אזור שחור.
- למדוד את קרינה פלואורסצנטית באמצעות את המסננים המתאימים עירור, פליטה.
הערה: למדוד את קרינה פלואורסצנטית בסיסי של מאגר המחשוף, מאגר • תנאי, כמו גם. מסנן שילובים צורך להיבחר מבוסס על החלבון הניאון נמדד (טבלה 9).חלבון פלואורסצנטי עירור מסננים (אן אם) מסננים פליטה (אן אם) mTurqiouse2 355/40 460/25 mEYFP 544/15 590/10 מאפל 544/15 590/10
טבלה 9: עירור פליטה ומסננים המשמשים לזיהוי חלבונים שונה פלורסנט.
- כיול
הערה: כדי ליצור עקומות כיול בשלב 4.6.1, קרינה פלואורסצנטית ערכי העוצמה של מחשוף - או • תנאי-מאגר-נפתר סובסטרטים מטוהרים בריכוזים שונים צריך למדוד.- לטהר את סובסטרטים פלורסנט.
הערה: עבור טיהור, SAMBs של המצע ריק (B) הדגימות לאחר וזמינותו פרוטאז שייאסף או SAMB החדש של הבולם וניתן גם להכין (ראו בסעיפים 4.1.1 ו 4.1.2).- מקום צינור עם SAMBs מושעה ב 1 מ"ל של מאגר המחשוף (2% - 10%; וי/v) MPC ולאסוף את החרוזים מגנטי על-ידי הפעלת MPC על ההפוכות בכל כיוון.
- פתח הצינור ולהסיר את מאגר המחשוף, הן את הצינור והן את המכסה.
- הסר את הצינורית MPC ולהוסיף 400-600 µL • תנאי המאגר SAMBs.
- לאט לאט לסובב ברכבת התחתית סגורה עם מסובב בטמפרטורת החדר במשך 5 דקות.
- מקם את הצינורית אל MPC ולאסוף את החרוזים על-ידי הפעלת MPC על ההפוכות.
- הסר את תגובת שיקוע המכיל המצע פלורסנט שלם מטוהרים (eluate), להעביר אותו צינור microcentrifuge נמוך-חלבון-מחייב.
הערה: Eluate מראה בבירור זריחה עם או אפילו ללא שימוש של DRBT.
- לבצע חילופי מאגר מקבילי באמצעות שני התקנים אולטראפילטרציה 0.5 mL 10K.
- למדוד חצי כמות eluate מוכן (200-300 µL) לתוך כל התקן אולטראפילטרציה.
- לאחר בכל שלב צנטריפוגה, לדלל את eluate מרוכז הראשון ואת המכשירים אולטראפילטרציה השני על-ידי מאגר • תנאי ומאגר המחשוף, בהתאמה.
- לאחר ההתאוששות, להתאים את הדגימות מרוכז נפתר במאגרי שונים באותו אמצעי אחסון, בין 120-200 µL.
הערה: עכשיו תוכן חלבון המצע נפתרה-מאגר מחשוף הוא זהה המצע • תנאי נפתרה-מאגר; לכן, זה לא הכרחי לקבוע את התוכן של האחד האחרון בשלב 4.5.3, החלבון אם השיטה למדידת ריכוז החלבון מפריע EDTA.
- לקבוע תכולת חלבון סובסטרטים התפרקה גם במאגר • תנאי או המחשוף על ידי מדידת את ספיגת ב 280 ננומטר.
הערה: שיטות אחרות (למשל, ברדפורד או bicinchoninic חומצה (BCA) מבחני) עשוי לשמש גם כדי למדוד ריכוז חלבון, אבל הפרעות אפשריות עם EDTA (קיים במאגר • תנאי) או את ספיגת של המצע פלורסנט צריך להיות נחשב. תכולת החלבון הראשונית של הפתרון המצע מיושמות בשלב 4.5.4 מומלץ להיות בין 0.4-2.0 mg/mL על מנת ליצור כיול של עקומת בטווח המתאים. ראה טבלה 10 המקדמים של הכחדה.המצע משקל מולקולרי
(Da)מקדם הכחדה
(מ-1 ס מ-1, ב 280 ננומטר נמדד במים)6שלו - MBP-VSQNY * PIVQ-mTurquoise2 72101.7 96845 6שלו - MBP-KARVL * AEAM-mTurquoise2 72042.7 95355 6שלו - MBP-VSQNY * PIVQ-mEYFP 72367.1 94325 6שלו - MBP-VSQNY * PIVQ-מאפל 72145.9 105200
טבלה 10: משקולות מולקולרית, המקדמים הכחדה של סובסטרטים חלבון היתוך שונה פלורסנט רקומביננטי. - להכין לדילול טורי כפולה לפחות שמונה שלבים, • תנאי- והן מן הפתרונות המצע מחשוף-מאגר-נפתרה, שימוש • תנאי או המחשוף המאגר עבור הדילול, בהתאמה.
- להעביר 30 µL של כל נקודה דילול microplate חצי-אזור שחור.
- למדוד את זריחה עם fluorimeter, הגדרה זו חלה בשלב 4.4.2.
הערה: למדוד את קרינה פלואורסצנטית בסיסי של המאגר • תנאי וגם את המחשוף.
- לטהר את סובסטרטים פלורסנט.
- הערכת וזמינותו
- להתוות את עקומות כיול.
- לחשב את הריכוז (במ מ) של הפתרונות המצע מטוהרים (משמש בשלב 4.5.4), בהתבסס על תוכן החלבון שנקבע בשלב 4.5.3.
- לתקן את ערכי העוצמה היחסית קרינה פלואורסצנטית (RFU) של נקודות דילול טורי על-ידי ערכי יסוד RFU של המאגר דילול יישומית (המאגר מחשוף או המאגר • תנאי).
- להתוות את הערכים RFU המתוקן כנגד ריכוז מולרי של סובסטרטים מטוהרים מחשוף - או • תנאי-מאגר-נפתר ולבצע רגרסיה ליניארית (כוח החיתוך לאפס).
הערה: ערך2 R גבוה (˃0.97) מציין מתאם ליניארי טוב בין זריחה של ריכוז החלבון הניאון. במקרה זה, השיפוע של קו הרגרסיה ניתן להשתמש כדי להעריך את הריכוז של הרכיבים assay בטווח שנבדקו בשלבים 4.6.2 ו 4.6.3. שגיאות ניסיוני והפצה נקודת נתונים שעשויים להשפיע על האמינות של הכיול; לפיכך, ניתן לבצע הערכה גרפי עם העזרה של זום-אין גרפים (כפי שמוצג באיור3), על מנת לבדוק אם R2 ואת הערכים מדרון מושפעים הנתונים.
- לחשב את כמות המוצר המחשוף פלורסנט C-מסוף הדגימות התגובה.
- לתקן את הערכים RFU של כל מדגם R עם הערכים RFU של המדגם B המתאימים.
- לחשב את הריכוז המוצר המחשוף (במ מ) הדגימות תגובה על-ידי חלוקת המתוקן את RFU ערכים באמצעות השיפוע של הכיול המבוססות על מחשוף-מאגר עקומת (ראה שלב 4.6.1.3).
- חשב את ריכוז המצע יישומית הדגימות התגובה.
- לתקן את הערכים RFU של המדגם C עם הערך RFU של המאגר • תנאי בסיסי.
- לחשב את ריכוז המצע eluted (במ מ) supernatants של המדגם C על-ידי חלוקת שלהם המתוקן RFU ערכים באמצעות השיפוע של הכיול • תנאי-מאגר מבוססי עקומת (ראה שלב 4.6.1.3).
- לקבוע ריכוז המצע (במ מ) של הפתרון SAMB מניות משמש ליצירת הדגימות assay בשלב 4.1.4.2, בהתבסס על המשוואה הבאה:
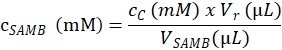
. הנה, cSAMB הוא ריכוז מולרי של הפתרון SAMB מניות מוכן בסעיף 4.1.3; cC הוא ריכוז מולרי של המצע eluted במדגם C מחושב בשלב 4.6.3.3; Vr הוא אמצעי של תערובת התגובה שנוצרו על-ידי התוספת של המאגר התגובה בשלב 4.1.4.5, המאגר אנזים בשלב 4.2.3.; VSAMB עוצמת הקול של הפתרון מניות SAMB במדגם C (שלב 4.1.4.2). - חשב את ריכוז מולרי סובסטרטים בכל מדגם R מבוסס על ריכוז מולרי של SAMB מניות הפתרון (במ מ) לפי האחסון (ב µL) נמדד כל שפופרת מדגם התגובה בשלב 4.1.4.2.
- לבצע עיבוד נתונים.
הערה: ניתוח הנתונים תלויה מטרת הניסוי. הסרטון מציג דוגמה לעיבוד נתונים של מחקר קינטי תלויי-המצע ב- HIV-1 יחסי ציבור באמצעות6שלו - MBP-VSQNY * PIVQ-mTurquoise2 המצע. הערכים מהירות התחלתית מחושבים לפי מספר שברי ביקוע C-מסוף, לעומת ריכוז המצע יישומית. הפרמטרים קינטי נקבעים על ידי ניתוח רגרסיה לא ליניארית קינטיקת מיכאליס-מנטן.
- להתוות את עקומות כיול.
- מיחזור של חרוזים מגנטי
הערה: לאחר ביצוע וזמינותו של, חרוזים agarose מגנטי ניתן לאסוף ולהשתמש ממוחזר.- לאסוף את החרוזים מגנטי בשימוש עם MPC וזורקים את תגובת שיקוע.
- לשטוף את החרוזים עם 1.8 מ של המאגרים הבאים, לפי הסדר בהתחשב: התחדשות מאגר A (0.05% Tween 20, 0.5 M NaOH), התחדשות מאגר B (0.05% Tween 20), התחדשות מאגר C (0.05% Tween 20, 100 מ מ EDTA, pH 8), התחדשות מאגר B, התחדשות מאגר D ( 0.05% Tween 20, 100 מ מ NiSO4, pH 8), התחדשות מאגר B, התחדשות מאגר E (0.5% Tween 20, 30% אתנול, pH 7).
הערה: תהליך הכביסה, ראה שלב 4.1.1.4.
- לשטוף את החרוזים עם 1.8 מ של המאגרים הבאים, לפי הסדר בהתחשב: התחדשות מאגר A (0.05% Tween 20, 0.5 M NaOH), התחדשות מאגר B (0.05% Tween 20), התחדשות מאגר C (0.05% Tween 20, 100 מ מ EDTA, pH 8), התחדשות מאגר B, התחדשות מאגר D ( 0.05% Tween 20, 100 מ מ NiSO4, pH 8), התחדשות מאגר B, התחדשות מאגר E (0.5% Tween 20, 30% אתנול, pH 7).
- לאחסן את החרוזים ממוחזר במאגר התחדשות E-4 מעלות צלזיוס.
- לאסוף את החרוזים מגנטי בשימוש עם MPC וזורקים את תגובת שיקוע.
5. דף ניתוח
-
הכנת הדוגמא
הערה: לאחר ביצוע וזמינותו מגנטית מבוססת על חרוז Ni-נ, supernatants assay ניתן לנתח באמצעות דף. במקרה זה, דלג על שלבים 5.1.1 ו 5.1.2. עם זאת, אפשרי גם לנתח את הפתרון סובסטרטים פלורסנט מטוהרים ו/או שברי ביקוע שלהם לאחר עיכול תוך-פתרון עם פרוטאז עניין. במקרה זה, ממשיכים את הפרוטוקול עם צעד 5.1.1.- להכין את הפתרון המצע פלורסנט מטוהרים לפי שלב 4.5.1.
- מבצעים בפתרון לעיכול.
- חילופי • תנאי מאגר עם מחשוף מאגר 0.5 mL 10K אולטראפילטרציה ההתקן ואת aliquot את הדגימות להתעכל לתוך צינורות microcentrifuge 1.5 mL.
הערה: עבור הניתוח של דף, אנחנו aliquoted µL 68 לכל סובסטרט, אך מספר צינורות מדגם ונפח המצע פתרון להיות aliquoted ניתן למטב לפי הדגם ניסיוני בודדים. - הוסף את הפתרון אנזים הדגימות.
הערה: עבור הניתוח של דף, והגשנו בקשה µL 2 של ציבור HIV-1, שהוכן כפי שתואר על ידי Bozóki et al.14, אבל אולי ניתן למטב את אמצעי האחסון לפי הדגם ניסיוני בודדים. מומלץ להשתמש המחשוף המאגר כדי להמיס ו/או לדלל את האנזים. - דגירה הדגימות לפי הדגם ניסיוני.
הערה: עבור הניתוח של דף, אנחנו מודגרות תערובת התגובה למשך 45 דקות ב- 37 מעלות צלזיוס, אך זמן הדגירה, טמפרטורה צורך להגדיר לפי הדגם ניסיוני. - לסיים את התגובה על ידי ביצוע שלב 5.1.3.
- חילופי • תנאי מאגר עם מחשוף מאגר 0.5 mL 10K אולטראפילטרציה ההתקן ואת aliquot את הדגימות להתעכל לתוך צינורות microcentrifuge 1.5 mL.
- להכין את הדגימה דף.
הערה: הדגימות פלורסנט המצע-המכילים שתהיה מוכנה לעמוד על nondenaturing או על ידי שיטה denaturing. לשימוש של תנאים nondenaturing או denaturing, בצע את שלב 5.1.3.1 או 5.1.3.2, בהתאמה.- להכין מדגם nondenatured: מערבבים µL 30 המדגם עם 6 µL של 6 x העמסה מדגם nondenaturing מאגר (300 ממ טריס, 20% גליצרול, bromophenol 0.05% כחול, pH 6.8).
- להכין מדגם denatured: מערבבים µL 30 המדגם עם 6 µL של 6 x העמסה מדגם denaturing מאגר (300 מ מ טריס, גליצרול 20%, 100 מ מ 0.05% bromophenol כחול, 12% מרחביות, β-mercaptoethanol, pH 6.8), מחממים את הדגימות ב 95 מעלות צלזיוס למשך 10 דקות.
-
ניתוח מרחביות-דף
הערה: לחלופין, אם רק הם דוגמאות nondenatured (מוכן ב שלב 5.1.3.1) כדי להיות מנותח, עמוד יליד ניתן גם לבצע. במקרה זה, לדלג על סעיף 5.3.- להכין של ג'ל מרחביות-לזיהוי (שימוש 14% הפרדת ו- 4% ג'ל הערימה) ולמלא את הטנק באמצעות אלקטרופורזה מאגר (2.5 מ"מ טריס, גליצין 19.2 מ"מ, 0.01% מרחביות).
- להוסיף את הדגימות (להכין בשלב 5.1.3.1 או 5.1.3.2) הבארות של ג'ל לזיהוי ולבצע אלקטרופורזה עם מתח V 120.
- להסיר את הקלטת ג'ל ממודול פועל ולמקם את הג'ל לתוך טנק כביסה.
הערה: דוגמאות Nondenatured כבר גלויים הג'ל, אפילו בעין בלתי מזוינת או עם DRBT.
-
בג'ל renaturation וזיהוי של חלבונים פלורסנט
הערה: כדי לזהות את החלבונים פלורסנט בדגימות שפגע בסימני (להכין בשלב 5.1.3.2)-DRBT, למען חברה דמוקרטית צריך להיסחף מן הג'ל, חלקית renature את החלבונים.- להוסיף ~ 100 מ ל מים מזוקקים הג'ל ולשטוף את הג'ל לפחות למשך 30 דקות.
הערה: כדי לשפר את הסרת מרחביות, להחליף את המים כל 10 דקות, או עד 60 דקות לשטוף. - דמיינו את החלבונים פלורסנט באמצעות DRBT או על-ידי הדמיה UV.
- להוסיף ~ 100 מ ל מים מזוקקים הג'ל ולשטוף את הג'ל לפחות למשך 30 דקות.
-
Coomassie המקובלת מכתים של הג'ל
- מכתים את הג'ל עם צבע כחול מבריק Coomassie להמחיש חלבונים nonfluorescent.
תוצאות
איור 1A מציג את מבנה סכמטי של מצע נציג חלבון רקומביננטי פלורסנט אשר ניתן לעבד על ידי HIV-1 יחסי ציבור-הרצף באתר שלו המחשוף ספציפיים. איור 1B מייצג את הייצור המצע שלהם יישומים אפשריים במבחני פרוטאז, כולל assay מגנטית מבוססת על חרוז Ni-נ ו/או דף.
כדי לקבל מידע אמין על-ידי fluorimetry, הליך הכיול נדרש, על מנת לקבוע את הכמויות של סובסטרטים פלורסנט ומוצרים המחשוף. בשביל זה, ערכי העוצמה של זריחה של סובסטרטים שונים בתנאים שונים המאגר צריך להימדד ויש צורך בקורלציה שלהם ריכוזי בטווח ריכוז לבדיקה (איור 3). ניתן להחיל את ערכי השיפוע של עקומות כיול כדי לקבוע את הכמויות של מצעים ומוצרי המחשוף הדגימות וזמינותו. המדרונות של עקומות כיול עצמאיים של הרצף האתר המחשוף מוכנס לתוך סובסטרטים (טבלה 11) והוא יכול לשמש באופן פוטנציאלי עבור סדרה של סובסטרטים התמזגו לאותו סוג של חלבון פלואורסצנטי. זום-אין גרפים מוצגים עבור כל regressions ליניארית, כדי להגדיל את הטווחים ריכוז נמוך יותר גם (איור 3). חשוב לציין כי הכיול צריך להתבצע בזהירות כי חלוקה נכונה של נקודות נתונים נדרש כיול אמין. מסיבה זו, דילול טורי כפולה מוחל להכין הדגימות כיול, כי הערך2 R מציין מתאם טוב בין את הריכוז של חלבון פלואורסצנטי פלורסצנטיות רק אם מספר מספיק של נקודות נתונים שימשו כדי לכסות את טווח הריכוז כולו. יתר על כן, שגיאות ניסיוני יכול מאוד להשפיע על הדיוק של הכיול; לפיכך, הערכה גרפי של קווי הרגרסיה עשויים להיות גם כן
מגוון רחב של מידות אנזימטי יכול להתבצע על ידי פרוטאז וזמינותו, כולל בחינה של השפעת ריכוז המצע על מהירות התגובה (איור 4A). מאת רגרסיה לא ליניארית, הנתונים ניתן לקבוע פרמטרים קינטי אנזים (למשל, vmax ו- Km). ההשעיה של חרוז לא מספיק ואת פיזור של סיום התגובה לא תקין עלול לגרום תוצאות שיוצרת (איור 4B), אשר אינם מתאימים עבור חישוב ערכים קינטי אנזים אמין.
התלות של היווצרות המוצר בזמן יכול להיקבע על ידי וזמינותו (איור 5A) (למשל, במהלך אופטימיזציה של הפרמטרים התגובה המחשוף). פעילות אנזים בנוכחות מעכב יכול להיות גם חקירה (איור 5B) על הקביעה של ריכוז האנזים פעיל ו קבוע מעכבות. באמצעות המתודולוגיה אותו, ההשפעות של מעכבי אחרים יכולים גם להיות מוקרן על ידי וזמינותו.
וזמינותו פרוטאז שימושית כאשר חוקרים את השפעת pH על פעילות האנזים, גם כן. איור 6A מייצג את התלות של פעילות אנזים pH מהדוגמה של ציבור אס, אשר כולל מגוון pH אופטימלי רחב (pH 6-9). אם התלות ה-pH על פעילות האנזים הוא למד (או אנזימים שיש של אופטימום pH חומצי צריך להימדד), יש לקחת בחשבון כי הכריכה זיקה של סובסטרטים רקומביננטי כדי החרוזים עשוי להיות מוגבל ב- pH חומצי מעט. דיסוציאציה מוגברות של סובסטרטים של החרוזים (איור 6B) עלול לגרום עיוות של התוצאות וזמינותו. כדי לשקול את הדיסוציאציה המצע ספונטנית של החרוזים, הערכים שנמדדו עבור התגובה דגימות צריך לתקן על ידי אלה דוגמאות B.
איור 7 מראה כי החלבונים פלורסנט nondenatured ניתן להבחין בין הג'ל מבוסס על הצבעים שלהם, באמצעות transillumination אור כחול (איור 7 א). אם הקביעה של משקולות מולקולרית של קטעים מצעים/מחשוף הוא הכרחי, denaturing תנאים יכול לשמש גם עבור הכנת הדוגמא, בגלל החלבונים פלורסנט יכולה להיות חלקית renatured הג'ל, יכול להתגלות על ידי תאורה UV (איור 7 ב) או על-ידי Coomassie מכתים (איור 7C). אם הדגימות R מנותחים, רק את המוצרים המחשוף C-מסוף הם גלויים (איור 7C), בעוד שברי ביקוע N-מסוף ותערובות uncleaved יישארו מחוברים החרוזים. לעיתים, חלבונים עשויה להיות חלקית שפגע בסימני למרות שימוש בתנאים nondenaturing (איור 7C), ואילו החלבונים nondenatured שופע יותר, שפגע בסימני טפסים הם גם לזיהוי במדגם. תופעה זו אינה משפיעה הגילוי של פצילות הפרוטאוליטי אבל צריך לקחת בחשבון במקרה של densitometry כמותית של דגימות nondenatured.
למרות תיאור מפורט מוצג רק עבור 2 מ"ל-צינור מבוססי assay, וזמינותו ניתן להתאים למערכת 96-ובכן המבוסס על צלחת (איור 8), אשר כבר נבדק בהצלחה במעבדה שלנו (לא מוצג). התבנית הותאם צלחת 96-ובכן הוא תואם באופן מלא עם fluorimetric, ניתוחים electrophoretic, כמו גם, והוא נתונים המתקבלים גם ניתן להעריך על סמך בשיטות המתוארות במאמר זה.
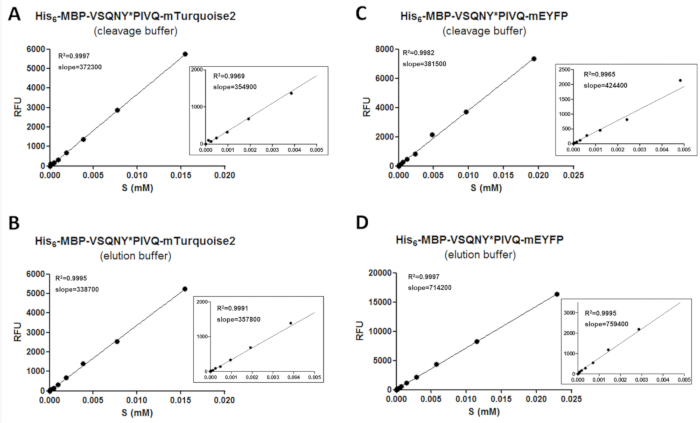
איור 3 : עקומות כיול. עקומות כיול המצע נציג מודגמות לדוגמה של שני מצעים רקומביננטי התמזגו לתגים פלורסצנט C-מסוף שונים: (A ו- B) - MBP-VSQNY שלו6* PIVQ-mTurquoise2, (ג , D ) - MBP-VSQNY שלו6* PIVQ-mEYFP. זום-אין דמויות מוצגים גם לייצג את הרגרסיה הליניארית של נקודות נתונים ב- 0-0.005 mM טווח ריכוז המצע. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
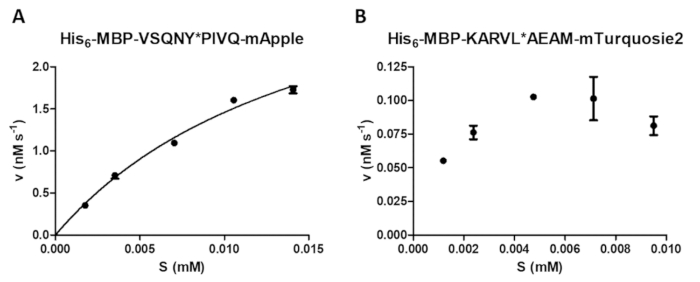
איור 4 : קביעת פרמטרים קינטי אנזים. מדידות קינטי תלויי-המצע בוצעו על ידי HIV-1 יחסי ציבור (בריכוז הפעיל הסופי של 41.2 ננומטר). הערכים מהירות התחלתית שורטטו כנגד ריכוז המצע ובוצע ניתוח רגרסיה לא ליניארית קינטיקת מיכאליס-מנטן. קווי השגיאה מייצגים SD (n = 2). (א) A תוצאה אופטימלית נציג מוצג עם הדוגמה של6שלו - MBP-VSQNY * לסובסטרט חלבון פיוז'ן PIVQ-מאפל. התוצאה שיוצרת נציג (B) A מוצג גם שלו6- MBP-KARVL * המצע AEAM-mTurquoise2, איפה ההגדרה של ריכוז המצע המתאים היה בעייתי עקב המגון לא מספיקות של הפתרון מניות SAMB , ואילו שגיאות גבוה יחסית נגרמו על ידי סיום התגובה לא תקין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
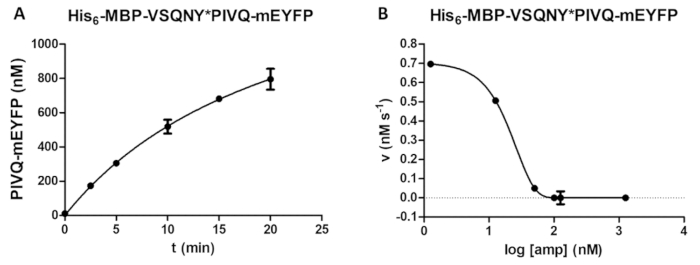
איור 5 : חקר זמן-קורס או מעכבות. (א) שלו 6- MBP-VSQNY * לסובסטרט חלבון רקומביננטי פיוז'ן (ב ריכוז הסופי של 0.00326 מ מ) היה ביקע מאת PR HIV-1 PIVQ-mEYFP (בריכוז הפעיל הסופי של 41.2 nM), ואת שחרורו של פלורסנט שברי הפרוטאוליטי PIVQ-mEYFP נמדדה כדי ביצוע ניתוח זמן כמובן. המדידות בוצעו בחמש נקודות זמן שונות. קווי השגיאה מייצגים SD (n = 2). (B) - MBP-VSQNY שלו6* PIVQ-mEYFP שימש המצע (ב מ מ 0.0015) כדי לקבוע את ההשפעה המעכבת של amprenavir על הפעילות של יחסי ציבור HIV-1 (בריכוז מוחלט של 163.8 ננומטר). על ידי התוויית הנתונים, חצי הריכוז המעכב מקסימלי (IC50) יכול להיות מוערך וריכוז האנזים פעיל (ריכוז הפעיל הסופי של 41.2 ננומטר) של HIV-1 יישומית ליחסי ציבור יכול גם להיות מחושב בהתבסס על העקומה עיכוב. קווי השגיאה מייצגים SD (n = 3). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
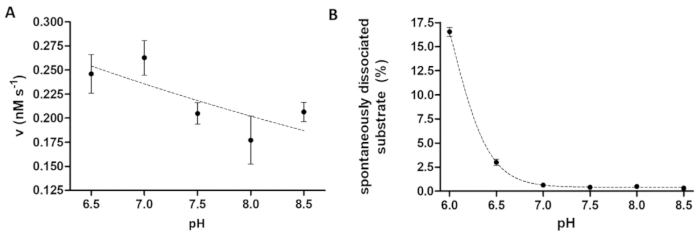
איור 6 : לומד תלות של פעילות אנזים, דיסוציאציה המצע ספונטנית על תואר דוקטורט (א) שלו - MBP6-VSQNY * PIVQ-mTurquoise2 המצע (ב- 0.033 מ"מ) נעשה שימוש כדי למדוד את פעילות האנזים אס PR (ב ריכוז מוחלט הסופי של 91.42 ננומטר) במאגר המחשוף מוגדר pH שונים, בין הטווח של 6.5-8.5. קווי השגיאה מייצגים SD (n = 2). הנתונים המותווים כבר פורסם בעבר14. (B) על סמך ערכי העוצמה פלורסנט היחסי של הדגימות ריק המצע, הדיסוציאציה ספונטנית שלו6- MBP-VSQNY * PIVQ-mTurquoise2 המצע (0.033 מ מ) בין החרוזים מגנטי נחקר על-ידי שימוש המחשוף מאגר עם pH שונים, בין 6.0-8.5. הנתונים המותווים כבר פורסם בעבר14. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
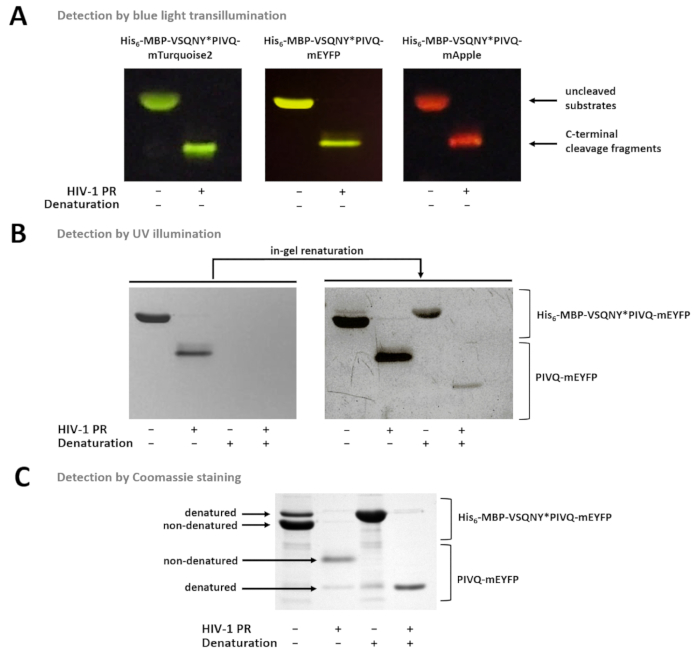
איור 7 : גילוי חלבונים הג'ל על ידי שיטות שונות- Uncleaved (א) ו- HIV-1 יחסי ציבור-מעוכלים פיוז'ן סובסטרטים חלבון לאחר הכנת הדוגמא nondenaturing היו דמיינו ידי transillumination אור כחול אחרי מרחביות-עמוד. התגובה המחשוף בוצע על ידי עיכול תוך-פתרון. (B) מיד לאחר העמוד, חלבונים nondenatured רק יכול להתגלות הג'ל על ידי תאורה UV, ואילו לאחר הסרת מרחביות, החלבונים פלורסנט בעבר denatured הפך חלקית renatured, לזיהוי. הדגימות הוכנו מ supernatants של וזמינותו מגנטית מבוססת על חרוז Ni-נ. ת. (ג) Coomassie מכתים יכול לשמש גם לגילוי חלבון, לאחר renaturation בג'ל. ההווה-מרחביות הג'ל-מאי דנטורציה חלקית את החלבון מקורי, אבל בדגימות מקורית, הצורות nondenatured שופע יותר. הדגימות הוכנו מ supernatants של וזמינותו מגנטית מבוססת על חרוז Ni-נ. ת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 8 : 96-ובכן עיבוד מבוסס-צלחת של פלטפורמת assay. (א) וזמינותו יכול להתבצע לא רק 2 mL צינורות אלא הבארות של צלחת 96-ובכן, גם כן. הנה אנחנו מראים על ייצוג סכמטי של יישום וזמינותו ללמוד יחודיות של פרוטאז בדויים באמצעות סדרה של מצעים פלורסנט, אשר עשוי להכיל פראי-סוג (wt) או מוטציה (mut-1 mut-4) המחשוף האתר רצפים. טיפול מגנטי החרוזים, רכז תואם 96-ובכן חלקיקים מגנטיים (MPC) יש להשתמש בניסויים. בכל אמצעי האחסון שצוין קשורות לבאר בודדת. כדי להשוות את יעילות המחשוף סובסטרטים, המצע המרה יכול להיות מוערך מן האחוז של ערכים RFU המצע-ריק-מתוקן של הדגימות התגובה, שוקל את הערכים RFU המצע-ריק-מתוקן של הקשור המצע דגימות הבקרה כמו 100. (B) לאחר fluorimetry, את supernatants מופרדים של וזמינותו דגימות ניתן לנתח גם על-ידי דף ולאחר הרכיבים חלבון פלואורסצנטי ניתן לנתח באופן ישיר או לאחר בבית-ג'ל renaturation במקרה של מדגם nondenaturing, denaturing הכנה, בהתאמה. שלושת הסוגים לדוגמה assay שונים מומחשים גם כל איור: C = המצע שליטה, B = המצע ריק, ו- R = התגובה. המצע שליטה הדגימות במאגר • תנאי, ואילו המצע ריק, התגובה הדגימות במאגר המחשוף. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| מאגר | חלבון פלואורסצנטי | CV % של מדרונות (%) |
| • תנאי | mTurquoise2 | 6.04 |
| פצילות | 9.11 | |
| • תנאי | מאפל | 10.92 |
| פצילות | 12.68 |
טבלה 11: מקדם של ערכי סטיה (CV %) של המדרונות של עקומות כיול המצע. כדי לבדוק אם זריחה של סובסטרטים חלבון רקומביננטי תלויה המחשוף שנוספו לאתר, ולידציות בוצעו על ידי סדרה של סובסטרטים מאפל - ו mTurquoise2-התמזגו (שישה משתנים עבור כל אחד, המכילים המחשוף שונים באתר רצפים של פרוטאז HIV-1), שניהם במאגרי • תנאי, המחשוף. מצאנו כי CV % ערכים של המדרונות הם מתחת לגיל 15% בכל המקרים, ממנה משתמע כי כיול סובסטרט יחיד יכול להיות מנוצל עבור הערכת המידה השונות המבוצעת על ידי משתנים המצע המכילים אותו תג ניאון.
Discussion
עקב החקירות התעשייה והאקדמיה אינטנסיבית של אנזימים הפרוטאוליטי ואת הביקוש האמריקנית ובמחיר של פלטפורמות וזמינותו של השודדים תואמי פרוטאז קבוע בהתאם, פיתחנו פרוטאז פלורסנט מגנטית מבוססת על חרוז וזמינותו. וזמינותו מבוסס על השימוש של חלבונים פיוז'ן רקומביננטי, אשר יכול להיות הרומן חלופות סובסטרטים פפטיד סינתטי שימוש נרחב.
בתבנית assay מפותחת, מצעים חלבון פיוז'ן הם מתאושש למשטחים של חרוזים ני chelate-מצופה agarose מגנטי. הקובץ המצורף המצע מסופק על ידי N-מסוף שלו תג קירבה6 החלבון פיוז'ן, אשר ישירות דבוקה תג MBP על מנת להקל על קיפול ולשפר את המסיסות במים המצע13. MBP ואחריו אתרים המחשוף של יחסי ציבור אס, פרוטאז עניין. לשעבר עשוי לשמש אתר המחשוף שליטה וזמינותו, בעוד שהשני יוכל לעבד את פרוטאז להיחקר. האתר מחשוף הוא להחלפה; dsDNA קצר רצף קידוד עבור האתר המחשוף עניין שניתן להוסיף גמיש "שיבוט בקלטת' של פלסמיד הביטוי על-ידי מצדו. החלבונים פיוז'ן רקומביננטי מכילה תג יציב מאוד, monomeric חלבון פלואורסצנטי במסוף C-, אשר מאפשרת זיהוי נקודת הקצה תשתחרר-אנזים, פלורסנט C-מסוף המחשוף המוצרים שפורסמו על המחשוף הפרוטאוליטי ( איור 1A). מצעים שלם פלורסנט מטוהרים נפתר במאגרי שונים משמשים גם לצורך כיול כדי להעריך את ריכוזי טוחנת מצעים ומוצרי המחשוף. בנוסף, לאחר fluorimetry, הרכיבים assay ניתן לנתח מאת מרחביות-דף, כמו גם. שניהם ילידי (nondenatured), שפגע בסימני חלבונים פלורסנט להיות visualized הג'ל, מיד לאחר אלקטרופורזה או לאחר renaturation הבאים בג'ל, בהתאמה. נוספים בהליך השילוב קונבנציונאלי כחול מבריק Coomassie מכתים-מאי לשמש ביעילות עבור האימות של התוצאות assay (איור 1B).
ההליך assay מורכב מהשלבים פשוטים, קל-אל-ביצוע בתבנית בנפח נמוך עשוי להיות מותאם באופן מלא כדי סביבה אוטומטית תפוקה גבוהה. עם זאת, באופן עצמאי מלבצע את הבדיקה באופן ידני או באמצעות מערכת אוטומציה, בחלקים הבאים של וזמינותו נחשבים להיות מכרעת ואני צריך תשומת לב מיוחדת תוך כדי ביצוע ההליך. i) ההומוגניות של הפתרון מגנטי חרוז. פתרון חרוז מגנטי הומוגני יש להשתמש בכל רחבי וזמינותו, הן טיהור ושטיפת צעדים. במיוחד, האמינות של מבחני פרוטאז בחוזקה תלוי כראוי aliquoting הפתרונות מניות צמוד-מצע מגנטי חרוז (SAMB). על מנת להגביר את היעילות של השעיה, פיזור, מומלץ להגדיר את הריכוז חרוז בין 2% ל- 10% (v/v). במהלך הכנת הדוגמא, השימוש של מאגרי בתוספת אבקת nonionic (כגון טריטון X-100 או Tween 20) עד 2% יכול גם להקטין את הדבקות של חרוזים מגנטי משטחי פלסטיק. הדבקות של החרוזים הקירות של מבחנות דגימה יכולה להימנע אם המתלים חרוז חלות בתשומת לב שהסוליות של הבקבוקונים במקום על גבי הקירות של צינורות מדגם. ההומוגניות של חרוזים מגנטי במהלך התגובה אנזימטי חיוני גם ומבטיחים יכול להיות ע י ניעור באופן רציף את הדגימות-600 סל ד בתקופת הדגירה. חרוזים מופצים כראוי בסחורות פלסטיק מעוגל או שהונעו, בזמן השימוש בקבוקונים V-התחתון אינו מומלץ. תוצאה שיוצרת הנגרמת על ידי חרוז פסולים המגון מיוצג באיור 4B. ii) סיום של דגימות התגובה. יתרון נוסף של השיטה הוא כי התגובה אנזימטי יכולה להיפסק ללא שימוש טיפול דנטורציה בחום או כל חומרים כימיים שעלולים מפריעות15. גם לאחר סיום יכול להתבצע בפשטות על-ידי הפרדת את החרוזים מגנטי מעירוב התגובה, באמצעות רכז חלקיקים מגנטיים קונבנציונלי. בעוד המאגר התגובה שהוסר מכיל את האנזים פעיל והמוצרים המחשוף פלורסנט C-מסוף שנוצר, מצעים uncleaved יישארו מחוברים החרוזים. בשל נוכחותם של האנזים פעיל במאגר של התגובה, ההליך ההפרדה צריך להתבצע בקפידה לצורך זיהוי נקודת הקצה אמין. לפני הצבת הבקבוקונים מדגם לתוך במסוע, מומלץ להחיל צנטריפוגה סיבוב קצר. לאחר הנחת הצינורות לתוך במסוע, לספק לפחות 15 s עבור החרוזים להיות שנאספו. תנועה קלה למפריד הגב וושוב עשוי להקל על האוסף של החרוזים. אנא שקול, במהלך פרידה שבוצעו באופן ידני, גם לאחר סיום בדרך כלל לוקח זמן רב יותר החניכה של התגובות. לכן, עיכוב מין רשומים כ- 2 מומלץ בין חנוכת אם באותו זמן דגירה צריך לחול על כל הדגימות.
עקרון וזמינותו הפרוטאוליטי המתואר היא יחסית פשוטה; עם זאת, צדדיות של המערכת מובטחת על ידי המבנה המצע גמיש ויציב. אופטימיזציה בודדים של וזמינותו מוגבלים רק על ידי התאימות של חרוזים זיקה עם תנאים יישומית, ריאגנטים, תוספים. מסכים עם הפרוטוקול של היצרן, מצאנו גם כי הכריכה זיקה של סובסטרטים למשטחים חרוז Ni-נ באופן משמעותי מחליש-pH ≤ 6.515. לכן, מומלץ ליישם את המצע ריק דגימות במקביל הדוגמאות התגובה, הקצב של דיסוציאציה ספונטנית המצע צריך להיחשב במהלך הערכת תוצאות.
במקרים אלה, שבו לא ניתן לבצע מבחני מגנטית מבוססת על חרוז עקב השימוש של רכיבים חרוז-לא תואם או pH נמוך, עיכול בפתרון סובסטרטים רקומביננטי מטוהרים ניתן גם ליישם. במקרים אלה, ניתן לנתח את תערובות התגובה על ידי אלקטרופורזה, ניתן לאבחן את החלבונים הג'ל מבוסס על הפרוטוקול המתואר. לחקור פעילות הפרוטאוליטי, בפתרון לעיכול, זיהוי בג'ל של החלבונים יכול להיות גם כלים חלופיים של fluorimetry. חידוש של מערכת המצע מעוצב הוא היישום של שלב בג'ל renaturation לאחר denaturing מרחביות-דף. בעוד חלבונים פלורסנט (nondenatured) יליד לשמור שלהם פלורסצנטיות במהלך אלקטרופורזה, המאפיין פלורסנט פוליטי על דנטורציה (איור 7 ב). עם זאת, ידי קרינה פלואורסצנטית של חלבונים שפגע בסימני ניתן לשחזר חלקית על ידי הסרת מרחביות של הג'ל. לפיכך, הפרדה של רכיבי התגובה באמצעות תנאים denaturing מאפשר לא רק את מבוסס על קרינה פלואורסצנטית אלא זיהוי מולקולרי-לפי משקל. יתרון נוסף של הזיהוי בג'ל פלורסנט לעומת הניתוח של ג'ל שהוכתמו Coomassie הוא כי ניתן לזהות בקלות החלבונים פלורסנט (מקורי או renatured) הג'ל מבוסס על קרינה פלואורסצנטית שלהם (ראה איור 7). זה עשוי להיות חשוב אם המחשוף תגובות מבוצעות דגימות המכילים מזהמים nonfluorescent או חלבונים מאוד דמוי משקולות מולקולרית של אחד את השני.
מבחני פרוטאז שימוש דומה מצעים מעוצב כבר פורסם בעבר8,9,10, ולמרות האתר המחשוף של הריבית באותם מקרים גם היה ממוקם בין תג זיקה ו- a חלבון פלואורסצנטי, מערכת assay שהוצגו כאן לא רק חוזר על הרעיונות המתואר אבל משלב את היתרונות השונים של פלטפורמות הקודם, גם משלים אותם עם שיפורים נוספים: i) הניצול של שותף פיוז'ן MBP, השני) נוכחות של אתר המחשוף שליטה אס PR, השלישי) השימוש מהונדסים לאחרונה FPs monomeric, ו- iv) היישום של תהליך כיול המצע ייחודי. וזמינותו עצמו תוכנן במיוחד כדי להיות שימושי עבור אנזים ירידה לפרטים ולימודי קינטי בכספת, אופן זמן - ו וחסכוניים, ללא צורך מכשור יקר. השיטה מיועדת להיות כלי מתאים ובמחיר למטרות מחקר אקדמיים ותעשייתיים בשני. בשל הגמישות של 'בקלטת שיבוט' של פלסמיד הביטוי, המערכת עשוי להיות מתאים עבור הדור מהירה וזולה של ספריות המצע רקומביננטי. וזמינותו המתוארים במסמך זה הוא כלי ריאלי עבור יישום היחודיות המצע, אנזים מוטגנזה מכוונת, ועיכוב מחקרים, גם, לספק כלי אלטרנטיבי לבצע קינטיקה אנזימטית. פלטפורמת assay (מתוך תא החיידק disruption קביעת הפרמטרים קינטי) ניתן להתאים סביבה HTS-אוטומציה מבוססי ואת, באופן פוטנציאלי, ניתן להחיל סינון מעכב פרוטאז תעשייתי ו/או תרופה קוטלת נגיפים פיתוח. בנוסף, הסתגלות of וזמינותו עבור proteolysis תחרותי הוא גם בעתיד היקף המעבדה שלנו. ב- assay כזה תחרותי, שני שונים סובסטרטים, כל המכיל אתר המחשוף שונים דבוקה אצבע שונות C-מסוף פלורסנט תג-הם נועד לשמש בו זמנית ב אותה התגובה המחשוף לחקור את ההעדפה של למדה האנזים על הרצף יעד נתון. יתר על כן, השימוש בטופס 96-ובכן הותאם צלחת assay (איור 8) גם להיות ממוטבת להקרנה מוטציה באמצעות סדרה של מצעים עם מחשוף ששונה רצפים האתר במקרה של פרוטאזות ציסטאין.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו היה נתמך בחלקה על ידי הפרויקט "יצירת צוותים PHARMPROT" GINOP-2.3.2-15-2016-00044 ובמימון, בנוסף, השכלה גבוהה התוכנית מצוינות המוסדי של משרד של הקיבולות האנושי בהונגריה, במסגרת ביוטכנולוגיה נושאיות במגמה אוניברסיטת דברצן. המחברים מודים חברי המעבדה של Retroviral ביוכימיה על עזרתם המדעי במהלך פיתוח assay וגם בשל סבלנותם במהלך הצילומים וזמינותו (במיוחד כדי נורברט Kassay, Joóné Matúz בשיא ו. נכון, ונדה מאוד- מי מופיעים ברקע של הוידאו). המחברים גם רוצה להגיד מיוחדת הודות Gedeon ריכטר Plc., במיוחד ד ר זולטאן Urbányi עבור המאפשר העבודה של Beáta Bozóki למחלקה לביוכימיה וביולוגיה מולקולרית כחוקרת חוות. המחברים גם רוצה להרחיב את תודתם ג'רג Zsadányi, Balázs Tőgyi, Balázs Pöstényi של זולטאן Király מולטימדיה ו- E-learning מרכז טכני אוניברסיטת דברצן על הסיוע המקצועי של וידאו ושמע ייצור.
Materials
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
References
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved