A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التفاعلات مع وغشاء التغلغل من الميتوكوندريا الدماغ بواسطة ألياف الليفية اميلويد
* These authors contributed equally
In This Article
Summary
المقدمة هنا هو بروتوكول للتحقيق في التفاعلات بين الشكل الأصلي ، بريفيبريلار ، والخلايا الليفية اميلويد ناضجه من الببتيدات مختلفه والبروتينات مع الميتوكوندريا معزولة من الانسجه المختلفة ومناطق مختلفه من الدماغ.
Abstract
وتشير مجموعه متزايدة من الادله إلى ان الغشاء يتخلله ، بما في ذلك الاغشيه الداخلية مثل الميتوكوندريا ، هو سمه مشتركه واليه الاوليه للسمية الناجمة عن الكلي اميلويد في الامراض التنكسية العصبية. ومع ذلك ، فان معظم التقارير التي تصف أليات اضطراب الغشاء تستند إلى أنظمه نموذجيه فوسفورية ، والدراسات التي تستهدف مباشره الاحداث التي تحدث علي مستوي الاغشيه البيولوجية نادره. وصف هنا هو نموذج لدراسة أليات سميه اميلويد علي مستوي الغشاء. للعزل الميتوكوندريا ، يتم استخدام الكثافة المتوسطة التدرج للحصول علي الاستعدادات مع الحد الأدنى من التلوث الميلين. بعد التاكد من سلامه غشاء الميتوكوندريا ، يتم التحقيق في تفاعل ألياف الليفية اميلويد الناشئة عن α-synuclein ، الانسولين البقري ، والدجاجة البيض الأبيض الليزوزيم (هيول) مع الميتوكوندريا الدماغ الفئران ، كنموذج في المختبر البيولوجية. وتبين النتائج ان علاج الميتوكوندريا الدماغ مع الجمعيات اللييفيه يمكن ان يسبب درجات مختلفه من تغلغل الغشاء وتعزيز المحتوي ROS. وهذا يشير إلى التفاعلات التي تعتمد علي البنية بين ألياف الليفية اميلويد وغشاء الميتوكوندريا. ومن المقترح ان الخصائص الفيزيائية الحيوية من ألياف الليفية اميلويد وملزمه محدده لاغشيه الميتوكوندريا قد توفر تفسيرات لبعض هذه الملاحظات.
Introduction
الاضطرابات المرتبطة اميلويد ، المعروفة باسم اميلويدسيس ، تشكل مجموعه كبيره من الامراض المحددة من قبل ظهور رواسب البروتين غير القابلة للذوبان في الانسجه المختلفة والاجهزه1،2. ومن بينها ، الاضطرابات العصبية هي الاشكال الأكثر شيوعا التي تظهر المجاميع البروتين في الجهاز العصبي المركزي أو المحيطي2. علي الرغم من انه قد تم اقتراح عدد من أليات للمشاركة في سميه المجاميع اميلويد3، وهناك مجموعه متزايدة من الادله تشير إلى اضطراب غشاء الخلية والتغلغل باعتبارها اليه الرئيسية للامراض اميلويد4، 5- بالاضافه إلى غشاء البلازما ، قد يتاثر أيضا الأرغن الداخلي (اي الميتوكوندريا).
ومن المثير للاهتمام ، تشير الادله الناشئة إلى ان ضعف الميتوكوندريا يلعب دورا حاسما في التسبب في اضطرابات الأعصاب ، بما في ذلك مرض الزهايمر ومرض باركنسون6،7. وفقا لهذه المسالة, وقد أشارت تقارير عديده ملزمه وتراكم اميلويد β-الببتيد, α-synuclein, huntingtin, و ALS المرتبطة متحولة SOD1 البروتينات إلى الميتوكوندريا8,9,10, 11. ويعتقد ان اليه الغشاء يتخلله المجاميع اميلويد تحدث اما من خلال تشكيل قنوات منفصلة (المسام) و/أو من خلال اليه غير محدده مثل المنظفات5,12, 13-الآن ومن الجدير بالذكر ان معظم هذه الاستنتاجات استندت إلى تقارير تتعلق بنظم نموذجيه فوسفورية ، وان الدراسات التي تستهدف مباشره الاحداث التي تحدث في الاغشيه البيولوجية نادره. ومن الواضح ان هذه الطبقات الدهنية الاصطناعية لا تعكس بالضرورة الخصائص الجوهرية لاغشيه بيولوجية ، بما في ذلك تلك الموجودة في الميتوكوندريا ، والتي هي هياكل غير متجانسة وتتالف من مجموعه واسعه من الدهون الفوسفاتية والبروتينات.
في هذه الدراسة ، يتم استخدام الميتوكوندريا معزولة من أدمغه الفئران كنموذج البيولوجية في المختبر لدراسة الآثار المدمرة من ألياف الليفية اميلويد الناشئة عن α-synuclein (كبروتين اميلويدروني) ، الانسولين البقري (كما يظهر نموذج الببتيد التماثل الهيكلية الكبيرة مع الانسولين البشري المشاركة في الحقن الموضعي الداء النشواني) ، والدجاجة البيض الأبيض الليزوزيم (هيول ؛ كبروتين نموذج مشترك لدراسة تراكم اميلويد). ثم يتم التحقيق في التفاعلات والاضرار المحتملة من اغشيه الميتوكوندريا المستحثة بواسطة ألياف الليفية اميلويد من خلال مراقبه الإفراج عن النازعة مالات الميتوكوندريا (MDH) (الموجود في مصفوفة الميتوكوندريا) والأكسجين الميتوكوندريا التفاعلية تعزيز الأنواع (ROS).
Protocol
وأجريت جميع التجارب الحيوانية وفقا للجنة المؤسسية للعناية بالماشية واستخدامها في العلوم الطبية بجامعه طهران. بذلت جهود قصوى للتقليل من المعاناة والآثار الضارة للفئران عن طريق شحذ شفرات المقصلة وتطبيق الحركات الحازمة والسريعة لنصل.
1. تجانس الدماغ والعزلة الميتوكوندريا
ملاحظه: تم اعداد جميع الكواشف للعزل الميتوكوندريا وفقا لسيمز وأندرسون14.
- اعداد المخازن المؤقتة للعزل الميتوكوندريا
- اعداد 100 mM تريس-HCl حل: تزن 0.605 غرام من تريس-HCl وتذوب في حوالي 40 مل من الماء منزوع الأيونات (DW) في الكاس. نقل الحل إلى قارورة 50 mL الحجمي وزيادة حجم النهائي إلى 50 مل عن طريق أضافه DW.
- اعداد حل 10 مم أدتا: تزن 0.202 غرام من أدتا وتذوب في حوالي 40 مل من DW في الكاس. نقل الحل إلى قارورة 50 mL الحجمي وزيادة حجم النهائي إلى 50 مل عن طريق أضافه DW.
ملاحظه: يمكن تخزين كلا الحلين في 4 درجه مئوية لمده 4 أسابيع علي الأقل. - اعداد تريس-HCl/أدتا/السكروز الأسهم الحل: أضافه 30 مل من 100 mM تريس-HCl و 30 مل من 10 مم أدتا في الكاس. تزن 32.86 غرام من السكروز وأضافه إلى الكاس مع التحريك مع التقليب المغناطيسي. عندما يذوب السكروز ، نقل الحل إلى قارورة 100 mL الحجمي وزيادة حجم النهائي إلى 100 مل عن طريق أضافه DW.
ملاحظه: يمكن تخزين هذا الحل في 4 درجه مئوية لمده تصل إلى 3 أيام. - اعداد العازلة العزلة (IB): أضافه 100 mL من تريس-HCl/أدتا/السكروز الأسهم إلى ما يقرب من 150 مل من DW. ضبط درجه الحموضة إلى 7.4 باضافه 0.1 M HCl. زيادة حجم النهائي إلى 300 mL عن طريق أضافه DW.
- اعداد 15 ٪ (v/v) كثافة التدرج المتوسط مع IB عن طريق أضافه 1.5 mL من متوسط التدرج الكثافة إلى 8.5 مل من IB الباردة.
- اعداد 10 ملغ/مل المصل البقري الزلال (بوسنيا) الحل: تزن 20 ملغ من الأحماض الدهنية الخالية من الحمض الصربي البوسني وتذوب في ما يقرب من 1.5 mL DW في قارورة 2 مل. زيادة حجم النهائي إلى 2 مل عن طريق أضافه DW وتخزينها علي الجليد حتى استخدامها.
ملاحظه: اعداد الحلول الطازجة من الخطوات 1-1-4 – 1-1--في يوم العزلة الميتوكوندريا وتخزينها علي الجليد حتى الاستخدام.
- عزله من دماغ الفئران
ملاحظه: تم تنفيذ قطع الراس وأزاله الدماغ من الفئران الذكور (150-200 ز) وفقا لسيمز وأندرسون14.- وضع كوب 30 مل في دلو الجليد وأضافه 10 مل من IB الباردة إلى الكاس.
- قطع راس الجرذ مع المقصلة الحيوانية الصغيرة وأزاله الدماغ من الجمجمة في غضون 1 دقيقه من قطع الرؤوس للحد من تدهور خصائص الميتوكوندريا.
- بسرعة نقل الدماغ إلى الكاس التي تحتوي علي IB الباردة.
- تجانس الدماغ واعداد الميتوكوندريا
ملاحظه: تم عزل الكسور الميتوكوندريا وفقا للبروتوكول الموصوف من قبل سيمز وأندرسون14، مع بعض التعديلات كما هو موضح سابقا15. من المهم العمل بسرعة والحفاظ علي كل شيء علي الجليد طوال العملية.- غسل الانسجه 2x مع 30 مل من IB ، ونقل إلى كوب يحتوي علي IB الباردة ، والمفروم ناعما الدماغ مع مقص.
- أضافه 10 مجلدات من IB المبردة مسبقا (حوالي 10 مل من IB لكل الفئران الدماغ).
- نقل تعليق الانسجه إلى 20 مل الخالط Dounce الباردة.
- تجانس قطع الانسجه باستخدام تسعه السكتات الدماغية صعودا وهبوطا مع مدقه الميكانيكية.
ملاحظه: اترك الخليط علي الجليد لمده 30 ثانيه تقريبا بعد كل مجموعه من ثلاثه السكتات الدماغية التجانس للتاكد من ان المتجانسة لا تزال بارده. - نقل متجانسة إلى ما قبل المبردة 10 مل أنبوب الطرد المركزي والطرد المركزي في 1 ، 300x g و 4 درجه مئوية لمده 3 دقائق.
- صب بعناية ونقلها إلى ما قبل المبردة 10 مل أنبوب الطرد المركزي والطرد المركزي في 21 ، 000x ز في 4 درجه مئوية لمده 10 دقيقه.
- تخلصي من المحلول الفائق وأوقفي الكريات الطينية في حل متوسط الكثافة بنسبه 15% (5 مل لكل مخ) بتحريك الخليط برفق مع ماصه.
- الطرد المركزي في الدوار زاوية ثابته في 30 ، 700x ز في 4 درجه مئوية لمده 5 دقائق باستخدام تسارع بطيء (45 s من 0 دوره في الدقيقة إلى 500 دوره في الدقيقة تليها تسارع العادي) والتباطؤ (لا الفرامل). وينبغي ان ينتج هذا نطاقين متميزين من المواد (الشكل 1 الف، يسارا).
- باستخدام ماصه باستور ، قم بازاله النطاق الحاد من المواد المتراكمة في اعلي التدرج ، والذي يحتوي في الغالب علي المايلين. ثم قم بازاله الحل المتوسط المتدرج لكثافة المادة (في النطاق 2) بقدر الإمكان دون فقدان اي جزء من الكسر المتقدريه المخصب في النطاق 2.
ملاحظه: الفرقة 2 يحتوي علي كل من الميتوكوندريا متشابك وغير متشابك. - أضافه 8 مل من IB إلى كسر الميتوكوندريا بينما يحرك برفق الخليط مع ماصه.
- أجهزه الطرد المركزي في 16 ، 700x ز في 4 درجه مئوية لمده 10 دقيقه وأزاله supernatant بعناية ، وترك بيليه فضفاضة أسفل دون عائق.
- أضف 1 مل من 10 ملغ/مل من الأحماض الدهنية الخالية من حمض الصرب البوسنيين إلى أنبوب الطرد المركزي بينما يحرك المزيج برفق مع طرف الماصة. زيادة حجم النهائي إلى 5 مل لكل الدماغ عن طريق أضافه IB.
- الطرد المركزي في 6 ، 900x ز في 4 درجه مئوية لمده 10 دقيقه ، والتي ينبغي ان تنتج بيليه شركه (الشكل 1a، الحق).
- Decant الفائقة وأعاده التعليق بلطف بيليه الميتوكوندريا في IB ، قسامه لهم في أنابيب 0.5 mL ، وتخزينها في النيتروجين السائل حتى الاستخدام.
2. تحديد تركيز البروتين
ملاحظه: يتم قياس تركيز البروتين باستخدام طريقه Lowry et al.16.
- اعداد الحلول لفحص اللوري
- اعداد الحل A: تزن 0.4 g من NaOH و 2 غرام من Na2CO3 وتذوب في 80 ml من DW ، ثم نقل الحل إلى قارورة الحجمي 100 ml وزيادة حجم إلى 100 مل عن طريق أضافه DW.
- اعداد الحل ب: تزن 0.1 غرام من طرطرات الصوديوم البوتاسيوم و 0.05 g من CuSO4 وتذوب في 8 مل من DW ، ثم نقل الحل إلى قارورة الحجمي 10 مل وزيادة حجم إلى 10 مل عن طريق أضافه DW.
ملاحظه: كلا الحلين A و B يمكن ان تبقي مستقره في 4 درجه مئوية لمده تصل إلى 6 أشهر. - اعداد الحل C: أضافه 0.5 ml من حل فلين إلى 7.5 ml من DW.
ملاحظه: اعداد الحل ج الطازجة والابتعاد عن الضوء حتى الاستخدام. - اعداد معايير الجيش الصربي البوسني مع التركيزات النهائية من 0, 20, 40, 60, 80, 100, 120 ميكروغرام/مل من خلال الجمع بين 0, 20, 40, 60, 80, 100, و 120 μL من 1 مغ/مل بوسنيا, علي التوالي, مع ما يكفي من DW لجعل 1000 μL من الحل.
- قياس تركيز البروتين
ملاحظه: لمزيد من الدقة ، تشغيل هذه الخطوة في ثلاث نسخ.- أضافه 50 μL من الحلول القياسية والمتجانسات الميتوكوندريا إلى كل بئر من لوحه جيده 96 ، تليها أضافه 45 μL من الحل A. ثم ، احتضان لوحه لمده 10 دقيقه في حمام الماء الدافئ تعيين في 50 درجه مئوية.
- أضافه 5 μL من الحل B واحتضان لوحه لمده 10 دقيقه في الظلام في درجه حرارة الغرفة (RT).
- أضافه 150 μL من الحل C واحتضان لوحه لمده 10 دقيقه في حمام الماء الدافئ تعيين في 50 درجه مئوية.
- تحميل لوحه في قارئ لوحه وتسجيل قيم الامتصاص للمعايير وتعليق الميتوكوندريا في 650 nm. ثم ، وذلك باستخدام منحني المعايرة ، وحساب محتوي البروتين من الميتوكوندريا.
3. تقرير النزاهة غشاء الميتوكوندريا
ملاحظه: يتم تاكيد سلامه غشاء الميتوكوندريا من خلال قياس النشاط مالات ديجينداز (MDH) في الميتوكوندريا المعزولة قبل وبعد اضطراب الغشاء بواسطة تريتون X-100.
- تمييع الميتوكوندريا المتجانسة إلى 1 مغ/مل مع IB الباردة ووضعها في اثنين من أنابيب 1.5 mL (عاده 195 μL من الميتوكوندريا لكل أنبوب).
- أضافه 5 μL من 20 ٪ (v/v) تريتون X-100 (المخفف مع DW) إلى أنبوب واحد (كعنصر تحكم إيجابي لنشاط الانزيم الأقصى) و 5 μL من DW إلى أنبوب آخر (للسيطرة) تليها الاختلاط مع الركاب.
- احتضان الأنابيب لمده 10 دقيقه في حمام الماء الدافئ تعيين في 30 درجه مئوية.
- بيليه الميتوكوندريا بواسطة طرد من الأنابيب في دوار زاوية ثابته في 16,000 x g و 4 درجه مئوية لمده 15 دقيقه.
- بعناية جمع المواد الخارقة الناتجة لتهدئه نشاط MDH الميتوكوندريا باستخدام المقايسة الطيفية القياسية الموصوفة في القسم التالي.
- حساب سلامه غشاء الميتوكوندريا علي النحو التالي:
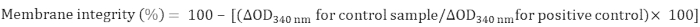
4. تحديد نشاط MDH
ملاحظه: تم قياس نشاط MDH فوتومتر كما هو موصوف من قبل Sottocasa et al.17.
- اعداد حلول لفحص النشاط MDH
- اعداد 50 mM تريس-HCl الحل (pH = 7.5): اعداد 7.9 ملغ/مل محلول في DW باستخدام تريس-HCl ، وضبط درجه الحموضة إلى 7.5 في 25 ° c مع 1.0 م NaOH.
- اعداد محلول اوكسالواسيتاتي 50 mM: اعداد 6.6 mg/mL محلول باستخدام اوكسالوخلات في تريس-HCl.
ملاحظه: هذا الحل غير مستقر مره واحده في الحل ويجب ان يتم اعداده مباشره قبل الاستخدام. - اعداد حل 10 مم β-NADH: اعداد 7.81 mg/mL محلول باستخدام β-NADH في تريس-HCl.
- تحديد نشاط MDH
ملاحظه: تركيزات الفحص النهائي في خليط التفاعل 1.0 mL هي 50 مم تريس-HCl ، 5 ملم اوكسالوخلات ، و 0.1 مم β-NADH.- تعيين مقياس الطيف إلى 25 درجه مئوية و 340 نانومتر. ماصه 890 μl تريس-HCl العازلة ، 100 μl من محلول اوكسالوخلات ، و 10 μl من محلول nadh إلى كوفيت فارغه و 880 μl تريس-HCl العازلة ، 100 μl من محلول اوكسالوخلات ، و 10 μl من محلول nadh إلى كوفيت عينه.
- احتضان الcuvettes في مقياس الطيف الطيفي لمده 3 – 4 دقائق والاشاره ضد الفراغ.
- ثم أضافه 10 μL من الخالط الميتوكوندريا (1 مغ/مل) إلى cuvette عينه ، مزيج علي الفور عن طريق عكس ، وسجل الانخفاضات في الامتصاص بسبب أكسده NADH في 340 nm لمده 1 دقيقه.
5. في المختبر α-synuclein, الانسولين البقري, وتشكيل الليفي هيويل
- اعداد البروتين
- α-synuclein:
ملاحظه: يتم تنفيذ التعبير وتنقيه المؤتلف α-synuclein كما وصفها Hoyer et al.18 مع بعض التعديلات ، ويتم تاكيد نقاء α-synuclein من قبل SDS-PAGE.- ديلايز تنقيه α-synuclein بين عشيه وضحيها ضد الفوسفات-مخزنه المالحة (تلفزيوني).
- تحديد تركيز البروتين باستخدام معامل الانقراض من 5600 M-1 سم-1 في 275 nm19.
- بروتين aliquots في أنابيب 1.5 mL وتخزين في-80 درجه مئوية حتى الاستخدام.
- الانسولين البقري و هيول:
- توفير كل من الانسولين البقري و هيول.
- حل كل بروتين في 50 mM العازلة الجليسين (pH = 1.6 ؛ ضبط درجه الحموضة مع حمض الهيدروكلوريك).
- تحديد الانسولين البقري والتركيز المحفور باستخدام معامل الانقراض من 1.0 و 2.63 ل 1.0 mg/mL في 276 nm و 280 nm ، علي التوالي20،21.
- α-synuclein:
- تحريض الرجفان اميلويد
- اعداد حلول لرجفان اميلويد:
- اعداد ثيوفلافين T (ThT) العازلة: تزن 0.3 غرام من الجناح2بو4 وتذوب في 80 مل من DW ، وضبط درجه الحموضة إلى 6.5 ، وزيادة حجم إلى 100 مل عن طريق أضافه DW.
- اعداد حل الأسهم ThT (5 ملم): تزن 1.6 ملغ من ThT وتذوب في 1 مل من العازلة ThT ، تمر من خلال ورقه فلتر 0.22 μm ، والابتعاد عن الضوء في 4 درجه مئوية حتى الاستخدام.
ملاحظه: يمكن تخزين هذا الحل في 4 درجه مئوية لمده تصل إلى 4 أسابيع. - اعداد حل ThT (1 مم): أضافه 200 μL من حل الأسهم ThT (5 مم) إلى 800 μL من المخزن المؤقت ThT.
ملاحظه: يمكن تخزين هذا الحل في 4 درجه مئوية لمده تصل إلى أسبوع واحد.
- في المختبر α-synuclein تشكيل الورم الليفي اميلويد:
- أضافه قسامات (294 μl) من محلول البروتين (200 μM) و 6 μl من محلول tht (1 ملم) إلى أنابيب 1.5 mL تليها التحريك.
- احتضان الأنابيب في ثيرموميكسير في 37 درجه مئوية تحت التحريك المستمر في 800 دوره في الدقيقة لمده 4 أيام.
- تاخذ قسامات (10 μl) من العينات المحتضنة بعد فترات زمنيه منتظمة وأضافه 490 μl من العازلة tht ، مختلطة تماما ، واحتضان لمده 5 دقائق في RT.
- تعيين الاثاره والانبعاثات عرض الشق كما 5 نانومتر و 10 نانومتر ، علي التوالي ، وقياس الفلورية ThT عن طريق الاثاره في 440 nm والانبعاثات في 485 nm باستخدام مقياس الطيف فلوري.
- في المختبر البقري الانسولين اميلويد تشكيل الفيريل:
- أضافه 637 μL من محلول البروتين (250 μM) إلى أنبوب 1.5 mL. ثم أضف 13 μL من محلول ThT (1 مم) متبوعا بالتحريك.
- أضافه قسامات (200 μl) من محلول البروتين (250 μm) التي تحتوي علي 20 μm tht إلى كل بئر من لوحه واضحة القاع 96 جيدا وختم لوحه مع الشريط الكريستال واضحة الختم.
- تحميل لوحه في القارئ لوحه مضان واحتضان في 57 درجه مئوية دون الانفعالات.
- قياس ThT مضان في فترات 30 دقيقه ، مع الاثاره في 440 nm والانبعاثات في 485 nm ، ل 12 ح.
ملاحظه: هز اللوحة لمده 5 ليالي قبل كل قياس.
- في المختبر التشكيل الليفي اميلويد فيسيل:
- أضافه قسامات (200 μl) من محلول البروتين) 1 ملم) التي تحتوي علي 20 μM tht إلى كل بئر من لوحه واضحة القاع 96 جيدا وختم لوحه مع الشريط الكريستال واضحة الختم.
- تحميل لوحه في القارئ لوحه مضان واحتضان في 57 درجه مئوية دون الانفعالات.
- قياس ThT مضان في فترات 2 ح ، مع الاثاره في 440 nm والانبعاثات في 485 nm ، لمده 4 أيام.
ملاحظه: بالنسبة لجميع البروتينات الثلاثة ، يتم تاكيد التشكيل الليفي اميلويد بواسطة المجهر القوه الذرية (الشكل 2B).
- اعداد حلول لرجفان اميلويد:
6. علاج الميتوكوندريا مع ألياف الليفية اميلويد ، وفحص الإفراج MDH ، وقياس روس
- حضانة الميتوكوندريا المعزولة مع الفيفيلز اميلويد
- بدوره علي الطرد المركزي وحمام المياه الدافئة وتعيين إلى 4 درجه مئوية و 30 درجه مئوية ، علي التوالي.
- باستخدام IF, تمييع الميتوكوندريا المتجانسة إلى تركيز نهائي من 1 مغ/مل.
- اعداد سلسلتين من أنابيب 1.5 mL التي تحتوي علي المتجانسات الميتوكوندريا (سلسله واحده لفحص الإفراج MDH واخر لقياس الروس الميتوكوندريا).
- أضافه الحبوب من ألياف الليفية الطازجة أو اميلويد من α-synuclein ، الانسولين البقري ، أو هيول (في التركيزات النهائية من 5 μM ، 10 μm ، 20 μM ، و 25 μM ؛ استخدام المخزن المؤقت أو الجليسين كعنصر تحكم) لمتجانس الميتوكوندريا (الحجم النهائي = 200 μl) (انظر الجدول 1 ، والجدول 3) متبوعا بتحريك المحلول برفق بواسطة ماصه.
ملاحظه: بالنسبة لفحص الإصدار MDH ، استخدم تريتون X-100 (عند تركيز نهائي من 0.5% [v/v]) كعنصر تحكم إيجابي للحد الأقصى لإفراز الانزيم. - حضن الأنابيب التي تحتوي علي تعليق الميتوكوندريا لمده 30 دقيقه في حمام الماء الدافئ تعيين إلى 30 درجه مئوية.
- قياس الإفراج عن MDH الميتوكوندريا والمحتوي ROS كما هو موضح في الأقسام 6.2 و 6.3.
- المتقدريه MDH الإفراج المقايسة
- أجهزه الطرد المركزي الخالطون الميتوكوندريا المحتضنة في 16,000 x g لمده 15 دقيقه ، ثم جمع بعناية supernatants الناتجة لتهدئه نشاط mdh الميتوكوندريا كما هو موضح في القسم 4.
- حساب الإفراج عن MDH كجزء من الحد الأقصى للتاثير (تريتون X-100) علي النحو التالي:
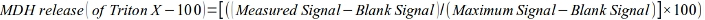
- قياس الروس المتقدريه
ملاحظه: يتم تحديد محتوي الروس الميتوكوندريا مع أكسده السلائف فلوتيروني الحساسة ديهيدروديتشلوروكاربوكسيفلوريسسين دياسيتات (dcfda)22.- اعداد حلول لقياس الروس المتقدريه. اعداد حل DCFDA 50 μM بحل في الميثانول (اعداد الطازجة) ومحلول سكسينات 200 mM عن طريق تذويب في DW.
- ماصه 191 μL من المتجانسات الميتوكوندريا المحتضنة لكل بئر من لوحه جيده 96 وأضافه 4 μL من 50 μM DCFDA (1 μM التركيز النهائي) و 5 μL من 200 mM سكسينات (5 مم التركيز النهائي).
- احتضان لوحه لمده 30 دقيقه في حمام الماء الدافئ تعيين في 30 درجه مئوية في حين أثاره بلطف.
- تحميل لوحه في القارئ لوحه مضان وقياس كثافة الفلورية ، مع الاثاره في 485 nm والانبعاثات في 530 nm.
7-التحليل الإحصائي
- اجراء جميع التجارب علي الأقل 2x أو 3x مع اختبارات ثلاثية الابعاد واجراء الاختبارات الاحصائيه المناسبة. هنا ، يتم عرض النتائج علي انها تعني ± SD ، وتم استخدام اختبار tالمقترن للطالب لحساب الاهميه الاحصائيه. واعتبرت القيم التي تقل قيمتها عن 0.01 و 0.05 ذات دلاله احصائيه (* p < 0.05 ؛ * * p < 0.01).
النتائج
يصف البروتوكول نموذجا لدراسة التفاعلات من الليفي اميلويد مع الميتوكوندريا الدماغ الفئران كنموذج البيولوجية في المختبر. لاعداد الميتوكوندريا ، تم استخدام 15 ٪ (v/v) كثافة التدرج المتوسطة لأزاله الميلين كتلوث الرئيسية للانسجه الدماغ14. كما هو مبين في الشكل 1a ، أنتجت
Discussion
وتدعم ثروة من النتائج التجريبية فرضيه ان السمية الخلوية للييفي المجاميع يرتبط بشكل كبير مع قدرتها علي التفاعل مع ويتخلل الاغشيه البيولوجية4,5. ومع ذلك ، تستند معظم البيانات علي الطبقات الدهنية الاصطناعية التي لا تعكس بالضرورة الخصائص الجوهرية لاغشيه بيولو...
Disclosures
وليس لدي المؤلفين ما يفصحون عنه.
Acknowledgements
وكان هذا العمل مدعوما بمنح من مجلس البحوث التابع لمعهد الدراسات العليا في العلوم الاساسيه ، زانجان ، إيران.
Materials
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorodihydrofluorescein diacetate | Sigma | 35845 | |
| Ammonium sulfate | Merck | 1012171000 | |
| Black 96-well plate | Corning | ||
| Black Clear-bottomed 96-well plate | Corning | ||
| Bovine insulin | Sigma | I6634 | |
| Bovine Serum Albumin (BSA) | Sigma | A2153 | |
| BSA essentially fatty acid-free | Sigma | A6003 | |
| Centrifuge | Sigma | ||
| Crystal clear sealing tape | Corning | ||
| CuSO4 | Sigma | 451657 | |
| Dialysis bag (cut off 2 KDa) | Sigma | D2272 | |
| Dounce homogenizer | Potter Elvehjem | ||
| EDTA | Sigma | E9884 | |
| Fluorescence plate reader | BioTek | ||
| Fluorescence spectrophotometer | Cary Eclipse VARIAN | ||
| Folin | Merck | F9252 | |
| Glycine | Sigma | G7126 | |
| Guillotine | Made in Iran | ||
| HCl | Merck | H1758 | |
| Hen Egg White Lysozyme (HEWL) | Sigma | L6876 | |
| Na2CO3 | Sigma | S7795 | |
| NaH2PO4 | Sigma | S7907 | |
| NaOH | Merck | S8045 | |
| Oxaloacetate | Sigma | O4126 | |
| Percoll | GE Healthcare | ||
| Phosphate Buffer Saline (PBS) | Sigma | CS0030 | |
| PMSF | Sigma | P7626 | |
| Potassium sodium tartrate | Sigma | 217255 | |
| Quartz cuvette | Sigma | ||
| Spectrophotometer | analytik jena | SPEKOL 2000 model | |
| Succinate | Sigma | S2378 | |
| Sucrose | Merck | 1076871000 | |
| Thermomixer | Eppendorph | ||
| Thioflavin T | Sigma | T3516 | |
| Tris-HCl | Merck | 1082191000 | |
| Triton X-100 | Sigma | T9284 | |
| Tryptone | QUELAB | ||
| Water bath | Memmert | ||
| Yeast Extract | QUELAB | ||
| β-NADH | Sigma | N8129 |
References
- Merlini, G., Bellotti, V. Molecular mechanisms of amyloidosis. New England Journal of Medicine. 349, 583-596 (2003).
- Berg, I. . Modeling amyloid disease in Drosophila melanogaster, Linköping Studies in Science and Technology Dissertation No. 1320. , (2010).
- Kagan, B. L., Uversky, V. N., Fink, A. L. Protein aggregation, ion channel formation, and membrane damage. Protein Misfolding, Aggregation, and Conformational Diseases. , 223-236 (2006).
- Demuro, A., et al. Calcium dysregulation and membrane disruption as a ubiquitous neurotoxic mechanism of soluble amyloid oligomers. The Journal of Biological Chemistry. 280, 17294-17300 (2005).
- Kayed, R., et al. Permeabilization of lipid bilayers is a common conformation-dependent activity of soluble amyloid oligomers in protein misfolding diseases. The Journal of Biological Chemistry. 279, 46363-46366 (2004).
- Manczak, M., Park, B. S., Jung, Y., Reddy, P. H. Differential expression of oxidative phosphorylation genes in patients with Alzheimer's disease: implications for early mitochondrial dysfunction and oxidative damage. Neuromolecular Medicine. 5, 147-162 (2004).
- Vila, M., Ramonet, D., Perier, C. Mitochondrial alterations in Parkinson's disease: new clues. Journal of Neurochemistry. 107, 317-328 (2008).
- Petersen, C. A. H., et al. The amyloid β-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 105, 13145-13150 (2008).
- Devi, L., Raghavendran, V., Prabhu, B. M., Avadhani, N. G., Anandatheerthavarada, H. K. Mitochondrial import and accumulation of α-synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain. The Journal of Biological Chemistry. 283, 9089-9100 (2008).
- Costa, V., Scorrano, L. Shaping the role of mitochondria in the pathogenesis of Huntington's disease. EMBO Journal. 31, 1853-1864 (2012).
- Vande Velde, C., Miller, T. M., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proceedings of the National Academy of Sciences of the United States of America. 105, 4022-4027 (2008).
- Kagan, B. L., Azimov, R., Azimova, R. Amyloid peptide channels. The Journal of Membrane Biology. 202, 1-10 (2004).
- Lashuel, H. A., Hartley, D., Petre, B. M., Walz, T., Lansbury, P. T. Neurodegenerative disease: amyloid pores from pathogenic mutations. Nature. 418, 291 (2002).
- Sims, N. R., Anderson, M. F. Isolation of mitochondria from rat brain using Percoll density gradient centrifugation. Nature Protocols. 3, 1228-1239 (2008).
- Ghobeh, M., et al. Interaction of Aβ (25-35) Fibrillation Products with Mitochondria: Effect of Small-Molecule Natural Products. Peptide Science. 102, 473-486 (2014).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry. 193, 265-275 (1951).
- Sottocasa, G. L., Kuylenstierna, B., Ernester, L., Bergstrand, A. Separation and some enzymatic properties of the inner and outer membrane of rat liver mitochondria. Methods in Enzymology. 10, 448-463 (1967).
- Hoyer, W., et al. Dependence of a-Synuclein Aggregate Morphology on Solution Conditions. Journal of Molecular Biology. 322, 383-393 (2002).
- Weinreb, P. H., et al. NACP, a protein implicated in Alzheimer's disease and learning, is natively unfolded. Biochemistry. 35, 13709-13715 (1996).
- Porter, R. R. Partition chromatography of insulin and other proteins. The Biochemical Journal. 53, 320-328 (1953).
- Goldberg, M. E., Rudolph, R., Jaenicke, R. A kinetic study of the competition between renaturation and aggregation during the refolding of denatured reduced egg white lysozyme. Biochemistry. 30, 2790-2797 (1991).
- Young, T. A., Cunningham, C. C., Bailey, S. M. Reactive oxygen species production by the mitochondrial respiratory chain in isolated rat hepatocytes and liver mitochondria: studies using myxothiazol. Archives of Biochemistry and Biophysics. 405, 65-72 (2002).
- Meratan, A. A., Ghasemi, A., Nemat-Gorgani, M. Membrane integrity and amyloid cytotoxicity: a model study involving mitochondria and lysozyme fibrillation products. Journal of Molecular Biology. 409, 826-838 (2011).
- Katebi, B., Mahdavimehr, M., Meratan, A. A., Ghasemi, A., Nemat-Gorgani, M. Protective effects of silibinin on insulin amyloid fibrillation, cytotoxicity and mitochondrial membrane damage. Archives of Biochemistry and Biophysics. 659, 22-32 (2018).
- Fink, A. L. The aggregation and fibrillation of alpha-synuclein. Accounts of Chemical Research. 39, 628-634 (2006).
- Diraviyam, K., Stahelin, R. V., Cho, W., Murray, D. Computer modeling of the membrane interaction of FYVE domains. Journal of Molecular Biology. 328, 721-736 (2003).
- Van Rooijen, B. D., Claessens, M., Subramaniam, V. Lipid bilayer disruption by oligomeric α-synuclein depends on bilayer charge and accessibility of the hydrophobic core. Biochimica et Biophysica Acta. 1788, 1271-1278 (2009).
- Kourie, J. I., Henry, C. L. Ion channel formation and membrane-linked pathologies of misfolded hydrophobic proteins: the role of dangerous unchaperoned molecules. Clinical and Experimental Pharmacology & Physiology. 29, 741-753 (2002).
- Bucciantini, M., et al. Inherent toxicity of aggregates implies a common mechanism for protein misfolding diseases. Nature. 416, 507-511 (2002).
- Bolognesi, B., et al. ANS binding reveals common features of cytotoxic amyloid species. ACS Chemical Biology. 5, 735-740 (2010).
- Posse, E., De Arcuri, B. F., Morero, R. D. Lysozyme interactions with phospholipid vesicles: relationships with fusion and release of aqueous content. Biochimica et Biophysica Acta. 1193, 101-106 (1994).
- Roqanian, S., et al. Polyphenols protect mitochondrial membrane against permeabilization induced by HEWL oligomers: possible mechanism of action. International Journal of Biological Macromolecules. 103, 709-720 (2017).
- Ulmer, T. S., Bax, A., Cole, N. B., Nussbaum, R. L. Structure and dynamics of micelle-bound human alphasynuclein. The Journal of Biological Chemistry. 280, 9595-9603 (2005).
- Stockl, M., Fischer, P., Wanker, E., Herrmann, A. Alpha-synuclein selectively binds to anionic phospholipids embedded in liquid-disordered domains. Journal of Molecular Biology. 375, 1394-1404 (2008).
- Devi, L., et al. Mitochondrial import and accumulation of α-synuclein impair complex I in human dopaminergic neuronal cultures and Parkinson disease brain. The Journal of Biological Chemistry. 283, 9089-9100 (2008).
- Ghio, S., Kamp, F., Cauchi, R., Giese, A., Vassallo, N. Interaction of α-synuclein with biomembranes in Parkinson's disease-role of cardiolipin. Progress in Lipid Research. 61, 73-82 (2016).
- Petersen, C. A. H., et al. The amyloid β-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of National Academy of Sciences of the United States of America. 105, 13145-13150 (2008).
- Costa, V., Scorrano, L. Shaping the role of mitochondria in the pathogenesis of Huntington's disease. EMBO Journal. 31, 1853-1864 (2012).
- Vande Velde, C., Miller, T. M., Cashman, N. R., Cleveland, D. W. Selective association of misfolded ALS-linked mutant SOD1 with the cytoplasmic face of mitochondria. Proceedings of National Academy of Sciences of the United States of America. 105, 4022-4027 (2008).
- Oladzad Abbasabadi, A., et al. Disruption of mitochondrial membrane integrity induced by amyloid aggregates arising from variants of SOD1. International Journal of Biological Macromolecules. 61, 212-217 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved