Method Article
بروتوكول كهربية عالمي وفعال للهندسة الوراثية للأعضاء المعدية المعوية
In This Article
Summary
يصف هذا البروتوكول طريقة كهربية فعالة لنقل أربعة كيانات أعضاء ية معوية مختلفة مع بلازميدات أكبر (إلى حد 10 كيلو ب. ). ويمكن أن يؤديها في غضون يوم واحد ولا تحتاج إلى إعداد مكثف أو خاصة، ومخازن الكهرباء كثيفة التكلفة.
Abstract
الكهربية هي طريقة شائعة للترانسفيكيشن مع أنواع مختلفة من الجزيئات عن طريق التصريف الكهربائي لغشاء البلازما. مع الاستخدام المتزايد للorganoids كوسيلة زراعة لمواد المريض الأولية في السنوات الأخيرة ، فإن طرق نقل فعالة لمكونات الهندسة الوراثية في هذا النظام الثقافي ثلاثي الأبعاد في حاجة إليها. خاصة بالنسبة للأعضاء ، تعتمد كفاءة التلاعب الجيني على تحويل ناجح. وهكذا، تم تطوير هذا البروتوكول لتسهيل الكهربية من organoids وإثبات وظائفها العالمية في كيانات مختلفة. تم بنجاح كهربية أمراض القولون والمستقيم والبنكرياس والكبد والأعضاء السرطانية في المعدة مع البلازميدات الصغيرة والكبيرة بالمقارنة. واستناداً إلى ناقلات ترميز GFP، تم تحديد كفاءة الإرسال بواسطة FACS. لا حاجة إلى إعداد واسع النطاق للخلايا أو مخازن كهربائية خاصة كثيفة التكلفة ، ويمكن تنفيذ البروتوكول في غضون يوم واحد.
Introduction
في السنوات الأخيرة ، تم تطوير نظام جديد لزراعة الخلايا ثلاثية الأبعاد ، يطلق عليه الأورجادات الاعضاء ، لمختلف الأنسجة الطبيعية والسرطانية. الأرغنويدات وظيفيا ومورفولوجيا قريبة جدا من نسيجها الأصلي. ويمكن توليدها من أنواع مختلفة، قابلة للتوسيع بسهولة، مستقرة وراثيا وقابلة للتعديل وراثيا، مما يجعلها نظاما نموذجيا مثاليا للتحقيقات الجينية1،2،3. تقنيات الهندسة الوراثية مثل CRISPR (متجمعة بانتظام Interspaced أقصر Palindromic يكرر)/Cas9 نظام تمكين التلاعب متنوعة. يمكن أن يتحقق اختيار المستنسخين من خلال شروط وسائل الإعلام المحددة ، على سبيل المثال ، عن طريق انسحاب WNT ligand لـ APC (أدينوماتوكيس بوليبواس كولي) استنساخ بالضربة القاضية4،5. بدلا ً من ذلك ، يجب إدخال علامات الاختيار عن طريق إصلاح موجه متجانس لمتجه الاستهداف6،7. يرجع ذلك إلى حقيقة أنه في كثير من الأحيان أكثر من البلازميد واحد يحتاج إلى إدخال، transfection كفاءة يصبح معلمة حاسمة. بالإضافة إلى ذلك، للحد من تأثيرات غير محددة خارج الهدف، تعبير عابر من Endonuclease Cas9 مرغوب فيه8.
الكهربية هي طريقة بسيطة نسبيا لنقل الخلايا مع الحمض النووي، الجيش الملكي النيبالي، البروتينات أو الجزيئات الكبيرة الأخرى. عن طريق البقول الكهربائية ، يصبح غشاء الخلية أكثر نفاذية ويسبب زيادة في التناول9. في بروتوكول electroporation نشرت سابقا من organoids القولون كفاءة 30 ٪ مع piggy-bac GFP (بروتين الفلورسنت الأخضر) تم التوصل إلى ناقلات (7.4 كيلو باء) في إجراء أربعة أيام10. تم تطوير البروتوكول التالي لتسهيل نقل فعال للأعضاء السرطانية أو الصحية مع ترميز البلازميدات الكبيرة لدليل واحد RNA (sgRNA) وتسلسل Endonuclease Cas9 (على سبيل المثال px458 كمتجه مع 9.3 كيلوبايت). يمكن إجراء عملية الكهربية بأكملها في غضون يوم واحد ، دون مخازن كهربية خاصة ، ومع كفاءة مماثلة على الأقل بين الأجهزة المعدية المعوية المختلفة ، وهي غدي القناة البنكرياسية (PDAC) ، سرطان القولون والمستقيم (CRC) ، cholangiocarcinoma (CCC) وسرطان المعدة (GC) organoids.
Protocol
تم الحصول على الموافقة على الأخلاقيات من اللجنة الأخلاقية في TU Dresden (#EK451122014).
1. الثقافة الأورجانية والاستعدادات قبل الكهربية
- إنشاء organoids عن طريق هضم الأنسجة كما هو موضح سابقا وتوسيعها مع كيانها المقابلة محددة وسيطة الثقافة في مصفوفة الطابق السفلي (نظرة عامة انظر الجدول 1 وجدول المواد)11،12،13،14،15،16،17.
ملاحظة: بالنسبة لعينات الأنسجة البشرية، من الضروري الحصول على الموافقة المستنيرة والموافقة على الدراسة من قبل لجنة أخلاقية. - الانسة الأولية 48-well لوحات في 37 درجة مئوية لبذر ما بعد الكهربية.
- إعداد المضادات الحيوية الأساسية المتوسطة w/o وكذلك المضادات الحيوية متوسطة الاستزراع العضوي الخاصة بالكيان (انظر الجدول 1)بما في ذلك 10 ميكرومتر Y-27632 و3 ميكرومتر CHIR99021.
ملاحظة: إن سحب المضادات الحيوية مهم للحد من الآثار السامة. Y-27632 وCHIR99021 تحسين استعادة الخلايا10. -
إعداد الأرغن (انظر الشكل 1)
- زراعة 5 آبار من organoids في لوحة 48-well لكل عينة electroporation في وسط الثقافة.
ملاحظة: يجب استخدام الأجهزة الاعضاء التكاثرية (حوالي 2-3 أيام بعد التقسيم الأخير). - إعداد 230 ميكرولتر من كاشف الانفصام (انظر جدول المواد)بما في ذلك 10 ميكرومتر Y-27632 لكل بئر.
- إزالة الوسط الثقافة من كل بئر وفصلها organoids ميكانيكيا في 230 ميكرولتر من خليط الانفصام المعدة. تجمع 5 الآبار لكل عينة electroporation في واحد 15 مل أنبوب.
- مزيج من قبل دوامة واحتضان لمدة 5-15 دقيقة في 37 درجة مئوية حتى مجموعات من 10-15 الخلايا تحدث. لذلك ، تحقق من التفكك مجهريًا. وقف الهضم عن طريق إضافة القاعدية متوسطة ث / س المضادات الحيوية تصل إلى 10 مل.
ملاحظة: هذه الخطوة حرجة جداً! سيتم تقليل كفاءة الكهربية ، عندما تكون الحضانة قصيرة جدًا ، ولكن الهضم الطويل سيقلل من القدرة على البقاء على قيد الحياة. - الطرد المركزي في 450 × ز لمدة 5 دقيقة في درجة حرارة الغرفة، وتجاهل supernatant وغسل مرتين مع 4 مل من المخزن الكهربائي العازلة (انظر جدول المواد).
- زراعة 5 آبار من organoids في لوحة 48-well لكل عينة electroporation في وسط الثقافة.
2- الكهربية
ملاحظة: تم تطوير البروتوكول التالي للأجهزة الكهربائية قادرة على موجات مربعة وفصل poring ونقل تسلسل نبض (انظر الشكل 2). اختياريا، يمكن قياس قيم المعاوقة وكذلك الفولتية والتيارات والطاقات المنقولة إلى العينة كتحكم في التجارب القابلة للتكرار.
- إعادة تعليق بيليه عضوي في 100 ميكرولتر من المخزن الكهربائي (انظر جدول المواد)التي تحتوي على 30 ميكروغرام من الحمض النووي البلازميد.
ملاحظة: ينبغي أن يتجاوز تركيز الحمض النووي البلازميد المستخدم 5 ميكروغرام/ميكرولتر للحصول على تركيز ملحي مثالي أثناء عملية الكهربية. لذلك ، يوصى بمجموعات maxi البلازمية الخالية من الإنطاب (انظر جدول المواد)لإعداد النواقل. ويمكن استخدام كمية إجمالية تصل إلى 45 ميكروغرام من الحمض النووي دون آثار السامة للخلايا. - الاستغناء عن خليط كامل DNA-organoid في كوفيت electroporation مع عرض الفجوة 2 ملم دون إنتاج فقاعات الهواء.
- تعيين معلمات الكهربية وفقا لفوجي وآخرون10 (انظر الجدول 2، الشكل 2).
- مزيج الخلايا قليلا دون رغوة عن طريق النقر على الكوفيت بإصبع. ضع الكوفيت في غرفة الكوفيت
- اضغط على زر الكتروبورات ودوّن قيمة المعاوقة.
ملاحظة: أظهرت مقاومة بين 30-40 درجة أفضل النتائج. بشكل عام، يجب أن يكون في النطاق بين 30-55 درجة. إذا لم يكن هذا هو الحال، يرجى السيطرة على الجوانب التالية: عرض الفجوة من كفيت المستخدمة، وصلات كابل من electroporator، فقاعات الهواء ممكن، الحجم الصحيح وتركيز الملح من خليط الكهربية. - اضغط على زر ابدأ لتنفيذ برنامج الكهربية والتحكم في قيم التيارات والفولتية والطاقات المعروضة.
ملاحظة: يجب أن تتوافق قيم الفولتية والتيارات والطاقات المقاسة مع معلمات الكهربية المحددة. وللمقارنة بين التجارب المتكررة، قد يكون من المفيد ملاحظة هذه البيانات. - بعد الكهربية، أضف على الفور 500 ميكرولتر من المضادات الحيوية متوسطة الثقافة (مع CHIR99021 و Y-27632؛ انظر الخطوة 1.3). مزيج عن طريق الأنابيب صعودا وهبوطا لفصل الرغوة البيضاء.
ملاحظة: تظهر الرغوة البيضاء بعد عملية الكهربية ويتم إرفاق عدد كبير من الخلايا بها. لذلك ، فإن الانفصام من ذلك مهم جدا لعدم فقدان الخلايا. - نقل العينة تماما من cuvette إلى أنبوب جديد 15 مل باستخدام ماصة تنتمي إلى الكفيت electroporation (انظر جدول المواد). يوصى بـ الإنتصار على الكوفيت مرة أخرى بوسيط القاعدي للحصول على الخلايا المتبقية.
- لتجديد الخلايا، احتضان لهم لمدة 40 دقيقة في درجة حرارة الغرفة.
3. البذر من الخلايا
- الطرد المركزي الخلايا في 450 × ز لمدة 5 دقيقة في درجة حرارة الغرفة وتجاهل supernatant.
- إعادة تعليق بيليه في 100 ميكرولتر من مصفوفة الطابق السفلي والبذور 20 ميكرولتر قطرات في لوحة 48 جيدا الدفء (انظر الخطوة 1.2). احتضان لمدة 10 دقيقة في 37 درجة مئوية للبلمرة وإضافة 250 ميكرولتر من الوسط الثقافة، والتي تستكمل مع Y-27632 وCHIR99021 حتى تقسيم المقبل من organoids نمت (حوالي 5-7 أيام).
4. تحديد كفاءة الترانزفيشن
ملاحظة: بشكل عام، يوصى بكهربة متجه يحمل علامة فلورية كتحكم إضافي في التغوط. تعتمد على علامة المختار ة ونضجه الكروموفوري سوف تكون مرئية في غضون حوالي 24-48 ح بعد transfection18.
- تحقق من الفلورسينس مجهريا بعد 24-48 ساعة في التحكم في transfection (انظر الشكل 4B).
-
مسح الخلايا المنشطة الفلورية (FACS)
- حصاد الخلايا على غرار الخطوة 1.4.2-1.4.4 وهضم حوالي 10-20 دقيقة حتى تكون هناك خلايا واحدة. أضف ما يصل إلى 10 مل من السالات العازلة للفوسفات (PBS).
- جهاز طرد مركزي في 450 × ز لمدة 5 دقيقة في درجة حرارة الغرفة وتجاهل supernatant.
- اختياريا للتمييز من الخلايا الحية: إعادة تعليق بيليه في 1 مل من الفوسفات العازلة المالحة (PBS) وإضافة جسم مضاد مناسب (انظر جدول المواد)أو يوديد بروبيديوم (PI). مزيج بعناية فائقة فقط عن طريق النقر واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام. يغسل مع 10 مل من PBS، والطرد المركزي وتجاهل supernatant.
- إعادة تعليق بيليه الخلية في 200 ميكرولتر من PBS واختياريا تصفية التعليق من خلال مصفاة خلية 100 ميكرومتر في أنبوب FACS.
- تحليل الخلايا بواسطة جهاز FACS باستخدام استراتيجية الجاتينغ المناسبة (انظر الشكل 3; الشكل 4A)وتحديد كفاءة نقل.
النتائج
تم تخطيط الأجزاء العضوية لأربعة كيانات سرطان مختلفة (CRC، CCC، PDAC، GC) 3 مرات على الأقل باستخدام 30 ميكروغرام من البلازميد الصغيرة (pCMV-EGFP، 4.2 كيلوبايت) أو بلازميد كبيرة (px458، 9.3 كيلوبايت). كلا المتجهات تحمل كاسيت GFP مما يسمح بتحديد كفاءة الترانزفيشن 48 ساعة بعد الكهربية عن طريق قياس التدفق الخلوي. لتحليل الخلايا الحية فقط ، تم إجراء تلطيخ مع جسم مضاد للحياة والموت قبل المسح الضوئي. تظهر استراتيجية الجاتينغ في الشكل 3.
في جميع الكيانات الاعضاء الأربعة تم نقل البلازميد بحجم 4.2 كيلو باء بكفاءة أعلى مقارنة بالأكبر (انظر الشكل 4). تم الوصول إلى الترانفس الأكثر كفاءة من البلازميد الصغيرة في organoids PDAC مع 92.1 ± 5.2 ٪ الخلايا الإيجابية GFP، في حين تم نقل البلازميد الكبيرة مع كفاءة 46.7 ± 3.7 ٪ (متوسط ± الانحراف المعياري، ن = 3). بالمقارنة مع organoids سرطان البنكرياس، كان البلازميد أكبر أكثر كفاءة تنتقل إلى organoids لجنة حقوق الطفل مع متوسط كفاءة 53.4 ± 11.7٪، في حين تم نقل البلازميد الصغيرة مع متوسط كفاءة 84.3 ± 5.8 ٪. وكان الكيان الأكثر صعوبة في نقل الأعضاء سرطان المعدة: لكل من البلازميد الكبيرة والصغيرة، تم التوصل إلى أدنى كفاءة transfection في هذا الكيان (32.3 ± 12.7٪ و 74.1 ± 5.5٪، على التوالي). وأظهرت الأجهزة CCC كفاءة تحويل متوسط من 83.0 ± 13.1 ٪ لبلازميد الصغيرة ولبلازميد كبيرة 39.5 ± 10.4 ٪ تم الحصول عليها.
كدليل على المفهوم ، تم كهربية organoids المعدة العادية البشرية مع ترميز البلازميد px458_Conc2 لCas9 ، GFP واثنين من sgRNAs التي تستهدف TP53. تم إصلاح فواصل حبلا مزدوجة Cas9 الناجمة عن exon 8 من قبل غير متجانسة النهاية الانضمام (NHEJ)، مما أدى إلى تحولات frameshifts وبالتالي خروج المغلوب من الجين (انظر الشكل التكميلي 1).
الجدول 1: تكوين الوسائط القاعدية وخلائط الهضم ووسائط الزراعة. الرجاء الضغط هنا لعرض هذا الملف (انقر على اليمين للتحميل).

الجدول 2: إعدادات الكهربية وفقا لفوجي وآخرون10.
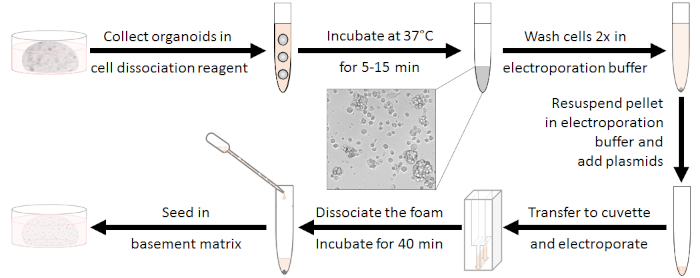
الشكل 1: سير العمل في إعداد الكهربة. أولاً، يجب فصل الأورجادات إلى مجموعات من 10-15 خلية والمضادات الحيوية يجب أن تغسل. بعد الكهربية الرغوة البيضاء يحتاج إلى فصل. يمكن أن تزرع الخلايا بعد تجديد لمدة 40 دقيقة في درجة حرارة الغرفة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
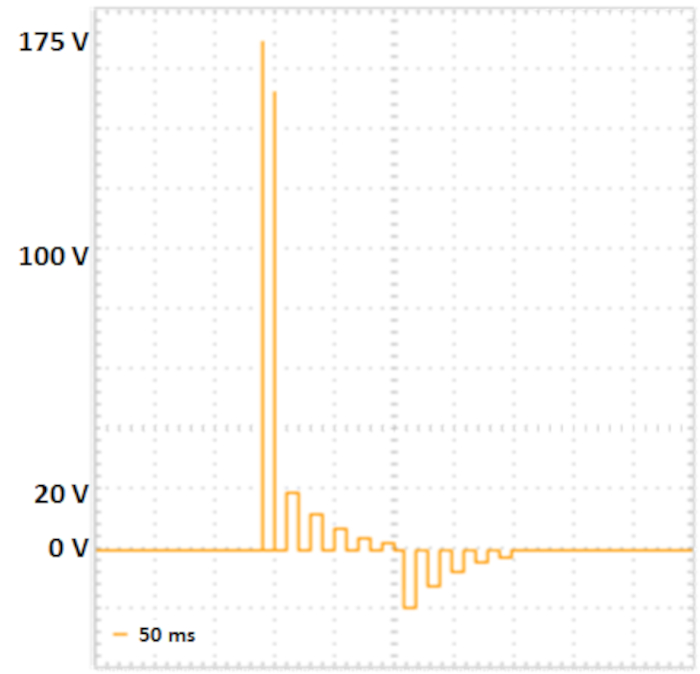
الشكل 2: الكهربية من خطوتين. اثنين من نبضات poring مع أعلى الجهد غير قصير المدة (175 V و 157.5 V، كل لمدة 5 مللي ثانية، وقفة لمدة 50 مللي ثانية، تلف الجهد 10٪) يؤدي إلى تشكيل المسام في أغشية الخلايا. نبضات النقل التالية توصل الحمض النووي إلى الخلايا: خمسة نبضات نقل إيجابية (مع 20 فولت، 12 V، 7.2 V، 4.32 V و 2,592 V، كل ل50 مللي ثانية، وقفة لمدة 50 مللي ثانية، تلف الجهد 40٪، تليها خمسة قطبية تبادلت نبضات النقل (مع 20 V، 12 V، 7.2 V، 4.32 V و 2،592 V، كل لمدة 50 مللي ثانية، وقفة لمدة 50 مللي ثانية، تلف الجهد 40٪. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
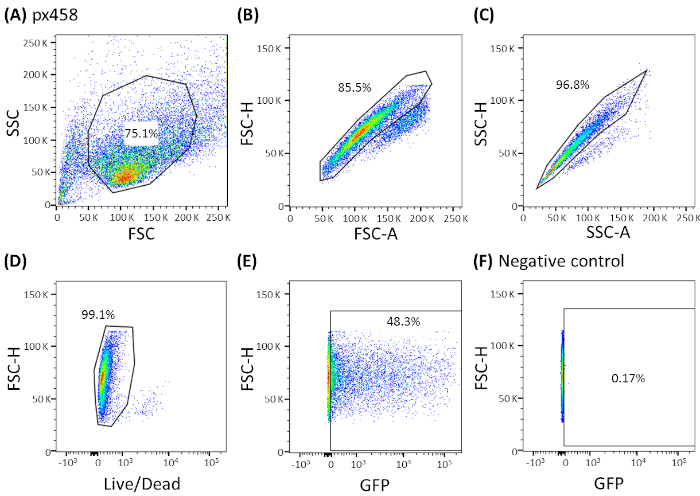
الشكل 3: استراتيجية الجاتينغ التمثيلية التي تظهرها الأجهزة الاعضاء CCC. تم تحليل جميع organoided electroporated بواسطة تدفق الخلايا 48 ساعة بعد electroporation. واستخدمت الخلايا الكهربية دون الحمض النووي البلازميد كضوابط سلبية. تم تعيين البوابات على النحو التالي:(A)التجة لشكل الخلية،(B،C)التجة للخلايا المفردة (التمييز المزدوج)،(D)التغّيل للخلايا الحية (ملطخة بجسم مضاد للخلايا المبرمجة) و(E،F)أخيراً لـ eGFP التعبير عن الخلايا (قناة FITC). FSC = مبعثر إلى الأمام؛ SSC = مبعثر الجانب. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
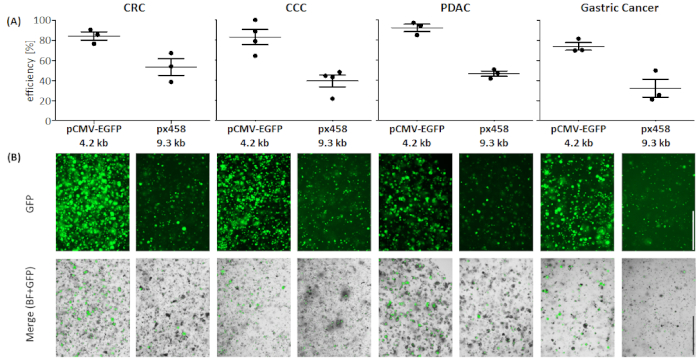
الشكل 4: كفاءة الكهربية لأربعة كيانات عضوية. (A)تحليل FACS (n = 34 ، يتم عرض متوسط الانحراف المعياري وكل قيمة واحدة) و (B)مقارنة بصرية بواسطة مجهر الفلورسينس. مقياس شريط = 1000 ميكرومتر. BF = حقل مشرق؛ CCC = cholangiocarcinoma; لجنة حقوق الطفل = سرطان القولون والمستقيم; GC = سرطان المعدة; PDAC = غدي القناة البنكرياسية. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
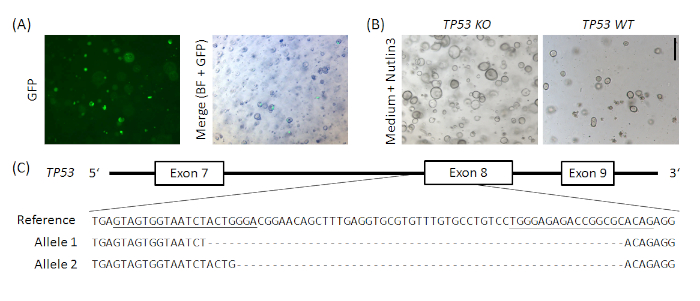
الشكل التكميلي 1: مثالية CRISPR/Cas9 القائم بالضربة القاضية من TP53 في organoids المعدة البشرية العادية. تم استنساخ px458_Conc2 متجه (انظر جدول المواد)عن طريق الجمع بين 2 gRNA concatemer ناقلات، هدية سخية من بون كيونغ كو19، مع px45820، مما أدى إلى ترميز البلازميد ل2 sgRNAs، Cas9 وGFP. تم إدخال اثنين من sgRNAs التي تستهدف TP53 في px458_Conc2 المتجه عن طريق استنساخ البوابة الذهبية (على غرار أندرسون رولف وآخرون.19). تم كهربة 10 ميكروغرام من الحمض النووي البلازميد في organoids المعدة العادية البشرية(A). تم اختيار المستنسخين من قبل إدارة Nutlin3(B)وتم تأكيد الضربة القاضية TP53 من خلال استنساخ TOPO TA وتسلسل الأليسال ، وهنا يظهر مثالي لاستنساخ واحد(C). يتم تسطير sgRNAs في المرجع. مقياس شريط = 200 ميكرومتر. BF = حقل مشرق. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هذا البروتوكول يعطي تعليمات مفصلة لكفاءة وسريعة وسهلة لأداء electroporation من الكيانات الاعضاء المختلفة. إضافة إلى الأعضاء الورم المقدمة من PDAC، لجنة حقوق الطفل، CCC وGC، فإنه يعمل بنجاح للorganoids المستمدة من الأنسجة السليمة كذلك. يمكن تنفيذ البروتوكول في غضون يوم واحد. في نشر بروتوكولات الترانزفان الاعضاء استمر الإجراء كله أربعة أيام بما في ذلك يومين من الاستعدادات مع أنواع مختلفة من وسائل الإعلام زراعة10،21. في بروتوكولنا لا يلزم معاملة مسبقة خاصة. عن طريق الغسيل مع المخزن الكهربائي قبل الكهربائي تم غسل مكونات المضادات الحيوية من وسائل الإعلام وتحقق تعديل التركيزات المالحة لقيم المعاوقة المثلى. ومع ذلك ، ينبغي النظر في بعض الجوانب الحرجة لنجاح electroporation :
الخلايا
في بروتوكول الكهربية من قبل فوجي وآخرون10 فمن المستحسن لفصل organoids إلى خلايا واحدة وتصفيتها من خلال مصفاة الخلية 20 ميكرومتر. في أيدينا الهضم إلى خلايا واحدة يقلل بشدة من البقاء على قيد الحياة من الخلايا. كما اقترح في Merenda وآخرون21، ونحن أيضا فصل organoids إلى مجموعات من 10-15 الخلايا ، ولم نتمكن من تحديد انخفاض الكفاءة مقارنة تفكك الخلية الواحدة. بعد الكهربية ، وهي خطوة مهمة جدا لفصل الرغوة البيضاء ، بحيث لا تضيع الخلايا المرفقة.
ل2D ثقافة الخلية، وقد تبين أن الوقت تجديد بعد الكهربائي لأكثر من 10 دقيقة تصل إلى 40 دقيقة يزيد من البقاء على قيد الحياة وكفاءة transfection خاصة من البلازميدات الكبيرة22. في تجارب الاختبار ، يمكن توثيق نفس الشيء للأعضاء ، مما يؤدي إلى خطوة حضانة من 40 دقيقة بعد الكهربية في هذا البروتوكول. من أجل زيادة الانتعاش من الكهربية، ونحن زرع لهم مع rho المرتبطة بروتين كيناز (روك) مثبط Y-27632 لمدة خمسة إلى سبعة أيام23. وبالمثل، فإن مكملات إضافية من الجليكوجين synthase كيناز 3 (GSK3) مثبط CHIR99021 يهدف إلى مساعدة الخلايا المفردة لاسترداد10.
اعدادات
واحدة من مزايا الكهربائي المستخدمهو أن يمكن قياس المعاوقة قبل الكهربية للظروف المثلى. وفقا للشركة المصنعة، يجب أن تكون قيم المعاوقة 30-55 درجة. في أيدينا، أظهرت قيم المعاوقة من 30-40 درجة الكفاءة المثلى. في تجربة أولية ، تم تنوع الفولتية المختلفة وقيم طول النبض لنبض التهام للعثور على النسبة المثلى من الكفاءة إلى البقاء على قيد الحياة. وباختصار، يمكننا أن نؤكد القيم الموصوفة لفوجي وآخرين10 في مختلف الكيانات الموصوفة هنا.
الحمض النووي
تم اختبار تأثير كميات مختلفة من الحمض النووي في التجارب الأولية حتى 45 ميكروغرام من الحمض النووي لكل عينة. لا يمكن الكشف عن أي آثار السامة للخلايا. تمت زيادة كفاءة الترانفسيففيشن بطريقة تعتمد على الجرعة مع التشبع > 30 ميكروغرام. لذلك، استخدمنا 30 ميكروغرام لكل عينة في البروتوكول النهائي، ولكن بالطبع يمكن زيادتها (على سبيل المثال، للكهربية لمزيد من البلازميدات بالتوازي). بالإضافة إلى ذلك ، يبدو أن نقاء وتركيز الحمض النووي مهم للغاية. وقد أظهر التركيز الذي يتجاوز 5 ميكروغرام/ميكرولتر كفاءة نقل مثالية.
كما هو متوقع، يمكن نقل البلازميد 9.3 كيلو باء مع كفاءة أقل من أصغر 4.2 كيلو باء plasmid (انظر الشكل 4). ومن المتوقع أن استخدام البلازميدات أكبر من 10 كيلو باء لزيادة خفض الكفاءة. للتطبيقات المستقبلية ، قد يكون من المثير للاهتمام اختبار الحمض النووي minicircle كناقل ، لأن هذه الناقلات الجينات تفتقر إلى العمود الفقري البكتيري للبلازميد مما يجعلها أصغر24. وينبغي أن يؤدي ذلك إلى تعزيز كفاءة الترانزفية. وعلاوة على ذلك، لتلاعب CRISPR القائم على organoids الكهربية المباشرة من sgRNAs ملزمة Cas9 كمركب ribonucleoprotein (RNP) يمكن أن يكون بديلا أو إضافة25.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر جوليان فوغروب، آن كريستين مِنيكي وماكس هايدوك على المساعدة التقنية الممتازة. تم توفير التمويل من قبل دويتشه كريبشيلف (رقم 111350 و 70112925) وشيلر ستيفتونغ (رقم 2014.104.1) وهيكتور ستيفتونغ (No M65.2) والاتحاد الأوروبي (ERC No 639050).
Materials
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 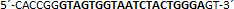 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 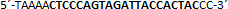 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 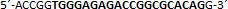 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 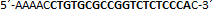 |
References
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved