Method Article
胃肠道有机体遗传工程的通用高效电穿孔协议
摘要
该协议描述了一种有效的电穿孔方法,用于转染四个不同胃肠道有机体实体,其质粒较大(范围为10 kB)。它可以在一天内执行,不需要大量准备或特殊的,成本密集型电穿孔缓冲器。
摘要
电穿孔是血浆膜电渗透对不同类型分子进行转染的常用方法。近年来,随着有机物作为原发性患者物质培养方法的日益应用,该3D培养系统中基因工程成分的有效转移方法也日益需要。特别是对于器官,基因操作的效率取决于成功的转染。因此,开发该协议是为了便利有机物的电穿孔,并证明其在不同实体中的通用功能。比较,人结肠直肠、胰腺癌、肝癌和胃癌有机体成功地用小质粒和大质粒电化。基于GFP编码向量,通过FACS测定转染效率。无需对电池进行大量制备,也无需使用成本高的特殊电穿孔缓冲液,且可在一天内执行该协议。
引言
近年来,为各种正常和癌变组织开发了一种新的3D细胞培养系统,称为有机体。有机物在功能和形态上非常接近其起源组织。它们可以产生从不同的物种,很容易扩展,基因组稳定和基因可修改,这使得他们一个理想的模型系统的基因研究1,2,3。遗传工程技术,如CRISPR(集中定期间隔短音段重复)/Cas9系统支持不同的操作。克隆的选择可以通过定义的介质条件来实现,例如,通过WNT配体提取APC(腺瘤多波司大肠杆菌)敲除克隆4,5。或者,选择标记必须通过同源定向修复靶向量6,7来引入。由于往往需要引入多个质粒,有效的转染成为一个关键参数。此外,为了减少非特异性脱靶效应,Cas9内糖的瞬态表达是理想的8。
电穿孔是一种用DNA、RNA、蛋白质或其他大分子转染细胞的一种相对简单的方法。通过电脉冲,细胞膜变得更易渗透,并导致增加的接受量9。在先前公布的结肠器官电穿孔协议中,用猪巴GFP(绿色荧光蛋白)表达载体(7.4 kB)在四天程序10中达到30%的效率。开发以下方案,以促进癌症或健康器官的有效转染,其大质粒编码为单导RNA(sgRNA)和Cas9内分酶序列(例如px458作为载体,9.3 kb)。整个电穿孔过程可以在一天内进行,无需特殊的电穿孔缓冲液,并且不同胃肠道有机体(即 PDAC)、结肠直肠癌(CRC)、胆囊癌(CCC)和胃癌(GC)有机体之间至少具有可比效率。
研究方案
道德认证已获得德累斯顿大学道德委员会(#EK451122014)。
1. 电穿孔前的组织培养与准备
- 如前所述,通过组织消化建立组织,并在基底矩阵中用相应的实体特定培养基培养基(概述见表1和材料表)11、12、13、14、15、16、17扩展它们。
注:对于人体组织样本,必须获得伦理委员会知情同意和批准研究。 - 在37°C下预热48孔板,用于电穿孔后播种。
- 制备无基基介质的抗生素以及实体特异性有机体培养基培养基(无抗生素(见表1),包括10μM Y-27632和3μM CHIR99021。
注:戒取抗生素对减少毒性影响非常重要。Y-27632和CHIR99021改善细胞恢复10。 -
器官的制备(见图1)
- 在培养基培养基中,每电穿孔样品在48孔板中培养5孔有机物。
注:应使用增殖性有机体(上次分裂后约2-3天)。 - 制备230 μL解散试剂(见材料表),包括每口10μM Y-27632。
- 从每个井中取出培养基,在230 μL的制备解离混合物中机械分离有机体。将每个电穿孔样品池 5 孔放入一个 15 mL 管中。
- 通过涡旋混合,在37°C下孵育5-15分钟,直到10-15个细胞团出现。因此,从微观上检查解散。通过添加基底培养基(不含10 mL)抗生素来停止消化。
注:此步骤非常关键!当孵育时间太短时,电穿孔效率会降低,但长期消化会降低生存能力。 - 在室温下以450 x g离心5分钟,丢弃上清液,用4 mL电穿孔缓冲液洗涤两次(见材料表)。
- 在培养基培养基中,每电穿孔样品在48孔板中培养5孔有机物。
2. 电穿孔
注:以下协议是为能够产生方波和分离的孔隙和传输脉冲序列的电孔器开发的(见图2)。或者,阻抗值以及传输到样品的电压、电流和能量可以作为可重复实验的控制进行测量。
- 在含有30μg质粒DNA的电穿孔缓冲液(见材料表)中重新悬浮有机物颗粒。
注:在电穿孔过程中,使用的质粒DNA浓度应超过5μg/μL,以获得最佳盐浓度。因此,建议使用不含内质粒maxi试剂盒(见材料表)制备载体。总共可使用高达45μg的DNA,无细胞毒性作用。 - 将完整的DNA-有机体混合物放入具有2毫米间隙宽度的电穿孔比质器中,而不会产生气泡。
- 根据 Fujii 等人10设置电穿孔参数(参见表2,图 2)。
- 用手指轻触比色皿,稍微混合细胞,而不会发泡。将比色皿放入比色皿室。
- 按电波器的 + 按钮,记下阻抗值。
注: 30-40 Ω 之间的阻抗显示了最佳效果。通常,它应该在 30-55 Ω 之间。如果不是这样,请控制以下几个方面:使用的比色皿的间隙宽度、电波器的电缆连接、可能的气泡、电穿孔混合物的正确体积和盐浓度。 - 按"开始"按钮执行电穿孔程序并控制显示的电流、电压和能量的值。
注: 测量的电压、电流和能量的值应对应于设定的电穿孔参数。对于重复实验的比较,注意这些数据会很有帮助。 - 电穿孔后,立即加入500 μL的培养基,不含抗生素(使用CHIR99021和Y-27632;参见步骤1.3)。通过上下移液混合,以分离白色泡沫。
注:在电穿孔过程后出现白色泡沫,并附着大量电池。因此,分离它是非常重要的,不失去细胞。 - 使用属于电穿孔的移液器将样品从比色皿完全转移到新的 15 mL 管中(参见材料表)。建议再次用基底培养基使比色皿下火,以获得剩余的细胞。
- 为了再生细胞,在室温下孵育40分钟。
3. 细胞播种
- 在室温下,在450 x g下将细胞离心5分钟,并丢弃上清液。
- 在基底基质的100 μL中重新悬浮颗粒,将种子20μL滴在预热的48孔板中(参见步骤1.2)。在37°C下孵育10分钟,用于聚合,加入250μL培养基,辅以Y-27632和CHIR99021,直到下一次分裂生长的有机物(约5-7天)。
4. 转化效率的确定
注:通常,建议电化携带荧光标记的载体作为额外的转染控制。取决于所选的标记及其染色体成熟荧光将在转染后24-48小时左右可见。
- 在转染控制中检查24-48小时后的荧光(参见图4B)。
-
荧光活细胞扫描 (FACS)
- 收获与步骤1.4.2-1.4.4类似的细胞,消化10-20分钟左右,直到有单个细胞。加10 mL的磷酸盐缓冲盐水 (PBS)。
- 在室温下以450 x g离心5分钟,并丢弃上清液。
- 选择性地用于鉴别活细胞:将颗粒重新悬浮在1 mL的磷酸盐缓冲盐水(PBS)中,并添加合适的抗体(见材料表)或碘化钠(PI)。只有在室内温度下在黑暗中轻敲和孵育30分钟,才能非常小心地混合。用10 mL的PBS清洗,离心机并丢弃上清液。
- 在 200 μL 的 PBS 中重新悬浮细胞颗粒,并选择性地通过 100 μm 细胞过滤器将悬浮液过滤到 FACS 管中。
- 使用适当的门控策略通过 FACS 机器分析单元(参见图 3;图4A)并确定转染效率。
结果
使用30微克的小质粒(pCMV-EGFP,4.2 kb)或大质粒(px458,9.3 kb),对四种不同癌症实体(CRC、CCC、PDAC、GC)的有机体进行电镀至少3次。两种载体均带有GFP盒式磁带,通过流式细胞测定电穿孔后可测定转染效率48小时。只分析活细胞,在进行扫描前用死性抗体染色。浇注策略如图3所示。
在所有四个有机体实体中,4.2 kB 大小的质粒比较大的质粒具有更高的效率转染(见图4)。在PDAC有机体中,GFP阳性细胞达到小质粒最有效的转染,而大质粒转染效率为46.7 ± 3.7%(均值= 标准差,n = 3)。与胰腺癌有机体相比,较大的质粒更有效地转染成CRC有机体,平均效率为53.4± 11.7%,而小质粒转染效率为84.3 ~5.8%。最难转染的实体是胃癌有机体:对于大质粒和小质粒,该实体的转染效率最低(分别为32.3 ± 12.7% 和 74.1 ± 5.5%)。CCC有机物对小质粒和大质粒的平均转染效率为83.0 ± 13.1%,大质粒为39.5 ± 10.4%。
作为概念的证明,人类正常的胃类化合物被电化与px458_Conc2质粒编码的Cas9,GFP和两个sgRNA针对TP53。在外源8上由Cas9诱导的双链断裂通过非同源端连接(NHEJ)修复,导致帧移位,进而对基因进行敲除(参见补充图1)。
表1:基底培养基、消化混合物和栽培介质的组成。请点击此处查看此文件(右键单击下载)。

表2:根据藤井等人10的电穿孔设置。
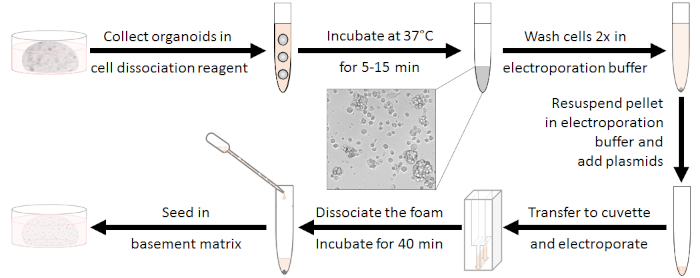
图1:电穿孔制备工作流程。首先,有机物应该与10-15个细胞的簇分离,抗生素应该被冲走。电穿孔后,白色泡沫需要分离。细胞在室温下再生40分钟后可以播种。请点击此处查看此图的较大版本。
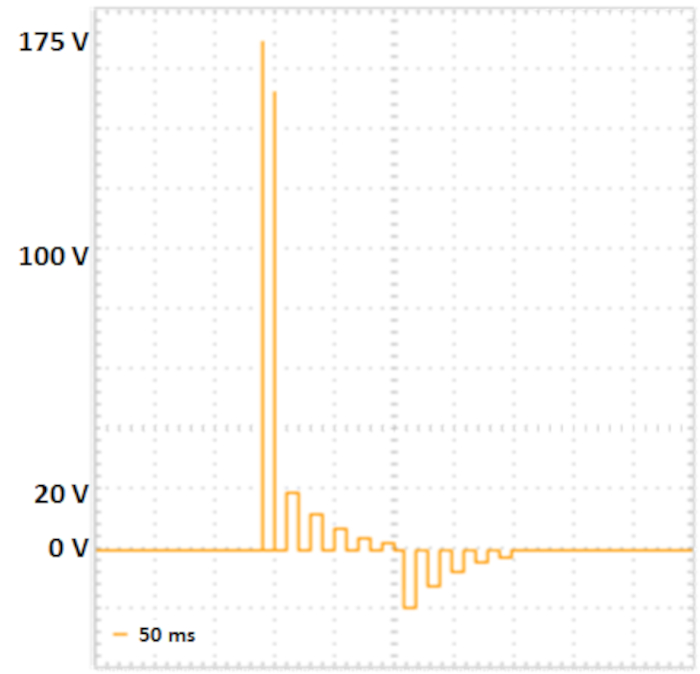
图2:两步电穿孔。两个电压高、持续时间较短的孔隙脉冲(175 V 和 157.5 V,每个脉冲 5 毫秒,暂停 50 ms,电压衰减 10%)导致细胞膜中毛孔的形成。以下转移脉冲将 DNA 输送到细胞中:五个正转移脉冲( 20 V , 12 V 、 7 . 2 V 、 4 . 32 V 和 2 , 592 V ,每张为 50 毫秒,暂停为 50 ms ,电压衰减 40% ),然后是 5 个极换传输脉冲( 20 V 、 12 V 、 7 . 2 V 、 4 . 32 V 和 2 , 592 V ,每个为 50 ms ,暂停为 50 ms ,电压衰减 40% )。请点击此处查看此图的较大版本。
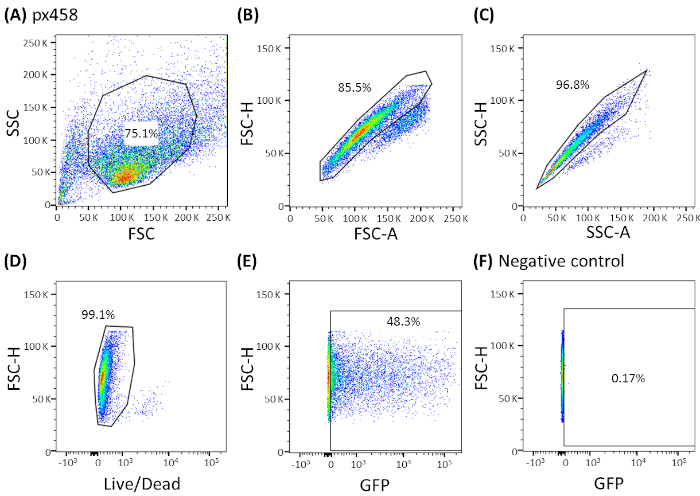
图3:CCC有机体显示的代表性门控策略。电穿孔后,所有电穿孔有机物均通过流式细胞测定48小时进行分析。没有质粒DNA电化的细胞被用作阴性对照。门被设置为: (A) 单细胞形状的浇注, (B,C) 单细胞的门控 (双色歧视), (D) 活细胞的门控 (与凋亡细胞的抗体染色) 和 (E,F) 最后门门的 eGFP 表达细胞 (FITC 通道).FSC = 正向散射;SSC = 侧散射。请点击此处查看此图的较大版本。
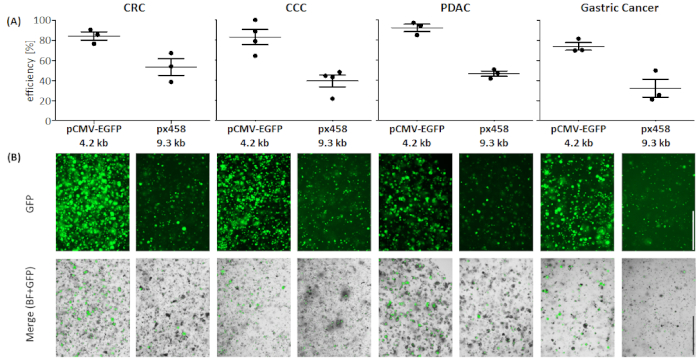
图4:四个有机体实体的电穿孔效率。(A) FACS 分析 (n = 34,平均标准差和每个单个值显示) 和 (B) 通过荧光显微镜进行视觉比较。刻度条 = 1,000 μm. BF = 亮场;CCC = 胆囊癌;CRC = 结肠直肠癌;GC = 胃癌;PDAC = 胰腺导管腺癌。请点击此处查看此图的较大版本。
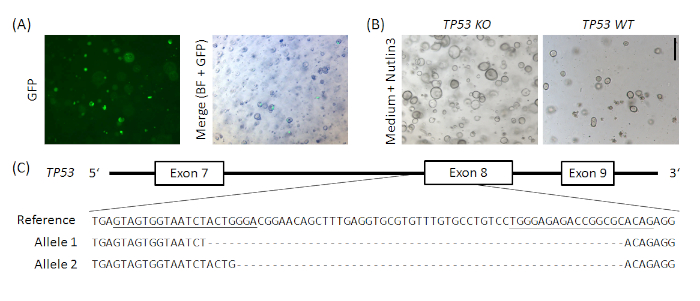
补充图1:在正常人胃器官中,基于TP53的示范性CRISPR/Cas9敲除。px458_Conc2载体(见材料表)通过结合2gRNA串联载体进行克隆,这是邦-金古19的慷慨礼物,与px45820相结合,从而对2个sgRNA、Cas9和GFP进行了质粒编码。金门克隆在px458_Conc2载体中引入了两种针对TP53的sgRNA(类似于安徒森-罗尔夫等人19)。10 μg质粒DNA在人类正常胃器官(A) 中电镀克隆由Nutlin3管理(B)选择,TP53敲除被TOPO TA克隆和等位基因测序确认,这里示范一个克隆(C)。sgRNA 在引用中带有下划线。刻度条 = 200 μm BF = 亮场。请点击此处查看此图的较大版本。
讨论
该协议为高效、快速、简便地对不同有机体实体进行电穿孔提供了详细说明。除了来自PDAC、CRC、CCC和GC的肿瘤有机体外,它还成功地用于从健康组织衍生的有机体。该协议可在一天内执行。在公布的有机物转染方案中,整个过程历时四天,包括两天的准备,用不同类型的培养媒介10,21。在我们的协议中,不需要特殊的预处理。通过在电穿孔前用电穿孔缓冲液清洗,将介质的抗生素成分洗掉,并调整盐碱浓度,以实现最佳阻抗值。然而,成功的电穿孔应考虑一些关键方面:
细胞
在Fujii等人10的电穿孔协议中,建议将有机物分离到单个细胞中,并通过20μm细胞滤网过滤它们。在我们的手中消化到单个细胞会强烈地降低细胞的生存能力。正如Merenda等人21条所建议的那样,我们还将有机物分离到10-15个细胞的簇中,并且不能确定与单细胞分离相比效率降低。电穿孔后,分离白色泡沫是非常重要的一步,这样不会丢失任何附着的细胞。
对于2D细胞培养,已经表明,电穿孔超过10分钟至40分钟的再生时间可提高生存能力和转染效率,特别是大质粒22。在测试实验中,对有机体可以记录同样的情况,导致本协议中电穿孔后40分钟的孵育步骤。为了增加电穿孔的回收率,我们用Rho相关蛋白激酶(ROCK)抑制剂Y-27632培养它们5至7天23。同样,补充糖原合成酶激酶3(GSK3)抑制剂CHIR99021是为了帮助单个细胞恢复10。
设置
使用的电波器的优点之一是,阻抗可以在电穿孔之前测量,以实现最佳条件。根据制造商的说法,阻抗值应为 30-55 Ω。在我们手中,30-40 Ω 的阻抗值显示了最佳效率。在初步实验中,对孔隙脉冲的不同电压和脉冲长度值进行了变化,以找到效率与生存能力的最佳比例。总之,我们可以确认藤井等人10在本文描述的不同实体中描述的数值。
Dna
在初步实验中,对不同DNA量的影响进行了测试,每个样本的DNA含量高达45微克。检测出细胞毒性作用。转染效率以剂量依赖方式提高,饱和度>30 μg。因此,我们在最终协议中使用了每个样品30μg,但当然可以增加(例如,用于并行电穿孔)。此外,DNA的纯度和浓度似乎非常重要。浓度超过5μg/μL,显示了最佳的转染效率。
正如预期的那样,9.3 kB 质粒可以转染,其效率低于较小的 4.2 kB 质粒(参见图 4)。预计使用大于10 kB的质粒会进一步降低效率。对于未来的应用,测试小圆DNA作为载体可能很有趣,因为这些基因载体缺乏质粒的细菌骨干,这使得它们更小24。这应导致更高的转染效率。此外,对于基于CRISPR的有机物操作,直接电穿孔的sgRNA结合到Cas9作为核糖核蛋白(RNP)复合物可以是一个替代或添加25。
披露声明
作者没有什么可透露的。
致谢
我们感谢朱利安·福格鲁、安-克里斯汀·梅内克和马克斯·海杜克的出色技术援助。资金由德国克雷布西尔夫(No 111350和70112925)、Sander Stiftung(No 2014.104.1)、赫克托·斯蒂夫通(No M65.2)和欧盟(ERC No 639050)提供。
材料
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 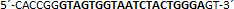 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 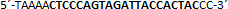 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 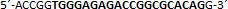 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 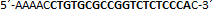 |
参考文献
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。