Method Article
Универсальный и эффективный протокол электропорации для генной инженерии гастроэнтепробий органоидов
В этой статье
Резюме
Этот протокол описывает эффективный метод электропорации для трансфекции четырех различных органоидов желудочно-кишечного тракта с более крупными плазмидами (в размере 10 кВ). Она может быть выполнена в течение одного дня и не нуждается в обширной подготовке или специальных, затратных электропорация буферов.
Аннотация
Электропорация является распространенным методом трансфекции с различными видами молекул путем электрической пермяки плазменной мембраны. С увеличением использования органоидов в качестве культивирования метода первичного материала пациента в последние годы, эффективные методы передачи компонентов для генной инженерии в этой системе 3D культуры нуждаются. Особенно для органоидов эффективность генетических манипуляций зависит от успешной трансфекции. Таким образом, этот протокол был разработан для облегчения электропорации органоидов и для доказательства его универсальной функциональности в различных сущностях. Человеческие колоректальные, поджелудочные, печеночные и раковые органоиды желудка были успешно электропоранированы с малыми и большими плазмидами в сравнении. На основе векторов кодирования GFP эффективность трансфекции определялась FACS. Нет необходимости в обширной подготовке клеток или специальных, затратоемких электропорных буферов, и протокол может быть выполнен в течение одного дня.
Введение
В последние годы, новая система 3D-клеточной культуры, называется органоидов, была разработана для различных нормальных и раковых тканей. Органоиды функционально и морфологически очень близки к их ткани происхождения. Они могут быть получены из различных видов, легко расширяемые, геномно стабильны и генетически изменяемы, что делает их идеальной модельной системой для генетических исследований1,2,3. Методы генной инженерии, такие как CRISPR (кластерные регулярно межпространственные короткие палиндромные повторы)/Система Cas9 позволяют осуществлять разнообразные манипуляции. Выбор клонов может быть реализован по определенным медиа-условиям, например, путем вывода ЛИГАнд WNT для APC (Adenomatosis Polyposis Coli) нокаутклонов4,5. Кроме того, маркеры отбора должны быть введены гомологичным направленным ремонтом вектор таргетинга6,7. В связи с тем, что часто требуется внедрять более одного плазмида, эффективная трансфекция становится важнейшим параметром. Кроме того, чтобы уменьшить неспецифические вне целевых эффектов, переходное выражение cas9 эндонуклеазы желательно8.
Электропорация является сравнительно простым методом трансфектных клеток с ДНК, РНК, белками или другими макромолекулами. С помощью электрических импульсов, клеточная мембрана становится более проницаемой и вызывает увеличение поглощения9. В ранее опубликованном протоколе электропорации органов толстой кишки 30% эффективность с поросенок-бак GFP (зеленый флуоресцентный белок) выражая вектор (7.4 кB) была достигнута в четырехдневной процедуре10. Следующий протокол был разработан для облегчения эффективного трансфекции раковых или здоровых органоидов с большими плазмидами, кодируя для однонаправной РНК (sgRNA) и последовательности эндонуклеаза Cas9 (например, px458 как вектор с 9,3 кб). Весь процесс электропорации может быть выполнен в течение одного дня, без специальных буферов электропорации, и по крайней мере сопоставимых эффективности между различными желудочно-кишечных органоидов, а именно поджелудочной железы протоковой аденокарциномы (PDAC), колоректального рака (CRC), холангиокарцинома (CCC) и желудочного рака (ГК).
протокол
Разрешение на этику было получено от комитета по этике Дрездена (#EK451122014).
1. Органоидная культура и препараты перед электропорированием
- Установить органоиды по перевариванию тканей, как описано ранее, и расширить их с соответствующей сущности конкретной среды культуры в подвале матрицы (обзор см. Таблица 1 и Таблица материалов)11,12,13,14,15,16,17.
ПРИМЕЧАНИЕ: Для образцов тканей человека необходимо информированное согласие и одобрение исследования этическим комитетом. - Предопрогрейте 48-колодные пластины при 37 градусах Посева при 37 градусах по Цельсию для постэлектропорации.
- Подготовка базальных средних без антибиотиков, а также лица конкретных органоидных культуры среднего ж / о антибиотиков (см. Таблица 1) в том числе 10 МКм Y-27632 и 3 мкм CHIR99021.
ПРИМЕЧАНИЕ: Отмена антибиотиков имеет важное значение для уменьшения токсического воздействия. Y-27632 и CHIR99021 улучшение восстановления клеток10. -
Приготовление органоидов (см. рисунок 1)
- Выращивайте 5 скважин органоидов в 48-колодецной пластине на образец электропорации в культурной среде.
ПРИМЕЧАНИЕ: Пролиферативные органоиды должны быть использованы (около 2-3 дней после последнего расщепления). - Подготовьте 230 злицитационный реагент (см. Таблицу Материалов),в том числе 10 мкм Y-27632 на скважину.
- Удалите культурную среду из каждой скважины и механически разъедините органоиды в 230 злицы подготовленной диссоциационистской смеси. Бассейн 5 скважин на электропорацию образца в одну трубку 15 мл.
- Смешайте путем вихря и инкубировать в течение 5-15 мин при 37 градусах Цельсия, пока кластеры 10-15 клеток происходят. Поэтому проверьте диссоциационную микроскопию. Остановить пищеварение, добавив базальные средние антибиотики w/o до 10 мл.
ПРИМЕЧАНИЕ: Этот шаг очень важен! Эффективность электропорации будет снижена, когда инкубация слишком коротка, но длительное пищеварение снизит живучесть. - Центрифуга при температуре 450 х г в течение 5 мин при комнатной температуре, отбросьте супернатант и дважды промойте 4 мл электропоряционного буфера (см. Таблица материалов).
- Выращивайте 5 скважин органоидов в 48-колодецной пластине на образец электропорации в культурной среде.
2. Электропорация
ПРИМЕЧАНИЕ: Для электропороров, способных к квадратным волнам и разделенным последовательности пульса (см. рисунок 2),разработан следующий протокол. Дополнительно значения импедеданции, а также напряжения, токи и энергии, передаваемые в выборку, могут быть измерены как контроль для воспроизводимых экспериментов.
- Отрепетить органоидные гранулы в 100 зл и буферэлектроационных (см. Таблица материалов),содержащий 30 мкг плазмидной ДНК.
ПРИМЕЧАНИЕ: Концентрация используемой плазмидной ДНК должна превышать 5 мкг/Л для оптимальной концентрации соли в процессе электропорации. Поэтому для приготовления переносчиков рекомендуются эндофри-плазменные макси-наборы (см. Таблица материалов). Общее количество до 45 мкг ДНК может быть использовано без цитотоксического воздействия. - Распределите полную ДНК-органоидную смесь в кювет электропорации с шириной 2 мм, не производя пузырьков воздуха.
- Установите параметры электропорации в соответствии с Fujii et al.10 (см. Таблица 2, Рисунок 2).
- Смешайте клетки немного без вспенивания, нажав на кювет пальцем. Поместите кювет в камеру кювета.
- Нажмите кнопку электропоратора и сделайте заметку о значении импедеданса.
ПРИМЕЧАНИЕ: Импеданс между 30-40 и показал лучшие результаты. В общем, он должен находиться в диапазоне от 30-55 евро. Если это не так, пожалуйста, контролируйте следующие аспекты: ширина зазора используемого кветка, кабельные соединения электропорера, возможные пузырьки воздуха, правильный объем и концентрация соли смеси электропорации. - Нажмите кнопку «Пуск», чтобы выполнить программу электропорации и контролировать значения показанных токов, напряжений и энергий.
ПРИМЕЧАНИЕ: Значения измеренных напряжений, токов и энергий должны соответствовать установленным параметрам электропорации. Для сравнения повторных экспериментов, это может быть полезно отметить эти данные. - После электропорации немедленно добавляйте 500 зЛ культурных антибиотиков w/o (с CHIR99021 и Y-27632; см. шаг 1.3). Смешайте путем pipetting вверх и вниз, чтобы разъединить белую пену.
ПРИМЕЧАНИЕ: Белая пена появляется после процесса электропорации и значительное количество клеток прилагается к нему. Таким образом, диссоциация его очень важно для не потерять клетки. - Передача образца полностью из кювета в новую трубку 15 мл с помощью пипетки, принадлежащей к кювету электропорации (см. Таблица материалов). Промыть квет снова с базальной среды рекомендуется для получения оставшихся клеток.
- Для регенерации клеток инкубировать их в течение 40 минут при комнатной температуре.
3. Посев клеток
- Центрифуги клетки на 450 х г в течение 5 минут при комнатной температуре и отбросить супернатант.
- Повторите гранулы в 100 qL фундаментальной матрицы и семени 20 капель L в предварительно разогретой 48-хорошо пластины (см. шаг 1.2). Инкубировать в течение 10 мин при 37 градусах По Цельсия для полимеризации и добавить 250 кЛ культуры среды, которая дополняется Y-27632 и CHIR99021 до следующего расщепления выросли органоиды (около 5-7 дней).
4. Определение эффективности трансфекции
ПРИМЕЧАНИЕ: В целом, рекомендуется электропоратный вектор, несущий флуоресценционный маркер в качестве дополнительного контроля трансфекции. В зависимости от выбранного маркера и его созревания хромофора флуоресценция будет видна в пределах 24-48 ч после трансфекции18.
- Проверьте флуоресценцию микроскопически после 24-48 ч в трансфекционном контроле (см. рисунок 4B).
-
Флуоресцентное активированное сканирование клеток (FACS)
- Урожай клетки аналогично шаг 1.4.2-1.4.4 и переварить около 10-20 мин, пока Есть одиночные клетки. Добавьте до 10 мл фосфатно-буферизированного сольятого раствора (PBS).
- Центрифуга при температуре 450 х г в течение 5 мин при комнатной температуре и отбрасываете супернатант.
- Дополнительно для дискриминации живых клеток: Приостановить гранулы в 1 мл фосфат-буферизированного солей (PBS) и добавить подходящее антитело (см. Таблица материалов)или пропидий йодид (PI). Смешайте очень тщательно только нажав и инкубировать в течение 30 минут при комнатной температуре в темноте. Вымойте 10 мл PBS, центрифуги и отбросить супернатант.
- Приостановите действие клеточных гранул в 200 Л ПБС и дополнительно процедите подвеску через 100 мкм-ситечко в трубку FACS.
- Анализ клеток с помощью машины FACS с помощью соответствующей стратегии gating (см. Рисунок 3; Рисунок 4А) и определить эффективность трансфекции.
Результаты
Органоиды четырех различных онкологических образований (CRC, CCC, PDAC, GC) были электропоированы не менее 3 раз с использованием 30 мкг небольшой плазмиды (pCMV-EGFP, 4,2 кб) или большой плазмиды (px458, 9.3 кБ). Оба вектора несут кассету GFP, позволяющую определить эффективность трансфекции 48 ч после электропорации цитометрией потока. Анализировать только живые клетки, окрашивание антителами смерти жизни перед сканированием. Стратегия gating показана на рисунке 3.
Во всех четырех органоидных сущностях плазмида размером 4,2 кБ была трансинфицирована с более высокой эффективностью по сравнению с более крупной (см. рисунок 4). Наиболее эффективная трансфекция мелкой плазмиды была достигнута в органоидах PDAC с 92,1 и 5,2% Положительных клеток GFP, в то время как большая плазмида была трансинфицирована с эффективностью 46,7 и 3,7% (среднее стандартное отклонение, n No 3). По сравнению с органоидами рака поджелудочной железы, большая плазмида была более эффективно трансфицирована в органоиды CRC со средней эффективностью 53,4 и 11,7%, в то время как небольшая плазмида была трансинфицирована со средней эффективностью 84,3 и 5,8 %. Наиболее сложными для трансфекта были органоиды рака желудка: как для больших, так и для небольшой плазмиды, самая низкая эффективность трансфекции была достигнута в этом субъекте (32,3 и 12,7% и 74,1 и 5,5%, соответственно). Органоиды CCC показали среднее трансфекционную эффективность 83.0 и 13.1 % для малого плазмиды и для большой плазмиды 39.5 и 10.4% были получены.
В качестве доказательства концепции, нормальные органоиды желудка человека были электропоидированы с px458_Conc2 плазмид кодирования для Cas9, GFP и два sgRNAs ориентации TP53. Cas9-индуцированных двойных нитей перерывы на экзон 8 были отремонтированы не-гомологичное окончание (NHEJ), в результате чего frameshifts и, следовательно, нокаут гена (см. Дополнительная рисунок 1).
Таблица 1: Состав базальных носителей, смесей пищеварения и средств культивирования. Пожалуйста, нажмите здесь, чтобы просмотреть этот файл (Право нажмите, чтобы скачать).

Таблица 2: Настройки электропорации в соответствии с Fujii и др.10.
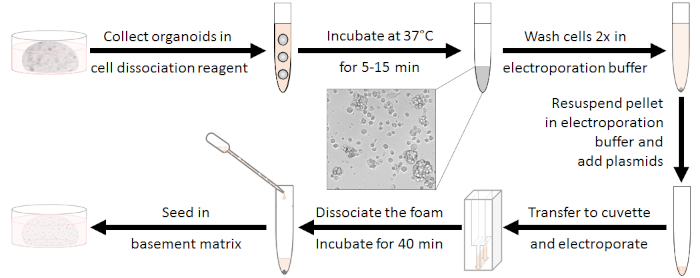
Рисунок 1: Рабочий процесс подготовки электропорации. Во-первых, органоиды должны быть разобщены с кластерами из 10-15 клеток и антибиотики должны быть вымываются. После электропорации белую пену необходимо разъединить. Клетки могут быть посеяны после регенерации в течение 40 минут при комнатной температуре. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
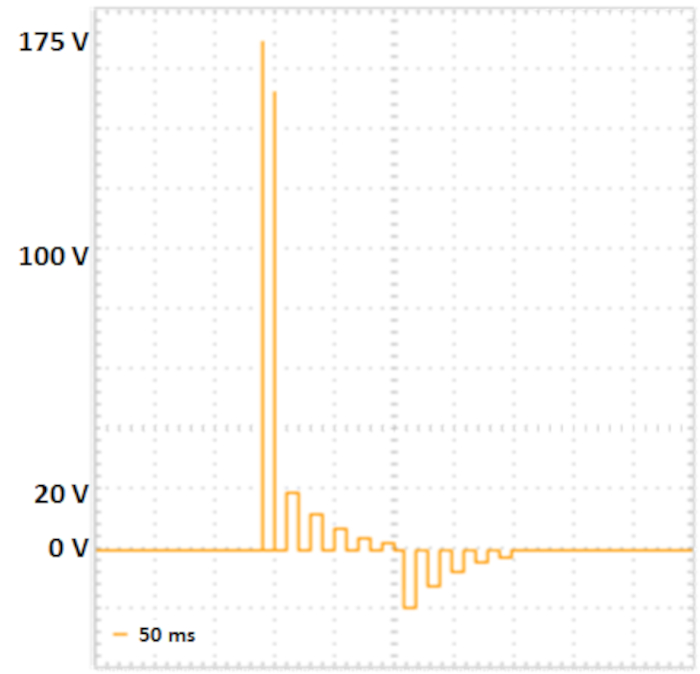
Рисунок 2: Двухступенчатая электропорация. Два poring импульса с более высоким напряжением и короткой продолжительностью (175 V и 157.5 V, каждый на 5 мс, пауза на 50 мс, распад напряжения 10%) привести к образованию пор в клеточных мембранах. Следующие импульсы передачи поставляют дна в клетки: 5 положительных ИМПы ульс перехода (с 20 V, 12 V, 7.2 V, 4.32 V и 2,592 V, каждый на 50 мс, пауза на 50 мс, распад напряжения 40%), а затем пять полярности обменялись импульсами передачи (с 20 V, 12 V, 7.2 V, 4.32 V и 2,592 V, каждый на 50 мс, пауза на 50 мс, напряжение распада 40%). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
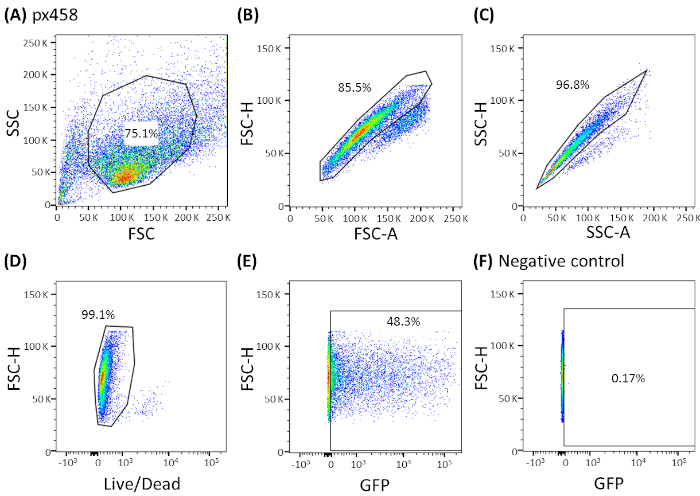
Рисунок 3: Представитель gating стратегии показано CCC органоидов. Все электропорированные органоиды были проанализированы цитометрией течения 48 h после электропорации. Клетки, электропозаливаемые без плазмидной ДНК, использовались в качестве отрицательного контроля. Ворота были установлены следующим образом: (A) gating для формы клетки, (B,C) gating для одиночных клеток (двойная дискриминация), (D) gating для живых клеток (окрашенных с антителом для апоптотические клетки) и (E,F) наконец gating для eGFP выражая клетки (FITC канал). FSC - рассеяние вперед; SSC и боковой рассеяние. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
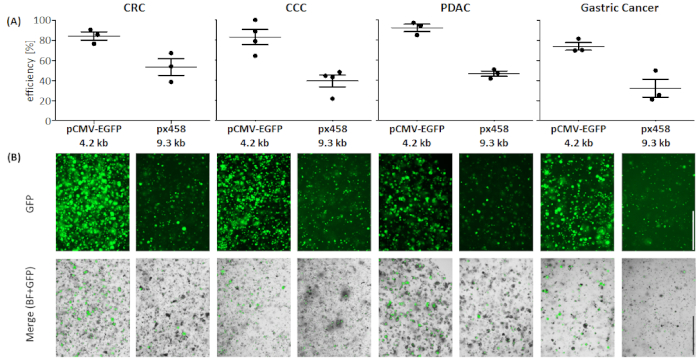
Рисунок 4: Эффективность электропорации четырех органоидных сущностей. (A) анализ FACS (n no 34, среднее стандартное отклонение и каждое отдельное значение показано) и (B)визуальное сравнение флуоресцентным микроскопом. Шкала бар - 1000 мкм. BF - яркое поле; КСК и холангиокарцинома; CRC - колоректальный рак; GC - рак желудка; PDAC - аденокарцинома поджелудочной железы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
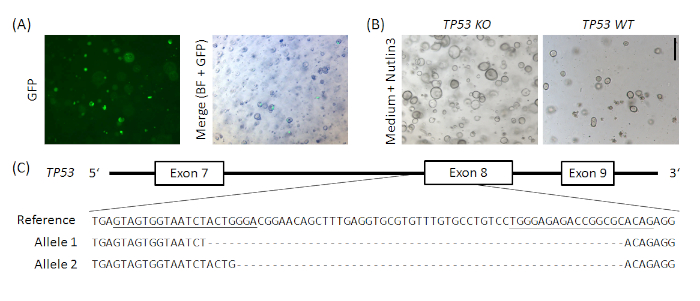
Дополнительная фигура 1: Образцовый CRISPR/Cas9 на основе нокаута TP53 в нормальных органов желудка человека. Вектор px458_Conc2 (см. Таблица материалов) был клонирован путем объединения 2 gRNA конкатетер вектор, щедрый подарок от Bon-Kyoung Koo19, с px45820, в результате плазмид кодирования для 2 sgRNAs, Cas9 и GFP. Два sgRNA ориентации TP53 были введены в px458_Conc2 вектор омрачительным клонированием золотых ворот (аналогично Андерссон-Рольф и др.19). 10 мкг плазмидной ДНК были электропоированы в нормальных желудочных органоидах человека(А). Клоны были выбраны Nutlin3 администрации (B) и TP53 нокаут был подтвержден TOPO TA клонирования и последовательности аллелей, здесь образцовое показано для одного клона (C). SgRNA подчеркнуты в справке. Шкала бар 200 мкм. BF - яркое поле. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Этот протокол дает подробные инструкции для эффективного, быстрого и легкого для выполнения электропорации различных органоидных сущностей. Помимо представленных опухолевых органоидов из PDAC, CRC, CCC и GC, он успешно работает для органоидов, полученных из здоровых тканей, а также. Протокол может быть выполнен в течение одного дня. В опубликованных протоколах органоидной трансфекции вся процедура длилась четыре дня, включая два дня препаратов с различными типами культивирования носителей10,21. В нашем протоколе не требуется специальной предварительной обработки. Путем мытья с буфером электропорации перед электропорированием компоненты антибиотика средств были вымыты вне и регулировка концентраций солиней для оптимальных значений impedance была достигнута. Тем не менее, некоторые критические аспекты должны быть рассмотрены для успешного электропорации:
Клетки
В протоколе электропорации Fujii et al.10 рекомендуется отмежевать органоиды к одиночным клеткам и фильтровать их через 20 мкм-ситечко. В наших руках пищеварение в одиночные клетки сильно снижает живучесть клеток. Как было предложено в Merenda et al.21,мы также разъединили органоиды на кластеры 10-15 клеток и не могли определить пониженную эффективность по сравнению с одноклеточной диссоциацией. После электропорации, это очень важный шаг, чтобы разъединить белую пену, так что никакие прикрепленные клетки не теряются.
Для 2D-клеточной культуры было показано, что время регенерации после электропорации более 10 мин до 40 мин повышает живучесть и эффективность трансфекции, особенно крупных плазмидов22. В тестовых экспериментах то же самое можно задокументировать для органоидов, что привело к инкубации шаг 40 мин после электропорации в этом протоколе. Для того, чтобы увеличить восстановление после электропорации, мы культивировали их с Род-ассоциированным ингибитором белка киназы (ROCK) Y-27632 в течение пяти-семи дней23. Аналогичным образом, дополнительные добавки гликогена синтазы киназы 3 (GSK3) ингибитор CHIR99021 предназначен, чтобы помочь одиночных клеток для восстановления10.
Параметры
Одним из преимуществ используемого электропорера является то, что импеданс может быть измерен до электропорации для оптимальных условий. По мнению производителя, значения импедеданса должны составить 30-55 евро. В наших руках импедеданные значения 30-40 и 30-40 евро показали оптимальную эффективность. В ходе предварительного эксперимента различные напряжения и значения длины пульса пульса были изменены, чтобы найти оптимальную пропорцию эффективности к живучести. Таким образом, мы могли бы подтвердить описанные значения Fujii et al.10 в различных сущностях, описанных здесь.
Днк
Эффект различных количеств ДНК был протестирован в ходе предварительных экспериментов до 45 мкг ДНК на образец. Никаких цитотоксических эффектов обнаружено не может. Эффективность трансфекции была увеличена в дозе зависимым способом с насыщением и 30 мкг. Таким образом, мы использовали 30 мкг на образец в итоговом протоколе, но, конечно, он может быть увеличен (например, для электропорации более плазмиды параллельно). Кроме того, чистота и концентрация ДНК, как представляется, очень важно. Концентрация, превышающая 5 мкг/л, показала оптимальную эффективность трансфекции.
Как и ожидалось, плазмида 9,3 кВ может быть трансфицируется с меньшей эффективностью, чем меньший плазмид 4,2 кВ (см. рисунок 4). Ожидается, что использование еще больших плазмидов, чем 10 кВ, приведет к дальнейшему снижению эффективности. Для будущих применений, это может быть интересно проверить мини-круг ДНК в качестве вектора, так как эти генные носители отсутствие бактериальной позвоночника плазмиды, что делает их меньше24. Это должно привести к повышению эффективности трансфекции. Кроме того, для CRISPR основе манипуляций органоидов прямой электропорации sgRNAs связаны cas9 как рибонуклеопротеин (RNP) комплекс может быть альтернативой илидополнением 25.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Джулиана Фохруба, Анн-Кристин Мейнеке и Макса Хайдука за отличную техническую помощь. Финансирование обеспечили Deutsche Krebshilfe (No 111350 и 70112925), Сандер Стифтунг (No 2014.1), Гектор Стифтунг (No M65.2) и Европейский союз (ERC No 639050).
Материалы
| Name | Company | Catalog Number | Comments |
| For establishment and culture medium | |||
| [Leu15] Gastrin | Sigma-Aldrich | G9145 | |
| A83-01 | Tocris Bioscience | 2939 | |
| Advanced DMEM/F-12 | Invitrogen | 12634010 | |
| B27 | Invitrogen | 17504044 | |
| B27 Supplement, minus vitamin A | Thermo Fisher Scientific | 12587010 | |
| CHIR99021 | Stemgent | 04-0004 | |
| Collagenase II | Life Technologies | 17101-015 | |
| Collagenase XI | Sigma-Aldrich | C9407-100MG | |
| Collagenase D | Roche | 11088866001 | |
| Dispase II | Roche | 4942078001 | |
| Dnase I | Sigma-Aldrich | D5319 | |
| D-sorbitol | Roth | 6213.1 | |
| Dithiothreitol | Thermo Scientific | 1859330 | |
| EDTA | Roth | 8040 | |
| Forskolin | Tocris Bioscience | 1099 | |
| Glutamax | Life Technologies | 35050061 | |
| Hepes | Thermo Fisher Scientific | 15630106 | |
| hFGF-10 | Preprotech | 100-26 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Roth | 3904.2 | |
| Matrigel | Corning | 356231 | basement matrix |
| mEGF | Invitrogen | PMG8043 | |
| N2 | Invitrogen | 17502048 | |
| NaCl | Roth | 3957.1 | |
| Na2HPO4 | Roth | K300.2 | |
| N-Acetyl-L-Cystein | Sigma-Aldrich | A9165 | |
| Nicotinamid | Sigma-Aldrich | N0636 | |
| Noggin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (Hek293-mNoggin-Fc) |
| PBS | Gibco | 14190169 | |
| Penicillin Streptomycin | Life Technologies | 15140122 | |
| Primocin | InvivoGen | ant-pm-1 | |
| Prostaglandin E2 | Tocris Bioscience | 2296 | |
| Recombinant Human HGF | Preprotech | 100-39H | |
| Rspondin | n.a. | n.a. | Conditioned medium produced from HEK293 cells (HA-Rspo1-Fc-293T) |
| SB202190 | Sigma-Aldrich | S7067 | |
| Sucrose | VWR | 27,480,294 | |
| TrypLE Express | Gibco | 12604021 | Dissociation reagent |
| Wnt3A | n.a. | n.a. | Conditioned medium produced from L-Wnt3a cells (from Sylvia Boj) |
| Y-27632 | Sigma-Aldrich | Y0503 | |
| Consumables | |||
| Cell Strainer 100 µm | Falcon | 352360 | |
| 48-well plate | Corning | 3548 | |
| Nepa Electroporation Cuvettes 2mm gap w/pipettes | Nepa Gene Co., Ltd. | EC-002S | |
| Tubes 15 ml | Greiner | 188271 | |
| Tubes 15 ml low binding | Eppendorf | 30122208 | Tubes for FACS preparing |
| Equipment | |||
| Electroporator Nepa21 | Nepa Gene Co., Ltd. | n.a. | |
| EVOS FL Auto | Invitrogen | AMAFD1000 | Fluorescence microscope |
| LSRFortessa | BD Bioscience | 647800E6 | FACS |
| Reagents and plasmids | |||
| Live/dead fixable blue dead cell stain kit | Invitrogen | L34962 | Includes antibody for live/dead staining for FACS analysis |
| EndoFree Plasmid Maxi Kit | Qiagen | 12362 | |
| Nutlin-3 | Selleckchem | S1061/07 | |
| Opti-MEM | Gibco | 31985047 | Electroporation buffer |
| 2 gRNA concatemer vector | AddGene | 84879 | |
| pCMV-EGFP | Nepa Gene Co., Ltd. | n.a. | |
| px458 plasmid | AddGene | 48138 | coding for sgRNA and Cas9 |
| px458_Conc2 plasmid | AddGene | 134449 | px458 plasmid containing 2x U6 promotors for two different sgRNAs |
| sgRNA_hTP53_1a | Eurofins Genomics | n.a. | 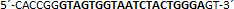 |
| sgRNA_hTP53_1b | Eurofins Genomics | n.a. | 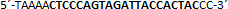 |
| sgRNA_hTP53_2a | Eurofins Genomics | n.a. | 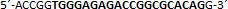 |
| sgRNA_hTP53_2b | Eurofins Genomics | n.a. | 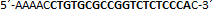 |
Ссылки
- Huch, M., et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell. 160 (1-2), 299-312 (2015).
- Werner, K., Weitz, J., Stange, D. E. Organoids as Model Systems for Gastrointestinal Diseases: Tissue Engineering Meets Genetic Engineering. Current Pathobiology Reports. 4 (1), 1-9 (2016).
- Olayanju, A., Jones, L., Greco, K., Goldring, C. E., Ansari, T. Application of porcine gastrointestinal organoid units as a potential in vitro tool for drug discovery and development. Journal of applied toxicology. 39 (1), 4-15 (2019).
- Drost, J., et al. Sequential cancer mutations in cultured human intestinal stem cells. Nature. 521 (7550), 43-47 (2015).
- Matano, M., et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nature Medicine. 21 (3), 256-262 (2015).
- Schwank, G., et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 13 (6), 653-658 (2013).
- Drost, J., et al. Use of CRISPR-modified human stem cell organoids to study the origin of mutational signatures in cancer. Science. 358 (6360), 234-238 (2017).
- Zhang, X. H., Tee, L. Y., Wang, X. G., Huang, Q. S., Yang, S. H. Off-target Effects in CRISPR/Cas9-mediated Genome Engineering. Molecular Therapy Nucleic Acids. 4, e264 (2015).
- Tsong, T. Y. Electroporation of cell membranes. Biophysical journal. 60 (2), 297-306 (1991).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Broutier, L., et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation. Nature Protocols. 11 (9), 1724-1743 (2016).
- Broutier, L., et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening. Nature Medicine. 23 (12), 1424-1435 (2017).
- Hennig, A., et al. CFTR Expression Analysis for Subtyping of Human Pancreatic Cancer Organoids. Stem Cells Int. 2019, 1024614 (2019).
- Seidlitz, T., et al. Human gastric cancer modelling using organoids. Gut. 68 (2), 207-217 (2019).
- Stepanenko, O. V., Verkhusha, V. V., Kuznetsova, I. M., Uversky, V. N., Turoverov, K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes. Current protein & peptide science. 9 (4), 338-369 (2008).
- Andersson-Rolf, A., et al. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 271-277 (2016).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8, 2281 (2013).
- Merenda, A., et al. A Protocol for Multiple Gene Knockout in Mouse Small Intestinal Organoids Using a CRISPR-concatemer. Journal of Visualized Experiments. (125), (2017).
- Lesueur, L. L., Mir, L. M., Andre, F. M. Overcoming the Specific Toxicity of Large Plasmids Electrotransfer in Primary Cells In Vitro. Molecular Therapy Nucleic Acids. 5, e291 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Darquet, A. M., Cameron, B., Wils, P., Scherman, D., Crouzet, J. A new DNA vehicle for nonviral gene delivery: supercoiled minicircle. Gene Therapy. 4 (12), 1341-1349 (1997).
- Jacobi, A. M., et al. Simplified CRISPR tools for efficient genome editing and streamlined protocols for their delivery into mammalian cells and mouse zygotes. Methods. 121-122, 16-28 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены