A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استجواب مواز لـ α-Arrestin2 تجنيد لـ Ligand الفحص على نطاق GPCR على نطاق واسع باستخدام PRESTO-Tango assay
In This Article
Summary
وبالنظر إلى أن الـ GPCRs أهداف جذابة قابلة للتخدير، فإن فحص GPCR ligand أمر لا غنى عنه لتحديد مركبات الرصاص ودراسات إزالة التيتم. نحو هذه الجهود، ونحن نصف PRESTO-Tango، منصة موارد مفتوحة المصدر تستخدم للتنميط المتزامن للتجنيد العابر في حوالي 300 GPCRs باستخدام تقييم مراسل TEV.
Abstract
باعتبارها أكبر وأكثر تنوعا الجينات superfamily والوسطاء من سلسلة من مسارات الإشارات الخلوية، G-البروتين مقرونة مستقبلات (GPCRs) تمثل واحدة من الأهداف الواعدة لصناعة الأدوية. Ergo ، وتصميم وتنفيذ وتحسين GPCR ligand فحص المقالات أمر بالغ الأهمية ، لأنها تمثل أدوات التحكم عن بعد لاكتشاف المخدرات والتلاعب الدوائية GPCR والنتائج. في الماضي ، كانت المقالات المعتمدة على البروتين G تجسد هذا المجال من البحث ، واكتشاف الأحداث الناجمة عن ligand وتحديد عدد الرسل الثانويين. ومع ذلك ، منذ ظهور الانتقائية الوظيفية ، فضلا عن زيادة الوعي بعدة مسارات أخرى G المستقلة عن البروتين والقيود المرتبطة بمقالات G-البروتين تعتمد ، هناك دفعة أكبر نحو خلق بديل GPCR ligand فحص المقالات. نحو هذا المسعى ، ونحن نصف تطبيق واحد من هذه الموارد ، ومنصة PRESTO - Tango ، وهو نظام قائم على مراسل luciferase التي تمكن من الاستجواب المتوازي والمتزامن للGPCR -ome الإنسان ، وهو إنجاز كان ينظر فيه سابقا من الناحية الفنية والاقتصادية غير مجدية. واستناداً إلى اختبار تجنيد مستقل من نوع G-protein-ed-arrestin2، فإن عالمية الاتجار ببوساطة α-arrestin2 والإشارة في GPCRs تجعل PRESTO-TANGO أداة ملائمة لدراسة ما يقرب من 300 من وحدات GPCRs البشرية غير الشمية، بما في ذلك ما يقرب من 100 مستقبلات اليتيم. حساسية PRESTO-Tango وقوتها تجعلها مناسبة للشاشات الأولية عالية الإنتاجية باستخدام المكتبات المركبة ، وتستخدم للكشف عن أهداف GPCR جديدة للأدوية المعروفة أو لاكتشاف ليغاند جديدة للمستقبلات اليتيمة.
Introduction
تشكل مستقبلات البروتين G-المقترنة (GPCRs) أكبر عائلة وأكثرها تنوعًا من البروتينات عبر الغشاء ، وتعمل كواجهات اتصال بين الخلية وبيئتها1. ويبرز براعة GPCRs من خلال قدرتها على الكشف عن مجموعة متنوعة من ligands - من الناقلات العصبية إلى النيوكليوتيدات ، والببتيدات إلى الفوتونز ، وغيرها الكثير ، فضلا عن قدرتها على تنظيم العديد من الشلالات إشارات المصب المشاركة في النمو الخلوي ، والهجرة ، والتمايز ، وموت الخلايا المبرمج ، وإطلاق الخلايا ، وما إلى ذلك2،3. وبالنظر إلى انتشارها ومشاركتها في العديد من العمليات الفسيولوجية ، فإن هذه العائلة المستقبلة ذات أهمية علاجية قصوى ، ويتضح ذلك من خلال حقيقة أن أكثر من ثلث الأدوية الموصوفة المتاحة حاليًا تستهدف GPCRs4. ومع ذلك، تستهدف هذه العلاجات الموجودة فقط مجموعة فرعية صغيرة من الأسرة الخارقة (ما يقدر بـ 10٪)، ولا يزال علم الأدوية للعديد من وحدات المعالجة بالأدوية الوراثية غير مُستوضح. وعلاوة على ذلك، أكثر من 100 GPCRs موجودة كمستقبلات اليتيم، كما أنها لم تكن مطابقة مع ligand الذاتية5. وبالتالي ، فإن فحص GPCR ligand أمر بالغ الأهمية في إزالة التيتم وتطوير الدواء ، لأنه يمهد الطريق نحو اكتشاف الرصاص والتحسين ، وربما إلى مرحلة التجربة السريرية.
وقد انخفضت أساليب فحص جي بي سي جي ليغاند تقليديا في واحدة من فئتين، G-البروتين تعتمد أو G-البروتين مستقل مقالات وظيفية6. يتم تنظيم إشارات GPCR من قبل البروتينات G-البروتينات الغيرية (Gααα) ، والتي يتم تنشيطها من خلال تبادل GTP للناتج المحلي الإجمالي المقيد على الوحدة الفرعية Gα7. يتم نقل الإشارات من المستقبلات المنشطة بواسطة G-proteins عبر الرسل الثانوية ، مثل cAMP ، الكالسيوم ، DAG ، و IP3 ، للتوسط في إشارات المصب في المؤثرات المصب8. وقد استغلت طبيعة العواقب الوظيفية للإشارة G-البروتين لإنشاء الخلايا القائمة على المقالات التي تعكس تنشيط مستقبلات. هذه الأساليب، التي تقيس الأحداث القريبة (المباشرة) أو البعيدة (غير المباشرة) في إشارات G-protein، تستخدم في أغلب الأحيان لفحص GPCR ligand وقد استخدمت بشكل رئيسي في دراسات إزالة التيتم6. أمثلة على الاختبارات التي تقيس مباشرة GPCR بوساطة تنشيط G-البروتين تشمل [35S] GTPаS ملزمة للتحليل، الذي يقيس ملزمة من التسمية الإشعاعية وغير hydrolyzable GTP التناظرية إلى الوحدة الفرعية Gα، وFörster / bioluminescence نقل الطاقة بالرنين (FRET / بريت، على التوالي) تحقيقات لرصد GPCR-Gα وGα / Gα التفاعلات، والتي تم كسب المزيد من الجر على مدى السنوات9،10. المقالات التي ترصد الأحداث البعيدة هي الأدوات الأكثر استخدامًا لتنميط GPCR؛ على سبيل المثال، يقيس cAMP وIP1/3 التراكم داخل الخلايا للرسل الثانويين المعتمدين على G-protein، في حين أن [Ca2+]التدفق ومقالات المراسل ة التي تنطوي على عناصر استجابة محددة متورطة في تنشيط G-protein (CRE، NFAT-RE، SRE، SRF-RE) تفحص الأحداث بشكل أكبر في اتجاه التعاقب الالإشارات11. في حين أن معظم المقالات المذكورة أعلاه يمكن أن يتم إجراؤها على مستوى الإنتاجية العالية، حساسة إلى حد ما ، وتتباهى ببعض المزايا الخاصة بالقياس (على سبيل المثال ، التمييز بين الناهضات الكاملة / الجزئية ، والخصوم المحايدين والمناهضين العكسيين في حالة ربط GTPаS ، أو وظيفة القياس على الخلايا الحية مثل [Ca2 +] و IP1/3)6، للأسف لا توجد طرق تعتمد على البروتين G تناسب استجواب GPCR-ome القابل للتخدير بالكامل. ويرجع ذلك إلى حد كبير إلى اقتران الأصلي من الأسر الفرعية G-البروتين متعددة إلى GPCRs، مما أدى إلى إشارات في العديد من السلاسل التعاقبية واقتران البروتين G غير معروف في GPCRs اليتيم. للتخفيف من هذه المسألة، وقد وضعت المقالات لفرض مشوش G-البروتين اقتران من خلال إشارة واحدة مشتركة القراءة، مثل cAMP، وكاليفورنيا2 +، وإن كان معظمهم من الإنتاجية المنخفضة12.
أحد الجوانب الهامة في دورة حياة GPCR هو إنهاء الإشارات المعتمدة على البروتين G ، والتي تحدث في جزء كبير منها من خلال تجنيد α-arrestins الذي يؤدي إلى تفكك بروتين G ، وفي نهاية المطاف إزالة الحساسية من المستقبل ، والتي تستهدف الاستيعاب الداخلي المغلف بالكلاترين13. الأشكال المتساوية الأكثر تعبيراً في كل مكان من α-arrestin هي α-arrestin1 و α-arrestin2 غير البصرية، المشار إليها أيضاً باسم arrestin-2 وarrestin-3، على التوالي14. أدخل G-البروتين المستقلة الخلايا القائمة على المقالات, التي تضيف بعدا جديدا لفحص LIGAND GPCR; مستقبلات الاتجار، خلية كاملة خالية من التسمية، ومقال التوظيف α-arrestin كلها أمثلة بارزة. اختبارات الاتجار GPCR تستخدم الليغاند المسمى الفلوروفورأو الأجسام المضادة المشتركة التي تستهدفالمستقبلات 15، في حين تستخدم اختبارات الخلايا الكاملة الخالية من التسمية أجهزة الاستشعار الحيوية التي تترجم التغيرات الخلوية الناجمة عن الربط بالليجة إلى مخرجات قابلة للقياس الكمي ، مثل الإشارات الكهربائية أو البصرية16. وتجدر الإشارة إلى أن تفاعلات GPCR-α-arrestin الجوهرية تُعنى بعملية اختبار التوظيف باعتبارها أداة جذابة في ذخيرة المقالات الجوهرية17. نظام التانغو، الذي طوره بارينا وآخرون قبل عقد واحد فقط، ينطوي على إدخال ثلاثة عناصر وراثية خارجية: مزيج البروتين يتكون من α-arrestin2 مع بروتياز فيروس حفر التبغ (TEVp)، وهو محول التتراسيكلين (tTA) الذي يرتبط GPCR عن طريق فيروس حفر التبغ موقع انشقاق البروتياز (TEVcs) ويسبقه تسلسل من C-terminus من مستقبلات V2 فاسوبريسين (V2 الذيل) لتعزيز تجنيد arrestin، وجين لوسيفيراز المراسل الذي يتم تشغيل النسخ من قبل tTA نسخ عامل نقل إلى نواة، والتي يتم تحريرها من رسو الغشاء بعد تجنيد α-arrestin2(الشكل 1)18. ويمكن بعد ذلك تحديد القراءات الكمية لتفعيل GPCR وتجنيد α-arrestin2 من خلال القراءة للتلأل. وثمة تمييز ملحوظ هو أنه في حين أن الاتجار بالمستقبلات وطرق الخلايا الكاملة الخالية من التسمية منخفضة الإنتاجية نسبيًا ، فإن التانغو له العديد من المزايا ، بما في ذلك القراءة الانتقائية الخاصة بالمستقبل المستهدف والحساسية بسبب تكامل الإشارة ، مما يجعله مرشحًا مناسبًا لفحص ligand على نطاق أوسع18.
في ضوء هذه الميزات الاستراتيجية ، طورت Kroeze وآخرون PRESTO-Tango (التعبير المتوازي للمستقبلات -ome والفرز عبر النسخ الإخراج -Tango) ، وهي منصة مفتوحة المصدر عالية الإنتاجية تستخدم نهج Tango لتوصيف GPCR-ome القابل للتخدير بطريقة متوازية ومتزامنة19. استغلال "مشوش" تجنيد α-arrestin2 إلى ما يقرب من جميع GPCRs، PRESTO-Tango هو الأول من نوعه من حيث الاختبارات الوظيفية القائمة على الخلية، مما يتيح الفحص السريع "الجولة الأولى" من مركبات الجزيئات الصغيرة في جميع GPCRs تقريبا غير الشمية، بما في ذلك الأيتام، مستقلة عن اقتران الأسرة الفرعية G-البروتين.
Protocol
1. الفحص الأولي: زراعة الخلايا وبذر الصفيحة
- لإعداد لوحات بولي-L-ليسين (PLL)، الاستغناء 20 ميكرولتر/بئر من 25 ميكروغرام/مل من محلول الأسهم PLL في الأبيض أو الأسود 384-well لوحات القاع البصرية باستخدام ماصة متعددة القنوات الإلكترونية أو موزع كاشف. احتضان لوحات في درجة حرارة الغرفة لمدة 0.5-2 ساعة.
ملاحظة: إذا كنت تستخدم اللوحات السوداء 384-well، فتوقع أن تكون إشارة الخلفية أقل مقارنة باللوحات البيضاء. يوصى باللوحات السوداء للحد من النزيف من خلال التلألؤ بين الآبار المجاورة. - للحفاظ على لوحات المغلفة وغسل قبالة PLL الزائدة، وإزالة PLL عن طريق النقر عليه على الحوض، والاستفادة الجافة على منشفة ورقية، وإضافة 40 ميكرولتر / جيدا من محلول 1x المخفف من المضادات الحيوية المضادة للميكولتيك باستخدام ماصة متعددة القنوات الإلكترونية أو موزع كاشف. تخزين لوحات PLL المغلفة في 4 درجة مئوية حتى جاهزة للبذر لوحة.
- الحفاظ على خلايا HTLA (التكرم المقدمة من قبل الدكتور ريتشارد أكسل) - خط خلية الكلى الجنينية البشرية (HEK293T) صريحة بشكل ثابت عبر α-arrestin2-TEV و luciferase tTA-riven-riven-in كامل دولبكو تعديل النسر المتوسطة (DMEM) تستكمل مع 5٪ من مصل الأبقار الجنين، 5% من مصل العجل البقري، 2.5 ميكروغرام/مل من البوروميسين، 50 ميكروغرام/مل من الهيغروماسين، 100 يو/مل البنسلين، و100 ميكروغرام/مل ستربتوموسين عند 37 درجة مئوية في حاضنة رطبة تحتوي على 5% ثاني أكسيد الكربون2.
- خلايا HTLA الثقافة في أطباق 150 ملم وتمرير الخلايا مرتين في الأسبوع في عامل تخفيف من 1:10، مع عدد مرور الخلية الأمثل من 5-25. تأكد من أن عددًا كافيًا من الأطباق مقاس 150 مم مالًا مُلحّة في يوم بذر الصفيحة 384 بئرًا ، اعتمادًا على حجم الشاشة الأساسية.
ملاحظة: قد يؤدي استخدام خلايا HTLA أكبر من المقطع 25 إلى انخفاض القدرة على البقاء، مما يؤدي إلى نتائج دون المستوى الأمثل. - لبذور خلايا HTLA للشاشة الأساسية، شطف بلطف الطبق (es) 150 مم المحيرة مع 1x الفوسفات العازلة المالحة (PBS)، درجة الحموضة 7.4. فصل الخلايا مع ما يقرب من 6 مل من 0.05٪ التربسين/0.53 mM EDTA، ونقل إلى أنبوب الطرد المركزي التي تحتوي على ما لا يقل عن كمية متساوية من كامل دولبيكو في المتوسط النسر المعدلة (DMEM) لتحييد التربسين.
- قم بتدوير خلايا HTLA عند 500 × ز لمدة 3 دقيقة وإعادة تعليق بيليه الخلية بكثافة 0.22 × 106 خلايا / مل في DMEM كاملة ، مع حذف إضافة 2.5 ميكروغرام / مل من البوروميسين و 50 ميكروغرام / مل من الهيغروميسين لأنها يمكن أن تقلل من فعالية الإرسال.
- احتضان لوحات 384-well-pLL المغلفة في 37 درجة مئوية لتدفئة لهم قبل البذر الخلايا. قم بإزالة محلول التخزين من 1x مضاد المضادات الحيوية- الأميكتيك من لوحة (ق) PLL المغلفة 384-well-PLL عن طريق النقر على لوحة فوق الحوض وتسجيله على منشفة ورقية لتجف.
- خلايا البذور في 384 جيدا PLL المغلفة لوحات في الكثافة النهائية من 10000 خلية / جيدا عن طريق الاستغناء 45 ميكرولتر من تعليق 0.22 × 106 خلايا / مل HTLA باستخدام أنبوب متعدد القنوات الإلكترونية. لوحات احتضان في 37 درجة مئوية بين عشية وضحاها. إذا كان يفضل الترانفسيف في نفس اليوم، خلايا البذور بكثافة 16،000 الخلايا / جيدا وأداء transfection 4 ح في وقت لاحق.
ملاحظة: للحصول على كفاءة نقل عالية، 50-70٪ التقاء الخلية هو الأمثل.
2. الفحص الأولي: إعداد لوحة الحمض النووي وtransfections
- لإعداد لوحة مصدر الحمض النووي 384-well للتطفل كما هو موضح في الشكل 2، قم بتوزيع cDNAs البلازميد ترميز بنيات GPCR-Tango ذات الاهتمام في لوحة 96-well ، مع GPCR /well مختلفة. وينبغي تعليق الحمض النووي البلازميد في 0.1x تريس-EDTA (TE) عازلة بتركيز 50 نانوغرام/ميكرولتر.
ملاحظة: يمكن إغلاق لوحات الحمض النووي 96-well وتخزينها عند -20 درجة مئوية، وإعادة استخدامها في تجارب فحص متعددة. جميع cDNA ترميز GPCR-Tango يبني متوفرة تجاريا (انظر جدول المواد)ويتم استنساخها في pcDNA3.1 neomycin plasmid. تتكون مجموعة PRESTO-Tango GPCR من أربعة لوحات تحتوي على 96 بئرًا ، والتي تشمل 80 GPCRs لكل منها ، واثنين من الآبار ذات المتجه الفارغ كعناصر تحكم سلبية ، وآبار تحكم إيجابية تحمل مستقبلات الدوبامين D2 (DRD2) ، والآبار التي تحمل ترميزًا بلازميدًا بروتين فلوري (YFP) لتتبع كفاءة التغوط. - باستخدام ماصة متعددة القنوات، قم بنقل محلول الحمض النووي يدويًا من 96-well إلى لوحة مصدر الحمض النووي 384-well، مما يضيف 10 ميكرولتر لكل 384 بئرًا. لضمان أن يتم فحص كل حالة من شروط التجربة في رباعية، نصف لوحة الحمض النووي 96-well (الصفوف A-D أو E-H) سوف تغطي لوحة كاملة 384-well عن طريق توزيع كل GPCR في الربعين (الربع الأول = - مركب، الربع الثاني = + مركب)، بحيث سيتم نقل GPCR نفسه في 8 آبار من لوحة 384-well (انظر الشكل 2 كدليل).
- تجميع الكواشف الترانفية التالية اللازمة لطريقة هطول الأمطار فوسفات الكالسيوم، كما وصفها الأردن وآخرون20:0.1x TE المخزن المؤقت (1 mM Tris-HCl و 0.1 mM EDTA)؛ 2.5 M CaCl2 الحل؛ 2x العازلة Hepes، درجة الحموضة 7.05 (50 mM HEPES، 280 mM NaCl، 1.5 mM Na2HPO4). قم بتعقيم جميع الحلول عن طريق الترشيح وتخزينها عند درجة حرارة 4 درجات مئوية. يوم الترانزفيشن، والسماح للكواشف للوصول إلى درجة حرارة الغرفة قبل الاستخدام.
- تمييع 2.5 M CaCl2 حل الأسهم في 0.1x TE (1:8 تخفيف) إلى تركيز نهائي من 0.313 M CaCl2 والدوامة. نقل 40 ميكرولتر من 0.313 M CaCl2 إلى لوحة مصدر الحمض النووي 384-well ومزيج عن طريق الأنابيب صعودا وهبوطا مع ماصة متعددة القنوات باليد أو على مقاعد البدلاء الآلي 384 قناة pipettor.
- إضافة 50 ميكرولتر من 2x العرافة العازلة إلى لوحة مصدر الحمض النووي 384-well, مزيج مرة أخرى عن طريق الأنابيب صعودا وهبوطا والسماح للوقوف لمدة 1 دقيقة; كل 384-جيدا سيكون كمية كافية من الحمض النووي / خليط transfection لنقل تسعة لوحات 384-well, اعتمادا على عدد من المركبات التي تحتاج إلى اختبار. نقل 10 ميكرولتر من خليط الحمض النووي/ الترانسفير من لوحة مصدر الحمض النووي 384 بئر إلى خلايا HTLA المزروعة واحتضان اللوحات بين عشية وضحاها عند 37 درجة مئوية.
3. الفحص الأولي: تحفيز الخلايا
- بعد 24 ساعة، قم بإزالة الخلايا المنقولة عن طريق النقر بلطف على لوحة 384-well على الحوض وتسجيله فوق منشفة ورقية، أو برأس طاب. إضافة ببطء 40 ميكرولتر من وسائل الإعلام المتضورة جوعا (DMEM تكملها مع 1٪ مصل الأبقار الجنينية (dFBS) و 1x المضادات الحيوية / antimycotic)، مع الحرص على تجنب لمس الخلايا مباشرة.
- Pipet 20 μL من مركب الفائدة في تركيز 3x (التركيز النهائي للدواء في لوحة الخلية سيكون 1x) في الصفوف بالتناوب مع (+) التحفيز، و 20 ميكرولتر من الحاجز مركبة للصفوف بالتناوب دون (-) مركب. عودة لوحة الخلية في 37 درجة مئوية في 5٪ CO2 واحتضان لمدة لا تقل عن 16 ساعة.
4. الفحص الأولي: قراءة الإنارة
- إعداد كاشف غلو, تعديل من بيكر وبويس21: 108 mM تريس-HCl; 42 mM Tris-Base, 75 m M NaCl, 3 mM MgCl2, 5 mM Dithiothrei-tol (DTT), 0.2 mM إنزيم A, 0.14 ملغم/مل D-لوسيفيرين, 1.1 mM ATP, 0.25% v/v Triton X-100, 2 mM هيدروسولفيت الصوديوم.
ملاحظة: يمكن إجراء حلول المخزون من الكواشف مقدما، باستثناء D-لوسيفيرين، الذي يتم إضافته دائما طازجة إلى كاشف غلو في شكله مسحوق. إذا تم استخدام لوحات سوداء، يمكن زيادة كمية D-لوسيفيرين تصل إلى 0.25 ملغ/مل. - في 16-24 ساعة بعد التحفيز, decant وسائل الإعلام الخلايا المنقولة عن طريق النقر بلطف لوحة 384 جيدا على الحوض وتسجيله على منشفة ورقية. إضافة 20 ميكرولتر / بئر من الكاشف غلو واحتضان لوحة في درجة حرارة الغرفة لمدة 5-20 دقيقة. قراءة لوحات باستخدام عداد التلألؤ لوحة صغيرة، مع وقت التكامل من 1 ق / حسنا.
5- الفحص الأولي: تحليل البيانات
- تصدير الملفات المحفوظة من عداد الإنارة كجدول بيانات؛ سيتم تسجيل النتائج في وحدات التلألؤ النسبي (RLU). استنادا إلى تخطيط لوحة 384 جيدا، حساب تفعيل (تغيير أضعاف) من كل مستقبل باستخدام الصيغة التالية:
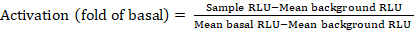
ملاحظة: هنا عينة RLU يشير إلى قيمة كل من الآبار الأربعة تكرار رباعي ة تحفيز (+ مركب) ، متوسط الخلفية RLU هو متوسط الضوابط السلبية على لوحة، وRLU القاعدية يعني متوسط الربع غير المعالجة من نفس المستقبل (- مركب). بالإضافة إلى ذلك، قم بحساب الانحراف المعياري لنقاط البيانات الأربعة للتحقق من جودة النتائج. فمن المستحسن لإجراء تحويل log2 على متوسط التغييرات أضعاف لتصحيح أي heteroskedasticity; قاعدة log2 هو خيار عملي للمساعدة في تحديد الزيارات الإيجابية. وضع العتبات الإيجابية للإصابة على نحو تجريبي؛ لا بد من ملاحظة أن بعض المستقبلات يمكن أن يكون لها زيادة منخفضة تصل إلى 2 أضعاف وإلى زيادة تصل إلى 40 مرة للآخرين مع الناضون الكامل. - واستناداً إلى النتائج، حدد الاستعراضات العامة للنتائج التي يمكن أن تكون إيجابية للفحص الثانوي.
6. الفحص الثانوي: البذر الخلوي وtransfections
- خلايا HTLA الثقافة الفرعية في أطباق 100 ملم بكثافة خلايا إجمالية تبلغ 5 × 10خلايا في 11 مل من الوسائط الكاملة (4.55 × 105/ مل) واحتضان عند 37 درجة مئوية لمدة 24 ساعة. إذا كان يفضل الترانزفيشن في نفس اليوم، خلايا البذور بكثافة 7.5 × 106 خلايا وأداء transfection 4 ساعة في وقت لاحق.
- ما قبل التدفئة الكواشف اللازمة لهطول الأمطار فوسفات الكالسيوم في درجة حرارة الغرفة. الجمع بين 450 ميكرولتر من 0.1x العازلة TE مع 50 ميكرولتر من 2.5 M CaCl2 ودوامة بسرعة؛ هذه المبالغ محددة لطبق واحد 100 ملم، على أساس حجم متوسط النمو الذي يحمله.
- في أنبوب، إضافة 500 ميكرولتر من الحل TE/CaCl2 إلى 10 ميكروغرام من CDNA GPCR والدوامة. إضافة 500 ميكرولتر من محلول العازلة 2x Hepes في أنبوب، يهز بقوة (لا دوامة)، واحتضان لمدة 1 دقيقة.
ملاحظة: 1 ميكروغرام من أي ترميز البلازميد بروتين الفلورسنت (مثل YFP، mCherry، الخ) يمكن أن تكون تشارك في transfect مع 9 ميكروغرام من CDNA GPCR لما مجموعه 10 ميكروغرام. يتم استخدام البروتين الفلوري لتتبع كفاءة الترانفسيشن، وهذا الحد الأدنى من المبلغ لن تتداخل مع مقادير. - مباشرة بعد حضانة قصيرة، والاستغناء عن حل 1 مل dropwise على الخلايا. صخرة بلطف لوحة ذهابا وإيابا لتوزيع بالتساوي راسب، مع الحرص على عدم دوامة لوحة، واحتضان في 37 درجة مئوية لمدة 24 ساعة.
- في اليوم التالي، ومراقبة كفاءة الترانزفية من خلال النظر في التعبير عن البروتين الفلوري تحت صور خلية الفلورسنت؛ transfections أكبر من 50٪ تغطية مثالية.
- احتضان لوحة (ق) PLL المغلفة 384-well-well-المصممة في الحاضنة عند درجة حرارة 37 درجة مئوية لتسخينها قبل خلايا البذر. قم بإزالة محلول التخزين من 1x مضاد المضادات الحيوية- الأميكتيك من لوحة (ق) PLL المغلفة 384-well-PLL عن طريق النقر على لوحة فوق الحوض وتسجيله على منشفة ورقية لتجف.
- شطف بلطف الخلايا المنقولة مع محلول Versene (1X PBS، درجة الحموضة 7.4؛ 0.53 mM EDTA)، وفصل عن طريق إضافة 3 مل من 0.05٪ التربسين/0.53 mM EDTA إلى الطبق. نقل المحتويات إلى أنبوب الطرد المركزي التي تحتوي على الأقل على كمية متساوية من DMEM كاملة لتحييد التربسين.
- قم بتدوير الخلايا عند 500 × ز لمدة 3 دقيقة وإعادة تعليق الخلايا بكثافة 0.4 × 106 خلايا / مل في الوسائط المتضورة جوعاً. خلايا البذور في لوحة (لوحات) PLL المغلفة 384-well-pLL بكثافة نهائية تبلغ 25,000 خلية/جيد ًا عن طريق الاستغناء عن 45 ميكرولتر من تعليق الخلية باستخدام أنبوب إلكتروني متعدد القنوات. إعادة لوحات إلى 37 درجة مئوية لمدة لا تقل عن 4 ساعة، مما يسمح للخلايا نعلق بشكل صحيح إلى الآبار قبل الشروع في التحفيز.
7. الفحص الثانوي: إعداد صفيحة الدواء لمنحنى الجرعة من 16 نقطة (نصف سجل)
- في لوحة 96-well، أضف 270 ميكرولتر من 1X HBSS Drug buffer (1x حل الملح المتوازن لهانك [HBSS]، 20 mM HEPES pH 7.4، 1x مضاد المضادات الحيوية)، باستثناء الصف الأخير (الصف H) من اللوحة، كما هو موضح في الشكل 4.
ملاحظة: بالنسبة للببتيدات والجزيئات الغروية والمركبات القابلة للذوبان في الماء بشكل سيئ ، يقترح إضافة 0.1-1٪ BSA. لمنع أكسدة المخدرات، يمكن أيضا إضافة ما يصل إلى 0.01٪ حمض الأسكوربيك. - من مخزون المخدرات ، وإعداد محلول المخدرات (يشار إليها باسم التركيز "العالي") عن طريق حساب تركيز 3x النهائي (التركيز النهائي للدواء في لوحة الخلية سيكون 1x). على سبيل المثال، بالنسبة لمنحنى الجرعة والاستجابة مع 10 ميكرومتر كأعلى تركيز له، قم بإعداد التركيز "العالي" عند 30 ميكرومتر. Pipet 300 ميكرولتر من التركيز "العالي" في الآبار في الصف H.
- في أنبوب آخر، قم بإعداد التركيز "المنخفض"، الذي يمثل التركيز "العالي" مقسومًا على 3.16 (نصف سجل). واستناداً إلى المثال السابق، سيكون التركيز "المنخفض" 9.49 ميكرومتر. Pipet 300 ميكرولتر من التركيز "المنخفض" في الآبار في الصف H، بجوار الآبار "العالية".
ملاحظة: يعتمد العدد الإجمالي لـ 96 بئرًا مطلوبة في الصف H على عدد الخلايا وظروف التحفيز. أربعة آبار (اثنين من "عالية" واثنين من "منخفضة") سيكون لها حل المخدرات وافرة لتحفيز لوحة بئر 384 كامل. - تنفيذ تخفيف المسلسل عن طريق pipetting 30 ميكرولتر من محلول المخدرات من "عالية" و "منخفضة" آبار الصف H إلى الصف السابق (الصف G) ومزيج عن طريق الأنابيب يدويا صعودا وهبوطا، أو على النحو الموصى به، وذلك باستخدام ماصة متعددة القنوات الإلكترونية مع وظيفة "ماصة وميكس". كرر هذه الخطوة حتى الصف الأول والأكثر تخفيفا (الصف A)، مع تجاهل النصائح بين المخففات.
ملاحظة: إذا رغبت في ذلك، يمكن إيقاف التخفيفات التسلسلية قبل الصف A، الذي يمثل عنصر تحكم داخلي بدون دواء، وبعبارة أخرى، "صفر حقيقي". - باستخدام الشكل 4 كمرجع، تحفيز الخلايا المنقولة عن طريق الأنابيب 20 ميكرولتر من "منخفض" تخفيف العمود من لوحة 96-well إلى الصفوف A-O من لوحة 384-well المصنفة سابقاً، وكذلك 20 ميكرولتر من تخفيف العمود "العالي" إلى الآبار B-P. احتضان اللوحة عند 37 درجة مئوية لمدة لا تقل عن 16 ساعة.
8- الفحص الثانوي: قراءة الإنارة وتحليل البيانات
- في 16-24 ساعة بعد التحفيز, decant وسائل الإعلام الخلايا المنقولة عن طريق النقر بلطف لوحة 384 جيدا على الحوض وتسجيله على منشفة ورقية. إضافة 20 ميكرولتر / بئر من الكاشف غلو واحتضان لوحة في درجة حرارة الغرفة لمدة 5-20 دقيقة. قراءة لوحات باستخدام عداد التلألؤ لوحة صغيرة، مع وقت التكامل من 1 ق / حسنا.
- تصدير الملفات المحفوظة من عداد الإنارة كجدول بيانات؛ سيتم تسجيل النتائج في وحدات التلألؤ النسبي (RLU). نقل بيانات لوحة 384-well إلى برنامج الإحصائيات لتحليل النتائج باستخدام التحليل المدمج XY لمنحنى الانحدار غير الخطي المناسب. حدد المدمج في 3-المعلمة وظيفة تحفيز الجرعة والاستجابة "سجل (agonist) مقابل الاستجابة (ثلاثة معلمات)"،

ملاحظة: هنا أعلى وأسفل هي الهضاب في وحدات المحور ص، على التوالي الاستجابة القصوى والمستوى القاعدي، EC50 هو تركيز الناضر الذي يولد استجابة 50٪ بين أعلى وأسفل، وX يشير إلى تركيز سجل من الناضر. يفترض هذا النموذج أن منحنى الاستجابة للجرعة له ميل تل قياسي من 1.
النتائج
باستخدام بروتوكول PRESTO-Tango المعروض هنا ، تم فحص مستخلص حبيبات الكرومافين (CG) مقابل 168 هدفًا من أهداف GPCR غير الشمية ، وغالبيتها هي مستقبلات يتيمة. تم تنفيذ التنميط من استخراج وقال من خلال فحص تعبئة α-arrestin2 في المستقبلات المختارة، استنادا إلى المبدأ الذي صممه بارنيا وآخرون18
Discussion
وGPCRs ديناميكية تشكيلية هي القوى من نقل الإشارات. الخصائص الفيزيوكيميائية للجيوب الملزمة لهذه المستقبلات heptahelical، فضلا عن أهميتها الفسيولوجية تؤكد الحاجة إلى أدوات فحص جي بي سي آر ليغاند. وكما هو موضح أعلاه، فإن اختبار PRESTO-Tango سريع وحساس وسهل الاستخدام، ويضفي نفسه على تطوير المخدرات. ليس فق...
Disclosures
تعلن ساعات العمل عن عدم وجود مصالح متنافسة.
Acknowledgements
وقد دعم هذا العمل المعاهد الكندية للبحوث الصحية (CIHR منحة #MOP142219).
Materials
| Name | Company | Catalog Number | Comments |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, BLACK, with lid, Sterile | NUNC | 12-566 | |
| 384 Well Optical Bottom Plates, Polystyrene Polymer Base, Cell Culture Treated, White, with lid, Sterile | NUNC | 12-566-1 | |
| 384 Well Round Bottom, Polypropylene, Non-Treated, Blue, non-sterile, without lid | ThermoFisher | 12-565-390 | |
| Antibiotic-Antimycotic | Wisent | 450-115-EL | |
| D-Luciferin, sodium salt | GoldBio | LUCNA | |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Corning | 10-013-CV | |
| Eppendorf Xplorer, 12-channel, variable, 15–300 µL | Eppendorf | 4861000155 | |
| Eppendorf Xplorer, 12-channel, variable, 5–100 µL | Eppendorf | 4861000139 | |
| Matrix Platemate 2x3 | ThermoFisher | 801-10001 | |
| MicroBeta 1450 Wallac | Perkin Elmer | ||
| Penicilin-Streptomycin | Wisent | 450-201-EL | |
| Poly-L-Lysine hydrobromide | Millipore-Sigma | P2636-500MG | |
| Roth Lab PRESTO-Tango GPCR Kit | Addgene | Kit #1000000068 |
References
- Liapakis, G., et al. The G-protein coupled receptor family: actors with many faces. Current pharmaceutical design. 18 (2), 175-185 (2012).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3 (9), 639-650 (2002).
- Kroeze, W. K., Sheffler, D. J., Roth, B. L. G-protein-coupled receptors at a glance. Journal of cell science. 116, 4867-4869 (2003).
- Rask-Andersen, M., Almén, M. S., Schiöth, H. B. Trends in the exploitation of novel drug targets. Nature Reviews Drug Discovery. 10 (8), 579-590 (2011).
- Ngo, T., et al. Identifying ligands at orphan GPCRs: current status using structure-based approaches. British journal of pharmacology. 173 (20), 2934-2951 (2016).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta pharmacologica Sinica. 33 (3), 372-384 (2012).
- Kimple, A. J., Bosch, D. E., Giguere, P. M., Siderovski, D. P. Regulators of G-Protein Signaling and Their G Substrates: Promises and Challenges in Their Use as Drug Discovery Targets. Pharmacological Reviews. 63 (3), 728-749 (2011).
- Wettschureck, N., Offermanns, S. Mammalian G Proteins and Their Cell Type Specific Functions. Physiological Reviews. 85 (4), 1159-1204 (2005).
- Denis, C., Saulière, A., Galandrin, S., Sénard, J. -. M., Galés, C. Probing heterotrimeric G protein activation: applications to biased ligands. Current Pharmaceutical Design. 18 (2), 128-144 (2012).
- Yin, H., et al. Lipid G protein-coupled receptor ligand identification using beta-arrestin PathHunter assay. The Journal of Biological Chemistry. 284 (18), 12328-12338 (2009).
- Cheng, Z., et al. Luciferase Reporter Assay System for Deciphering GPCR Pathways. Current Chemical Genomics. 4, 84-91 (2010).
- Roth, B. L., Kroeze, W. K. Integrated Approaches for Genome-wide Interrogation of the Druggable Non-olfactory G Protein-coupled Receptor Superfamily. The Journal of Biological Chemistry. 290 (32), 19471-19477 (2015).
- Jean-Charles, P. -. Y., Kaur, S., Shenoy, S. K. G Protein-Coupled Receptor Signaling Through β-Arrestin-Dependent Mechanisms. Journal of Cardiovascular Pharmacology. 70 (3), 142-158 (2017).
- Smith, J. S., Rajagopal, S. The β-Arrestins: Multifunctional Regulators of G Protein-coupled Receptors. The Journal of Biological Chemistry. 291 (17), 8969-8977 (2016).
- Böhme, I., Beck-Sickinger, A. G. Illuminating the life of GPCRs. Cell Communication and Signaling. 7 (1), 16 (2009).
- Fang, Y. Label-Free Receptor Assays. Drug discovery today. Technologies. 7 (1), 5-11 (2011).
- Wang, T., et al. Measurement of β-Arrestin Recruitment for GPCR Targets. Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Barnea, G., et al. The genetic design of signaling cascades to record receptor activation. Proceedings of the National Academy of Sciences of the United States of America. 105 (1), 64-69 (2008).
- Kroeze, W. K., et al. PRESTO-Tango as an open-source resource for interrogation of the druggable human GPCRome. Nature Structural & Molecular Biology. 22 (5), 362-369 (2015).
- Jordan, M., Schallhorn, A., Wurm, F. M. Transfecting Mammalian Cells: Optimization of Critical Parameters Affecting Calcium-Phosphate Precipitate Formation. Nucleic Acids Research. 24 (4), 596-601 (1996).
- Baker, J. M., Boyce, F. M. High-throughput functional screening using a homemade dual-glow luciferase assay. Journal of Visualized Experiments. (88), 50282 (2014).
- Li, H., Eishingdrelo, A., Kongsamut, S., Eishingdrelo, H. G-protein-coupled receptors mediate 14-3-3 signal transduction. Signal Transduction and Targeted Therapy. 1 (1), 16018 (2016).
- Walther, C., Ferguson, S. S. G. Minireview: Role of intracellular scaffolding proteins in the regulation of endocrine G protein-coupled receptor signaling. Molecular Endocrinology. 29 (6), 814-830 (2015).
- Gurevich, E. V., Benovic, J. L., Gurevich, V. V. Arrestin2 expression selectively increases during neural differentiation. Journal of Neurochemistry. 91 (6), 1404-1416 (2004).
- Shaikh, S., Nicholson, L. F. B. Optimization of the Tet-On system for inducible expression of RAGE. Journal of Biomolecular Techniques JBT. 17 (4), 283-292 (2006).
- Blau, H. M., Rossi, F. M. Tet B or not tet B: advances in tetracycline-inducible gene expression. Proceedings of the National Academy of Sciences of the United States of America. 96 (3), 797-799 (1999).
- Roche, O., et al. Development of a Virtual Screening Method for Identification of "Frequent Hitters" in Compound Libraries. Journal of Medicinal Chemistry. 45 (1), 137-142 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved