Method Article
فحص قياس الخلايا التدفقي القائم على الحمض النووي/Ki67 لتحليل دورة الخلية لخلايا CD8 T الخاصة بالمضاد في الفئران الملقحة
* These authors contributed equally
In This Article
Erratum Notice
Summary
التوسع كلونال هو سمة رئيسية للاستجابة الخلية التائية الخاصة مستضد. ومع ذلك، فإن دورة الخلية من الخلايا التائية المستجيبة للمضاد قد تم التحقيق فيها بشكل سيئ، ويرجع ذلك جزئيا إلى القيود التقنية. نحن نصف طريقة تدفق القياسات الخلوية لتحليل Clonally توسيع خلايا CD8 T مستضد محددة في الطحال والغدد الليمفاوية من الفئران المطعمة.
Abstract
تم فحص دورة الخلية من الخلايا التائية الخاصة بالمضاد في الجسم الحي باستخدام عدد قليل من الطرق ، وكلها تمتلك بعض القيود. برومودوكسيوريدين (BrdU) علامات الخلايا التي هي في أو الانتهاء مؤخرا S-المرحلة, وcarboxyfluorescein succinimidyl إستر (CFSE) يكشف الخلايا ابنة بعد الانقسام. ومع ذلك، لا تسمح هذه الأصباغ بتحديد مرحلة دورة الخلية في وقت التحليل. نهج بديل هو استغلال Ki67، علامة التي يتم التعبير عنها بشكل كبير من قبل الخلايا في جميع مراحل دورة الخلية باستثناء المرحلة هادئة G0. لسوء الحظ، لا يسمح Ki67 بمزيد من التمايز لأنه لا يفصل الخلايا في مرحلة S التي تلتزم بالإصابة بالميتوسيس عن تلك الموجودة في G1 التي يمكن أن تبقى في هذه المرحلة، أو المضي قدما في ركوب الدراجات ، أو الانتقال إلى G0.
هنا، ونحن نصف طريقة تدفق القياسات الخلوية لالتقاط "لقطة" من الخلايا التائية في مراحل دورة الخلية المختلفة في أجهزة الماوس اللمفاوي الثانوي. هذه الطريقة تجمع بين Ki67 وتلطيخ الحمض النووي مع مجمع التوافق الهستوباتية الرئيسية (MHC) - الببتيد متعدد الحشرات واستراتيجية مبتكرة gating ، مما يسمح لنا للتمييز بنجاح بين خلايا CD8 T الخاصة بالمستضد في G0، في G1 وفي مراحل S-G2/ M من دورة الخلية في الطحال واستنزاف الغدد الليمفاوية للفئران بعد التطعيم مع ناقلات الفيروسات التي تحمل هفوة مستضد نموذجي لفيروس نقص المناعة البشرية (HIV)-1.
وكانت الخطوات الحاسمة للطريقة هي اختيار صبغة الحمض النووي واستراتيجية اللغات لزيادة حساسية المقايسة وتضمين الخلايا التائية ذات المضادات الخاصة بالنضد التي كانت ستفوتها المعايير الحالية للتحليل. وقد مكنتنا صبغة الحمض النووي Hoechst 33342 منالحصولعلى تمييز عالي الجودة بين قمم الحمض النووي G 0 /G1 و G2/M ، مع الحفاظ على الغشاء والتلوين داخل الخلايا. وبهذه الطريقة إمكانات كبيرة لزيادة المعرفة حول استجابة الخلايا التائية في الجسم الحي وتحسين تحليل الرصد المناعي.
Introduction
الخلايا التائية السذاجة تخضع للتوسع اللاستنساخي والتمايز على مستضد فتيلة. تعرض الخلايا التائية المتمايزة وظائف التأثير الضرورية لإزالة المستضد والحفاظ على ذاكرة خاصة بالمضاد ، وهو أمر أساسي للحماية طويلة الأمد. خلال الخطوات الأولى من الاستجابة الأولية ، فإن تفاعل الخلايا التائية الساذجة مع الخلايا التي تقدم المستضد (APCs) داخل منافذ متخصصة في الأعضاء اللمفاوية أمر بالغ الأهمية للحث على انتشار الخلايا التائية الضخم الذي يميز مرحلة التوسع اللاستنساخي1و2و3. T التفاعل بين الخلية APC وينظم بدقة بتركيز واستمرار مستضد, إشارات المحفزة المشتركة, والعوامل القابلة للذوبان (السيتوكينات وchemkines) التي تؤثر على كمية ونوعية ذرية الخلية التائية4,5,6,7.
على الرغم من الدراسات المكثفة للتوسع في الخلايا التائية، لا يزال من غير المعروف ما إذا كانت الخلايا التائية التي تستعد للمضاد تكمل دورة الخلية بأكملها في موقع التعرف على المستضد، أو ما إذا كانت تهاجر إلى أعضاء أخرى أثناء تطور دورة الخلية. ويرجع هذا النقص في المعرفة إلى خصائص الأدوات المتاحة لتحليل دورة الخلية. وتشمل هذه الأجسام المضادة أحادية النسيلة (mAbs) المحددة للعلامة النووية، Ki67، وأصباغ الخلايا التي تحدد إما الخلايا التي خضعت للمرحلة S من دورة الخلية (على سبيل المثال، بروموديوكسيوريدين (BrdU)) أو تميز بين الخلايا الابنة وأسلافها (على سبيل المثال، إستر الكربوكسي فلووريسين succinimidyl (CFSE)).
ومع ذلك ، فإن صبغات وسم الخلايا ، مثل CFSE و BrdU ، لا تسمح بتحديد ما إذا كانت الخلايا الموجودة في جهاز معين انتشرت محليا أو بالأحرى هاجرت إلى هذا الموقع بعد القسم8،9. وعلاوة على ذلك، فإن البروتين داخل النووية، Ki67، قادر فقط على التمييز بين الخلايا في G0 (الخلايا السلبية Ki67) وتلك الموجودة في أي مرحلة أخرى من مراحل دورة الخلية (خلايا إيجابية Ki67). وبالتالي، لا يميز تحليل Ki67 الخلايا في الانتشار النشط (أي في S أو G2أو M) عن تلك الموجودة في G1، والتي قد تتقدم بسرعة إلى التقسيم أو تبقى لفترات طويلة في G1 أو تعود إلى الهدوء10،11.
هنا، ونحن نصف طريقة جديدة تدفق الخلايا لتحليل دورة الخلية من الخلايا التائية CD8 مستضدمحددة 12 من الطحال والغدد الليمفاوية (LNs) من الفئران تطعيم(الشكل 1). هذه الطريقة يستغل مزيجا من Ki67 وتلطيخ الحمض النووي التي كانت تستخدم سابقا لتحليل دورة الخلية من نخاع العظام الماوس (BM) خلايا الدم13،14. هنا، ونحن طبقت بنجاح Ki67 بالإضافة إلى تلطيخ الحمض النووي، جنبا إلى جنب مع استراتيجية مبتكرة نشرت مؤخرا gating12،لتحليل CD8 T توسيع الخلية التخفي. كنا قادرين على التمييز بوضوح بين خلايا CD8 T الخاصة بالمضاد في G0، في G1، وفي مراحل S-G2/ M في الطحال واستنزاف ال LNs من الفئران الملقحين.
Protocol
تم إيواء الفئران في مرفق بلايسانت للحيوانات، وتم تنفيذ العمل بموجب تصريح وزارة الصحة الإيطالية رقم 1065/2015-PR. وقد اتبع البروتوكول المبادئ التوجيهية لرعاية الحيوان وفقا للقوانين والسياسات الوطنية والدولية (توجيه UE 2010/63/UE؛ و UE 2010/2010/ UE. المرسوم التشريعي الإيطالي 26/2014).
1. إعداد محلول متوسط وتلطيخ
- إعداد المتوسطة كاملة: معهد روزويل بارك التذكاري (RPMI) المتوسطة مع 2 m الجلوتامين، 100 U/mL البنسلين / العقدية، 50 ميكرومتر بيتا ميركابتوثانول، و 10٪ حجم / حجم (v/v) من مصل البقر الجنيني (FBS)
- إعداد تلطيخ العازلة: الفوسفات العازلة المالحة دون Ca2 +/ ملغ2 + (PBS) مع 1٪ الوزن / الحجم (ث / الخامس) ألبوم مصل البقري (BSA) و 2 M الإيثيلينديامينتتراسيتريستيك حمض ملح الصوديوم (EDTA)
2. معالجة الماوس
- رئيس الوزراء 7-8 أسابيع من العمر، أنثى Balb / ج الفئران عن طريق الحقن العضلي (i.m.) في quadriceps من فيروس نقص المناعة البشرية (HIV)-1-هفوة التعبير عن الشمبانزي ناقلات أدينوفيرالية (ChAd3-gag) مع جرعة من 107 جزيئات الفيروسية.
- في 1-4 أشهر بعد فتيلة، وتعزيز مرة واحدة الفئران عن طريق i.m. حقن فيروس نقص المناعة البشرية-1-gag-التعبير عن فيروس أنقرة vaccinia المعدلة (MVA-gag) بجرعة من 106 وحدات تشكيل البلاك.
- في اليوم الثالث بعد التعزيز، ضحي بالفئران المعززة عن طريق خلع عنق الرحم، وحللها بالتوازي مع الفئران غير المعالجة.
- حصاد LNs استنزاف quadriceps (الحرقفي، popliteal، والأربية) والطحال من الفئران عززت وغير المعالجة. وعلاوة على ذلك، جمع BM من الساقين الخلفيتين من الفئران غير المعالجة، واستخدام هذا BM لإعدادات مقياس التدفق والتحكم الإيجابي لتحليل دورة الخلية(الشكل 2).
ملاحظة: توليد ChAd3-gag و MVA-gag ناقلات كما هو موضح سابقا12,15,16,17.
3. عزل استنزاف LN، الطحال، وخلايا BM
- عزل خلايا الطحال و LN
- ضع 5 مل من الوسط الكامل في كل من أنبوبين سعة كل منهما 15 مل، وابقهما على الجليد، جاهزين لجمع الأعضاء.
- التضحية فأر بالغ عن طريق خلع عنق الرحم.
- ضع الماوس على ظهره، وتعقيم سطح الجلد مع 70٪ v/v الإيثانول.
- لجمع LNs الإربية، وجعل شق طولي ~ 1 سم على البطن مع مقص، وتمتد شق مع ملقط.
- تصور LNs الإربية على السطح الداخلي للجلد، وحصادها مع ملقط. ضع LNs الإربية في أحد أنابيب 15 مل اثنين أعدت في الخطوة 3.1.1.
- لجمع الطحال، وجعل شق الصفاق مع مقص وإزالة الطحال. بعد قطع النسيج الضام المحيط، ضع الطحال في أنبوب 15 مل الثاني المعد في الخطوة 3.1.1.
- لجمع LNs إيلياك، نقل الأمعاء جانبا وتصور LNs الحرقفي قريبة من كافا الوريد السفلي، ومن ثم جمعها باستخدام ملقط. ضع LNs الحرقفي في نفس الأنبوب الذي يحتوي على LNs الإربية.
ملاحظة: للحصول على خلايا LN كافية لتلطيخ (راجع المقطع 4) ، غالبا ما يكون من الضروري تجميع ال LNs popliteal ، الأربية ، و iliac من ماوس واحد. هذه LNs كلها تستنزف quadriceps (موقع التطعيم i.m). يستخدم هذا البروتوكول أنبوب واحد فقط 15 مل من LNs المجمعة. - لجمع ال LNs popliteal، فهم الجلد من الساقين الخلفيتين وسحب بلطف إلى أسفل للكشف عن العضلات. ثم، إدراج ملقط بين العضلات تحت مفصل الركبة، وجمع LNs popliteal. مكان LNs popliteal في نفس الأنبوب الذي يحتوي على LNs الإربية والايلية.
ملاحظة: راجع ملاحظة بعد 3.1.7. - ضع الطحال في مصفاة خلايا 70 ميكرومتر داخل طبق ثقافة 60 مم مليء ب 5 مل من الوسط الكامل. باستخدام المكبس حقنة 5 مل، هرس بلطف الجهاز حتى تصنيفها الكامل.
- إزالة مصفاة، ونقل تعليق الخلية إلى أنبوب نظيفة 15 مل.
- إضافة 5 مل من المتوسطة كاملة إلى طبق الثقافة، وغسل بعناية الطبق ومصفاة لضمان أن جميع الخلايا قد تم استردادها. تجمع مع بقية تعليق الخلية الطحال في أنبوب 15 مل.
- لNS الأربية المجمعة، الحرقفي، وpopliteal، وإعداد تعليق خلية واحدة بعد إجراء مماثل لتلك المستخدمة في الخطوات 3.1.9 إلى 3.1.11 للطحال.
- خلايا الطرد المركزي في 400 × غرام لمدة 10 دقيقة في 4 درجة مئوية. تجاهل supernatant ، وإعادة إنفاق الكريات الخلية في برنامج تلفزيوني.
- عد الخلايا مع غرفة نيوباور باستخدام العازلة تحلل خلايا الدم الحمراء و 0.04٪ v/v تريبان الأزرق في برنامج تلفزيوني.
- عزل خلايا BM
- ضع 5 مل متوسط كامل في أنبوب 15 مل، وإبقائه على الجليد، وعلى استعداد لجمع الساقين الخلفيتين.
- التضحية فأر بالغ عن طريق خلع عنق الرحم.
- تعقيم سطح الجلد مع 70٪ v/v الإيثانول.
- جعل ~ 1 سم شق عرضي على الجلد البطني مع مقص، فهم الجلد بحزم على جانبي القطع، وسحب بلطف إلى أسفل للكشف عن عضلات الساقين الخلفيتين.
- للقضاء على الجلد من الجزء الخلفي من الساقين الخلفيتين، والحفاظ على الماوس في موقف supine، ووضع المشبك تحت الركبة، وسحب صعودا لفضح العضلات.
- قطع العظام في الطرفين من ساق واحدة الخلفية: الحوض / مفصل الورك والكاحل.
- نقل كلا الساقين الخلفيتين إلى أنبوب 15 مل أعدت في الخطوة 3.2.1. أبقي الأنبوب على الثلج
- خذ الساقين الخلفيتين من أنبوب 15 مل ونقلها إلى ورق الأنسجة. قطع الساقين الخلفيتين فقط تحت مفصل الركبة لإزالة الساق. تشريح عظم الفخذ والساق من العضلات المحيطة بها، وإزالة الأنسجة الزائدة باستخدام مقص، والرطب ورقة الأنسجة.
- قطع العظام ينتهي مع مقص لفضح رمح النخاع الداخلي. أدخل الساق وعظم الفخذ في أنبوب استخراج BM (انظر التحضير في 3.2.9.1-3.2.9.218)،مع أوسع نهاية في الجزء السفلي.
- قطع تلميح ماصة 200 ميكرولتر في الخط فوق نهاية الطرف وعند خط 100 ميكرولتر.
- ضع الجزء الأوسط في الجزء العلوي الأكبر من الطرف، وضع هذا في أنبوب ميكروفوج 1.5 مل.
- تدور أنبوب استخراج BM في 800 × غرام لمدة 1 دقيقة.
- تجاهل العظام، وإعادة إنفاق بقوة بيليه في 1 مل من المتوسطة كاملة لإزالة أي مجموعات. تصفية تعليق الخلية من خلال مرشح 70 ميكرومتر وضعت على الجزء العلوي من أنبوب 15 مل.
- غسل أنبوب استخراج BM مرتين مع 1 مل من المتوسطة كاملة في كل مرة. تصفية من خلال مرشح 70 ميكرومتر، وتجمع وحدة التخزين مع بقية تعليق الخلية التي تم الحصول عليها في الخطوة 3.2.11.
ملاحظة: أنبوب واحد 15 مل سوف تحتوي على خلايا من كلا الساقين الخلفية من الماوس. - خلايا الطرد المركزي في 400 × غرام لمدة 10 دقيقة في 4 درجة مئوية. تجاهل supernatant ، وإعادة إنفاق بيليه الخلية في برنامج تلفزيوني.
- عد الخلايا مع غرفة نيوباور باستخدام العازلة تحلل خلايا الدم الحمراء و 0.04٪ v/v تريبان الأزرق في برنامج تلفزيوني.
4. تلطيخ الطحال، LN، وخلايا BM
- تقسيم عينات الخلايا لتكون ملطخة إلى 3 مجموعات فرعية: عينات الخلايا للتعويض، بما في ذلك خلايا BM من الفئران غير المعالجة لتكون ملطخة فقط مع Hoechst 33342 (يشار إليها من الآن فصاعدا باسم Hoechst) وخلايا الطحال من الفئران غير المعالجة لاستخدامها لإعداد مزيج الخلايا الميتة / الحية للتعويض عن صبغ الخلايا الميتة ؛ التحكم الإيجابي لتحليل دورة الخلية، ويتألف من عينة BM من الفئران غير المعالجة ؛ وعينات تجريبية تحتوي على عينات الطحال وال LN من الفئران غير المعالجة والملقحين.
ملاحظة: تأكد من وجود خلايا الطحال و LN كافية لتحليل أعداد كافية من خلايا CD8 T الخاصة بالكمامة. غالبا ما يكون من الضروري استخدام خلايا الطحال المجمعة وخلايا LN المجمعة من 3 فئران تم تطعيمها وتلطيخ عينتين متطابقتين أو أكثر من الخلايا المجمعة ، تحتوي كل منها على 3 × 106 خلايا. دمج عينات متطابقة في خطوة من تلطيخ Hoechst. وبالمثل، تجمع بقع خلايا الطحال وخلايا LN من 3 فئران غير معالجة، ودمج عينات متطابقة في نهاية المطاف. خصص عينة غير ملطخة من خلايا الطحال من فأرة غير معالجة لاستخدامها في إعداد الأداة والتعويض. - إعداد مزيج الخلية الميتة / الحية للتعويض صبغ الخلية الميتة (هذا المزيج من الخلايا سوف تكون ملطخة فقط مع صبغة الخلية الميتة).
- سخني حمام مائي عند 65 درجة مئوية.
- اتخاذ aliquot من خلايا الطحال (~ 3 × 106).
- نقل تعليق الخلية إلى أنبوب microfuge، وضعه في حمام الماء في 65 درجة مئوية لمدة 5 دقائق، ومن ثم وضعه على الفور على الجليد لمدة 10 دقيقة.
- خلط الخلايا التي قتلت الحرارة مع خلايا الطحال الحية (~ 3 × 106) في نسبة 1:1، ونقل نصف الخليط إلى لوحة أسفل 96 جولة جيدة (~ 3 × 106 خلايا / جيدا للسيطرة على تلطيخ الخلايا الميتة).
- تلطيخ الخلايا الميتة للعينات التجريبية ، والتحكم الإيجابي لتحليل دورة الخلية ومزيج الخلايا الميتة / الحية
- نقل الطحال، LN، خلايا BM (3 ×10 6 خلايا / جيدا)، ومزيج الخلايا الميتة / الحية (القسم 4.2) إلى لوحة مستديرة القاع 96 جيدا، وفقا لنظام تلطيخ (الخطوة 4.1)، والطرد المركزي في 400 × غرام لمدة 3 دقائق في 4 درجة مئوية.
- Resuspend كل بيليه الخلية في 50 ميكرولتر من صبغة الخلية الميتة المخفف في برنامج تلفزيوني، وإعادة الإنفاق عن طريق الأنابيب صعودا وهبوطا 3 مرات على الفور.
- حضانة لمدة 30 دقيقة في 4 درجة مئوية، محمية من الضوء.
- غسل الخلايا 2 مرات مع تلطيخ العازلة. المرة الأولى مع 200 ميكرولتر و المرة الثانية مع 250 ميكرولتر. لكل جهاز طرد مركزي غسل لوحة في 400 × غرام لمدة 3 دقائق في 4 درجة مئوية.
- تجاهل supernatant، وإعادة إنفاق بيليه الخلية في 20 ميكرولتر من برنامج تلفزيوني.
- تلطيخ خلية الغشاء مع مجمع التوافق الهستوباتية الرئيسية (MHC) - الببتيد multimers وmAbs.
- مع الأخذ في الاعتبار الأحجام اللازمة وفقا لنظام تلطيخ (إعدادات تدفق الخلايا، الجدول 1)،وإعداد الكواشف التالية:
- تمييع mAb 2.4G2 في العازلة تلطيخ وفقا لتخفيف المناسبة (انظر جدول المواد)؛ لكل عينة لتكون ملطخة، استخدم 10 ميكرولتر من هذا التخفيف.
ملاحظة: كتل 2.4G2 ماب ملزمة غير مستضد محددة من الغلوبولين المناعي لمستقبلات FcγIII و FcγII. - تمييع H-2k (د) AMQMLKETI allophycocyanin (APC) المسمى tetramer (Tetr-gag) في المخزن المؤقت للتلطيخ للحصول على التخفيف المناسب (انظر جدول المواد)؛ لكل عينة لتكون ملطخة، استخدم 20 ميكرولتر من هذا التخفيف.
- إعداد مزيج الأجسام المضادة عن طريق تمييع mAbs في العازلة تلطيخ وفقا لتخفيف المناسبة (انظر جدول المواد)التي تم تحديدها سابقا في تجارب المعايرة. لكل عينة لتكون ملطخة، استخدم 20 ميكرولتر من هذا المزيج الأجسام المضادة.
ملاحظة: هنا، تم استخدام بروتين الكلوروفيرويل المضاد للCD3e peridinin (PerCP-Cy5.5) (استنساخ 145-2C11)، والأشعة فوق البنفسجية الرائعة CD8a المضادة (BUV805) (استنساخ 53-6.7)، ومكافحة CD62L phycoerythrin cyanine7 (PECy7) (استنساخ MEL-14).
- تمييع mAb 2.4G2 في العازلة تلطيخ وفقا لتخفيف المناسبة (انظر جدول المواد)؛ لكل عينة لتكون ملطخة، استخدم 10 ميكرولتر من هذا التخفيف.
- أضف 10 ميكرولتر من 2.4G2 mAb المخفف سابقا (الخطوة 4.4.1.1) ، واحتضن لمدة 10 دقائق عند 4 درجات مئوية ، محمية من الضوء.
- إضافة 20 ميكرولتر من APC Tetr-gag المخفف سابقا (الخطوة 4.4.1.2) و 10 ميكرولتر من H-2k (d) AMQMLKETI phycoerythrin (PE) بنتامير (المكبوتة). حضانة لمدة 15 دقيقة في 4 درجة مئوية، محمية من الضوء.
- أضف 20 ميكرولتر من مزيج الأجسام المضادة المعد مسبقا (الخطوة 4.4.1.3)، واحتضن 15 دقيقة عند 4 درجات مئوية، محمية من الضوء.
ملاحظة: وبالتالي، الحجم النهائي هو 80 ميكرولتر لكل بئر (الخطوة 4.3.5، الخطوات 4.4.2 إلى 4.4.4). - غسل الخلايا مع 200 ميكرولتر من العازلة تلطيخ. جهاز طرد مركزي عند 400 × غرام لمدة 5 دقائق عند 4 درجات مئوية.
- Resuspend بيليه الخلية في 250 ميكرولتر من العازلة تلطيخ، ونقل تعليق الخلية إلى أنابيب 5 مل. أضف 1 مل من العازلة تلطيخ إلى الأنبوب، والطرد المركزي في 400 × غرام لمدة 5 دقائق في 4 درجة مئوية.
- خذ المغذيات من خلايا BM (3 × 106 خلايا) (انظر قائمة عينات الخلايا ، القسم 4.1) لاستخدامها لتعويض قناة Hoechst (Hoechst 33342 متحمس بواسطة ليزر الأشعة فوق البنفسجية (إعدادات مقياس التدفق الخلوي(الجدول 2))، ونقل تعليق الخلية إلى أنبوب 5 مل. أضف 1 مل من العازلة تلطيخ إلى الأنبوب، والطرد المركزي 400 × غرام لمدة 5 دقائق في 4 درجة مئوية.
- مع الأخذ في الاعتبار الأحجام اللازمة وفقا لنظام تلطيخ (إعدادات تدفق الخلايا، الجدول 1)،وإعداد الكواشف التالية:
5. التثبيت / التهيئة
- إعداد تثبيت جديدة / permeabilization العازلة عن طريق تخفيف 1 جزء من التركيز التثبيت / permeabilization مع 3 أجزاء من تثبيت / ثنائي permeabilization ، وفقا لتعليمات الشركة المصنعة.
- تجاهل دوامة supernatant والنبض العينات لتجزئة تماما بيليه.
- إضافة 1 مل من التثبيت الطازج / permeabilization العازلة إلى كل أنبوب، بما في ذلك أنبوب مع خلايا الطحال غير الملطخة (3 × 106،انظر قائمة عينات الخلية، القسم 4.1)، ودوامة.
- حضانة لمدة 16 ساعة في 4 درجة مئوية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا.
6. تلطيخ داخل الخلايا
- Ki67 تلطيخ
- إعداد البيرمابيلية الطازجة العازلة 1x عن طريق تخفيف permeabilization العازلة 10x مع الماء المقطر، وفقا لتعليمات الشركة المصنعة. قبل الاستخدام، يجب تصفية المخزن المؤقت permeabilization 1x من خلال عامل تصفية 0.45 ميكرومتر لإزالة التجميعات.
- تمييع mAb Ki67 الفلورسين ايزوثيوسيانات (FITC) (استنساخ SolA15) في permeabilization العازلة 1x (انظر جدول المواد)،كما هو محدد سابقا في تجارب المعايرة (الحجم النهائي من 100 ميكرولتر لكل عينة).
- أضف 3 مل من حاجز permeabilization 1x إلى كل أنبوب، والطرد المركزي عند 400 × غرام لمدة 5 دقائق في درجة حرارة الغرفة (RT).
- تجاهل supernatant وتكرار الخطوة 6.1.3.
- تجاهل supernatant، وإعادة إنفاق بيليه الخلية في 100 ميكرولتر من MAb Ki67 FITC المخفف سابقا (الخطوة 6.1.2).
- احتضان لمدة 30 دقيقة في RT، محمية من الضوء.
- غسل الخلايا 2 مرات مع 4 مل من المخزن المؤقت permeabilization 1x. لكل جهاز طرد مركزي غسيل في 400 × غرام لمدة 5 دقائق في RT.
- إعادة إنفاق بيليه الخلية في برنامج تلفزيوني النظر في المجلدات التالية: 350 ميكرولتر من برنامج تلفزيوني للعينات التي سيتم الحصول عليها مباشرة في تدفق الخلايا; 250 ميكرولتر من برنامج تلفزيوني للعينات التي سيتم احتضانها مع Hoechst قبل وقت قصير من تدفق قياس الخلايا (القسم 6.2).
- تلطيخ الحمض النووي
- إضافة 250 ميكرولتر من 4 ميكروغرام / مل Hoechst في برنامج تلفزيوني لكل عينة (التركيز النهائي من Hoechst هو 2 ميكروغرام / مل).
ملاحظة: في حالة اثنين أو أكثر من عينات متطابقة من 250 ميكرولتر في برنامج تلفزيوني تم إعدادها، ودمجها في هذه الخطوة، وإضافة حجم متساو من محلول Hoechst 4 ميكروغرام / مل في برنامج تلفزيوني (التركيز النهائي من Hoechst هو 2 ميكروغرام / مل). عدد الخلايا يؤثر بشكل كبير على خطوة تلطيخ الحمض النووي. استخدم نفس رقم الخلية في كل عينة. كن على علم أنه حتى انخفاض طفيف في عدد الخلايا (على سبيل المثال ، بسبب فقدان الخلايا في خطوات الغسيل السابقة) يؤدي إلى ربط Hoechst أعلى للحمض النووي وكثافة Hoechst أعلى. - احتضان لمدة 15 دقيقة في RT، محمية من الضوء.
- طرد العينات في 400 × غرام لمدة 5 دقائق في RT.
- Resuspend بيليه الخلية في 350 ميكرولتر من برنامج تلفزيوني.
- إضافة 250 ميكرولتر من 4 ميكروغرام / مل Hoechst في برنامج تلفزيوني لكل عينة (التركيز النهائي من Hoechst هو 2 ميكروغرام / مل).
7. إعداد عينات حبة التعويض
- إعداد 5 ميكرولتر من الأجسام المضادة عن طريق تمييع ماب في العازلة تلطيخ بشكل مناسب.
ملاحظة: لكل mAb مترافق مع الفلوروشروم المستخدمة في التجربة، قم بإعداد عينة حبة التعويض المقابلة لها. - دوامة السيطرة السلبية ومكافحة الفئران / الهامستر Ig, κ حبات شركات قبل الاستخدام.
- لكل عينة، إدخال قطرة واحدة (~ 20 ميكرولتر) من CompBeads التحكم السلبية وإسقاطة واحدة من مكافحة الفئران / الهامستر Ig، ك CompBeads.
- إضافة 5 ميكرولتر من الأجسام المضادة قبل مخفف (الخطوة 7.1) إلى الأنبوب، وماصة صعودا وهبوطا.
- حضانة لمدة 15 دقيقة في 4 درجة مئوية، محمية من الضوء.
- غسل العينات مع 2 مل من العازلة تلطيخ. جهاز طرد مركزي عند 400 × غرام لمدة 5 دقائق عند 4 درجات مئوية.
- تجاهل supernatant، وإعادة إنفاق بيليه بإضافة 500 ميكرولتر من برنامج تلفزيوني إلى كل أنبوب ودوامة.
8. إعداد الصك والتعويض واكتساب عينة تجريبية في مقياس تدفق الخلايا
ملاحظة: راجع إعدادات مقياس التدفق الخلوي(الجدول 2)لتكوين مقياس الخلايا.
- إعداد الأداة العامة والتعويض
- افتح البرنامج للحصول على عينات (راجع جدول المواد)،ثم أنشئ تجربة جديدة بالنقر فوق تجربة جديدة في قسم شريط مساحة العمل وتحديد تجربة فارغة جديدة.
- انقر نقرا مزدوجا على التجربة التي تم إنشاؤها لفتحه.
- في إطار إعدادات السيتومتر، انقر على المعلمات وحدد جميع القنوات (على سبيل المثال، PE، APC، الخ) المستخدمة في لوحة تلطيخ بما في ذلك الأمام مبعثر (FSC) والمعلمات الجانبية مبعثر (SSC).
- حدد مقياس خطي كمعلمة Hoechst بإلغاء تحديد مقياس السجل، وتحقق من العرض (W) لنبض الجهد لFCS وSSC وHoechst.
ملاحظة: يتم عرض كافة المعلمات بشكل افتراضي في مقياس لوغاريتمي (سجل) باستثناء FSC و SSC التي هي في مقياس خطي. يتم تحليل جميع المعلمات من قبل المنطقة (A) والارتفاع (H) من نبض الجهد. - في ورقة العمل العمومية، قم بإنشاء رسم نقطة مع FSC-A على المحور س و SSC-A على المحور ص.
- تشغيل عينة الطحال غير الملون بالنقر فوق الحصول على البيانات على لوحة معلومات الاستحواذ.
- تعيين إعدادات FSC و SSC المناسبة لتصور الخلايا عن طريق تعديل قيم الجهد في المقطع معلمات وإنشاء بوابة لتحديد كافة الخلايا المعروضة في رسم نقطة FSC-A/SSC-A بالنقر فوق بوابة المضلع على شريط أدوات مساحة العمل في ورقة العملالعمومية .
- عرض الخلايا المسورة في المدرجات مع كل معلمة مضان على المحور س.
- تشغيل عينات الطحال غير الملطخة والملطخة بالكامل لضبط كاشف الفلورسينس (PMT) ليكون فصل واضح بين الإشارات السلبية والإيجابية للخلايا الملطخة لكل معلمة مضان.
- لتنفيذ إعداد التعويض، انقر فوق التجربة في شريط مساحة العمل وتحت قسم إعداد التعويض، حدد إنشاء عناصر تحكم التعويض. قم بإلغاء تحديد تضمين أنبوب التحكم غير الملطخ/حسنا وانقر فوق موافق.
ملاحظة: ستؤدي هذه العملية إلى إنشاء نموذج يسمى "عناصر التحكم بالتعويض" و "ورقة عمل عادي" تحتوي على أوراق متعددة مطابقة لكل معلمة محددة. - تشغيل عينة من حبات التعويض (انظر القسم 7)؛ تعيين إعدادات FSC وSSC المناسبة لتصور الخرز عن طريق تعديل قيم الجهد و عتبة الاستحواذ 5000 على معلمات FSC في إطار Cytometer.
- ضبط بوابة P1 على السكان حبة، والتحقق من أن القمم الإيجابية والسلبية على حد سواء مرئية على المحور س. كرر هذه العملية لكل عينة حبة تعويض، وأخيرا سجل كل ملف عينة بالنقر فوق "بيانات السجل" على لوحة التحكم اكتساب (سجل الأحداث 5,000 على الأقل لكل عينة).
- لكل عينة حبة مسجلة، قم بتعيين البوابتين P2 و P3 على القمم الإيجابية والسلبية، على التوالي.
- تشغيل عينات الخلية للحصول على تعويض (راجع الخطوتين 4.2 و4.4.7، والأقسام 5 و6). تعديل الفولتية FSC وSSC وقيمة عتبة تصور الخلايا، وضبط بوابة P1، وأخيرا تسجيل كل ملف عينة (تسجيل ما لا يقل عن 10،000 الأحداث). تعيين P2 و P3 بوابات على قمم إيجابية وسلبية، على التوالي.
ملاحظة: للحصول على تعويض قناة Hoechst استخدم G0/G1 كذروة سالبة (P3) و G2/M كج الموجب (P2). - انقر على التجربة في قسم شريط مساحة العمل وفي قسم إعداد التعويض، حدد حساب التعويض.
- قم بتسمية إعداد التعويض الذي تم إنشاؤه وربطه وحفظه بالتجربة الحالية.
- الحصول على عينة تجريبية
- افتح عينة بالنقر فوق عينة جديدة على شريط أدوات المستعرض، ثم قم بإنشاء استراتيجية gating في ورقة العمل العمومية.
ملاحظة: استراتيجية الحصول على العينة مماثلة لاستراتيجية تحليل العينة، الموصوفة في الشكل 3 والباب 9. - عرض كافة المحتوى الحدث في مخطط مع CD3-A على المحور س. إنشاء بوابة الفاصل الزمني لتحديدالخلايا + CD3 فقط.
- على لوحة معلومات الاستحواذ، حدد بوابة التخزين كجميع الأحداث لعينات LN ، وإما جميع الأحداث أو خلايا CD3+ لعينات الطحال.
- تشغيل العينات التجريبية بسرعة منخفضة، وأخيرا تسجيل جميع الملفات التأكد من جمع ما لا يقل عن 100-200 خلايا CD8 T مستضد محددة لكل عينة من الفئران تطعيمها.
ملاحظة: حجم ملف عينات تجريبية عادة كبيرة (30-120 ميغابايت) ، خاصة عندما يكون تردد خلايا CD8 T الخاصة مستضد منخفضة. وبالتالي، يجب جمع أعداد كبيرة من الأحداث (> 1 ×10 6)لتسجيل ما لا يقل عن 100-200 خلايا CD8 T الخاصة بمضادات الضد. قد تبطئ الملفات الكبيرة عملية تحليل البيانات اللاحقة. الحصول على خلايا CD3+ فقط في عينات الطحال (انظر الخطوة 8.2.2 أعلاه) مفيد للحفاظ على حجم الملف أصغر. - تشغيل وتسجيل التحكم الإيجابي لتحليل دورة الخلية، أي عينة BM من الفئران غير المعالجة.
- افتح عينة بالنقر فوق عينة جديدة على شريط أدوات المستعرض، ثم قم بإنشاء استراتيجية gating في ورقة العمل العمومية.
9. تحليل البيانات
- افتح البرنامج (راجع جدول المواد)،ثم أنشئ مجموعات مختلفة مطابقة للأجهزة المختلفة التي سيتم تحليلها بالنقر فوق إنشاء مجموعة في قسم شريط مساحة العمل (أي إنشاء مجموعة "A-LNs"؛ "ب الطحال"; "c-BM").
ملاحظة: ستظهر المجموعات التي تم إنشاؤها حديثا في قائمة المجموعة، بينما يتم إنشاء مجموعة "التعويض" تلقائيا بواسطة البرنامج. - افتح إطار تعديل المجموعة بالنقر المزدوج فوق اسم المجموعة، وتحقق من مزامنة المجموعات التي تم إنشاؤها حديثا. إذا لم يكن كذلك، إدراج علامة اختيار على الدالة مزامنة.
- اسحب كل ملف .fcs في المجموعة المقابلة له.
- إنشاء استراتيجية gating بدءا من مجموعة "A-LNs".
- انقر نقرا مزدوجا فوق العينة الملطخة بالكامل في المجموعة لفتح إطار الرسم البياني؛ يتم تصنيف المحورين س و ص كما في ملفات FCS (انظر إعدادات مقياس التدفق الخلوي، الجدول 2).
- عرض إجمالي الأحداث المكتسبة لهذه العينة في رسم نقطة مع DNA-A على محور س وDNA-W على المحور ص.
- حدد فقط فئة الخلية المفردة بالنقر فوق مستطيل في قسم أداة gating في إطار الرسم البياني.
ملاحظة: تحتوي الخلايا المفردة على قيم DNA-A كما يلي: 2N (منخفض): بين 2N و 4N (متوسط)، أو يساوي 4N (مرتفع)، بينما قيم DNA-W متطابقة لكل منها (الخطوة 1 من الشكل 3). - انقر نقرا مزدوجا في وسط البوابة المستطيلة لعرض خلايا مفردة في رسم نقطة مع المعلمة FSC-A على المحور س وصبغ الخلية الميتة على المحور ص.
- حدد فقط مجموعة الخلايا الحية بالنقر فوق المضلع في قسم أداة gating في إطار الرسم البياني. الخلايا الحية هي سلبية لصبغ الخلية الميتة (الخطوة 2 من الشكل 3).
- انقر نقرا مزدوجا فوق في وسط البوابة المضلعة لعرض الخلايا في رسم نقطة مع المعلمة FSC-A على المحور س و SSC-A المعلمة على المحور ص.
- انقر على المستطيل، وإنشاء بوابة "استرخاء" لتشمل جميع الخلايا الحية واحدة في هذا الرسم البياني12 (الخطوة 3 من الشكل 3).
- انقر نقرا مزدوجا في وسط البوابة "استرخاء" لعرض الخلايا في مؤامرة نقطة مع CD3 على المحور س وCD8 على المحور ص.
- حدد CD3+CD8+ الخلايا بالنقر على المضلع (الخطوة 4 من الشكل 3).
- انقر نقرا مزدوجا في وسط CD3+CD8+ بوابة لعرض الخلايا في مؤامرة نقطة مع Tetr-gag على المحور س وبنت هفوة على المحور ص.
- حدد خلايا CD8 T الخاصة بالمضاد (موجبة لكل من Tetr-gag و Pent-gag) بالنقر فوق المضلع (الخطوة 5 من الشكل 3).
- انقر نقرا مزدوجا في وسط البوابة الخاصة بالهفوة لعرض الخلايا في مؤامرة نقطة مع الحمض النووي -A على المحور س وKi67 على المحور ص (الشكل 4).
- حدد الخلايا في مراحل دورة الخلية المختلفة عن طريق النقر على رباعية في قسم أداة gating من إطار الرسم البياني.
ملاحظة: الخلية في المرحلة G0 هي خلايا منخفضة Ki67neg-DNA (الربع الأيسر السفلي); الخلايا في G1 هي Ki67pos-DNA منخفضة (الربع الأيسر العلوي); الخلايا في S-G2/M هي Ki67pos-DNA وسيطة / عالية (الربع الأيمن العلوي) (الشكل 4). - نسخ استراتيجية gating التي تم إنشاؤها في عينة واحدة إلى المجموعة المقابلة لتطبيق البوابات على كافة عينات المجموعة.
- كرر الخطوات من 9.5 إلى 9.18 ل "مجموعة A-LN".
- تأكد من أن جميع البوابات مناسبة لكل عينة من مجموعة "b-spleen". لتحليل دورة الخلية بين خلايا BM (التحكم الإيجابي)، انقر في وسط البوابة "المريحة" لعرض الخلايا في مؤامرة نقطة مع DNA-A على المحور س وKi67 على المحور ص.
- تأكد من أن جميع البوابات مناسبة لكل عينة من المجموعات 3 (أي للخلايا من الطحال، LN، وBM).
ملاحظة: قد يكون لبوابة تعداد الخلية المفردة (الخطوة 9.7) والبوابة الرباعية لدورة الخلية (الخطوة 9.17) إحداثيات بوابة مختلفة في عينات مختلفة، ويرجع ذلك أساسا إلى الاختلافات الطفيفة المحتملة لكثافة صبغة Hoechst بين العينات (القسم 6.2). لهذا السبب، قد يكون من الضروري تعديل بوابة تعداد الخلية المفردة والبوابات الرباعية لدورة الخلية في كل عينة. سيتم القيام بذلك كما يلي: انقر نقرا مزدوجا فوق اسم المجموعة، وإزالة المزامنة من خصائص المجموعة. تسمح هذه العملية بتعديل البوابات في عينة واحدة دون تعديل نفس البوابات في جميع العينات الأخرى للمجموعة. بعد إزالة المزامنة، قم بتعديل البوابات عند الضرورة. - لتصور النتائج التي تم الحصول عليها من خلال هذا التحليل، انقر فوق محرر التخطيط في قسم شريط مساحة العمل لفتحه. اسحب كل بوابة من استراتيجية gating في جزء العينة إلى محرر التخطيط ، ووضع المؤامرات وفقا لتسلسل استراتيجية gating. إذا لزم الأمر، قم بتغيير نوع الرسم البياني بالنقر المزدوج على الرسم المطابق في التخطيط وتحديد النوع المناسب في إطار تعريف الرسم البياني.
- انقر على المجموعة وتكريرها حسب الوظائف على شريط التخطيط لتصور النتائج التي تم الحصول عليها في كل جهاز، ومقارنة عينات مختلفة.
النتائج
تم تحليل مراحل دورة الخلية من الخلايا من الطحال، LNs، وBM من الفئران بالب / ج باستخدام صبغ الحمض النووي الفلورسنت، Hoechst، ومكافحة Ki67 ماب، وفقا للبروتوكول ملخصة في الشكل 1. سمح هذا التلطيخ بتمايز الخلايا في المراحل التالية من دورة الخلية: G0 (Ki67neg، مع 2N من الحمض النووي المعرفة باسم DNAlow)، G1 (Ki67pos، DNAlow)، و S-G2/M (Ki67pos، مع محتوى الحمض النووي تتألف بين 2N و 4N، أو يساوي 4N من الحمض النووي المعرفة باسم DNAintermediate/high).
قمنا أولا بتحليل دورة الخلية لخلايا BM لإعادة إنتاج النتائج المنشورة سابقا13و14 ثم قمنا بتحليل الخلايا ذات الاهتمام ، أي خلايا CD8 T. ويبين الشكل 2 مثالا نموذجيا لتحليل دورة الخلية لخلايا BM (الشكل 2A). وأسفر البروتوكول عن معامل منخفض للتباين (CV) يبلغ ذروته في G0/G1 و G2/M DNA ، مما يشير إلى الجودة الممتازة لتلطيخ الحمض النووي(الشكل 2B، مما يدل على مثال مع السيرة الذاتية < 2.5 ؛ السيرة الذاتية كانت دائما < 5 في جميع التجارب).
ثم طبقنا نفس البروتوكول على خلايا CD8 T الخاصة بالمضاد من الفئران الملقحة. تم تطعيم الفئران BALB / c ضد هفوة مستضد فيروس نقص المناعة البشرية-1 باستخدام تشاد3-هفوة ل فتيلة وMVA-gag لتعزيز، وكلاهما مصممة لحمل هفوة فيروس نقص المناعة البشرية-1. في اليوم (د) 3 بعد دفعة، قمنا بتحليل وتيرة الخلايا التائية CD8 الخاصة بالهفوة من الطحال واستنزاف LNs. لقد استفدنا من استراتيجية الغاينج المحددة حديثا للخلايا التائية في المرحلة المبكرة من الاستجابة المناعية ، والتي على النقيض من الاستراتيجية التقليدية ، مناسبة للكشف عن خلايا CD8 T المستجيبة للمضاد عالية التنشيط12. نفذنا الاستراتيجية الجديدة في خمس خطوات لاحقة. في الخطوة 1، استبعدنا doublets أو المجاميع بواسطة بوابة DNA-A/-W، وفي الخطوة 2، حددنا الخلايا الحية عن طريق استبعاد علامة الخلية الميتة. في الخطوة 3، حددنا السكان من مصلحة باستخدام غير التقليدية "استرخاء" FSC-A/ SSC-A بوابة(الشكل 3A) بدلا من بوابة الخلايا الليمفاوية الضيقة الكنسي12. بعد gating على CD3+CD8+ الخلايا (الخطوة 4 من الشكل 3A)،حددنا الخلايا CD8 T الكمامة محددة باستخدام اثنين من multimers MHC مختلفة، أي، بنت هفوة وتيتر هفوة (الخطوة 5 من الشكل 3A). استخدمنا اثنين من multimers بدلا من واحد لتحسين حساسية الكشف عن الخلايا CD8 T الكمامة محددة في الفئران المطعمة، دون زيادة خلفية تلطيخ في الفئران غير المعالجة(الشكل 3B و C،الخطوة 5). وهكذا، نجحنا في تمييز الفئران غير المعالجة (0.00٪ و 0.00٪ خلايا CD8 T الخاصة بالمضاد في LNs والطحال، على التوالي) من الفئران الملقحة (0.46٪ و 0.29٪ خلايا CD8 T الخاصة بالمضاد في LNs والطحال، على التوالي، الشكل 3B و C).
وتجدر الإشارة إلى أن البروتوكول سمح لنا بالحصول على خلفية منخفضة للغاية في بوابة خلايا CD8 T الخاصة بالمضاد من LNs وطحال الفئران غير المعالجة (عادة 0.00٪ وبحد أقصى 0.02٪). وأظهرت المقارنة بين الكمامة المحددة وليس الكمامة محددة FSC-A / SSC-A المؤامرات أن الخلايا الخاصة الكمامة لديها عالية SSC-A و FSC-A (الشكل 3D)، مما يؤكد الحاجة إلى استخدام "استرخاء" FSC-A/ SSC-A بوابة لالتقاط هذه الخلايا. ثم قمنا بتقييم النسب المئوية للخلايا CD8 T الخاصة بالهفوة في مراحل دورة الخلية المختلفة(الشكل 4A). وجدنا أن خلايا CD8 T الخاصة بالهفوة في الطحال وأكثر من ذلك في LNs المستنزفة تحتوي على نسبة عالية من الخلايا في مراحل S-G2/ M في اليوم 3 بعد الدفعة (18.60٪ و 33.52٪، على التوالي).
وعلاوة على ذلك، وجدنا أن خلايا CD8 T الخاصة بالهفوة في مراحل S-G2/M كان لها FSC-A و SSC-A عالية، عندما تم تراكبها على إجمالي خلايا CD8 T من نفس الجهاز(الشكل 4B). كان التعبير CD62L بواسطة خلايا CD8 T الخاصة بالهفوة منخفضا ، كما هو متوقع للخلايا التائية المنشطة ، باستثناء عدد قليل من الخلايا في G0 في LNs (الشكل 4C). وإجمالا، أكدت هذه النتائج أن البوابة "المريحة" (الخطوة 3 من الشكل 3A وB وC)كانت مطلوبة لتشمل جميع خلايا CD8 T الخاصة بالمستضداتالمنتشرة 12. كان البروتوكول قيما للغاية لتقييم "لقطة" لمراحل دورة الخلية من خلايا CD8 T الخاصة بالمضاد في وقت التحليل والتعبير CD62L بواسطة الخلايا في مراحل دورة الخلية المختلفة.

الشكل 1: مخطط البروتوكول لتحليل دورة الخلية للخلايا التائية CD8 الخاصة بالمضاد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
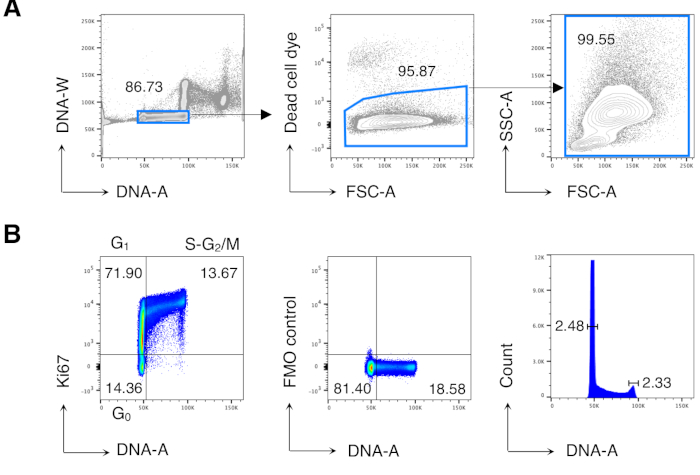
الشكل 2: تحليل دورة الخلية من خلايا BM. تم تلوين خلايا BM من فئران Balb/c غير المعالجة وتحليلها عن طريق قياس التدفق الخلوي. (أ) مثال على استراتيجية الصياغة. نحن بوابات على خلايا واحدة في مؤامرة الحمض النووي A / W (يسار) وبعد ذلك على الخلايا الحية عن طريق استبعاد صبغ الخلايا الميتة (وسط). ثم تم استخدام بوابة FSC-A/SSC-A "المريحة" لجميع خلايا BM (يمين). (ب) مثال تحليل دورة الخلية لخلايا BM (يسار). استخدمنا مزيجا من Ki67 وتلطيخ الحمض النووي لتحديد الخلايا في المراحل التالية من دورة الخلية: G0 (الربع الأيسر السفلي، خلايا Ki67neg-DNAlow)، G1 (الربع الأيسر العلوي، Ki67pos-DNAlow)، S-G2/M (الربع الأيمن العلوي، Ki67pos-DNAintermediate/high). يتم عرض سيطرة الفلوريس ناقص واحد (FMO) على Ki67 mAb (وسط) ومس الرسم البياني للحمض النووي (يمين). في مؤامرة مخطط الحمض النووي، تتوافق البوابتين اليسرى والأي اليمنى مع G0/G1 وذروة الحمض النووي G2/M، على التوالي، وتمثل الأرقام معاملات الاختلاف (CV) لكل قمة. في جميع المؤامرات الأخرى، تمثل الأرقام نسب الخلية في البوابات المشار إليها. ويبين الشكل تجربة تمثيلية واحدة من أصل 5 تجارب. في كل تجربة، قمنا بتحليل خلايا BM المجمعة من 3 فئران. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
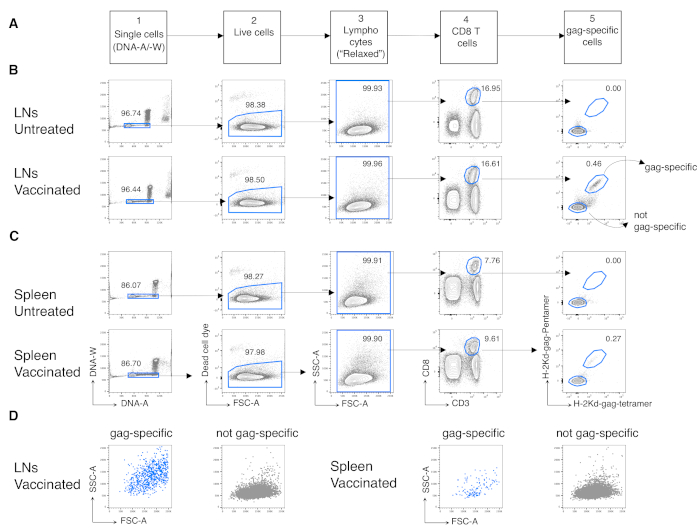
الشكل 3:تحليل خلايا CD8 T الخاصة بمضادات الضد من LNs والطحال. تم تجهيز الفئران بالب / ج عضلي (ط.m.) مع تشاد3 هفوة وعززت ط.m. مع MVA-gag. في اليوم الثالث بعد التعزيز، تم تلوين واستنزاف خلايا LN والطحال من فئران التحكم الملقحة وغير المعالجة وتحليلها عن طريق قياس التدفق الخلوي. (أ) مخطط استراتيجية التنغيق في خمس خطوات لتحديد الخلايا المفردة (الخطوة 1)؛ الخلايا الحية (الخطوة 2)؛ الخلايا اللمفاوية (الخطوة 3)؛ خلايا CD8 T (الخطوة 4)؛ وخلايا خاصة بالتكميم (الخطوة 5). (ب-ج) مثال على المؤامرات: تحليل الخلايا من (B) LNs و (C) طحال الفئران غير المعالجة (العلوية) والملقحين (السفلية). حددنا خلايا واحدة على مؤامرة الحمض النووي A / -W في الخطوة 1. ثم، في الخطوة 2، اخترنا الخلايا الحية عن طريق استبعاد صبغة الخلية الميتة. في الخطوة 3، استخدمنا بوابة "مريحة" غير قانونية للخلايا الليمفاوية. في الخطوة 4، حددنا خلايا CD8 T من خلال تعبيرها المزدوج عن CD3 و CD8. ثم حددنا خلايا محددة الكمامة وليس الكمامة محددة في الخطوة 5، على أساس قدرتها على ربط fluorochrome المسمى H-2kd-gag-Pentamer (بنتامر بنتامر) وH-2kd-gag-Tetramer (تيتر-هفوة)، أم لا، على التوالي. (د) ملفات تعريف FSC-A/SSC-A للخلايا (الزرقاء) الخاصة بالكمامة وليس الخلايا (الرمادية) الخاصة بالكمامة بعد الالتهاز كما هو موضح أعلاه. تمثل الأرقام نسب الخلية في البوابات المشار إليها. ويبين الشكل تجربة تمثيلية واحدة من أصل 5 تجارب. في كل تجربة، قمنا بتحليل الطحال المجمع وتجميع خلايا LN من 3 فئران تم تطعيمها و3 فئران غير معالجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
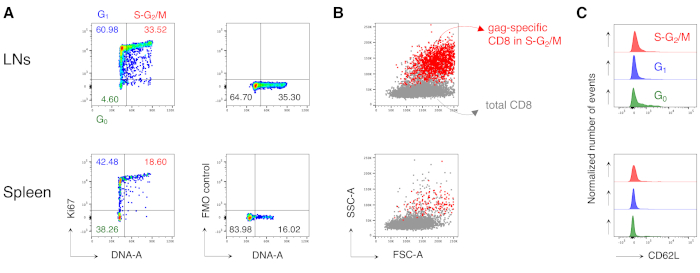
الشكل 4: تحليل دورة الخلية من خلايا CD8 T الخاصة مستضد. تم تطعيم الفئران كما هو الحال في الشكل 3 وتم إجراء تحليل دورة الخلية للخلايا الخاصة بالهفوة في اليوم 3 بعد التعزيز ، بعد أن تم إجراء 5 خطوات كما هو الحال في الشكل 3. (أ)مثال على تحليل دورة الخلية للخلايا CD8 T الخاصة بالهفوة من LNs (أعلى) والطحال (أسفل) الفئران الملقحة. تم تحديد مراحل دورة الخلية كما في الشكل 2B. تمثل اللوحات خلايا في G0، في G1، وفي S-G2/ M (يسار) وتحكم Fluorescence Minus One (FMO) في Ki67 mAb (يمين). تمثل الأرقام نسب الخلية في البوابات المشار إليها. (ب) FSC-A/SSC-A نقطة المؤامرات التي تظهر الخلايا التائية CD8 الكمامة محددة في مراحل S-G2/M (باللون الأحمر) مضافا إليها على مجموع CD3+CD8+ T الخلايا (باللون الرمادي) من LNs (أعلى) والطحال (أسفل) الفئران المطعمة. (ج) تعويض المدرجات التكرارية التي تظهر التعبير CD62L بواسطة خلايا CD8 T الخاصة بالهفوة في G0 (الأخضر)، وفي G1 (الأزرق)، وفي S-G2/M (أحمر) من LNs (أعلى) والطحال (أسفل) الفئران المطعمة. تشير المحاور y إلى عدد الأحداث التي تم تسويتها. ويبين الشكل مثالا تمثيليا من أصل 5 تجارب مستقلة أجريت على ما مجموعه 15 فأرا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
المواد التكميلية: إعدادات مقياس التدفق الخلوي. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
على الرغم من أن التوسع في الخلايا التائية قد درس بشكل مكثف ، إلا أن بعض الجوانب لا تزال غير معروفة ، ويرجع ذلك في الغالب إلى أن الأدوات المتاحة للتحقيق فيها قليلة ولها عيوبها الخاصة. من هذا المنظور، وضعنا طريقة حساسة للغاية لقياس التدفق الخلوي لتحليل دورة الخلية من خلايا CD8 T الخاصة بالمضاد في الأوقات المبكرة بعد التطعيم في نموذج الماوس. ويستند البروتوكول على مزيج من Ki67 وتلطيخ الحمض النووي، والتي كانت تستخدم سابقا لتحليل دورة الخلية من الخلايا الدموية BM في الفئران13،14. لتكييف البروتوكول مع خلايا CD8 T الخاصة بالمضاد ، كان علينا النظر في عدد قليل من القضايا الحرجة ، بما في ذلك اختيار صبغة الحمض النووي ، والظروف المناسبة للحصول على تلطيخ الحمض النووي القابل للمقارنة عبر عينات مختلفة ، واستراتيجية gating لتحليل البيانات.
تتوفر العديد من الأصباغ لتلطيخ الحمض النووي، بما في ذلك البروبيديوم يوديد و 7-أميناكتينوميسين D. اخترنا Hoechst لأنه كان متوافقا مع تلطيخ الغشاء وبروتوكول التثبيت / permeabilization خفيفة المطلوبة لتلطيخ Ki67. في الوقت نفسه ، سمح لنا التلطيخ مع Hoechst بالحصول على مخطط بياني للحمض النووي بجودة ممتازة ، أي أن قمم G0/ G1 و G2/ M الحمض النووي كان لها معامل أقل بكثير من الاختلاف (CV) من قمم الحمض النووي التي يتم الحصول عليها عادة مع أصباغ الحمض النووي الأخرى ، على سبيل المثال ، DRAQ519. في الواقع، Hoechst يمكن وصمة عار الحمض النووي حتى في الخلايا الحية20.
واستخدمت بعض الاستراتيجيات لتجنب التقلبات في كثافة Hoechst في عينات مختلفة من نفس التجربة. تم إجراء تلطيخ Hoechst قبل الحصول على العينة مباشرة في مقياس التدفق الخلوي لتقليل انخفاض كثافة الصبغة خلال الوقت. بالنسبة للمهتمين بإعادة إنتاج البروتوكول في تجارب كبيرة مع العديد من العينات ، نوصي بإجراء تلطيخ Hoechst على عينات قليلة في كل مرة. عيب واحد آخر هو أن كثافة Hoechst يمكن أن تتأثر بشدة برقم الخلية أثناء الحضانة مع الصبغة. لهذا السبب، نوصي بشدة دائما باستخدام نفس العدد من الخلايا ونفس الحجم لكل عينة لتلطيخ الحمض النووي. إذا كان هناك حاجة إلى عدد كبير من الخلايا للحصول على مقياس التدفق الخلوي، نوصي بإعداد عينتين متطابقتين أو أكثر ثم دمجها قبل خطوة تلطيخ Hoechst مباشرة.
وتتمثل إحدى النقاط الرئيسية للبروتوكول في استراتيجية تحليل البيانات. نشرنا مؤخرا استراتيجية جديدة لتحليل الخلايا التائية في الأوقات الأولى من الاستجابة المناعية ، والتي سمحت لنا بزيادة حساسية الكشف عن الخلايا التائية الخاصة بالمضاد12. وطبقنا هذه الاستراتيجية على البيانات المبينة هنا على النحو التالي. أولا، استبعدنا مجاميع الخلايا في مؤامرة الحمض النووي A/W. ثانيا، بعد إخراج الخلايا الميتة، استخدمنا بوابة كبيرة إلى حد ما للخلايا اللمفاوية في مؤامرة FSC/SSC ("بوابة مريحة"). من خلال هذه الاستراتيجية، تمكنا من تضمين خلايا CD8 T الخاصة بالمضاد المنشط للغاية في S-G2/M التي عادة ما تفوتها استراتيجيات gating الحالية، حيث أن هذه الخلايا لديها FSC-A و SSC-A عالية. وباختصار، يمثل تحليل البيانات جزءا حاسما من الطريقة، وهو أمر ضروري للحصول على كشف حساس للخلايا التائية المنشطة/المتكاثرة الخاصة بالمضاد.
وتمنع هذه الطريقة إمكانية فقدان بيانات الخلايا التائية الحرجة في المراحل المبكرة من الاستجابة المناعية وتفتح آفاقا جديدة لرصد المناعة للخلايا التائية. قد يكون التحسن المستقبلي هو تضمين تلطيخ فوسفو-هيستون 3 الذي من شأنه أن يسمح بالتمايز بين G2 و M21. القيد الحالي هو أن الخلايا يجب أن تكون ثابتة و permeabilized وصمة عار للعلامة النووية، Ki67. وبالتالي، لا يمكن استخدام الخلايا لأنواع أخرى من التحليل مثل الفرز والتحليل الوظيفي اللاحق. وعلاوة على ذلك، فإن أصباغ الحمض النووي، بما في ذلك هويشست، تتداخل عادة مع تحليل الحمض النووي الجينومي ولا تصلح لهذا النوع من التقييم. تحديد علامات الغشاء التي ترتبط مع مراحل دورة الخلية المختلفة التي يمكن أن تكون ملطخة على الخلايا الحية يمكن التغلب على هذا القيد. في الختام، فإن هذه الطريقة لديها إمكانات كبيرة لتقييم الخلايا التائية المنشطة / المنتشرة في عدة سياقات مثل التطعيم والعدوى والأمراض بوساطة المناعة والعلاج المناعي.
Disclosures
أ. فولغوري وس. كابوني هما موظفان في شركة Reithera Srl. A. نيقوسيا تم تسميته مخترعا في طلب براءة الاختراع WO 2005071093 (A3) "حاملات لقاح فيروس الشمبانزي الغدي". وليس لدى المؤلفين الآخرين ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل ريثيرا، ومشروع MIUR 2017K55HLC_006، ومنحة 5 × 1000 من أسوسيازيون إيطاليانا رايسركا سول كانكرو (AIRC). تم الحصول على التترامر التالي من خلال مرفق تترامر المعاهد القومية للصحة: APC-مترافق H-2K (د) هفوة فيروس نقص المناعة البشرية 197-205 AMQMLKETI.
Materials
| Name | Company | Catalog Number | Comments |
| 1-200 μL universal fit bulk packed pipet tips | Corning | CLS4866-1000EA | |
| 2.4G2 anti-FcγR mAb | BD | 553141 | 10 μg/ml final concentration |
| 5 ml syringe plunger | BD Emerald | 307733 | |
| 15 ml conical tubes | MercK Millipore | SBHA025SB | |
| 60 mm TC-treated Cell Culture Dish | Falcon | 353002 | |
| 70 μm cell strainer | Falcon | 352097 | |
| 96-well Clear Round Bottom TC-treated Culture Microplate | Falcon | 353077 | |
| Anti-Rat/Hamster Ig,k/Negative Control Compensation Particles | BD- Bioscience | 552845 | |
| Beta-mercaptoethanol | Sigma | M3148 | |
| Bovine Serum Albumin | Sigma | A07030 | |
| BUV805 Rat Anti-Mouse CD8a | BD- Bioscience | 564920 | 4 μg/ml final concentration |
| Dulbecco's Phosphate Buffer Saline w/o Calcium w/o Magnesium | Euroclone | ECB4004L | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120159 | |
| Ethanol | Sigma | 34852-1L-M | |
| Ethylenediaminetetraacetic Acid Disodium Salt solution (EDTA) | Sigma | E7889 | |
| Fetal Bovine Serum | Corning | 35-079-CV | |
| Filcon, Sterile, Syringe-Type 70 μm | Falcon | 352350 | |
| Fixable Viability Dye eFluor 780 | eBioscience | 65-0865-14 | 1:1000 final concentration |
| Foxp3 / Transcription Factor Staining Buffer Set | eBioscience | 00-5523-00 | This Set contains fixation/permeabilization concentrate and diluent, and permeabilization buffer 10x |
| H-2k(d) AMQMLKETI allophycocyanin (APC)-labelled tetramer | provided by NIH Tetramer Core Facility | 6 μg/ml final concentration | |
| H-2k(d) AMQMLKETI phycoerythrine (PE) labelled pentamer | Proimmune | F176-2A-E - 176 | 10 μL / sample |
| Hoechst 33342, Trihydrochloride, Trihydrate - 10 mg/mL Solution in Water | ThermoFisher | H3570 | |
| Ki-67 Monoclonal Antibody (SolA15), FITC | eBioscience | 11-5698-82 | 5 μg/ml final concentration |
| L-Glutamine 100X (200 mM) | Euroclone | ECB3000D | |
| Millex-HA Filters 0,45 µm | BD | 340606 | |
| Penicillin/Streptomycin 100X | Euroclone | ECB3001D | |
| PE/Cyanine7 anti-mouse CD62L Antibody | Biolegend | 104418 | 0.2 μg/ml final concentration |
| PerCP-Cy™5.5 Hamster Anti-Mouse CD3e | BD- Bioscience | 551163 | 4.4 μg/ml final concentration |
| Red Blood Cell Lysis Buffer | Sigma | R7757 | |
| Round-Bottom Polystyrene Tubes, 5 mL | Falcon | 352058 | |
| RPMI 1640 Medium without L-Glutamine with Phenol Red | Euroclone | ECB9006L | |
| Software package for analyzing flow cytometry data | FlowJo | v.10 | |
| Software for acquisition of samples at flowcytometer | BD FACSDiva | v 6.2 | |
| Trypan Blue Solution | Euroclone | ECM0990D |
References
- Castellino, F., et al. Chemokines enhance immunity by guiding naive CD8+ T cells to sites of CD4+ T cell-dendritic cell interaction. Nature. 440 (7086), 890-895 (2006).
- Zhang, N., Bevan, M. J. CD8(+) T cells: foot soldiers of the immune system. Immunity. 35 (2), 161-168 (2011).
- Bajénoff, M., et al. Highways, byways and breadcrumbs: directing lymphocyte traffic in the lymph node. Trends Immunology. 28 (8), 346-352 (2007).
- Bevan, M. J., Fink, P. J. The CD8 response on autopilot. Nature Immunology. 2 (5), 381-382 (2001).
- Van Stipdonk, M. J., Lemmens, E. E., Schoenberger, S. P. Naïve CTLs require a single brief period of antigenic stimulation for clonal expansion and differentiation. Nature Immunology. 2 (5), 423-429 (2001).
- Kaech, S. M., Wherry, E. J., Ahmed, R. Effector and memory T-cell differentiation: implications for vaccine development. Nature Review Immunology. 2 (4), 251-262 (2002).
- Beverley, P. C. Primer: making sense of T-cell memory. Nature Clinical Practice Rheumatology. 4 (1), 43-49 (2008).
- Parretta, E., et al. CD8 cell division maintaining cytotoxic memory occurs predominantly in the bone marrow. Journal of Immunology. 174 (12), 7654-7664 (2005).
- Di Rosa, F. Maintenance of memory T cells in the bone marrow: survival or homeostatic proliferation. Nature Review Immunology. 16 (4), 271 (2016).
- Di Rosa, F. Two niches in the bone marrow: a hypothesis on life-long T cell memory. Trends in Immunology. 37 (8), 503-512 (2016).
- Di Rosa, F. Commentary: Memory CD8(+) T cells colocalize with IL-7(+) stromal cells in bone marrow and rest in terms of proliferation and transcription. Frontiers in Immunology. 7, 102 (2016).
- Simonetti, S., et al. Antigen-specific CD8 T cells in cell cycle circulate in the blood after vaccination. Scandinavian Journal of Immunology. 89 (2), 12735 (2019).
- Wilson, A., et al. c-Myc controls the balance between hematopoietic stem cell self-renewal and differentiation. Genes & Development. 18 (22), 2747-2763 (2004).
- Hirche, C., et al. Systemic virus infections differentially modulate cell cycle state and functionality of long-term hematopoietic stem cells in vivo. Cell Report. 19 (11), 2345-2356 (2017).
- Colloca, S., et al. Vaccine vectors derived from a large collection of simian adenoviruses induce potent cellular immunity across multiple species. Science Translational Medicine. 4 (115), (2012).
- Di Lullo, G., et al. Marker gene swapping facilitates recombinant Modified Vaccinia Virus Ankara production by host-range selection. Journal of Virological Methods. 156 (1-2), 37-43 (2009).
- Di Lullo, G., et al. The combination of marker gene swapping and fluorescence-activated cell sorting improves the efficiency of recombinant modified vaccinia virus Ankara vaccine production for human use. Journal of Virological Methods. 163 (2), 195-204 (2010).
- . Mouse phenotype Available from: https://www.mousephenotype.org/data/secondaryproject/3i (2020)
- Yoon, H., Kim, T. S., Braciale, T. J. The cell cycle time of CD8+ T cells responding in vivo is controlled by the type of antigenic stimulus. PLoS One. 5 (11), 15423 (2010).
- Pauklin, S., Vallier, L. The cell-cycle state of stem cells determines cell fate propensity. Cell. 155 (1), 135-147 (2013).
- Vignon, C., et al. Flow cytometric quantification of all phases of the cell cycle and apoptosis in a two-color fluorescence plot. PLoS One. 8 (7), 68425 (2013).
Erratum
Formal Correction: Erratum: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice
Posted by JoVE Editors on 11/03/2021. Citeable Link.
An erratum was issued for: A DNA/Ki67-Based Flow Cytometry Assay for Cell Cycle Analysis of Antigen-Specific CD8 T Cells in Vaccinated Mice. The Authors section and a figure were updated.
The authors section was updated from:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
* These authors contributed equally
To:
Sonia Simonetti*1,2, Ambra Natalini*1,2, Giovanna Peruzzi3, Alfredo Nicosia4, Antonella Folgori5, Stefania Capone5, Angela Santoni2,6, Francesca Di Rosa1
1Institute of Molecular Biology and Pathology, National Research Council of Italy (CNR),
2Department of Molecular Medicine, University of Rome “Sapienza”,
3Center for Life Nano Science, Istituto Italiano di Tecnologia,
4Department of Molecular Medicine and Medical Biotechnology, University of Naples Federico II,
5Reithera Srl
6IRCCS, Neuromed
* These authors contributed equally
Figure 1 was updated from:
Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.
To:

Figure 1: Scheme of the protocol for cell cycle analysis of antigen-specific CD8 T cells. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved