A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحريض وتحليل الإجهاد التأكسدي في الجمال النائم Transposon-Transfected الخلايا الظهارية صبغة الشبكية البشرية
In This Article
Summary
نقدم بروتوكول لتطوير واستخدام نموذج الإجهاد التأكسدي عن طريق علاج الخلايا الظهارية الصباغية الشبكية مع H2O2، وتحليل مورفولوجيا الخلايا ، وقابلية البقاء ، والكثافة ، الجلوتاثيون ، ومستوى UCP-2. وهو نموذج مفيد للتحقيق في التأثير المضاد للأكسدة من البروتينات التي تفرزها الخلايا المتحولة جنسيا لعلاج الانحطاط العصبي الشبكي.
Abstract
يلعب الإجهاد التأكسدي دورا حاسما في العديد من الأمراض التنكسية ، بما في ذلك الضمور البقعي المرتبط بالعمر (AMD) ، وهو مرض يصيب حوالي 30 مليون مريض في جميع أنحاء العالم. وهو يؤدي إلى انخفاض في ظهارة صبغ الشبكية (RPE) توليفها العوامل العصبية، على سبيل المثال، عامل مشتق من ظهارة الصباغ (PEDF) وعامل تحفيز مستعمرة الحبيبية الضامة (GM-CSF)، تليها فقدان خلايا RPE، وفي نهاية المطاف مستقبلات ضوئية وخلية العقدة الشبكية (RGC) الموت. نحن نفترض أن إعادة تشكيل بيئة الشبكية العصبية والعصبية من خلال زرع تحت الشبكية لخلايا RPE المصابة التي تفرط في التعبير عن PEDF و GM-CSF لديه القدرة على منع انحطاط الشبكية من خلال التخفيف من آثار الإجهاد التأكسدي ، وتثبيط الالتهاب ، ودعم بقاء الخلية. باستخدام نظام الإرسال والاستقبال الجمال النائم (SB100X)وقد تم تحويل خلايا RPE الإنسان مع الجينات PEDF وجنرال موتورز-CSF وأظهرت التكامل الجيني مستقرة، والتعبير الجيني على المدى الطويل، وإفراز البروتين باستخدام qPCR، وصمة عار الغربية، ELISA، و immunofluorescence. لتأكيد وظائف وفعالية PEDF و GM-CSF التي تفرزها خلايا RPE المصابة ، قمنا بتطوير اختبار في المختبر لتحديد الحد من الإجهاد التأكسدي H2O2- الناجم عن خلايا RPE في الثقافة. تم تقييم حماية الخلايا من خلال تحليل مورفولوجيا الخلايا والكثافة ومستوى الجلوتاثيون داخل الخلايا والتعبير الجيني UCP2 وقابلية بقاء الخلية. وأظهر كل من خلايا RPE المصابة التي تزيد من التعبير عن PEDF و / أو GM-CSF والخلايا غير المصابة ولكن المعالجة مع PEDF و / أو GM-CSF (المتاحة تجاريا أو النقية من الخلايا المصابة) حماية كبيرة للخلايا المضادة للأكسدة مقارنة بالضوابط غير المعالجة. النموذج الحالي H2O2هو نهج بسيط وفعال لتقييم التأثير المضاد للأكسدة للعوامل التي قد تكون فعالة لعلاج AMD أو الأمراض العصبية المماثلة.
Introduction
النموذج الموصوف هنا، يقدم نهجا مفيدا لتقييم كفاءة العوامل الصيدلانية الحيوية للحد من الإجهاد التأكسدي في الخلايا. لقد استخدمنا النموذج للتحقيق في الآثار الوقائية ل PEDF و GM-CSF على الإجهاد التأكسدي H2O2- بوساطة على الخلايا الظهارية الصباغية الشبكية ، والتي تتعرض لمستويات عالية من O2، والضوء المرئي ، وداء البلعومية لأغشية الجزء الخارجي مستقبلات ضوئية ، مما يولد مستويات كبيرة من أنواع الأكسجين التفاعلي (ROS)1، 2. وهي تعتبر مساهما رئيسيا في الإمراض من الضمور البقعي المرتبط بالعمر الوعائي (aAMD)3،4،5،6،7،8. الى جانب ذلك ، هناك انخفاض في العوامل العصبية المركبة RPE ، وتحديدا عامل الصباغ المشتقة من الظهارة (PEDF) ، وعوامل النمو الشبيهة بالإنسولين (IGFs) ، وعامل تحفيز مستعمرة الماكروفولسيتي الحبيبي (GM-CSF) مما يؤدي إلى خلل وفقدان خلايا RPE ، تليها خلية الشبكية والشبكية العقدية (RGC) وفاة3و4و5 . AMD هو مرض معقد ينتج عن التفاعل بين العوامل الأيضية والوظيفية والوراثية والبيئية4. عدم وجود علاجات لAMD هو السبب الرئيسي للعمى في المرضى الذين تزيد أعمارهم عن 60 سنة في البلدان الصناعية9،10. إعادة تشكيل بيئة الشبكية العصبية والعصبية المنشأ عن طريق زرع تحت الشبكية من خلايا RPE المعدلة وراثيا الإفراط في التعبير PEDF وجنرال موتورز-CSF لديه القدرة على منع انحطاط الشبكية عن طريق التخفيف من آثار الإجهاد التأكسدي, تثبيط التهاب ودعم بقاء الخلية11,12,13,14,15,16 . على الرغم من أن هناك العديد من المنهجيات لتسليم الجينات إلى الخلايا، اخترنا غير الفيروسية فرط النشاط الجمال النائم transposon نظام لتسليم PEDF والجنرال موتورز-CSF الجينات إلى خلايا RPE بسبب ملفها الشخصي السلامة، ودمج الجينات في جينوم الخلايا المضيفة، وميلها لدمج الجينات تسليمها في مواقع نشطة غير النسخ كما أظهرنا سابقا17، 18،19.
يمكن أن يسبب الإجهاد التأكسدي الخلوي في الخلايا المستزرعة في المختبر من قبل العديد من العوامل التأكسدية، بما في ذلك بيروكسيد الهيدروجين (H2O2)،4-هيدروينونال (HNE)، tertbutylhydroperoxide (tBH)، وارتفاع التوترات الأكسجين، والضوء المرئي (الطيف الكامل أو الأشعة فوق البنفسجية)20،21. تتطلب التوترات العالية للأوكسجين والضوء معدات وظروف خاصة، مما يحد من إمكانية النقل إلى أنظمة أخرى. عوامل مثل H2O2، HNE ، و tBH تحفز تداخل الإجهاد التأكسدي التغيرات الجزيئية والخلوية. اخترنا H2O2 لاختبار النشاط المضاد للأكسدة من PEDF و GM-CSF لأنه مناسب وذي صلة بيولوجيا لأنه يتم إنتاجه من قبل خلايا RPE كأوكسجين تفاعلي وسيط أثناء مستقبلات ضوئية الجزء الخارجي phagocytosis22 ويوجد في الأنسجة العينية في الجسم الحي23. منذ أكسدة الجلوتاثيون قد تكون مسؤولة جزئيا عن إنتاج H2O2 في العين، قمنا بتحليل مستويات GSH / الجلوتاثيون في دراساتنا، والتي ترتبط H2O2-الناجم عن الإجهاد التأكسدي والقدرة التجديدية للخلايا21،22. تحليل مستويات الجلوتاثيون ذات صلة خاصة لأنه يشارك في آليات الحماية المضادة للأكسدة في العين24. يستخدم التعرض ل H2O2 بشكل متكرر كنموذج لفحص قابلية الإجهاد التأكسدي والنشاط المضاد للأكسدة لخلايا RPE1و25و26و27و28و29و30، بالإضافة إلى ذلك ، فإنه يظهر أوجه تشابه مع تلف الإجهاد التأكسدي الناجم عن الضوء ، وهو مصدر "فسيولوجي" للإجهاد التأكسدي21.
لتقييم وظائف وفعالية العوامل العصبية، قمنا بتطوير نموذج في المختبر يسمح للتحليل بتحديد التأثير المضاد للأكسدة لعوامل النمو التي تعبر عنها الخلايا المعدلة وراثيا للتعبير المفرط عن PEDF و GM-CSF. هنا، نظهر أن خلايا RPE المصابة بجينات PEDF و GM-CSF أكثر مقاومة للآثار الضارة ل H2O2 من خلايا التحكم غير المصابة، كما يتضح من مورفولوجيا الخلية، والكثافة، والبقاء، ومستوى داخل الخلايا من الجلوتاثيون، والتعبير عن الجين UCP2، الذي رموز للبروتين الميتوكوندريا فك 2 التي ثبت للحد من أنواع الأكسجين التفاعلي (ROS)31.
Protocol
وقد وافقت اللجنة الأخلاقية للبحوث الكانتونية (رقم 2016-01726) على إجراءات جمع العين البشرية واستخدامها.
1. عزل الخلية وظروف الثقافة
- خط الخلية ARPE-19 البشري
- الثقافة 5 × 105 خلايا ARPE-19، خط الخلية RPE الإنسان، في دولبيكو النسر المعدلة المتوسطة / المغذيات خليط F-12 لحم الخنزير (DMEM / هام F-12) تكمل مع 10٪ مصل البقر الجنيني (FBS)، 80 U/mL البنسلين، 80 ميكروغرام/مل من الستربتومايسين، و2.5 ميكروغرام/مل أمفوتريسين B (متوسط كامل) عند 37 درجة مئوية في جو رطب بنسبة 5٪ CO2 و95٪ هواء في قارورة T75 (لكثافة الخلايا الأخرى انظر الجدول 1).
- تغيير المتوسط ثلاث مرات في الأسبوع.
- مرة واحدة تزرع الخلايا إلى ما يقرب من 90٪ التقاء (تقييم نوعيا)، يستنشق المتوسطة وغسل الخلايا مع برنامج تلفزيوني 1x عقيمة.
- احتضان الخلايا مع حل EDTA 5٪ تريبسين-2٪ لمدة 7-10 دقيقة في 37 درجة مئوية (لمجلدات انظر الجدول 1). مراقبة انفصال بصريا.
- إيقاف المحاولة بإضافة وسيطة كاملة تحتوي على 10٪ FBS (لوحدات التخزين راجع الجدول 1).
- قم بإعادة إصابة الخلايا (انظر الخطوة 2. من البروتوكول) أو زراعة الخلايا بنسبة 1:10 (مرة واحدة في الأسبوع) أو البذور في لوحة 96 بئرا كما هو مفصل أدناه (انظر الخطوتين 3.3 و 3.4 من البروتوكول).
| متوسط (مل) | ||||||
| المساحة (سم²) | كثافة البذر لخلايا ARPE-19 (خلايا / بئر) | تطبيق | لثقافة الخلية | لإيقاف التريبسين | حجم التريبسين (مل) | |
| قارورة T75 | 75 | 5,00,000 | ARPE-19 نمو الخلايا | 10 | 7 | 3 |
| 6 لوحة بئر | 9.6 | 1,00,000 | بذر خلايا ARPE-19 المصابة | 3 | 1 | 0.5 |
| 24 لوحة بئر | 2 | 50,000 | بذر خلايا hRPE المصابة | 1 | 0.8 | 0.2 |
| 96 لوحة بئر | 0.32 | 5000 لتجارب الإجهاد التأكسدي مع الخلايا المصابة (الشكل 1) | تجارب الإجهاد التأكسدي | 0.2 | ||
| 3000 لتجارب الإجهاد التأكسدي مع الخلايا غير المصابة بالإضافة إلى البروتينات (الشكل 1) | ||||||
الجدول 1: وحدات تخزين ثقافة الخلية. مجلدات الوسائط الموصى بها لوحات ثقافة الخلية وقوارير لثقافة ARPE-19 والخلايا RPE البشرية الأولية.
- خلايا RPE البشرية الأساسية
- عزل خلايا RPE البشرية الأولية كما وصفها Thumann et al.17, وخلايا الثقافة في المتوسط الكامل تكملها 20٪ FBS.
- تغيير المتوسط مرتين في الأسبوع. بمجرد وصول الخلايا إلى التقاء (رصد بصريا)، والحد من FBS إلى 1٪ لتجنب فرط النمو.
- إعادة إصابة الخلايا (انظر الخطوة 2 من البروتوكول)، أو البذور في لوحة 96 جيدا كما هو مفصل أدناه (انظر الخطوتين 3.3 و 3.4 من البروتوكول).
ملاحظة: جمعت البيانات المعروضة هنا من ثقافة خلايا RPE التي تم الحصول عليها من عيون أربعة متبرعين بشريين. الجدول 2 تفاصيل التركيبة السكانية للمتبرعين من الليونز هدية البصر بنك العين (سانت بول، MN). تم تلقيح العينين 12.7 ± 5.7 ساعة (متوسط ± SD) بعد الحصول على موافقة مستنيرة وفقا لإعلان هلسنكي.
| لا | عمر | جنس | الموت إلى الحفظ (ساعات) | الموت إلى العزلة | حرث | حرث | رمز في الرسم البياني | |
| (أيام) | قبل العدوى (أيام) | بعد العدوى (أيام) | ||||||
| 2 | 80 | M | 20.7 | 8 | 140 | 36 |  | |
| 3 | 86 | F | 12.8 | 8 | 85 | 45 |  | |
| 4 | 86 | F | 8.5 | 5 | 26 | 133 |  | |
| 8 | 83 | F | 8.9 | 6 | 18 | 27 |  | |
| دني | 83.8 | 12.7 | 6.8 | 67.3 | 60.3 | |||
| SD | 2.9 | 5.7 | 1.5 | 57.0 | 49.1 |
الجدول 2: التركيبة السكانية للمتبرعين البشريين للخلايا الظهارية الصباغية الشبكية.
2. الكهرومبوريشن ARPE-19 والخلايا البشرية الأولية RPE
- جرب خلايا ARPE-19 أو خلايا RPE البشرية الأساسية كما هو موضح في الخطوات 1.1.3-1.1.5 من البروتوكول.
- إجراء عملية الصعق الكهربائي باستخدام مجموعة أجهزة التحويل المتاحة تجاريا (انظر جدول المواد).
- وبالنسبة لإصابة خلايا ARPE-19، تشير إلى Johnen et al.32 و hRPE الأولي إلى الخميسوآخرين. باختصار، resuspend 1 × 105 ARPE-19 خلايا أو 5 × 104 خلايا hRPE الأولية في 11 ميكرولتر من R العازلة وإضافة 2 ميكرولتر من خليط البلازميد التي تحتوي على 0.03 ميكروغرام pSB100X نقل33 و 0.47 ميكروغرام pT2-CMV-PEDF-له أو pT2-CMV-GMCSF-جهاز الإرسال والاستقبال له (نسبة transposase:transposon 1:16). بالنسبة للخلايا المتحولة المزدوجة PEDF و GM-CSF، استخدم نسبة 1:16:16 (0.03 ميكروغرام pSB100X، 0.47 ميكروغرام pT2-CMV-PEDF-His، و0.47 ميكروغرام pT2-CMV-GMCSF-His). استخدم معلمات الكهربوين التالية: نبضتان 1,350 فولت ب 20 مللي ثانية (عرض النبض) لخلايا ARPE-19؛ نبضات 150 فولت ب 20 مللي ثانية (عرض النبض) لخلايا ARPE-19؛ نبضات 150 فولت(2005) لخلايا ARPE-19؛ نبضات 150 فولت(2005) لخلايا ARPE-19. نبضتان من 1100 فولت لمدة 20 مللي ثانية للخلايا الأولية.
- البذور 1 × 105 ARPE-19 أو 5 × 104 خلايا hRPE الأولية المصابة في 6-جيدا و 24-جيدا لوحات، على التوالي، في المتوسطة تكملها مع 10٪ FBS دون المضادات الحيوية أو مضادات المخدرات. إضافة البنسلين (80 U/mL)، الستربتومايسين (80 ميكروغرام/مل)، والأمفوتريسين B (2.5 ميكروغرام/مل) مع أول تبادل متوسط بعد 3 أيام من العدوى.
- تحديد نمو الخلايا عن طريق الرصد المجهري الأسبوعي للخلايا. يتم رصد كفاءة العدوى عن طريق تحليل التعبير الجيني عن طريق RT-PCR، وإفراز البروتين من قبل ELISA وWB (الأساليب الموضحة في المواد التكميلية).
ملاحظة: يمكن تقييم كفاءة العدوى لأول مرة بمجرد وصول الخلايا إلى الالتقاء، أي عند ~7 أيام و4 أسابيع بعد العدوى لخلايا ARPE-19 وخلايا hRPE الأولية، على التوالي. - خلايا البذور في لوحة 96 جيدا كما هو مفصل أدناه (انظر الخطوة 3.5 من البروتوكول).
3. تحريض الإجهاد التأكسدي (H2O2 العلاج) و neuroprotection (PEDF و / أو العلاج GM-CSF)
- إعداد المتوسطة مشروطة من الخلايا ARPE-19 المصابة
- استخدام ARPE-19 خلايا مصابة بالجينات PEDF، GM-CSF ، أو كليهما (انظر الخطوة 2 من البروتوكول) ؛ الخلايا الموروثة لمدة 28 يوما كما هو موضح في الخطوة 1.1 من البروتوكول.
- في 28 يوما بعد العدوى، حاول تثقيب الخلايا (انظر الخطوات 1.1.3-1.1.5 من البروتوكول)، عد الخلايا باستخدام غرفة نيوباور34،35،والبذور 5 × 105 خلايا في قوارير T75 في وسط كامل كما هو موضح في الخطوة 1.1.1 من البروتوكول. تبادل المتوسطة عندما ثقافة الخلية هو التقاء 80٪ تقريبا (تقريبا بعد 1 أسبوع؛ التحقق نوعيا). جمع المتوسطة بعد 24 ساعة.
- تخزين المتوسطة في -20 درجة مئوية حتى الاستخدام.
ملاحظة: تم التحقق من تركيز كاف من PEDF المؤتلف وGM-CSF في الوسط المكيف من قبل البنك الدولي وتم قياسه كميا من قبل ELISA كما هو موضح في المواد التكميلية.
- تنقية PEDF و GM-CSF من المتوسطة المكيفة من خلايا ARPE-19 المصابة
- الطرد المركزي الوسط الذي تم جمعه من الخطوة 3.1.2 عند 10000 × غرام لمدة 15 دقيقة عند 4 درجات مئوية.
- استخدم التدفق الفائق Ni-NTA (انظر جدول المواد)وفقا لبروتوكولات الشركة المصنعة لتنقية البروتينات الموسومة به كما هو موضح أدناه.
- ماصة 30 ميكرولتر من خليط Ni-NTA في أنبوب 1.5 مل وطارد مركزي في 2600 × غرام لمدة 30 ثانية والتخلص من التدفق من خلال. غسل بيليه مرتين مع 200 ميكرولتر من العازلة حضانة 1x.
- جهاز الطرد المركزي في 2600 س غ لمدة 30 s والتخلص من تدفق من خلال. إضافة 40 ميكرولتر من العازلة حضانة 4x وإعادة الإنفاق.
- إضافة 900 ميكرولتر من المتوسطة المكيفة الطرد المركزي واحتضان في 70 دورة في الدقيقة (شاكر المداري) لمدة 1 ساعة في RT. الطرد المركزي في 2600 × غرام لمدة 1 دقيقة والتخلص من التدفق من خلال.
- غسل بيليه مرتين مع 175 ميكرولتر من العازلة الحضانة 1x. جهاز الطرد المركزي في 2600 س غ لمدة 30 s والتخلص من تدفق من خلال.
- لeute له الموسومة PEDF وجنرال موتورز - CSF البروتينات ، إضافة 20 ميكروغرام من العازلة Elution واحتضان في 70 دورة في الدقيقة (شاكر المدارية) لمدة 20 دقيقة في RT. الطرد المركزي في 2600 × ز لمدة 30 ثانية. الحفاظ على supernatant التي تحتوي على PEDF المؤتلف أو GM-CSF.
- قياس إجمالي البروتين باستخدام مجموعة اختبار البروتين BCA المتاحة تجاريا (انظر جدول المواد)وفقا لتعليمات الشركة المصنعة.
- تخزين محلول البروتين في -20 درجة مئوية حتى الاستخدام.
ملاحظة: يحتوي المخزن المؤقت للحضانة (4x) على 200 mM NaH2PO4و 1.2 M NaCl و 40 mM Imidazol؛ يحتوي المخزن المؤقت Elution على 50 mM NaH2PO4و 300 mM NaCl و 250 mM Imidazol.
- علاج الخلايا غير المصابة ARPE-19/primary hRPE مع المتوسطة مشروطة بالإضافة إلى H2O2 (الشكل 1A)
- البذور 3000 ARPE-19 غير المصابة (من الخطوة 1.1.6 من البروتوكول) أو hRPE الأولية (من الخطوة 1.2.3 من البروتوكول) الخلايا لكل بئر في لوحة 96 جيدا والثقافة في 200 ميكروغرام من المتوسطة مكيفة من الخلايا ARPE-19 المصابة.
- زراعة الخلايا لمدة 10 أيام عند 37 درجة مئوية في جو رطب من 5٪ CO2 و 95٪ الهواء. تغيير المتوسطة مشروطة كل يوم. تعريض الخلايا إلى 350 ميكرومتر H2O2 لمدة 24 ساعة.
- تقييم أضرار الإجهاد التأكسدي وتحديد التأثير المضاد للأكسدة من PEDF و GM-CSF عن طريق تحديد كمي لمستويات الجلوتاثيون (انظر الخطوة 4.1 من البروتوكول)، المجهر (انظر الخطوة 4.2 من البروتوكول)، وتقيس السمية الخلوية (انظر الخطوة 4.2 من البروتوكول).
ملاحظة: مدة التجربة 12 يوما. وتستخدم لوحات واضحة مسطحة أسفل microwell لتقييم التلألؤ وكذلك مورفولوجيا الخلية. لإجراء السمية الخلوية و المقايسة الجلوتاثيون في نفس الوقت، يجب أن تكون بذر صفيحتين مع الخلايا في نفس اليوم.
- علاج الخلايا غير المصابة ARPE-19/primary hRPE مع PEDF وعوامل النمو GM-CSF بالإضافة إلى H2O2 (الشكل 1B)
- البذور 3000 ARPE-19 غير المصابة (من الخطوة 1.1.6 من البروتوكول) أو hRPE الأولية (من الخطوة 1.2.3 من البروتوكول) خلايا لكل بئر (لوحات 96 بئر مع أسفل مسطحة واضحة) في 200 ميكرولتر من متوسطة الثقافة الكاملة التي تحتوي على 500 نانوغرام /مل PEDF المؤتلف و / أو 50 نانوغرام / مل المؤتلف GM-CSF، وتنقيتها من وسط خلايا ARPE-19 المصابة أو المتاحة تجاريا. خلايا زراعة لمدة 48 ساعة عند 37 درجة مئوية في جو رطب من 5٪ CO2 و 95٪ من الهواء. تجديد المتوسط بما في ذلك PEDF وعوامل النمو GM-CSF يوميا.
ملاحظة: إضافة عوامل النمو جديدة إلى الوسيطة. - بعد 48 ساعة من علاج الخلايا مع عوامل النمو، وإزالة المتوسط وإضافة وسيطة كاملة تحتوي على 350 ميكرومتر H2O2 بالإضافة إلى 500 نانوغرام / مل PEDF و / أو 50 نانوغرام / مل GM-CSF.
- تقييم أضرار الإجهاد التأكسدي وتحديد التأثير المضاد للأكسدة من PEDF و GM-CSF عن طريق تحديد كمي لمستويات الجلوتاثيون (انظر الخطوة 4.1 من البروتوكول)، المجهر (انظر الخطوة 4.2 من البروتوكول)، وتقيس السمية الخلوية (انظر الخطوة 4.2 من البروتوكول).
ملاحظة: مدة التجربة هي 3 أيام.
- البذور 3000 ARPE-19 غير المصابة (من الخطوة 1.1.6 من البروتوكول) أو hRPE الأولية (من الخطوة 1.2.3 من البروتوكول) خلايا لكل بئر (لوحات 96 بئر مع أسفل مسطحة واضحة) في 200 ميكرولتر من متوسطة الثقافة الكاملة التي تحتوي على 500 نانوغرام /مل PEDF المؤتلف و / أو 50 نانوغرام / مل المؤتلف GM-CSF، وتنقيتها من وسط خلايا ARPE-19 المصابة أو المتاحة تجاريا. خلايا زراعة لمدة 48 ساعة عند 37 درجة مئوية في جو رطب من 5٪ CO2 و 95٪ من الهواء. تجديد المتوسط بما في ذلك PEDF وعوامل النمو GM-CSF يوميا.
- علاج الخلايا المضادة للإصابة ARPE-19/الأولية HRPE مع H2O2 (الشكل 1C)
- تحقق من التعبير الجيني الكافي وإفراز البروتين للخلايا المصابة من قبل البنك الدولي و ELISA كما هو موضح في المواد التكميلية.
- إزالة الوسيطة من الآبار التي تحتوي على الخلايا المصابة (انظر الخطوة 2 من البروتوكول).
- حاول تكبير الخلايا كما هو موضح في الخطوات 1.1.3-1.1.5 من البروتوكول. عد الخلايا باستخدام غرفة نيوباور34،35.
- البذور 5000 الخلايا المصابة / جيدا في لوحة 96 جيدا في 200 ميكروغرام من المتوسطة كاملة. خلايا زراعة لمدة 24 ساعة عند 37 درجة مئوية في جو رطب من 5٪ CO2 و 95٪ من الهواء. بعد 24 ساعة، يعرض الخلايا إلى 350 ميكرومتر H2O2 لمدة 24 ساعة.
- تقييم تلف الإجهاد التأكسدي وتحديد التأثير المضاد للأكسدة من PEDF و GM-CSF عن طريق تحديد كمي لمستويات الجلوتاثيون (انظر الخطوة 4.1 من البروتوكول)، المجهر (انظر الخطوة 4.2 من البروتوكول)، فحص السمية الخلوية (انظر الخطوة 4.2 من البروتوكول)، وتحديد التعبير الجيني UCP2 (انظر الخطوة 4.3 من البروتوكول).
ملاحظة: مدة التجربة يومين.
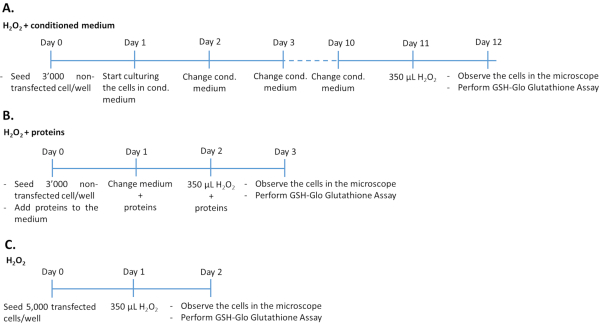
الشكل 1: الجداول الزمنية للH2O2 المقايسة في ثلاثة نهج تجريبية مختلفة. تم بذر 3000 خلية غير مصابة بالبروتينات المتوسطة /المؤتلفة أو 5000 خلية مصابة في 96 بئرا للعلاج باستخدام H2O2. لتحديد تأثير المتوسطة مشروطة، تم استزراع الخلايا في المتوسط 100٪ مثقف لمدة 10 أيام متتالية، وتغيير المتوسطة كل يوم. لتحديد تأثير عوامل النمو المؤتلفة، تم استزراع الخلايا بإضافة الكمية المناسبة من عوامل النمو كل يوم لمدة 3 أيام متتالية. لاحظ أن الخلايا غير المصابة تم زرعها في 3000 خلية لكل بئر لتجنب فرط النمو خلال فترة الثقافة الأطول مقارنة بالخلايا المصابة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تحليل مستوى الإجهاد التأكسدي والقدرة المضادة للأكسدة
- فحص الجلوتاثيون
- قياس مستويات الجلوتاثيون (GSH) باستخدام عدة المتاحة تجاريا (انظر جدول المواد)وفقا لتعليمات الشركة المصنعة. لفترة وجيزة، وإعداد وحجم مناسب من مزيج كاشف 1x (100 ميكرولتر كاشف / جيدا): لوسيفيرين NT الركيزة وGlutathione S-Transferase المخفف 1:100 في رد فعل المخزن المؤقت.
ملاحظة: يتطلب لوح 96-well 10 مل من مزيج الكاشف 1x، الذي يتم إعداده بإضافة 100 ميكرولتر من ركيزة لوسيفيرين-NT و100 ميكرولتر من الجلوتاثيون S-Transferase إلى 10 مل من حاجز التفاعل. إعداد مزيج 1x الكاشف مباشرة قبل الاستخدام. لا تخزن مزيج الكاشف المعد للاستخدام في المستقبل. - إعداد كاشف الكشف عن لوسيفيرين عن طريق نقل زجاجة واحدة من العازلة إعادة تشكيل إلى كاشف الكشف لوسيفيرين lyophilized.
- إعداد منحنى قياسي باستخدام حل قياسي من الجلوتاثيون (GSH) (5 م م). تمييع محلول GSH 5 mM 1:100 مع dH2O (أضف 10 ميكرولتر من محلول GSH 5 mM إلى 990 ميكرولتر من dH2O). تنفيذ 7 المسلسل 1:1 التخفيف في 500 ميكرولتر من dH2O. نقل 10 ميكرولتر من كل معيار المخفف إلى بئر المناسبة في التكرار.
ملاحظة: سيتراوح التركيز النهائي للجلوتاثيون من 0.039 ميكرومتر إلى 5 ميكرومتر. - إعداد فارغة (1x مزيج الكاشف) ونقل 10 ميكرولتر (التكرارات) إلى الآبار المناسبة.
- إزالة H2O2-تعامل الخلايا من الحاضنة.
ملاحظة: توثيق مورفولوجيا H2O2-تعامل الخلايا بواسطة المجهر برايتفيلد (40x).
عندما تتأكسد الخلايا، فإنها تبدو أكثر تقريبا وأقل انتشارا. - يستنشق بعناية وسط الثقافة. إضافة 100 ميكرولتر من مزيج الكاشف 1x المعدة إلى كل بئر. خلط الخلايا مع الكاشف لمدة 15 ثانية في 500 دورة في الدقيقة على شاكر المدارية.
- احتضان لوحة في RT لمدة 30 دقيقة. إضافة 100 ميكرولتر من الكاشف الكشف لوسيفيرين المعاد تشكيلها إلى كل بئر.
- مزيج الحل لمدة 15 ثانية في 500 دورة في الدقيقة على شاكر المداري. احتضان لوحة لمدة 15 دقيقة في RT.
- تحديد التلألؤ باستخدام قارئ لوحة باستخدام برنامج مثبت مسبقا ADP-Glo.
ملاحظة: ضع اللوحة داخل قارئ اللوحة بدون الغطاء.- انقر على تغيير تخطيط واختيار الإعدادات التالية في المعلمات الأساسية: Costar 96-لوحة جيدا; أعلى البصرية؛ تأخير تحديد المواقع: 0.1؛ وقت بدء القياس: 0.0; زمن الفاصل الزمني للقياس: 1.0؛ الوقت لتطبيع النتائج: 0.0; يتم ضبط الربح تلقائيا من قبل الجهاز. تعريف الفراغات والمعايير والعينات. انقر على قياس البدء.
- تصدير البيانات كملف Excel. حساب تركيز GSH في كل عينة عن طريق الاستيفاء من منحنى القياسية.
- قياس مستويات الجلوتاثيون (GSH) باستخدام عدة المتاحة تجاريا (انظر جدول المواد)وفقا لتعليمات الشركة المصنعة. لفترة وجيزة، وإعداد وحجم مناسب من مزيج كاشف 1x (100 ميكرولتر كاشف / جيدا): لوسيفيرين NT الركيزة وGlutathione S-Transferase المخفف 1:100 في رد فعل المخزن المؤقت.
- فحص السمية الخلوية والتحليل المجهري
- يستنشق المتوسط من الخلايا وإضافة 100 ميكرولتر من المتوسطة كاملة تحتوي على 1٪ FBS إلى كل بئر. أعد الخلايا إلى الحاضنة.
ملاحظة: يستخدم 1٪ FBS لأن نسب أعلى من FBS يمكن أن تتداخل مع قياس التلألؤ، وبالتالي يتم استخدام 1٪ FBS في هذه الحالة. - قياس صلاحية الخلية باستخدام مجموعة القياسات السمية الخلوية المتاحة تجاريا (انظر جدول المواد)اتباع تعليمات الشركة المصنعة. باختصار، قم بإعداد مزيج الكاشف إضافة المخزن المؤقت المقايسة إلى الركيزة lyophilized. إعداد الكاشف Lysis بإضافة 33 ميكرولتر Digitonin إلى 5 مل من المخزن المؤقت Assay (لوحة واحدة 96 جيدا). تخلط جيدا عن طريق الأنابيب صعودا وهبوطا لضمان التجانس.
ملاحظة: للحصول على أفضل النتائج، استخدم مزيج الكاشف الطازج. يمكن تخزين الاستخدام في غضون 12 ساعة إذا تم تخزينه في مزيج RT. الكاشف عند 4 درجات مئوية لمدة تصل إلى 7 أيام ويمكن تخزينه في الأسعار أحادية الاستخدام لمدة تصل إلى 4 أشهر عند -70 درجة مئوية. يجب تجنب التجميد والذوبان. يمكن تخزين كاشف التحلل عند درجة حرارة 4 درجات مئوية لمدة تصل إلى 7 أيام. - إعداد منحنى قياسي مع خلايا ARPE-19 غير المعالجة.
- جرب الخلايا كما هو موضح في الخطوات 1.1.3-1.1.5 من البروتوكول واحص الخلايا باستخدام غرفة نيوباور34،35. الطرد المركزي الخلايا في 120 غرام لمدة 10 دقيقة في RT. أسبيرات الناموست وإعادة إنفاق بيليه الخلية في المتوسط DMEM / هام F12 تحتوي على 1٪ FBS إلى تركيز نهائي من 1 × 105 خلايا / مل.
- إعداد 7 المسلسل 1:1 التخفيف في 200 μL المتوسطة التي تحتوي على 1٪ FBS. نقل 100 ميكرولتر من كل معيار إلى الآبار المناسبة (التكرارات). إضافة 50 ميكرولتر من مزيج الكاشف لجميع الآبار.
- خلط الخلايا مع الكاشف لمدة 15 ثانية في 500 دورة في الدقيقة على شاكر المدارية. احتضان لوحة لمدة 15 دقيقة في RT. قياس التلألؤ باستخدام قارئ لوحة كما هو موضح في الخطوة 4.1.9 من البروتوكول. أضف 50 ميكرولتر من كاشف التحلل واحتضن لمدة 15 دقيقة. قياس التلألؤ باستخدام قارئ لوحة كما هو موضح في الخطوة 4.1.9 من البروتوكول.
- حساب النسبة المئوية للخلايا القابلة للحياة: (100 - ٪ الخلايا الميتة) والنسبة المئوية للخلايا الميتة = [قياس التلألؤ الأول ((الخلايا الميتة في العينة)/ قياس التلألؤ الثاني (جميع الخلايا الميتة بعد علاج digitonin)] × 100.
- يستنشق المتوسط من الخلايا وإضافة 100 ميكرولتر من المتوسطة كاملة تحتوي على 1٪ FBS إلى كل بئر. أعد الخلايا إلى الحاضنة.
- تحليل التعبير UCP2 بواسطة RT-qPCR
- حاول تحليل الخلايا المصابة كما هو موضح أعلاه (الخطوات 1.1.3-1.1.5 من البروتوكول).
- عد الخلايا باستخدام غرفة نيوباور34،35.
- البذور 5000 الخلايا ARPE-19 المصابة / جيدا في لوحات 96 بئرا.
- بعد 24 ساعة من الثقافة، علاج الخلايا مع 350 μM H2O2 لمدة 24 ساعة.
- عزل إجمالي الحمض النووي الريبي باستخدام عدة تجارية لعزل الحمض النووي الريبي من عدد قليل من الخلايا (انظر جدول المواد)بعد تعليمات الشركة المصنعة.
- أداء في الوقت الحقيقي PCR الكمية (RT-qPCR) كما هو موضح في المواد التكميلية. باختصار، توليد cDNA عن طريق retrotranscription باستخدام مزيج المتاحة تجاريا تحتوي على نسخة M-MLV عكس الأمثل (انظر جدول المواد).
- بالنسبة ل qPCR استخدم كوكتيل رد فعل جاهز للاستخدام يحتوي على جميع المكونات (بما في ذلك SYBR Green) باستثناء التهيئة (انظر الجدول S1 من المواد التكميلية)وقالب الحمض النووي. استخدم شروط الدوران الحراري التالية: التشبع الأولي عند 95 درجة مئوية لمدة 10 دقائق، و40 دورة مع التشبع عند 95 درجة مئوية لمدة 15 درجة مئوية، والتعيين عند 60 درجة مئوية لمدة 30 درجة مئوية، والإطالة عند 72 درجة مئوية لمدة 32 s.
- استخدم طريقة 2^(-ΔΔCT) للتحليل36.
- إعداد lysate الخلية لتحليل SDS-PAGE و البنك الدولي من pAkt (Ser473)
- البذور 3 × 105 GM-CSF-transfected ARPE-19 الخلايا / جيدا في لوحات 6 آبار (≥21 يوما بعد العدوى) لتحديد ما إذا كان GM-CSF يحمي خلايا RPE من التلف من قبل H2O2 من خلال تفعيل مسار البقاء على قيد الحياة Akt15.
- بعد 24 ساعة من خلايا الثقافة تتعرض ل350 ميكرومتر H2O2 لمدة 24 ساعة.
- مزيج 1 مل من العازلة RIPA مع 10 ميكرولتر من كوكتيل مثبطات الفوسفاتاز بروتياز، 10 ميكرولتر من 0.5 M EDTA، و 25 ميكرولتر من 8 M يوريا (وحدات التخزين المستخدمة لولع واحد).
- يستنشق بعناية المتوسطة وغسل الخلايا مع برنامج تلفزيوني 1x.
- إضافة وحدة التخزين الكاملة من RIPA المخزن المؤقت المزيج إلى الخلايا.
- ماصة صعودا وهبوطا.
- جمع lysate في أنابيب 1.5 مل.
- جهاز طرد مركزي عند 20,000 x g لمدة 30 دقيقة عند 4°C.
- نقل supernatant إلى أنبوب جديد 1.5 مل.
- تحديد مستويات pAkt في 15 ميكرولتر من lysate الخلية غير مخففة من قبل البنك الدولي كما هو موضح في المواد التكميلية.
النتائج
تحريض الإجهاد التأكسدي في الخلايا الظهارية صبغ الشبكية البشرية
تم التعامل مع ARPE-19 وخلايا hRPE الأولية بتركيزات متفاوتة من H2O2 لمدة 24 ساعة وتم قياس مستوى الجلوتاثيون المضاد للأكسدة داخل الخلايا كميا(الشكل 2A،B). H2O2 ?...
Discussion
يقدم البروتوكول المعروض هنا نهجا لتحليل وظيفة مكافحة الأكسدة والحماية ل PEDF و GM-CSF التي تنتجها الخلايا المصابة ، والتي يمكن تطبيقها على الخلايا المصابة بأي جين مفيد مفترض. في الاستراتيجيات العلاجية الجينية التي تهدف إلى إيصال البروتينات إلى الأنسجة عن طريق زرع الخلايا المعدلة وراثيا، من ا...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ويود المؤلفان أن يشكرا غريغ سيلي وألان كونتي على المساعدة التقنية الممتازة والبروفيسور زوزسانا إزفاك من مركز ماكس دلبروك في برلين على التكرم بتوفير PSB100X و pT2-CAGGS-فينوس بلاميدز. وقد دعم هذا العمل كل من المؤسسة الوطنية السويسرية للعلوم والمفوضية الأوروبية في سياق البرنامج الإطاري السابع. تم تمويل Z.I من قبل مجلس البحوث الأوروبي، ERC المتقدمة [ERC-2011-ADG 294742].
Materials
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 353047 | |
| 6-well plates | Greiner | 7657160 | |
| 96-well culture plate white with clear flat bottom | Costar | 3610 | Allows to check the cells before measuring the luminescence (GSH-Glo Assay) |
| 96-well plates | Corning | 353072 | |
| Acrylamid 40% | Biorad | 161-0144 | |
| Amphotericin B | AMIMED | 4-05F00-H | |
| Antibody anti-GMCSF | ThermoFisher Scientific | PA5-24184 | |
| Antibody anti-mouse IgG/IgA/IgM | Agilent | P0260 | |
| Antibody anti-PEDF | Santa Cruz Biotechnology Inc | sc-390172 | |
| Antibody anti-penta-His | Qiagen | 34660 | |
| Antibody anti-phospho-Akt | Cell Signaling Technology | 9271 | |
| Antibody anti-rabbit IgG H&L-HRP | Abcam | ab6721 | |
| Antibody donkey anti-rabbit Alexa Fluor 594 | ThermoFisher Scientific | A11034 | |
| Antibody goat anti-mouse Alexa 488 | ThermoFisher Scientific | A-11029 | |
| ARPE-19 cell line | ATCC | CRL-2302 | |
| BSA | Sigma-Aldrich | A9418-500G | |
| chamber culture glass slides | Corning | 354118 | |
| CytoTox-Glo Cytotoxicity Assay | Promega | G9291 | |
| DAPI | Sigma-Aldrich | D9542-5MG | |
| DMEM/Ham`s F12 | Sigma-Aldrich | D8062 | |
| Duo Set ELISA kit | R&D Systems | DY215-05 | |
| EDTA | ThermoFisher Scientific | 78440 | |
| ELISAquant kit | BioProducts MD | PED613-10-Human | |
| Eyes (human) | Lions Gift of Sight Eye Bank (Saint Paul, MN) | ||
| FBS | Brunschwig | P40-37500 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680-25ML | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| GraphPad Prism software (version 8.0) | GraphPad Software, Inc. | ||
| GSH-Glo Glutathione Assay | Promega | V6912 | |
| hydrogen peroxide (H2O2) | Merck | 107209 | |
| ImageJ software (image processing program) | W.S. Rasband, NIH, Bethesda, MD, USA; https://imagej.nih.gov/ij/; 1997–2014 | ||
| Imidazol | Axonlab | A1378.0010 | |
| Leica DMI4000B microscope | Leica Microsystems | ||
| LightCycler 480 Instrument II | Roche Molecular Systems | ||
| LightCycler 480 SW1.5.1 software | Roche Molecular Systems | ||
| NaCl | Sigma-Aldrich | 71376-1000 | |
| NaH2PO4 | Axonlab | 3468.1000 | |
| Neon Transfection System | ThermoFisher Scientific | MPK5000 | |
| Neon Transfection System 10 µL Kit | ThermoFisher Scientific | MPK1096 | |
| Neubauer chamber | Marienfeld-superior | 640010 | |
| Ni-NTA superflow | Qiagen | 30410 | |
| Nitrocellulose | VWR | 732-3197 | |
| Omega Lum G Gel Imaging System | Aplegen Life Science | ||
| PBS 1X | Sigma-Aldrich | D8537 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781-100 | |
| PerfeCTa SYBR Green FastMix | Quantabio | 95072-012 | |
| PFA | Sigma-Aldrich | 158127-100G | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23227 | |
| Primers | Invitrogen | See Table 1 in Supplementary Materials | |
| pSB100X (250 ng/µL) | Mátés et al., 2009. Provide by Prof. Zsuzsanna Izsvak | ||
| pT2-CMV-GMCSF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| pT2-CMV-PEDF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| QIAamp DNA Mini Kit | QIAGEN | 51304 | |
| recombinant hGM-CSF | Peprotech | 100-11 | |
| recombinant hPEDF | BioProductsMD | 004-096 | |
| ReliaPrep RNA Cell Miniprep System | Promega | Z6011 | |
| RIPA buffer | ThermoFisher Scientific | 89901 | |
| RNase-free DNase Set | QIAGEN | 79254 | |
| RNeasy Mini Kit | QIAGEN | 74204 | |
| SDS | Applichem | A2572 | |
| Semi-dry transfer system for WB | Bio-Rad | ||
| SuperMix qScript | Quantabio | 95048-025 | |
| Tris-buffered saline (TBS) | ThermoFisher Scientific | 15504020 | |
| Triton X-100 | AppliChem | A4975 | |
| Trypsin/EDTA | Sigma-Aldrich | T4174 | |
| Tween | AppliChem | A1390 | |
| Urea | ThermoFisher Scientific | 29700 | |
| WesternBright ECL HRP substrate | Advansta | K-12045-D50 | |
| Whatman nitrocellulose membrane | Chemie Brunschwig | MNSC04530301 |
References
- Zareba, M., Raciti, M. W., Henry, M. M., Sarna, T., Burke, J. M. Oxidative stress in ARPE-19 cultures: Do melanosomes confer cytoprotection. Free Radical Biology and Medicine. 40 (1), 87-100 (2006).
- Gong, X., Draper, C. S., Allison, G. S., Marisiddaiah, R., Rubin, L. P. Effects of the macular carotenoid lutein in human retinal pigment epithelial cells. Antioxidants. 6 (4), (2017).
- Sacconi, R., Corbelli, E., Querques, L., Bandello, F., Querques, G. A Review of current and future management of geographic atrophy. Ophthalmology and Therapy. 6, 69-77 (2017).
- Al-Zamil, W. M., Yassin, S. A. Recent developments in age-related macular degeneration: a review. Clinical Interventions in Aging. 12, 1313-1330 (2017).
- Kumar-Singh, R. The role of complement membrane attack complex in dry and wet AMD - From hypothesis to clinical trials. Experimental Eye Research. 184, 266-277 (2019).
- Ung, L., Pattamatta, U., Carnt, N., Wilkinson-Berka, J. L., Liew, G., White, A. J. R. Oxidative stress and reactive oxygen species. Clinical Science. 131, 2865-2883 (2017).
- Beatty, S., Koh, H. H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Alhasani, R. H., et al. Gypenosides protect retinal pigment epithelium cells from oxidative stress. Food and Chemical Toxicology. 112, 76-85 (2018).
- . National Institute of Health Available from: https://nei.nih.gov/learn-about-eye-health/resources-for-health-educators/eye-health-data-and-statistics/age-related-macular-degeneration-amd-data-and-statistics (2020)
- Mitchell, P., Liew, G., Gopinath, B., Wong, T. Y. Age-related macular degeneration. The Lancet. 392, 1147-1159 (2018).
- He, Y., Leung, K. W., Ren, Y., Jinzhi, P., Jian, G., Tombran-Tink, J. PEDF improves mitochondrial function in RPE cells during oxidative stress. Investigative Ophthalmology & Visual Science. 55, 6742-6755 (2014).
- Cao, S., Walker, G. B., Wang, X., Cui, J. Z., Matsubara, J. A. Altered cytokine profiles of human retinal pigment epithelium: Oxidant injury and replicative senescence. Molecular Vision. 19, 718-728 (2013).
- Farnoodian, M., Sorenson, C. M., Sheibani, N. PEDF expression affects the oxidative and inflammatory state of choroidal endothelial cells. Amercian Journal of Physiology and Cell Physiology. 314 (4), 456-472 (2018).
- Polato, F., Becerra, S. P. Retinal Degenerative Diseases: Mechanisms and Experimental Therapies. Retinal Degenerative Diseases. , 699-706 (2016).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF regulates the ERK1/2 pathways and protects injured retinal ganglion cells from induced death. Experimental Eye Research. 89, 665-677 (2009).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF protects rat photoreceptors from death by activating the SRC-dependent signalling and elevating anti-apoptotic factors and neurotrophins. Graefes Archives for Clinical and Experimental Ophthalmology. 250, 699-712 (2012).
- Thumann, G., et al. Engineering of PEDF-expressing primary pigment epithelial cells by the SB transposon system delivered by pFAR4 plasmids. Molecular Therapy - Nucleic Acids. 6, 302-314 (2017).
- Garcia-Garcia, L., et al. Long-term PEDF release in rat iris and retinal epithelial cells after Sleeping Beauty transposon-mediated gene delivery. Molecular Therapy - Nucleic Acids. 9, 1-11 (2017).
- Johnen, S., et al. Antiangiogenic and neurogenic activities of Sleeping Beauty-mediated PEDF-transfected RPE cells in vitro and in vivo. BioMed Research International. 2015, (2015).
- Weigel, A. L., Handa, J. T., Hjelmeland, M. L. Microarray analysis of H2O2-, HNE-, or tBH-treated ARPE-19 cells. Free Radical Biology & Medicine. 33 (10), 1419-1432 (2002).
- Allen, R. G., Tresini, M. Oxidative stress and gene regulation. Free Radical Biology and Medicine. 28 (3), 463-499 (2000).
- Tate, D. J., Miceli, M. V., Newsome, D. A. Phagocytosis and H2O2 induce catalase and metallothionein gene expression in human retinal pigment epithelial cells. Investigative Ophthalmology and Visual Science. 36 (7), 1271-1279 (1995).
- Halliwell, B., Clement, M. V., Long, L. H. Hydrogen peroxide in the human body. FEBS Letters. 486 (1), 10-13 (2000).
- Giblin, F. J., McCready, J. P., Kodama, T., Reddy, V. N. A direct correlation between the levels of ascorbic acid and H2O2 in aqueous humor. Experimental Eye Research. 38, 87-93 (1984).
- Geiger, R. C., Waters, C. M., Kamp, D. W., Glucksberg, M. R. KGF prevents oxygen-mediated damage in ARPE-19 cells. Investigative Ophthalmology and Visual Science. 46, 3435-3442 (2005).
- Campochiaro, P. A., et al. Lentiviral vector gene transfer of endostatin/angiostatin for macular degeneration (GEM) study. Human Gene Therapy. 28, 99-111 (2017).
- Chen, X. -. D., Su, M. -. Y., Chen, T. -. T., Hong, H. -. Y., Han, A. -. D., Li, W. -. S. Oxidative stress affects retinal pigment epithelial cell survival through epidermal growth factor receptor/AKT signaling pathway. International Journal of Ophthalmology. 10 (4), 507-514 (2017).
- Tu, G., et al. Allicin attenuates H2O2 - induced cytotoxicity in retinal pigmented epithelial cells by regulating the levels of reactive oxygen species. Molecular Medicine Reports. 13, 2320-2326 (2016).
- Hao, Y., Liu, J., Wang, Z., Yu, L., Wang, J. Piceatannol protects human retinal pigment epithelial cells against hydrogen peroxide induced oxidative stress and apoptosis through modulating. Nutrients. 11, 1-13 (2019).
- Ballinger, S. W., Van Houten, B., Conklin, C. A., Jin, G. F., Godley, B. F. Hydrogen peroxide causes significant mitochondrial DNA damage in human RPE cells. Experimental Eye Research. 68 (6), 765-772 (1999).
- Ma, S., et al. Transgenic overexpression of uncoupling protein 2 attenuates salt-induced vascular dysfunction by inhibition of oxidative stress. American Journal of Hypertension. 27 (3), 345-354 (2014).
- Johnen, S., et al. Sleeping Beauty transposon-mediated transfection of retinal and iris pigment epithelial cells. Investigative Ophthalmology and Visual Science. 53 (8), 4787-4796 (2012).
- Mátés, L., et al. Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nature Genetics. 41 (6), 753-761 (2009).
- . Marienfeld Technical information Neubauer-improved Available from: https://www.marienfeld-superior.com/information-about-our-counting-chambers.html (2020)
- . Electron Microscopy Sciences. Neubauer Haemocytometry Available from: https://www.emsdiasum.com/microscopy/technical/datasheet/68052-14.aspx (2020)
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2^(-ΔΔCT) method. Methods. 25 (4), 402-408 (2001).
- Bascuas, T., et al. Non-virally transfected primary human pigment epithelium cells overexpressing the oxidative stress reduction factors PEDF and GM-CSF to treat retinal neurodegeneration neurodegenerationl. Human Gene Therapy. 30 (11), (2019).
- Zhuge, C. C., et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1. Investigative Ophthalmology & Visual Science. 55 (7), 4628-4638 (2014).
- Kaczara, P., Sarna, T., Burke, M. Dynamics of H2O2 Availability to ARPE-19 cultures in models of oxidative stress. Free Radical Biology and Medicine. 48 (8), 1068-1070 (2010).
- Gorrini, C., Harris, I. S., Mak, T. W. Modulation of oxidative stress as an anticancer strategy. Nature Reviews Drug Discovery. 12, 931-947 (2013).
- Wang, X., et al. PEDF protects human retinal pigment epithelial cells against oxidative stress via upregulation of UCP2 expression. Molecular Medicine Reports. 19 (1), 59-74 (2019).
- Donadelli, M., Dando, I., Fiorini, C., Palmieri, M. UCP2, a mitochondrial protein regulated at multiple levels. Cellular and Molecular Life Sciences. 71, 1171-1190 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved