Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индукция и анализ окислительного стресса в транспозонно-трансфектированных пигментных эпителиальных клетках сетчатки человека
В этой статье
Резюме
Представлен протокол разработки и использования модели окислительного стресса путем обработки пигментных эпителиальных клеток сетчатки H2 O2,анализа морфологии клеток, жизнеспособности, плотности, глутатиона и уровня UCP-2. Это полезная модель для исследования антиоксидантного эффекта белков, секретируемых транспозонно-трансфектированными клетками для лечения нейроретинальной дегенерации.
Аннотация
Окислительный стресс играет решающую роль в нескольких дегенеративных заболеваниях, включая возрастную макулярную дегенерацию (ВМД), патологию, которая затрагивает ~ 30 миллионов пациентов во всем мире. Это приводит к снижению нейропротекторных факторов, синтезированных пигментным эпителием сетчатки (RPE), например, фактора, полученного из пигментного эпителия (PEDF) и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), за которым следует потеря клеток RPE и, в конечном итоге, гибель фоторецепторных и ганглиозных клеток сетчатки (RGC). Мы предполагаем, что восстановление нейропротекторной и нейрогенной среды сетчатки путем субретинальной трансплантации трансфектированных клеток RPE, чрезмерно экспрессирующих PEDF и GM-CSF, имеет потенциал для предотвращения дегенерации сетчатки путем смягчения последствий окислительного стресса, ингибирования воспаления и поддержки выживания клеток. Используя транспозонную систему Sleeping Beauty (SB100X),человеческие RPE-клетки были трансфектированы генами PEDF и GM-CSF и показали стабильную интеграцию генов, долгосрочную экспрессию генов и секрецию белка с использованием qPCR, вестерн-блоттинга, ИФА и иммунофлуоресценции. Чтобы подтвердить функциональность и эффективность PEDF и GM-CSF, секретируемых трансфектированными клетками RPE, мы разработали анализ in vitro для количественной оценки снижения H2 O2-индуцированногоокислительногостресса на клетках RPE в культуре. Клеточную защиту оценивали путем анализа морфологии клеток, плотности, внутриклеточного уровня глутатиона, экспрессии гена UCP2 и жизнеспособности клеток. Как трансфектированные клетки RPE, чрезмерно экспрессирующие PEDF и/или GM-CSF, так и клетки, нетрансфектированные, но предварительно обработанные PEDF и/или GM-CSF (коммерчески доступные или очищенные из трансфектированных клеток), показали значительную антиоксидантную защиту клеток по сравнению с необработанными контрольными группами. Настоящая модельH2O2представляет собой простой и эффективный подход к оценке антиоксидантного действия факторов, которые могут быть эффективными для лечения ВМД или аналогичных нейродегенеративных заболеваний.
Введение
Модель, описанная здесь, предлагает полезный подход к оценке эффективности биофармацевтических агентов для снижения окислительного стресса в клетках. Мы использовали модель для исследования защитных эффектов PEDF и GM-CSF на H2 O2-опосредованный окислительныйстресс на пигментные эпителиальные клетки сетчатки, которые подвергаются воздействию высоких уровнейO2и видимого света, а также фагоцитоз мембран наружного сегмента фоторецептора, генерирующий значительные уровни активных форм кислорода (АФК)1, 2. Они считаются основным фактором патогенеза аваскулярной возрастной макулярной дегенерации (аАМД)3,4,5,6,7,8. Кроме того, наблюдается снижение синтезированных RPE нейропротекторных факторов, в частности фактора, полученного из пигментного эпителия (PEDF), инсулиноподобных факторов роста (IGF) и гранулоцитарного макрофагально-колониестимулирующего фактора (GM-CSF), что приводит к дисфункции и потере клеток RPE, за которыми следует гибель фоторецепторов и ганглиозных клеток сетчатки (RGC)3,4,5 . ВМД является сложным заболеванием, которое является результатом взаимодействия между метаболическими, функциональными, генетическими и экологическими факторами4. Отсутствие методов лечения АМД является основной причиной слепоты у пациентов старше 60 лет в промышленно развитых странах9,10лет. Восстановление нейропротекторной и нейрогенной среды сетчатки путем субретинальной трансплантации генетически модифицированных клеток RPE, чрезмерно экспрессирующих PEDF и GM-CSF, имеет потенциал для предотвращения дегенерации сетчатки путем смягчения последствий окислительного стресса, ингибирования воспаления и поддержки выживания клеток11,12,13,14,15,16 . Несмотря на то, что существует несколько методологий доставки генов в клетки, мы выбрали невирусную гиперактивную транспозонную систему Sleeping Beauty для доставки генов PEDF и GM-CSF в клетки RPE из-за ее профиля безопасности, интеграции генов в геном клеток-хозяев и ее склонности интегрировать доставленные гены в нетранскрипционно активные сайты, как мы показалиранее 17. 18,19.
Клеточный окислительный стресс может быть индуцирован в клетках, культивируемых in vitro несколькими окислительными агентами, включая перекись водорода(H2O2),4-гидроиноненал (HNE), третбутилгидропероксид (tBH), высокое напряжение кислорода и видимый свет (полный спектр или УФ-облучение)20,21. Высокое напряжение кислорода и свет требуют специального оборудования и условий, что ограничивает переносимость на другие системы. Такие агенты, какH2O2,HNE и tBH, индуцируют перекрывающиеся окислительные стрессовые молекулярные и клеточные изменения. Мы выбралиH2O2 для проверки антиоксидантной активности PEDF и GM-CSF, потому что это удобно и биологически значимо, поскольку он продуцируется клетками RPE в качестве реактивного кислородного промежуточного продукта во время фагоцитоза наружного сегмента фоторецептора22 и обнаруживается в тканях глаза in vivo23. Поскольку окисление глутатиона можетбытьчастично ответственным за выработку H2 O2 в глазу, мы проанализировали уровни GSH / глутатиона в наших исследованиях, которые связаны сH2O 2-индуцированнымокислительнымстрессом и регенеративной способностью клеток21,22. Анализ уровня глутатиона особенно актуален, так как он участвует в антиокислительных защитных механизмах в глазу24. ВоздействиеH2O2 часто используется в качестве модели для изучения восприимчивости к окислительному стрессу и антиоксидантной активности клеток RPE1,25,26,27, 28,29,30,и, кроме того, оно показывает сходство со световым индуцированным повреждением окислительного стресса, «физиологическим» источником окислительного стресса21.
Чтобы оценить функциональность и эффективность нейропротекторных факторов, мы разработали модель in vitro, которая позволяет проводить анализ для количественной оценки антиоксидантного эффекта факторов роста, экспрессируемых клетками, генетически модифицированными для сверхэкспрессии PEDF и GM-CSF. Здесь мы показываем, что клетки RPE, трансфектированные генами PEDF и GM-CSF, более устойчивы к вредному воздействиюH2O2, чем нетрансфектированные контрольные клетки, о чем свидетельствует морфология клеток, плотность, жизнеспособность, внутриклеточный уровень глутатиона и экспрессия гена UCP2, который кодирует митохондриальный разъединяющий белок 2, который, как было показано, уменьшает активные формы кислорода (АФК)31.
протокол
Процедуры сбора и использования человеческих глаз были одобрены Кантональной этической комиссией по исследованиям (No 2016-01726).
1. Изоляция клеток и условия культивирования
- Клеточная линия ARPE-19 человека
- Культивируйте 5 x10 5 клеток ARPE-19, клеточную линию RPE человека, в модифицированной смеси среды и питательных веществ F-12 Ham (DMEM/Ham's F-12) Dulbecco, дополненной 10% фетальной бычьей сывороткой (FBS), 80 ЕД/мл пенициллина, 80 мкг/мл стрептомицина и 2,5 мкг/мл амфотерицина B (полная среда) при 37 °C во влажной атмосфере 5% CO2 и 95% воздуха в колбе T75 (для других плотностей клеток см. Таблицу 1).
- Меняйте среду три раза в неделю.
- Как только клетки будут выращены примерно до 90% слияния (оценено качественно), аспирируйте среду и промывайте клетки стерильным 1x PBS.
- Инкубируют клетки 5% раствором трипсина-2% ЭДТА в течение 7-10 мин при 37 °С (объемы см. в таблице 1). Визуальный мониторинг отсоединения.
- Остановите трипсинизацию, добавив полный носитель, содержащий 10% FBS (объемы см. в таблице 1).
- Трансфектируйте клетки (см. шаг 2. протокола), субкультивируйте клетки в соотношении 1:10 (один раз в неделю) или посейте в 96-луночную пластину, как описано ниже (см. шаги 3.3 и 3.4 протокола).
| Средний (мл) | ||||||
| Площадь (см²) | Плотность посева для клеток ARPE-19 (клетки/лунка) | Приложение | Для клеточной культуры | Остановить трипсин | Объем трипсина (мл) | |
| Колба T75 | 75 | 5,00,000 | Рост клеток ARPE-19 | 10 | 7 | 3 |
| 6 Плита скважины | 9.6 | 1,00,000 | Посев трансфектированных клеток ARPE-19 | 3 | 1 | 0.5 |
| 24 Плита скважины | 2 | 50,000 | Посев трансфектированных hRPE клеток | 1 | 0.8 | 0.2 |
| 96 Плита скважины | 0.32 | 5000 для экспериментов с окислительным стрессом с трансфектированными клетками (рис. 1) | Эксперименты с окислительным стрессом | 0.2 | ||
| 3000 для экспериментов с окислительным стрессом с нетрансфектированными клетками плюс белки (рис. 1) | ||||||
Таблица 1: Объемы клеточных культур. Рекомендуемые объемы сред для пластин клеточных культур и колб для культуры ARPE-19 и первичных клеток RPE человека.
- Первичные клетки RPE человека
- Выделяют первичные клетки RPE человека, как описано в Thumann et al.17,и культивируют клетки в полной среде, дополненной 20% FBS.
- Меняйте среду два раза в неделю. Как только клетки достигнут слияния (контролируемого визуально), уменьшите FBS до 1%, чтобы избежать чрезмерного роста.
- Трансфектируйте клетки (см. шаг 2 протокола) или вводите их в 96-луночную пластину, как описано ниже (см. шаги 3.3 и 3.4 протокола).
ПРИМЕЧАНИЕ: Данные, представленные здесь, были собраны из культуры клеток RPE, полученной из глаз четырех доноров-людей. В таблице 2 приводится подробная демографическая информация о донорах из Банка «Львиный дар глаз» (Сент-Пол, Миннесота). Глаза были энуклеированы через 12,7 ± 5,7 ч (среднее значение ± SD) после получения информированного согласия в соответствии с Хельсинкской декларацией.
| Нет | возраст | род | смерть к сохранению (часы) | смерть от изоляции | разведение | разведение | Символ на графике | |
| (дней) | до трансфекции (дней) | после трансфекции (дней) | ||||||
| 2 | 80 | M | 20.7 | 8 | 140 | 36 |  | |
| 3 | 86 | F | 12.8 | 8 | 85 | 45 |  | |
| 4 | 86 | F | 8.5 | 5 | 26 | 133 |  | |
| 8 | 83 | F | 8.9 | 6 | 18 | 27 |  | |
| значить | 83.8 | 12.7 | 6.8 | 67.3 | 60.3 | |||
| СД | 2.9 | 5.7 | 1.5 | 57.0 | 49.1 |
Таблица 2: Демография человеческих доноров пигментных эпителиальных клеток сетчатки.
2. Электропорация ARPE-19 и первичных клеток RPE человека
- Трипсинизировать клетки ARPE-19 или первичные клетки RPE человека, как описано в шагах 1.1.3-1.1.5 протокола.
- Выполните электропорацию с помощью коммерчески доступного комплекта для трансфекции (см. Таблицу материалов).
- Для трансфекции клеток ARPE-19 обратитесь к Johnen et al.32, а для первичного hRPE к Thumann et al.17. Вкратце, повторно суспендируют 1х 10 5 клеток ARPE-19 или 5х 10 4 первичных hRPE клеток в 11 мкл R-буфера и добавляют 2 мкл плазмидной смеси, содержащей 0,03 мкг pSB100X транспозазы33 и 0,47 мкг pT2-CMV-PEDF-His или pT2-CMV-GMCSF-Его транспозон (соотношение транспозаза:транспозон 1:16). Для клеток с двойным трансфектированием PEDF и GM-CSF используйте соотношение 1:16:16 (0,03 мкг pSB100X,0,47 мкг pT2-CMV-PEDF-His и 0,47 мкг pT2-CMV-GMCSF-His). Используйте следующие параметры электропорации: два импульса 1,350 В на 20 мс (широта импульса) для ячеек ARPE-19; два импульса 1 100 В в течение 20 мс для первичных клеток.
- Семена 1 х 105 трансфектированных ARPE-19 или 5 х 104 трансфектированных первичных hRPE клеток в 6-луночных и 24-луночных пластинах, соответственно, в среде, дополненной 10% FBS без антибиотиков или антимикотиков. Добавьте пенициллин (80 Ед/мл), стрептомицин (80 мкг/мл) и амфотерицин В (2,5 мкг/мл) с первым средним обменом через 3 дня после трансфекции.
- Определяют рост клеток путем еженедельного микроскопического мониторинга клеток. Эффективность трансфекции контролируется путем анализа экспрессии генов методом ОТ-ПЦР и секреции белка с помощью ИФА и ВБ (методы, описанные в дополнительном материале).
ПРИМЕЧАНИЕ: Эффективность трансфекции может быть оценена впервые, как только клетки достигнут конфюентности, т.е. через ~7 дней и 4 недели после трансфекции для клеток ARPE-19 и первичных клеток hRPE, соответственно. - Семенные клетки в 96-луночной пластине, как подробно описано ниже (см. шаг 3.5 протокола).
3. Индукция окислительного стресса (лечениеH2O2) и нейропротекция (лечение PEDF и / или GM-CSF)
- Получение кондиционированной среды трансфектированных клеток ARPE-19
- Используйте клетки ARPE-19, трансфектированные генами PEDF, GM-CSF или и тем, и другим (см. шаг 2 протокола); культивировать клетки в течение 28 дней, как описано в шаге 1.1 протокола.
- Через 28 дней после трансфекции трипсинизируют клетки (см. шаги 1.1.3-1.1.5 протокола), подсчитывают клетки с помощью камеры Нойбауэра34,35и засевают 5 х 105 клеток в колбы Т75 в полной среде, как описано на этапе 1.1.1 протокола. Обмен среды, когда клеточная культура примерно на 80% сливается (примерно через 1 неделю; проверена качественно). Собирают среду через 24 ч.
- Храните среду при температуре -20 °C до использования.
ПРИМЕЧАНИЕ: Достаточная концентрация рекомбинантных PEDF и GM-CSF в кондиционированной среде была проверена WB и количественно определена С помощью ИФА, как описано в дополнительном материале.
- Очистка PEDF и GM-CSF из кондиционированной среды трансфектированных клеток ARPE-19
- Центрифугируют собранную среду со стадии 3.1.2 при 10 000 х г в течение 15 мин при 4 °С.
- Используйте суперпоток Ni-NTA (см. Таблицу материалов)в соответствии с протоколами производителя для очистки белков, помеченных His, как описано ниже.
- Пипетка 30 мкл смеси Ni-NTA в пробирку объемом 1,5 мл и центрифугу при 2 600 х г в течение 30 с и отбрасывает проточную. Дважды промыть гранулу 200 мкл 1x инкубационного буфера.
- Центрифуга при 2 600 х г в течение 30 с и отбрасывает сквозной поток. Добавьте 40 мкл 4x инкубационного буфера и повторно суспендируйте.
- Добавьте 900 мкл центрифугированной кондиционированной среды и инкубируйте при 70 об/мин (орбитальный шейкер) в течение 1 ч при RT. Центрифуга при 2 600 х г в течение 1 мин и отброс потока.
- Дважды промыть гранулу 175 мкл 1x инкубационного буфера. Центрифуга при 2 600 х г в течение 30 с и отбрасывает сквозной поток.
- Чтобы элюировать помеченные His белки PEDF и GM-CSF, добавьте 20 мкл буфера элюирования и инкубируйте при 70 об/мин (орбитальный шейкер) в течение 20 мин в RT. Центрифуга при 2 600 х г в течение 30 с. Сохраните супернатант, содержащий рекомбинант PEDF или GM-CSF.
- Количественно оценить общий белок с помощью коммерчески доступного набора для анализа белка BCA (см. Таблицу материалов)в соответствии с инструкциями производителя.
- Хранить белковый раствор при -20 °C до использования.
ПРИМЕЧАНИЕ: Инкубационный буфер (4x) содержит 200 мМ2PO4,1,2 М NaCl и 40 мМ Имидазол; Буфер элюирования содержит 50 мМ2PO4,300 мМ NaCl и 250 мМ Имидазола.
- Лечение нетрансфектированных клеток ARPE-19/primary hRPE с кондиционированной средой плюсH2O2 (Рисунок1A)
- Семенные 3000 нетрансфектированных ARPE-19 (из стадии 1.1.6 протокола) или первичных hRPE (из стадии 1.2.3 протокола) клеток на лунку в 96-луночной пластине и культуру в 200 мкл кондиционированной среды из трансфектированных клеток ARPE-19.
- Культивируйте клетки в течение 10 дней при 37 °C в увлажненной атмосфере 5%CO2 и 95% воздуха. Меняйте кондиционированную среду каждый день. Подвергаете клетки воздействию 350 мкМ H2O2 в течение 24 ч.
- Оценить повреждение от окислительного стресса и определить антиоксидантный эффект PEDF и GM-CSF путем количественной оценки уровней глутатиона (см. шаг 4.1 протокола), микроскопии (см. шаг 4.2 протокола) и анализа цитотоксичности (см. шаг 4.2 протокола).
ПРИМЕЧАНИЕ: Продолжительность эксперимента составляет 12 дней. Прозрачные пластины микролунок с плоским дном используются для оценки люминесценции, а также морфологии клеток. Для одновременного выполнения анализа цитотоксичности и глутатиона в один и тот же день необходимо засеять клетками две пластины.
- Лечение нетрансфектированных клеток ARPE-19/primary hRPE факторами роста PEDF и GM-CSF плюсH2O2 (рисунок1B)
- Семена 3000 нетрансфектированных ARPE-19 (из стадии 1.1.6 протокола) или первичных hRPE (из стадии 1.2.3 протокола) клеток на лунку (96-луночные пластины с четким плоским дном) в 200 мкл полной культуральной среды, содержащей 500 нг/мл рекомбинантного PEDF и/или 50 нг/мл рекомбинантного GM-CSF, очищенного из среды трансфектированных клеток ARPE-19 или коммерчески доступного. Культивировать клетки в течение 48 ч при 37 °С в увлажненной атмосфере с содержанием 5%СО2 и 95% воздуха. Ежедневно обновляйте среду, включая факторы роста PEDF и GM-CSF.
ПРИМЕЧАНИЕ: Добавьте свежие факторы роста в среду. - После 48 ч обработки клеток факторами роста удаляют среду и добавляют полную среду, содержащую 350 мкМ H2O2 плюс 500 нг/мл PEDF и/или 50 нг/мл GM-CSF.
- Оценить повреждение от окислительного стресса и определить антиоксидантный эффект PEDF и GM-CSF путем количественной оценки уровней глутатиона (см. шаг 4.1 протокола), микроскопии (см. шаг 4.2 протокола) и анализа цитотоксичности (см. шаг 4.2 протокола).
ПРИМЕЧАНИЕ: Продолжительность эксперимента составляет 3 дня.
- Семена 3000 нетрансфектированных ARPE-19 (из стадии 1.1.6 протокола) или первичных hRPE (из стадии 1.2.3 протокола) клеток на лунку (96-луночные пластины с четким плоским дном) в 200 мкл полной культуральной среды, содержащей 500 нг/мл рекомбинантного PEDF и/или 50 нг/мл рекомбинантного GM-CSF, очищенного из среды трансфектированных клеток ARPE-19 или коммерчески доступного. Культивировать клетки в течение 48 ч при 37 °С в увлажненной атмосфере с содержанием 5%СО2 и 95% воздуха. Ежедневно обновляйте среду, включая факторы роста PEDF и GM-CSF.
- Лечение трансфектированных клеток ARPE-19/первичных hRPE сH2O2 (Рисунок1C)
- Проверить достаточную экспрессию генов и секрецию белка трансфектированных клеток WB и ИФА, как описано в Дополнительном материале.
- Удалите среду из скважин, содержащих трансфектированные клетки (см. шаг 2 протокола).
- Трипсинизировать клетки, как описано на этапах 1.1.3-1.1.5 протокола. Подсчитайте ячейки с помощью камеры Нойбауэра34,35.
- Посейте 5000 трансфектированных клеток/лунок в 96-луночную пластину в 200 мкл полной среды. Культивировать клетки в течение 24 ч при 37 °С в увлажненной атмосфере с содержанием 5%СО2 и 95% воздуха. Через 24 ч подвергают клетки воздействию 350 мкМ H2O2o 2 в течение 24 ч.
- Оценить повреждение от окислительного стресса и определить антиоксидантный эффект PEDF и GM-CSF путем количественной оценки уровней глутатиона (см. шаг 4.1 протокола), микроскопии (см. шаг 4.2 протокола), анализа цитотоксичности (см. шаг 4.2 протокола) и определения экспрессии гена UCP2 (см. шаг 4.3 протокола).
ПРИМЕЧАНИЕ: Продолжительность эксперимента составляет 2 дня.
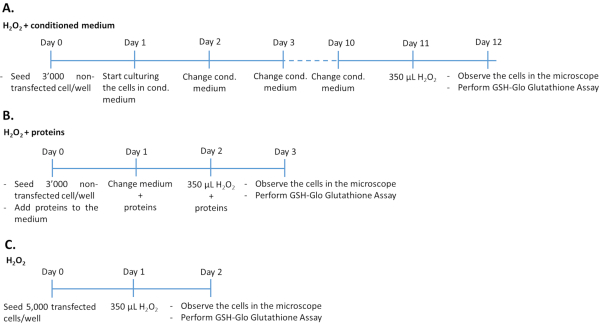
Рисунок 1:Временные шкалы анализаH2O2 в трех различных экспериментальных подходах. 3000 нетрансфектированных клеток, обработанных кондиционированными средними/рекомбинантными белками или 5000 трансфектированных клеток, были посеяны в 96-луночные пластины дляобработки H2O2. Чтобы определить эффект условной среды, клетки культивировали в 100% культивируемой среде в течение 10 дней подряд, меняя среду каждый день. Чтобы определить влияние рекомбинантных факторов роста, клетки культивировали путем добавления соответствующего количества факторов роста каждый день в течение 3 последовательных дней. Обратите внимание, что нетрансфектированные клетки были посеяны по 3000 клеток на лунку, чтобы избежать чрезмерного роста в течение большей продолжительности культивирования по сравнению с трансфектированными клетками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Анализ уровня окислительного стресса и антиоксидантной способности
- Анализ глутатиона
- Измерьте уровни глутатиона (GSH) с помощью коммерчески доступного комплекта (см. Таблицу материалов)в соответствии с инструкциями производителя. Вкратце, подготовьте и соответствующий объем 1x смеси реагентов (100 мкл реагента в лунку): субстрат Люциферин-NT и глутатион S-трансфераза, разбавленные 1:100 в реакционном буфере.
ПРИМЕЧАНИЕ: Для 96-луночной пластины требуется 10 мл 1x смеси реагентов, которая получается путем добавления 100 мкл субстрата Люциферина-NT и 100 мкл глутатиона S-трансферазы к 10 мл реакционного буфера. Подготовьте 1x смесь реагентов непосредственно перед использованием. Не храните приготовленную смесь реагентов для дальнейшего использования. - Подготовьте реагент обнаружения люциферина, перенеся одну бутылку буфера восстановления в лиофилизированный реагент обнаружения люциферина.
- Подготовьте стандартную кривую, используя стандартный раствор глутатиона (GSH) (5 мМ). Разбавить 5 мМ раствор ГШ 1:100 с dH2O(добавьте 10 мкл 5 мМ раствора GSH к 990 мкл dH2O). Выполняют 7 последовательных разбавлений 1:1 в 500 мкл dH2O.Перенесите 10 мкл каждого разбавленного стандарта в соответствующую лунку в двух экземплярах.
ПРИМЕЧАНИЕ: Конечная концентрация глутатиона будет варьироваться от 0,039 мкМ до 5 мкМ. - Подготовьте заготовку (1x смесь реагентов) и передайте 10 мкл (дубликаты) в соответствующие скважины.
- Удалитеклетки,обработанныеH2O2, из инкубатора.
ПРИМЕЧАНИЕ: Документирование морфологии клеток, обработанныхH2O2,с помощью микроскопии Брайрайтфилда (40x).
Когда клетки окисляются, они выглядят более округлыми и менее распространенными. - Тщательно аспирируйте культуральную среду. Добавьте 100 мкл приготовленной 1x смеси реагентов в каждую лунку. Смешайте ячейки с реагентом в течение 15 с при 500 об/мин на орбитальном шейкере.
- Инкубировать пластину на RT в течение 30 мин. Добавьте 100 мкл восстановленного реагента люциферина для обнаружения в каждую лунку.
- Перемешивайте раствор в течение 15 с при 500 об/мин на орбитальном шейкере. Инкубировать пластину в течение 15 мин на RT.
- Определить люминесценцию можно с помощью планшетного считывателя с помощью предустановленной программы ADP-Glo.
ПРИМЕЧАНИЕ: Поместите пластину внутрь считывателя пластин без крышки.- Нажмите «Изменить макет» и выберите следующие настройки в разделе «Основные параметры»:Режущая 96-луночная плита; верхняя оптика; задержка позиционирования: 0,1; время начала измерения: 0,0; интервал измерения времени: 1,0; время нормализации результатов: 0,0; коэффициент усиления регулируется устройством автоматически. Определение заготовок, стандартов и образцов. Нажмите кнопку Начать измерение.
- Экспортируйте данные в виде файла Excel. Рассчитайте концентрацию GSH в каждом образце путем интерполяции стандартной кривой.
- Измерьте уровни глутатиона (GSH) с помощью коммерчески доступного комплекта (см. Таблицу материалов)в соответствии с инструкциями производителя. Вкратце, подготовьте и соответствующий объем 1x смеси реагентов (100 мкл реагента в лунку): субстрат Люциферин-NT и глутатион S-трансфераза, разбавленные 1:100 в реакционном буфере.
- Анализ цитотоксичности и микроскопический анализ
- Аспирируйте среду из клеток и добавляйте 100 мкл полной среды, содержащей 1% FBS, в каждую лунку. Верните клетки в инкубатор.
ПРИМЕЧАНИЕ: 1% FBS используется, потому что более высокие проценты FBS могут мешать измерению люминесценции, поэтому в этом случае используется 1% FBS. - Измерьте жизнеспособность клеток с помощью коммерчески доступного набора для анализа цитотоксичности (см. Таблицу материалов)в соответствии с инструкциями производителя. Вкратце, подготовьте смесь реагентов, добавив буфер анализа к лиофилизированному субстрату. Приготовьте лизисовый реагент, добавив 33 мкл дигитонина в буфер анализа 5 мл (для одной 96-луночной пластины). Хорошо перемешайте путем пипетки вверх и вниз для обеспечения однородности.
ПРИМЕЧАНИЕ: Для достижения оптимальных результатов используйте свежеприготовленную смесь реагентов. Используйте в течение 12 ч при хранении в RT. Смесь реагентов может храниться при 4 °C до 7 дней и может храниться в одноразовых аликвотах до 4 месяцев при -70 °C. Необходимо избегать замерзания и оттаивания. Реагент лизиса может храниться при температуре 4 °C до 7 дней. - Подготовьте стандартную кривую с необработанными клетками ARPE-19.
- Трипсинизируют клетки, как описано на этапах 1.1.3-1.1.5 протокола, и подсчитывают клетки с помощью камеры Нойбауэра34,35. Центрифугируют клетки при 120 г в течение 10 мин при RT. Аспирируют супернатант и повторно суспендируют клеточную гранулу в среде DMEM/Ham F12, содержащей 1% FBS до конечной концентрации 1 х 105 клеток/мл.
- Готовят 7 последовательных разведений 1:1 в среде 200 мкл, содержащей 1% FBS. Перенос 100 мкл каждого стандарта в соответствующие скважины (дубликаты). Добавьте 50 мкл смеси реагентов во все лунки.
- Смешайте ячейки с реагентом в течение 15 с при 500 об/мин на орбитальном шейкере. Инкубируйте пластину в течение 15 мин на RT. Измерьте люминесценцию с помощью считывателя пластин, как описано на этапе 4.1.9 протокола. Добавить 50 мкл лизисного реагента и инкубировать в течение 15 мин. Измерьте люминесценцию с помощью пластинчатого считывателя, как описано в шаге 4.1.9 протокола.
- Рассчитайте процент жизнеспособных клеток: (100 - % мертвых клеток) и процент мертвых клеток = [1-е измерение люминесценции ((мертвые клетки в образце))/ 2-е измерение люминесценции (все клетки мертвы после обработки дигитонином)] x 100.
- Аспирируйте среду из клеток и добавляйте 100 мкл полной среды, содержащей 1% FBS, в каждую лунку. Верните клетки в инкубатор.
- Анализ выражений UCP2 с помощью RT-qPCR
- Трипсинизировать трансфектированные клетки, как описано выше (этапы 1.1.3-1.1.5 протокола).
- Подсчитайте ячейки с помощью камеры Нойбауэра34,35.
- Семена 5000 трансфектированных клеток ARPE-19 / скважина в 96-луночных пластинах.
- Через 24 ч культуры обрабатывают клетки 350 мкМH2O2o 2 в течение 24 ч.
- Изолируют общую РНК с помощью коммерческого набора для выделения РНК из небольшого числа клеток (см. Таблицу материалов)в соответствии с инструкцией производителя.
- Выполните количественную ПЦР в режиме реального времени (RT-qPCR), как описано в дополнительном материале. Вкратце, генерируйте кДНК путем ретротранскрипции, используя коммерчески доступную смесь, содержащую оптимизированную обратную транскриптазу M-MLV (см. Таблицу материалов).
- Для qPCR используют готовый к употреблению реакционный коктейль, содержащий все компоненты (включая SYBR Green), за исключением праймеров (см. Таблицу S1 дополнительного материала)и шаблона ДНК. Используйте следующие условия термоциклирования: начальная денатурация при 95 °C в течение 10 мин, 40 циклов с денатурацией при 95 °C в течение 15 с, отжиг при 60 °C в течение 30 с и удлинение при 72 °C в течение 32 с.
- Используйте метод 2^(-ΔΔCT) для анализа36.
- Подготовка лизата клеток для SDS-PAGE и WB анализа pAkt (Ser473)
- Семена 3 x 105 GM-CSF-трансфектированных клеток ARPE-19 / скважина в 6-луночных пластинах (≥21 день после трансфекции), чтобы определить, защищает ли GM-CSF клетки RPE от поврежденияH2O2 путем активации пути выживания Akt15.
- Через 24 ч клетки культуры подвергают воздействию 350 мкМ Н2О2в течение 24 ч.
- Смешайте 1 мл буфера RIPA с 10 мкл коктейля ингибитора протеазы фосфатазы, 10 мкл 0,5 М ЭДТА и 25 мкл 8 М мочевины (объемы, используемые для одной лунки).
- Тщательно аспирируйте среду и промывайте клетки 1x PBS.
- Добавьте весь объем буферной смеси RIPA в ячейки.
- Пипетка вверх и вниз.
- Соберите лизат в пробирки по 1,5 мл.
- Центрифуга при 20 000 х г в течение 30 мин при 4 °C.
- Перенесите супернатант в новую трубку объемом 1,5 мл.
- Определить уровни pAkt в 15 мкл неразбавленного лизата клеток WB, как описано в дополнительном материале.
Результаты
Индукция окислительного стресса в пигментных эпителиальных клетках сетчатки человека
Клетки ARPE-19 и первичные hRPE обрабатывали различными концентрациямиH2O2 в течение 24 ч и количественно определяли внутриклеточный уровень антиоксиданта глутати?...
Обсуждение
Протокол, представленный здесь, предлагает подход к анализу антиоксидантной и защитной функции PEDF и GM-CSF, продуцируемых трансфектированными клетками, который может быть применен к клеткам, трансфектированным любым предполагаемым полезным геном. В геннотерапевтических стратегиях, цел...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Грегга Сили и Алена Конти за отличную техническую помощь и профессора Zsuzsanna Izsvák из Центра Макса-Дельбрюка в Берлине за любезное предоставление плазмид pSB100X и pT2-CAGGS-Venus. Эта работа была поддержана Швейцарским национальным научным фондом и Европейской комиссией в контексте Седьмой рамочной программы. Z.I финансировался Европейским исследовательским советом, ERC Advanced [ERC-2011-ADG 294742].
Материалы
| Name | Company | Catalog Number | Comments |
| 24-well plates | Corning | 353047 | |
| 6-well plates | Greiner | 7657160 | |
| 96-well culture plate white with clear flat bottom | Costar | 3610 | Allows to check the cells before measuring the luminescence (GSH-Glo Assay) |
| 96-well plates | Corning | 353072 | |
| Acrylamid 40% | Biorad | 161-0144 | |
| Amphotericin B | AMIMED | 4-05F00-H | |
| Antibody anti-GMCSF | ThermoFisher Scientific | PA5-24184 | |
| Antibody anti-mouse IgG/IgA/IgM | Agilent | P0260 | |
| Antibody anti-PEDF | Santa Cruz Biotechnology Inc | sc-390172 | |
| Antibody anti-penta-His | Qiagen | 34660 | |
| Antibody anti-phospho-Akt | Cell Signaling Technology | 9271 | |
| Antibody anti-rabbit IgG H&L-HRP | Abcam | ab6721 | |
| Antibody donkey anti-rabbit Alexa Fluor 594 | ThermoFisher Scientific | A11034 | |
| Antibody goat anti-mouse Alexa 488 | ThermoFisher Scientific | A-11029 | |
| ARPE-19 cell line | ATCC | CRL-2302 | |
| BSA | Sigma-Aldrich | A9418-500G | |
| chamber culture glass slides | Corning | 354118 | |
| CytoTox-Glo Cytotoxicity Assay | Promega | G9291 | |
| DAPI | Sigma-Aldrich | D9542-5MG | |
| DMEM/Ham`s F12 | Sigma-Aldrich | D8062 | |
| Duo Set ELISA kit | R&D Systems | DY215-05 | |
| EDTA | ThermoFisher Scientific | 78440 | |
| ELISAquant kit | BioProducts MD | PED613-10-Human | |
| Eyes (human) | Lions Gift of Sight Eye Bank (Saint Paul, MN) | ||
| FBS | Brunschwig | P40-37500 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680-25ML | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| GraphPad Prism software (version 8.0) | GraphPad Software, Inc. | ||
| GSH-Glo Glutathione Assay | Promega | V6912 | |
| hydrogen peroxide (H2O2) | Merck | 107209 | |
| ImageJ software (image processing program) | W.S. Rasband, NIH, Bethesda, MD, USA; https://imagej.nih.gov/ij/; 1997–2014 | ||
| Imidazol | Axonlab | A1378.0010 | |
| Leica DMI4000B microscope | Leica Microsystems | ||
| LightCycler 480 Instrument II | Roche Molecular Systems | ||
| LightCycler 480 SW1.5.1 software | Roche Molecular Systems | ||
| NaCl | Sigma-Aldrich | 71376-1000 | |
| NaH2PO4 | Axonlab | 3468.1000 | |
| Neon Transfection System | ThermoFisher Scientific | MPK5000 | |
| Neon Transfection System 10 µL Kit | ThermoFisher Scientific | MPK1096 | |
| Neubauer chamber | Marienfeld-superior | 640010 | |
| Ni-NTA superflow | Qiagen | 30410 | |
| Nitrocellulose | VWR | 732-3197 | |
| Omega Lum G Gel Imaging System | Aplegen Life Science | ||
| PBS 1X | Sigma-Aldrich | D8537 | |
| Penicillin/Streptomycin | Sigma-Aldrich | P0781-100 | |
| PerfeCTa SYBR Green FastMix | Quantabio | 95072-012 | |
| PFA | Sigma-Aldrich | 158127-100G | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23227 | |
| Primers | Invitrogen | See Table 1 in Supplementary Materials | |
| pSB100X (250 ng/µL) | Mátés et al., 2009. Provide by Prof. Zsuzsanna Izsvak | ||
| pT2-CMV-GMCSF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| pT2-CMV-PEDF-His plasmid DNA (250 ng/µL) | Constructed using the existing pT2-CMV-PEDF-EGFP plasmid reported in Johnen, S. et al. (2012) IOVS, 53 (8), 4787-4796. | ||
| QIAamp DNA Mini Kit | QIAGEN | 51304 | |
| recombinant hGM-CSF | Peprotech | 100-11 | |
| recombinant hPEDF | BioProductsMD | 004-096 | |
| ReliaPrep RNA Cell Miniprep System | Promega | Z6011 | |
| RIPA buffer | ThermoFisher Scientific | 89901 | |
| RNase-free DNase Set | QIAGEN | 79254 | |
| RNeasy Mini Kit | QIAGEN | 74204 | |
| SDS | Applichem | A2572 | |
| Semi-dry transfer system for WB | Bio-Rad | ||
| SuperMix qScript | Quantabio | 95048-025 | |
| Tris-buffered saline (TBS) | ThermoFisher Scientific | 15504020 | |
| Triton X-100 | AppliChem | A4975 | |
| Trypsin/EDTA | Sigma-Aldrich | T4174 | |
| Tween | AppliChem | A1390 | |
| Urea | ThermoFisher Scientific | 29700 | |
| WesternBright ECL HRP substrate | Advansta | K-12045-D50 | |
| Whatman nitrocellulose membrane | Chemie Brunschwig | MNSC04530301 |
Ссылки
- Zareba, M., Raciti, M. W., Henry, M. M., Sarna, T., Burke, J. M. Oxidative stress in ARPE-19 cultures: Do melanosomes confer cytoprotection. Free Radical Biology and Medicine. 40 (1), 87-100 (2006).
- Gong, X., Draper, C. S., Allison, G. S., Marisiddaiah, R., Rubin, L. P. Effects of the macular carotenoid lutein in human retinal pigment epithelial cells. Antioxidants. 6 (4), (2017).
- Sacconi, R., Corbelli, E., Querques, L., Bandello, F., Querques, G. A Review of current and future management of geographic atrophy. Ophthalmology and Therapy. 6, 69-77 (2017).
- Al-Zamil, W. M., Yassin, S. A. Recent developments in age-related macular degeneration: a review. Clinical Interventions in Aging. 12, 1313-1330 (2017).
- Kumar-Singh, R. The role of complement membrane attack complex in dry and wet AMD - From hypothesis to clinical trials. Experimental Eye Research. 184, 266-277 (2019).
- Ung, L., Pattamatta, U., Carnt, N., Wilkinson-Berka, J. L., Liew, G., White, A. J. R. Oxidative stress and reactive oxygen species. Clinical Science. 131, 2865-2883 (2017).
- Beatty, S., Koh, H. H., Phil, M., Henson, D., Boulton, M. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Survey of Ophthalmology. 45 (2), 115-134 (2000).
- Alhasani, R. H., et al. Gypenosides protect retinal pigment epithelium cells from oxidative stress. Food and Chemical Toxicology. 112, 76-85 (2018).
- . National Institute of Health Available from: https://nei.nih.gov/learn-about-eye-health/resources-for-health-educators/eye-health-data-and-statistics/age-related-macular-degeneration-amd-data-and-statistics (2020)
- Mitchell, P., Liew, G., Gopinath, B., Wong, T. Y. Age-related macular degeneration. The Lancet. 392, 1147-1159 (2018).
- He, Y., Leung, K. W., Ren, Y., Jinzhi, P., Jian, G., Tombran-Tink, J. PEDF improves mitochondrial function in RPE cells during oxidative stress. Investigative Ophthalmology & Visual Science. 55, 6742-6755 (2014).
- Cao, S., Walker, G. B., Wang, X., Cui, J. Z., Matsubara, J. A. Altered cytokine profiles of human retinal pigment epithelium: Oxidant injury and replicative senescence. Molecular Vision. 19, 718-728 (2013).
- Farnoodian, M., Sorenson, C. M., Sheibani, N. PEDF expression affects the oxidative and inflammatory state of choroidal endothelial cells. Amercian Journal of Physiology and Cell Physiology. 314 (4), 456-472 (2018).
- Polato, F., Becerra, S. P. Retinal Degenerative Diseases: Mechanisms and Experimental Therapies. Retinal Degenerative Diseases. , 699-706 (2016).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF regulates the ERK1/2 pathways and protects injured retinal ganglion cells from induced death. Experimental Eye Research. 89, 665-677 (2009).
- Schallenberg, M., Charalambous, P., Thanos, S. GM-CSF protects rat photoreceptors from death by activating the SRC-dependent signalling and elevating anti-apoptotic factors and neurotrophins. Graefes Archives for Clinical and Experimental Ophthalmology. 250, 699-712 (2012).
- Thumann, G., et al. Engineering of PEDF-expressing primary pigment epithelial cells by the SB transposon system delivered by pFAR4 plasmids. Molecular Therapy - Nucleic Acids. 6, 302-314 (2017).
- Garcia-Garcia, L., et al. Long-term PEDF release in rat iris and retinal epithelial cells after Sleeping Beauty transposon-mediated gene delivery. Molecular Therapy - Nucleic Acids. 9, 1-11 (2017).
- Johnen, S., et al. Antiangiogenic and neurogenic activities of Sleeping Beauty-mediated PEDF-transfected RPE cells in vitro and in vivo. BioMed Research International. 2015, (2015).
- Weigel, A. L., Handa, J. T., Hjelmeland, M. L. Microarray analysis of H2O2-, HNE-, or tBH-treated ARPE-19 cells. Free Radical Biology & Medicine. 33 (10), 1419-1432 (2002).
- Allen, R. G., Tresini, M. Oxidative stress and gene regulation. Free Radical Biology and Medicine. 28 (3), 463-499 (2000).
- Tate, D. J., Miceli, M. V., Newsome, D. A. Phagocytosis and H2O2 induce catalase and metallothionein gene expression in human retinal pigment epithelial cells. Investigative Ophthalmology and Visual Science. 36 (7), 1271-1279 (1995).
- Halliwell, B., Clement, M. V., Long, L. H. Hydrogen peroxide in the human body. FEBS Letters. 486 (1), 10-13 (2000).
- Giblin, F. J., McCready, J. P., Kodama, T., Reddy, V. N. A direct correlation between the levels of ascorbic acid and H2O2 in aqueous humor. Experimental Eye Research. 38, 87-93 (1984).
- Geiger, R. C., Waters, C. M., Kamp, D. W., Glucksberg, M. R. KGF prevents oxygen-mediated damage in ARPE-19 cells. Investigative Ophthalmology and Visual Science. 46, 3435-3442 (2005).
- Campochiaro, P. A., et al. Lentiviral vector gene transfer of endostatin/angiostatin for macular degeneration (GEM) study. Human Gene Therapy. 28, 99-111 (2017).
- Chen, X. -. D., Su, M. -. Y., Chen, T. -. T., Hong, H. -. Y., Han, A. -. D., Li, W. -. S. Oxidative stress affects retinal pigment epithelial cell survival through epidermal growth factor receptor/AKT signaling pathway. International Journal of Ophthalmology. 10 (4), 507-514 (2017).
- Tu, G., et al. Allicin attenuates H2O2 - induced cytotoxicity in retinal pigmented epithelial cells by regulating the levels of reactive oxygen species. Molecular Medicine Reports. 13, 2320-2326 (2016).
- Hao, Y., Liu, J., Wang, Z., Yu, L., Wang, J. Piceatannol protects human retinal pigment epithelial cells against hydrogen peroxide induced oxidative stress and apoptosis through modulating. Nutrients. 11, 1-13 (2019).
- Ballinger, S. W., Van Houten, B., Conklin, C. A., Jin, G. F., Godley, B. F. Hydrogen peroxide causes significant mitochondrial DNA damage in human RPE cells. Experimental Eye Research. 68 (6), 765-772 (1999).
- Ma, S., et al. Transgenic overexpression of uncoupling protein 2 attenuates salt-induced vascular dysfunction by inhibition of oxidative stress. American Journal of Hypertension. 27 (3), 345-354 (2014).
- Johnen, S., et al. Sleeping Beauty transposon-mediated transfection of retinal and iris pigment epithelial cells. Investigative Ophthalmology and Visual Science. 53 (8), 4787-4796 (2012).
- Mátés, L., et al. Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates. Nature Genetics. 41 (6), 753-761 (2009).
- . Marienfeld Technical information Neubauer-improved Available from: https://www.marienfeld-superior.com/information-about-our-counting-chambers.html (2020)
- . Electron Microscopy Sciences. Neubauer Haemocytometry Available from: https://www.emsdiasum.com/microscopy/technical/datasheet/68052-14.aspx (2020)
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2^(-ΔΔCT) method. Methods. 25 (4), 402-408 (2001).
- Bascuas, T., et al. Non-virally transfected primary human pigment epithelium cells overexpressing the oxidative stress reduction factors PEDF and GM-CSF to treat retinal neurodegeneration neurodegenerationl. Human Gene Therapy. 30 (11), (2019).
- Zhuge, C. C., et al. Fullerenol protects retinal pigment epithelial cells from oxidative stress-induced premature senescence via activating SIRT1. Investigative Ophthalmology & Visual Science. 55 (7), 4628-4638 (2014).
- Kaczara, P., Sarna, T., Burke, M. Dynamics of H2O2 Availability to ARPE-19 cultures in models of oxidative stress. Free Radical Biology and Medicine. 48 (8), 1068-1070 (2010).
- Gorrini, C., Harris, I. S., Mak, T. W. Modulation of oxidative stress as an anticancer strategy. Nature Reviews Drug Discovery. 12, 931-947 (2013).
- Wang, X., et al. PEDF protects human retinal pigment epithelial cells against oxidative stress via upregulation of UCP2 expression. Molecular Medicine Reports. 19 (1), 59-74 (2019).
- Donadelli, M., Dando, I., Fiorini, C., Palmieri, M. UCP2, a mitochondrial protein regulated at multiple levels. Cellular and Molecular Life Sciences. 71, 1171-1190 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены