Method Article
التحليل الطيفي المزدوج اللون للفلورسين المترابط لدراسة التفاعل بين البروتين والبروتين وديناميكيات البروتين في الخلايا الحية
* These authors contributed equally
In This Article
Summary
نقدم بروتوكول تجريبي وسير عمل تحليل البيانات لأداء الخلية الحية المزدوجة اللون مضان عبر التحليل الطيفي الارتباط (FCCS) جنبا إلى جنب مع Förster الرنين نقل الطاقة (FRET) لدراسة ديناميات مستقبلات الغشاء في الخلايا الحية باستخدام تقنيات وضع العلامات الفلورية الحديثة.
Abstract
نحن نقدم بروتوكول وسير العمل لأداء الخلية الحية المزدوجة اللون مضان عبر الارتباط الطيفي (FCCS) جنبا إلى جنب مع Förster الرنين نقل الطاقة (FRET) لدراسة ديناميات مستقبلات الغشاء في الخلايا الحية باستخدام تقنيات وضع العلامات الفلورية الحديثة. في FCCS ثنائي اللون ، حيث تمثل التقلبات في كثافة الفلورسينس "بصمة" ديناميكية للجزيئ الحيوي الفلوري المعني ، يمكننا التحقيق في الانتشار المشترك أو الربط بين المستقبلات. FRET، مع حساسيتها العالية للمسافات الجزيئية، بمثابة "نانورولر" معروفة لرصد التغيرات داخل الجزيئية. وإذا ما أخذت معا، فإن التغيرات التنظيمية والمعلمات الرئيسية مثل تركيزات المستقبلات المحلية وثوابت التنقل تصبح متاحة في البيئات الخلوية.
إن أساليب الفلورسينس الكمية تشكل تحديا في الخلايا بسبب مستويات الضوضاء العالية وضعف العينة. هنا نعرض كيفية إجراء هذه التجربة، بما في ذلك خطوات المعايرة باستخدام اللون المزدوج المسمى β2-مستقبلاتالأدرينالية (β2AR) المسمى مع eGFP وSNAP-tag-TAMRA. يتم توفير إجراء تحليل البيانات خطوة بخطوة باستخدام برامج مفتوحة المصدر وقوالب يسهل تخصيصها.
يمكن دليلنا الباحثين من كشف التفاعلات الجزيئية للجزيئات الحيوية في الخلايا الحية في الموقع مع موثوقية عالية على الرغم من مستويات الإشارة إلى الضوضاء المحدودة في تجارب الخلايا الحية. وتسمح النافذة التشغيلية ل FRET وخاصة FCCS بتركيزات منخفضة بالتحليل الكمي في الظروف شبه الفسيولوجية.
Introduction
التحليل الطيفي الفلوري هو واحد من الطرق الرئيسية لقياس ديناميات البروتين والتفاعلات البروتين البروتين مع الحد الأدنى من الاضطراب في السياق الخلوي. التحليل الطيفي للارتباط الفلوري الكونفوكوكال (FCS) هو واحد من الأساليب القوية لتحليل الديناميات الجزيئية كما هو جزيء واحد حساسة، انتقائية للغاية، ويعيش الخليةمتوافقة 1. بالمقارنة مع النهج الأخرى الموجهة نحو الديناميكيات ، فإن FCS لديها نطاق زمني أوسع قابل للقياس يمتد من ~ ns إلى ~ s ، والأهم من ذلك تغطية المقاييس الزمنية السريعة التي غالبا ما لا يمكن الوصول إليها عن طريق الأساليب القائمة على التصوير. وعلاوة على ذلك، فإنه يوفر أيضا الانتقائية المكانية بحيث يمكن بسهولة تمييز الغشاء، السيتوبلازميك، والنواة الديناميات الجزيئية 2. وهكذا، يمكن تحليل الوميض الجزيئي ومتوسط التركيز المحلي ومعامل الانتشار كميا باستخدام FCS. الديناميات بين الجزيئية مثل الربط تصبح سهلة الوصول إليها عند التحقيق في الانتشار المشترك لنوعين الجزيئية في التحليل الطيفي عبر الارتباط الفلوري (FCCS)تحليل 3،4،5 في نهج ثنائي اللون.
المبدأ الأساسي الأساسي في التحليل الطيفي للارتباط هو التحليل الإحصائي لتقلبات الكثافة المنبعثة من الجزيئات الحيوية المسماة الفلورية المنتشرة داخل وخارج تركيز الليزر(الشكل 1A). يمكن بعد ذلك تحليل وظائف الارتباط التلقائي أو المتبادل الناتجة عن ذلك عن طريق منحنى مناسب لاشتقاق ثوابت معدل الفائدة في نهاية المطاف. وبعبارة أخرى، فإن الأساليب الإحصائية FCS و FCCS لا توفر آثار جزيء واحد كما هو الحال في تتبع الجسيمات واحد، ولكن نمط ديناميكي أو "بصمة" عينة التحقيق مع دقة زمنية عالية. عندما يقترن Förster نقل الطاقة الرنين (FRET) ، يمكن رصد الديناميات داخل الجزيئية مثل التغيرات تشكيلية في نفس الوقت في الإعداد confocalالمشتركة 5،6. FRET تحقيقات المسافة من اثنين من الفلوروفوريس وغالبا ما يشار إليها باسم الجزيئية "nanoruler". ولا يحدث نقل الطاقة إلا عندما تكون الجزيئات في محيط قريب (< 10 نانومتر)، ويتداخل طيف انبعاثات المتبرع بشكل كبير مع طيف امتصاص جزيء المقبول، ويوازي اتجاه ثنائي القطب للمتبرع والمتقبل (بما فيه الكفاية). وهكذا ، فإن الجمع بين FRET و FCCS يوفر تقنية ذات دقة زمنية عالية جدا. عندما الانتقائية المكانية، والحساسية، فضلا عن التوافق بين الخلايا الحية مطلوب، FRET-FCCS لديه مفيد واضح على أساليب أخرى مثل قياس حرارية المعايرة Isothermal (ITC)7،سطح بلازمون الرنين (SPR)8،أو الرنين المغناطيسي النووي (NMR)9،10 لقياس ديناميات البروتين والتفاعلات.
على الرغم من قدرات ووعد مزدوج اللون مضان عبر الارتباط الطيفي (DC-FCCS)، أداء DC-FCCS في الخلايا الحية هو التحدي من الناحية الفنية بسبب نزيف الطيفية من خلال أو عبر الحديث بين القنوات3،4، والفرق في أحجام confocal بسبب خطوط الليزر متميزة طيفيا3،4،11، إشارة الخلفية ، والضوضاء أو القدرة الضوئية المحدودة للعينات12، 13،14،15. وكان إدخال الإثارة النبض interleaved (PIE) ل FCCS قرص مهم لفصل زمنيا الإثارة الليزر المختلفة للحد من الكلام الطيفي بين القنوات16. طرق التصحيح الأخرى لمواجهة النزيف الطيفي من خلال17،18،19 وتصحيحات الخلفية كما تم قبولها جيدا17،18،19. للحصول على تفاصيل وأساسيات على FCS، PIE أو FRET القارئ يشار إلى المراجع التالية2،4،6،16،20،21،22،23،24.
هنا، يتم تقديم جميع تجارب المعايرة اللازمة والتحليل جنبا إلى جنب مع النتائج التجريبية لمستقبلات G-البروتين إلى جانب نموذجي، β2-مستقبلات الأدرينالين (β2AR)، لثلاثة سيناريوهات مختلفة: (1) جزيئات ذات تسمية واحدة تحمل إما "الأخضر" (eGFP) أو "الأحمر" (SNAP-tag القائم على وضع العلامات)25 الفلوروفور؛ (2) بناء مزدوج المسمى، الذي يحمل علامة SNAP-محطة N وeGFP داخل الخلايا (NT-SNAP) [في هذه الحالة، كل التسميات هي في نفس البروتين. وبالتالي من المتوقع 100٪ نشر مشترك]؛ و (3) عينة مزدوجة التسمية، حيث يكون كلا الفلوروفوريس على نفس الجانب من غشاء الخلية (CT-SNAP). وهو يحمل علامة SNAP-TERMINAL C وeGFP داخل الخلايا. هنا، مرة أخرى كل التسميات هي في نفس البروتين مع مرة أخرى 100٪ المشاركة في الانتشار المتوقع. كما كل التسميات هي قريبة جدا من بعضها البعض، على نفس الجانب من غشاء الخلية، فإنه يظهر القدرة على مراقبة FRET والسلوك المضادة للارتهان. تم تحويل جميع المنشآت المصابة في خلايا مبيض الهامستر الصيني (CHO) ووصفت في وقت لاحق مع ركيزة الفلورسنت الحمراء التي هي غشاء غير منفذة لبناء NT-SNAP والغشاء نفاذية لبناء CT-SNAP. وأخيرا، فإن البيانات المحاكاة تجسد تأثير المعلمات التجريبية على مضاد الارتباط الناجم عن FRET، وتأثير التفاعلات بين البروتين والبروتين على اتساع الانتشار المشترك.
وهكذا، يوفر هذا البروتوكول دليلا كاملا لأداء FRET-FCCS مجتمعة في الخلايا الحية لفهم ديناميات البروتين والتفاعلات البروتين البروتين مع جعل على بينة من التحف التقنية / المادية، والتحديات، والحلول الممكنة.
Protocol
1. البروتوكول التجريبي
- إعداد العينة
ملاحظة: إجراء بذر الخلية و إعادة العدوى في ظل ظروف معقمة.- ضع غطاء تنظيفه في بئر في لوحة ثقافة 6-well واغسل ثلاث مرات بالمحلول الملحي المعقم العازل بالفوسفات (PBS).
ملاحظة: يتم تفصيل بروتوكول تنظيف غطاء في الملاحظة التكميلية 1. - إلى كل بئر، أضف 2 مل من وسط زراعة الخلية الكامل الذي يحتوي على فينول أحمر (مكمل بمصل بقري جنيني 10٪ (FBS)، و100 ميكروغرام/مل بنسلين و100 ميكروغرام/مل ستربتوميسين) والحفاظ على اللوحة جانبا.
- ثقافة خلايا CHO في نفس الوسط التي تحتوي على الفينول الأحمر في 37 درجة مئوية و 5٪ CO2. غسل الخلايا مع 5 مل من برنامج تلفزيوني لإزالة الخلايا الميتة.
- أضف 2 مل من التريبسين واحتضن لمدة دقيقتين في درجة حرارة الغرفة (RT).
- تمييع الخلايا المنفصلة مع 8 مل من المتوسطة التي تحتوي على الفينول الأحمر وتخلط بعناية عن طريق pipetting.
- عد الخلايا في غرفة نيوباور والبذور في كثافة 1.5 × 105 خلايا / جيدا في لوحة ثقافة الخلية 6 جيدا التي تحتوي على coverlips (أعدت في الخطوة 1.1.1-1.1.2).
- دع الخلايا تنمو في حاضنة (37 درجة مئوية، 5٪ CO2)لمدة 24 ساعة من أجل تحقيق التقاء 80٪ تقريبا.
- تمييع 2 ميكروغرام من الحمض النووي المتجهي المطلوب (على سبيل المثال، CT-SNAP أو NT-SNAP) و 6 ميكرولتر من كاشف العدوى في أنبوبين منفصلين، يحتوي كل منهما على 500 ميكرولتر من المتوسط المنخفض المصل لكل بئر واحتضان لمدة 5 دقائق في RT.
- امزج الحلين معا للحصول على خليط العدوى واحتضانه لمدة 20 دقيقة في RT.
- في غضون ذلك، غسل خلايا CHO المصنف مرة واحدة مع برنامج تلفزيوني عقيم.
- استبدال برنامج تلفزيوني مع 1 مل / بئر من فينول الأحمر خالية المتوسطة تكملها مع 10٪ FBS دون أي مضادات حيوية.
- إضافة كامل 1 مل من خليط العدوى دروبيا إلى كل بئر واحتضان الخلايا بين عشية وضحاها في 37 درجة مئوية، في 5٪ CO2.
- لوضع العلامات على بناء SNAP، تمييع حل الأسهم الركيزة SNAP المناسبة في 1 مل من المتوسط تكملها مع 10٪ FBS للحصول على تركيز نهائي من 1 ميكرومتر.
- غسل الخلايا المصابة مرة واحدة مع برنامج تلفزيوني وإضافة 1 مل لكل بئر من محلول ركيزة SNAP 1 ميكرومتر. احتضان الخلايا لمدة 20 دقيقة في 37 درجة مئوية في 5٪ CO2.
- غسل الخلايا ثلاث مرات مع فينول الأحمر خالية المتوسطة وإضافة 2 مل لكل فينول جيدا المتوسطة الحمراء خالية. احتضان الخلايا لمدة 30 دقيقة في 37 درجة مئوية في 5٪ CO2.
- نقل الأغطية لجميع العينات في وقت لاحق في غرفة التصوير ويغسل مع 500 ميكرولتر التصوير العازلة. أضف المخزن المؤقت للتصوير 500 ميكرولتر قبل الانتقال إلى إعداد FRET-FCS.
- ضع غطاء تنظيفه في بئر في لوحة ثقافة 6-well واغسل ثلاث مرات بالمحلول الملحي المعقم العازل بالفوسفات (PBS).
- قياسات المعايرة
ملاحظة: تم تجهيز إعداد FRET-FCS بهدف مياه المجهر البؤري، واثنين من خطوط الليزر، ونظام عد الفوتونات المفرد المرتبط بالوقت (TCSPC)، وأنابيب فوتوموليير هجينة (PMT) واثنين من الثنائيات الضوئية الانهيار الجليدي (APD) لجمع الفوتون وبرامج جمع البيانات. من المهم جدا محاذاة الإعداد في كل مرة قبل قياسات الخلايا الحية. يمكن العثور على وصف الإعداد المفصل في الملاحظة التكميلية 2. كل من الليزر وجميع أجهزة الكشف (اثنين PMTs واثنين من APDs) هي دائما على خلال القياسات، وجميع القياسات تحتاج إلى أن تجرى في ظل ظروف متطابقة. لقياسات المعايرة، استخدم غطاء من نفس القطعة التي تم زرع الخلايا عليها، وهذا يقلل من الاختلاف في تصحيح حلقة ذوي الياقات البيضاء.- لضبط التركيز، ثقب وطوق موقف حلقة، ضع 2 nM حل المعايرة الخضراء على غطاء الزجاج والتبديل على الليزر 485 نانومتر و 560 نانومتر. تشغيل الليزر في نبضي الإثارة Interleaved (PIE) واسطة16.
- التركيز على الحل وضبط الثقب وطوق موقف حلقة بحيث يتم الحصول على أعلى معدل العد وأصغر حجم confocal للحصول على أقصى قدر من السطوع الجزيئي.
- كرر هذه العملية للقنوات الحمراء مع 10 nM حل المعايرة الحمراء وخليط من كل من, حل المعايرة الأخضر والأحمر.
- ضع محلول الحمض النووي 10 nM على غطاء زجاجي وضبط موضع حلقة التركيز والثقب والطوق بحيث يكون الارتباط المتبادل بين قنوات الكشف الخضراء والحمراء أعلى ، أي يظهر أعلى السعة.
ملاحظة: قد يلزم تكرار الخطوتين 1.2.1 و1.2.4 ذهابا وإيابا للعثور على المحاذاة المثلى. خذ 3-5 قياسات من كل حل معايرة لمدة 30 - 120 s بعد التركيز ، تم محاذاة الثقب ، ووضع حلقة الياقات البيضاء بشكل مثالي لقنوات الكشف الخضراء والحمراء وحجم التداخل البؤري. - قياس قطرة من DDH2O، وسيلة التصوير، وخلية غير مصابة 3-5 مرات لكل من 30 ق - 120 ق لتحديد معدلات العد الخلفية.
- جمع وظيفة استجابة الصك مع 3-5 قياسات لمدة 30 ق -- 120 ق. هذا اختياري ولكن موصى به للغاية.
- قياسات الخلايا الحية
- العثور على خلية مناسبة من خلال إلقاء الضوء مع مصباح الزئبق ومراقبة من خلال العين.
ملاحظة: الخلايا المناسبة على قيد الحياة تظهر مورفولوجيا نموذجية من خط الخلية الملتصقة المعنية. مضان البروتين من الفائدة، وهنا مستقبلات السطح، مرئية في جميع أنحاء السطح. الخلايا الأقل سطوعا هي أكثر ملاءمة من تلك الأكثر إشراقا بسبب التباين الأفضل في FCS عندما يكون عدد قليل من الجزيئات في التركيز. - قم بتشغيل كل من الليزر في وضع PIE وركز على الغشاء من خلال النظر إلى الحد الأقصى للأعداد في الثانية.
ملاحظة: قد تحتاج طاقة الليزر إلى تقليلها لعينات الخلية (أقل من 5 ميكروواط عند الهدف). وهذا يعتمد على الفلوروفوريس المستخدمة والإعداد. - مراقبة السيارات وعبر الارتباط منحنيات eGFP أو المسمى SNAP-العلامة المرفقة β2AR في المعاينة عبر الإنترنت من برنامج جمع البيانات وجمع العديد من القياسات القصيرة (~ 2 -10) مع وقت الاستحواذ بين 60-180 ثانية.
ملاحظة: لا تثير الخلايا لفترة طويلة باستمرار كما قد الفلوروفوريس التبييض. ومع ذلك، فإنه سيعتمد على سطوع كل خلية، وكم من الوقت يمكن أن تكون القياسات، وعدد القياسات في المجموع يمكن القيام بها.
- العثور على خلية مناسبة من خلال إلقاء الضوء مع مصباح الزئبق ومراقبة من خلال العين.
2. تحليل البيانات
- تصدير البيانات
- تصدير منحنيات الارتباط، G (tc)، ومعدلات العد، CR، من جميع القياسات.
- الحرص على تعريف الإطارات الزمنية "موجه" و "تأخير" بشكل صحيح واستخدام الخيار "gating microtime" في برنامج ارتباط البيانات.
ملاحظة: في المجموع، هناك حاجة إلى ثلاثة ارتباطات مختلفة: (1) التصحيح التلقائي للقناة الخضراء في الإطار الزمني الفوري(ACFgp)،(2) التصحيح التلقائي للقنوات الحمراء في نافذة وقت التأخير (ACFRD)،وأخيرا (3) الارتباط المتبادل لإشارة القناة الخضراء في نافذة وقت المطالبة مع إشارة القناة الحمراء في نافذة وقت التأخير(CCFPIE). يتم عرض تصدير البيانات خطوة بخطوة لبرامج مختلفة في الملاحظة التكميلية 3.
- قياسات المعايرة
- استخدام وظائف التصحيح الذاتي للالأخضر(ACF gp)والأحمر (ACFrd) حلول الفلوروفور، وتناسبها مع نموذج نشر ثلاثي الأبعاد مع مصطلح ثلاثي إضافي إذا لزم الأمر (eq. 1) لمعايرة شكل وحجم حجم الكشف البؤري للقنوات اللونية المستخدمة:
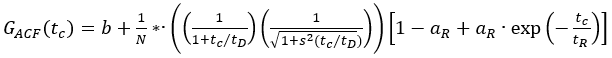 مكافئ.
مكافئ.
هنا، ب هو خط الأساس للمنحنى، N عدد الجزيئات في التركيز، رD وقت الانتشار (في MS)، و s = z0/w0 عامل الشكل من عنصر حجم confocal. يوصف ثلاثي وامض أو photophysics أخرى من خلال اتساعها R ووقت الاسترخاء ر.
ملاحظة: يتم سرد كافة المتغيرات والرموز المستخدمة ضمن البروتوكول في الجدول 1. - استخدم معاملات الانتشار المعروفة D لمعيار المعايرة الأخضر26 والأحمر27 وعوامل الشكل التي تم الحصول عليها باللونين الأخضر والأحمر لتحديد الأبعاد (العرض ث0 والارتفاع z0)والحجم Veff من عنصر الحجم البؤري (مكافئ. 2a-c).
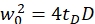 eq. 2a
eq. 2a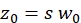 مكافئ. 2b
مكافئ. 2b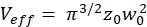 مكافئ. 2c
مكافئ. 2c
ملاحظة: يتم توفير قوالب لحساب معلمة المعايرة كملفات تكميلية (S7). - احسب α الإشارة الفلورية الخضراء (التي تم جمعها في القناتين 0 و2) في قنوات الكشف الحمراء (القناة رقم 1 و3) كنسبة من إشارات (BG) المصححة للخلفية (eq. 3).
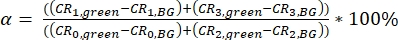
eq. 3 - تحديد الإثارة المباشرة للمقبل الفلوروفوري δ من قبل الطول الموجي الإثارة المانحة بنسبة معدل العد تصحيح الخلفية من قياسات المعايرة الحمراء في النافذة الزمنية "موجه" (الإثارة بواسطة الليزر الأخضر) إلى معدل العد تصحيح الخلفية في نافذة الوقت "تأخير" (الإثارة بواسطة الليزر الأحمر) (eq. 4).
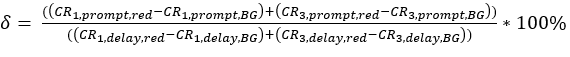
eq. 4 - حساب السطوع الجزيئي B من كل من الفلوروفور الأخضر والأحمر (eq. 5a-b) استنادا إلى معدلات العد تصحيح الخلفية وعدد الجزيئات التي تم الحصول عليها في التركيز، N، من نوبة الانتشار 3D (eq. 1):
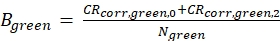 eq. 5a
eq. 5a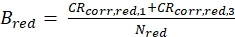 eq. 5b
eq. 5b - تناسب كل من سباق الجائزة الكبرى ACF و ACFrd وكذلك CCFPIE من الحمض النووي مزدوجة المسمى لنموذج نشر 3D (eq. 1). الحفاظ على عوامل الشكل التي تم الحصول عليها، قالأخضر والأحمرs،ثابت لسباق الجائزةالكبرى ACF و ACFrd،على التوالي. عامل الشكل ل CCFPIE, sPIE, عادة ما يكون بين هاتين القيمتين.
ملاحظة: في الإعداد المثالي، كل من Veffوالأخضر والخامس eff، الأحمر سيكون لها نفس الحجم والتداخل تماما. - تحديد السعة في وقت الارتباط صفر، G0(رج)، استنادا إلى القيم الموجودة من عدد واضح من الجزيئات في التركيز (Nالأخضر، Nالأحمر و NPIE).
- حساب نسبة السعة rGR و rRG لعينة مع 100٪ نشر مشترك من الفلوروهور الأخضر والأحمر (مكافئ. 6). كن على علم بأن NPIE لا يعكس عدد الجزيئات ذات العلامات المزدوجة في التركيز ولكنه يعكس فقط 1 /G0(tc).
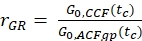 و
و 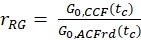 eq. 6
eq. 6
- استخدام وظائف التصحيح الذاتي للالأخضر(ACF gp)والأحمر (ACFrd) حلول الفلوروفور، وتناسبها مع نموذج نشر ثلاثي الأبعاد مع مصطلح ثلاثي إضافي إذا لزم الأمر (eq. 1) لمعايرة شكل وحجم حجم الكشف البؤري للقنوات اللونية المستخدمة:
- تجارب الخلايا الحية
- لبنى ذات تسمية مفردة، قم باحتواء عينات الخلية إلى نموذج مناسب. بالنسبة لمستقبلات الغشاء المعروضة ، يحدث الانتشار بطريقة ثنائية الشكل مع وقت نشر قصير وطويل. بالإضافة إلى ذلك ، يجب النظر في الفيزياء الضوئية ووميض الفلوروفوريس:
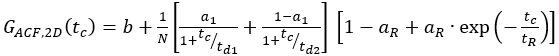 7
7
هنا، td1 و td2 هما وقتان مطلوبان للنشر، و 1 هو جزء من وقت الانتشار الأول.
ملاحظة: على النقيض من قياسات المعايرة ، حيث تنتشر الأصباغ الحرة وخيوط الحمض النووي بحرية في جميع الاتجاهات ، تظهر مستقبلات الغشاء انتشارا ثنائي الأبعاد فقط على طول أغشية الخلايا. وينعكس هذا الفرق بين الانتشار ثلاثي الأبعاد و2D من خلال مصطلح الانتشار المعدل (مقارنة eq. 1) ، حيث لا يعتمد t D في الحالة 2D على عامل الشكل s لعنصر الحجم البؤري. - حساب تركيز ج من البروتينات الخضراء أو الحمراء المسمى من N و Veff المعنية باستخدام الرياضيات الأساسية (eq. 8):
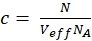 8
8
حيث NA = رقم أفوغادرو - بالنسبة لتسمية N-terminal SNAP وeGFP داخل الخلايا، قم باحتواء التصوقينين التلقائيين(ACFgp وACFrd)للعينة ذات التسمية المزدوجة باستخدام نفس الطراز كما هو الحال بالنسبة للبنى ذات العلامات المفردة ل ACFs (eq. 7) وCCF PIE باستخدام نموذج نشر ثنائي الوسائط (eq. 9):
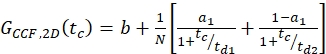 eq. 9
eq. 9
ملاحظة: للحصول على وصف عالمي للنظام، يجب أن تكون المنحنيات الثلاثة مناسبة بشكل مشترك: مصطلح الانتشار مطابق لجميع المنحنيات الثلاثة والفرق الوحيد هو مصطلح الاسترخاء ل CCFPIE. كما photophysics اثنين من الفلوروفوريس عادة لا علاقة لها ، لا يلزم مصطلح الارتباط. يؤدي هذا الغياب لشروط الاسترخاء إلى فطيرة CCF مسطحة في أوقات ارتباط قصيرة. ومع ذلك ، قد تظهر المحادثات المتقاطعة والإثارة المباشرة للمقبول بسبب الفلوروفور المانح سعة إيجابية زائفة ويجب فحصها بعناية لاستخدام قياسات المعايرة. - حساب تركيز ج من البروتينات الخضراء أو الحمراء المسمى من N و Veff المعنية باستخدام المعادلة 8.
- تقدير الكسر أو التركيز، جGR أو cRG،من البروتينات الخضراء والحمراء المسمية التفاعل من عينات الخلية باستخدام عوامل التصحيح التي تم الحصول عليها من عينات الحمض النووي، ونسب السعة صGR و RRG من عينة الخلية وتركيزات كل منها التي تم الحصول عليها (eq. 10).
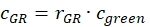 و
و 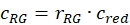 eq. 10
eq. 10 - بالنسبة لتسمية SNAP C-terminal وeGFP داخل الخلايا، قم بملاءمة الارتباطين التلقائيين(ACFgp وACFrd)لعينة FRET كعينات ذات تسمية واحدة (المعادلة 7) وCCFFRET إلى نموذج نشر ثنائي الوسائط يحتوي على مصطلح مضاد للارتباط (المعادلة 11)
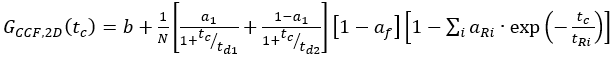 eq. 11
eq. 11
حيث تعكسf سعة إجمالي مكافحة الارتباط و R و tR السعة المعنية ووقت الاسترخاء.
ملاحظة: في حالة حدوث تغيرات مضانة مضادة للارتباط بسبب FRET، قد تكون هناك حاجة إلى مصطلح أو عدة شروط مضادة للارتباط (eq. 11)، مما يؤدي إلى "تراجع" CCFFRET في أوقات الارتباط المنخفضة التي تتزامن مع ارتفاع في العلاقات الذاتية(ACFgp و ACFRD). ومع ذلك ، كن على علم بأن فيزياء الصور مثل الوميض الثلاثي قد تخفي مصطلح مكافحة الارتباط عن طريق تخفيف الارتباط المضاد الناجم عن FRET. تحليل مشترك تكملها مع أساليب FCS تصفيتها قد تساعد على كشف مصطلح المضادة للارتباط. بالإضافة إلى ذلك، ينبغي استبعاد القطع الأثرية التقنية الناجمة عن أوقات ميتة في عد الالكترونيات في نطاق نانو ثانية16. يتم توفير إجراء أكثر تفصيلا خطوة بخطوة حول كيفية إجراء التحليل في ChiSurf28 وقوالب لحساب حجم الكونفوجال أو السطوع الجزيئي على مستودع Github (https://github.com/HeinzeLab/JOVE-FCS) وكملفات تكميلية(الملاحظة التكميلية 4 والملاحظة التكميلية 6). بالإضافة إلى ذلك، يمكن العثور على البرامج النصية بيثون لتصدير دفعة من البيانات المكتسبة مع برنامج سيمفوتيم في شكل .ptu هناك.
- لبنى ذات تسمية مفردة، قم باحتواء عينات الخلية إلى نموذج مناسب. بالنسبة لمستقبلات الغشاء المعروضة ، يحدث الانتشار بطريقة ثنائية الشكل مع وقت نشر قصير وطويل. بالإضافة إلى ذلك ، يجب النظر في الفيزياء الضوئية ووميض الفلوروفوريس:
النتائج
وفيما يلي مناقشة النتائج المثالية للمعايرة وقياسات الخلايا الحية. بالإضافة إلى ذلك ، يتم إظهار تأثير FRET على منحنيات الارتباط المتبادل استنادا إلى بيانات محاكاة بجانب تأثير تفاعل البروتين والبروتين الذي يزيد من سعة CCFPIE.
تصدير بيانات FCS المستندة إلى PIE
في تجارب PIE، يتم تجميع البيانات في وضع الوقت-العلامة-حل (TTTR)29،30. يظهر الشكل 1B الرسم البياني لوقت وصول الفوتون لقياس PIE لخيط الحمض النووي المزدوج المسمى على الإعداد الموصوف(الملاحظة التكميلية 1). يحتوي الإعداد على أربع قنوات كشف. يتم تقسيم انبعاث الفلورسينس أولا عن طريق الاستقطاب في اتجاهي "S" و "P" (في إشارة إلى المستوى المتعامد والمتوازي الذي يتذبذب فيه المجال الكهربائي لموجة ضوئية). ثانيا، يتم تقسيم كل اتجاه استقطاب بعد ذلك في قناتين ملونتين (الأخضر والأحمر) قبل الكشف، مما يؤدي إلى أربع قنوات (S-green، S-red، P-green، P-red). في النافذة الزمنية "الفورية" ، يتحمس الفلوروفور الأخضر ، ويتم اكتشاف الإشارة في كل من القناتين الخضراء والحمراء بسبب FRET. في فترة التأخير، لا يظهر سوى الفلوروفور الأحمر (في القناة الحمراء). استنادا إلى قنوات الكشف و "موجه" مقابل "تأخر" النوافذ الزمنية، يمكن الحصول على ما لا يقل عن خمسة منحنيات ارتباط مختلفة (3 منحنيات التصحيح التلقائي (ACFs) و 2 منحنيات عبر الارتباط (CCFs)) (الشكل 1C-D):(1) إشارة خضراء في الإطار الزمني الفوري (ACFgp)، (2) إشارة حمراء في نافذة زمنية سريعة (في حالة FRET، ACFrp)، و (3) إشارة حمراء في نافذة وقت التأخير(ACFrd). تقرير ACFs هذا عن حركة البروتين، والفيزياء الضوئية (على سبيل المثال، الوميض الثلاثي) وغيرها من التغيرات في السطوع المرتبطة بالوقت في الفلوروفوريس (على سبيل المثال، بسبب FRET). (4) و PIE القائم على تبادل الارتباط CCFPIE من الإشارة الخضراء في إطار الوقت الفوري مع إشارة حمراء في نافذة وقت التأخير يسمح تحديد جزء من الانتشار المشترك للفلوروفور الأخضر والأحمر16. (5) FRET المستندة عبر الارتباط CCFFRET من الأخضر مع إشارة حمراء في نافذة الوقت الفوري يرتبط FRET الناجمة، والتغيرات المضادة للارتباط سطوع في إشارات الأخضر والأحمر31،32،33.
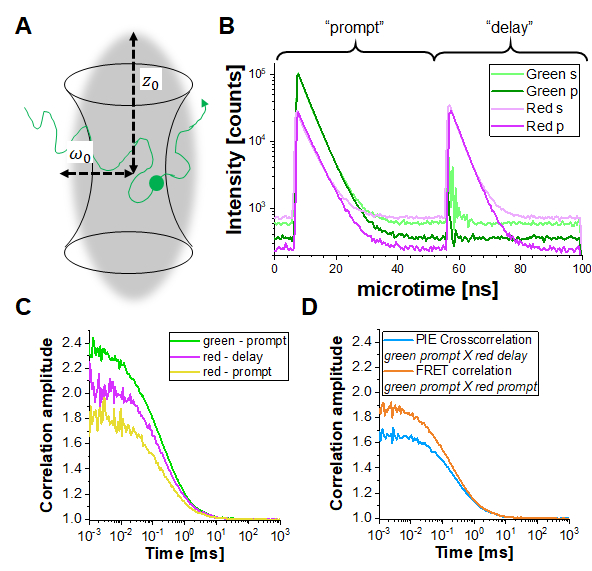
الشكل 1:الإثارة النبضية المتشابكة (PIE) القائمة على الفلورسينس (عبر) التحليل الطيفي للارتباط (F(C)CS). (A)في الجزيئات المسماة بفلورسنت FCS تنتشر بحرية داخل وخارج حجم بؤري (محدود الحيود) على شكل شعاع ليزر مركز يحفز الفلورسينس داخل هذا الحجم الصغير. ترتبط تقلبات الكثافة الناتجة للجزيئات التي تدخل الحجم وتتركه وتوفر معلومات عن حركة الجزيئات. (ب)في PIE، يتم استخدام خطين ليزر مختلفين ("موجه" و "تأخير") لإثارة العينة المسماة بفلوروفوريسين مختلفين ("أخضر" و"أحمر"). يتم تكييف الفرق الزمني بين كل من نبضات الإثارة لعمر الفلورية من الفلوروفوريس المعنية بحيث يكون أحدهما قد اضمحلال قبل الآخر متحمس. في العينة ذات العلامات المزدوجة الموضحة ، يكون كلا الفلوروفور قريبين بما يكفي للخضوع لنقل الطاقة الرنينية Förster (FRET) من الفلوروفور المانح "الأخضر" إلى مضان المقبول "الأحمر". وهكذا، يمكن الكشف عن انبعاث الفلورسينس الأحمر في النافذة الزمنية "الفورية" عند إثارة المتبرع الأخضر. في الإعداد المستخدم(الملاحظة التكميلية 2)،يتم استخدام كاشفين لكل لون، أحدهما موجه بالتوازي مع اتجاه شعاع الإثارة (المشار إليه ب "p") والثاني عمودي (يشار إليه ب "s"). (ج) يمكن تحديد ثلاث وظائف مختلفة للارتباط التلقائي في تجربة PIE: ارتباط i) إشارات القناة الخضراء في النافذة الزمنيةالفورية (ACFgp)،ii) إشارات القناة الحمراء في النافذة الزمنية الفورية(ACFrp)و3) إشارات القناة الحمراء في نافذة وقت التأخير(ACFrd). (د) يمكن تحديد وظيفتين مختلفتين للارتباط المتبادل: رابعا) الارتباط المتبادل "PIE"(CCFPIE)مع إشارات القناة الخضراء في النافذة الزمنية الفورية المرتبطة بإشارات القناة الحمراء في نافذة التأخير، حيث ترتبط سعة هذا المنحنى بالانتشار المشترك للفلوروفوريس؛ و v) "FRET" عبر الارتباط(CCFFRET)مع إشارات القناة الخضراء في نافذة الوقت الفوري المرتبطة إشارات القناة الحمراء في نفس النافذة الفورية؛ هنا يرتبط شكل هذا المنحنى في بعض الأحيان أسرع من الانتشار إلى التغيرات كثافة FRET الناجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
المعايره
ويبين الشكل 2 ألف- باء قياس معايرة للفلوروفور الأخضر والأحمر المنتشر بشكل مخنوق، على التوالي. استنادا إلى تناسب مع eq. 1 ومعامل الانتشار المعروف Dالأخضر26 وD الأحمر27 الشكل ( ض0 و ث 0) وحجم ( Veff) من حجم الكشف تحسب باستخدام مكافئ. 2a-c. نتائج تناسب من سباق الجائزة الكبرى ACF من الفلوروفور الأخضر و ACFrd من الفلوروفور الأحمر هي ملخصة في الشكل 2C. يظهر كل من الفلوروفوريس ثابت وقت استرخاء إضافي قدره 8.6 ميكروس (18٪) و 36 ميكروس (15٪) على التوالي. وتبلغ السطوع الجزيئي (مكافئ 5a-b) للفلوروفور الأخضر والأحمر 12.5 كيلوهرتز لكل جزيء و2.7 كيلوهرتز لكل جزيء على التوالي.
للحصول على تقدير موثوق لحجم وشكل حجم الكونفوجكال وكذلك السطوع الجزيئي ، يوصى بإجراء 3-5 قياسات لكل تجربة معايرة وتناسب مشترك (أو عالمي) لجميع التكرارات.
α المحادثات المتقاطعة(الشكل 2D، eq. 3) والإثارة المباشرة للمقبل من قبل δ الليزر الأخضر(الشكل 2E، eq. 4) لهذا الزوج الفلوروفوري تكمن في ~ 15 ٪ و ~ 38 ٪ ، على التوالي.
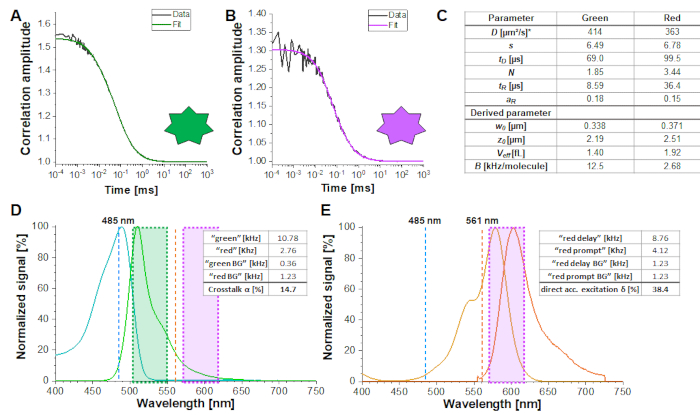
الشكل 2: قياسات المعايرة من بحرية نشر الأخضر والأحمر معيار المعايرة. (A-B) ممثل 60 ق قياس 2 نانومتر الأخضر(A)و 10 نانومتر الأحمر(ب)قياس معيار المعايرة تركيبها على نموذج نشر 3D بما في ذلك وقت إضافي للاسترخاء (eq. 1). الجدول في لوحة (C) يظهر نتائج تناسب والمعلمة المشتقة على أساس eq. 2a-c وeq. 5a-b. * تم أخذ معاملات الانتشار من الأدب26،27. (د)تحديد α الإشارة الخضراء في القنوات الحمراء (eq. 3). يظهر طيف الإثارة للمعيار الأخضر في سماوي، طيف الانبعاثات باللون الأخضر. خطوط الليزر الإثارة في 485 نانومتر (الأزرق) و 561 نانومتر (البرتقالي) وتظهر خطوط متقطعة. تظهر مربعات الشفافية الخضراء والأرجواني نطاق الانبعاثاتالمجمعة (الملاحظة التكميلية 2). (ه)تحديد الإثارة المباشرة δ الفلوروفور الأحمر بواسطة الليزر 485 نانومتر (eq. 4). رمز اللون مطابق ل (D) ، الضوء والبرتقال الداكن تظهر الإثارة والانبعاثات الطيف من المعيار الأحمر ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتحديد ومعايرة التداخل بين حجم الإثارة الخضراء والحمراء ، يتم استخدام حبلا مزدوج الحمض النووي المسمى(الشكل 3A)كما هو موضح أعلاه. هنا، متباعدة الفلوروفوريس 40 نقطة أساس وبصرف النظر بحيث لا يمكن أن يحدث أي FRET بين الفلوروفوريس الأخضر والأحمر تعلق على نهايات خيوط الحمض النووي المزدوج. الشكل 3B يظهر autocorrelations من كل من الفلوروفوريس باللون الأخضر(ACF gp)والأرجواني(ACFrd)وارتباط PIE-cross، CCFPIE، في سماوي. يرجى ملاحظة أن لCCFPIE، ترتبط الإشارة في القنوات الخضراء في نافذة وقت المطالبة مع الإشارة في القنوات الحمراء في نافذة وقت التأخير16.
هنا، يتم الحصول على معامل انتشار متوسط لخيط الحمض النووي للحمض النووي D = 77 ميكرومتر مربع / ثانية. يمكن العثور على مزيد من التفاصيل حول الحساب في بروتوكول خطوة بخطوة، الملاحظة التكميلية 4. يتم الحصول على هذه القيمة عن طريق إدراج حجم أحجام الكشف الخضراء والحمراء معايرة (الشكل 2) وأوقات الانتشار ذات الصلة من سباق الجائزةالكبرى ACF وACFrd من حبلا الحمض النووي(الشكل 3C) في المعادلة 2a. بعد ذلك ، باستخدام قيم التصحيح التي تم الحصول عليها rGR و rRG واستخدام EQ. 6 لاحقا ، يمكن تحديد كمية الانتشار المشترك ، أي الجزيئات ذات العلامات المزدوجة (أو مجمعات البروتين في حالة المشاركة في العدوى لاثنين من البروتينات المختلفة) من عينات الخلية.
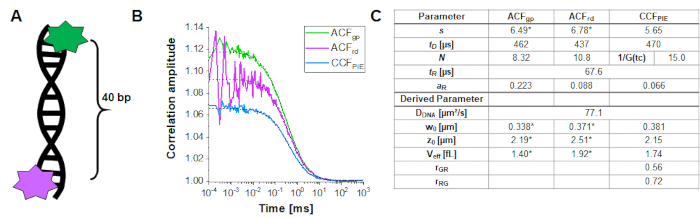
الشكل 3:معايرة حجم التداخل الأخضر والأحمر باستخدام عينة من الحمض النووي. (أ) حبلا الحمض النووي المستخدمة للمعايرة يحمل فلوروفور معايرة خضراء وحمراء، مع مسافة 40 نقطة أساس بينهما. يجب أن تكون مسافة التباعد كبيرة بما يكفي لاستبعاد FRET بين الفلوروفوريس. (ب) قياس الممثل 60 ق من محلول الحمض النووي 10 ن م. autocorrelations من كل من الفلوروفوريس باللون الأخضر(ACF gp، المعيار الأخضر) والأرجواني(ACFrd، المعيار الأحمر) و PIE-crosscorrelation ، CCFPIE، باللون الأزرق. الجدول في لوحة (C) يظهر نتائج تناسب استنادا إلى نموذج نشر 3D بما في ذلك مصطلح استرخاء إضافية (eq. 1) ومعامل نشر المعلمة المشتقة من الحمض النووي، DDNA (EQ. 2a)، وحجم وشكل حجم التداخل (eq. 2a-c) ونسب التصحيح rGR و rRG (eq. 6. ). يرجى ملاحظة أن قيم حجم الكشف الأخضر والأحمر (المسمى ب *) مأخوذة من نوبة الفلوروفوريس الفردية الموضحة في الشكل 2. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تجارب الخلايا الحية
في المقطع التالي، يتم عرض تحليل تجارب الخلايا الحية لمختلف β2AR. كما β2AR هو بروتين غشاء، ويقتصر انتشاره إلى حد كبير إلى انتشار ثنائي الأبعاد(الشكل 4A)على طول غشاء الخلية (باستثناء عمليات النقل أو إعادة التدوير من أو إلى الغشاء) 2. مع تقييد لنشر 2D عامل الشكل ق = ض0/ث0 في eq. 1 يصبح عفا عليها الزمن مما أدى إلى نموذج نشر مبسطة (eq. 9).
البنى ذات العلامات المفردة: β2AR-IL3-eGFP و NT-SNAP-β2AR
يوضح الشكل 4 قياسات مثالية لبناء التسمية المفردة β2AR-IL3-eGFP(الشكل 4B)،حيث يتم إدراج eGFP في الحلقة 3 داخل الخلية، وبناء NT-SNAP-β2AR (الشكل 4C)،حيث يتم اقتران علامة SNAP بالنهاية N من β2AR. وسمت علامة SNAP مع ركيزة سطح SNAP غير منفذة للأغشية. وتبين المنحنيات التمثيلية متوسط القياسات المتكررة 4-6 مع أوقات اقتناء من 120-200 ق لكل منهما. يتم تركيب العلاقات الذاتية لكل من سباق الجائزة الكبرى ACF وACFrd من eGFP وSNAP إشارة لنموذج نشر ثنائية الأبعاد ثنائية الأبعاد (eq. 9). من حيث الديناميات السريعة ، eGFP يظهر فقط الثلاثي المتوقع وامض في ر1 ~ 9 ميكروس في حين أن إشارة SNAP يتطلب مرتين الاسترخاء ، واحدة في وقت الوميض الثلاثي نموذجي من ر1 ~ 5 ميكروثانية والثانية في ر2 ~ 180 ميكروس.
السطوع الجزيئي للفلوروفوريس في الخلايا الحية هو 0.8 كيلوهرتز (eGFP) و 1.7 كيلوهرتز (SNAP) لكل جزيء في ظل ظروف الإثارة المعطى (مكافئات. 5a-b). تركيز المسمى β2AR يبني أدرجت في غشاء الخلية ينبغي أن يكون في نطاق نانو الضرس ويمكن تحديدها من خلال متوسط عدد الجزيئات (eq. 9، الشكل 4C)وحجم حجم كونفوكال كل من القناة الخضراء والحمراء (الشكل 2) باستخدام EQ. 8.
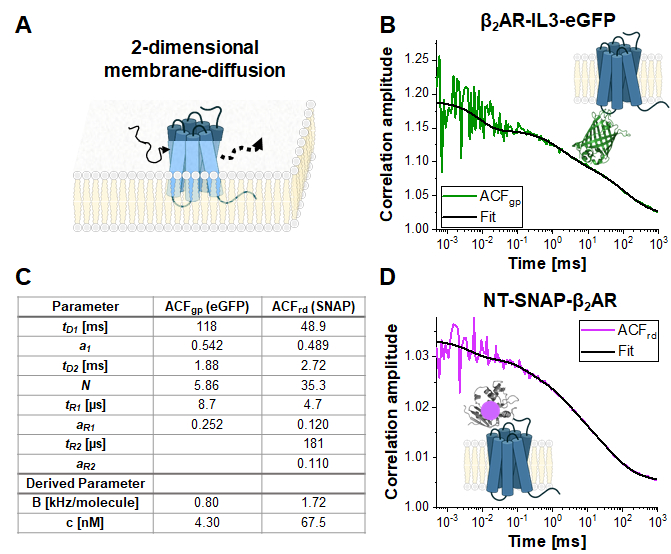
الشكل 4:القياس التمثيلي لبنى التسمية المفردة. (A) في هذه الدراسة ، تم استخدام مستقبلات الغشاء β2AR كمثال. على النقيض من الفلوروفوريس وخيط الحمض النووي المستخدمة للمعايرة ، والتي يمكن أن تطفو بحرية من خلال حجم الكشف ، تنتشر بروتينات الغشاء بشكل رئيسي أفقيا على طول الغشاء ، الذي يوصف بأنه انتشار ثنائي الأبعاد. (ب, د) ACFسباق الجائزة الكبرى و ACFrd من تسميات واحدة يبني β2AR-IL3-eGFP(ب)وNT-SNAP-β2AR (D). يظهر متوسط 4-6 قياسات يتم جمعها لكل منها لمدة 120-200 s. الجدول في لوحة (C) يظهر نتائج تناسب البيانات لنموذج ثنائي الأبعاد نشر ثنائي الأبعاد بما في ذلك شروط إضافية للاسترخاء (eq. 7). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بناء مزدوج التسمية: NT-SNAP-β2AR-IL3-eGFP
في بناء مزدوج المسمى NT-SNAP-β2AR-IL3-eGFP (قصيرة NT-SNAP)، يتم إدراج eGFP في حلقة داخل الخلية 3، و، علامة SNAP مترافقة مع ن-terminus من β2AR (الشكل 5A). في هذا التكوين، وeGFP هو على الجانب الداخلي من الغشاء وSNAP على الجانب الخارجي مع مسافات كبيرة جدا ل FRET. في الحالة المثالية ، فإن هذا البناء يظهر 100 ٪ من الانتشار المشترك للفلوروفور الأخضر والأحمر ، وليس إشارة FRET. الشكل 5B-D يظهر قياسين من NT-SNAP في زينتين في يومين قياس مختلفة. تركيب سباقالجائزة الكبرى ACF وASCFrd من قياس "أفضل" هو مبين في الشكل 5B مع EQ. 7 وCCF PIE مع EQ. 9، ويكشف 50-60 جزيئات في التركيز لسباق الجائزة الكبرى ACF وASCFrd،في حين أنالتطبيقN، وبالتالي 1/G0(رج) ~ 114 لCCF PIE ( الشكل5C ). تركيز المستقبلات المسمى يكمن في نطاق ~ 100 nM كما هو محدد مع EQ. 8. لتحديد متوسط تركيز الجزيئات ذات العلامات المزدوجة ، أولا ، يتم حساب نسبة G0(tc) (ممثلة ب 1 /N(التطبيق)) من CCFPIE إلى ACF gp و ACFrd، على التوالي ، (eq. 6). بعد ذلك، تتم مقارنة هذه القيم R GRcell= 0.43 وr RGcell = 0.53 بالقيم التي تم الحصول عليها من قياس الحمض النووي(rGR، DNA= 0.51 و rRG، DNA = 0.79 في يوم القياس هذا). باستخدام قاعدة النسب، يعكس rGRcell= 0.43 من سباق الجائزةالكبرى ACF للإشارة eGFP إلى جزء صغير من الانتشار المشترك (rGRcell/rGR، DNA)من 0.84، حيث للحالة الأخرى من ACF rd من إشارة الركيزة SNAP، تبلغ هذه القيمة 0.67. ويمكن أخيرا حساب متوسط تركيز بناء NT-SNAP ذي التسمية المزدوجة استنادا إلى eq. 10. في المقابل، في القياس المبين في الشكل 5D من يوم مختلف، وتركيز المستقبلات منخفضة جدا والبيانات صاخبة جدا بحيث يقتصر نطاق تناسب تصل إلى ~ 10 ميكروس. وبالإضافة إلى ذلك، لوحظ وجود كمية منخفضة فقط من الانتشار المشترك (15-26 في المائة).
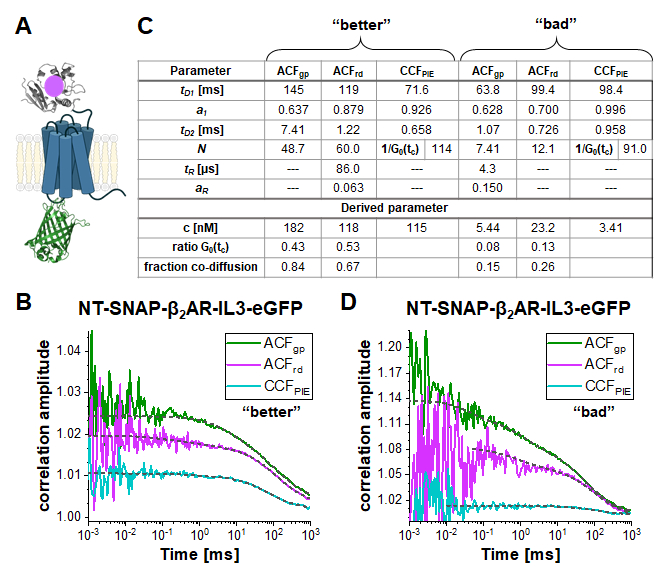
الشكل 5: مزدوج المسمى NT-SNAP-β2AR-IL3-eGFP بناء. (أ) في بناء المسمى المزدوج، يتم إدراج eGFP في حلقة داخل الخلية 3 والعلامة SNAP المرفقة إلى N-terminus من β2AR (NT-SNAP). (ب, د) ACFgp, ACFrd و CCFPIE لقياسين للبناء مزدوج التسمية. البيانات مناسبة لنموذج ثنائي الأبعاد انتشار ثنائي الأبعاد (eq. 9، CCFPIE) بما في ذلك شروط استرخاء إضافية (eq. 7، ACFgp و ACFRD). الجدول في لوحة (C) يظهر نتائج تناسب وتركيز المعلمة المشتقة (eq. 8), نسبة السعة الارتباط في وقت الارتباط صفر (G0(رج)) وجزء من جزيئات المشاركة في نشر (eq. 10). يرجى ملاحظة أن القياسات تم الحصول عليها في أيام مختلفة، وبالتالي تم استخدام عامل مختلف قليلا لتصحيح السعة (B: rGR، DNA = 0.51 و r RG، DNA = 0.79؛ D: صGR، الحمض النووي = 0.51 و R RG، الحمض النووي = 0.56). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بناء مزدوج التسمية يخضع ل FRET: β2AR-IL3-eGFP-CT-SNAP
في بناء مزدوج المسمى β2AR-IL3-eGFP-CT-SNAP (الشكل 6A)، يتم إدراج eGFP في حلقة داخل الخلية 3 متطابقة مع NT-SNAP-β2AR-IL3-eGFP بناء مع علامة SNAP تعلق على C-terminus. هنا، كلا التسميات هي على نفس الجانب من غشاء البلازما الخلايا، بحيث الفلوروفوريس في المنطقة المجاورة بحيث FRET يحدث كما هو مبين في العمر eGFP مروي(ملاحظة التكميلية 5). وبالنظر إلى مرونة مناطق البروتين غير المنظمة نسبيا مثل C-terminus34 واثنين على الأقل من تشكيلات البروتين المختلفة من GPCRs35، "HIGH FRET" (HF) أو "LOW FRET" (LF) ، يمكن ملاحظة التغيرات الديناميكية في كفاءة FRET بسبب تغييرات المسافة eGFP-SNAP وتحديدها من خلال مصطلح مضاد للترابط في CCFFRET (منحنى برتقالي في الشكل 6B ). وقد ثبت أن تقلبات FRET مضادة للكوريلد حيث أن المستقبلات يمكن أن تكون في حالة واحدة فقط في كل مرة ، إما HF أو LF. المشتركة (أو العالمية) تناسب جميع منحنيات الارتباط الخمسة (الشكل 6B) يكشف ~ 70٪ من جزيئات نشر ببطء في ~ 100 مللي ثانية في حين ينتشر الباقي مع ~ 1 مللي ثانية. جميع العلاقات الذاتية وCCFFRET تظهر شروط الاسترخاء في 37 ميكروجرام و 3 ميكروس. تلك الارتباطات التي تهيمن عليهاإشارة حمراء( ACF RP، ACFRD و CCFFRET) تظهر مكونا بطيئا إضافيا ~ 50 مللي ثانية (الشكل 6C).
وتظهر التغيرات الناجمة عن FRET على CCFFRET في ظل ظروف مختلفة(الشكل 6D)من خلال سلسلة من عمليات المحاكاة لنظام الدولتين مع وقت تقلب قدره 70 ميكرومتر بين ولايات LF وHF. عند التبديل من LF إلى حالة HF ، لوحظت تغييرات في الإشارة المضادة للكوريلد في النافذة الزمنية الفورية: تنخفض الإشارة الخضراء وتزداد الإشارة الحمراء (والعكس صحيح لتبديل HF -> LF). إذا كان التحول HF-LF يحدث على الجداول الزمنية أسرع من وقت الانتشار، وبعبارة أخرى خلال وقت الإقامة للجزيء في التركيز، يمكن أن تستمد معدل من anticorrelation في CCFFRET6،31،36. يرجى ملاحظة أنه لا يمكن ملاحظة العمليات الديناميكية أبطأ من وقت الانتشار في FCS.
في هذه المظاهرة، تم افتراض سيناريوهين مختلفين FRET، مما يدل على تغيير معتدل أو أقصى في كفاءة FRET بين الدولتين. تم إجراء المحاكاة باستخدام Burbulator37 والنظر في غياب أو وجود طرف ثلاثي وزيادة كمية من الكلام المتبادل المانحة في القنوات الحمراء. تم تصميم مصطلح الانتشار على أنه توزيع ثنائي الوسائط مع 30٪ من جزيئات الانتشار السريع في tD1 = 1 مللي ثانية وبقية الجزيئات تنتشر ببطء مع tD2 = 100 مللي ثانية. في المجموع، تمت محاكاة 107 فوتونات في حجم على شكل 3D Gaussian مع ث0 = 0.5 ميكرومتر وz0 = 1.5 ميكرومتر، حجم مربع من 20، وNFCS = 0.01.
الشكل 6E-F يظهر نتائج المحاكاة ل FRET الناجمة عن عبر الارتباط CCFFRET للمعتدلة (الشكل 6E) والتباين FRET القصوى ( الشكل6F) في غياب (خطوط صلبة) ووجود وامض الثلاثي (خطوط متقطعة). يمكن بسهولة رؤية المضادة للارتباط FRET الناجمة في الشكل 6F. تأثير "المثبطة" عند إضافة دولة ثلاثية إضافية يقلل من اتساع الارتباط (الشكل 6E-F)38،39.
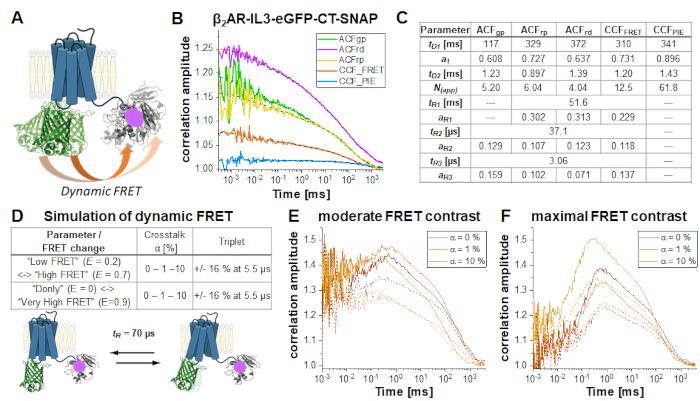
الشكل 6: محاكاة عينة مزدوجة التسمية تظهر FRET الديناميكية. (A)مزدوجة المسمى β2AR مع eGFP إدراجها في حلقة داخل الخلية 3 وعلامة SNAP C-المحطة الطرفية. كل من الفلوروفوريس قريبة بما يكفي للخضوع FRET وتظهر تغييرات في كفاءة FRET إذا كان المستقبل يخضع لديناميات البروتين. (ب) التصحيح التلقائي (ACFgp, ACFRP و ACFrd, يتناسب مع eq. 7) ومنحنيات الارتباط المتبادل (CCFFRET (eq. 7) و CCFPIE (eq. 9)) لقياس المثال. الجدول في لوحة (C) يظهر نتائج تناسب. (D-F) لإظهار تأثير المعلمة التجريبية على مصطلح مكافحة الترابط المتوقع الناجم عن FRET ، تم إجراء 12 محاكاة ، حيث تم تصميم التغيير في كفاءة FRET (صغيرة أو كبيرة) ، وكمية مختلفة من الحديث المتبادل بين المانحين في قنوات القبول (0٪ أو 1٪ أو 10٪) وعدم وجود طرف ثلاثي. ويفترض أن كسر التوازن في كل من دول FRET إلى 50:50 وأسعار الصرف المعدلة بحيث وقت الاسترخاء التي تم الحصول عليها ر = 70 ميكروس. مزيد من التفاصيل حول المحاكاة انظر في النص. (E) CCFFRET من نتائج المحاكاة مع تباين FRET معتدل وفي غياب الحديث المتبادل (البرتقالي الداكن) ، 1 ٪ عبر الحديث (البرتقالي) و 10 ٪ من الكلام المتبادل (البرتقالي الفاتح). خطوط صلبة تظهر النتائج في غياب خطوط ثلاثية متقطعة في وجود الثلاثي. (F) CCFFRET من نتائج المحاكاة مع أقصى تباين FRET. رمز اللون مطابق ل (E). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ومع ذلك ، في المحاكاة الأكثر تشابها مع الظروف التجريبية (α = 10 ٪ ، 15 ٪ ثلاثية وامضة ومعتدلة على النقيض FRET ، خط أصفر متقطع في الشكل 6E) ، فإن مصطلح مكافحة الترابط يتضاءل تقريبا. ويبين الشكل 7 نتيجة تحليل هذه البيانات المحاكاة باستخدام المعلومات المشفرة في المدرجات التكرارية لوقت وصول الفوتون (أي عمر الفلورسينس) عن طريق التحليل الطيفي للارتباط مدى الحياة الفلوري (FLCS)17أو19 أو FCS (fFCS)18. هنا، يتم استخدام العمر الفلوري لأنواع HF و LF المعروفة(الشكل 7A)لتوليد الأوزان أو "المرشحات"(الشكل 7B)التي يتم تطبيقها أثناء إجراء الارتباط. في الأنواع التي تم الحصول عليها لصناعة السيارات في وعبر الارتباط المنحنيات (الشكل 7C-D) يمكن ملاحظة مكافحة الترابط بوضوح.
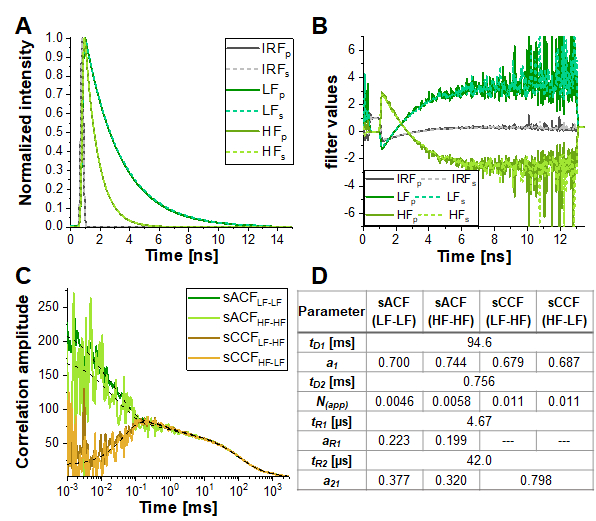
الشكل 7: يمكن أن تساعد FCS التي تمت تصفيتها مدى الحياة في الكشف عن التقلبات القائمة على ديناميكيات البروتين في كفاءة FRET في العينات ذات الكلام المتقاطع العالي أو الوميض الثلاثي الكبير أو غيرها من الخصائص الفوتوفيزيائية أو التجريبية التي تخفي العلاقة المضادة الناجمة عن FRET في CCFFRET. هنا، يظهر النهج المثالي للبيانات المعروضة في الشكل 6E للمحاكاة التي تحتوي على 10٪ من الكلام المتبادل و 5٪ ثلاثي وامض. (أ)أنماط الاضمحلال كثافة الفلورية تطبيع لنوعين FRET (الضوء والأخضر الداكن ل FRET عالية ومنخفضة، على التوالي) و IRF (رمادي). يظهر نمط قناة الكشف المتوازية في خطوط متصلة وخطوط متقطعة لقناة الكشف العمودية. (ب) تم إنشاء وظيفة الترجيح أو "مرشح" استنادا إلى الأنماط المبينة في (A) ، رمز اللون مطابق ل (A). يرجى ملاحظة أن الإشارة في قنوات الكشف الخضراء فقط، وبالتالي إرواء المانحين الناجم عن FRET، يتم النظر فيها هنا. (ج)يتم الحصول على أربعة أنواع مختلفة انتقائية الارتباطات: الأنواع-autocorrelations من الدولة فريت منخفضة(SACFLF-LF،الأخضر الداكن) وحالة فريت عالية (SACFHF-HF،الأخضر الفاتح)، واثنين من الأنواع-crosscorrelations بين فريت منخفضة إلى حالة فريت عالية (SCCFLF-HF،البرتقالي الداكن) والعكس بالعكس (SCCFHF-LF ، برتقالي). يظهر SCCF بوضوح مضاد الترابط في نطاق μs. خطوط سوداء متقطعة تظهر نوبات. sACF كانت تناسب مع eq. 9 و SCCF مع eq. 11. الجدول في لوحة (D) يظهر نتائج تناسب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
سعة CCFPIE لدراسة التفاعل بين البروتين والبروتين (PPI)
وأخيرا، فإن حالة الاستخدام الشائعة لFCS المستندة إلى PIE في الخلايا الحية هي دراسة التفاعل بين بروتينين مختلفين. هنا، المعلمة القراءة التدريجي هو اتساع فطيرةCCF،أو على نحو أكثر دقة نسبة السعة التصحيح التلقائي ACF gp وACFrd إلى سعة CCFPIE. لإظهار تأثير زيادة الانتشار المشترك على CCFPIE، تم إجراء المحاكاة استنادا إلى البناءين أحاديي التسمية ، β2AR-IL3-eGFP و NT-SNAP-β2AR (الشكل 8A). ويبين الشكل 8B كيف تزداد سعة فطيرة CCF عندما يتغير جزء جزيئات الانتشار المشترك من 0٪ إلى 100٪. يرجى ملاحظة أنه تمت إضافة إشارة خضراء بنسبة 1٪ إلى القنوات الحمراء في نافذة وقت التأخير مع مكونات الانتشار على غرار ما هو موضح أعلاه.
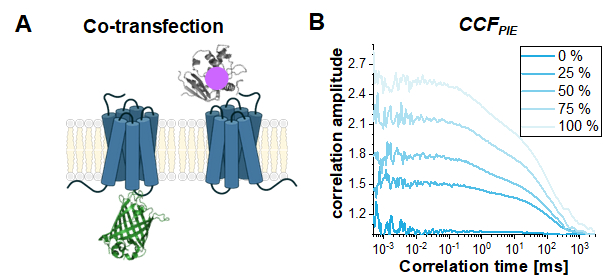
الشكل 8: يمكن استخدام فطيرة CCF لدراسة تفاعل اثنين من البروتينات. (أ) هنا ، تم محاكاة دراسة العدوى المشتركة β2AR-IL3-eGFP مع NT-SNAP-β2AR (تحمل علامة SNAP "حمراء". (ب) لكمية متزايدة من الجزيئات المشاركة في الانتشار (0٪ (الأزرق الداكن) - > 100٪ (الأزرق الفاتح)) زيادة السعة G(tc). تم تصميم مصطلح الانتشار مرة أخرى بصورة توزيع ثنائي الوسائط مع 30٪ من جزيئات الانتشار السريع في tD1 = 1 مللي ثانية وبقية الجزيئات تنتشر ببطء مع tD2 = 100 مللي ثانية. بالإضافة إلى ذلك، تمت إضافة 1٪ من الإشارة الخضراء إلى نافذة وقت التأخير الحمراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| رمز | المعنى (وحدة مشتركة) | |||
| α | الحديث المتبادل من الفلوروفور الأخضر بعد الإثارة الخضراء في قنوات الكشف الحمراء (٪) | |||
| أ1 | جزء من أول مكون نشر في نموذج نشر ثنائي الوسائط لمستقبلات الأغشية | |||
| أ و | السعة الكلية لمصطلح مكافحة العلاقات | |||
| أر | اتساع photophysics / ثلاثية وامض | |||
| b | خط الأساس / إزاحة منحنى الارتباط | |||
| B | السطوع الجزيئي للفلوروفور ((كيلو-) التهم لكل جزيء والثانية) | |||
| بي جي | الخلفية (على سبيل المثال من عينة مرجعية مناسبة: ddH2O، المخزن المؤقت، الخلية غير المصابة وما إلى ذلك) | |||
| c | تركيز | |||
| كر | معدل العد (KHz أو (كيلو-) عدد في الثانية) | |||
| δ | الإثارة المباشرة للفلوروفور الأحمر بعد الإثارة الخضراء (٪) | |||
| D | معامل الانتشار (μm²/s) | |||
| G(tc) | دالة الارتباط | |||
| N | عدد الجزيئات في التركيز | |||
| نأ | رقم أفوغادرو (6.022*1023 مول-1) | |||
| rGR, rRG | نسبة السعة لوظيفة الارتباط التلقائي الخضراء أو الحمراء إلى الدالة المتبادلة بين الارتباطات المستندة إلى PIE | |||
| s | عامل شكل عنصر حجم كونفوج | |||
| رج | وقت الارتباط (عادة بالمللي ثانية) | |||
| tD | وقت الانتشار (عادة بالمللي ثانية أو ميكروثانية) | |||
| رر | وقت الاسترخاء من photophysics (عادة في ميكروثانية) | |||
| تيتي | وقت الاسترخاء من الوميض الثلاثي (عادة في ميكروثانية) | |||
| ث0 | نصف عرض عنصر وحدة التخزين البؤرية (ميكرومتر) | |||
| z0 | نصف ارتفاع عنصر وحدة التخزين البؤرية (μm) | |||
الجدول 1: قائمة المتغيرات والاختصارات. لاستخدام الرموز والتعريف في تجارب الفلورسينس و FRET ، يوصى بالمبادئ التوجيهية لمجتمع FRET40.
ملفات تكميلية:
SuppNote1_Coverslip التنظيف.docx الرجاء الضغط هنا لتحميل هذا الملف.
SuppNote2_Confocal الإعداد.docx الرجاء الضغط هنا لتحميل هذا الملف.
SuppNote3_Data التصدير.docx الرجاء الضغط هنا لتحميل هذا الملف.
SuppNote4_FCCS تحليل المعايرة باستخدام ChiSurf.docx الرجاء الضغط هنا لتحميل هذا الملف.
SuppNote5_Fluorescence المدرجات التكرارية مدى الحياة.docx الرجاء النقر هنا لتحميل هذا الملف.
S6_Scripts.zip الرجاء الضغط هنا لتحميل هذا الملف.
S7_Excel_templates.zip الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
تسمح تقنيات FCS في GPCRs بتقييم حركة وتفاعلات المستقبلات داخل الخلايا الحية41. وميزة تقنية FRET-FCS هي أنه، إلى جانب التنقل، يمكن التحقيق في الديناميات التوافقية ل GPCRs. ومع ذلك ، فإن أداء FRET-FCS في الخلايا الحية أمر صعب ويتطلب الخلايا التي تظهر تعبيرا منخفضا (أو معتدلا إلى أقصى حد) عن البروتين المسمى بالفلورسنت المثير للاهتمام والإعداد الجيد وخطوط أنابيب جيدة لتحليل البيانات. هنا، أولا، تناقش النقاط الحرجة في إعداد العينات والإجراءات التجريبية فيما يتعلق بالنقاط البيولوجية والتحليلية والتقنية.
وتشمل الخطوات التجريبية الحاسمة التقليل إلى أدنى حد من الخلفية والفلورية التلقائية (باستخدام الأغطية النظيفة على نطاق واسع والوسائط الحرة الفينول الحمراء)، وتحسين ظروف العدوى (على سبيل المثال، كمية الحمض النووي البلازميد والوقت بعد العدوى) لتحقيق مستويات التعبير المنخفضة ووضع العلامات الفعالة. وبطبيعة الحال، من الضروري أيضا ضمان عدم إعاقة وظيفة البروتين المسمى. وهكذا، في تجارب الخلايا الحية، وغالبا ما يتخذ القرار لوضع العلامات الاستراتيجية ووضع التسمية لصالح البروتينات الفلورية أو SNAP / CLIP العلامة المرفقة مرنة N- أو C-terminus42،43. استراتيجيات وضع العلامات البديلة مثل إدراج حمض أميني غير طبيعي مع سلسلة جانبية تفاعلية لوضع العلامات مع الفلوروفور العضوي قد ظهرت في السنوات الأخيرة44.
بالنسبة ل PIE-FCS ثنائي اللون ، حيث لا يتم التحقيق إلا في تفاعل جزيئين مثيرين للاهتمام ، يمكن اختيار الفلوروفوريس من بين مجموعة كبيرة ومتنوعة من البروتينات الفلورية الراسخة أو ركائز SNAP / CLIP. هنا ، يجب أن يكون الهدف من التحليل الطيفي هو اختيار زوج بحيث يحدث القليل من الكلام المتقاطع أو الإثارة المقبولة المباشرة. بالإضافة إلى ذلك ، يجب أن تكون الفلوروفوريس المختارة قابلة للصور وتظهر القليل من التبييض أو لا تظهر على أي حال في ظل الظروف التجريبية المختارة. فمن المستحسن لتحديد الفلوروفوريس في النطاق الطيفي الأحمر كما (1) يتم تقليل الخلفية autofluorescence من الخلية و (2) ضوء الإثارة هو من الطول الموجي أطول، وبالتالي أقل فوتولوكسيك14. يمكن تقليل photobleaching عن طريق إجراء ما يسمى "سلسلة الطاقة" أولا ، حيث يتم زيادة قوة الليزر تدريجيا ، ويلاحظ السطوع الجزيئي. تكمن مجموعة كثافة الإثارة المثلى في النطاق الخطي للنتائج45.
إذا كان من المفترض أن التسميتين للإبلاغ أيضا عن ديناميات تشكيل البروتين من خلال FRET ثم اختيار الفلوروفوريس المتاحة هو أكثر تقييدا. هنا، ينبغي تقدير المسافة الدنيا/القصوى الممكنة بين الفلورين مسبقا، على سبيل المثال، استنادا إلى الهياكل المتاحة أو الحجم الجزيئي، وزوج الفلوروفور الذي تم اختياره بنصف قطر Förster R 0 المعقول بحيث يمكن أن يحدث FRET فعليا20.
هنا ، تم اختيار eGFP وعلامة SNAP للتسمية ، وتم تسمية علامة SNAP إما بركيزة سطحية داخل الخلايا أو ركيزة سطحية غير منفذة للغشاء. الأطياف مماثلة لتلك التي تظهر في الشكل 2C-D. يظهر هذا المزيج من الفلوروفوريس التحدث المتبادل العالي ل eGFP في قنوات الكشف الحمراء والإثارة المقبولة المباشرة للركيزة SNAP بواسطة الإثارة الخضراء في النافذة الزمنية الفورية ويؤدي إلى إشارة "كاذبة" كبيرة في القنوات الحمراء في النافذة الزمنية الفورية. من الناحية المثالية ، يجب ألا تتجاوز القيمتين ، والكلام المتبادل والإثارة المقبولة المباشرة ، 5٪5،6،38. ومع ذلك ، مع دائرة نصف قطرها Förster من 57 Å ، فمن المناسب بشكل مثالي للتحقيق في المسافة بين التسميات في β2AR-IL3-eGFP-CT-SNAP بناء كما يمكن تقييمها من عمر eGFP مروي (ملاحظة التكميلية 5).
من الناحية الفنية ، كما هو الحال بالنسبة لأي تجربة مطيافية مضانة ، يجب أن يكون الجهاز متوافقا بشكل جيد ويجب أن يمتلك مصادر إثارة مناسبة ، ومرشح انبعاثات ، وأجهزة كشف حساسة. لتجنب القطع الأثرية من كاشف بعد الضخ على مقياس الوقت μs، يجب أن يكون هناك كاشفان على الأقل من كل لون، والتي يمكن ربطها. في الوقت الحديث المرتبطة فوتون واحد عد الالكترونيات ، والوقت الميت من بطاقة الكشف في النطاق الزمني NS لا يكاد يلعب دورا بسبب قنوات التوجيه المستقلة ، ومع ذلك ، فإنه قد يتم التحقق من ذلك على النحو المقترح من قبل مولر وآخرون 16 شريطة أن النطاق الزمني للاهتمام يكمن في النطاق الزمني sub-μs / ns. بالإضافة إلى ذلك، حتى لقرارات وقت أعلى في نطاق PS، ينبغي مضاعفة كل قناة الكشف، أي أربعة كاشفات لكل لون ينبغي استخدامها، لتجاوز أيضا كاشف الميت مرات2،15،29،46. وفي حين يمكن تقدير متوسط عمر الفلورسين باستخدام الكشف عن الفلورسينس غير المستقطب، يتعين جمع الانبعاثات المعتمدة على الاستقطاب لتحليل المسافة (~التوزيع) بين الفلوروفوريس. ويرجع ذلك إلى حقيقة أن كفاءة نقل الطاقة في FRET تعتمد على اتجاه الفلوروفورين. ويمكن الاطلاع على مزيد من المعلومات التفصيلية هنا20،28،47. وأخيرا، في تجارب PIE، المسافة بين نبضة المطالبات والتأخير حرجة وينبغي اختيارها بحيث تتحلل كثافة الفلورية للفلوروفوريس إلى حد كبير(الشكل 1B). القاعدة الشائعة هي وضع النبضات 5x عمر الفلورسينس بعيدا ، أي بالنسبة ل eGFP مع عمر مضان قدره 2.5 ns يجب أن تكون المسافة 12.5 ns بحد أدنى22.
بعد أن تم تفصيل جميع الاعتبارات للإجراء التجريبي ، تتم مناقشة البيانات وتحليلها بمزيد من التفصيل. كما هو مذكور في قسم البروتوكول، يجب التحقق من محاذاة الإعداد يوميا، بما في ذلك تحليل قياسات المعايرة. وتظهر البيانات المبينة في الشكل 2 ألف- جيم مثلا عنصرا إضافيا للاسترخاء في نطاق 8-40 ميكروس. ومن المعروف أن الوميض الثلاثي النموذجي للمضايرة الخضراء يحدث في نطاق 2-10 ميكروس13،15،48. عنصر الاسترخاء البطيء المطلوب في جميع منحنيات عينة الحمض النووي(الشكل 3C)،بطيئ جدا للوميض الثلاثي الفعلي، قد ينبع من تفاعلات الحمض النووي مع الفلوروفوريس39. ومع ذلك، لن يتوقع هذا المكون في CCFPIE، وينبع على الأرجح من الكلام المتبادل المتبقي. وبالتالي ، فإنه من المستحسن للغاية لإجراء تحليل عينات المعايرة مباشرة قبل الشروع في تجارب الخلية للحكم على نوعية المحاذاة اليوم.
تتطلب المعايرة المناسبة لحجم التداخل البؤري عينة مع نشر مشترك بنسبة 100٪ للتسمية الخضراء والحمراء. هنا، يتم استخدام الحمض النووي المزدوج الذي تقطعت به السبل المسمى بالفلورسنت. يمكن تصميم كلا خيوط الحمض النووي ليكون الفلوروفوريس المطلوب على المسافة المطلوبة من بعضها البعض. يمكن أن تكون خيوط مصممة مع ارتفاع العائد. ومع ذلك ، تنصح الممارسة المختبرية الجيدة بالتحقق من سلامة ودرجة وضع العلامات على خيوط الحمض النووي عن طريق إلكتروفورسيس هلام الآغروز وقياس طيف الامتصاص. أيضا، يجب التحقق من العائد من التجميع المزدوج تقطعت بهم السبل كما قياس المعايرة هذا يعتمد بشكل حاسم على افتراض أن هناك 100٪ نشر مشترك من الأخضر مع التسمية الحمراء. في حالة افتراض غير صالح، قد يكون من الضروري تطبيق عوامل التصحيح16،22. في قياسات المعايرة المبينة في الشكل 2 والشكل 3،تم الحصول على حجم كشف قدره 1.4 fL و 1.9 fL في القناة الخضراء والحمراء، على التوالي. ومن المتوقع هذا الفرق حجم لإعداد مع وحدات التخزين الإثارة الحيود محدودة تقريبا (ملاحظة التكميلية 2). في ظل هذه الحالة ، حجم حجم الإثارة المقاييس مع الطول الموجي الإثارة. وهذا بدوره يفسر الاتساعات المختلفة للارتباط الملاحظة في الشكل 3B. عوامل التصحيح المشتقة rGR = 0.56 و rRG = 0.72 الصحيح لهذا التباين حجم وتداخل غير مثالي المحتملة من حجمين الإثارة3،4.
الشكل 4، الشكل 5، الشكل 6، والشكل 7 عرض سير العمل من PIE - F (C) CS دراسة مقرها تهدف إلى فهم ديناميات البروتين تشكيلية. أولا، يعمل البناءان أحاديا التسمية β2AR-IL3-eGFP وNT-SNAP-β2AR كضوابط لتوصيف خصائص الفلوروفور في الخلايا في غياب الفلوروفوري الأخرى المعنية(الشكل 4). بعد ذلك ، فإن بناء مزدوج المسمى NT - SNAP - β2AR - IL3 - eGFP تحمل SNAP - العلامة التي تواجه الخارجي الخلية وeGFP على الجانب السيتوبلازمي بمثابة "100 ٪ نشر مشترك" السيطرة(الشكل 5). آخر بناء، β2AR-IL3-eGFP-CT-SNAP، يحمل كل من الفلوروفوريس على الجانب السيتوبلازمي وقريبة بما فيه الكفاية معا للخضوع FRET. هنا، مرة أخرى من المتوقع 100٪ نشر مشترك جنبا إلى جنب مع تقلبات كثافة المضادة للارتباط في إشارة القنوات الخضراء والحمراء في نافذة الوقت الفوري، أي بعد الإثارة المانحة، وذلك بسبب ديناميات البروتين التأثير على كفاءة FRET31،32،33. قد تظهر هذه الديناميكيات كمكافحة الارتباط في CCFFRET (الشكل 6-7).
جميع GPCR β2AR يبني تظهر انتشار ثنائي الوسائط على غشاء الخلية(الشكل 4A). في حين أن β2AR-IL3-eGFP يظهر فقط الوميض الثلاثي المتوقع(الشكل 5B)13،15، NT-SNAP-β2AR يظهر وقت استرخاء بطيء إضافي(الشكل 5C-D). ومن المرجح أن TR2 قد تنبع من ركيزة SNAP غير منضمة. ويمكن توضيح ذلك من خلال إجراء المزيد من التجارب، على سبيل المثال، من خلال قياس الانتشار والخصائص الفيزيائية الضوئية للركيزة SNAP المستخدمة في محلول مائي. وتجدر الإشارة إلى أن التجربة المباشرة للتمييز بين أوقات الانتشار والاسترخاء هي تغيير الثقب في الإعداد الكونفوجال ، أي زيادة الحجم الفعال: في حين أن أوقات الانتشار تزداد مع زيادة الأحجام الفعالة ، فإن شروط الاسترخاء لا تتغير13. عند تحديد تركيز البروتين الفلوري (FP) على أساس النتائج المناسبة ، كن على علم بأن FPs بشكل عام يخضع لعملية نضوج ، والتي يتم فيها تشكيل الكروموفوري في النهاية12. قد يختلف وقت النضج هذا من FP إلى FP بالإضافة إلى الفيزياء الضوئية التي تعتمد على البيئة الكيميائية المحلية13،15. وبالتالي، فإن تركيز البروتين الفعلي الموجود في العينة التي أبلغ عنها FCS عادة ما يتم الاستهانة به، والذي يمكن تصحيحه إذا كان يمكن تحديد جزء من FPs غير الفلورية في التجربة. وأخيرا، فإنه من المستحسن للتحقق من أطياف الفلوروفور في الخلايا الحية لتصحيح القيم α δ، إذا لزم الأمر، كما يتفاعل معظم الفلوروفوريس حساسة لبيئتهم13،15،48. يتم تحديد الخلفية للطرح بواسطة الإشارة التي تم جمعها في الخلايا غير المصابة. بالإضافة إلى ذلك، يجب التحقق من الارتباط التلقائي للقناة اللونية الأخرى المعنية و PIE CCF لتكون قادرة على تحديد إشاراتخاطئة (ملاحظة تكميلية 4 - الشكل 30).
تمالحصولعلى القياسين من NT-SNAP-β 2 AR-IL3-eGFP(الشكل 5D)،حيث تقع الفلوروفورات على جوانب مختلفة من الغشاء، في أيام مختلفة ويظهر أهمية الإحصاءات في مضان جزيء واحد حل الوقت. هنا، قد تكون النتائج المختلفة بسبب اختلاف درجة وضع العلامات: في خلية واحدة أدت الدرجة العليا من وضع العلامات ومتوسط القياسات إلى ضوضاء منخفضة نسبيا(الشكل 5B)،بينما من الخلية الأخرى، يمكن جمع قياسين فقط(الشكل 5A). بالإضافة إلى جمع كمية كافية من البيانات، من الضروري تقييم النتائج في الوقت المناسب، وربما تحسين استراتيجية وضع العلامات. عند تصميم التجارب، من المهم أن نتذكر أن FRET حساسة، ولكن تقتصر على مسافات تصل إلى 10 نانومتر و "أعمى" خلاف ذلك. في حالتنا ، يشار إلى هذا "العمى" من خلال عمر الفلورية eGFP دون تغيير (الملاحظة التكميلية 5). في β2AR-IL3-eGFP-CT-SNAP بناء(الشكل 6A)،يمكن تحديد FRET من العمر eGFP مروي (ملاحظة التكميلية 5). ومع ذلك، لا يلاحظ مصطلح مكافحة الترابط(الشكل 6B)،مما يعني أن FRET إما لا تتقلب أو على مقياس زمني أبطأ من وقت الانتشار. مطلوب ما يصل إلى ثلاثة شروط إضافية للاسترخاء في سباق الجائزة الكبرىACF، ACFRP، ACFRD و CCFFRET (الشكل 6C). قد يكون العنصر البطيء في ACFRPو ACFrd و CCFFRET بسبب تبييض المقبول ، وبطبيعة الحال ، يؤثر على القيمة التي تم الحصول عليها من الانتشار البطيء الموجود في هذه المنحنيات (~ 350 مللي ثانية مقارنة ب 117 مللي ثانية في سباق الجائزةالكبرىACF). TD في القناة الحمراء من المفترض أن تكون أكبر قليلا مما كانت عليه في القناة الخضراء بسبب أحجام confocal مختلفة الحجم (الشكل 2) - ولكن فقط من قبل عامل مماثل لفارق الحجم. وقت الاسترخاء سريع جدا من 3 μs يعكس ثلاثية وامض من الفلوروفوريس13،15،48، في حين أن وقت الاسترخاء أبطأ من 37 ميكرومتر قد يكون بسبب FRET : وبالمثل ، كما FRET يحفز anticorrelation في FRETCCF، ومن المتوقع الارتباطات الإيجابية في autocorrelations31،32،33. ويمكن تفسير وجود هذا المصطلح بأنه "إيجابي" في إطار التعاونالقطري المشترك ووجوده في إطار التعاون الإقليمي بالحضور المتبادل العالي وينبغي توضيحه أكثر. لاحظ أن CCFPIE مسطح في أوقات الارتباط قصيرة كما هو متوقع.
من ناحية أخرى ، تجدر الإشارة إلى أن حدوث FRET في نظام المصالح يؤدي إلى آثار غير خطية على منحنيات الارتباط6. السطوع الجزيئي على سبيل المثال ، من جداول جزيء في اتساع الارتباط التربيعية وكل FRET الدولة (والجزيئات الموجودة دائما دون مستقبلات نشطة) يظهر سطوع الجزيئية المختلفة. في الواقع ، FRET يقلل من التركيز الظاهر للجزيئات الخضراء المكتشفة (أي يزيد من سعة سباق الجائزة الكبرى ACF) وعدد الجزيئات الحمراء (التي تحدد من الأحمر الفوري) مبالغ فيه5. كلا التأثيرين تؤثر على مقدار التفاعل المستمدة من كل من CCFFRET و CCFPIE. ومع ذلك، يمكن للتحليل العالمي كما هو مبين على سبيل المثال للديناميات داخل الجزيئية من كالمودولين 31،32 أو Syntaxin33 تكشف عن ديناميات البروتين. عند معايرة بعناية، يمكن استخراج متوسط كفاءة FRET من السعة النسبية CCFPIE و ACF22،في حين يمكن تحديد الدول المقيدة من تحليل توزيع العمر الفلوري المانح33.
وبالنظر إلى حقيقة أنه في تجارب الخلايا الحية مع الفلوروفوريس الكبيرة مثل eGFP من المرجح أن يكون تباين FRET أقل من المفترض للمحاكاة الموضحة في الشكل 6 وأن الإثارة المباشرة للمقبول لم تتم إضافتها في المحاكاة ، قد يفسر لماذا تحديد مضاد الترابط في تجارب الخلايا الحية أمر صعب للغاية. بديل تحليل واعد يعتمد على حصاد المعلومات المشفرة في المدرجات التكرارية وقت وصول الفوتون(الشكل 1B)يمكن الوصول إليها بسبب الوقت المترابط الفوتون واحد عد جمع البيانات29،30. إذا كان عمر الفلورسينس (~patterns) لنوعين (أو أكثر) (FRET) داخل العينة معروفين (الشكل 7A) ، يمكن اختيار "فلتر" أو أوزان يتم تطبيقها أثناء عملية الارتباط (الشكل 7B)17،18،19. وهكذا فإن منحنيات الارتباط التي تم الحصول عليها، لم تعد تمثل ارتباط قنوات الكشف، بل تمثل الارتباطات التلقائية أو المتبادلة بين نوعين مختلفين (FRET)، وبالتالي أعيدت تسميتهما إلى الأنواع -ACF (sACF) أو الأنواع-CCF (sCCF). تطبيق هذا النهج على البيانات محاكاة مع التباين FRET معتدلة، وارتفاع التحدث المتبادل وامض الثلاثي يستعيد مصطلح مكافحة العلاقة(الشكل 7C-D). ومع ذلك ، تجدر الإشارة إلى أنه يمكن الحصول على أوقات الاسترخاء ولكن يتم فقدان العلاقة مع السعة18. وقد تم تطبيق هذا النهج سابقا في تجارب الخلايا الحية على سبيل المثال لدراسة تفاعل EGFR مع خصمها49 أو لفصل الفلورسينس من البروتينات المرفقة بمتغيرات eGFP مع عمر مضان قصير وطويل بشكل استثنائي50.
في حين تستخدم قياسات FRET المستندة إلى PIE في البروتينات النقية إلى حد كبيرلدراسة ديناميكيات البروتين 3622، في الخلايا الحية ، فإنها تركز على فهم التفاعلات بين البروتين والبروتين. وقد تم تطبيق هذا النهج لدراسة تنظيم نشاط كيناز MAP في الخميرة51 أو لحل تفاعل بروتينات الأغشية مع شريكها ملزمة السيتوسوليك كما هو ملخص في هذه المادة الأخيرة52. هنا، قد تنشأ مضاعفات عندما لا يزال هناك حديث متقاطع كبير من الفلوروفوريس الأخضر في نافذة وقت التأخير للقنوات الحمراء أو الإشارة الحمراء في القنوات الخضراء في النافذة الزمنية الفورية. وقد يكون السبب الأول هو التأخير غير الكافي للنبض الأحمر فيما يتعلق بالنبض الأخضر في حين أن كلا التأثيرين ينبعان من تداخل شديد في الإثارة وأطياف الانبعاثات للفلوروفوريس المختار. فمن المستحسن للتحقق من كل واحد المسمى يبني بعناية والصحيح لاتساع CCFPIE إيجابية كاذبة، وخاصة في الخلايا حيث autofluorescence مع عمر مضان قصيرة جدا قد يكون عاملا آخر تعقيد22.
في الختام، فإن نهج FRET-FCS الموصوف هنا لديه إمكانات كبيرة لفهم التفاعلات البروتينية البروتينية وديناميكيات البروتين في الخلايا الحية بتركيزات فسيولوجية قريبة. وفي هذا البروتوكول، تم التركيز على قياسات المعايرة المطلوبة والتحليل الكمي اللازم الذي يتعين إجراؤه أثناء قياسات الخلايا الحية. وتحقيقا لهذه الغاية، عرضت قياسات مختلفة للخلايا الحية تكملها عمليات محاكاة. وتوفر عمليات المحاكاة الفهم العام هنا حيث يمكن أن تختلف المعلمة بشكل منهجي مع نماذج تناسب المصممة خصيصا التي تصف التنقل المحدد والخصائص الفيزيائية الضوئية للبيانات المعنية. وقد تم إجراء التحليل باستخدام أدوات برمجيات مفتوحة المصدر مع بروتوكول شامل خطوة بخطوة وقوالب سهلة التكيف. وأخيرا، فإن التقدم التقني، وبالتالي توافر أنظمة PIE-FCS المستقرة الجاهزة للشراء إلى جانب انتشار البرمجيات مفتوحة المصدر لتحليل البيانات، سيجعل هذه التقنية أكثر سهولة لمجتمع بحثي أكبر لكشف تفاعل البروتين وديناميكياته في الخلايا الحية ذات الحساسية القصوى.
Disclosures
ولا يوجد لدى أصحاب البلاغ أي تعارضات يعلنونها.
Acknowledgements
وقد تم دعم هذا المشروع من قبل دويتشه Forschungsgemeinschaft (SFB/TR 240، رقم المشروع 374031971، مشروع INF) إلى J.B وK.G.H.
نشكر مركز رودولف فيرتشو على الدعم المالي والتصوير الفلوري للوحدة الأساسية على الدعم الفني. بالإضافة إلى ذلك، نشكر أشوين بالاكريشنان على قراءة الأدلة الشاملة.
Materials
| Name | Company | Catalog Number | Comments |
| 1x Telescope in 4f configuration with five lenses | Qioptiq, Rhyl, UK | G063126000 | Optics |
| 2x Band pass filters Brightline | AHF, Tübingen, Germany | HC 525/50 and HC 600/52 | Filter |
| 2x Dichroic beam splitter | AHF, Tübingen, Germany | HC BS F38-573 | Filter |
| 6-well culture plate Nunc | Thermo Scientific (Waltham, USA) | 140675 | Reagent |
| Alexa Fluor 488 NHS Ester (green calibration standard) | Invitrogen, Life Technologies (Carlsbad, USA) | A20000 | Reagent |
| Alexa Fluor 568 NHS Eater (red calibration standard) | Invitrogen, Life Technologies (Carlsbad, USA) | A20003 | Reagent |
| ASI stage PZ-2000 XYZ | Visitron Systems GmbH, Puchheim, Germany | WK-XYB-PZ-IX71 | Microscope Parts |
| Attofluor Cell Chamber, 35 mm diameter for 25 mm round coverslips | Invitrogen, Life Technologies (Carlsbad, USA) | A7816 | Glass coverslip holder |
| Avalanche photodiode Perkin Elmer (SPCM-AQR-14) | Laser Components GmbH, Olching, Germany | SPCM-AQR-14 | Single photon counting detector |
| Beamsplitter | Newport, Darmstadt, Germany | 10FC16PB.3 | Filter |
| Biorender (Software) | Science Suite Inc - o/a BioRender (Toronto, Canada) | --- | Software used to create GPCR sketch, https://app.biorender.com/ |
| Chinese hamster ovary (CHO) cell line | ATCC | CCL-61 | Cell lines |
| ChiSurf (Data analysis Software) | Thomas-Otavio Peulen, Department of Bioengineering and Therapeutic Sciences, University of California, San Francisco, USA | --- | tttrlib-based software to analyze fluorescence correlation data and fluorescence decay histograms, https://github.com/Fluorescence-Tools/chisurf Tutorial: https://www.youtube.com/watch?v=k9NgYbyLyXk&t=2s Ref: Peulen et al. J Phys Chem B. 121 (35), 8211-8241, (2017) |
| Chloroform | Sigma-Aldrich (St. Louis, USA) | 472476-2.5L | Reagent |
| DMSO | AppliChem GmbH (Darmstadt, Germany) | A3672,0250 | Reagent |
| DNA strand (40 bp fluorophore distance) | IBA Lifesciences GmbH (Göttingen, Germany) | --- | Reagent, 5’ CGC ACT GAA CAG CAT ATG ACA CGC GAT AGG CTA TCC TGC AGT ACG CT(Alexa568)C AGG 3’, 3’ GCG TGA CT(Alexa488)T GTC GTA TAC TGT GCG CTA TCC GAT AGG ACG TCA TGC GAG TCC 5’ |
| Dulbecco’s Modified Eagle Medium: Nutrient Mixture F12 (with and without phenol red) | GIBCO, Life Technologies (Carlsbad, USA) | P04-41250, P04-41650 | Reagent |
| Ethanol (absolute) | Sigma-Aldrich (St. Louis, USA) | 34852-1L-M | Reagent |
| Erythrosin B,Dye content >=95 % | Sigma-Aldrich (St. Louis, USA) | 200964-5G | Reagent, Instrument Response function, solve in EtOH to 10 mg/mL |
| Fetal Bovine Serum (FBS) | Biochrom (Berlin, Germany) | S 0615 | Reagent |
| Fluorescence Light Source X-Cite 120 Q | Excelitas Technologies, Ontario, Canada | XI120-Q-5060 | Microscope Parts |
| Fluorescent SNAP-substrate cell : SNAP Cell TMR- STAR | New England BioLabs (Frankfurt am Main, Germany) | S9105S | Reagent |
| Fluorescent SNAP-substrate surface : DY-549 | New England BioLabs (Frankfurt am Main, Germany) | S9112S | Reagent |
| Glass coverslips (Dimensions: diameter 24 mm, thickness 0.13 - 0.16 mm) | Marienfeld-Superior (Lauda-Königshofen, Germany) | 111640 | Reagent |
| Laser Controller | Picoquant, Berlin, Germany | 910020 (PDL 828-S "SEPIA II") | Optics |
| Laser lines (480 nm and 560 nm) | Picoquant, Berlin, Germany | 912485 (LDH-D-C-485), 912561 (LDH-D-TA-560) | Optics |
| Lipofectamine 2000 | Invitrogen, Life Technologies (Carlsbad, USA) | 11668-019 | Reagent |
| MFD suite (Software) | AG Seidel, Heinrich-Heine-University Duesseldorf, Germany | --- | Software package for analysis of single-molecule fluorescence experiments including e.g. Kristine (correlation of tttr data), Burbulator (simulation of single-molecule experiment), https://www.mpc.hhu.de/software/3-software-package-for-mfd-fcs-and-mfis |
| Mounted Achromatic Doublet, ARC: 400-700 nm, f=150 mm, D=25.4 mm | Thorlabs, Bergkirchen, Germany | AC254-150-A-ML | Second part of Beam expander |
| Neubauer Chamber (deepness 0.1 mm) | Marienfeld-Superior (Lauda-Königshofen, Germany) | 640110 | Reagent |
| Olympus IX 71 stand | Olympus, Hamburg, Germany | IX2-ILL100 | Microscope Parts |
| Opti-MEM (Reduced-Serum Medium) | GIBCO, Life Technologies (Carlsbad, USA) | 31985-047 | Reagent |
| Penicillin/Streptomycin | Sigma-Aldrich (St. Louis, USA) | 049M4857V | Reagent |
| Phosphate-buffered Saline (PBS) | GIBCO, Life Technologies (Carlsbad, USA) | 14190144 | Reagent |
| Pinhole (50 µM) | Newport, Darmstadt, Germany | PNH-50 | Pinhole |
| PMT Hybrid-40 | Picoquant, Berlin, Germany | 932200 (PMA Hybrid 40) | Single photon counting detector |
| Python scripts (Software) | Katherina Hemmen, Rudolf-Virchow Center for Integrative and Translational Imaging, University Wuerzburg, Germany | --- | Collection of self-written Python scripts based on tttrlib (https://github.com/Fluorescence-Tools/tttrlib) used to (1) determine the average count rates, (2) correlate the data and (3) build fluorescence decay histograms, https://github.com/HeinzeLab/JOVE-FCS |
| Quad band beamsplitter (zt405/473-488/561/640 rpc phase r uf1) | AHF, Tübingen, Germany | F73-421PH | Filter |
| Single mode fiber polarization keeping, NA = 0.08 with collimator | Picoquant, Berlin, Germany | 02126 | Optics |
| Sodium Hydroxide (NaOH) | Carl Roth (Karlsruhe, Germany) | 6771.1 | Reagent |
| SymPhotime x64 Software (Data collection and data export software) | Picoquant, Berlin, Germany | 931073 (SPT64-1+2 single user ) | Time-tag time-resolved (tttr) data collection at the self-built FCCS setup, data export |
| Time-Correlated Single Photon Counting (TCSPC) system Hydraharp 400 | Picoquant, Berlin, Germany | 930010 (Hydraharp 400) | Optics |
| Trypsin-EDTA | Sigma-Aldrich (St. Louis, USA) | T4299-100ml | Reagent |
| Unmounted Achromatic Doublets, ARC: 400 - 700 nm, D=12.7 mm, F=-20 mm | Thorlabs, Bergkirchen, Germany | ACN127-020-A | First part of Beam expander |
| Water immersion objective (UPlanSApo 60x/1.20 W) | Olympus, Hamburg, Germany | UPLSAPO60XW | Objective |
References
- Hess, S. T., Huang, S. H., Heikal, A. A., Webb, W. W. Biological and chemical applications of fluorescence correlation spectroscopy: A review. Biochemistry. 41 (3), 697-705 (2002).
- Haustein, E., Schwille, P. Ultrasensitive investigations of biological systems by fluorescence correlation spectroscopy. Methods. 29 (2), 153-166 (2003).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature Methods. 3 (2), 83-89 (2006).
- Bacia, K., Schwille, P. Practical guidelines for dual-color fluorescence cross-correlation spectroscopy. Nature Protocols. 2 (11), 2842-2856 (2007).
- Kohl, T., Heinze, K. G., Kuhlemann, R., Koltermann, A., Schwille, P. A protease assay for two-photon crosscorrelation and FRET analysis based solely on fluorescent proteins. Proceedings of the National Academy of Sciences. 99 (19), 12161-12166 (2002).
- Sahoo, H., Schwille, P. FRET and FCS--friends or foes. Chemphyschem. 12 (3), 532-541 (2011).
- Wang, Y., Wang, G., Moitessier, N., Mittermaier, A. K. Enzyme Kinetics by Isothermal Titration Calorimetry: Allostery, Inhibition, and Dynamics. Frontiers in Molecular Bioscience. 7, 583826 (2020).
- Yanase, Y., et al. Surface plasmon resonance for cell-based clinical diagnosis. Sensors (Basel). 14 (3), 4948-4959 (2014).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annual Review of Biophysics. 43, 171-192 (2014).
- Nishida, N., Ito, Y., Shimada, I. In situ structural biology using in-cell NMR. Biochimica et Biophysica Acta General Subjects. 1864 (2), 129364 (2020).
- Schwille, P., Meyer-Almes, F. J., Rigler, R. Dual-color fluorescence cross-correlation spectroscopy for multicomponent diffusional analysis in solution. Biophysical Journal. 72 (4), 1878-1886 (1997).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15 (1), 47-51 (2018).
- Haupts, U., Maiti, S., Schwille, P., Webb, W. W. Dynamics of fluorescence fluctuations in green fluorescent protein observed by fluorescence correlation spectroscopy. Proceedings of the National Academy of Sciences. 95 (23), 13573-13578 (1998).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Widengren, J., Mets, U., Rigler, R. Photodynamic properties of green fluorescent proteins investigated by fluorescence correlation spectroscopy. Chemical Physics. 250 (2), 171-186 (1999).
- Müller, B. K., Zaychikov, E., Bräuchle, C., Lamb, D. C. Pulsed interleaved excitation. Biophysical Journal. 89 (5), 3508-3522 (2005).
- Böhmer, M., Wahl, M., Rahn, H. -. J., Erdmann, R., Enderlein, J. Time-resolved fluorescence correlation spectroscopy. Chemical Physics Letters. 353 (5), 439-445 (2002).
- Felekyan, S., Kalinin, S., Sanabria, H., Valeri, A., Seidel, C. A. M. Filtered FCS: Species Auto- and Cross-Correlation Functions Highlight Binding and Dynamics in Biomolecules. Chemphyschem. 13 (4), 1036-1053 (2012).
- Kapusta, P., Wahl, M., Benda, A., Hof, M., Enderlein, J. Fluorescence lifetime correlation spectroscopy. Journal of Fluorescence. 17 (1), 43-48 (2007).
- Algar, W. R., Hildebrandt, N., Vogel, S. S., Medintz, I. L. FRET as a biomolecular research tool-understanding its potential while avoiding pitfalls. Nature Methods. 16 (9), 815-829 (2019).
- Elson, E. L., Magde, D. Fluorescence Correlation Spectroscopy .1. Conceptual Basis and Theory. Biopolymers. 13 (1), 1-27 (1974).
- Hendrix, J., Lamb, D. C. Pulsed interleaved excitation: principles and applications. Methods Enzymol. 518, 205-243 (2013).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. 13 (1), 29-61 (1974).
- Thompson, N. L., Lakowicz, J. R. . Topics in Fluorescence Spectroscopy. , 337-378 (1991).
- Cole, N. B. Site-specific protein labeling with SNAP-tags. Current protocols in protein science. 73, 1-16 (2013).
- Petrásek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. 94 (4), 1437-1448 (2008).
- Siegel, A. P., Baird, M. A., Davidson, M. W., Day, R. N. Strengths and Weaknesses of Recently Engineered Red Fluorescent Proteins Evaluated in Live Cells Using Fluorescence Correlation Spectroscopy. International Journal of Molecular Sciences. 14 (10), 20340-20358 (2013).
- Peulen, T. O., Opanasyuk, O., Seidel, C. A. M. Combining Graphical and Analytical Methods with Molecular Simulations To Analyze Time-Resolved FRET Measurements of Labeled Macromolecules Accurately. The Journal of Physical Chemistry B. 121 (35), 8211-8241 (2017).
- Wahl, M., Rahn, H. J., Gregor, I., Erdmann, R., Enderlein, J. Dead-time optimized time-correlated photon counting instrument with synchronized, independent timing channels. Review of Scientific Instruments. 78 (3), 033106 (2007).
- Wahl, M., et al. Scalable time-correlated photon counting system with multiple independent input channels. Review of Scientific Instruments. 79 (12), 123113 (2008).
- Price, E. S., Aleksiejew, M., Johnson, C. K. FRET-FCS Detection of Intralobe Dynamics in Calmodulin. The Journal of Physical Chemistry B. 115 (29), 9320-9326 (2011).
- Price, E. S., DeVore, M. S., Johnson, C. K. Detecting intramolecular dynamics and multiple Forster resonance energy transfer states by fluorescence correlation spectroscopy. The Journal of Physical Chemistry B. 114 (17), 5895-5902 (2010).
- Margittai, M., et al. Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proceedings of the National Academy of Sciences. 100 (26), 15516-15521 (2003).
- Cherezov, V., et al. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science. 318 (5854), 1258-1265 (2007).
- Manglik, A., et al. Structural Insights into the Dynamic Process of beta2-Adrenergic Receptor Signaling. Cell. 161 (5), 1101-1111 (2015).
- Olofsson, L., et al. Fine tuning of sub-millisecond conformational dynamics controls metabotropic glutamate receptors agonist efficacy. Nature Communications. 5 (1), 5206 (2014).
- Kalinin, S., Valeri, A., Antonik, M., Felekyan, S., Seidel, C. A. Detection of structural dynamics by FRET: a photon distribution and fluorescence lifetime analysis of systems with multiple states. The Journal of Physical Chemistry B. 114 (23), 7983-7995 (2010).
- Hom, E. F. Y., Verkman, A. S. Analysis of coupled bimolecular reaction kinetics and diffusion by two-color fluorescence correlation spectroscopy: Enhanced resolution of kinetics by resonance energy transfer. Biophysical Journal. 83 (1), 533-546 (2002).
- Widengren, J., Schweinberger, E., Berger, S., Seidel, C. A. M. Two new concepts to measure fluorescence resonance energy transfer via fluorescence correlation spectroscopy: Theory and experimental realizations. Journal of Physical Chemistry A. 105 (28), 6851-6866 (2001).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Briddon, S. J., Kilpatrick, L. E., Hill, S. J. Studying GPCR Pharmacology in Membrane Microdomains: Fluorescence Correlation Spectroscopy Comes of Age. Trends in Pharmacological Sciences. 39 (2), 158-174 (2018).
- Barak, L. S., et al. Internal trafficking and surface mobility of a functionally intact beta2-adrenergic receptor-green fluorescent protein conjugate. Molecular Pharmacology. 51 (2), 177-184 (1997).
- Calebiro, D., et al. Single-molecule analysis of fluorescently labeled G-protein-coupled receptors reveals complexes with distinct dynamics and organization. Proceedings of the National Academy of Sciences. 110 (2), 743 (2013).
- Nikić, I., Kang, J. H., Girona, G. E., Aramburu, I. V., Lemke, E. A. Labeling proteins on live mammalian cells using click chemistry. Nature Protocols. 10 (5), 780-791 (2015).
- Robert, T. Y., Haibing, T. Measuring protein dynamics in live cells: protocols and practical considerations for fluorescence fluctuation microscopy. Journal of Biomedical Optics. 19 (9), 1-24 (2014).
- Felekyan, S., et al. Full correlation from picoseconds to seconds by time-resolved and time-correlated single photon detection. Review of Scientific Instruments. 76 (8), 083104 (2005).
- Forster, T. Zwischenmolekulare Energiewanderung Und Fluoreszenz. Annalen Der Physik. 2 (1-2), 55-75 (1948).
- Widengren, J., Mets, U., Rigler, R. Fluorescence Correlation Spectroscopy of Triplet-States in Solution - a Theoretical and Experimental-Study. Journal of Physical Chemistry. 99 (36), 13368-13379 (1995).
- Chen, J., Irudayaraj, J. Fluorescence lifetime cross correlation spectroscopy resolves EGFR and antagonist interaction in live cells. Analytical Chemistry. 82 (15), 6415-6421 (2010).
- Stefl, M., Herbst, K., Rubsam, M., Benda, A., Knop, M. Single-Color Fluorescence Lifetime Cross-Correlation Spectroscopy In Vivo. Biophysical Journal. 119 (7), 1359-1370 (2020).
- Maeder, C. I., et al. Spatial regulation of Fus3 MAP kinase activity through a reaction-diffusion mechanism in yeast pheromone signalling. Nature Cell Biololy. 9 (11), 1319-1326 (2007).
- Christie, S., Shi, X., Smith, A. W. Resolving Membrane Protein-Protein Interactions in Live Cells with Pulsed Interleaved Excitation Fluorescence Cross-Correlation Spectroscopy. Accounts of Chemical Research. 53 (4), 792-799 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved