Method Article
Canlı Hücrelerde Protein-Protein Etkileşimi ve Protein Dinamiklerini incelemek için Çift Renkli Floresan Çapraz Korelasyon Spektroskopisi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Modern floresan etiketleme tekniklerini kullanarak canlı hücrelerdeki membran reseptör dinamiklerini incelemek için Förster Rezonans Enerji transferi (FRET) ile birlikte canlı hücre çift renkli floresan çapraz korelasyon spektroskopisi (FCCS) gerçekleştirmek için deneysel bir protokol ve veri analizi iş akışı sunuyoruz.
Özet
Modern floresan etiketleme tekniklerini kullanarak canlı hücrelerdeki membran reseptör dinamiklerini incelemek için Förster Rezonans Enerji transferi (FRET) ile birlikte canlı hücre çift renkli floresan çapraz korelasyon spektroskopisi (FCCS) gerçekleştirmek için bir protokol ve iş akışı sunuyoruz. Floresan yoğunluğundaki dalgalanmaların ilgili floresan biyomolekülün dinamik "parmak izini" temsil ettiği çift renkli FCCS'de, reseptörlerin ortak difüzyonunu veya bağlanmasını araştırabiliriz. FRET, moleküler mesafelere karşı yüksek hassasiyeti ile, intramoleküler değişiklikleri izlemek için iyi bilinen bir "nanoruler" görevi görür. Birlikte ele alındığında, konformasyon değişiklikleri ve yerel reseptör konsantrasyonları ve hareketlilik sabitleri gibi temel parametreler hücresel ortamlarda erişilebilir hale gelir.
Nicel floresan yaklaşımları, yüksek gürültü seviyeleri ve numunenin güvenlik açığı nedeniyle hücrelerde zorlayıcıdır. Burada, eGFP ve SNAP-tag-TAMRA etiketli çift renkli etiketli β2-adrenerjik reseptör (β2AR) kullanılarak kalibrasyon adımları da dahil olmak üzere bu deneyin nasıl gerçekleştirildiğini gösteriyoruz. Özelleştirilebilen açık kaynaklı yazılımlar ve şablonlar kullanılarak adım adım veri analizi yordamı sağlanır.
Kılavuzumuz, araştırmacıların canlı hücre deneylerindeki sınırlı sinyal-gürültü seviyelerine rağmen, canlı hücrelerdeki biyomoleküllerin moleküler etkileşimlerini yerinde yüksek güvenilirlikle çözmelerini sağlar. FRET ve özellikle FCCS'nin düşük konsantrasyonlardaki çalışma penceresi, fizyolojik koşullara yakın koşullarda nicel analize izin verir.
Giriş
Floresan spektroskopi, hücresel bağlamda minimum pertürbasyon ile protein dinamiklerini ve protein-protein etkileşimlerini ölçmek için ana yöntemlerden biridir. Konfokal floresan korelasyon spektroskopisi (FCS), tek moleküllü duyarlı, son derece seçici ve canlı hücre uyumlu olduğu için moleküler dinamikleri analiz etmek için güçlü yöntemlerden biridir1. Diğer dinamik yönelimli yaklaşımlarla karşılaştırıldığında, FCS ~ ns'den ~ s'ye kadar uzanan daha geniş bir ölçülebilir zaman aralığına sahiptir ve en önemlisi görüntüleme tabanlı yöntemlerle erişilemeyen hızlı zaman ölçeklerini kapsar. Ayrıca, membran, sitoplazmik ve çekirdek moleküler dinamiklerinin kolayca ayırt edilebilmesi için mekansal seçicilik sağlar 2. Böylece, moleküler yanıp sönme, ortalama lokal konsantrasyon ve difüzyon katsayısı FCS ile nicel olarak analiz edilebilir. Floresan çapraz korelasyon spektroskopisi (FCCS) analizi3,4,5'te iki moleküler türün eş difüzyonunu çift renkli bir yaklaşımla yoklarken bağlama gibi intermoleküler dinamiklere kolayca erişilebilir hale gelir.
Korelasyon spektroskopisinde temel prensip, lazer odağının içinde ve dışında yayılan floresan etiketli biyomoleküllerin yaydığı yoğunluk dalgalanmalarının istatistiksel analizidir (Şekil 1A). Elde edilen otomatik veya çapraz korelasyon işlevleri daha sonra sonunda faiz oranı sabitlerini türetmek için eğri uydurma ile daha fazla analiz edilebilir. Başka bir deyişle, istatistiksel yöntemler FCS ve FCCS, tek parçacık izlemede olduğu gibi tek molekül izleri sağlamaz, ancak yüksek zamansal çözünürlüğe sahip bir problanmış numunenin dinamik bir deseni veya "parmak izi" sağlar. Förster rezonans enerji transferi (FRET) ile birleştirildiğinde, konformasyon değişiklikleri gibi intramoleküler dinamikler aynı anda ortak bir konfokal kurulumda izlenebilir5,6. FRET iki floroforun mesafesini araştırır ve genellikle moleküler "nanoruler" olarak adlandırılır. Enerji transferi sadece moleküller yakın çevredeyken (< 10 nm) gerçekleşir, donörün emisyon spektrumu, alıcı molekülün emilim spektrumu ile önemli ölçüde örtüşir ve donörün ve alıcının dipol yönelimi (yeterince) paraleldir. Böylece, FRET ve FCCS kombinasyonu çok yüksek mekansal-zamansal çözünürlüğe sahip bir teknik sağlar. Mekansal seçicilik, hassasiyet ve canlı hücre uyumluluğu gerektiğinde, FRET-FCCS protein dinamiklerini ve etkileşimlerini ölçmek için İzotermal Titrasyon Kalorimetresi (ITC)7, Yüzey Plazmon Rezonansı (SPR)8veya Nükleer Manyetik Rezonans (NMR)9,10 gibi diğer yöntemlere göre belirgin avantajlıdır.
Çift renkli floresan çapraz korelasyon spektroskopisi (dc-FCCS) yeteneklerine ve sözüne rağmen, canlı hücrelerde DC-FCCS gerçekleştirmek,3,4, kanallar arasındaki spektral kanama veya çapraz konuşma nedeniyle teknik olarakzordur,spektral olarak farklı lazer çizgileri nedeniyle konfokal hacimlerdeki fark3,4,11, arka plan sinyali, ve gürültü veya örneklerin sınırlı fototability12, 13,14,15. Nabız aralanmış eksitasyonun (PIE) FCCS'ye tanıtılması, kanallar arasındaki spektral çapraz sapını azaltmak için farklı lazer eksitasyonlarını zamansal olarak ayırmak için önemli bir inceayardı 16. Spektral kanamaya karşı koymak için diğer düzeltme yöntemleri17,18,19 ve arka plan düzeltmeleri de iyi kabul edilmiştir17,18,19. FCS, PIE veya FRET ile ilgili ayrıntılar ve temel bilgiler için okuyucu aşağıdaki referanslara atıfta bulunulmaktadır2,4,6,16,20,21,22,23,24.
Burada, üç farklı senaryo için prototipik G-protein bağlantılı reseptörün β2-adrenerjik reseptörün (β2AR) deneysel sonuçlarıyla birlikte gerekli tüm kalibrasyon deneyleri ve analizleri sunulmaktadır: (1) "yeşil" (eGFP) veya "kırmızı" (SNAP etiket tabanlı etiketleme) taşıyan tek etiketli moleküller25 fluorophore; (2) N-terminal SNAP etiketi ve hücre içi eGFP (NT-SNAP) taşıyan çift etiketli bir yapı [bu durumda, her iki etiket de aynı proteindedir. Böylece %100 ortak difüzyon beklenir]; ve (3) her iki floroforun hücre zarının (CT-SNAP) aynı tarafında olduğu çift etiketli bir örnek. C-terminal SNAP etiketi ve hücre içi eGFP taşır. Burada, yine her iki etiket de aynı proteindedir ve yine% 100 ko-difüzyon beklenir. Her iki etiket de birbirine çok yakın olduğundan, hücre zarının aynı tarafında, FRET ve antikor ilişkili davranışı gözlemleme potansiyelini gösterir. Tüm yapılar Çin Hamster Yumurtalık (CHO) hücrelerine transktriye edildi ve daha sonra NT-SNAP yapısı için membran geçirimsiz ve CT-SNAP yapısı için membran geçirgen olan kırmızı bir floresan substrat ile etiketlendi. Son olarak, simüle edilmiş veriler, deneysel parametrelerin FRET kaynaklı antikorrelasyon üzerindeki etkisini ve protein-protein etkileşimlerinin ko-difüzyon genliği üzerindeki etkisini örneklemektedir.
Bu nedenle, bu protokol, teknik / fiziksel eserlerden, zorluklardan ve olası çözümlerden haberdar olurken protein dinamiklerini ve protein-protein etkileşimlerini anlamak için canlı hücrelerde birleşik FRET-FCCS'yi gerçekleştirmek için eksiksiz bir kılavuz sağlar.
Protokol
1. Deneysel Protokol
- Numune hazırlama
NOT: Steril koşullarda hücre tohumlama ve transfeksiyonunu gerçekleştirin.- 6 kuyulu bir kültür tabağına kuyu başına temizlenmiş bir kapak yerleştirin ve steril fosfat tamponlu salin (PBS) ile üç kez yıkayın.
NOT: Kapak temizleme protokolü Ek Not 1'deayrıntılı olarak yer lanır. - Her kuyuya, fenol kırmızısı içeren tam hücre kültürü ortamının 2 mL'sini ekleyin (%10 fetal sığır serumu (FBS), 100 μg/mL penisilin ve 100 μg/mL streptomisin ile desteklenmiştir) ve plakayı bir kenara bırakın.
- CHO hücrelerini 37 °C ve%5 CO2'de fenol kırmızısı içeren aynı ortamda kültüre edin. Ölü hücreleri çıkarmak için hücreleri 5 mL PBS ile yıkayın.
- 2 mL tripsin ekleyin ve oda sıcaklığında (RT) 2 dakika kuluçkaya yaslayın.
- Müstakil hücreleri fenol kırmızısı içeren 8 mL orta ile seyreltin ve pipetleme ile dikkatlice karıştırın.
- Neubauer odasındaki hücreleri sayın ve kapak örtülerini içeren 6 kuyulu hücre kültürü plakasında (adım 1.1.1-1.1.2'de hazırlanan) 1.5 x 105 hücre / kuyu yoğunluğunda tohum.
- Hücrelerin yaklaşık% 80 izdiah elde etmek için24saat boyunca bir inkübatörde (37 °C, % 5 CO 2) büyümesine izin verin.
- İstenen vektör DNA'sının 2 μg'sını (örneğin, CT-SNAP veya NT-SNAP) ve transfeksiyon reaktifinin 6 μL'sini her kuyu için azaltılmış serum ortamının 500 μL'si içeren iki ayrı tüpte seyreltin ve RT'de 5 dakika kuluçkaya yatırın.
- Transfeksiyon karışımını elde etmek için iki çözeltiyi karıştırın ve RT'de 20 dakika kuluçkaya yatırın.
- Bu arada, tohumlu CHO hücrelerini steril PBS ile bir kez yıkayın.
- PBS'i antibiyotiksiz %10 FBS ile desteklenmiş 1 mL/kuyu fenol kırmızı içermeyen ortamla değiştirin.
- 1 mL transfeksiyon karışımının tamamını her kuyuya damla yönünde ekleyin ve hücreleri bir gecede 37 °C'de% 5 CO2'dekuluçkaya bırakın.
- SNAP yapının etiketlenerek, uygun SNAP substrat stok çözeltisini% 10 FBS ile desteklenmiş ortamın 1 mL'sinde seyrelterek 1 μM'lik son bir konsantrasyon elde edin.
- Transfected hücreleri PBS ile bir kez yıkayın ve 1 μM SNAP substrat çözeltisinin kuyusu başına 1 mL ekleyin. Hücreleri% 5 CO 2'de 37 ° C'de20dakika kuluçkaya yatırın.
- Hücreleri fenol kırmızı içermeyen ortamla üç kez yıkayın ve kuyu başına 2 mL fenol kırmızı içermeyen ortam ekleyin. Hücreleri% 5 CO2'de37 ° C'de 30 dakika kuluçkaya yatırın.
- Tüm numunelerin kapaklarını daha sonra görüntüleme odasına aktarın ve 500 μL görüntüleme tamponu ile yıkayın. FRET-FCS kurulumuna geçmeden önce 500 μL görüntüleme tamponu ekleyin.
- 6 kuyulu bir kültür tabağına kuyu başına temizlenmiş bir kapak yerleştirin ve steril fosfat tamponlu salin (PBS) ile üç kez yıkayın.
- Kalibrasyon Ölçümleri
NOT: FRET-FCS kurulumu bir konfokal mikroskop su hedefi, iki lazer hattı, bir Time-Korelated Tek Foton Sayma (TCSPC) sistemi, iki hibrit fotomultiplier tüp (PMT) ve foton toplama ve veri toplama yazılımı için iki çığ fotodiyot (APD) ile donatılmıştır. Canlı hücre ölçümlerinden önce kurulumu her seferinde hizalamak çok önemlidir. Ayrıntılı kurulum açıklaması Ek Not 2'de bulunabilir. Tüm ölçümlerin aynı koşullarda yapılması gerektiğinden, ölçümler sırasında hem lazerler hem de tüm dedektörler (iki PMT ve iki APD) her zaman AÇıKTıR. Kalibrasyon ölçümleri için, hücrelerin tohumladığı aynı lottan bir kapak kip kullanın, bu yaka halkası düzeltmeslerindeki varyasyonu azaltır.- Odak, iğne deliği ve yaka halkası konumunu ayarlamak için, cam bir kapak ucuna 2 nM yeşil kalibrasyon çözeltisi yerleştirin ve 485 nm ve 560 nm lazeri kapatın. Lazeri Pulsed Interleaved Excitation (PIE) modunda çalıştırın16.
- Çözeltiye odaklanın ve iğne deliği ve yaka halkası konumunu, maksimum moleküler parlaklığı elde etmek için en yüksek sayım oranı ve en küçük konfokal hacim elde olacak şekilde ayarlayın.
- 10 nM kırmızı kalibrasyon çözeltisi ve her ikisinin de yeşil ve kırmızı kalibrasyon çözeltisinin bir karışımı ile kırmızı kanallar için bu işlemi tekrarlayın.
- 10 nM DNA çözeltisini bir cam kapak ucuna yerleştirin ve odak, iğne deliği ve yaka halkası konumunu yeşil ve kırmızı algılama kanalları arasındaki çapraz korelasyonun en yüksek olduğu, yani en yüksek genliği gösteren şekilde ayarlayın.
NOT: En uygun hizalamayı bulmak için adım 1.2.1 ve 1.2.4'ün ileri geri tekrarlanması gerekebilir. Odak, iğne deliği ve yaka halkası konumu yeşil ve kırmızı algılama kanalları ve konfokal örtüşme hacmi için en uygun şekilde hizalandıktan sonra 30 s - 120 s için her kalibrasyon çözümünden 3-5 ölçüm alın. - Arka plan sayım oranlarını belirlemek için 30 s -120s için ddH 2 O, görüntüleme ortamı ve transfected olmayan bir hücrenin her biri 3-5 kez ölçün.
- 30 s - 120 s için 3-5 ölçümle cihaz tepki işlevini toplayın. Bu isteğe bağlıdır, ancak şiddetle tavsiye edilir.
- Canlı hücre ölçümleri
- Cıva lambası ile aydınlatarak ve oküler gözleyerek uygun bir hücre bulun.
NOT: İlgili yapışan hücre hattının tipik morfolojisini gösteren uygun hücreler canlıdır. İlgi proteininin floresan, burada bir yüzey reseptörü, yüzeyin her yerinde görülebilir. Daha az parlak hücreler, düşük sayıda molekül odakta olduğunda FCS'deki daha iyi kontrast nedeniyle daha parlak olanlardan daha uygundur. - PIE modunda her iki lazeri de aç ve saniyede maksimum sayıya bakarak zara odaklan.
NOT: Hücre örnekleri için lazer gücünün azaltılması gerekebilir (objektif olarak 5 μW'tan az). Bu, kullanılan floroforlara ve kuruluma bağlıdır. - Veri toplama yazılımının çevrimiçi önizlemesinde eGFP'nin otomatik ve çapraz korelasyon eğrilerini veya β2AR'ye bağlı ETIKETLi SNAP etiketini gözlemleyin ve 60-180 s arasında bir alım süresine sahip birkaç kısa ölçüm (~2 -10) toplayın.
NOT: Floroforlar ağartabileceği için hücreleri sürekli olarak uzun süre heyecanlandırmayın. Bununla birlikte, her hücrenin parlaklığına, ölçümlerin ne kadar süre olabileceğine ve toplamda kaç ölçüm yapılabildiğine bağlı olacaktır.
- Cıva lambası ile aydınlatarak ve oküler gözleyerek uygun bir hücre bulun.
2. Veri analizi
- Veri Verme
- Korelasyon eğrilerini, G(tc) ve sayım oranlarını, CR'yi tüm ölçümlerden dışa aktarın.
- "İstem" ve "gecikme" zaman pencerelerini doğru tanımlamaya ve veri korelasyon yazılımında "microtime gating" seçeneğini kullanmaya özenin.
NOT: Toplamda üç farklı korelasyon gereklidir: (1) yeşil kanalın istemi zaman penceresinde otomatik korelasyonu(ACFgp),(2) gecikme süresi penceresindeki kırmızı kanalların otomatik korelasyonu (ACFrd) ve son olarak (3) yeşil kanal sinyalinin gecikme süresi penceresindeki kırmızı kanal sinyaliyle çapraz korelasyonu(CCFPIE). Veri dışa aktarma, Tamamlayıcı Not 3'te farklı yazılımlar için adım adım gösterilir.
- Kalibrasyon ölçümleri
- Yeşil (ACFgp) ve kırmızı (ACFrd) florofor çözeltilerinin otomatik algılama işlevlerini kullanın ve kullanılan iki renk kanalı için konfokal algılama hacminin şeklini ve boyutunu kalibre etmek için gerekirse (örneğin 1) ek bir üçüz terimli bir 3D difüzyon modeline takın:
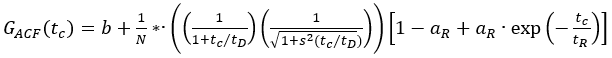 eq. 1
eq. 1
Burada, b eğrinin temeli, N odaktaki molekül sayısı, tD difüzyon süresi (ms içinde) ve s = z0/w0 konfokal hacim öğesinin şekil faktörüdür. Üçüz yanıp sönen veya diğer fotofizik, genliği birR ve gevşeme süresi tRile tanımlanır.
NOT: Protokol içinde kullanılan tüm değişkenler ve semboller Tablo 1'de listelenmiştir. - Konfokal hacim elemanının (eq. 2a-c) boyutlarını (genişlik w0 ve yükseklikz 0) ve hacim Veff'ini belirlemek için yeşil 26 ve kırmızı kalibrasyon standardı27için bilinen D difüzyon katsayılarını ve elde edilen şekil faktörlerini yeşil ve skırmızı olarak kullanın.
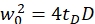 eq. 2a
eq. 2a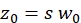 eq. 2b
eq. 2b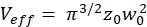 eq. 2c
eq. 2c
NOT: Kalibrasyon parametresinin hesaplanması için şablonlar ek dosyalar (S7) olarak sağlanır. - Yeşil floresan sinyalinin (0 ve 2 kanallarında toplanan) kırmızı algılama kanallarına (kanal numarası 1 ve 3) arka planda düzeltilmiş (BG) sinyallerin bir oranı olarak α spektral çapraz konuşma α hesaplayın (eq. 3).
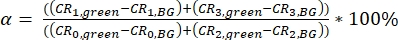
eq. 3 - Bağışçının heyecan verici dalga boyu tarafından δ kabul eden floroforun doğrudan heyecanlanması, "prompt" zaman penceresindeki kırmızı kalibrasyon ölçümlerinin arka planda düzeltilen sayım oranının (yeşil lazerle heyecanlanma) "gecikme" zaman penceresindeki (kırmızı lazerle heyecanlanma) arka planda düzeltilen sayım oranına oranına göre belirlenir (eq. 4).
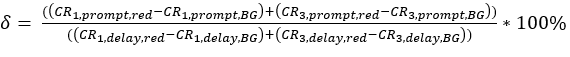
eq. 4 - Hem yeşil hem de kırmızı floroforların (eq. 5a-b) moleküler parlaklığını, arka planda düzeltilmiş sayım oranlarına ve odaktaki elde edilen molekül sayısına göre hesaplayın, N, 3D difüzyon uyumundan (eq. 1):
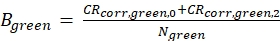 eq. 5a
eq. 5a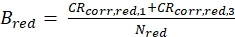 eq. 5b
eq. 5b - 3D difüzyon modeline hem ACF gp hem de ACFrd hem de çift etiketli DNA'nın CCFPIE'ını takın (eq. 1). Elde edilen şekil faktörlerini, syeşil ve skırmızı, ACFgp ve ACFrdiçin sabit tutun. CCFPIE, sPIE için şekil faktörü genellikle bu iki değer arasındadır.
NOT: İdeal bir kurulumda, hem Veff,hem yeşil hem de Veff, kırmızı aynı boyuta sahip olur ve mükemmel bir şekilde üst üste binar. - Odaktaki molekül sayısının bulunan değerlerine (Nyeşil , N kırmızı ve NPIE)bağlı olarak, sıfır korelasyon süresi olan G0(tc) genliğini belirleyin.
- Yeşil ve kırmızı floroforların %100 birlikte yayılmasına sahip bir numune için genlik oranı rGR ve rRG'yi hesaplayın (eq. 6). NPIE'ın odaktaki çift etiketli molekül sayısını yansıtmadığını, sadece 1/G0(tc)yansıttığını unutmayın.
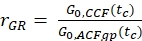 ve
ve 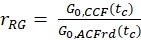 eq. 6
eq. 6
- Yeşil (ACFgp) ve kırmızı (ACFrd) florofor çözeltilerinin otomatik algılama işlevlerini kullanın ve kullanılan iki renk kanalı için konfokal algılama hacminin şeklini ve boyutunu kalibre etmek için gerekirse (örneğin 1) ek bir üçüz terimli bir 3D difüzyon modeline takın:
- Canlı hücre denemeleri
- Tek etiketli yapılar için hücre örneklerini uygun bir modele sığdırın. Gösterilen membran reseptörü için difüzyon, kısa ve uzun bir difüzyon süresi ile bimodal bir şekilde gerçekleşir. Ek olarak, fotofizik ve floroforların yanıp sönme göz önünde bulundurulmalıdır:
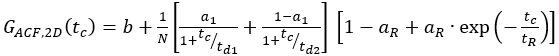 eq. 7
eq. 7
Burada, td1 ve td2 gerekli iki difüzyon süresidir ve 1 ilk difüzyon süresinin kesirleridir.
NOT: Serbest boyaların ve DNA iplikçiklerinin her yöne serbestçe dağıldığı kalibrasyon ölçümlerinin aksine, membran reseptörü hücre zarları boyunca sadece 2D difüzyon gösterir. 3D ve 2D difüzyon arasındaki bu fark, 2D durumda tD'nin konfokal hacim öğesinin şekil faktörü s'lere bağlı olmadığı değiştirilmiş difüzyon terimi (eşlem 1 ile karşılaştırın) tarafından yansıtılır. - Temel matematiği kullanarak ilgili N ve V eff'den yeşil veya kırmızı etiketli proteinlerin c konsantrasyonunun hesaplayın (eq. 8):
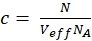 eq. 8
eq. 8
burada NA = Avogadro'nun numarası - N-terminal SNAP etiketi ve hücre içi eGFP için, IKI taraflı örneklemlerin iki otomatik tutarlılığına (ACFgp ve ACFrd) acf'ler için tek etiketli yapılar (örneğin 7) ve CCFPIE için bimodal difüzyon modeli (eq. 9) kullanarak aynı modeli kullanarak sığdırın:
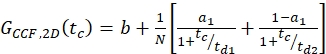 eq. 9
eq. 9
NOT: Sistemin genel bir açıklaması için, üç eğrinin de ortaklaşa sığdırılması gerekir: Difüzyon terimi her üç eğri için de aynıdır ve tek fark CCFPIEiçin gevşeme terimidir. İki floroforun fotofizikleri genellikle ilgisiz olduğundan, korelasyon terimi gerekmez. Gevşeme terimlerinin bu yokluğu, kısa korelasyon sürelerinde düz bir CCFPIE ile sonuçlanır. Bununla birlikte, donör floroforu nedeniyle alıcının çapraz konuşma ve doğrudan çıkarılması yanlış-pozitif genlikler gösterebilir ve kalibrasyon ölçümlerini kullanmak için dikkatlice kontrol edilmelidir. - Denklem 8 kullanarak ilgili N ve Veff'den yeşil veya kırmızı etiketli proteinlerin c konsantrasyonunun hesaplayın.
- DNA örneklerinden elde edilen düzeltme faktörlerini, hücre örneğinin genlik oranlarını r GR ve r RG'yive ilgili elde edilen konsantrasyonlarını kullanarak hücre örneklerinden yeşil ve kırmızı etiketli proteinlerin etkileşime girmesinin c GR veya c RG olan fraksiyonunu veya konsantrasyonunu tahmin edin (eq. 10).
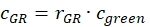 ve
ve 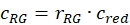 eq. 10
eq. 10 - C-terminal SNAP etiketi ve hücre içi eGFP için, FRET örneğinin iki otomatik korelasyonunu (ACFgp ve ACFrd) tek etiketli örnekler (denklem 7) ve CCFFRET'i korelasyon önleyici terim içeren bir bimodal difüzyon modeline (denklem 11) sığdırın
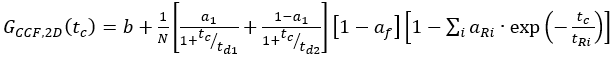 eq. 11
eq. 11
burada birf, toplam anti-korelasyonun genliğini ve ilgili genlik ve gevşeme süresininR ve tR'sını yansıtır.
NOT: FRET'e bağlı anti-korelasyonlu floresan değişiklikleri durumunda, bir veya birkaç korelasyon karşıtı terim gerekebilir (eq. 11), iki otomatik korelasyonda(ACFgp ve ACFrd)bir yükselişle çakışan düşük korelasyon zamanlarında CCFFRET'in "düşüşü" ile sonuçlanır. Bununla birlikte, üçlü yanıp sönme gibi fotofiziklerin FRET kaynaklı anti-korelasyonu sönümleyerek anti-korelasyon terimini maskeleyebileceğini unutmayın. Filtrelenmiş FCS yöntemleriyle desteklenmiş bir ortak analiz, korelasyon önleyici terimin maskesini düşürmeye yardımcı olabilir. Ayrıca, nanosaniye aralığındaki sayım elektroniğindeki ölü zamanlardan kaynaklanan teknik eserler hariç tutulmalıdır16. ChiSurf28'de analizin nasıl gerçekleştirildiğine dair daha ayrıntılı bir adım adım prosedür ve konfokal hacim veya moleküler parlaklığın hesaplanması için şablonlar Github deposunda (https://github.com/HeinzeLab/JOVE-FCS) ve ek dosyalar olarak sağlanmaktadır (Tamamlayıcı Not 4 ve Tamamlayıcı Not 6). Ayrıca, .ptu biçiminde Symphotime yazılımıyla elde edilen verilerin toplu olarak dışa aktarılması için python komut dosyaları burada bulunabilir.
- Tek etiketli yapılar için hücre örneklerini uygun bir modele sığdırın. Gösterilen membran reseptörü için difüzyon, kısa ve uzun bir difüzyon süresi ile bimodal bir şekilde gerçekleşir. Ek olarak, fotofizik ve floroforların yanıp sönme göz önünde bulundurulmalıdır:
Sonuçlar
Kalibrasyon ve canlı hücre ölçümlerinin örnek sonuçları aşağıda tartışılmıştır. Ek olarak, FRET'in çapraz korelasyon eğrileri üzerindeki etkisi, CCFPIE genliğini artıran protein-protein etkileşiminin etkisinin yanında simüle edilmiş verilere dayanarak gösterilmiştir.
PIE tabanlı FCS veri dışa aktarma
PIE denemelerinde, veriler zaman etiketi zaman çözümlenen modunda (TTTR)29,30'da toplanır. Şekil 1B, açıklanan kurulumda çift etiketli bir DNA ipliğinin PIE ölçümünün foton varış saati histogramlarını gösterir (Tamamlayıcı Not 1). Kurulumun dört algılama kanalı vardır. Floresan emisyonu ilk olarak "S" ve "P" yönlerindeki polarizasyonla bölünür (bir ışık dalgasının elektrik alanının salındığı dik ve paralel düzleme atıfta bulunarak). İkincisi, her polarizasyon yönü tespit etmeden önce iki renk kanalına (yeşil, kırmızı) bölünür ve dört kanal (S-yeşil, S-kırmızı, P-yeşil, P-kırmızı) ile sonuçlanır. "İstem" zaman penceresinde, yeşil florofor heyecanlanır ve sinyal FRET nedeniyle hem yeşil hem de kırmızı kanallarda algılanır. Gecikme süresi penceresinde, yalnızca kırmızı florofor (kırmızı kanalda) görülebilir. Algılama kanallarına ve "prompt" ile "gecikmeli" zaman pencerelerine göre, en az beş farklı korelasyon eğrisi (3 otomatik korelasyon eğrisi (AF) ve 2 çapraz korelasyon eğrisi (CCF)) elde edilebilir (Şekil 1C-D): (1) istemi zaman penceresinde yeşil sinyal (ACFgp), (2) istemi zaman penceresinde kırmızı sinyal (FRET durumunda, ACFrp), ve (3) gecikme süresi penceresinde(ACFrd)kırmızı sinyal. Bu AFO'lar protein hareketliliği, fotofizik (örneğin, üçüz yanıp sönme) ve floroforlardaki diğer zaman ilişkili parlaklık değişikliklerini (örneğin, FRET nedeniyle) rapor eder. (4) Gecikme süresi penceresindeki kırmızı sinyal ile istemi zaman penceresindeki yeşil sinyalin PIE tabanlı çapraz korelasyonu CCFPIE, yeşil ve kırmızı floroforun ortak difüzyonunun fraksiyonunun belirlenmesini sağlar16. (5) FRET tabanlı çapraz korelasyon CCFFRET, yeşil ve kırmızı sinyallerdeki FRET kaynaklı, antikor ilişkili parlaklık değişiklikleri ile ilgilidir31,32,33.
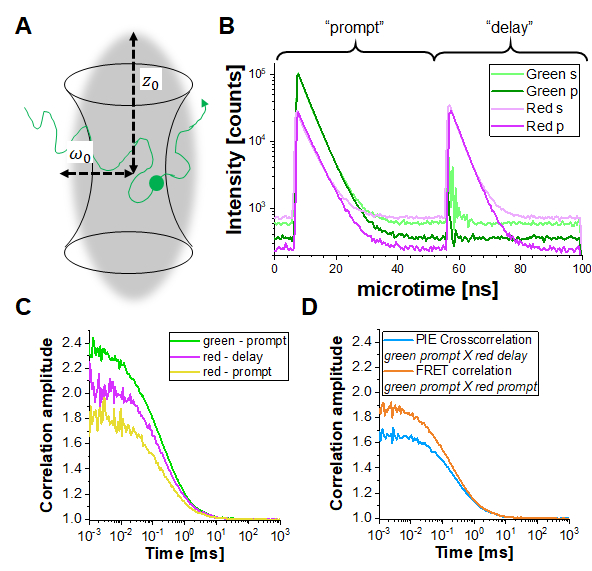
Şekil 1: Darbeli-interleaved ekscitasyon (PIE) bazlı floresan (çapraz) korelasyon spektroskopisi (F(C)CS). (A) FCS floresan etiketli moleküllerde, bu küçük hacimde floresan indükleyen odaklanmış bir lazer ışını tarafından şekillendirilen (kırınım sınırlı) bir odak hacmine serbestçe yayılır. Hacime giren ve çıkan moleküllerin ortaya çıkan yoğunluk dalgalanmaları ilişkilidir ve moleküllerin hareketliliği hakkında bilgi sağlar. (B) PIE'da, iki farklı floroforla etiketlenmiş örneği ("yeşil" ve "kırmızı") heyecanlandırmak için iki farklı lazer çizgisi ("istem" ve "gecikme") kullanılır. Her iki uyarlama darbesi arasındaki zaman farkı, ilgili floroforların floresan ömürlerine uyarlanır, böylece biri diğeri heyecanlanmadan önce çürümüş olur. Gösterilen çift etiketli örnekte, her iki floresan da "yeşil" donör floroforundan "kırmızı" kabul eden florofora kadar Förster Rezonans Enerji Transferi (FRET) geçirmek için yeterince yakındır. Böylece, yeşil donörün çıkarılması üzerine "hızlı" zaman penceresinde kırmızı floresan emisyonu tespit edilebilir. Kullanılan kurulumda (Tamamlayıcı Not 2), her renk için biri ekscitasyon ışını yönüne paralel ("p" olarak gösterilir) ve ikinci dik ("s" olarak gösterilir) olmak üzere iki dedektör kullanılır. (C) Bir PIE deneyinde üç farklı otomatik korelasyon işlevi belirlenebilir: i) istem süresi penceresindeki yeşil kanal sinyallerinin korelasyonu(ACFgp),ii) istem süresi penceresindeki kırmızı kanal sinyalleri(ACFrp) ve iii) gecikme süresi penceresindeki kırmızı kanal sinyalleri (ACFrd). (D) İki farklı çapraz korelasyon fonksiyonu belirlenebilir: iv) Bu eğrinin genliğinin floroforların ortak difüzyonu ile ilişkili olduğu gecikme penceresindeki kırmızı kanal sinyalleriyle ilişkili, istemi zaman penceresindeki yeşil kanal sinyalleri ile"PIE"çapraz korelasyonu ( CCF PIE ); ve v) "FRET" çapraz korelasyonu (CCFFRET) aynı istemi penceresindeki kırmızı kanal sinyalleriyle ilişkili istemi zaman penceresindeki yeşil kanal sinyalleri ile; burada bu eğrinin difüzyondan daha hızlı zaman zaman şekli FRET kaynaklı yoğunluk değişiklikleri ile ilgilidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kalibrasyon
Şekil 2A-B, sırasıyla tek tek dağınık yeşil ve kırmızı floroforların kalibrasyon ölçümünü gösterir. Eq. 1 ve bilinen difüzyon katsayısı Dyeşili 26 ve Dkırmızısı27 olan bir uyum temel alınarak, algılama hacminin şekli (z 0 ve w 0) ve boyutu ( Veff) eq. 2a-c kullanılarak hesaplanır. Yeşil florofordan ACFgp ve kırmızı florofordan ACFrd'den elde edilen uyum sonuçları Şekil 2C'deözetlenmiştir. Her iki florofor da sırasıyla 8,6 μs (%18) ve 36 μs (%15) ek gevşeme süresi sabiti gösterir. Yeşil ve kırmızı floroforun moleküler parlaklığı (eq. 5a-b) molekül başına 12,5 kHz ve molekül başına 2,7 kHz'dir.
Konfokal hacim boyutunun ve şeklinin yanı sıra moleküler parlaklığın güvenilir bir tahmini için, kalibrasyon deneyleri başına 3-5 ölçüm ve tüm tekrarların eklem (veya küresel) bir uyumu yapılması önerilir.
Çapraz konuşma α(Şekil 2D, eq. 3) ve bu florofor çifti için yeşil lazer δ(Şekil 2E, eq. 4) tarafından doğrudan kabul edilenin doğrudan çıkarılması sırasıyla ~ % 15 ve ~ % 38'de yatmıştır.
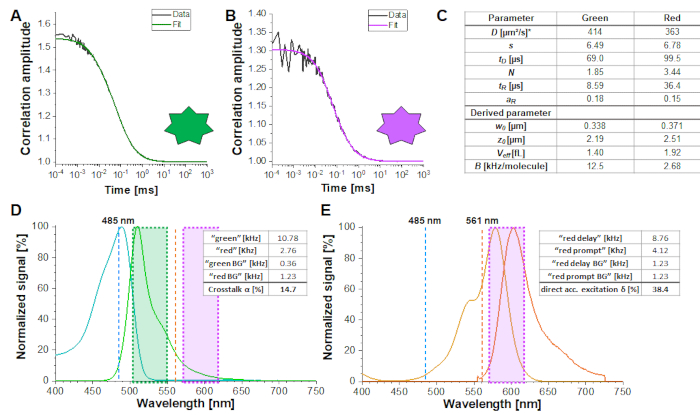
Şekil 2: Serbestçe yayılan yeşil ve kırmızı kalibrasyon standardının kalibrasyon ölçümleri. (A-B) Temsilci 60 s 2 nM yeşil (A) ve 10 nM kırmızı (B) kalibrasyon standart ölçümü ek bir gevşeme süresi de dahil olmak üzere 3D difüzyon modeline monte edilmiştir (eq. 1). Paneldeki tablo (C) sığdırma sonuçlarını ve eq. 2a-c ve eq. 5a-b'yedayalı türetilmiş parametreyi gösterir. *Difüzyon katsayıları literatürden alınmıştır26,27. (D) Yeşil sinyalin kırmızı kanallara α çapraz konuşma tayini (eq. 3). Yeşil standardın heyecan spektrumu, yeşil emisyon spektrumu olan siyanda gösterilir. 485 nm (mavi) ve 561 nm (turuncu) olan heyecan lazer hatları kesik çizgiler olarak gösterilir. Şeffaf yeşil ve macenta kutuları toplanan emisyon aralığını gösterir (Tamamlayıcı Not 2). (E) Kırmızı floroforun doğrudan ekscitasyon δ 485 nm lazer tarafından belirlenmesi (eq. 4). Renk kodu (D) ile aynıdır, açık ve koyu turuncu sırasıyla kırmızı standardın uyarımını ve emisyon spektrumunu gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Yeşil ve kırmızı ekscitasyon hacminin çakışmasını belirlemek ve kalibre etmek için, yukarıda açıklandığı gibi çift etiketli bir DNA çift iplikçik kullanılır (Şekil 3A). Burada, floroforlar 40 bp aralıklıdır, böylece DNA çift iplikçiklerinin uçlarına bağlı yeşil ve kırmızı floroforlar arasında FRET meydana gelemez. Şekil 3B, yeşil (ACFgp) ve macenta ( ACFrd) ve PIE-çapraz korelasyonu, CCFPIE, camgöbeğindeki floroforlardan gelen otomatik korelasyonları göstermektedir. CCFPIEiçin, istemin zaman penceresindeki yeşil kanallardaki sinyalin, gecikme süresi penceresindeki kırmızı kanallardaki sinyalle ilişkili olduğunu lütfen unutmayın16.
Burada DDNA 'sının DNA zinciri = 77 μm²/s için ortalama difüzyon katsayısı elde edilir. Hesaplama hakkında daha fazla ayrıntı adım adım protokolde bulunabilir, Tamamlayıcı Not 4. Bu değer, kalibre edilmiş yeşil ve kırmızı algılama hacimleri boyutu (Şekil 2) ve DNA ipliğinin ACFgp ve ACF rd'nin ilgili difüzyon süreleri (Şekil 3C) denklem 2a'ya eklenerek elde edilir. Daha sonra, elde edilen düzeltme değerleri rGR ve rRG kullanılarak ve daha sonra eq. 6 kullanılarak, hücre örneklerinden ko-difüzyon miktarı, yani çift etiketli moleküller (veya iki farklı proteinin birlikte transfeksiyonu durumunda protein kompleksleri) belirlenebilir.
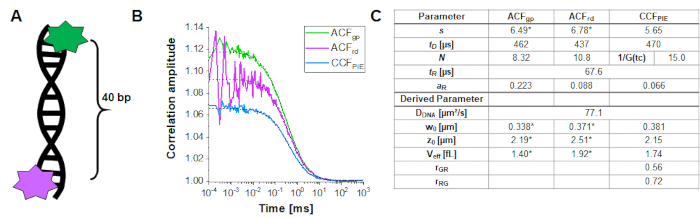
Şekil 3: Bir DNA örneği kullanılarak yeşil-kırmızı örtüşme hacminin kalibrasyonu. (A) Kalibrasyon için kullanılan DNA teli, arada 40 bp mesafe olan yeşil ve kırmızı kalibrasyon floroforu taşır. Floroforlar arasındaki FRET'i dışlamak için interdye mesafesi yeterince büyük olmalıdır. (B) 10 nM DNA çözeltisinin temsili 60 s ölçümü. Hem yeşil(ACFgp, yeşil standart) hem de macenta(ACFrd, kırmızı standart) ve PIE-crosscorrelation, CCFPIE, mavi floresanlardan otomatik olarak elde edilenler. Paneldeki tablo (C) ek bir gevşeme terimi ( eq. 1 ) ve DNA, DDNA (eq. 2a)türetilmiş parametre difüzyon katsayısı dahil olmak üzere 3D Difüzyon modeline dayalı uyum sonuçlarını gösterir, örtüşme hacminin boyutu ve şekli (eq. 2a-c) ve düzeltme oranları r ve gr ve rRG (eq. 6q. ). Yeşil ve kırmızı algılama hacmine ilişkin değerlerin (*ile etiketlenmiş) Şekil 2'degösterilen bireysel floroforların uyumundan alındığını lütfen unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Canlı hücre deneyleri
Aşağıdaki bölümde, farklı β2AR yapıları için canlı hücre deneylerinin analizi sunulmuştur. β2AR bir membran proteini olduğundan, difüzyonu büyük ölçüde hücre zarı boyunca iki boyutlu bir difüzyonla(Şekil 4A)sınırlıdır (membrana veya membrandan taşıma veya geri dönüşüm işlemleri hariç) 2. 2B difüzyonun kısıtlanmasıyla, s = z0/w0 eq'da şekil faktörü 1 eskir ve basitleştirilmiş bir difüzyon modeliyle sonuçlanır (eq. 9).
Tek etiketli yapılar: β2AR-IL3-eGFP ve NT-SNAP-β2AR
Şekil 4, eGFP'nin hücre içi döngü 3'e eklendiği2AR-IL3-eGFP(Şekil 4B)ve SNAP etiketinin2AR'β N-terminusuna eşlendiği NT-SNAP-β 2 AR (Şekil 4C)yapısına β tek etiketli yapının örnek ölçümlerini göstermektedir. SNAP etiketi, membran geçirimsiz SNAP yüzey alt tabakası ile etiketlenmiştir. Temsili eğriler, her biri 120 - 200 sn alım süreleri ile 4-6 tekrarlanan ölçümün ortalamasını gösterir. EGFP ve SNAP sinyalinin ilgili otomatik düzeltmeleri ACFgp ve ACFrd, bimodal, iki boyutlu difüzyon modeline (eq. 9) takılmıştır. Hızlı dinamikler açısından, eGFP yalnızca beklenen üçlünün tR1 ~ 9 μs'de yanıp söndüğünü gösterirken, SNAP sinyali iki gevşeme süresi gerektirir, biri tR1 ~ 5 μs'nin tipik üçüz yanıp sönme zamanında ve ikincisi tR2 ~ 180 μs'de.
Canlı hücrelerdeki floroforların moleküler parlaklığı, verilen uyarılma koşulları altında molekül başına 0,8 KHz (eGFP) ve 1,7 kHz 'dir (SNAP). Hücre zarında bulunan etiketli β2AR yapının konsantrasyonu nano-molar aralığında olmalıdır ve ortalama molekül sayısı (eq. 9, Şekil 4C)ve yeşil ve kırmızı kanal için ilgili konfokal hacmin büyüklüğü (Şekil 2) kullanılarak belirlenebilir.
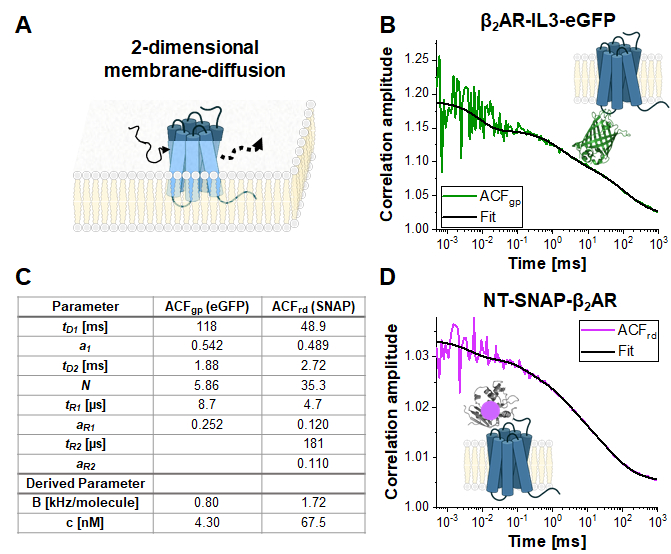
Şekil 4: Tek etiketli yapıların temsili ölçümü. (A) Bu çalışmada2AR β membran reseptörü örnek olarak kullanılmıştır. Kalibrasyon için kullanılan ve algılama hacmi boyunca serbestçe yüzebilen floroforların ve DNA iplikçiklerinin aksine, membran proteinleri esas olarak 2 boyutlu difüzyon olarak tanımlanan membran boyunca yanal olarak yayılır. (B, D) TEK ETIKETLİ yapıların ACFgp ve ACFrd β2AR-IL3-eGFP (B) ve NT-SNAP-β2AR (D). Gösterilen, her biri 120 - 200 s için toplanan 4-6 ölçümün ortalamasıdır. Paneldeki tablo (C) verilerin ek gevşeme terimleri de dahil olmak üzere bimodal iki boyutlu difüzyon modeline uygun sonuçlarını gösterir (eq. 7). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Çift etiketli yapı: NT-SNAP-β2AR-IL3-eGFP
Nt-SNAP-β2AR-IL3-eGFP (kısa NT-SNAP) yapısında, eGFP hücre içi döngü 3'e eklenir ve SNAP etiketi β2AR'nin N-terminusuna eşlenmiştir (Şekil 5A). Bu yapılandırmada, eGFP membranın iç tarafında ve SNAP dış tarafta FRET için çok büyük mesafelerle. İdeal bir durumda, bu yapı yeşil ve kırmızı floroforun% 100 ortak difüzyonunu gösterecektir ve FRET sinyali göstermez. Şekil 5B-D, iki farklı ölçüm gününde iki hücrede NT-SNAP'in iki ölçümünü gösterir. Şekil 5B'de gösterilen "daha iyi" ölçümün ACFgp ve ACFrd'sini eq. 7 ve CCFPIE'da eq. 9 ile sığdırarak, ACFgp ve ACFrdiçin odakta 50- 60 molekül ortaya çıkar, bu nedenle Nuygulaması, böylece CCFPIE için 1/G0(tc) ~ 114 (Şekil 5C ). Etiketli reseptörlerin konsantrasyonu, eq. 8 ile belirlenen ~100 nM aralığında yatmaktadır. Çift etiketli moleküllerin ortalama konsantrasyonunun belirlenmesi için, ilk olarak, CCFPIE'ın G0(tc) (1 /N(uygulama)ile temsil edilir) sırasıyla ACFgp ve ACFrd'ye oranı hesaplanır (eq. 6). Daha sonra, bu değerler, rGRcell= 0.43 ve rRGcell = 0.53 DNA ölçümünden elde edilen değerlerle karşılaştırılır (rGR, DNA= 0.51 ve rRG,DNA = 0.79 bu ölçüm gününde). Oran kuralını kullanarak, eGFP sinyalinin ACF gp'sinden bir rGRcell= 0,43, SNAP substrat sinyalinin diğer ACFrd durumu için bu değerin 0,67 olduğu 0,84'lük bir ortak difüzyon (rGRcell/rGR,DNA) kısmına yansır. Çift etiketli NT-SNAP yapının ortalama konsantrasyonu nihayet eq. 10 temel alınarak hesaplanabilir. Buna karşılık, farklı bir günden Şekil 5D'de gösterilen ölçümde, reseptörlerin konsantrasyonu oldukça düşüktür ve veriler çok gürültülüdür, böylece sığma aralığı ~ 10 μs'ye kadar sınırlıdır. Ek olarak, sadece düşük miktarda ko-difüzyon gözlenir (%15 - 26).
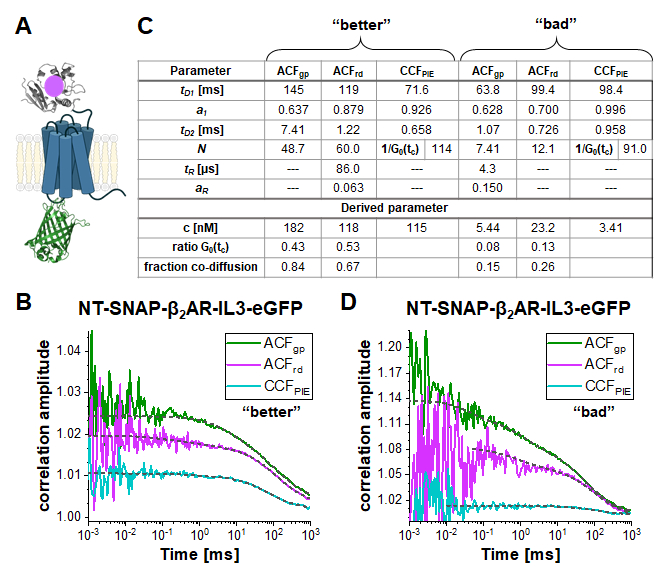
Şekil 5: Çift etiketli NT-SNAP-β2AR-IL3-eGFP yapısı. (A) Çift etiketli yapıda, eGFP hücre içi döngü 3'e ve snap etiketi β2AR'nin (NT-SNAP) N-terminusuna eklenir. (B, D) ACFgp, ACFrd ve CCFPIE çift etiketli yapının iki ölçümü. Veriler bimodal iki boyutlu difüzyon modeline(eq. 9, CCFPIE) uygundur ve ek gevşeme terimleri(eq. 7, ACFgp ve ACFrd)dahildir. Paneldeki tablo (C) sığdırma sonuçlarını ve türetilmiş parametre konsantrasyonunu (eq. 8), korelasyon genliğinin sıfır korelasyon süresindeki oranını (G0(tc) ve birlikte yayılan moleküllerin fraksiyonunu gösterir (eş. 10). Ölçümlerin farklı günlerde elde edildiğini, bu nedenle genlik düzeltmesi için biraz farklı faktörlerin kullanıldığını lütfen unutmayın (B: rGR, DNA = 0.51 ve r RG,DNA = 0.79; D: rGR,DNA = 0,51 ve rRG,DNA = 0,56). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
FRET'e tabi olan çift etiketli yapı: β2AR-IL3-eGFP-CT-SNAP
2AR-IL3-eGFP-CT-SNAP ( Şekil6A)β çift etiketli yapıda, eGFP, C-terminusa iliştirilmiş SNAP etiketiyle NT-SNAP-β2AR-IL3-eGFP yapısıyla aynı hücre içi döngü 3'e yerleştirilir. Burada, her iki etiket de hücrelerin plazma zarının aynı tarafındadır, böylece floroforlar yakın çevrededir, böylece FRET söndürülen eGFP ömründe belirtildiği gibi gerçekleşir(Ek Not 5). C-terminus34 gibi nispeten yapılandırılmamış protein bölgelerinin esnekliği ve GPCRs35, "yüksek FRET" (HF) veya "düşük FRET" (LF) gibi en az iki farklı protein uyumunun esnekliği göz önüne alındığında, eGFP-SNAP mesafe değişiklikleri nedeniyle FRET verimliliğindeki dinamik değişiklikler CCFFRET'te bir antikorrelasyon terimi ile gözlemlenebilir ve tanımlanabilir (Şekil 6B'deki turuncu eğri) ). Reseptör aynı anda HF veya LF olmak üzere sadece bir durumda olabileceği için FRET dalgalanmalarının antikor ilişkili olduğu gösterilmiştir. Beş korelasyon eğrisinin de eklem (veya küresel) uyumu (Şekil 6B), ~100 ms'de yavaşça yayılır moleküllerin ~% 70'ini ortaya, geri kalanı ise ~ 1 ms ile yayılır. Tüm otomatik düzeltmeler ve CCFFRET 37 μs ve 3 μs'de gevşeme terimleri gösterir; kırmızı sinyalin hakim olduğu korelasyonlar (ACFrp, ACFrd ve CCFFRET) ek bir yavaş bileşen ~ 50 ms (Şekil 6C)gösterir.
CCFFRET'te farklı koşullar altında FRET kaynaklı değişiklikler (Şekil 6D) LF ve HF durumları arasında 70 μs dalgalanma süresine sahip iki durumlu bir sistemin bir dizi simülasyon ile gösterilmiştir. LF'den HF durumuna geçtikten sonra, tonlamalı sinyaldeki değişiklikler istemi zaman penceresinde gözlenir: Yeşil sinyal azalır ve kırmızı sinyal artar (bunun tersi HF -> LF anahtarlama için). HF-LF anahtarlama, difüzyon süresinden daha hızlı zaman ölçeklerinde gerçekleşirse, başka bir deyişle, odaktaki molekülün ikamet süresi boyunca, oran CCFFRET6,31,36'dakiantikorrelasyondan türetilebilir. FCS'de difüzyon süresinden daha yavaş dinamik işlemlere uyulamayacağını lütfen unutmayın.
Bu gösteride, iki devlet arasında FRET verimliliğinde ılımlı veya maksimum bir değişiklik gösteren iki farklı FRET senaryosu varsayılır. Simülasyonlar Burbulator37 kullanılarak gerçekleştirildi ve üçüz yanıp sönme ve kırmızı kanallara artan miktarda donör çapraz konuşma yokluğu veya varlığı göz önünde bulunduruldu. Difüzyon terimi, tD1 = 1 ms'de hızlı dağılan moleküllerin% 30'u ve moleküllerin geri kalanı tD2 = 100 ms ile yavaşça dağılım ile bimodal dağılım olarak modellenmiştir. Toplamda, 3D Gauss şeklindeki bir hacimde 107 foton w 0 = 0.5 μm ve z 0 =1.5 μm, kutu boyutu 20 ve NFCS = 0.01 simüle edildi.
Şekil 6E-F, yoklukta (düz çizgiler) ve üçlü yanıp sönme (kesik çizgiler) varlığında orta (Şekil 6E) ve maksimum FRET kontrastı ( Şekil6F) için FRET kaynaklı çapraz korelasyon CCFFRET simülasyon sonuçlarını gösterir. FRET kaynaklı anti-korelasyon Şekil 6F'dekolayca görülebilir. Ek bir üçüz durumu eklemedeki "sönümleme" etkisi korelasyon genliğini azaltır (Şekil 6E-F)38,39.
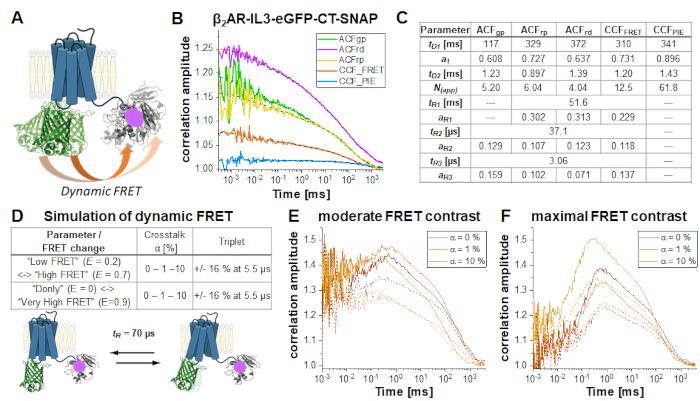
Şekil 6: Dinamik FRET gösteren çift etiketli numune simülasyonu. (A) Hücre içi döngü 3'e ve C-terminal SNAP etiketine yerleştirilmiş bir eGFP ile çift etiketli β2AR. Her iki florofor da FRET'e tabi olacak kadar yakındır ve reseptör protein dinamiklerinden geçerse FRET verimliliğinde değişiklikler gösterir. (B) Örnek bir ölçümün otomatik korelasyonu (ACFgp, ACFrp ve ACFrd, eq. 7ile uyum ) ve çapraz korelasyon eğrileri (CCFFRET (eq. 7) ve CCFPIE (eq. 9)). Paneldeki tablo (C) sığdırma sonuçlarını gösterir. (D-F) Deneysel parametrenin beklenen, FRET kaynaklı antikorrelasyon terimi üzerindeki etkisini göstermek için, FRET verimliliğindeki değişimin (küçük veya büyük), alıcı kanallara farklı miktarda donör çapraz sapının (%0, %1 veya %10) ve üçlü yanıp sönmenin yokluğu ve varlığının model alındığı 12 simülasyon gerçekleştirildi. Her iki FRET-durumlarının denge fraksiyonu 50:50 olarak kabul edildi ve döviz kurları elde edilen gevşeme süresi tR = 70 μs olacak şekilde ayarlandı. Simülasyonlar hakkında daha fazla ayrıntı metinde görür. (E) Simülasyonun CCFFRET'i orta derecede FRET kontrastı ile ve çapraz konuşma (koyu turuncu), %1 çapraz konuşma (turuncu) ve %10 çapraz konuşma (açık turuncu) yokluğunda sonuçlanır. Düz çizgiler, üçüz varlığında üçüz, kesik çizgilerin yokluğunda sonuçları gösterir. (F) CCF FRET maksimumFRET kontrastı ile simülasyon sonuçları. Renk kodu (E) ile aynıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bununla birlikte, deneysel koşullara en çok benzeyen simülasyonda (α = % 10, % 15 üçlü yanıp sönen ve ılımlı FRET kontrastı, Şekil 6E'dekesikli sarı çizgi), antikorrelasyon terimi neredeyse azalır. Şekil 7, foton varış zamanı histogramlarında (yani floresan ömründe) kodlanan bilgileri Floresan Ömür Boyu Korelasyon Spektroskopisi (FLCS)17,19 veya tür filtreli FCS (fFCS)18ile kodlanmış bilgileri kullanarak bu benzetimli verilerin analiz edilmesi sonucunu göstermektedir. Burada, bilinen HF ve LF türlerinin floresan ömürleri (Şekil 7A) korelasyon prosedürü sırasında uygulanan ağırlıkları veya "filtreleri" (Şekil 7B) oluşturmak için kullanılır. Elde edilen tür-oto ve çapraz korelasyon eğrilerinde (Şekil 7C-D) antikorrelasyon açıkça gözlenebilir.
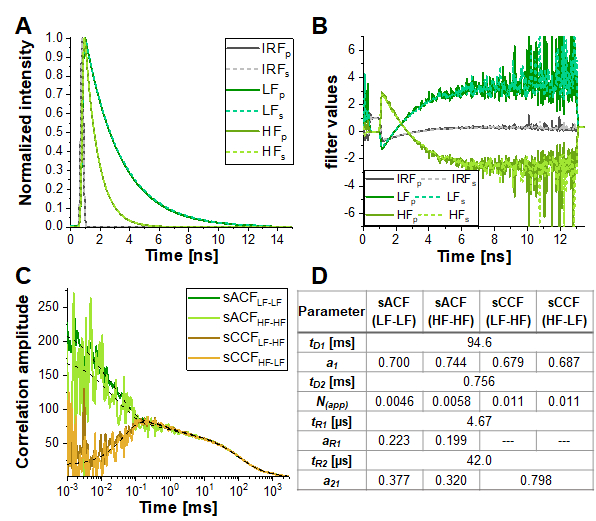
Şekil 7: Ömür boyu filtreli FCS, CCFFRET'tekiFRET kaynaklı antikorrelasyonu maskeleyen yüksek çapraz konuşma, önemli üçlü yanıp sönme veya diğer fotofiziksel veya deneysel özelliklere sahip örneklerde FRET verimliliğindeki protein dinamiklerine dayalı dalgalanmaları ortaya çıkarmaya yardımcı olabilir. Burada, %10 çapraz konuşma ve %5 üçlü yanıp sönme içeren simülasyon için Şekil 6E'de gösterilen veriler için yaklaşım örnek gösterilmiştir. (A) İki FRET türü (sırasıyla yüksek ve düşük FRET için açık ve koyu yeşil) ve IRF (gri) için normalleştirilmiş floresan yoğunluğu bozunması desenleri. Paralel algılama kanalının deseni, dik algılama kanalı için düz çizgiler, kesik çizgiler halinde gösterilir. (B) Ağırlıklandırma işlevi veya "filtre" ( A ), renk kodu(A)ile aynıdır. Burada sadece yeşil algılama kanallarındaki sinyalin ve dolayısıyla FRET kaynaklı donör söndürmenin dikkate alındığını lütfen unutmayın. (C) Dört farklı tür seçici korelasyon elde edilir: düşük FRET durumunun tür-otomatik korelasyonları (sACFLF-LF, koyu yeşil) ve yüksek FRET durumu (sACF HF-HF, açık yeşil) ve düşük FRET ile yüksek FRET durumu (sCCFLF-HF, koyu turuncu) ve tersi (sCCFHF-LF) arasındaki iki tür çapraz korelasyonları , turuncu). SCCF, μs aralığındaki antikorrelasyonu açıkça gösterir. Kesikli siyah çizgiler uyum sağlar. sACF eq. 9 ve sCCF eq. 11ile uygundu. Paneldeki tablo (D) sığdırma sonuçlarını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protein-Protein Etkileşimi (PPI) çalışmak için CCFPIE genliği
Son olarak, canlı hücrelerde PIE tabanlı FCS için yaygın bir kullanım örneği, iki farklı protein arasındaki etkileşimi incelemektir. Burada, okuma parametresi CCFPIE'ıngenliği veya daha doğrusu otomatik ilişki genliklerinin ACFgp ve ACFrd'nin CCFPIEgenliğine oranıdır. Artan ko-difüzyonun CCFPIEüzerindeki etkisini göstermek için, simülasyonlar2AR-IL3-eGFP ve NT-SNAP-β2AR(Şekil 8A)β iki tek etiketli yapıya dayanarak gerçeklenmiştir. Şekil 8B, ko-difüzör moleküllerinin fraksiyonu% 0'dan% 100'e değiştiğinde CCFPIE genliğinin nasıl arttığını göstermektedir. Gecikme süresi penceresindeki kırmızı kanallara yeşil sinyalin %1'lik bir çapraz sapının, yukarıda gösterildiği gibi başka türlü modellenen difüzyon bileşenleriyle eklendiğini lütfen unutmayın.
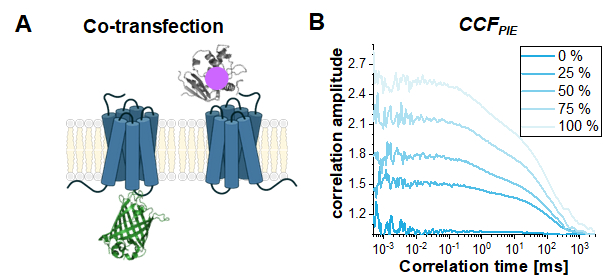
Şekil 8: CCFPIE, iki proteinin etkileşimini incelemek için kullanılabilir. (A) Burada, NT-SNAP-β2AR ("kırmızı" snap etiketi taşıyan) ile β2AR-IL3-eGFP'nin ortak transfeksiyon çalışması simüle edildi. (B) Artan miktarda ko-difüzör molekülü için (%0 (koyu mavi) -> %100 (açık mavi)) genlik G (tc) artar. Difüzyon terimi yine t D1 = 1 ms'de hızlı difüzyon moleküllerinin %30'u ve t D2 = 100 ms ile yavaşça dağılan moleküllerin geri kalanı ile bimodal dağılım olarak modellenmiştir. Ayrıca, yeşil sinyalin kırmızı gecikme süresi penceresine %1 çapraz sap eklendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Sembol | Anlamı (ortak birim) | |||
| α | kırmızı algılama kanallarına yeşil ekscitasyondan sonra yeşil floroforun çapraz saplanması (%) | |||
| a1 | membran reseptörlerinin bimodal difüzyon modelinde ilk difüzyon bileşeninin fraksiyonu | |||
| birf | antikorrelasyon teriminin toplam genliği | |||
| R | fotofizik genliği /üçlü yanıp sönme | |||
| b | korelasyon eğrisinin taban çizgisi / uzaklığı | |||
| B | floroforun moleküler parlaklığı ((kilo-) molekül başına sayılır ve ikincisi) | |||
| BG | arka plan (örneğin uygun bir referans örneğinden: ddH2O, tampon, iletilmemiş hücre vb.) | |||
| c | konsantrasyon | |||
| CR | sayım hızı (KHz veya (kilo-) saniyede sayar) | |||
| δ | yeşil ekscitasyondan sonra kırmızı floroforun doğrudan çıkarılması (%) | |||
| D | difüzyon katsayısı (μm²/s) | |||
| G(tc) | korelasyon işlevi | |||
| N | odaktaki molekül sayısı | |||
| NA | Avogadro'nun numarası (6.022*1023 Mol-1) | |||
| rGR, rRG | yeşil veya kırmızı otomatik korelasyon işlevinin PIE tabanlı çapraz korelasyon işlevine genlik oranı | |||
| s | konfokal hacim öğesinin şekil faktörü | |||
| tc | korelasyon süresi (genellikle milisaniye cinsinden) | |||
| tD | difüzyon süresi (genellikle milisaniye veya mikrosaniye cinsinden) | |||
| tR | fotofizik gevşeme süresi (genellikle mikrosaniye olarak) | |||
| tT | üçüz yanıp sönmenin gevşeme süresi (genellikle mikrosaniye olarak) | |||
| w0 | konfokal hacim elemanının yarım genişliği (μm) | |||
| z0 | konfokal hacim elemanının yarı yüksekliği (μm) | |||
Tablo 1: Değişkenlerin ve kısaltmaların listesi. Floresan ve FRET deneylerinde sembollerin ve tanımın kullanılması için FRET topluluğu40'ın yönergeleri önerilir.
EK DOSYALAR:
SuppNote1_Coverslip temizleme.docx Bu Dosyayı indirmek için lütfen tıklayınız.
SuppNote2_Confocal Kur.docx Bu Dosyayı indirmek için lütfen burayı tıklatın.
SuppNote3_Data verin.docx Bu Dosyayı indirmek için lütfen tıklayınız.
ChiSurf kullanarak kalibrasyon analizi SuppNote4_FCCS.docx Bu Dosyayı indirmek için lütfen buraya tıklayın.
SuppNote5_Fluorescence ömür boyu histogramlar.docx Bu Dosyayı indirmek için lütfen tıklayınız.
S6_Scripts.zip Bu Dosyayı indirmek için lütfen tıklayınız.
S7_Excel_templates.zip Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
GPCR'lerdeki FCS teknikleri, canlı hücrelerin içindeki reseptörlerin hareketliliğinin ve etkileşimlerinin değerlendirilmesini sağlar41. FRET-FCS tekniğinin avantajı, hareketlilik ile birlikte GPCR'lerin konformasyonsal dinamiklerinin araştırılabilmesidir. Bununla birlikte, canlı hücrelerde FRET-FCS yapmak zordur ve floresan olarak etiketlenmiş ilgi proteininin düşük (veya maksimum derecede ılımlı) ifadesini gösteren hücreler, iyi kalibre edilmiş bir kurulum ve verileri analiz etmek için iyi bir işlem hattı gerektirir. Burada, öncelikle numune hazırlama ve deneysel prosedürdeki kritik noktalar biyolojik, spektroskopik ve teknik bakış açıları ile ilgili olarak tartışılmaktadır.
Kritik deneysel adımlar arasında arka planı ve otofluoresansı en aza indirmek (kapsamlı bir şekilde temizlenmiş kapaklar ve fenol-kırmızısı serbest ortamlar kullanarak), düşük ifade seviyelerine ve verimli etiketlemeye ulaşmak için transfeksiyon koşullarının optimizasyonu (örneğin, plazmid DNA miktarı ve transfeksiyondan sonraki süre) yer almaktadır. Tabii ki, etiketli proteinin işlevinin engellenmediğinden emin olmak da hayati önem taşır. Bu nedenle, canlı hücre deneylerinde, etiketleme stratejisi ve etiket pozisyonu için karar genellikle floresan proteinler veya esnek N veya C-terminus42 , 43'e bağlı SNAP / CLIP etiketi lehine yapılır. Organik florofor ile etiketleme için reaktif bir yan zincire sahip doğal olmayan bir amino asit eklemek gibi alternatif etiketleme stratejileri son yıllarda ortaya çıkıyor44.
Sadece iki ilgi molekülünün etkileşiminin araştırılacağı çift renkli PIE-FCS için, floroforlar çok çeşitli yerleşik floresan proteinler veya SNAP / CLIP substratları arasından seçilebilir. Burada, spektroskopi açısından amaç, küçük çapraz konuşma veya doğrudan kabul eden çıkarmanın meydana geldiği bir çift seçmek olmalıdır. Ek olarak, seçilen floroforlar fotoğraflanabilir olmalı ve seçilen deneysel koşullar altında çok az ağartma göstermeli veya göstermemelidir. Kırmızı spektral aralıktaki floroforların (1) hücreden gelen otofluoresans arka planının azaltılması ve (2) eksitasyon ışığının daha uzun dalga boyunda olması, böylece daha az fototoksik14olarak seçilmesi önerilir. Fotobleaching, önce lazer gücünün adım adım artırıldığı ve moleküler parlaklık gözlendiği "güç serisi" olarak adlandırılan bir şekilde yapılarak en aza indirilebilir. En uygun heyecan yoğunluğu aralığı, sonuçların doğrusal aralığında yatmektedir45.
İki etiketin FRET aracılığıyla protein konformasyon dinamikleri hakkında da rapor etmesi gerekiyorsa, mevcut floroforların seçimi daha kısıtlıdır. Burada, iki floresan arasındaki olası minimum / maksimum mesafe önceden tahmin edilmelidir, örneğin mevcut yapılara veya moleküler boyuta göre ve makul bir Förster yarıçapı R0 ile seçilen bir florofor çifti, FRET'in gerçekten20.
Burada, etiketleme için eGFP ve snap etiketi seçildi ve SNAP etiketi hücre içi veya membran geçirimsiz yüzey substratı ile etiketlendi. Spektrum, Şekil 2C-D'degösterilenlere benzer. Floroforların bu kombinasyonu, eGFP'nin kırmızı algılama kanallarına yüksek çapraz sapını ve SNAP substratının istem zaman penceresindeki yeşil ekscitasyon tarafından doğrudan kabul edici ekscite edilmesini gösterir ve istemi zaman penceresinde kırmızı kanallarda önemli bir "yanlış" sinyalle sonuçlanır. İdeal olarak, her iki değer, çapraz konuşma ve doğrudan alıcı çıkarma,% 5 'i geçmemelidir5,6,38. Bununla birlikte, 57 Å'lık bir Förster yarıçapı ile, söndürülen eGFP ömründen (Tamamlayıcı Not 5) değerlendirilebileceği gibi, β2AR-IL3-eGFP-CT-SNAP yapısındaki etiketler arasındaki mesafeyi araştırmak için idealdir.
Teknik olarak, herhangi bir floresan spektroskopi deneyine gelince, cihaz iyi hizalanmalı ve uygun heyecan kaynaklarına, emisyon filtresine ve hassas dedektörlere sahip olmalıdır. μs zaman ölçeğinde artçılardan gelen yapıtları önlemek için, her renkten en az iki dedektör bulunmalıdır ve bu da çapraz korelasyona sahip olabilir. Modern zaman ilişkili tek foton sayma elektroniği, algılama kartının ns zaman aralığındaki ölü zamanı, bağımsız yönlendirme kanalları nedeniyle neredeyse hiç rol oynamaz, ancak, ilgi zaman aralığının alt-μs / ns zaman aralığında olması koşuluyla Müller ve ark 16 tarafından önerildiği gibi kontrol edilebilir. Ek olarak, ps aralığında daha da yüksek zaman çözünürlükleri için, her algılama kanalı iki katına çıkarılmalıdır, yani, dedektör ölü zamanlarınıatlamakiçin renk başına dört dedektör kullanılmalıdır 2,15,29,46. Ortalama floresan ömrü polarize olmayan floresan tespiti kullanılarak tahmin edilebilirken, floroforlar arasındaki mesafenin (~dağılımın) analizi için emisyonun polarizasyona bağlı olarak toplanması gerekir. Bunun nedeni, FRET'teki enerji transferinin verimliliğinin iki floroforun yönelimine dayanmasıdır. Daha ayrıntılı bilgiye buradan ulaşabilirsiniz20,28,47. Son olarak, PIE deneylerinde, istemin ve gecikme darbesi arasındaki mesafe kritiktir ve floroforların floresan yoğunluğunun büyük ölçüde çürümüş olması için seçilmelidir (Şekil 1B). Yaygın bir kural, iki darbeyi floresan ömrünün 5 katı ayrı tutmaktır, yani floresan ömrü 2,5 ns olan eGFP için mesafe en az 22'de 12,5nolmalıdır.
Deneysel prosedür için tüm hususlar ayrıntılı olarak ele alındıktan sonra, veriler ve analizi daha ayrıntılı olarak tartışılır. Protokol bölümünde belirtildiği gibi, kalibrasyon ölçümlerinin analizi de dahil olmak üzere kurulumun hizalaması günlük olarak kontrol edilmelidir. Şekil 2A-C'de gösterilen veriler, örneğin, 8-40 μs aralığında ek bir gevşeme bileşeni gösterir. Yeşil kalibrasyon floroforunun tipik üçüz yanıp sönmesinin 2-10 μs aralığında13 , 15,48arasında meydana geldiği bilinmektedir. DNA örneğinin tüm eğrilerinde gerekli olan yavaş gevşeme bileşeni (Şekil 3C), gerçek üçlü yanıp sönme için çok yavaş, DNA'nın floroforlarla etkileşimlerinden kaynaklanabilir39. Ancak, bu bileşen CCFPIE'da beklenmez ve büyük olasılıkla artık çapraz konuşmadan kaynaklanır. Bu nedenle, günün hizalamasının kalitesini değerlendirmek için hücre deneylerine geçmeden önce kalibrasyon örneklerinin analizini doğrudan gerçekleştirmeniz şiddetle tavsiye edilir.
Konfokal örtüşme hacminin uygun kalibrasyonu, yeşil ve kırmızı etiketin% 100 ortak difüzyonuna sahip bir örnek gerektirir. Burada floresan etiketli çift iplikli DNA kullanılmaktadır. Her iki DNA teli de istenen floroforlara birbirinden gerekli mesafede olacak şekilde uyarlanabilir. Tasarlanan iplikçikler yüksek verimle tavlanabilir. Bununla birlikte, İyi Laboratuvar Uygulaması, Agarose jel elektroforezi ile DNA iplikçiklerinin bütünlüğünü ve etiketleme derecesini kontrol etmeyi ve emilim spektrumunun ölçülmesini önerir. Ayrıca, bu kalibrasyon ölçümü, yeşilin kırmızı etiketle% 100 ortak difüzyonu olduğu varsayımı kritik olarak dayandığından, çift telli montajın verimi kontrol edilmelidir. Varsayımın geçerli olmaması durumunda, düzeltme faktörlerinin16,22uygulanması gerekebilir. Şekil 2 ve Şekil 3'tegösterilen kalibrasyon ölçümlerinde yeşil ve kırmızı kanalda sırasıyla 1,4 fL ve 1,9 fL algılama hacmi elde edilmiştir. Bu boyut farkı, neredeyse kırınım sınırlı heyecan hacimlerine sahip bir kurulum için beklenir (Tamamlayıcı Not 2). Bu durum altında, uyarım hacminin boyutu uyarım dalga boyu ile ölçekler. Bu da Şekil 3B'degözlenen farklı korelasyon genliklerini açıklar. Türetilmiş düzeltme faktörleri rGR = 0,56 ve rRG = 0,72 bu boyut tutarsızlığı ve iki heyecan birimi 3,4'ünolası mükemmel olmayan çakışması için doğrudur.
Şekil 4, Şekil 5, Şekil 6ve Şekil 7, konformasyonel protein dinamiklerini anlamaya yönelik PIE-F(C)CS tabanlı bir çalışmanın iş akışını sergiler. İlk olarak,2AR-IL3-eGFP ve NT-SNAP-β2AR β iki tek etiketli yapı, ilgili diğer floroforun yokluğunda hücrelerdeki florofor özelliklerini karakterize etmek için kontrol görevi eder (Şekil 4). Daha sonra, hücre dış cephesine bakan bir SNAP etiketi ve sitoplazmik tarafta bir eGFP taşıyan nt-snap-β2AR-IL3-eGFP çift etiketli yapı "% 100 ko-difüzyon" kontrolü olarak hizmet eder (Şekil 5). 2AR-IL3-eGFP-CT-SNAP β son yapı, sitoplazmik tarafta hem floroforlar taşır hem de FRET'e tabi olacak kadar yakındır. Burada, yine FRET verimliliğini etkileyen protein dinamikleri nedeniyle, hızlı zaman penceresindeki yeşil ve kırmızı kanal sinyallerindeki anti-korelasyonlu yoğunluk dalgalanmaları ile birlikte%100ko-difüzyon beklenecektir. Bu dinamikler CCFFRET'te korelasyon karşıtı olarak görünebilir (Şekil 6-7).
Tüm GPCR β2AR yapıları hücre zarında bimodal difüzyon gösterir (Şekil 4A). β2AR-IL3-eGFP yalnızca beklenen üçlü yanıp sönmeyi gösterirken (Şekil 5B)13,15, NT-SNAP-β2AR ek bir yavaş gevşeme süresi gösterir (Şekil 5C-D). TR2'nin ilişkisiz SNAP alt tabakasından kaynaklanabilir. Bu, örneğin, kullanılan SNAP substratının difüzyon ve fotofizik özelliklerini sulu bir çözeltide ölçerek daha fazla deneyle aydınlatılabilir. Not olarak, difüzyon ve gevşeme sürelerini ayırt etmek için basit bir deney, konfokal kurulumun iğne deliğini değiştirmek, yani etkili hacmi artırmaktır: Difüzyon süreleri artan etkili hacimlerle artarken, gevşeme terimleri değiştirilmez13. Fit sonuçlara göre floresan protein (FP) konsantrasyonunu belirlerken, genel olarak FP'lerin sonunda kromoforun oluştuğu bir olgunlaşma sürecinden geçtiğini unutmayın12. Bu olgunlaşma süresi, yerel kimyasal ortama bağlı fotofiziklere ek olarak FP'den FP'ye farklılık gösterebilir13,15. Bu nedenle, FCS tarafından bildirilen örnekte bulunan gerçek protein konsantrasyonu genellikle hafife alınmaktadır, bu da deneyde floresan olmayan FP'lerin fraksiyonu belirlenebilirse düzeltilebilir. Son olarak, çoğu florofor çevrelerine duyarlı tepki verdiği için, gerekirse α ve δ değerlerini düzeltmek için canlı hücrelerdeki florofor spektrumunu kontrol etmeniz önerilir13,15,48. Çıkartacak arka plan, transfected olmayan hücrelerde toplanan sinyal tarafından belirlenir. Ayrıca, ilgili diğer renk kanalının ve CCFPIE'ın otomatik olarak ilişkili olması, yanlış sinyalleri tanımlayabilmesi için kontrol edilmelidir(Ek Not 4 - Şekil 30).
Floroforların zarın farklı taraflarında bulunduğu NT-SNAP-β2AR-IL3-eGFP'den(Şekil 5D)alınan iki ölçüm farklı günlerde elde edilmiş dirilmiştir ve zaman içinde çözülen tek molekül floresanında istatistiklerin önemini göstermektedir. Burada, farklı sonuçlar farklı etiketleme derecesinden kaynaklanabilir: Bir hücrede ölçümlerin daha yüksek etiketleme derecesi ve ortalaması nispeten düşük gürültüye neden oldu (Şekil 5B), diğer hücreden ise sadece iki ölçüm toplanabilir (Şekil 5A). Yeterli miktarda veri toplamanın ötesinde, sonuçları zamanında değerlendirmek ve belki de etiketleme stratejisini optimize etmek önemlidir. Deneyleri tasarlarken, FRET'in hassas olduğunu, ancak 10 nm'ye kadar olan mesafelerle sınırlı olduğunu ve aksi takdirde "kör" olduğunu hatırlamak önemlidir. Bizim durumumuzda, bu "körlük" değişmemiş eGFP floresan ömrü ile gösterilir (Ek Not 5). β2AR-IL3-eGFP-CT-SNAP yapısında (Şekil 6A), FRET söndürülen eGFP ömründen (Tamamlayıcı Not 5) tam olarak tespit edilebilir. Bununla birlikte, hiçbir antikorrelasyon terimi gözlenmez (Şekil 6B), yani FRET dalgalanmaz veya difüzyon süresinden daha yavaş bir zaman ölçeğindedir. ACFgp,ACFrp , ACF rd ve CCFFRET (Şekil 6C)için en fazla üç ek gevşeme şartı gereklidir. ACFrp, ACFrd ve CCFFRET'teki yavaş bileşen, alıcı ağartmadan kaynaklanıyor olabilir ve elbette, bu eğrilerde bulunan yavaş difüzyonun elde edilen değerini etkiler (ACFgp'de117 ms'ye kıyasla ~ 350 ms). kırmızı kanaldaki tD'nin, farklı boyutlardaki konfokal hacimler nedeniyle yeşil kanaldakinden biraz daha büyük olması gerekir (Şekil 2) - ancak yalnızca boyut farkıyla karşılaştırılabilir bir faktör tarafından. 3 μs'lik çok hızlı gevşemesüresi,floroforların13,15,48' in üçlü yanıp sönmesini yansıtırken, 37 μs'lik daha yavaş gevşeme süresi FRET'e bağlı olabilir: Benzer şekilde, FRET CCFFRET'tebir antikorrelasyona neden olduğuiçin,31 ,32,33otomatik korelasyonlarında pozitif korelasyonlar beklenmektedir. CcFFRET'te bu terimin "pozitif" olarak varlığı ve ACFrd'deki varlığı yüksek çapraz konuşma ile açıklanabilir ve daha fazla aydınlatılmalıdır. CCFPIE'ın beklendiği gibi kısa korelasyon süreleri arasında düz olduğunu unutmayın.
Öte yandan, FRET'in bir ilgi sisteminde ortaya çıkmasının korelasyon eğrileri üzerinde doğrusal olmayan etkilere yol açtığı belirtilmelidir6. Örneğin, bir molekülün moleküler parlaklığı korelasyon genliği kareli olarak ölçekler ve her FRET durumu (ve aktif bir reseptör olmadan her zaman mevcut moleküller) farklı moleküler parlaklık gösterir. Gerçekten de, FRET tespit edilen yeşil moleküllerin görünür konsantrasyonu azaltır (yani, ACFgp genliğini arttırır) ve kırmızı moleküllerin sayısı (kırmızı istemin belirlenmesi)5fazla tahmin edilir. Her iki etki de hem CCFFRET hem de CCFPIE'danelde edilen etkileşim miktarını etkiler. Bununla birlikte, calmodulin 31,32 veya Syntaxin 33'ünintramoleküler dinamikleri için gösterildiği gibi küresel analiz protein dinamiklerini ortaya çıkarabilir. Dikkatlice kalibre edildiğinde, ortalama FRET verimliliği göreli CCFPIE ve ACF genliklerindençıkarılabilir 22, sınırlayıcı durumlar ise donör floresan ömür dağılımının analizinden belirlenebilir33.
eGFP gibi büyük floroforlarla yapılan canlı hücre deneylerinde FRET kontrastının Şekil 6'da gösterilen simülasyonlar için varsayılandan daha da düşük olması ve simülasyona alıcının doğrudan heyecanılmasının eklenmediği göz önüne alındığında, canlı hücre deneylerinde antikorrelasyonun tanımlanmasının neden çok zor olduğunu açıklayabilir. Umut verici bir analiz alternatifi, zaman ilişkili tek foton sayım veri toplama29,30nedeniyle erişilebilen foton varış zamanı histogramlarında ( Şekil1B) kodlanan bilgilerin toplanmasına dayanır. Numunenin içindeki iki (veya daha fazla) (FRET) türün floresan ömrü (~desenleri) biliniyorsa (Şekil 7A), korelasyon işlemi sırasında uygulanan "filtre" veya ağırlıklar seçilebilir (Şekil 7B)17,18,19. Böylece elde edilen korelasyon eğrileri, artık algılama kanallarının korelasyonunu değil, iki farklı (FRET) tür arasındaki otomatik veya çapraz korelasyonları temsil eder, böylece tür-ACF (sACF) veya tür-CCF (sCCF) olarak yeniden adlandırılır. Bu yaklaşımı orta derecede FRET kontrastı, yüksek çapraz konuşma ve üçlü yanıp sönme ile simüle edilmiş verilere uygulamak, antikorrelasyon terimini kurtarır (Şekil 7C-D). Bununla birlikte, gevşeme sürelerinin elde edilebileceği, ancak genlik ile ilişkisinin kaybolduğu unutulmamalıdır18. Bu yaklaşım daha önce canlı hücre deneylerinde uygulanmıştır, örneğin EGFR'nin antagonisti49 ile etkileşimini incelemek veya floresanları eGFP varyantlarına bağlı proteinlerden son derece kısa ve uzun floresan ömürleri ile ayırmakiçin 50.
Saflaştırılmış proteinlerdeki PIE tabanlı FRET ölçümleri büyük ölçüde protein dinamiklerini incelemek için kullanılırken3622, canlı hücrelerde protein-protein etkileşimlerini anlamaya odaklanır. Bu yaklaşım, maya51'deki MAP kinaz aktivitesinin düzenlenmesini incelemek veya membran proteinlerinin sitosolik bağlayıcı partnerleriyle etkileşimini çözmek içinuygulanmıştır. Burada, kırmızı kanalların gecikme süresi penceresinde veya istemi zaman penceresindeki yeşil kanallarda kırmızı sinyalde yeşil floroforların önemli çapraz takibi hala mevcut olduğunda komplikasyonlar ortaya çıkabilir. Birincisi, her iki etki de seçilen floroforların çok güçlü bir şekilde üst üste binen ekscitasyon ve emisyon spektrumundan kaynaklanırken, yeşil nabız açısından kırmızı darbenin yetersiz gecikmesinden kaynaklanabilir. İlgili tek etiketli yapıların yanlış-pozitif CCFPIE genlikleri için dikkatlice ve doğru bir şekilde kontrol edilmesi önerilir, özellikle çok kısa floresan ömrüne sahip otofluoresansın başka bir karmaşık faktör olabileceği hücrelerde22.
Sonuç olarak, burada açıklanan FRET-FCS yaklaşımı, canlı hücrelerdeki protein-protein etkileşimlerini ve protein dinamiklerini fizyolojik konsantrasyonlara yakın olarak anlamak için büyük bir potansiyele sahiptir. Bu protokolde canlı hücre ölçümleri sırasında yapılması gereken kalibrasyon ölçümlerine ve gerekli nicel analizlere odaklanılmıştır. Bu amaçla simülasyonlarla tamamlanan farklı canlı hücre ölçümleri gösterildi. Simülasyonlar, parametrenin ilgili verilerin belirli hareketliliğini ve fotofiziksel özelliklerini açıklayan özel uygun modellerle sistematik olarak değişebileceği için buradaki genel anlayışı sağlar. Analiz, kapsamlı bir adım adım protokol ve uyarlanabilir şablonlara sahip açık kaynaklı yazılım araçlarıyla gerçekleştirildi. Son olarak, teknik gelişmeler ve böylece veri analizi için açık kaynaklı yazılımların yayılmasıyla birlikte satın almaya hazır kararlı PIE-FCS sistemlerinin kullanılabilirliği, daha büyük bir araştırma topluluğunun en yüksek hassasiyete sahip canlı hücrelerdeki protein etkileşimini ve dinamiklerini çözmesi için bu tekniği giderek daha erişilebilir hale getirecektir.
Açıklamalar
Yazarların beyan edecekleri bir çakışma yoktur.
Teşekkürler
Bu proje Deutsche Forschungsgemeinschaft (SFB/TR 240, proje numarası 374031971, Project INF) tarafından J.B. ve K.G.H.
Rudolf Virchow Center'a finansal destek için ve Çekirdek Birim Floresan Görüntüleme'ye teknik destek için teşekkür ederiz. Ayrıca, Ashwin Balakrishnan'a kapsamlı kanıt okuması için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1x Telescope in 4f configuration with five lenses | Qioptiq, Rhyl, UK | G063126000 | Optics |
| 2x Band pass filters Brightline | AHF, Tübingen, Germany | HC 525/50 and HC 600/52 | Filter |
| 2x Dichroic beam splitter | AHF, Tübingen, Germany | HC BS F38-573 | Filter |
| 6-well culture plate Nunc | Thermo Scientific (Waltham, USA) | 140675 | Reagent |
| Alexa Fluor 488 NHS Ester (green calibration standard) | Invitrogen, Life Technologies (Carlsbad, USA) | A20000 | Reagent |
| Alexa Fluor 568 NHS Eater (red calibration standard) | Invitrogen, Life Technologies (Carlsbad, USA) | A20003 | Reagent |
| ASI stage PZ-2000 XYZ | Visitron Systems GmbH, Puchheim, Germany | WK-XYB-PZ-IX71 | Microscope Parts |
| Attofluor Cell Chamber, 35 mm diameter for 25 mm round coverslips | Invitrogen, Life Technologies (Carlsbad, USA) | A7816 | Glass coverslip holder |
| Avalanche photodiode Perkin Elmer (SPCM-AQR-14) | Laser Components GmbH, Olching, Germany | SPCM-AQR-14 | Single photon counting detector |
| Beamsplitter | Newport, Darmstadt, Germany | 10FC16PB.3 | Filter |
| Biorender (Software) | Science Suite Inc - o/a BioRender (Toronto, Canada) | --- | Software used to create GPCR sketch, https://app.biorender.com/ |
| Chinese hamster ovary (CHO) cell line | ATCC | CCL-61 | Cell lines |
| ChiSurf (Data analysis Software) | Thomas-Otavio Peulen, Department of Bioengineering and Therapeutic Sciences, University of California, San Francisco, USA | --- | tttrlib-based software to analyze fluorescence correlation data and fluorescence decay histograms, https://github.com/Fluorescence-Tools/chisurf Tutorial: https://www.youtube.com/watch?v=k9NgYbyLyXk&t=2s Ref: Peulen et al. J Phys Chem B. 121 (35), 8211-8241, (2017) |
| Chloroform | Sigma-Aldrich (St. Louis, USA) | 472476-2.5L | Reagent |
| DMSO | AppliChem GmbH (Darmstadt, Germany) | A3672,0250 | Reagent |
| DNA strand (40 bp fluorophore distance) | IBA Lifesciences GmbH (Göttingen, Germany) | --- | Reagent, 5’ CGC ACT GAA CAG CAT ATG ACA CGC GAT AGG CTA TCC TGC AGT ACG CT(Alexa568)C AGG 3’, 3’ GCG TGA CT(Alexa488)T GTC GTA TAC TGT GCG CTA TCC GAT AGG ACG TCA TGC GAG TCC 5’ |
| Dulbecco’s Modified Eagle Medium: Nutrient Mixture F12 (with and without phenol red) | GIBCO, Life Technologies (Carlsbad, USA) | P04-41250, P04-41650 | Reagent |
| Ethanol (absolute) | Sigma-Aldrich (St. Louis, USA) | 34852-1L-M | Reagent |
| Erythrosin B,Dye content >=95 % | Sigma-Aldrich (St. Louis, USA) | 200964-5G | Reagent, Instrument Response function, solve in EtOH to 10 mg/mL |
| Fetal Bovine Serum (FBS) | Biochrom (Berlin, Germany) | S 0615 | Reagent |
| Fluorescence Light Source X-Cite 120 Q | Excelitas Technologies, Ontario, Canada | XI120-Q-5060 | Microscope Parts |
| Fluorescent SNAP-substrate cell : SNAP Cell TMR- STAR | New England BioLabs (Frankfurt am Main, Germany) | S9105S | Reagent |
| Fluorescent SNAP-substrate surface : DY-549 | New England BioLabs (Frankfurt am Main, Germany) | S9112S | Reagent |
| Glass coverslips (Dimensions: diameter 24 mm, thickness 0.13 - 0.16 mm) | Marienfeld-Superior (Lauda-Königshofen, Germany) | 111640 | Reagent |
| Laser Controller | Picoquant, Berlin, Germany | 910020 (PDL 828-S "SEPIA II") | Optics |
| Laser lines (480 nm and 560 nm) | Picoquant, Berlin, Germany | 912485 (LDH-D-C-485), 912561 (LDH-D-TA-560) | Optics |
| Lipofectamine 2000 | Invitrogen, Life Technologies (Carlsbad, USA) | 11668-019 | Reagent |
| MFD suite (Software) | AG Seidel, Heinrich-Heine-University Duesseldorf, Germany | --- | Software package for analysis of single-molecule fluorescence experiments including e.g. Kristine (correlation of tttr data), Burbulator (simulation of single-molecule experiment), https://www.mpc.hhu.de/software/3-software-package-for-mfd-fcs-and-mfis |
| Mounted Achromatic Doublet, ARC: 400-700 nm, f=150 mm, D=25.4 mm | Thorlabs, Bergkirchen, Germany | AC254-150-A-ML | Second part of Beam expander |
| Neubauer Chamber (deepness 0.1 mm) | Marienfeld-Superior (Lauda-Königshofen, Germany) | 640110 | Reagent |
| Olympus IX 71 stand | Olympus, Hamburg, Germany | IX2-ILL100 | Microscope Parts |
| Opti-MEM (Reduced-Serum Medium) | GIBCO, Life Technologies (Carlsbad, USA) | 31985-047 | Reagent |
| Penicillin/Streptomycin | Sigma-Aldrich (St. Louis, USA) | 049M4857V | Reagent |
| Phosphate-buffered Saline (PBS) | GIBCO, Life Technologies (Carlsbad, USA) | 14190144 | Reagent |
| Pinhole (50 µM) | Newport, Darmstadt, Germany | PNH-50 | Pinhole |
| PMT Hybrid-40 | Picoquant, Berlin, Germany | 932200 (PMA Hybrid 40) | Single photon counting detector |
| Python scripts (Software) | Katherina Hemmen, Rudolf-Virchow Center for Integrative and Translational Imaging, University Wuerzburg, Germany | --- | Collection of self-written Python scripts based on tttrlib (https://github.com/Fluorescence-Tools/tttrlib) used to (1) determine the average count rates, (2) correlate the data and (3) build fluorescence decay histograms, https://github.com/HeinzeLab/JOVE-FCS |
| Quad band beamsplitter (zt405/473-488/561/640 rpc phase r uf1) | AHF, Tübingen, Germany | F73-421PH | Filter |
| Single mode fiber polarization keeping, NA = 0.08 with collimator | Picoquant, Berlin, Germany | 02126 | Optics |
| Sodium Hydroxide (NaOH) | Carl Roth (Karlsruhe, Germany) | 6771.1 | Reagent |
| SymPhotime x64 Software (Data collection and data export software) | Picoquant, Berlin, Germany | 931073 (SPT64-1+2 single user ) | Time-tag time-resolved (tttr) data collection at the self-built FCCS setup, data export |
| Time-Correlated Single Photon Counting (TCSPC) system Hydraharp 400 | Picoquant, Berlin, Germany | 930010 (Hydraharp 400) | Optics |
| Trypsin-EDTA | Sigma-Aldrich (St. Louis, USA) | T4299-100ml | Reagent |
| Unmounted Achromatic Doublets, ARC: 400 - 700 nm, D=12.7 mm, F=-20 mm | Thorlabs, Bergkirchen, Germany | ACN127-020-A | First part of Beam expander |
| Water immersion objective (UPlanSApo 60x/1.20 W) | Olympus, Hamburg, Germany | UPLSAPO60XW | Objective |
Referanslar
- Hess, S. T., Huang, S. H., Heikal, A. A., Webb, W. W. Biological and chemical applications of fluorescence correlation spectroscopy: A review. Biochemistry. 41 (3), 697-705 (2002).
- Haustein, E., Schwille, P. Ultrasensitive investigations of biological systems by fluorescence correlation spectroscopy. Methods. 29 (2), 153-166 (2003).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature Methods. 3 (2), 83-89 (2006).
- Bacia, K., Schwille, P. Practical guidelines for dual-color fluorescence cross-correlation spectroscopy. Nature Protocols. 2 (11), 2842-2856 (2007).
- Kohl, T., Heinze, K. G., Kuhlemann, R., Koltermann, A., Schwille, P. A protease assay for two-photon crosscorrelation and FRET analysis based solely on fluorescent proteins. Proceedings of the National Academy of Sciences. 99 (19), 12161-12166 (2002).
- Sahoo, H., Schwille, P. FRET and FCS--friends or foes. Chemphyschem. 12 (3), 532-541 (2011).
- Wang, Y., Wang, G., Moitessier, N., Mittermaier, A. K. Enzyme Kinetics by Isothermal Titration Calorimetry: Allostery, Inhibition, and Dynamics. Frontiers in Molecular Bioscience. 7, 583826 (2020).
- Yanase, Y., et al. Surface plasmon resonance for cell-based clinical diagnosis. Sensors (Basel). 14 (3), 4948-4959 (2014).
- Freedberg, D. I., Selenko, P. Live cell NMR. Annual Review of Biophysics. 43, 171-192 (2014).
- Nishida, N., Ito, Y., Shimada, I. In situ structural biology using in-cell NMR. Biochimica et Biophysica Acta General Subjects. 1864 (2), 129364 (2020).
- Schwille, P., Meyer-Almes, F. J., Rigler, R. Dual-color fluorescence cross-correlation spectroscopy for multicomponent diffusional analysis in solution. Biophysical Journal. 72 (4), 1878-1886 (1997).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15 (1), 47-51 (2018).
- Haupts, U., Maiti, S., Schwille, P., Webb, W. W. Dynamics of fluorescence fluctuations in green fluorescent protein observed by fluorescence correlation spectroscopy. Proceedings of the National Academy of Sciences. 95 (23), 13573-13578 (1998).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays. 39 (8), 1700003 (2017).
- Widengren, J., Mets, U., Rigler, R. Photodynamic properties of green fluorescent proteins investigated by fluorescence correlation spectroscopy. Chemical Physics. 250 (2), 171-186 (1999).
- Müller, B. K., Zaychikov, E., Bräuchle, C., Lamb, D. C. Pulsed interleaved excitation. Biophysical Journal. 89 (5), 3508-3522 (2005).
- Böhmer, M., Wahl, M., Rahn, H. -. J., Erdmann, R., Enderlein, J. Time-resolved fluorescence correlation spectroscopy. Chemical Physics Letters. 353 (5), 439-445 (2002).
- Felekyan, S., Kalinin, S., Sanabria, H., Valeri, A., Seidel, C. A. M. Filtered FCS: Species Auto- and Cross-Correlation Functions Highlight Binding and Dynamics in Biomolecules. Chemphyschem. 13 (4), 1036-1053 (2012).
- Kapusta, P., Wahl, M., Benda, A., Hof, M., Enderlein, J. Fluorescence lifetime correlation spectroscopy. Journal of Fluorescence. 17 (1), 43-48 (2007).
- Algar, W. R., Hildebrandt, N., Vogel, S. S., Medintz, I. L. FRET as a biomolecular research tool-understanding its potential while avoiding pitfalls. Nature Methods. 16 (9), 815-829 (2019).
- Elson, E. L., Magde, D. Fluorescence Correlation Spectroscopy .1. Conceptual Basis and Theory. Biopolymers. 13 (1), 1-27 (1974).
- Hendrix, J., Lamb, D. C. Pulsed interleaved excitation: principles and applications. Methods Enzymol. 518, 205-243 (2013).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. 13 (1), 29-61 (1974).
- Thompson, N. L., Lakowicz, J. R. . Topics in Fluorescence Spectroscopy. , 337-378 (1991).
- Cole, N. B. Site-specific protein labeling with SNAP-tags. Current protocols in protein science. 73, 1-16 (2013).
- Petrásek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. 94 (4), 1437-1448 (2008).
- Siegel, A. P., Baird, M. A., Davidson, M. W., Day, R. N. Strengths and Weaknesses of Recently Engineered Red Fluorescent Proteins Evaluated in Live Cells Using Fluorescence Correlation Spectroscopy. International Journal of Molecular Sciences. 14 (10), 20340-20358 (2013).
- Peulen, T. O., Opanasyuk, O., Seidel, C. A. M. Combining Graphical and Analytical Methods with Molecular Simulations To Analyze Time-Resolved FRET Measurements of Labeled Macromolecules Accurately. The Journal of Physical Chemistry B. 121 (35), 8211-8241 (2017).
- Wahl, M., Rahn, H. J., Gregor, I., Erdmann, R., Enderlein, J. Dead-time optimized time-correlated photon counting instrument with synchronized, independent timing channels. Review of Scientific Instruments. 78 (3), 033106 (2007).
- Wahl, M., et al. Scalable time-correlated photon counting system with multiple independent input channels. Review of Scientific Instruments. 79 (12), 123113 (2008).
- Price, E. S., Aleksiejew, M., Johnson, C. K. FRET-FCS Detection of Intralobe Dynamics in Calmodulin. The Journal of Physical Chemistry B. 115 (29), 9320-9326 (2011).
- Price, E. S., DeVore, M. S., Johnson, C. K. Detecting intramolecular dynamics and multiple Forster resonance energy transfer states by fluorescence correlation spectroscopy. The Journal of Physical Chemistry B. 114 (17), 5895-5902 (2010).
- Margittai, M., et al. Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proceedings of the National Academy of Sciences. 100 (26), 15516-15521 (2003).
- Cherezov, V., et al. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science. 318 (5854), 1258-1265 (2007).
- Manglik, A., et al. Structural Insights into the Dynamic Process of beta2-Adrenergic Receptor Signaling. Cell. 161 (5), 1101-1111 (2015).
- Olofsson, L., et al. Fine tuning of sub-millisecond conformational dynamics controls metabotropic glutamate receptors agonist efficacy. Nature Communications. 5 (1), 5206 (2014).
- Kalinin, S., Valeri, A., Antonik, M., Felekyan, S., Seidel, C. A. Detection of structural dynamics by FRET: a photon distribution and fluorescence lifetime analysis of systems with multiple states. The Journal of Physical Chemistry B. 114 (23), 7983-7995 (2010).
- Hom, E. F. Y., Verkman, A. S. Analysis of coupled bimolecular reaction kinetics and diffusion by two-color fluorescence correlation spectroscopy: Enhanced resolution of kinetics by resonance energy transfer. Biophysical Journal. 83 (1), 533-546 (2002).
- Widengren, J., Schweinberger, E., Berger, S., Seidel, C. A. M. Two new concepts to measure fluorescence resonance energy transfer via fluorescence correlation spectroscopy: Theory and experimental realizations. Journal of Physical Chemistry A. 105 (28), 6851-6866 (2001).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Briddon, S. J., Kilpatrick, L. E., Hill, S. J. Studying GPCR Pharmacology in Membrane Microdomains: Fluorescence Correlation Spectroscopy Comes of Age. Trends in Pharmacological Sciences. 39 (2), 158-174 (2018).
- Barak, L. S., et al. Internal trafficking and surface mobility of a functionally intact beta2-adrenergic receptor-green fluorescent protein conjugate. Molecular Pharmacology. 51 (2), 177-184 (1997).
- Calebiro, D., et al. Single-molecule analysis of fluorescently labeled G-protein-coupled receptors reveals complexes with distinct dynamics and organization. Proceedings of the National Academy of Sciences. 110 (2), 743 (2013).
- Nikić, I., Kang, J. H., Girona, G. E., Aramburu, I. V., Lemke, E. A. Labeling proteins on live mammalian cells using click chemistry. Nature Protocols. 10 (5), 780-791 (2015).
- Robert, T. Y., Haibing, T. Measuring protein dynamics in live cells: protocols and practical considerations for fluorescence fluctuation microscopy. Journal of Biomedical Optics. 19 (9), 1-24 (2014).
- Felekyan, S., et al. Full correlation from picoseconds to seconds by time-resolved and time-correlated single photon detection. Review of Scientific Instruments. 76 (8), 083104 (2005).
- Forster, T. Zwischenmolekulare Energiewanderung Und Fluoreszenz. Annalen Der Physik. 2 (1-2), 55-75 (1948).
- Widengren, J., Mets, U., Rigler, R. Fluorescence Correlation Spectroscopy of Triplet-States in Solution - a Theoretical and Experimental-Study. Journal of Physical Chemistry. 99 (36), 13368-13379 (1995).
- Chen, J., Irudayaraj, J. Fluorescence lifetime cross correlation spectroscopy resolves EGFR and antagonist interaction in live cells. Analytical Chemistry. 82 (15), 6415-6421 (2010).
- Stefl, M., Herbst, K., Rubsam, M., Benda, A., Knop, M. Single-Color Fluorescence Lifetime Cross-Correlation Spectroscopy In Vivo. Biophysical Journal. 119 (7), 1359-1370 (2020).
- Maeder, C. I., et al. Spatial regulation of Fus3 MAP kinase activity through a reaction-diffusion mechanism in yeast pheromone signalling. Nature Cell Biololy. 9 (11), 1319-1326 (2007).
- Christie, S., Shi, X., Smith, A. W. Resolving Membrane Protein-Protein Interactions in Live Cells with Pulsed Interleaved Excitation Fluorescence Cross-Correlation Spectroscopy. Accounts of Chemical Research. 53 (4), 792-799 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır