Method Article
عزل وتوصيف الحويصلات خارج الخلية البكتيرية الزرقاء
* These authors contributed equally
In This Article
Summary
يقدم هذا البروتوكول وصفا مفصلا لعزل وتركيز وتوصيف الحويصلات خارج الخلية من مزارع البكتيريا الزرقاء. كما تناقش نهج لتنقية الحويصلات من الثقافات على مستويات مختلفة، والمفاضلات بين المنهجيات، واعتبارات العمل مع العينات الميدانية.
Abstract
البكتيريا الزرقاء هي مجموعة متنوعة من البكتيريا الضوئية سالبة الجرام التي تلعب أدوارا حاسمة في النظم الإيكولوجية العالمية وتعمل كنماذج أساسية للتكنولوجيا الحيوية. وقد أظهرت الأبحاث الحديثة أن البكتيريا الزرقاء البحرية والعذبة تنتج حويصلات خارج الخلية - وهي هياكل صغيرة مرتبطة بالغشاء تطلق من السطح الخارجي للميكروبات. في حين أن الحويصلات من المحتمل أن تسهم في العمليات البيولوجية المتنوعة ، إلا أن أدوارها الوظيفية المحددة في بيولوجيا البكتيريا الزرقاء لا تزال غير معروفة إلى حد كبير. لتشجيع وتطوير البحوث في هذا المجال ، يتم تقديم بروتوكول مفصل لعزل وتركيز وتنقية الحويصلات خارج الخلية البكتيرية الزرقاء. يناقش العمل الحالي المنهجيات التي نجحت في عزل الحويصلات من الثقافات الكبيرة من Prochlorococcus و Synechococcus و Synechocystis. يتم عرض طرق لقياس وتوصيف عينات الحويصلات من هذه السلالات. كما يتم وصف نهج عزل الحويصلات عن عينات الحقول المائية. وأخيرا، تناقش أيضا التحديات النموذجية التي تواجه تنقية الحويصلة البكتيرية الزرقاء، والاعتبارات المنهجية لمختلف التطبيقات النهائية، والمفاضلات بين النهج.
Introduction
الحويصلات خارج الخلية (EVs) هي هياكل كروية ، يتراوح قطرها بين ~ 20-400 نانومتر ، تطلقها جميع الكائنات الحية تقريبا في بيئتها المحيطة1،2،3. يتم تحديد الحويصلات بواسطة طبقة ثنائية الدهون ولا يمكنها تكرار نفسها. في البكتيريا سالبة الجرام ، يعتقد أن هذه الهياكل تنشأ في المقام الأول عن طريق "نفخ" أجزاء صغيرة من الغشاء الخارجي. ومع ذلك ، فإن العمليات الأخرى ، بما في ذلك حركة السوط ، وتحلل الخلايا ، وإفراز كل من مواد الغشاء الداخلي والخارجي ، يمكن أن تنتج حويصلات أيضا 4,5. يمكن أن تحتوي المركبات الكهربائية على جزيئات حيوية مختلفة ، بما في ذلك الدهون والبروتينات القابلة للذوبان والغشاء والأحماض النووية والأيضات ، ويمكن أن تنقل هذه المواد بين الخلايا4،5،6. وبالنظر إلى هذه الميزات، تجري دراسة المركبات الكهربائية لفهم أدوارها المحتملة في مجموعة واسعة من العمليات البيولوجية، بما في ذلك الاتصالات الخلوية، وتكوين الأغشية الحيوية، ونقل الجينات الأفقي، وديناميكيات العاثيات المضيفة، وتبادل المغذيات 4,6.
البكتيريا الزرقاء هي مجموعة كبيرة ومتنوعة من البكتيريا سالبة الجرام ، بما في ذلك الكائنات وحيدة الخلية والخيطية. وهي ذات أهمية من وجهات نظر عديدة، بما في ذلك فهم فسيولوجيتها وتنوعها 7,8، ووظائف النظام الإيكولوجي الحرجة التي تخدمها9,10، وفائدتها للتكنولوجيا الحيوية11,12. توجد البكتيريا الزرقاء في مجموعة واسعة من الموائل ، إما ككائنات حية حرة في البيئات البحرية والمياه العذبة والأرضية ، أو في ارتباطات تكافلية مع الطحالب والسرخس والنباتات أو في الأشنات والإسفنج13. وهي تعمل كمنتجين أوليين حاسمين في النظم الإيكولوجية المائية ، حيث تنتج الأكسجين والكربون العضوي من خلال التمثيل الضوئي للأكسجين 9,10 ، وبعضها قادر على تثبيت النيتروجين في الغلاف الجوي وكذلك7. تنتج البكتيريا الزرقاء البحرية والمياه العذبة ، بما في ذلك Prochlorococcus و Synechococcus و Synechocystis ، EVs تحت ظروف المختبر 14،15،16 ، ويمكن أيضا العثور على الحويصلات البكتيرية الزرقاء في البيئات الطبيعية14،17. الوظائف البيولوجية والبيئية للحويصلات البكتيرية الزرقاء غير معروفة ، ولكن من المرجح أن توفر المزيد من الأبحاث في هذا المجال رؤى جديدة في الأسئلة المتعلقة بفسيولوجيا البكتيريا الزرقاء ، والتمايز ، واستراتيجيات الاتصال ، والتطور ، والتفاعلات الغذائية. بالإضافة إلى ذلك ، قد يكون لقدرة المركبات الكهربائية البكتيرية الزرقاء على حمل فئات متنوعة من الجزيئات الحيوية تطبيقات تجارية18,19.
يصف هذا البروتوكول طرق عزل وتوصيف الحويصلات من مزارع البكتيريا الزرقاء والعينات الميدانية لتمكين وتشجيع إجراء فحص أوسع لبيولوجيا الحويصلات خارج الخلية البكتيرية الزرقاء. في حين أن سير العمل الموصوف هنا مشابه لبروتوكولات عزل وتوصيف المركبات الكهربائية من البكتيريا الأخرى ، فإن مزارع البكتيريا الزرقاء والعينات الميدانية تحتوي عادة على تركيزات أقل من الخلايا والحويصلات مما لوحظ عادة مع أنظمة النماذج المرتبطة بالمضيف أو المسببة للأمراض 20،21،22. وبالتالي ، فإن دراسات المركبات الكهربائية البكتيرية الزرقاء تتطلب اعتبارات خاصة وتحسينات للزراعة وعزل الحويصلة ، والتي تختلف أكثر بين السلالات والخلفيات الإعلامية. نظرا لعدم وجود بروتوكول واحد سيعمل بشكل جيد على قدم المساواة لجميع السلالات وظروف النمو والتطبيقات النهائية ، فإننا نقدم خيارات متعددة ونناقش المقايضات المعنية حتى يتمكن الباحثون من تحديد الأساليب الأكثر ملاءمة لمعالجة أسئلتهم التجريبية.
Protocol
يتم الحصول على سلالات البكتيريا الزرقاء من عدة مجموعات مستزرعة (انظر المناقشة للحصول على التفاصيل).
1. زراعة البكتيريا الزرقاء
- زراعة البكتيريا الزرقاء البحرية Prochlorococcus و Synechococcus باتباع الخطوات أدناه.
- قم بزراعة سلالات Prochlorococcus و Synechococcus في قوارير البولي كربونات باستخدام وسط مناسب مثل Pro99 أو SN (انظر جدول المواد). لمزيد من التفاصيل، يرجى الاطلاع على المراجع المنشورة سابقا23,24.
- تأقلم الثقافات من خلال زراعتها عبر نقلتين إلى ثلاث عمليات نقل (1:20 تخفيف الثقافة إلى وسائط جديدة لكل مقطع) تحت درجة الحرارة المطلوبة وظروف الإشعاع المطلوبة للتجربة.
ملاحظة: تشمل ظروف النمو النموذجية 23,25 درجات حرارة تتراوح بين 15-30 درجة مئوية عند الإشعاع بين 8-150 ميكرومول فوتونات m-2 s-1 ، ولكن تحمل الإجهاد الفردي والأمثل يختلف اختلافا كبيرا26 ويجب ضبطه بناء على إرشادات من تعليمات أو أدبيات مجموعة الثقافة ذات الصلة. راقب معدل النمو باستخدام التألق الاستزراعي أو تعداد التدفق الخلوي23 ، وتأكد من أن الثقافات تنمو بمعدل أسي ثابت في الحالة الثابتة قبل بدء التجربة. - قم بإجراء مجموعة من عمليات النقل التدريجية المتتالية من أحجام أصغر إلى أكبر بمجرد وصول الخلايا إلى المرحلة الأسية المتأخرة (على سبيل المثال ، 20 مل < 250 مل < 2 لتر < 10 لتر < 20 لتر).
ملاحظة: لا يمكن تلقيح الثقافات كبيرة الحجم مباشرة من كميات صغيرة من ثقافة البدء. لاحظ أن الثقافات الأكبر قد تتطلب إضافة مخازن مؤقتة (مثل 1 mM HEPES أو الرقم الهيدروجيني 7.5 أو 3.75 mM TAPS أو الرقم الهيدروجيني 8) ، إلى جانب بيكربونات الصوديوم التكميلية أو الفقاعات بالهواء المعقم24.
- زراعة المياه العذبة البكتيريا الزرقاء Synechocystis sp. PCC 6803.
- قم بإعداد مزرعة Synechocystis sp. PCC 6803 لاستخدامها كلقاح عن طريق زراعتها باستخدام التهوية (الهواء الفقاعي عند 1 لتر / دقيقة) ، عند 30 درجة مئوية ، تحت ضوء 16 ساعة (عدد الفوتونات 50 ميكرومول m-2 s-1) / 8 ساعات نظام مظلم ، حتى كثافة بصرية عند 730 نانومتر (OD730) من 1.0 (الطور الأسي) في BG11 المتوسطة27.
- تطعيم 30 مل من هذه الثقافة Synechocystis sp. PCC 6803 في 570 مل من BG11 المتوسطة إلى OD730 من 0.05 في 1 لتر زجاجات غسل الغاز الزجاجي.
- اسمح للخلايا بالنمو مع التهوية ، عند 30 درجة مئوية ، تحت ضوء 16 ساعة (عدد الفوتونات 50 ميكرومول m-2 s-1) / 8 ساعات نظام مظلم ، حتى OD730 النهائي من 1.0-1.5.
2. فصل الكتلة الحيوية للبكتيريا الزرقاء عن جزء الجسيمات الصغيرة (الحويصلة)
ملاحظة: أولا ، يوصى بفصل الخلايا عن supernatant من خلال تكوير الخلايا بالطرد المركزي. ومع ذلك ، عندما تكون أحجام الثقافة كبيرة جدا بحيث لا يمكن تحقيق ذلك ، فمن الممكن تخطي الطرد المركزي والمضي قدما مباشرة في تصفية الثقافات بأكملها باستخدام ترشيح الكبسولة (الخطوة 2.4).
- قم بإجراء الطرد المركزي لفصل الخلايا (الأفضل للأحجام التي تصل إلى ~ 4 لتر، اعتمادا على سعة أجهزة الطرد المركزي المتاحة).
- قم بالأوتوكلاف أو غسل زجاجات أجهزة الطرد المركزي وتنظيفها جيدا باستخدام مياه فائقة النقاء من النوع الأول (انظر جدول المواد) ، مما يضمن عدم بقاء أي صابون متبقي أو مواد أخرى.
- قم بتحميل عينات الثقافة في عدد مناسب من زجاجات أجهزة الطرد المركزي وقم بموازنتها.
- تدور الثقافات لمدة >10000 × غرام عند 4 درجات مئوية لمدة 10 دقائق. إذا ظل الفائق عكرا بشكل واضح ، فقم بزيادة ظروف الطرد المركزي إلى 20 دقيقة بأقصى سرعة وأعد المحاولة.
- قم بصب أو ماصة فائقة بعناية في وعاء نظيف وانتقل إلى أحد خيارات الترشيح التالية المذكورة في الخطوات 2.2-2.4.
- الخيار 1: إجراء ترشيح المحاقن باستخدام مرشحات 0.2 ميكرومتر (لأحجام العينات التي تصل إلى ~ 50 مل).
- املأ حقنة معقمة سعة 50 مل بوسط استزراع خال من الخلايا إلى حد كبير ، وقم بتصفيتها من خلال مرشح بولي إيثرسلفون (PES) 0.2 (أو 0.45) ميكرومتر (انظر جدول المواد). اجمع الترشيح في وعاء نظيف ومعقم.
- كرر هذه الخطوة حتى يتم انسداد الفلتر (على سبيل المثال ، يصبح من الصعب الدفع باستخدام المحقنة). استبدل بفلتر جديد، واستمر حتى تتم تصفية العينة بدقة.
- الخيار 2: إجراء ترشيح فراغي 0.2 ميكرومتر (حتى ~ 4 لتر).
- اغسل جهاز التفريغ ونظفه جيدا باستخدام مياه من النوع الأول - فائقة النقاء ، وقم بتوصيله بمصيدة فراغ ومضخة (انظر جدول المواد).
- أدخل مرشحا بحجم 0.2 ميكرومتر بقطر مناسب وقم بتثبيت جهاز التفريغ.
- أضف كمية صغيرة من عينة الاستزراع ، مما يضمن بقاء ضغط الفراغ <10 رطل لكل بوصة مربعة.
- استمر في تصفية الثقافة بزيادات صغيرة حتى تكتمل. إذا تباطأ معدل الترشيح بشكل كبير ، فأوقف الفراغ واستبدل الفلتر.
- اجمع الكسر <0.2 ميكرومتر الذي يحتوي على حويصلات في وعاء نظيف.
- الخيار 3: إجراء ترشيح كبسولة 0.2 ميكرومتر (لأحجام العينات > ~ 4 لتر)
- نظف الأنابيب المرنة ذات الحجم المناسب وأوعية التجميع عن طريق الغسيل بالماء والمنظفات الخفيفة. شطف المواد بالماء المقطر ومنزوع الأيونات.
ملاحظة: قبل الاستخدام ، يجب شطف المادة بمياه من النوع الأول - فائقة النقاء. - ضع الثقافة المراد تصفيتها في مكان آمن ومرتفع باستخدام وعاء التجميع النهائي أدناه. قم بتوصيل مرشح كبسولة 0.2 ميكرومتر (انظر جدول المواد) بمنفذ تدفق إلى الخارج بقطعة واحدة من الأنابيب وضعها في وعاء تجميع.
- ضع أنبوبا آخر في العينة ، وابدأ سيفون الجاذبية عن طريق سحب بعض العينات إلى الأنابيب باستخدام حقنة ، وقم بتوصيل الأنبوب بمرشح الكبسولة. استخدم فتحة التهوية لإطلاق الهواء الزائد وملء الغرفة ب supernatant.
- اسمح للمواد بالتحرك عبر الكبسولة حتى يتم ترشيح العينة جيدا. إذا أصبح معدل التدفق بطيئا جدا (< ~ 1/10th معدل تدفق البداية ، أو يخرج بانخفاض بدلا من تيار التدفق المستمر) ، فانتظر أو طبق قوة لطيفة باستخدام مضخة تمعجية حتى يزداد الضغط الخلفي. بدلا من ذلك ، قم باستعادة معدلات التدفق جزئيا عن طريق فصل المرشح مؤقتا ، وعكس الكتلة الحيوية المتراكمة من جانب التدفق بمياه فائقة النظافة حتى لا تصبح المادة عكرة بشكل واضح ، ثم أعد تشغيل عملية الترشيح.
- نظف الأنابيب المرنة ذات الحجم المناسب وأوعية التجميع عن طريق الغسيل بالماء والمنظفات الخفيفة. شطف المواد بالماء المقطر ومنزوع الأيونات.
3. تركيز عينة الحويصلة
- الخيار 1: إجراء الترشيح الفائق بالطرد المركزي لتركيز حجم العينات الصغير (<500 مل).
- شطف مكثفات الطرد المركزي فائقة الترشيح سعة 15-20 مل المفضلة باستخدام مياه من النوع الأول - فائقة النقاء.
- قم بتحميل المكثفات في جهاز الطرد المركزي وقم بالدوران عند 4400 × g عند 4 درجات مئوية. تجاهل التشغيل وكرر هذه الخطوة مرتين إضافيتين على الأقل.
- قم بتحميل العينة الفائقة في مكثفات مغسولة بالماء وقم بالدوران تحت نفس الظروف. اعتمادا على الأهداف التجريبية ، يمكن التخلص من ترشيح العينة أو جمعها لمزيد من التركيز (مع مكثفات ذات حد وزن جزيئي اسمي يبلغ 3 كيلو دالتون) والتحليل.
- كرر هذه الخطوة حتى يتم تركيز العينة إلى حجم نهائي من ~ 15-30 مل.
- الخيار 2: إجراء ترشيح التدفق العرضي (TFF) لتركيز حجم كبير (>500 مل) من العينة.
- قم بإعداد جهاز TFF وفقا لإرشادات الشركة المصنعة (انظر جدول المواد). قم بتوصيل مضخة تمعجية بخط السحب ووضع مشابك قابلة للتعديل على خط الثبات. قم بتعقيم TFF على النحو الموصى به من قبل الشركة المصنعة ، ثم اغسل الجهاز ب 1 لتر من النوع الأول - ماء فائق النقاء.
ملاحظة: يجب وضع خطوط السحب والقيد في خزان عينة نظيف (زجاجة زجاجية). يجب توجيه خط (خطوط) الترشيح إلى وعاء أو حوض نفايات. - أضف <0.2 ميكرومتر ترشيح إلى خزان العينة. قم بزيادة سرعة المضخة ومستويات الضغط الخلفي ببطء على خط الترشيح لزيادة الإنتاج من خطوط الترشيح.
- استمر في تشغيل TFF ، وإعادة ملء الخزان بمادة الاستزراع الفائقة أثناء إزالة المادة. تجنب السماح لخط السحب بالخروج من العينة أثناء المعالجة لتجنب إدخال فقاعات الهواء. تأكد من أن ضغط التغذية لا يتجاوز ~ 10 رطل لكل بوصة مربعة وأن يتدفق الارتداد من TFF بوتيرة ثابتة إلى الخزان.
- توقف عن تركيز العينة بمجرد وصول الحجم الموجود في الخزان إلى أدنى كمية ممكنة مطلوبة للحفاظ على التدفق إلى خط السحب دون إدخال فقاعات الهواء.
- أغلق خط التدفق الخارجي بمشبك. قم بإزالة الضغط الخلفي على خط الارتداد وإعادة تدوير الفائق المركز من خلال المرشح لمدة 10 دقائق تقريبا ، مما يقلل من معدل إعادة التدوير إلى 20-40 مل / دقيقة لتحقيق أقصى قدر من الاسترداد.
- انقل خط الارتداد إلى وعاء نظيف ، وأزل خط السحب من العينة ، وجمع المواد المركزة. استرجع أي مواد متبقية في خزان العينة باستخدام ماصة.
- قم بتصفية السوبرناتانت المركز من خلال مرشح حقنة 0.2 ميكرومتر (الخطوة 2.2) لضمان عدم بقاء أي خلايا.
ملاحظة: الخطوة 3.2.7 اختيارية. - إذا لزم الأمر ، قم بتخزين التركيز النهائي عند 4 درجات مئوية لمدة 3 أسابيع تقريبا قبل الانتقال إلى تنقية الحويصلة (الخطوة 4).
- قم بإعداد جهاز TFF وفقا لإرشادات الشركة المصنعة (انظر جدول المواد). قم بتوصيل مضخة تمعجية بخط السحب ووضع مشابك قابلة للتعديل على خط الثبات. قم بتعقيم TFF على النحو الموصى به من قبل الشركة المصنعة ، ثم اغسل الجهاز ب 1 لتر من النوع الأول - ماء فائق النقاء.
4. عزل الحويصلة وتنقية
- بيليه مباشرة عن طريق الطرد المركزي الفائق باتباع الخطوات أدناه.
- ضع عينة المستنبتة المركزة <0.2 ميكرومتر في أنبوب جهاز طرد مركزي نظيف. أضف وسائط نظيفة أو عازلا حسب الضرورة لضمان ملء الأنبوب بالكامل.
ملاحظة: إذا كانت عينة الاستزراع النهائية كبيرة جدا بحيث لا يمكن وضعها في أنبوب واحد، فإما أن تكرس المادة في أنابيب متعددة ليتم دمجها قبل خطوات الغسيل أو الكريات بشكل متسلسل في نفس الأنبوب. - إذا لزم الأمر ، قم بإنشاء توازن والدوران عند ~ 100000 × g لمدة 3 ساعات عند 4 درجات مئوية.
- قم بإزالة supernatant بعناية باستخدام ماصة. في حين أن كريات الحويصلة البكتيرية الزرقاء يمكن أن تظهر بعض التلوين، إلا أنها غالبا ما تكون غير مرئية.
- اغسل المادة الحبيبية عن طريق إضافة وسائط استزراع جديدة أو غسل المخزن المؤقت مثل 1x محلول ملحي مخزن بالفوسفات (PBS) (انظر المناقشة) إلى أنبوب جهاز الطرد المركزي الفائق ، واخلطه عن طريق السحب اللطيف ، وقم بالدوران مرة أخرى كما في الخطوة 4.1.2. كرر عملية الغسيل مرة ثانية.
- أعد تعليق الكرية النهائية في الثقافة الطازجة عن طريق السحب المتكرر ولكن بلطف لأعلى ولأسفل حول الجزء السفلي من الأنبوب باستخدام ماصة 1 مل. نقل إلى وعاء نظيف.
- ضع عينة المستنبتة المركزة <0.2 ميكرومتر في أنبوب جهاز طرد مركزي نظيف. أضف وسائط نظيفة أو عازلا حسب الضرورة لضمان ملء الأنبوب بالكامل.
- إجراء الطرد المركزي الفائق التدرج الكثافة.
- قم بإعداد مخزون اليوديكسانول (انظر جدول المواد) عن طريق عمل نسخة مركزة 4x من الخلفية العازلة المطلوبة للعينة (انظر المناقشة).
- امزج جزءا واحدا من المخزن المؤقت 4x مع ثلاثة أجزاء من مخزون اليوديكسانول بنسبة 60٪ لصنع محلول يوديكسانول بنسبة 45٪.
- تمييع 45٪ يوديكسانول مع أحجام من المخزن المؤقت 1x لإنشاء مخزونات من الوسائط المتدرجة في 40٪ ، 35٪ ، 30٪ ، 25٪ ، 20٪ ، 15٪ ، و 10٪ تركيزات يوديكسانول النهائية.
ملاحظة: ستختلف الكمية الإجمالية المطلوبة باختلاف سعة دوار/أنابيب أجهزة الطرد المركزي الفائقة. - قم بإعداد تدرج كثافة أجهزة الطرد المركزي الفائقة عن طريق تراكب كميات متساوية بعناية من 45٪ و 40٪ و 35٪ و 30٪ و 25٪ و 20٪ و 15٪ و 10٪ و 0٪ من الإيوكسيدينول في أنبوب جهاز طرد مركزي فائق بحيث يتم استخدام الحجم الكامل للأنبوب.
ملاحظة: يجب وضع عينة الحويصلة خارج الخلية المراد تنقيتها في الجزء العلوي من التدرج كجزء من طبقة اليوديكسانول بنسبة 0٪. إذا تجاوز الحجم النهائي لعينة الحويصلة حجم طبقة 0٪ ، فقم بخلط أي عينة حويصلة زائدة مع ما يكفي من 45٪ من اليوديكسانول و / أو المخزن المؤقت لتوليد الحجم المطلوب من مخزونات optiprep ذات التركيز 10٪ أو أعلى ، واستخدمها في الموقع المقابل في التدرج. - قم بتدوير التدرج عند ~ 100000 × g عند 4 درجات مئوية لمدة 6 ساعات.
- جمع الكسور (عادة 0.5 مل لكل تدرج ~ 4.5 مل) عن طريق السحب الدقيق أو استخدام جامع الكسور (انظر جدول المواد).
- حدد كثافة كل كسر (بالجم/مل) باستخدام ميزان تحليلي وماصة معايرة لقياس وزن حجم معروف من العينة. قم بإزالة العينة من الأنبوب، وحدد الوزن، وأعد العينة مباشرة.
- قم بتخفيف الكسور الفردية في أنبوب طرد مركزي جديد مع مخزن مؤقت نظيف واغسل المادة كما هو مذكور في الخطوات 4.1.2-4.1.4. بدلا من ذلك ، استخدم أعمدة غسيل الكلى أو الترشيح الفائق لاستعادة الجسيمات.
ملاحظة: عادة ما تهاجر الحويصلات خارج الخلية البكتيرية الزرقاء إلى كثافات عائمة تبلغ ~ 1.14-1.19 جم / مل في اليوديكسانول.
- تخزين الحويصلات في 4 درجة مئوية إذا كان سيتم استخدامها في غضون 1-3 أسابيع. قم بتجميد الحويصلات عند -20 درجة مئوية أو -80 درجة مئوية إذا لم يتم استخدامها لفترة أطول من تلك الفترة.
5. توصيف الحويصلات المعزولة
- إجراء الفحص المجهري الإلكتروني لنقل البقع سالبة (انظر جدول المواد) (TEM ؛ حجم الجسيمات ، الهيكل ، النقاء).
- لتحسين جودة الصورة، قم بتفريغ التوهج على سطح شبكة TEM المطلية سابقا باستخدام نظام تفريغ التوهج وفقا لإرشادات الشركة المصنعة (انظر جدول المواد).
- ضع بعناية ~ 5 ميكرولتر من عينة الحويصلة واتركها لمدة 5 دقائق.
ملاحظة: العينات ذات تركيزات الحويصلة >109 مل-1 عادة ما تعطي أفضل النتائج؛ المزيد من العينات المخففة سيكون لها عدد قليل من الحويصلات لكل صورة. - قم بإزالة العينة عن طريق لمس حافة الشبكة بقطعة من ورق الترشيح النظيف.
- ضع قطرة 20-50 ميكرولتر من خلات اليورانيل 2٪ (انظر جدول المواد) على سطح مستو مغطى بفيلم بلاستيكي ، وضع الشبكة العائمة فوقه لمدة دقيقتين.
- أزل أسيتات اليورانيل باستخدام ورق الترشيح وطفو لفترة وجيزة على قطرة من الماء فائق النقاء لغسلها. كرر غسل الماء مرة ثانية.
ملاحظة: الشبكة الجافة النهائية جاهزة للتصور بعد الخطوة 5.1.5.
- قم بإجراء تلطيخ مقطع رقيق للغاية ل TEM (حجم الجسيمات ، الهيكل الداخلي).
- أعد تعليق الكريات من الخطوة 4.1.5 مع 1 مل من 2.5٪ glutaraldehyde في 0.1 M الصوديوم cacodylate العازل (الرقم الهيدروجيني 7) (انظر جدول المواد) وإصلاح العينة لمدة 2 ساعة عند 4 درجات مئوية.
- تدور في ~ 100000 × غرام لمدة 1 ساعة عند 4 درجة مئوية.
- اغسل الكريات بعناية باستخدام مخزن كاكوديليت الصوديوم المخزن المؤقت 0.1 M (الرقم الهيدروجيني 7) ، ثم قم بالدوران عند ~ 100000 × g لمدة 1 ساعة عند 4 درجات مئوية.
- ثبت الكريات ب 1 مل من رابع أكسيد الأوزميوم بنسبة 1٪ (انظر جدول المواد) (المحضر في مخزن مؤقت كاكوديليت الصوديوم 0.1 M) لمدة ساعة واحدة ، ثم اغسله كما في الخطوة 5.2.3.
- تجفيف العينة مع 1 مل من سلسلة تصاعدية من الإيثانول (50 ٪ ، 70 ٪ ، 90 ٪ ، ومرتين في الإيثانول المطلق) في خطوات من 10 دقائق لكل منها عند 4 درجات مئوية.
- أضف 250 ميكرولتر من راتنجات الإيبوكسي (انظر جدول المواد) ممزوجا بالإيثانول المطلق (1: 1) إلى الكريات واحتضنها بين عشية وضحاها عند 4 درجات مئوية.
- انقل الكريات إلى 500 ميكرولتر من الراتنج النقي لمدة 24 ساعة. ثم ، احتضن الراتنج عند 65 درجة مئوية لمدة 48 ساعة.
ملاحظة: أصبح الراتنج جاهزا الآن للتقسيم بواسطة الميكروتوم الفائق، باتباع تعليمات الشركة المصنعة (انظر جدول المواد). - قم بتلطيخ الشبكات التي تحتوي على أقسام تحتوي على 2٪ من خلات اليورانيل (في 50٪ من الإيثانول) لمدة 5 دقائق. اغسل الشرائح بلطف تحت الماء الجاري منزوع الأيونات لمدة 10-15 ثانية لكل منها. ضع قطرة من سترات الرصاص (انظر جدول المواد) ووصمة عار لمدة 5 دقائق أخرى.
- اغسل كما كان من قبل ، وقم بإزالة الماء عن طريق نشاف الشبكة على ورقة تصفية ، وقم بتجفيف الشبكات في الهواء. تصور بواسطة TEM وفقا لإرشادات الشركة المصنعة (انظر جدول المواد).
- إجراء تحليل تتبع الجسيمات النانوية (NTA) (حجم الجسيمات وتركيزها).
- باستخدام ورق العدسة، امسح بعناية أي غبار أو مادة مرئية من الشقة البصرية. تحقق مما إذا كانت جميع حلقات O والأختام الأخرى نظيفة وسليمة. قم بتشغيل الأداة وابدأ تشغيل البرنامج.
- باستخدام حقنة نظيفة ، املأ الغرفة بالماء النقي للغاية. تأكد من عدم وجود فقاعات هواء.
- انقر فوق بدء تشغيل الكاميرا وتصور المنطقة المثلى من الغرفة حول "بصمة الإبهام". اضبط مرحلة المجهر أفقيا أو رأسيا حسب الحاجة بحيث تكون شدة الإشارة متساوية عبر المنطقة المصورة. حرك منطقة التصوير أفقيا بالنسبة إلى بصمة الإبهام (إلى اليمين، باتجاه الخط الرأسي)، وابحث عن منطقة قريبة ذات إشارة خلفية منخفضة.
- حرك منزلقي كسب الشاشة ومستوى الكاميرا إلى الحد الأقصى، ثم انخفضهما إلى أدنى مستوى لرؤية الجسيمات الأكثر تعتما.
ملاحظة: تستخدم الإعدادات النموذجية للحويصلات البكتيرية الزرقاء كسب الشاشة 7 ومستوى الكاميرا بين 10-12. - اضبط التركيز البؤري حسب الضرورة لضمان أن تكون الجسيمات مرئية بالتساوي تقريبا عبر مجال الرؤية. استمر في دفع المياه فائقة النظافة عبر الغرفة حتى تتأكد بصريا من نظافة الغرفة.
- قم بإزالة الماء المتبقي من الغرفة باستخدام حقنة مختلفة.
- افحص عينة من الوسائط/المخزن المؤقت الموجود في عينتك لتحديد تركيز جسيمات الخلفية عن طريق ملء الغرفة بالوسائط/المخزن المؤقت باستخدام حقنة نظيفة سعة 1 مل.
- حدد القياس القياسي من المربع المنسدل SOP . قم بتغيير الإعدادات لجمع ما لا يقل عن ثلاث نسخ طبق الأصل من مقاطع الفيديو التي يبلغ عددها 60 ثانية لكل منها. اضغط على إنشاء برنامج نصي وتشغيله واتبع المطالبات. ادفع ~ 100 ميكرولتر من العينة إلى الغرفة بين النسخ المتماثلة.
- عند اكتمال عملية الاستحواذ ، قم بإزالة المخزن المؤقت المتبقي باستخدام حقنة ، واغسل 3-5 مل من الماء فائق النقاء عبر الغرفة ، وقم بإزالة الماء المتبقي.
- أضف عينة الحويصلة إلى الغرفة باستخدام حقنة 1 مل وتأكد من إعدادات الاقتناء. إذا لم يكن عدد الجسيمات ضمن النطاق الخطي للأداة (عادة ما بين 20-80 جسيمة/إطارا)، فستحتاج العينة إلى تخفيفها أو تركيزها. ادفع ما لا يقل عن 500 ميكرولتر من العينة إلى الغرفة قبل جمع البيانات.
- اجمع بيانات الفيديو كما في الخطوة 5.3.8 ، مع التأكد من تنظيف الغرفة بمياه فائقة النقاء بين عينات مختلفة.
- جمع جميع العينات اللاحقة من نفس الكائن الحي / التجربة باستخدام إعدادات كاميرا متطابقة لضمان قابلية البيانات للمقارنة ؛ يمكن أن يكون للتغييرات في إعداد مستوى الكاميرا تأثير ملحوظ على القيم النهائية التي تم الحصول عليها.
- تحديد معلمات الجسيمات باستخدام قسم التحليل في البرنامج. حدد تحليل > فتح تجربة، وقم بتحميل نموذج الملف. حدد معالجة الملفات المحددة وانتظر حتى يكتمل التحليل. تأكد من استخدام نفس عتبة الكشف لجميع العينات اللاحقة من نفس التجربة.
ملاحظة: نظرا لأن الحويصلات البكتيرية الزرقاء غالبا ما تكون باهتة، فستحتاج عتبة الكشف عادة إلى تعديلها إلى القيمة الأكثر حساسية (الأدنى).
- إجراء تشتت الضوء الديناميكي (DLS) (حجم الجسيمات، إمكانات زيتا).
- قم بالتصفية من خلال مرشح بحجم المسام 0.2 ميكرومتر لأي عينة تدخل إلى DLS لفحص الجسيمات الكبيرة التي تتداخل مع القياسات.
- أضف 1 مل من الوسائط/المخزن المؤقت إلى كوفيت نظيف لفحص التجمعات المحتملة أو الجسيمات النانوية الأخرى القادمة من الوسائط. ضع الكوفيت مع الجانب المتجمد على اليسار في جهاز أخذ العينات الصغير ، وأغلق الغطاء. دع العينة تتوازن لمدة 5 دقائق على الأقل.
- أدخل معامل الانكسار للمادة وامتصاص المادة إذا كانا يختلفان اختلافا كبيرا عن الافتراضات الخاصة بالماء.
ملاحظة: سيكون لخصائص المواد تأثير ضئيل جدا إذا كانت الحويصلات أصغر من 100 نانومتر. عند قياس الجهد السطحي (إمكانات زيتا) للمركبات الكهربائية ، يجب إعادة تعليق الحويصلات في وسائط النمو الأصلية. - انقر على لوحة تحكم العدادات للتحقق من القراءات وبدء الحصول على البيانات من خلال النقر على الرمز الأخضر. إذا كانت القيم تبدو جيدة ولا تحتوي الوسائط/المخزن المؤقت على تجميعات أو جزيئات أخرى، فأنت الآن جاهز لقياس عينتك.
- أضف 1 مل من عينة الحويصلة إلى كوفيت نظيف واجمع البيانات كما هو مذكور في الخطوة 5.4.4. اجمع ما لا يقل عن ثلاثة نسخ طبق الأصل تقنية لمدة 10 دقائق لكل منها.
- قم بإجراء تحليل عديد السكاريد الشحمي (LPS) للتأكد من وجود المركبات الكهربائية سالبة الجرام في العينة.
- عينة حويصلة إزالة الطبيعة الحرارية عند 95 درجة مئوية لمدة 10 دقائق في المخزن المؤقت القياسي لعينة Laemmli 1x (انظر جدول المواد).
- احتضان مع 0.2 U من النوع الرابع عشر البروتياز من Streptomyces griseus (انظر جدول المواد) عند 37 درجة مئوية لمدة 30 دقيقة لإزالة البروتينات السكرية الملوثة.
- عينات معالجة منفصلة عن طريق الرحلان الكهربائي على تمسخ 16٪ (ث / v) SDS-polyacrylamide المواد الهلامية وفقا للبروتوكول16 المنشور سابقا.
- للكشف عن LPS ، قم بتلطيخ الجل إما بمجموعات التلطيخ المتاحة تجاريا أو باستخدام تقنية تلطيخ الفضة المعدلة28. حدد كمية وفرة LPS النسبية عن طريق تحليل قياس كثافة المواد الهلامية الملطخة وفقا للمراجع المنشورة سابقا29,30.
6. قياسات معدل إنتاج الحويصلة
- باستخدام تحليل تتبع الجسيمات النانوية كما هو الحال في الخطوة 5.3 ، أو ما يعادلها من التكنولوجيا ، قم بقياس تركيز الجسيمات في وسائط النمو للتجربة. إذا تم العثور على عدد جسيمات مرتفع ، فقم بالتصفية من خلال مرشح مسام 0.1 ميكرومتر وأعد الفحص.
ملاحظة: لتقليل الخطأ، يجب أن يكون تركيز جسيمات خلفية الوسائط أقل من 10٪ من تركيز الجسيمات الموجود في الثقافات ذات الكثافة المنخفضة. - تأقلم الثقافة عن طريق زراعة الخلايا لما لا يقل عن عمليتي نقل تسلسليتين متتاليتين في ظل الظروف الإعلامية والبيئية المطلوبة للتجارب كما في الخطوة 1.1.2. يجب نقل الثقافات بينما لا تزال في مرحلة النمو الأسي. ضمان اتساق معدلات نمو الثقافة المقاسة عبر عمليات النقل؛ إذا لم يكن الأمر كذلك ، فاستمر في نقل الثقافات حتى تصبح معدلات النمو قابلة للتكرار.
- جمع عينات من الدورة الزمنية عند التلقيح وفترات زمنية منتظمة عبر منحنى النمو في المرحلة الثابتة المبكرة. نقاط زمنية متداخلة للحصول على ما لا يقل عن 3-4 عينات تم جمعها عبر مجموعة كاملة من النمو الأسي. لإجراء عينة في كل نقطة زمنية، قم بتنفيذ الخطوات التالية.
- قم بتصفية 1 مل أو أكثر من الثقافة مباشرة من خلال فلتر حقنة نظيف ومعقم بسعة 0.2 ميكرومتر واحفظ الترشيح لقياس تركيز الحويصلات كما في الخطوة 5.3. قم بتجميد عينات الدورة الزمنية إذا رغبت في ذلك. استخدم التألق النسبي لمتابعة ديناميكيات نمو الثقافة.
- احفظ عينة من الثقافة بأكملها لتحديد حجم السكان باستخدام طريقة مناسبة للكائن الحي (قياس التدفق الخلوي ؛ طلاء المستعمرة ؛ أو غير ذلك).
- الحصول على قياسات للخلايا والجسيمات الشبيهة بالحويصلة (لكل مل) في كل نقطة زمنية.
- تحديد النقاط الزمنية التي حدثت خلال مرحلة النمو الأسي. لحساب r، يستخدم عدد الحويصلات المنتجة لكل خلية في كل جيل، بين نقطتين أثناء النمو الأسي (عادة بداية ونهاية الدورة الزمنية)، المعادلة الواردة في الملف التكميلي 1.
ملاحظة: هذه الطريقة صالحة فقط خلال ظروف النمو في حالة ثابتة. وترد الافتراضات الأساسية واشتقاق الحساب بالتفصيل في المرجع14.
النتائج
يقدم الشكل 1 نظرة عامة على عملية عزل الحويصلة البكتيرية الزرقاء ، مع تسليط الضوء على الجوانب الرئيسية للبروتوكول الموصوف هنا. وتجدر الإشارة بوجه خاص إلى الخطوات التي تفصل الكتلة الحيوية للبكتيريا الزرقاء عن جزء الجسيمات الصغيرة (الحويصلة)، وتركيز عينة الحويصلة وعزل الحويصلة وتنقيتها (الشكل 1، الخطوات من 2 إلى 4)، وهي خطوات حاسمة للحصول على مستحضرات قابلة للتكرار من الحويصلات. يعرض الشكل 2 نتائج تمثيلية من عزل وتوصيف الحويصلات خارج الخلية من البكتيريا الزرقاء Synechocystis sp. PCC 6803. وقد تبين أن الغشاء الخارجي لهذه البكتيريا الزرقاء يحتوي على الكاروتينات31 ، والتي تضفي تلوينا برتقاليا مميزا على عينات الحويصلات التي يتم جمعها عن طريق التكوير المباشر من خلال الطرد المركزي الفائق (الشكل 2A). بمجرد إنعاش حبيبات الحويصلة، يمكن فحص الحويصلات عن طريق المجهر الإلكتروني الناقل (TEM)، إما عن طريق تلطيخ العينات سلبا بخلات اليورانيل (الشكل 2B) أو عن طريق مراقبة المقاطع الرقيقة جدا (الشكل 2C). يمكن تقييم توزيع حجم الحويصلة وتركيزها باستخدام تشتت الضوء الديناميكي (DLS) (الشكل 2D) وتحليلات تتبع الجسيمات النانوية (NTA) (الشكل 2E). باستخدام البروتوكول الموصوف ، عادة ما يتم الحصول على ~ 3.5 ± 1.0 × 108 جسيمات نانوية لكل مل في ثقافة متنامية بشكل كبير من Synechocystis sp. PCC 6803 في OD730 من 1.0. يمكن إجراء التحليلات البيوكيميائية للمركبات الكهربائية المعزولة لاستكمال التوصيف الفيزيائي للحويصلات المعزولة. على سبيل المثال ، تم فصل حويصلات Synechocystis sp. PCC 6803 المنقاة على هلام SDS-polyacrylamide وملطخة بالسكريات الدهنية (LPS; الشكل 2 واو). نظرا لأن LPS خاص بالغشاء الخارجي32 ، فإن اكتشاف LPS يمكن أن يتحقق من وجود حويصلات مرتبطة بالغشاء ويعمل كعلامة لتحليل محتوى الحويصلة النسبية بين المستحضرات من نفس السلالة33. يمكن أن يشير فحص الوفرة النسبية ل LPS منخفض الوزن مقابل الوزن الجزيئي العالي إلى تغيرات في تكوين الحويصلة بين العينات34,35.
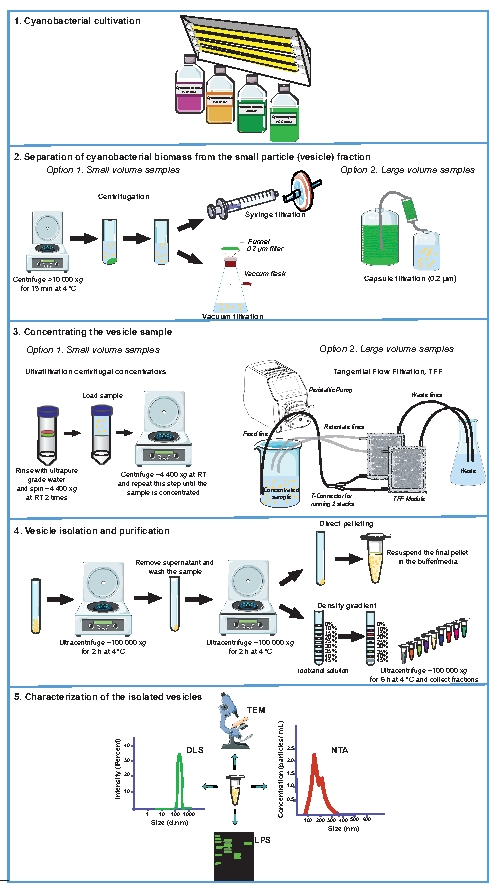
الشكل 1: الإجراءات التجريبية المستخدمة لعزل وتوصيف المركبات الكهربائية البكتيرية الزرقاء. التمثيلات التخطيطية للثقافات المتنامية (1) وفصل الكتلة الحيوية البكتيرية الزرقاء عن وسط النمو (2). تتركز العينات الخالية من الخلايا التي تحتوي على حويصلات (3) ، ثم يتم عزل المركبات الكهربائية وتنقيتها (4). اعتمادا على التطبيق ، يمكن وصف مستحضرات الحويصلة باستخدام واحد أو مزيج من المجهر الإلكتروني الناقل (TEM) ، وتحليل تتبع الجسيمات النانوية (NTA) ، وتشتت الضوء الديناميكي (DLS) ، وتوصيف عديد السكاريد الشحمي (LPS) (5). RT ، درجة حرارة الغرفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: النتائج التمثيلية لعزل الحويصلة خارج الخلية وتوصيف البكتيريا الزرقاء Synechocystis sp. PCC 6803. (أ) صورة فوتوغرافية لحبيبة الحويصلة خارج الخلية (بيليه EVs) التي تم الحصول عليها بعد الطرد المركزي الفائق للوسط خارج الخلية المركز الخالي من الخلايا من مزرعة Synechocystis sp. PCC 6803 التي تبلغ سعتها 600 مل والتي نمت إلى OD730 من 1.0-1.5. لاحظ التلوين البرتقالي النموذجي لحبيبات الحويصلة المشتقة من الكاروتينات الموجودة في الغشاء الخارجي. (ب، ج) صور المجهر الإلكتروني الناقل (TEM) للمقاطع ذات البقع السلبية (B) والرقيقة جدا (C) من عينات الحويصلة Synechocystis sp. PCC 6803. أشرطة المقياس: 200 نانومتر و 50 نانومتر ، على التوالي. تم تصور العينات على مجهر إلكتروني ناقل يعمل بسرعة 80 كيلو فولت. (د) مخطط نموذجي لتشتت الضوء الديناميكي (DLS) يصور توزيع حجم الحويصلة كدالة لقطر الحويصلة (بالنانومتر). تشير الخطوط الملونة إلى بيانات من ثلاثة قياسات تقنية مكررة لنفس العينة. (ه) بيانات تحليل تتبع الجسيمات النانوية التمثيلية (NTA) لتوزيع حجم الحويصلة خارج الخلية Synechocystis (بالنانومتر). يشير الخط الأسود إلى متوسط ثلاثة تكرارات فنية، وتمثل الخطوط الحمراء الخطأ القياسي للمتوسط. (F) تم الكشف عن ملف تعريف عديدات السكاريد الشحمية (LPS) بعد فصل إعداد الحويصلة عن طريق الرحلان الكهربائي على هلام SDS-polyacrylamide بنسبة 16٪ (w / v) والتلطيخ باستخدام مجموعة تلطيخ LPS تجارية. يمكن اكتشاف LPS منخفض الوزن وعالي الوزن الجزيئي ، المقابل لأشكال LPS الخشنة والملساء ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: معادلة لحساب r. يتم تحديد عدد الحويصلات المنتجة لكل خلية لكل جيل بين نقطتين أثناء النمو الأسي (عادة بداية ونهاية الدورة الزمنية) باستخدام هذه المعادلة. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
اعتبارات عامة
يتم تقديم البروتوكول (الشكل 1) كمجموعة من الخيارات لتسليط الضوء على أنه لا توجد طريقة "مقاس واحد يناسب الجميع" للعمل مع الحويصلات خارج الخلية البكتيرية الزرقاء. يمكن للباحثين المهتمين الاستفادة من أقسام هذا البروتوكول المتوافقة والمناسبة للكائن الحي النموذجي الخاص بهم ، والأسئلة / الأهداف التجريبية ، وتوافر المعدات. تنطوي جميع نهج عزل الحويصلات على مقايضات وستؤدي حتما إلى درجة معينة من التحيز. وفي حين ينبغي للمرء أن يسعى إلى التقليل إلى أدنى حد ممكن من ذلك، فإن الاعتبار الأكثر أهمية هو ضمان الإبلاغ عن المنهجية التفصيلية المستخدمة وفقا للمبادئ التوجيهية المناسبة36 المتعلقة بالحد الأدنى من المعلومات لدراسات الحويصلات خارج الخلية.
نمو الثقافة
يمكن الحصول على مزارع البكتيريا الزرقاء بسهولة من واحدة من العديد من مجموعات الثقافة المتاحة في جميع أنحاء العالم. ومن الأمثلة القليلة على ذلك مجموعة روسكوف الثقافية (المحطة البيولوجية دي روسكوف ، فرنسا) ، ومجموعة ثقافة باستور (معهد باستور ، باريس ، فرنسا) ، ومركز بروفاسولي - غيلارد الوطني للطحالب البحرية والميكروبات (NCMA ، مين ، الولايات المتحدة الأمريكية). يجب زراعة سلالة البكتيريا الزرقاء المفضلة في الظروف المتوسطة والبيئية المناسبة ، والتي تختلف اختلافا كبيرا بين السلالات المختلفة. يمكن العثور على قائمة بالوسائط الشائعة الاستخدام لزراعة البكتيريا الزرقاء في مواقع جمع الثقافة أو المنشورات الأخرى 37،38،39.
يمثل العمل مع الحويصلات خارج الخلية البكتيرية الزرقاء بعض التحديات الفريدة مقارنة بالمنهجيات المبلغ عنها للعديد من النماذج النموذجية المختبرية غير المتجانسة. تحتوي مزارع البكتيريا الزرقاء على تركيزات حويصلة أقل حجما من تلك الموجودة في الميكروبات الأخرى مثل الإشريكية القولونية14،16،40. وتعني هذه الاختلافات، التي يفترض أنها ناشئة عن انخفاض كثافات الخلايا و/أو معدلات إنتاج الحويصلات، أن المزارع الكبيرة نسبيا (~ 1-20 لترا أو أكثر) قد تكون مطلوبة لإنتاج مواد كافية للتحليلات السائبة. وبالتالي ، يتم تشجيع الباحثين على اختبار غلة الحويصلات من الثقافات الأصغر حجما لتحديد كمية المواد التي ستكون ضرورية لتحقيق أهدافهم النهائية المرجوة. كما يجب التأكيد على أهمية تحديد ما إذا كانت الوسائط المستخدمة في التجربة لها خلفية جسيمات يمكن اكتشافها قبل البدء في أي تجربة، لأن هذه المادة يمكن أن تربك كمية الحويصلات السكانية، أو تقلل من حساسية قياسات تركيز/حجم الحويصلة، أو تلوث مستحضرات الحويصلة النهائية.
تحد آخر لهذا المجال هو أنه ليس كل البكتيريا الزرقاء تنمو بشكل جيد ، أو على الإطلاق ، في الثقافة النقية. وإلى أن تصبح هذه التفسيرات محورية، فإن تفسيرات خصائص الحويصلات الفيزيائية أو معدلات الإنتاج أو المحتويات لا يمكن أن تؤدي بالضرورة إلى استنتاجات واضحة حول الحويصلات التي تنتجها أي سلالة واحدة في المجتمع. ينصح الباحثون أيضا بالنظر في الأنواع الأخرى من الجسيمات التي يمكن أن تكون موجودة والتي يحتمل الخلط بينها وبين الحويصلات بواسطة أدوات تحليل الجسيمات النانوية المحددة ، والتي لا يمكنها بالضرورة التمييز بين أنواع الجسيمات المختلفة. على سبيل المثال ، قد يكون من الضروري التحقق من أن السلالة المستخدمة تفتقر إلى البروفاج ، إما عن طريق تسلسل الجينوم أو اختبارات الحث أو غيرها من الوسائل أو لا تطلق أنواعا أخرى من الجسيمات. في تجربتنا ، يبلغ قطر معظم الحويصلات البكتيرية الزرقاء <0.2 ميكرومتر ، ولكن عند النظر إلى سلالة جديدة أو حالة نمو ، يجب على المرء أن يؤكد ما إذا كان استخدام مرشح بحجم 0.45 ميكرومتر يغير توزيع حجم الجسيمات النقية.
يمكن أن تؤثر العديد من جوانب ظروف الثقافة على إنتاج الحويصلة ومحتوياتها41,42. وبالتالي ، يجب توثيق الظروف الفيزيائية والكيميائية المستخدمة لنمو الثقافة (بما في ذلك الإشعاع الضوئي ودرجة الحرارة وتكوين الوسائط) والتحكم فيها إلى أقصى حد ممكن لضمان تكرار النتائج. يجب أن يأخذ أي تحليل كيميائي لمحتويات الحويصلة في الاعتبار تكوين الخلفية ، خاصة عند إجراء تحليلات عالية الإنتاجية على غرار "-omics". يمكن أن يكون هذا أمرا بالغ الأهمية بشكل خاص عند استخدام وسائط غير محددة ، مثل تلك التي تستند إلى خلفية مياه البحر الطبيعية أو المكملة بمستخلص الخميرة أو التربتون. قد يكون استخدام وسيط نمو محدد هو الأفضل اعتمادا على الأهداف التجريبية.
يحتاج الباحثون إلى مراقبة ديناميكيات نمو الثقافة بعناية على فترات منتظمة للتأكد من أنهم يعرفون أين توجد في مرحلة النمو ثقافة دفعة معينة وليس فقط جمع العينات بعد فترة زمنية تعسفية. يمكن أن يختلف تكوين الحويصلة عبر مراحل النمو ، خاصة بين المراحل الأسية والثابتة41,42. على سبيل المثال ، قد ينشأ جزء على الأقل من الحويصلات التي تم أخذ عينات منها في المرحلة الثابتة من آلية خلوية مختلفة ، مثل تحلل الخلايا ، والتي لن تحدث أثناء النمو الأسي. في حين أن هذا قد لا يزال ذا أهمية بيولوجية كبيرة ، فمن الضروري معرفة العينة. إذا وصلت مزرعة البكتيريا الزرقاء إلى مرحلة النمو المطلوبة في وقت لا يمكن فيه المضي قدما مباشرة إلى تركيز العينة ، فمن المستحسن فصل الخلايا عن جزء <0.2 ميكرومتر على الفور (مع الطرد المركزي و / أو الترشيح المباشر 0.2 ميكرومتر) ، ثم تخزين الترشيح الخالي من الخلايا عند 4 درجات مئوية. يمكن تخزين المواد بهذه الطريقة لعدة أيام مع تأثير ضئيل أو معدوم على تركيز أو توزيع حجم الحويصلات.
تنقية الحويصلة
تعد الحاجة المتكررة لعزل الحويصلات عن مزارع الحجم الكبير أمرا حيويا في سير عمل عزل الحويصلات البكتيرية الزرقاء. عند العمل مع كميات أكبر من المواد ، ستحتاج الحويصلات إلى التركيز قبل سير عمل الفصل في المصب. ينصح عموما بالمكثفات (أغشية مرشح التدفق العرضي أو أعمدة الطرد المركزي) ذات الحد الاسمي للوزن الجزيئي البالغ 100 كيلو دالوكير ، لأنها تسمح بالانفصال عن المواد القابلة للذوبان ذات الوزن الجزيئي المنخفض مع الحفاظ على أوقات التركيز معقولة ، ولكن يتم استخدام مرشحات 30 kDa بشكل متكرر مع النجاح. في حين أن العديد من الطرق غير القائمة على الطرد المركزي الفائق لتنقية الحويصلات (على سبيل المثال ، كروماتوغرافيا استبعاد الحجم ، والأنظمة القائمة على الموائع الدقيقة ، وتقنيات التقاط التقارب ، والنهج القائمة على هطول الأمطار) أصبحت شائعة في مجال الحويصلة خارج الخلية ، في تجربتنا ، يمكن أن تؤدي هذه الأساليب إلى انخفاض الغلة وعادة ما تكون غير متوافقة مع أحجام الثقافة اللازمة.
يحتاج الباحثون إلى النظر في تكوين خلفية اليوديكسانول والمخازن المؤقتة للغسيل / إعادة التعليق المستخدمة أثناء تنقية الحويصلة لضمان توافقها مع التطبيقات النهائية المطلوبة. في كثير من الحالات، يمكن إعادة تعليق عينة الحويصلة النهائية في وسائط النمو أو مخزن مؤقت محدد مماثل في تكوينه لوسط النمو (على سبيل المثال، مياه البحر الطبيعية مقابل مياه البحر الاصطناعية). ومع ذلك ، قد لا يكون هذا ممكنا مع الحويصلات البكتيرية الزرقاء البحرية ، والتي ستتطلب المزيد من التلاعب التجريبي للتحليل ، لأن تركيزات الملح العالية المماثلة لمستويات مياه البحر يمكن أن تمنع العديد من التفاعلات الأنزيمية. في مثل هذه الحالات ، تعمل المخازن المؤقتة المختبرية القياسية مثل 0.2 ميكرومتر المصفاة ، 1x PBS عادة بشكل جيد للحفاظ على استقرار الحويصلات البكتيرية الزرقاء البحرية ويمكن أن تكون أكثر توافقا مع العمليات التجريبية النهائية.
يمكن اعتبار تنقية تدرج الكثافة اختيارية اعتمادا على الأهداف التجريبية وتكوين الثقافة ولكن يوصى بشدة لإنتاج عينة أكثر نقاء وقابلة للتكرار. مجموعات EV غير متجانسة ويمكن العثور عليها عبر مجموعة من كثافات الطفو ، والتي تختلف أيضا حسب الإجهاد وظروف النمو وعوامل أخرى 4,5,6. تمثل الكثافات المذكورة أعلاه تلك الموجودة عادة للحويصلات من مزارع البكتيريا الزرقاء والعينات الميدانية في اليوديكسانول ، ولكن قد تختلف النتائج في سلالات أخرى. يمكن استخدام مواد تدرج الكثافة الأخرى مثل السكروز و CsCl للحويصلات ، لكنها ستنتقل إلى كثافات طفو مختلفة في هذه الخلفيات. يمكن أن تؤدي خلفيات الوسائط المتدرجة المختلفة إلى تحيز استعادة الفيروسات المحاطة بالدهون43 وقد تؤثر على استعادة الحويصلات من سلالات مختلفة.
يمكن فقدان الحويصلات في نقاط متعددة من خلال عزل الحويصلة ، وعملية تنقية التدرج الموضحة هنا ، مما يقلل من الغلة ويزيد من كمية المواد الأولية اللازمة لتحقيق عائد حويصلة نهائي معين للتطبيقات النهائية. يجب توخي الحذر بشكل خاص عند العمل مع كريات الحويصلة بعد الطرد المركزي الفائق. في حين أن بعض الحويصلات البكتيرية الزرقاء يمكن أن تحتوي على كاروتينات أو مركبات أخرى قد تضفي على عينات الحويصلات قدرا من التصبغ (الشكل 2) ، اعتمادا على سلالة أو كمية المواد ، ليس من المتوقع بالضرورة أن تكون قادرة على تصور حبيبات الحويصلات مباشرة. كن على دراية بالمكان الذي من المتوقع أن تعطى فيه الكريات نوع دوار أجهزة الطرد المركزي المستخدم. وعندما يكون ذلك ممكنا، يقترح فحص عينات الحويصلات النقية بواسطة المجهر الإلكتروني للتحقق من تكوين المادة النهائية المستعادة.
لا يزال تأثير ظروف التخزين على الحويصلات ومحتوياتها سؤالا مفتوحا. على الرغم من أنه وجد أن التخزين ليس له تأثير ملحوظ على حجم الحويصلة البكتيرية الزرقاء أو تركيزها14 ، إلا أن وظائف مستحضرات الحويصلة المعزولة قد تتغير بمرور الوقت44. وفي حين ينبغي تجنب دورات التجميد/الذوبان كلما أمكن ذلك، يبدو أن تأثير تجميد العينات على أعداد الحويصلات وأحجامها الإجمالية ضئيل للغاية. يجب على المرء أن يكون على دراية بإمكانية تأثير دورات التجميد والذوبان على تكوين محتويات الحويصلات ، مثل طول الأحماض النووية المرتبطة بالحويصلة أو استقرار البروتينات.
الحويصلات من field samples
الطرق الحالية لعزل الحويصلات خارج الخلية عن البيئات المائية الطبيعية تشبه من الناحية المفاهيمية والتشغيلية تلك الموصوفة هنا للثقافات كبيرة الحجم. ومع ذلك ، يمكن أن تتطلب كميات أكبر من المواد. يمكن أن تتضمن هذه العينات الميدانية جمع وترشيح وتركيز مئات إلى آلاف اللترات من الماء للحصول على مواد كافية للتحليل. اعتمادا على تعكر العينة المستخدمة ، قد تكون هناك حاجة إلى دمج خطوة واحدة أو أكثر من خطوات الترشيح المسبق قبل مرشح 0.2 ميكرومتر. يجب أن يكون جهاز TFF المحدد المستخدم مناسبا للعمل مع هذه الكميات الكبيرة في فترة زمنية معقولة (من الناحية المثالية في ترتيب الساعات) ودون وضع ضغط مفرط على العينة. ومن الناحية العملية، غالبا ما ينطوي ذلك على استخدام مساحة سطح إجمالية أكبر بكثير مما يمكن تطبيقه على العينات القائمة على الاستزراع، فضلا عن أنابيب ذات قطر أكبر لتسهيل زيادة معدلات التدفق. ومن المرجح أن تؤدي هذه الزيادة في مساحة سطح المرشح إلى زيادة هامشية في خسائر الجسيمات مقارنة بترتيبات TFF الأصغر حجما وحجم نهائي أكبر من التركيز؛ ومع ذلك ، يجب موازنة هذه المخاوف مع اعتبارات إجمالي وقت المعالجة. بالنسبة لحالات مثل رحلة بحرية أوقيانوغرافية ممتدة حيث لن تعود العينات إلى المختبر لعدة أيام بعد أخذ العينات ، نوصي بإجراء الترشيح الأولي 0.2 ميكرومتر وخطوات TFF في الميدان. يمكن بعد ذلك تخزين هذا الحجم الأصغر من المواد المركزة عند 4 درجات مئوية أو -80 درجة مئوية على متن الطائرة (اعتمادا على التوافر والاعتبارات التحليلية النهائية) حتى يتم إعادتها إلى المختبر للمعالجة النهائية.
يمكن أن يكون عزل وفصل الحويصلات خارج الخلية عن الجسيمات الصغيرة الأخرى ، العضوية وغير العضوية على حد سواء ، تحديا ، وطرق فصل الجسيمات المختلفة ليست مثالية بعد. على سبيل المثال ، قد لا تفصل تدرجات كثافة اليوديكسانول بسهولة جميع فئات الحويصلات والفيروسات الموجودة في عينة معينة. وبما أن أنواع الجسيمات المربكة، وخصائصها الفيزيائية، ستختلف بين مواقع أخذ العينات، فمن المستحيل حاليا توفير بروتوكول من شأنه أن يقسم بقوة جميع فئات الجسيمات المائية الصغيرة. والتجربة والخطأ أمران أساسيان، وسيلزم إجراء تجارب على نطاق اليوديكسانول المستخدم في ظروف التدرج والطرد المركزي الفائق لزيادة الفصل إلى أقصى حد؛ قد تكون هناك حاجة أيضا إلى مجموعة من كسور الكثافة الأصغر حجما والأكثر دقة. اعتمادا على السياق ، قد يساعد استخدام تدرجات CsCl بدلا من اليوديكسانول في فصل الجسيمات البيئية45. ومع ذلك ، فإن التغيير في الظروف الأسموزية يمكن أن يؤدي إلى تحيزات في المنتجات النهائية المستردة ، كما نوقش أعلاه.
توصيف الحويصلة
أدوات تحليل الجسيمات النانوية ليست متاحة بعد بشكل روتيني في بيئات مختبرات علم الأحياء الدقيقة ولكنها أصبحت متاحة بشكل متزايد. جميع المنهجيات لها إيجابيات وسلبيات ، ونحن لا نقدم أي تأييد محدد لمنصة واحدة على أنها أفضل من جميع المنهجيات الأخرى لعمل الحويصلة البكتيرية الزرقاء ؛ والواقع أن لكل منها مقايضات خاصة فيما يتعلق بالتكاليف، والاستبانة، وسهولة الاستخدام، وحدود الكشف، والتوافق مع مختلف وسائط النمو/الخلفيات المؤقتة، وإمكانية استنساخ البيانات. بالإضافة إلى الأدوات القائمة على تحليل تتبع الجسيمات النانوية الموصوفة أعلاه ، يمكن تطبيق طرق أخرى ، بما في ذلك قياس التدفق الخلوي النانوي ، واستشعار النبض المقاوم للموائع الدقيقة ، واستشعار النبض المقاوم القابل للضبط ، 46,47. يجب أن يكون المستخدمون حريصين على معرفة تفاصيل أجهزتهم المتاحة والتحقق من أنها تعمل بشكل جيد مع نظامهم ، حيث واجهنا صعوبات عند استخدام بعض المنصات مع الوسائط القائمة على مياه البحر. نحن نشجع المجال على التحرك نحو التوصيف الكمي لحجم الحويصلة والتركيزات ومعدلات الإنتاج. إن قياس تركيزات الحويصلات على أساس جسيم أساسي لكل مل ، وليس من حيث محتوى البروتين أو المقاييس الأخرى ، سيسمح بدمج الحويصلات في أطر أكثر كمية ويتيح المقارنات البينية بين السلالات والظروف. هناك حاجة إلى مزيد من الجهود لتحسين القدرة على معايرة قياسات التركيز لجسيمات <100nm.
حقيقة أن قياسات معدل إنتاج الحويصلة تتم مباشرة من 0.2 ميكرومتر من المستنبتات الفائقة المصفاة لتقليل خسائر الجسيمات سترتبط بخطوات التنقية الأخرى الموضحة أعلاه. ومع ذلك ، هذا يعني أن النهج لا يميز بالضرورة بين الحويصلات الفعلية خارج الخلية والجسيمات الصغيرة الأخرى الموجودة في الثقافات. قد يساعد عد الجسيمات فقط ضمن نطاقات حجم محددة (على سبيل المثال ، قطر 50-250 نانومتر) في استبعاد بعض القيم المتطرفة ، ولكن هناك حاجة إلى تأكيد بصري بأن محتويات المستنبتات <0.2 ميكرومتر الحبيبية تبدو حويصلات مرتبطة بالغشاء (بواسطة TEM أو غيرها من النهج) لتكون قادرة على الادعاء على وجه التحديد بأن المرء يقيس إنتاج الحويصلات بدلا من إنتاج الجسيمات الشبيهة بالحويصلة.
أحد العوامل الأساسية في توصيف الحويصلة هو التأكد من أن عينة الحويصلة يتم تحليلها في نطاق الحساسية الخطية المناسب لجهاز تحليل الجسيمات النانوية. عندما تكون العينة مركزة للغاية ، فمن السهل تخفيف تلك المادة باستخدام مخزن مؤقت نظيف وإعادة تحليلها. من ناحية أخرى ، يمكن أن تؤدي كثافة الخلايا و / أو الحويصلة المنخفضة نسبيا لبعض مزارع البكتيريا الزرقاء في بعض الأحيان إلى مستحضرات حويصلة أقل من حدود الكشف عن بعض الأدوات. في الحالات التي يحدث فيها هذا مع تنقية الحويصلة السائبة ، يمكن للمرء أن يفكر في زراعة مزارع أكبر حجما ، أو إعادة تكوير المواد النهائية وتعليقها بحجم أصغر ، أو تقييم ما إذا كانت هناك خطوة في عملية العزل تحدث فيها خسائر مفرطة ويمكن تخفيفها. عند قياس معدلات إنتاج الحويصلة ، فإن الإصلاحات ليست بالضرورة بهذه البساطة. يمكن تركيز العينات إذا لزم الأمر ، ولكن يجب أن ترى الأولى ما إذا كانت التعديلات على الوسائط يمكن أن تؤدي إلى زيادة كثافة الخلايا أو ما إذا كان يمكن الحصول على عينات مركزة بما فيه الكفاية من نقاط زمنية لاحقة خلال المرحلة الأسية حيث ستكون التركيزات أعلى.
القيود
كما هو الحال مع أي بروتوكول ، فإن عزل الحويصلة باستخدام هذه الأساليب له قيود واضحة. لا تعتمد هذه الأساليب على ضمانها بأن التحضير النقي تماما للحويصلات سيتم عزله. قد تحتوي كل من الثقافات والعينات الميدانية على مواد أخرى ، والتي تهاجر بشكل مشابه للحويصلات في تدرجات الكثافة. ومع ذلك ، على الأقل ، فإن هذه الأنواع من منهجيات التنقية الإضافية ضرورية لضمان دقة وتكرار تحليل الحويصلة. بينما نصف نهج عزل الحويصلة في سياق البكتيريا الزرقاء ، فإن مزارع العديد من الميكروبات الأخرى ستحتوي أيضا على حويصلات بتركيزات منخفضة نسبيا ، ويجب أن تكون الإجراءات الموضحة هنا قابلة للتطبيق بشكل عام. ومن المتوقع ألا تكون هذه الطرق بمثابة بروتوكول دائم ولكن بدلا من ذلك كنقطة انطلاق لتحفيز التطورات المستقبلية في العمل مع الحويصلات خارج الخلية من الميكروبات المتنوعة. ويلزم بذل جهود في المستقبل لدمج هذه الأساليب مع نهج أخرى مثل أعمدة استبعاد الحجم أو تجزئة تدفق الحقل غير المتماثل لتحسين التمييز والفصل بين فئات مختلفة من الجسيمات الصغيرة والثقافات والعينات البيئية. ونأمل أيضا أن تستمر هذه التقنيات في التطور جنبا إلى جنب مع التحسينات في تقنيات توصيف الجسيمات النانوية لتحسين القدرة على فحص عدم التجانس داخل مجموعات الحويصلات ومحتوياتها وأدوارها الوظيفية الدقيقة في البيئة.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يعترف المؤلفون بدعم منصات i3S العلمية "الواجهات الحيوية وتكنولوجيا النانو" ، و "علم الأنسجة والمجهر الإلكتروني" ، وهي عضو في البنية التحتية الوطنية المنصة البرتغالية للتصوير الحيوي (PPBI-POCI-01-0145-FEDER-022122). كما نشكر البروفيسور ج. أ. غونزاليس رييس (جامعة قرطبة، إسبانيا) على المساعدة في تحسين بروتوكول تلطيخ المقاطع الرقيقة للغاية ل TEM، والدكتورة سيسيليا دورايس والدكتورة آنا ريتا بينتو (جامعة بورتو، البرتغال) على تحليل تتبع الجسيمات النانوية.
تم تمويل هذا العمل من قبل مؤسسة العلوم الوطنية الأمريكية (OCE-2049004 إلى SJB) ، ومن قبل صناديق Fundo Europeu de Desenvolvimento Regional (FEDER) من خلال البرنامج التشغيلي للتنافسية والتدويل (POCI) لعام 2020 ، البرتغال ، 2020 ، ومن خلال الأموال البرتغالية من خلال Fundação para a Ciência e a Tecnologia / Ministério da Ciência ، Tecnologia e Ensino Superior في إطار المشروع POCI-01-0145-FEDER-029540 (PTDC / BIA-OUT/29540/2017 to PO). كما تم الاعتراف بشكل كبير ب Fundação para a Ciência e a Tecnologia لزمالة الدكتوراه SFRH / BD / 130478 / 2017 (SL) ، ومنحة FCT Investigator IF/00256/2015 (PO). م. س. م. بدعم من زمالة ماري سكلودوفسكا-كوري الفردية (فريق إعادة الإدماج) ضمن البرنامج الإطاري أفق 2020 (H2020-MSCA-IF-2018-RI-844891).
Materials
| Name | Company | Catalog Number | Comments |
| 1x Phosphate buffered saline (PBS), pH 7.4 | Home-made buffer | --- | Standard wash/storage buffer which can be used with vesicles; can be made in lab or purchased commercially |
| 2% Uranyl acetate solution | Electron Microscopy Sciences | 22400-2 | Negative staining - TEM |
| 4x Laemmli Sample Buffer | Bio-Rad | 161-0747 | Denaturation of vesicle sample prior to proteolysis, required for lipopolysaccharides (LPS) staining |
| Amicon Ultra Centrifugal Filters (100 kDa) | Merck | UFC9100XX | Alternative option for centrifugal ultrafiltration |
| BG11 medium | Home-made medium | --- | Medium for cultivation of Synechocystis sp. PCC 6803 |
| Carbon Support Film 200 Mesh, copper. CF200-Cu | Electron Microscopy Sciences | 71150 | Transmission electron microscopy (TEM) grid |
| easiGlow Glow Discharge Cleaning System | Ted Pella | 91000 | Commercial TEM grid glow discharger |
| EMbed 812 epoxy resin | Electron Microscopy Sciences | 14120 | Ultra-thin sections - TEM |
| Filter holder for vacuum system | Thermo Fisher Scientific | 300-4000 | Reusable units with filter membrane support plates |
| Glutaraldehyde Grade I | Sigma-Aldrich | G5882-10X1ml | Ultra-thin sections - TEM |
| HEPES [N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) sodium salt] | Sigma-Aldrich | H7006 | Buffering agent for cyanobacterial growth media |
| Lead Citrate, Trihydrate | Electron Microscopy Sciences | 17800 | Stain for use in electron microscopy |
| Macrosep Advance Centrifugal Devices with Omega Membrane 100K | Pall | MAP100C36 | For centrifugal ultrafiltration of small volume samples |
| Millipore Pellicon 3 TFF Module | EMD Millipore | XX42P0060 or XX42P0080 | Alternative TFF option for concentrating large volume samples |
| Milli-Q Reference Water Purification System | Merck | Z00QSV0WW | Water purification system for obtaining type I ultrapure grade water |
| NanoSight | Malvern Panalytical | LM14 or NS300 | Nanoparticle tracking analysis |
| Optima L80 XP Ultracentrifuge | Beckman Coulter | L80 XP | Ultracentrifuge (or similar model) |
| OptiPrep / Iodixanol | Sigma-Aldrich | D1556 | Density gradient media |
| Osmium Tetroxide Reagent Plus | Sigma-Aldrich | 201030 | Ultra-thin sections - TEM |
| Pall Centramate PE TFF holder | Pall Corporation | FS002K10 | TFF module good for concentrating 10s-100s of L of sample; requires additional 30 or 100 kDa filter modules to scale with your estimated volumes |
| Peristaltic pump Masterflex L/S | Cole-Parmer | 07559-07 | Pump for driving large-scale TFF modules |
| Piston Gradient Fractionator | Biocomp Instruments | 152-001 | Automated density gradient fractionation |
| Polycarbonate tubes for the 70 Ti rotor | Beckman Coulter | 355618 | Reusable ultracentrifuge polycarbonate aluminum tubes with cap assembly |
| Pro99 medium | Home-made medium | --- | Medium for cultivation of Prochlorococcus |
| Pro-Q Emerald LPS Gel Stain Kit | Thermo Fisher Scientific | P20495 | LPS staining |
| SN medium | Home-made medium | --- | Medium for cultivation of cyanobacterial marine strains such as Synechococcus |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250-100G | Buffering agent in the preparation of vesicles samples for TEM |
| SW32Ti swinging bucket rotor | Beckman Coulter | 369650 | Ultracentrifuge rotor, holds 6x ~40 mL tubes; good for pelleting of bulk material |
| SW60Ti swinging bucket rotor | Beckman Coulter | 335650 | Ultracentrifuge rotor, holds 6x ~4.5 mL tubes; good for gradient purifications and final vesicle washes |
| Syringe 1mL Luer | BD Plastipak | 303172 | For vesicle isolation and loading samples into nanparticle tracking analysis (NTA) equipment |
| Syringe filter 0.2 µm | Pall Corporation | 4602 | For vesicle isolation from cultures |
| TAPS [N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid] | Sigma-Aldrich | T5130 | Buffering agent for cyanobacterial growth media |
| Transmission electron microscope | JEOL | JEM-1400 | Or similar microscope |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | Ultracentrifuge rotor, holds 8x ~39 mL tubes; good for pelleting of bulk material |
| Type XIV protease from Streptomyces griseus | Sigma-Aldrich | P5147 | Enzyme for proteolysis of EVs proteins, required for LPS staining |
| UltraClear tubes for the SW32Ti rotor | Beckman Coulter | 344058 | Single use ultracentrifuge tubes |
| UltraClear tubes for the SW60Ti rotor | Beckman Coulter | 344062 | Single use ultracentrifuge tubes |
| Ultramicrotome PowerTome XL, PT-PC | RMC Products, Boeckeler Instruments | 75501 | Microtome for ultra-thin sections - TEM |
| Universal 320 R centrifuge | Hettich | Z654736 | This or any similar general-purpose benchtop/floor standing centrifuge can be used for pelleting cells |
| Vacuum apparatus | KNF Neuberger | N026.3 AT.18 | Or any similar vacuum pump and trap |
| Vivaflow 200 100,000 MWCO PES | Sartorius | VF20P4 | TFF module, good for 2-3L. You can connect different modules for higher volume (figure 1). |
| Whatman Polycap TC Capsule filter (0.2/0.2µm) | Cytiva | 6717-9502 | Capsule filter for filtering large volumes of liquid |
| Zetasizer | Malvern Panalytical | Zetasizer Nano ZS | Dynamic light scattering (DLS) instrument |
References
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Coelho, C., Casadevall, A. Answers to naysayers regarding microbial extracellular vesicles. Biochemical Society Transactions. 47 (4), 1005-1012 (2019).
- Schwechheimer, C., Kuehn, M. J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions. Nature Reviews Microbiology. 13 (10), 605-619 (2015).
- Toyofuku, M., Nomura, N., Eberl, L. Types and origins of bacterial membrane vesicles. Nature Reviews Microbiology. 17 (1), 13-24 (2019).
- Kulp, A., Kuehn, M. J. Biological Functions and Biogenesis of Secreted Bacterial Outer Membrane Vesicles. Annual Review of Microbiology. 64 (1), 163-184 (2010).
- Berman-Frank, I., Lundgren, P., Falkowski, P. Nitrogen fixation and photosynthetic oxygen evolution in cyanobacteria. Research in Microbiology. 154 (3), 157-164 (2003).
- Flores, E., Herrero, A. Compartmentalized function through cell differentiation in filamentous cyanobacteria. Nature Reviews Microbiology. 8 (1), 39-50 (2010).
- Flombaum, P., et al. Present and future global distributions of the marine cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9824(2013).
- Biller, S. J., Berube, P. M., Lindell, D., Chisholm, S. W. Prochlorococcus: the structure and function of collective diversity. Nature Reviews Microbiology. 13 (1), 13-27 (2015).
- Abed, R. M. M., Dobretsov, S., Sudesh, K. Applications of cyanobacteria in biotechnology. Journal of Applied Microbiology. 106 (1), 1-12 (2009).
- Lea-Smith, D. J., et al. Editorial: Exploring the growing role of cyanobacteria in industrial biotechnology and sustainability. Frontiers in Microbiology. 12, 1963(2021).
- Garcia-Pichel, F., Zehr, J. P., Bhattacharya, D., Pakrasi, H. B. What's in a name? The case of cyanobacteria. Journal of Phycology. 56 (1), 1-5 (2020).
- Biller, S. J., et al. Bacterial vesicles in marine ecosystems. Science. 343 (6167), 183(2014).
- Pardo, Y. A., Florez, C., Baker, K. M., Schertzer, J. W., Mahler, G. J. Detection of outer membrane vesicles in Synechocystis PCC 6803. FEMS Microbiology Letters. 362 (20), (2015).
- Oliveira, P., et al. The versatile TolC-like Slr1270 in the cyanobacterium Synechocystis sp. PCC 6803. Environmental Microbiology. 18 (2), 486-502 (2016).
- Biller, S. J., et al. Membrane vesicles in sea water: heterogeneous DNA content and implications for viral abundance estimates. The ISME Journal. 11 (2), 394-404 (2017).
- Yin, H., et al. Synechococcus elongatus PCC7942 secretes extracellular vesicles to accelerate cutaneous wound healing by promoting angiogenesis. Theranostics. 9 (9), 2678-2693 (2019).
- Lima, S., Matinha-Cardoso, J., Tamagnini, P., Oliveira, P. Extracellular vesicles: An overlooked secretion system in cyanobacteria. Life. 10 (8), 129(2020).
- Gupta, S., Marcela Rodriguez, G. Isolation and characterization of extracellular vesicles produced by iron-limited mycobacteria. Journal of Visualized Experiments: JoVE. (152), e60359(2019).
- Jung, A. L., et al. Legionella pneumophila outer membrane vesicles: Isolation and analysis of their pro-inflammatory potential on macrophages. Journal of Visualized Experiments: JoVE. (120), e55146(2017).
- Fantappiè, L., et al. Antibody-mediated immunity induced by engineered Escherichia coli OMVs carrying heterologous antigens in their lumen. Journal of Extracellular Vesicles. 3 (1), (2014).
- Moore, L. R., et al. Culturing the marine cyanobacterium Prochlorococcus. Limnology and Oceanography: Methods. 5 (10), 353-362 (2007).
- Rippka, R., et al. Prochlorococcus marinus Chisholm et al. 1992 subs. Pastoris subs. nov. Strain PCC 9511, the first axenic chlorophyll a2/b2-containing cyanobacterium (Oxyphotobacteria). International Journal of Systematic and Evolutionary Microbiology. 50 (5), 1833(2000).
- Moore, L. R., Chisholm, S. W. Photophysiology of the marine cyanobacterium Prochlorococcus: Ecotypic differences among cultured isolates. Limnology and Oceanography. 44 (3), 628(1999).
- Charpy, L., Larkum, A. W. D. Bulletin de l'Institut Océanographique de Monaco, (n spécial 19). , 457-475 (1999).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Fomsgaard, A., Freudenberg, M. A., Galanos, C. Modification of the silver staining technique to detect lipopolysaccharide in polyacrylamide gels. Journal of Clinical Microbiology. 28 (12), 2627-2631 (1990).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Peterson, T. Densitometric analysis using NIH image. North American Vascular Biology Organization (NAVBO) eNewsletter. 16 (3), (2010).
- Jürgens, U. J., Weckesser, J. Carotenoid-containing outer membrane of Synechocystis sp. strain PCC6714. Journal of Bacteriology. 164 (1), 384-389 (1985).
- Whitfield, C., Trent, M. S. Biosynthesis and export of bacterial lipopolysaccharides. Annual Review of Biochemistry. 83 (1), 99-128 (2014).
- McBroom, A. J., Johnson, A. P., Vemulapalli, S., Kuehn, M. J. Outer membrane vesicle production by Escherichia coli is independent of membrane instability. Journal of Bacteriology. 188 (15), 5385-5392 (2006).
- Kadurugamuwa, J. L., Beveridge, T. J. Virulence factors are released from Pseudomonas aeruginosa in association with membrane vesicles during normal growth and exposure to gentamicin: a novel mechanism of enzyme secretion. Journal of Bacteriology. 177 (14), 3998-4008 (1995).
- Nguyen, T. T., Saxena, A., Beveridge, T. J. Effect of surface lipopolysaccharide on the nature of membrane vesicles liberated from the Gram-negative bacterium Pseudomonas aeruginosa. Journal of Electron Microscopy. 52 (5), 465-469 (2003).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Norena-Caro, D. A., Malone, T. M., Benton, M. G. Nitrogen sources and iron availability affect pigment biosynthesis and nutrient consumption in Anabaena sp. UTEX 2576. Microorganisms. 9 (2), 431(2021).
- Rippka, R. Isolation and purification of cyanobacteria. Methods in Enzymology. , Academic Press. 3-27 (1988).
- Van Alphen, P., Abedini Najafabadi, H., Branco dos Santos, F., Hellingwerf, K. J. Increasing the photoautotrophic growth rate of Synechocystis sp. PCC 6803 by identifying the limitations of its cultivation. Biotechnology Journal. 13 (8), 1700764(2018).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA. mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12 (383), (2021).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209(2019).
- Soares, N. C., et al. Associating growth-phase-related changes in the proteome of Acinetobacter baumannii with increased resistance to oxidative stress. Journal of Proteome Research. 9 (4), 1951-1964 (2010).
- Thurber, R. V., Haynes, M., Breitbart, M., Wegley, L., Rohwer, F. Laboratory procedures to generate viral metagenomes. Nature Protocols. 4 (4), 470-483 (2009).
- Dell'Annunziata, F., et al. Outer membrane vesicles derived from Klebsiella pneumoniae are a driving force for horizontal gene transfer. International Journal of Molecular Sciences. 22 (16), 8732(2021).
- Linney, M. D., Schvarcz, C. R., Steward, G. F., DeLong, E. F., Karl, D. M. A method for characterizing dissolved DNA and its application to the North Pacific Subtropical Gyre. Limnology and Oceanography: Methods. 19 (3), 210-221 (2021).
- Arab, T., et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms. Journal of Extracellular Vesicles. 10 (6), 12079(2021).
- Cimorelli, M., Nieuwland, R., Varga, Z., vander Pol, E. Standardized procedure to measure the size distribution of extracellular vesicles together with other particles in biofluids with microfluidic resistive pulse sensing. PLoS ONE. 16 (4), 0249603(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved