Method Article
シアノバクテリア細胞外小胞の単離と特性評価
* これらの著者は同等に貢献しました
要約
本プロトコールは、シアノバクテリア培養物からの細胞外小胞の単離、濃縮、および特性評価に関する詳細な説明を提供する。異なるスケールの培養物から小胞を精製するためのアプローチ、方法論間のトレードオフ、およびフィールドサンプルを扱うための考慮事項についても議論する。
要約
シアノバクテリアは、光合成のグラム陰性細菌の多様なグループであり、地球生態系において重要な役割を果たし、不可欠なバイオテクノロジーモデルとして機能します。最近の研究は、海洋と淡水の両方のシアノバクテリアが細胞外小胞 - 微生物の外表面から放出された小さな膜結合構造 - を産生することを実証しました。小胞は多様な生物学的プロセスに寄与する可能性が高いが、シアノバクテリア生物学におけるそれらの特定の機能的役割はほとんど知られていない。この分野における研究を奨励し、前進させるために、シアノバクテリアの細胞外小胞を単離、濃縮、および精製するための詳細なプロトコルが提示される。現在の研究は、プロクロロコッカス 、シネココッカス、およびシネコシスチスの大規模培養物から小胞を単離することに成功した方法論について論じ ている。これらの株からの小胞サンプルを定量および特徴付けるための方法が提示される。水生場サンプルから小胞を単離するためのアプローチも記載されている。最後に、シアノバクテリア小胞の精製で直面する典型的な課題、さまざまな下流用途の方法論的考慮事項、およびアプローチ間のトレードオフについても議論します。
概要
細胞外小胞(EV)は球状構造で、直径は約20〜400nmの範囲で、事実上すべての生物によって周囲の環境に放出されます1,2,3。小胞は脂質二重層によって区切られており、それ自体を複製することはできません。グラム陰性菌では、これらの構造は主に外膜からの小さな部分の「ブレビング」によって生じると考えられている。それでも、鞭毛運動、細胞溶解、および内膜および外膜材料の両方の分泌を含む他のプロセスも、小胞を産生することができる4,5。EVは、脂質、可溶性および膜タンパク質、核酸、および代謝産物を含む様々な生体分子を含むことができ、細胞間でこの物質を輸送することができる4、5、6。これらの特徴を考慮して、EVは、細胞通信、バイオフィルム形成、水平遺伝子導入、宿主ファージダイナミクス、および栄養交換を含む幅広い生物学的プロセスにおけるそれらの可能な役割を理解するために研究されている4,6。
シアノバクテリアは、単細胞および糸状生物を含むグラム陰性細菌の大規模で多様なグループである。彼らは、生理学と多様性7,8、それらが果たす重要な生態系機能9,10、バイオテクノロジー11,12の有用性を理解するなど、多くの観点から興味深いものです。シアノバクテリアは、海洋、淡水、陸生環境の自由生活生物として、またはコケ、シダ、植物、または地衣類や海綿類との共生関連のいずれかで、多種多様な生息地で発見されています13。彼らは水生生態系における重要な一次生産者として機能し、酸素光合成9,10を通して酸素と有機炭素を生産し、一部は大気中の窒素も固定することができます7。プロクロロコッカス、シネココッカス、シネコシスチスなどの海洋および淡水のシアノバクテリアは、実験室条件下でEVを生産し14,15,16、シアノバクテリア小胞も自然環境14,17で見つけることができます。シアノバクテリア小胞の生物学的および生態学的機能は不明であるが、この分野におけるさらなる研究は、シアノバクテリアの生理学、分化、コミュニケーション戦略、進化、および栄養相互作用に関する疑問に対する新しい洞察を提供する可能性が高い。さらに、多様なカテゴリーの生体分子を運ぶシアノバクテリアEVの能力は、商業的用途を有する可能性がある18,19。
本プロトコールは、シアノバクテリアの細胞外小胞生物学のより広範な研究を可能にし、奨励するために、シアノバクテリア培養物およびフィールドサンプルから小胞を単離および特徴付けるための方法を記載する。ここで説明するワークフローは、他の細菌からEVを単離および特徴付けるためのプロトコルに類似しているが、シアノバクテリア培養物および野外サンプルは、典型的には、宿主関連または病原性モデル系で一般的に観察されるよりも低い細胞および小胞濃度を含む20,21,22。したがって、シアノバクテリアEVの研究には、培養および小胞単離のための特別な考慮事項および最適化が必要であり、これは株および培地の背景によってさらに異なる。単一のプロトコルがすべての菌株、成長条件、および下流のアプリケーションで同等にうまく機能するわけではないため、研究者が実験上の問題に対処するのに最も適したアプローチを決定できるように、複数のオプションを提供し、関連するトレードオフについて議論します。
プロトコル
シアノバクテリア株は、いくつかの培養コレクションから取得される(詳細については 、議論 を参照のこと)。
1. シアノバクテリア培養
- 以下の手順に従って、海洋シアノバクテリア プロクロロ コッカ スとシネココッカス を培養します。
- Proクロロコッカス株およびシネココッカス株をポリカーボネートフラスコ中で、Pro99またはSNなどの適切な培地を用いて培養する(材料表を参照)。詳しくは、既刊の参考文献23,24をご覧ください。
- 実験に必要な所望の温度および放射照度条件下で、2〜3回の移送(継代ごとに新鮮な培地への培養物の1:20希釈)にわたってそれらを増殖させることによって、培養物を順応させる。
注:典型的な成長条件23,25には、8〜150μmol光子m−2 s−1の間の放射照度で15〜30°Cの間の温度が含まれるが、個々の株の許容差および最適度は大きく異なり26、関連する培養収集指示書または文献からのガイダンスに基づいて設定する必要がある。培養蛍光カウントまたはフローサイトメトリーカウント23を使用して増殖速度を監視し、実験を開始する前に培養物が一貫した定常状態指数速度で増殖することを確認します。 - 細胞が後期指数期に達したら、より小さい容量からより大きな容量への一連の連続した段階的移入を行う(例えば、20 mL < 250 mL < 2 L < 10 L < 20 L)。
注:大量の培養物は、少量の開始培養物から直接接種することはできません。大規模な培養では、バッファー (1 mM HEPES、pH 7.5 または 3.75 mM TAPS など)、補助的な炭酸水素ナトリウム、または滅菌空気24 によるバブリングが必要になる場合があります。
- 淡水シアノバクテリウム ・シネコシスチス 属PCC 6803を栽培する。
- 接種源として使用するSynechocystis sp. PCC 6803の培養液を、30°Cで、16時間光(光子数50μmol m-2 s-1)/8時間暗所体制下、BG11培地27で730nm(OD730)の光学濃度が1.0(指数期)になるまで培養することにより調製する。
- この培養物 であるシネコシスティス sp. PCC 6803 30 mL を 570 mL の BG11 培地に 0.05 の OD730 を 1 L のガラス製ガス洗浄ボトルに接種する。
- 細胞を通気しながら、30°Cで、16時間の光(光子数50μmol m-2 s-1)/ 8時間の暗所体制下で、最終OD730が1.0〜1.5になるまで増殖させる。
2. 小粒子(小胞)画分からのシアノバクテリアバイオマスの分離
注:まず、細胞の遠心ペレット化によって上清から細胞を分離することをお勧めします。しかし、培養量が大きすぎてこれが実現できない場合、遠心分離をスキップし、カプセル濾過を用いて培養物全体を濾過することに直接進むことができる(ステップ2.4)。
- 遠心分離を実行して細胞を分離します(使用可能な遠心分離機容量に応じて、最大 4 L の容量に最適です)。
- オートクレーブまたはタイプIの超純水( 材料表を参照)を使用して遠心分離ボトルを徹底的に洗浄して洗浄し、残留石鹸または他の材料が残っていないことを確認します。
- 培養サンプルを適切な数の遠心分離機ボトルにロードし、バランスを取ります。
- >10,000 x g の培養物を4°Cで10分間スピンする。上清が目に見えて濁ったままの場合は、遠心分離条件を最高速度で20分間に増やし、再試行してください。
- 上清を慎重にデカントまたはピペットで清潔な容器に入れ、手順2.2~2.4で説明した以下のろ過オプションのいずれかに進みます。
- オプション1:0.2μmフィルター(最大50mLのサンプル量)を使用してシリンジろ過を実行します。
- 滅菌した 50 mL シリンジに大部分が無細胞の培養培地を充填し、0.2 (または 0.45) μm のポリエーテルスルホン (PES) フィルターでろ過します ( 材料表を参照)。濾液を清潔で滅菌された容器に集める。
- フィルターが目詰まりするまで(例えば、シリンジで押すことが困難になるまで)、この手順を繰り返します。新しいフィルターと交換し、サンプルが完全にろ過されるまで続行します。
- オプション2:0.2μmの真空ろ過(最大4L)を実行します。
- タイプI-超純水を使用して真空装置を徹底的に洗浄し、洗浄し、真空トラップとポンプに接続します( 材料表を参照)。
- 適切な直径の0.2μmフィルターを挿入し、真空装置をクランプする。
- 少量の培養サンプルを加え、真空圧力が<10psiのままであることを確認する。
- 完了するまで、カルチャのフィルター処理を少しずつ続けます。ろ過速度が大幅に遅くなる場合は、真空を停止してフィルターを交換してください。
- 小胞を含む<0.2μm画分を清潔な容器に集める。
- オプション3:0.2μmカプセルろ過(サンプル量>〜4Lの場合)
- 適切なサイズの可撓性チューブと回収容器は、水と中性洗剤で洗浄して清掃してください。蒸留水と脱イオン水で材料をすすいでください。
注:使用する前に、材料はタイプI - 超純潔グレードの水ですすいでください。 - 濾過する培養物を、下の最終的な収集容器を有する安全で高い場所に置く。0.2μmのカプセルフィルター( 材料表を参照)の流出口を1本のチューブに接続し、回収容器に入れます。
- サンプルに別のチューブを入れ、シリンジでサンプルをチューブに引き込んで重力サイフォンを開始し、チューブをカプセルフィルターに接続します。通気口を使用して余分な空気を放出し、チャンバーを上澄み液で満たします。
- サンプルが完全にろ過されるまで、材料がカプセル内を移動するのを許します。流量が遅くなりすぎる場合(開始流量の<〜1/10、または連続的に流れる流れとは対照的に滴下して出てくる場合)、背圧が上昇するまでペリスタルティックポンプで待機するか、穏やかな力を加えます。あるいは、フィルターを一時的に取り外して流量を部分的に回復させ、流入側から蓄積されたバイオマスを超清浄な水でバックフラッシュして、材料が目に見えて濁らなくなるまでしてから、ろ過プロセスを再開します。
- 適切なサイズの可撓性チューブと回収容器は、水と中性洗剤で洗浄して清掃してください。蒸留水と脱イオン水で材料をすすいでください。
3. 小胞サンプルの濃縮
- オプション1:少量(<500mL)のサンプルを濃縮するための遠心限外ろ過を実行します。
- お好みの15~20 mLの限外ろ過遠心濃縮機をタイプI - 超純水ですすいでください。
- 濃縮器を遠心分離機に装填し、4°Cで4,400 x g で回転させる。 実行を破棄し、この手順を少なくとも 2 回繰り返します。
- 上澄みサンプルを水すすぎ濃縮器にロードし、同じ条件でスピンします。実験目標に応じて、サンプル濾液を廃棄または回収して、さらなる濃縮(公称分子量限界が3kDaの濃縮器を使用)および分析することができます。
- サンプルが〜15〜30mLの最終容量まで濃縮されるまで、このステップを繰り返します。
- オプション2:大量の(>500mL)サンプルを濃縮するための接線流ろ過(TFF)を実行します。
- 製造元のガイドラインに従ってTFF装置をセットアップします( 材料表を参照)。ペリスタルティックポンプを吸気ラインに取り付け、保持ラインに調整可能なクランプを置きます。製造元の推奨に従ってTFFを消毒し、1LのタイプI - 超純水でデバイスを洗い流します。
注:インテークラインと保持ラインは、清潔なサンプルリザーバ(ガラス瓶)に入れる必要があります。濾液ラインは、廃棄物容器または流し台に向ける必要があります。 - <0.2 μmのろ液をサンプルリザーバに加える。保持液ラインのポンプ速度と背圧レベルをゆっくりと上げて、濾液ラインからの出力を増やします。
- TFFを稼働させ続け、物質が除去されるように培養上清をリザーバに補充する。気泡の導入を避けるために、処理中にサンプルから吸気ラインが出てくるのを避けてください。供給圧力が~10 psiを超えないようにし、保持液がTFFから一定のペースでリザーバに流れ戻ってくることを確認します。
- リザーバ内の体積が気泡を導入せずに吸気ラインへの流れを維持するために必要な最小量に達したら、サンプルの濃縮を停止します。
- 流出ラインをクランプで閉じます。保持液ラインの背圧を除去し、濃縮された上清をフィルターを通して約10分間再循環させ、再循環速度を20〜40mL/分に減少させて回収率を最大化する。
- 保持液ラインを清潔な容器に移動し、サンプルから吸気ラインを取り外し、濃縮材料を回収する。ピペットを使用してサンプルリザーバに残っている材料を回収します。
- 濃縮した上清を0.2μmのシリンジフィルターでろ過し(ステップ2.2)、細胞が残っていないことを確認します。
メモ: ステップ 3.2.7 はオプションです。 - 必要に応じて、最終濃縮物を4°Cで約3週間保存してから、小胞精製に移行する(ステップ4)。
- 製造元のガイドラインに従ってTFF装置をセットアップします( 材料表を参照)。ペリスタルティックポンプを吸気ラインに取り付け、保持ラインに調整可能なクランプを置きます。製造元の推奨に従ってTFFを消毒し、1LのタイプI - 超純水でデバイスを洗い流します。
4. 小胞の単離精製
- ペレットは、以下の手順に従って超遠心分離により直接行う。
- 濃縮した<0.2 μm培養サンプルを清潔な超遠心管に入れる。必要に応じて清潔なメディアまたはバッファーを追加して、チューブが完全に満たされていることを確認します。
注:最終培養サンプルが大きすぎて1つのチューブに収まらない場合は、洗浄ステップの前に組み合わせる複数のチューブで材料をペレット化するか、同じチューブ内で連続してペレット化します。 - 必要に応じて、天秤を作り、約100,000 x g で4°Cで3時間スピンします。
- 上清をピペットで慎重に取り除きます。シアノバクテリア小胞ペレットは多少の着色を示すことがありますが、しばしば目に見えません。
- 新鮮な培養培地または1xリン酸緩衝生理食塩水(PBS)などの洗浄緩衝液( 「議論」を参照)を超遠心管に加え、穏やかなピペッティングで混合し、ステップ4.1.2のように再び回転させて、ペレット状の材料を洗浄する。洗浄プロセスをもう一度繰り返します。
- 1mLピペットでチューブの底の周りを上下に繰り返しながら穏やかにピペッティングすることによって、最終ペレットを新鮮な培養物に再懸濁する。清潔な容器に移す。
- 濃縮した<0.2 μm培養サンプルを清潔な超遠心管に入れる。必要に応じて清潔なメディアまたはバッファーを追加して、チューブが完全に満たされていることを確認します。
- 密度勾配超遠心分離を行う。
- サンプルに必要なバッファーバックグラウンドの4倍の濃縮バージョンを作成して、イオジキサノールストック( 材料表を参照)を調製します( 「ディスカッション」を参照)。
- 4x緩衝液の1部を60%ヨウジキサノールストックの3部と混合して、45%ヨウジキサノール溶液を作る。
- 45%のイオジキサノールを1x緩衝液の容量で希釈し、40%、35%、30%、25%、20%、15%、および10%の最終イオジキサノール濃度でグラジエント培地のストックを作成する。
注:必要な合計量は、超遠心ローター/チューブの容量によって異なります。 - チューブの全容積が利用されるように、45%、40%、35%、30%、25%、20%、15%、10%、および0%のイオキシジノールの等量を超遠沈チューブに慎重に重ね合わせることによって、超遠心密度勾配を設定する。
注:精製される細胞外小胞サンプルは、0%ヨウジキサノール層の一部として勾配の上部に配置する必要があります。ベシクルサンプルの最終体積が0%層のサイズを超える場合は、過剰なベシクルサンプルを十分な45%イオジキサノールおよび/またはバッファーと混合して、10%以上の濃度のオプティプレップストックの必要な容量を生成し、これらをグラジエント内の対応する場所で使用します。 - グラジエントを 4 °C で約 100,000 x g で 6 時間回転させます。
- フラクション(通常、約4.5 mLのグラジエントでそれぞれ0.5 mL)を、慎重なピペッティングまたはフラクションコレクター( 材料表を参照)を使用して収集します。
- 分析天秤と較正ピペットを使用して各フラクションの密度(g/mL)を決定し、既知の量のサンプルの重量を測定します。チューブからサンプルを取り出し、重量を決定し、サンプルを直接返却します。
- 新しい超遠心管で個々の画分を清潔な緩衝液で希釈し、ステップ4.1.2-4.1.4で述べたように材料を洗浄する。あるいは、透析カラムまたは限外ろ過カラムを使用して粒子を回収することもできます。
注:シアノバクテリアの細胞外小胞は、典型的には、イオジキサノール中で〜1.14〜1.19g / mLの浮力密度に移行する。
- 小胞を1〜3週間以内に使用する場合は、4°Cで保管してください。小胞を-20°Cまたは-80°Cで凍結し、その期間を超えて使用しない場合は凍結する。
5. 単離された小胞の特性評価
- ネガティブ染色透過型電子顕微鏡( 材料表参照)(TEM;粒径、構造、純度)を行う。
- 画質を向上させるには、メーカーのガイドラインに従ってグロー放電システムを使用して、前者でコーティングされたTEMグリッドの表面をグロー放電します( 材料表を参照)。
- 約5μLの小胞サンプルを慎重に塗布し、5分間放置する。
注:小胞濃度>109 mL-1のサンプルは、通常、最良の結果が得られます。より希薄なサンプルは、画像ごとにいくつかの小胞を有するであろう。 - グリッドの端をきれいなろ紙に触れてサンプルを取り出します。
- プラスチックフィルムで覆われた平らな面に20〜50μLの2%酢酸ウラニル( 材料表を参照)をピペッティングし、その上に浮かぶグリッドを2分間置きます。
- ろ紙を使って酢酸ウラニルを取り除き、超純水一滴に短時間浮かべて洗浄します。水洗いをもう一度繰り返します。
注: 最終的なドライグリッドは、ステップ 5.1.5 以降に視覚化する準備ができています。
- TEM(粒径、内部構造)に対して超薄切片染色を行う。
- ステップ4.1.5のペレットを0.1 Mカコジル酸ナトリウム緩衝液(pH 7)中の2.5%グルタルアルデヒド1 mLで再懸濁し( 材料表を参照)、サンプルを4°Cで2時間固定する。
- ~100,000 x g で4°Cで1時間スピンします。
- ペレットを0.1 Mカコジル酸ナトリウム緩衝液(pH 7)で注意深く洗浄し、次いで〜100,000 x g で4°Cで1時間スピンする。
- ペレットを1mLの1%四酸化オスミウム( 材料表を参照)(0.1Mカコジル酸ナトリウム緩衝液中で調製)で1時間固定し、次いでステップ5.2.3と同様に洗浄する。
- 1mLのアセンダント系列エタノール(50%、70%、90%、および無水エタノール中で2回)でサンプルを4°Cでそれぞれ10分間のステップで脱水する。
- 無水エタノール(1:1)と混合した250μLのエポキシ樹脂( 材料表を参照)をペレットに加え、4°Cで一晩インキュベートする。
- ペレットを500μLの純樹脂に24時間移す。次いで、樹脂を65°Cで48時間インキュベートする。
メモ:これで、樹脂は製造元の指示に従ってウルトラミクロトームで切片化できる状態になりました( 材料表を参照)。 - 切片を含むグリッドを2%酢酸ウラニル(50%エタノール中)で5分間染色する。スライドを、稼働中の脱イオン水でそれぞれ10~15秒間優しく洗浄します。クエン酸鉛を一滴( 材料表を参照)に置き、さらに5分間染色する。
- 先ほどと同じように洗い流し、ろ紙でグリッドを吸い取って水を取り除き、グリッドを風乾します。メーカーのガイドラインに従ってTEMで可視化します( 材料表を参照)。
- ナノ粒子追跡分析(NTA)(粒子サイズ、濃度)を実行します。
- レンズ用紙を使用して、光学式フラットからほこりや目に見える物質を慎重に拭き取ります。すべてのOリングと他のシールが清潔で無傷であるかどうかを確認します。計測器の電源を入れ、ソフトウェアを起動します。
- 清潔な注射器を使用して、チャンバーを超純水で満たします。気泡が存在しないことを確認します。
- [カメラの開始]をクリックし、「拇印」に関するチャンバーの最適な領域を視覚化します。必要に応じて顕微鏡ステージを水平または垂直に調整して、信号強度が画像領域全体で均等になるようにします。撮影領域を拇印に対して水平方向に(右に、垂直線に向かって)移動させ、背景信号が低い近くの領域を見つける。
- スクリーンゲインスライダとカメラレベルスライダを最大までスライドさせ、次に最も低いレベルまで下げて、最も暗いパーティクルを表示します。
注:シアノバクテリア小胞の一般的な設定では、スクリーンゲイン7とカメラレベル10〜12を使用します。 - 必要に応じてフォーカスを調整して、パーティクルが視野全体でほぼ均等に見えるようにします。チャンバーが清潔であることを視覚的に確認するまで、超きれいな水をチャンバーに押し込み続けます。
- 別のシリンジを使用してチャンバーから残留水を除去する。
- サンプルが入っている培地/バッファーのサンプルを調べ、クリーンな 1 mL シリンジを使用してチャンバーをメディア/バッファーで満たしてバックグラウンド粒子濃度を決定します。
- [ SOP ]ドロップダウンボックスから[標準測定]を選択します。設定を変更して、それぞれ 60 秒のビデオの技術的な複製を少なくとも 3 つ収集します。 [スクリプトの作成と実行] を押し、画面の指示に従います。複製の間に約100μLのサンプルをチャンバーに押し込みます。
- 取得が完了したら、シリンジで残留バッファーを除去し、チャンバーを通して3〜5mLの超純水を流し、残りの水を除去する。
- 1mLシリンジを用いて小胞サンプルをチャンバーに加え、取得設定を確認する。粒子数が装置の直線範囲内にない場合(通常、20〜80個の粒子/フレームの間)、サンプルを希釈または濃縮する必要があります。データを収集する前に、少なくとも500 μLのサンプルをチャンバーに押し込みます。
- ステップ5.3.8のようにビデオデータを収集し、異なるサンプル間で超純水でチャンバーを清掃してください。
- データの比較可能性を確保するために、同じカメラ設定を使用して同じ生物/実験から後続のすべてのサンプルを収集します。[カメラ レベル] 設定の変更は、取得される最終値に顕著な影響を与える可能性があります。
- ソフトウェアの解析セクションを使用して粒子パラメータを決定します。[ 分析] > [実験を開く] を選択し、サンプル ファイルを読み込みます。[ 選択したファイルを処理 ] を選択し、分析が完了するのを待ちます。同じ実験からの後続のすべてのサンプルに同じ 検出しきい値 を使用するようにしてください。
注: シアノバクテリア小胞はしばしば薄暗いため、検出しきい値は通常、最も感度の高い(最も低い)値に調整する必要があります。
- 動的光散乱(DLS)(粒径、ゼータ電位)を行う。
- DLSに入るサンプルを0.2μmの孔径フィルターでろ過し、測定を妨げる大きな粒子をスクリーニングします。
- 1 mL の培地/バッファーをクリーンなキュベットに加え、凝集の可能性や培地から来る他のナノ粒子を調べます。左側がつや消しの付いたキュベットをマイクロサンプラーに入れ、蓋を閉めます。サンプルを少なくとも5分間平衡化させます。
- 材料の屈折率と、水のデフォルトと大きく異なる場合は、材料の吸収を入力します。
注:小胞が100nmより小さい場合、材料特性にはほとんど影響しません。EVの表面電位(ゼータ電位)を測定する場合、小胞は元の成長培地に再懸濁する必要があります。 - インストルメントコントロールパネルをクリックして測定値を確認し、緑色のアイコンをクリックしてデータ集録を開始します。値が良好に見え、メディア/バッファーに凝集やその他のパーティクルが含まれていない場合は、サンプルを測定する準備ができました。
- 1 mL の小胞サンプルをきれいなキュベットに加え、ステップ 5.4.4 で説明したようにデータを収集します。少なくとも3つの技術反復をそれぞれ10分間収集します。
- リポ多糖(LPS)分析を行い、グラム陰性EVがサンプル中に存在することを確認します。
- ベシクルサンプルを標準1x Laemmliサンプルバッファー中で95°Cで10分間加熱変性させる( 材料表を参照)。
- ストレプトマイセス・グリセウス(材料表を参照)由来の0.2U型XIVプロテアーゼを37°Cで30分間インキュベートし、夾雑糖タンパク質を除去した。
- 以前に公開されたプロトコル16に従って変性16%(w/v)SDSポリアクリルアミドゲル上で電気泳動によって処理されたサンプルを分離する16。
- LPSを検出するには、市販の染色キットまたは修正銀染色技術28のいずれかでゲルを染色する。以前に公開された参考文献29、30に従って染色されたゲルのデンシトメトリー分析によって相対LPS存在量を定量する。
6. 小胞生産率測定
- ステップ5.3のようなナノ粒子追跡分析、または同等の技術を使用して、実験用成長媒体中の粒子濃度を測定する。高い粒子数が見つかった場合は、0.1 μmの細孔フィルターでろ過し、再確認してください。
注: 誤差を最小限に抑えるために、培地バックグラウンド粒子濃度は、最低濃度の培養物で見つかった粒子濃度の 10% 未満である必要があります。 - ステップ1.1.2のように実験に望ましい培地および環境条件下で少なくとも2つの連続した連続移動のために細胞を増殖させることによって培養物を順応させる。文化は、指数関数的な成長段階にある間に移す必要があります。測定された培養増殖率が移送間で一貫していることを確認する。そうでない場合は、成長率が再現可能になるまで培養物を移し続けます。
- 接種時にタイムコースサンプルを収集し、成長曲線を横切って初期の静止期まで定期的に時間間隔を計ります。時間ポイントをずらして、指数関数的な成長の全範囲にわたって少なくとも3〜4個のサンプルを収集します。各時点でサンプリングするには、次の手順を実行します。
- 1 mL 以上の培養物を清潔で滅菌済みの 0.2 μm シリンジフィルターで直接ろ過し、ろ液を保存して、ステップ 5.3 と同様に小胞濃度を測定します。必要に応じて、タイムコースサンプルをフリーズします。相対蛍光を使用して、培養の成長ダイナミクスを追跡します。
- 培養物全体のサンプルを保存し、生物に適した方法(フローサイトメトリー;コロニープレーティング;またはその他の方法)を使用して集団サイズを決定する。
- 各時点における細胞および小胞様粒子の測定値(mLあたり)を得る。
- 指数関数的な成長フェーズ中に発生したタイムポイントを特定します。指数関数的成長中の2つの点(典型的には時間経過の始まりと終わり)の間の、世代当たりの細胞当たりに産生される小胞の数 であるrを計算するには、 補足ファイル1に提供される式を使用する。
注: この方法は、定常状態の成長条件の場合にのみ有効です。計算の基礎となる仮定および導出は、参考文献14に詳述されている。
結果
図1は、シアノバクテリア小胞単離プロセスの概要を示し、ここで説明するプロトコルの重要な側面を強調しています。特に注目すべきは、小粒子(vesicle)画分からのシアノバクテリアバイオマスの分離、小胞サンプルの濃縮、および小胞の単離および精製(図1、ステップ2〜4)を詳述するステップであり、これらは、小胞の再現性のある調製物を得るために重要である。図2は、シアノバクテリウム・シネコシスチス・エスピーPCC 6803からの細胞外小胞の単離および特徴付けからの代表的な結果を提示する。このシアノバクテリウムの外膜にはカロテノイド31が含まれていることが示されており、超遠心分離による直接ペレット化によって収集された小胞のサンプルに特徴的なオレンジ色の着色を与えます(図2A)。ベシクルペレットが再懸濁されると、ベシクルは透過型電子顕微鏡(TEM)、サンプルを酢酸ウラニルで陰性染色するか(図2B)、または超薄切片の観察(図2C)によって検査することができます。ベシクルのサイズ分布および濃度は、動的光散乱(DLS)(図2D)およびナノ粒子追跡分析(NTA)(図2E)を用いて評価することができる。記載されたプロトコールを用いて、典型的には、1.0のOD730でシネコシスティス・エスピーPCC6803の指数関数的に増殖する培養物において、mL当たり典型的には〜3.5±1.0 x 108個のナノ粒子が得られた。単離されたEVの生化学的分析は、単離された小胞の物理的特性評価を補完するために実施することができる。一例として、精製されたSynechocystis sp. PCC 6803小胞をSDS−ポリアクリルアミドゲル上で分離し、リポ多糖類(LPS;図2F)。LPSは外膜32に特異的であるため、LPS検出は、膜結合小胞の存在を検証し、同じ株33からの調製物間の相対小胞含量を分析するためのマーカーとして役立つ。低分子量LPS対高分子量LPSの相対存在量の検査は、試料34、35間の小胞組成の変化を示すことができる。
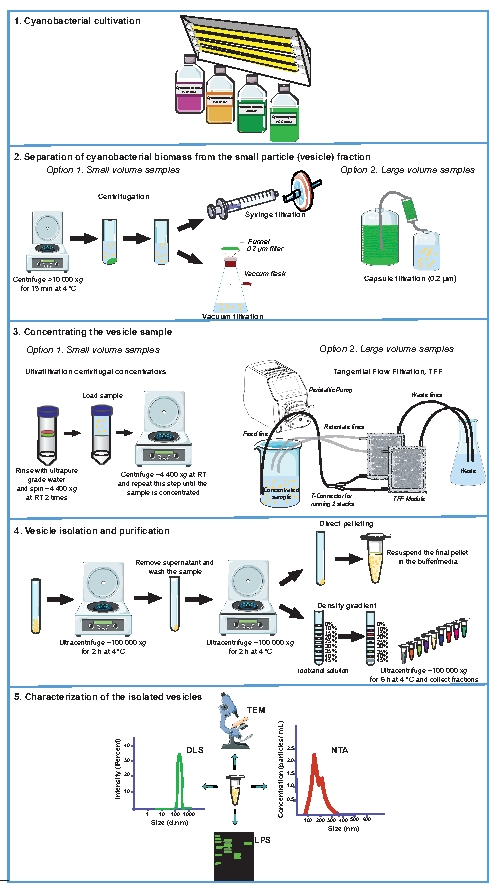
図1:シアノバクテリアのEV単離および特性評価に使用した実験手順。 増殖培養物(1)および増殖培地からのシアノバクテリアバイオマスの分離(2)の概略図。小胞を含む無細胞サンプルを濃縮し(3)、EVを単離精製します(4)。用途に応じて、ベシクル調製物は、透過型電子顕微鏡(TEM)、ナノ粒子追跡分析(NTA)、動的光散乱(DLS)、およびリポ多糖(LPS)プロファイリングの1つまたは組み合わせを用いて特徴付けることができる(5)。RT, 室温. この図の拡大版を表示するには、ここをクリックしてください。

図2:シアノバクテリウム・シネコシスチス・エスピーPCC 6803についての細胞外小胞単離および特性評価の代表的な結果。 (a)600 mL Synechocystis sp. PCC 6803培養物から濃縮無細胞細胞外培地を超遠心した後に得られた細胞外小胞ペレット(EVsペレット)をOD730に増殖させた1.0-1.5の写真。外膜に見られるカロテノイドに由来する小胞ペレットの典型的なオレンジ色の着色に留意されたい。(B,C)Synechocystis sp. PCC 6803小胞サンプルの負染色された(B)および超薄切片(C)の透過型電子顕微鏡(TEM)写真。スケールバー:それぞれ200nmおよび50nm。試料を80kVで操作した透過型電子顕微鏡で可視化した。(d)ベシクル直径(nm単位)の関数としてのベシクル体積の分布を描写する典型的な動的光散乱(DLS)プロット。色付きの線は、同じサンプルの3つのテクニカルレプリケート測定からのデータを示します。(e)シネコシスチス細胞外小胞のサイズ分布(nm単位)の代表的なナノ粒子追跡分析(NTA)データ。黒い線は3つの技術反復の平均を示し、赤い線は平均の標準誤差を表します。(f)リポ多糖(LPS)プロファイルは、16%(w/v)SDSポリアクリルアミドゲル上で電気泳動によって小胞調製物を分離し、市販のLPS染色キットで染色した後に検出された。粗いLPS形態および平滑LPS形態に対応する低分子および高分子LPSは、それぞれ検出可能である。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:rを計算する方程式。指数関数的増殖中の2点間(典型的には時間経過の始まりと終わり)の間の世代当たりの細胞当たりに産生される小胞の数は、この式を用いて決定される。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
一般的な考慮事項
プロトコル(図1)は、シアノバクテリアの細胞外小胞を扱うための「万能」の方法がないことを強調するための一連のオプションとして提示されています。関心のある研究者は、特定のモデル生物、実験的な質問/目標、および機器の可用性に互換性があり、適切なこのプロトコルのセクションを利用できます。すべての小胞単離アプローチにはトレードオフが伴い、必然的にある程度のバイアスが生じます。可能な限りこれを最小限に抑えるよう努めるべきであるが、最も重要な考慮事項は、使用される詳細な方法論が適切なMISEV(細胞外小胞の研究のための最小情報)ガイドライン36に従って報告されることを確実にすることである。
文化の成長
シアノバクテリア培養物は、世界中で入手可能な多くの培養コレクションの1つから容易に入手することができる。いくつかの例は、ロスコフ文化コレクション(フランス、ロスコフの駅生物学)、パスツール文化コレクション(パリ、フランス、パスツール研究所)、および海洋藻類と微生物叢のためのプロヴァソリ・ギラード国立センター(NCMA、メイン州、米国)です。選択したシアノバクテリア株は、適切な培地および環境条件下で培養されなければならず、異なる株間で有意に異なる。シアノバクテリア培養に一般的に使用される培地のリストは、培養コレクションのウェブサイトまたは他の出版物37,38,39で見つけることができる。
シアノバクテリアの細胞外小胞を扱うことは、多くの典型的なモデル実験室従属栄養について報告された方法論と比較して、いくつかのユニークな課題を提示する。シアノバクテリア培養物は、大腸菌14、16、40などの他の微生物に見られるものよりも桁違いに低い小胞濃度を有する。これらの差は、おそらく低い細胞密度および/または小胞産生速度から生じるが、バルク分析に十分な材料を得るためには、比較的大きな培養物(〜1〜20L以上)が必要であり得ることを意味する。したがって、研究者は、小規模培養物からの小胞収量を試験して、所望の最終目標を達成するためにどれだけの材料が必要かを判断することが奨励されている。実験に使用した培地が検出可能な粒子状背景を有するかどうかを確立することの重要性は、その物質が小胞集団定量を混乱させたり、小胞濃度/サイズ測定の感度を低下させたり、最終的な小胞調製物を汚染したりする可能性があるため、実験を開始する前に強調する必要があります。
この分野のもう一つの課題は、すべてのシアノバクテリアが純粋な培養でうまく成長するわけではない、またはまったく成長しないことです。軸索的になるまで、物理的な小胞の特性、生産速度、または内容の解釈は、必ずしもコミュニティ内のいずれかの株によって産生される小胞に関する明確な結論につながるとは限らない。研究者はまた、特定のナノ粒子分析ツールによって、他の種類の粒子が存在し、潜在的に小胞と混同される可能性があるかを検討することをお勧めします。例えば、使用されている株が、ゲノムシーケンシング、誘導アッセイ、または他の手段 のいずれかを介して プロファージを欠いているか、または他のタイプの粒子状物質を放出していないことを確認することが不可欠であり得る。私たちの経験では、ほとんどのシアノバクテリア小胞は直径<0.2μmですが、新しい株や増殖条件を見るときは、0.45μmの細孔径フィルターを使用して精製粒子のサイズ分布が変化するかどうかを確認する必要があります。
培養条件の多くの態様は、小胞産生およびその内容物41、42に影響を及ぼし得る。したがって、培養増殖に使用される物理的および化学的条件(光放射照度、温度、および培地組成を含む)を文書化し、結果の再現性を保証するために可能な限り制御する必要があります。小胞内容物の化学分析は、特に「-omics」スタイルのハイスループット分析を実行する場合、バックグラウンド組成を考慮する必要があります。これは、天然の海水バックグラウンドに基づくものや、酵母エキスまたはトリプトンを補充したものなど、未定義の培地を使用する場合に特に重要であり得る。実験目標に応じて、定義された増殖培地を使用することが好ましい場合がある。
研究者は、培養の成長ダイナミクスを定期的に注意深く監視して、任意の時間後にサンプルを収集するのではなく、特定のバッチ培養が成長段階のどこにあるかを確実に把握する必要があります。小胞組成は、成長相全体、特に指数期と定常期との間で変化し得る41、42。例えば、固定期にサンプリングされた小胞の少なくとも一部は、指数関数的な増殖中には起こらない細胞溶解などの異なる細胞機構から生じる可能性がある。これはまだ生物学的に大きな関心事かもしれませんが、サンプルを知ることは不可欠です。シアノバクテリア培養物が、サンプル濃度に直接進むことができない時点で所望の増殖段階に達した場合、直ちに<0.2μm画分から細胞を分離し(遠心分離および/または直接0.2μm濾過)、次いで無細胞濾液を4°Cで保存することが推奨される。材料は、小胞の濃度またはサイズ分布にほとんどまたはまったく顕著な影響を及ぼさずに、この方法で数日間保存することができる。
小胞の浄化
大量の培養物から小胞を単離する頻繁な必要性は、シアノバクテリア小胞単離ワークフローにおいて極めて重要である。大量の材料を扱う場合、下流の分離ワークフローの前に小胞を濃縮する必要があります。公称分子量制限が100 kDaの濃縮器(接線流フィルター膜または遠心カラム)は、濃縮時間を合理的に保ちながら低分子量の可溶性物質からの分離を可能にするため、一般的に推奨されますが、30 kDaフィルターも頻繁に使用され、成功しています。小胞を精製するいくつかの非超遠心ベースの方法(例えば、サイズ排除クロマトグラフィー、マイクロ流体ベースのシステム、親和性捕捉技術、および沈殿ベースのアプローチ)が細胞外小胞分野で普及しつつあるが、我々の経験では、これらのアプローチは収量の減少をもたらし、典型的には必要な培養量と互換性がない。
研究者は、イオジキサノールバックグラウンドおよび小胞精製中に使用される洗浄/再懸濁緩衝液の組成を考慮して、それらが所望の下流用途と適合性があることを確認する必要があります。多くの場合、最終小胞サンプルは、成長培地または成長培地に匹敵する組成で定義された緩衝液(例えば、天然海水対人工海水)に再懸濁することができる。しかし、海洋シアノバクテリア小胞ではこれが不可能な場合があり、海水レベルに似た高い塩濃度は多くの酵素反応を阻害する可能性があるため、分析のためにさらなる実験操作が必要になります。このような場合、0.2μmの濾過、1x PBSなどの標準的な実験室緩衝液は、通常、海洋シアノバクテリア小胞の安定性を維持するために良好に作用し、下流の実験プロセスとより適合性があり得る。
密度勾配精製は、実験目標および培養組成に応じて任意と考えることができるが、より厳密に純粋で再現性のあるサンプルを製造するために強く推奨される。EV集団は不均一であり、様々な浮力密度にわたって見出すことができ、それらはひずみ、成長条件、および他の要因によってさらに異なる4,5,6。上に列挙した密度は、イオジキサノール中のシアノバクテリア培養物および野外サンプルからの小胞について典型的に見出されるものを表すが、他の株における結果は異なる可能性がある。スクロースおよびCsClなどの他の密度勾配材料を小胞に利用することができるが、それらはこれらの背景において異なる浮力密度に移行するであろう。異なる勾配培地の背景は、脂質封入ウイルス43の回収を偏らせる可能性があり、異なる株からの小胞の回収に潜在的に影響を及ぼす可能性がある。
ベシクルは、ここで説明するベシクル単離およびグラジエント精製プロセスを通じて複数のポイントで失われる可能性があり、下流用途で所与の最終ベシクル収率を達成するために必要な収率を低下させ、出発物質の量を増加させる。超遠心分離後の小胞ペレットを扱う場合は特に注意が必要です。いくつかのシアノバクテリア小胞は、小胞サンプルにある程度の色素沈着を貸す可能性のあるカロテノイドまたは他の化合物を有することができるが(図2)、材料の株または量によっては、小胞ペレットを直接視覚化できることは必ずしも期待されない。ペレットに予想される遠心分離機ローターの種類に注意してください。可能であれば、精製されたベシクルサンプルは、回収された最終材料の組成を検証するために電子顕微鏡によって検査されることが推奨される。
小胞およびその内容物に対する貯蔵条件の影響は、依然として未解決の問題である。貯蔵がシアノバクテリア小胞のサイズまたは濃度14に顕著な影響を及ぼさないことが見出されるが、単離された小胞調製物の機能性は経時的に変化し得る44。凍結/融解サイクルは可能な限り避けるべきですが、凍結サンプルが全体的な小胞の数とサイズに与える影響は最小限に抑えられているようです。凍結融解サイクルが、小胞関連核酸の長さやタンパク質の安定性など、小胞内容物の組成に影響を与える可能性に注意する必要があります。
Vesicles from field samples
自然の水生環境から細胞外小胞を単離するための現在の方法は、概念的および運用的に、大量培養についてここで説明したものと類似している。それでも、さらに多くの量の材料が必要になることがあります。このようなフィールドサンプルには、分析に十分な材料を得るために、数百〜数千リットルの水の収集、ろ過、および濃縮が含まれる場合があります。使用するサンプルの濁度によっては、0.2 μm フィルターの前に 1 つ以上の予備ろ過ステップを組み込む必要がある場合があります。使用される特定のTFFデバイスは、妥当な時間(理想的には時間単位)で、サンプルに過度の圧力をかけることなく、このような大量のものを扱うのに適している必要があります。実際には、これには多くの場合、培養ベースのサンプルに適用されるよりもはるかに大きな総表面積と、流量の増加を容易にするためのより大きな直径のチューブの使用が含まれます。この増加したフィルタ表面積は、より小さなTFF配置およびより大きな最終濃縮物量と比較して、粒子損失のわずかな増加をもたらす可能性が高い。ただし、これらの懸念事項は、合計処理時間の考慮事項とのバランスを取る必要があります。長時間の海洋クルーズなど、サンプルがサンプリング後何日もラボに戻らないような状況では、現場で最初の0.2μmろ過とTFFステップを実行することをお勧めします。この少量の濃縮材料は、最終処理のためにラボに返送されるまで、4 °C または -80 °C で (入手可能性と下流の分析上の考慮事項に応じて) 船上で保管できます。
有機および無機の両方の他の小粒子からの細胞外小胞の単離および分離は困難な場合があり、異なる粒子を分離する方法はまだ完全ではない。例えば、イオジキサノール密度勾配は、所与のサンプル中に存在する小胞およびウイルスのすべてのクラスを容易に分離するわけではないかもしれない。交絡粒子の種類とその物理的性質はサンプリングサイトによって異なるため、すべてのクラスの小さな水生粒子を堅牢に分割するプロトコルを提供することは現在不可能です。試行錯誤が不可欠であり、分離を最大化するためには、勾配および超遠心分離条件で使用されるヨージキサノール範囲での実験が必要になります。より小さな体積の集合体、より細かく分解された密度分数も必要であり得る。文脈に応じて、ヨウジキサノールの代わりにCsCl勾配を使用することは、環境粒子45を分離するのに役立ち得る。それでも、浸透圧条件の変化は、上で論じたように、最終的な回収生成物にバイアスをもたらす可能性がある。
小胞の特性評価
ナノ粒子分析機器は、微生物学の実験室環境ではまだ日常的に利用できませんが、ますます利用可能になっています。すべての方法論には長所と短所があり、シアノバクテリア小胞の作業のために他のすべてのプラットフォームよりも優れているという特定の支持はありません。実際、コスト、解像度、使いやすさ、検出限界、さまざまな成長メディア/バッファ背景との互換性、およびデータの再現性に関して、それぞれに特定のトレードオフがあります。上述のナノ粒子追跡分析に基づく機器に加えて、ナノフローサイトメトリー、マイクロ流体抵抗パルスセンシング、および同調可能な抵抗パルスセンシングを含む他のアプローチを適用することができる46、47。ユーザーは、海水ベースのメディアで一部のプラットフォームを使用するときに問題が発生した場合、利用可能な計装の詳細を学習し、それがシステムでうまく動作することを確認するように注意する必要があります。我々は、この分野が小胞のサイズ、濃度及び生産速度の定量的特徴付けに向けて動くことを奨励する。小胞濃度を、タンパク質含有量やその他の測定基準ではなく、1mLあたりの基本粒子ベースで測定することで、小胞をより定量的な枠組みに統合し、株や条件間の相互比較が可能になります。<100nm粒子の濃度測定値を較正する能力を改善するためのさらなる努力が必要である。
小胞産生速度測定が、粒子損失を最小限に抑えるために0.2μm濾過培養上清から直接行われるという事実は、上述の他の精製ステップと関連しているであろう。しかし、これは、このアプローチが必ずしも実際の細胞外小胞と培養物中に見出される他の小粒子とを区別するわけではないことを意味する。特定のサイズ範囲(例えば、直径50〜250nm)内の粒子を計数するだけで、いくつかの外れ値を除外するのに役立つかもしれないが、ペレット状の<0.2μm培養内容物が(TEMまたは他のアプローチによって)膜結合小胞であるように見えるという視覚的確認は、小胞様粒子の産生とは対照的に小胞の産生を測定していることを具体的に主張するために必要である。
ベシクル特性評価に不可欠な要素は、ベシクルサンプルがナノ粒子分析装置の適切な線形感度範囲で分析されていることを確認することです。サンプルが濃縮されすぎると、その材料をきれいなバッファーで希釈して再分析するのは簡単です。一方、一部のシアノバクテリア培養物の細胞および/または小胞密度が比較的低いため、一部の器具の検出限界を下回る小胞調製物が生成されることがあります。これがバルク小胞精製で起こる場合、より大きな体積の培養物の成長、より小さな体積で最終材料の再ペレット化および再懸濁、または単離プロセスに過度の損失が発生し、軽減できるステップがあるかどうかを評価することを検討することができる。小胞産生率を測定する場合、修正は必ずしもそれほど簡単ではありません。サンプルは必要に応じて濃縮できますが、最初のサンプルでは、培地の調整によって細胞密度が高くなるかどうか、または濃度が高くなる指数関数的な段階の後の時点から十分に濃縮されたサンプルが得られるかどうかを確認する必要があります。
制限
他のプロトコルと同様に、これらのアプローチを使用した小胞単離には明確な制限があります。これらのアプローチは、小胞の完全に純粋な調製物が単離されるという保証に依存しない。培養物および野外サンプルの両方に、密度勾配で小胞と同様に移動する他の材料が含まれていてもよい。それでも、少なくとも、これらのタイプの追加の精製方法論は、ベシクル分析の厳密さと再現性を確保するために不可欠です。シアノバクテリアの文脈で小胞単離アプローチを説明するが、他の多くの微生物の培養物も比較的低濃度の小胞を含むであろうし、ここで説明する手順は一般的に適用可能であるべきである。これらの方法は、恒久的なプロトコルとしてではなく、多様な微生物由来の細胞外小胞を扱う将来の進歩を促進するための出発点として役立つことが期待されています。これらの方法をサイズ排除カラムや非対称フィールドフロー分画などの他のアプローチとマージして、培養物や環境サンプルからの異なるカテゴリの小粒子の識別と分離を改善するための今後の努力が必要です。また、これらの技術がナノ粒子特性評価技術の改善とともに進化し続け、小胞集団内の不均一性、その内容、および環境におけるそれらの正確な機能的役割を調べる能力が向上することを期待しています。
開示事項
著者らは利益相反がないと宣言しています。
謝辞
著者らは、i3S科学プラットフォーム「バイオインターフェースとナノテクノロジー」と、国家インフラポルトガルバイオイメージングプラットフォーム(PPBI-POCI-01-0145-FEDER-022122)のメンバーである「組織学と電子顕微鏡」の支持を認めている。また、TEMの超薄切片染色プロトコルの最適化を支援してくれたJ. A. Gonzalez-Reyes教授(スペイン、コルドバ大学)と、ナノ粒子追跡分析に協力してくれたCecília Durães博士とAna Rita Pinto博士(ポルトガルのポルト大学)にも感謝します。
この研究は、米国国立科学財団(OCE-2049004からSJB)、COMPETE 2020 Operacional Program for Competitiveness and Internationalization(POCI)、ポルトガル、2020年、およびFundação para a Ciência e a Tecnologia/Ministério da Ciência、Tecnologia e Ensino Superior in the project POCI-01-0145-FEDER-029540(PTDC/BIA-OUT/29540/2017 to PO)を通じてポルトガルの資金によって資金提供されました。Fundação para a Ciência e a Tecnologiaは、PhDフェローシップSFRH/BD/130478/2017(SL)およびFCT研究者助成金IF/00256/2015(PO)でも高く評価されています。M.C.M.-M.Horizon 2020フレームワークプログラム(H2020-MSCA-IF-2018-RI-844891)内のMarie Skłodowska-Curie個人フェローシップ(再統合パネル)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1x Phosphate buffered saline (PBS), pH 7.4 | Home-made buffer | --- | Standard wash/storage buffer which can be used with vesicles; can be made in lab or purchased commercially |
| 2% Uranyl acetate solution | Electron Microscopy Sciences | 22400-2 | Negative staining - TEM |
| 4x Laemmli Sample Buffer | Bio-Rad | 161-0747 | Denaturation of vesicle sample prior to proteolysis, required for lipopolysaccharides (LPS) staining |
| Amicon Ultra Centrifugal Filters (100 kDa) | Merck | UFC9100XX | Alternative option for centrifugal ultrafiltration |
| BG11 medium | Home-made medium | --- | Medium for cultivation of Synechocystis sp. PCC 6803 |
| Carbon Support Film 200 Mesh, copper. CF200-Cu | Electron Microscopy Sciences | 71150 | Transmission electron microscopy (TEM) grid |
| easiGlow Glow Discharge Cleaning System | Ted Pella | 91000 | Commercial TEM grid glow discharger |
| EMbed 812 epoxy resin | Electron Microscopy Sciences | 14120 | Ultra-thin sections - TEM |
| Filter holder for vacuum system | Thermo Fisher Scientific | 300-4000 | Reusable units with filter membrane support plates |
| Glutaraldehyde Grade I | Sigma-Aldrich | G5882-10X1ml | Ultra-thin sections - TEM |
| HEPES [N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) sodium salt] | Sigma-Aldrich | H7006 | Buffering agent for cyanobacterial growth media |
| Lead Citrate, Trihydrate | Electron Microscopy Sciences | 17800 | Stain for use in electron microscopy |
| Macrosep Advance Centrifugal Devices with Omega Membrane 100K | Pall | MAP100C36 | For centrifugal ultrafiltration of small volume samples |
| Millipore Pellicon 3 TFF Module | EMD Millipore | XX42P0060 or XX42P0080 | Alternative TFF option for concentrating large volume samples |
| Milli-Q Reference Water Purification System | Merck | Z00QSV0WW | Water purification system for obtaining type I ultrapure grade water |
| NanoSight | Malvern Panalytical | LM14 or NS300 | Nanoparticle tracking analysis |
| Optima L80 XP Ultracentrifuge | Beckman Coulter | L80 XP | Ultracentrifuge (or similar model) |
| OptiPrep / Iodixanol | Sigma-Aldrich | D1556 | Density gradient media |
| Osmium Tetroxide Reagent Plus | Sigma-Aldrich | 201030 | Ultra-thin sections - TEM |
| Pall Centramate PE TFF holder | Pall Corporation | FS002K10 | TFF module good for concentrating 10s-100s of L of sample; requires additional 30 or 100 kDa filter modules to scale with your estimated volumes |
| Peristaltic pump Masterflex L/S | Cole-Parmer | 07559-07 | Pump for driving large-scale TFF modules |
| Piston Gradient Fractionator | Biocomp Instruments | 152-001 | Automated density gradient fractionation |
| Polycarbonate tubes for the 70 Ti rotor | Beckman Coulter | 355618 | Reusable ultracentrifuge polycarbonate aluminum tubes with cap assembly |
| Pro99 medium | Home-made medium | --- | Medium for cultivation of Prochlorococcus |
| Pro-Q Emerald LPS Gel Stain Kit | Thermo Fisher Scientific | P20495 | LPS staining |
| SN medium | Home-made medium | --- | Medium for cultivation of cyanobacterial marine strains such as Synechococcus |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250-100G | Buffering agent in the preparation of vesicles samples for TEM |
| SW32Ti swinging bucket rotor | Beckman Coulter | 369650 | Ultracentrifuge rotor, holds 6x ~40 mL tubes; good for pelleting of bulk material |
| SW60Ti swinging bucket rotor | Beckman Coulter | 335650 | Ultracentrifuge rotor, holds 6x ~4.5 mL tubes; good for gradient purifications and final vesicle washes |
| Syringe 1mL Luer | BD Plastipak | 303172 | For vesicle isolation and loading samples into nanparticle tracking analysis (NTA) equipment |
| Syringe filter 0.2 µm | Pall Corporation | 4602 | For vesicle isolation from cultures |
| TAPS [N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid] | Sigma-Aldrich | T5130 | Buffering agent for cyanobacterial growth media |
| Transmission electron microscope | JEOL | JEM-1400 | Or similar microscope |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | Ultracentrifuge rotor, holds 8x ~39 mL tubes; good for pelleting of bulk material |
| Type XIV protease from Streptomyces griseus | Sigma-Aldrich | P5147 | Enzyme for proteolysis of EVs proteins, required for LPS staining |
| UltraClear tubes for the SW32Ti rotor | Beckman Coulter | 344058 | Single use ultracentrifuge tubes |
| UltraClear tubes for the SW60Ti rotor | Beckman Coulter | 344062 | Single use ultracentrifuge tubes |
| Ultramicrotome PowerTome XL, PT-PC | RMC Products, Boeckeler Instruments | 75501 | Microtome for ultra-thin sections - TEM |
| Universal 320 R centrifuge | Hettich | Z654736 | This or any similar general-purpose benchtop/floor standing centrifuge can be used for pelleting cells |
| Vacuum apparatus | KNF Neuberger | N026.3 AT.18 | Or any similar vacuum pump and trap |
| Vivaflow 200 100,000 MWCO PES | Sartorius | VF20P4 | TFF module, good for 2-3L. You can connect different modules for higher volume (figure 1). |
| Whatman Polycap TC Capsule filter (0.2/0.2µm) | Cytiva | 6717-9502 | Capsule filter for filtering large volumes of liquid |
| Zetasizer | Malvern Panalytical | Zetasizer Nano ZS | Dynamic light scattering (DLS) instrument |
参考文献
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Coelho, C., Casadevall, A. Answers to naysayers regarding microbial extracellular vesicles. Biochemical Society Transactions. 47 (4), 1005-1012 (2019).
- Schwechheimer, C., Kuehn, M. J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions. Nature Reviews Microbiology. 13 (10), 605-619 (2015).
- Toyofuku, M., Nomura, N., Eberl, L. Types and origins of bacterial membrane vesicles. Nature Reviews Microbiology. 17 (1), 13-24 (2019).
- Kulp, A., Kuehn, M. J. Biological Functions and Biogenesis of Secreted Bacterial Outer Membrane Vesicles. Annual Review of Microbiology. 64 (1), 163-184 (2010).
- Berman-Frank, I., Lundgren, P., Falkowski, P. Nitrogen fixation and photosynthetic oxygen evolution in cyanobacteria. Research in Microbiology. 154 (3), 157-164 (2003).
- Flores, E., Herrero, A. Compartmentalized function through cell differentiation in filamentous cyanobacteria. Nature Reviews Microbiology. 8 (1), 39-50 (2010).
- Flombaum, P., et al. Present and future global distributions of the marine cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9824(2013).
- Biller, S. J., Berube, P. M., Lindell, D., Chisholm, S. W. Prochlorococcus: the structure and function of collective diversity. Nature Reviews Microbiology. 13 (1), 13-27 (2015).
- Abed, R. M. M., Dobretsov, S., Sudesh, K. Applications of cyanobacteria in biotechnology. Journal of Applied Microbiology. 106 (1), 1-12 (2009).
- Lea-Smith, D. J., et al. Editorial: Exploring the growing role of cyanobacteria in industrial biotechnology and sustainability. Frontiers in Microbiology. 12, 1963(2021).
- Garcia-Pichel, F., Zehr, J. P., Bhattacharya, D., Pakrasi, H. B. What's in a name? The case of cyanobacteria. Journal of Phycology. 56 (1), 1-5 (2020).
- Biller, S. J., et al. Bacterial vesicles in marine ecosystems. Science. 343 (6167), 183(2014).
- Pardo, Y. A., Florez, C., Baker, K. M., Schertzer, J. W., Mahler, G. J. Detection of outer membrane vesicles in Synechocystis PCC 6803. FEMS Microbiology Letters. 362 (20), (2015).
- Oliveira, P., et al. The versatile TolC-like Slr1270 in the cyanobacterium Synechocystis sp. PCC 6803. Environmental Microbiology. 18 (2), 486-502 (2016).
- Biller, S. J., et al. Membrane vesicles in sea water: heterogeneous DNA content and implications for viral abundance estimates. The ISME Journal. 11 (2), 394-404 (2017).
- Yin, H., et al. Synechococcus elongatus PCC7942 secretes extracellular vesicles to accelerate cutaneous wound healing by promoting angiogenesis. Theranostics. 9 (9), 2678-2693 (2019).
- Lima, S., Matinha-Cardoso, J., Tamagnini, P., Oliveira, P. Extracellular vesicles: An overlooked secretion system in cyanobacteria. Life. 10 (8), 129(2020).
- Gupta, S., Marcela Rodriguez, G. Isolation and characterization of extracellular vesicles produced by iron-limited mycobacteria. Journal of Visualized Experiments: JoVE. (152), e60359(2019).
- Jung, A. L., et al. Legionella pneumophila outer membrane vesicles: Isolation and analysis of their pro-inflammatory potential on macrophages. Journal of Visualized Experiments: JoVE. (120), e55146(2017).
- Fantappiè, L., et al. Antibody-mediated immunity induced by engineered Escherichia coli OMVs carrying heterologous antigens in their lumen. Journal of Extracellular Vesicles. 3 (1), (2014).
- Moore, L. R., et al. Culturing the marine cyanobacterium Prochlorococcus. Limnology and Oceanography: Methods. 5 (10), 353-362 (2007).
- Rippka, R., et al. Prochlorococcus marinus Chisholm et al. 1992 subs. Pastoris subs. nov. Strain PCC 9511, the first axenic chlorophyll a2/b2-containing cyanobacterium (Oxyphotobacteria). International Journal of Systematic and Evolutionary Microbiology. 50 (5), 1833(2000).
- Moore, L. R., Chisholm, S. W. Photophysiology of the marine cyanobacterium Prochlorococcus: Ecotypic differences among cultured isolates. Limnology and Oceanography. 44 (3), 628(1999).
- Charpy, L., Larkum, A. W. D. Bulletin de l'Institut Océanographique de Monaco, (n spécial 19). , 457-475 (1999).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Fomsgaard, A., Freudenberg, M. A., Galanos, C. Modification of the silver staining technique to detect lipopolysaccharide in polyacrylamide gels. Journal of Clinical Microbiology. 28 (12), 2627-2631 (1990).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Peterson, T. Densitometric analysis using NIH image. North American Vascular Biology Organization (NAVBO) eNewsletter. 16 (3), (2010).
- Jürgens, U. J., Weckesser, J. Carotenoid-containing outer membrane of Synechocystis sp. strain PCC6714. Journal of Bacteriology. 164 (1), 384-389 (1985).
- Whitfield, C., Trent, M. S. Biosynthesis and export of bacterial lipopolysaccharides. Annual Review of Biochemistry. 83 (1), 99-128 (2014).
- McBroom, A. J., Johnson, A. P., Vemulapalli, S., Kuehn, M. J. Outer membrane vesicle production by Escherichia coli is independent of membrane instability. Journal of Bacteriology. 188 (15), 5385-5392 (2006).
- Kadurugamuwa, J. L., Beveridge, T. J. Virulence factors are released from Pseudomonas aeruginosa in association with membrane vesicles during normal growth and exposure to gentamicin: a novel mechanism of enzyme secretion. Journal of Bacteriology. 177 (14), 3998-4008 (1995).
- Nguyen, T. T., Saxena, A., Beveridge, T. J. Effect of surface lipopolysaccharide on the nature of membrane vesicles liberated from the Gram-negative bacterium Pseudomonas aeruginosa. Journal of Electron Microscopy. 52 (5), 465-469 (2003).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Norena-Caro, D. A., Malone, T. M., Benton, M. G. Nitrogen sources and iron availability affect pigment biosynthesis and nutrient consumption in Anabaena sp. UTEX 2576. Microorganisms. 9 (2), 431(2021).
- Rippka, R. Isolation and purification of cyanobacteria. Methods in Enzymology. , Academic Press. 3-27 (1988).
- Van Alphen, P., Abedini Najafabadi, H., Branco dos Santos, F., Hellingwerf, K. J. Increasing the photoautotrophic growth rate of Synechocystis sp. PCC 6803 by identifying the limitations of its cultivation. Biotechnology Journal. 13 (8), 1700764(2018).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA. mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12 (383), (2021).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209(2019).
- Soares, N. C., et al. Associating growth-phase-related changes in the proteome of Acinetobacter baumannii with increased resistance to oxidative stress. Journal of Proteome Research. 9 (4), 1951-1964 (2010).
- Thurber, R. V., Haynes, M., Breitbart, M., Wegley, L., Rohwer, F. Laboratory procedures to generate viral metagenomes. Nature Protocols. 4 (4), 470-483 (2009).
- Dell'Annunziata, F., et al. Outer membrane vesicles derived from Klebsiella pneumoniae are a driving force for horizontal gene transfer. International Journal of Molecular Sciences. 22 (16), 8732(2021).
- Linney, M. D., Schvarcz, C. R., Steward, G. F., DeLong, E. F., Karl, D. M. A method for characterizing dissolved DNA and its application to the North Pacific Subtropical Gyre. Limnology and Oceanography: Methods. 19 (3), 210-221 (2021).
- Arab, T., et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms. Journal of Extracellular Vesicles. 10 (6), 12079(2021).
- Cimorelli, M., Nieuwland, R., Varga, Z., vander Pol, E. Standardized procedure to measure the size distribution of extracellular vesicles together with other particles in biofluids with microfluidic resistive pulse sensing. PLoS ONE. 16 (4), 0249603(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved