Method Article
בידוד ואפיון של שלפוחיות חוץ-תאיות ציאנובקטריאליות
* These authors contributed equally
In This Article
Summary
הפרוטוקול הנוכחי מספק תיאורים מדוקדקים לבידוד, ריכוז ואפיון של שלפוחיות חוץ-תאיות מתרביות ציאנובקטריאליות. כמו כן נדונו גישות לטיהור בועיות מתרבויות בקני מידה שונים, פשרות בין מתודולוגיות ושיקולים לעבודה עם דוגמאות שטח.
Abstract
ציאנובקטריה הם קבוצה מגוונת של חיידקים פוטוסינתטיים, גראם-שליליים, הממלאים תפקידים קריטיים במערכות אקולוגיות גלובליות ומשמשים כמודלים ביו-טכנולוגיים חיוניים. עבודות אחרונות הראו כי הן ציאנובקטריה ימית והן ציאנובקטריה של מים מתוקים מייצרים שלפוחיות חוץ-תאיות - מבנים קטנים הקשורים לממברנה המשתחררים מפני השטח החיצוניים של המיקרובים. בעוד שהבועיות ככל הנראה תורמות לתהליכים ביולוגיים מגוונים, התפקידים התפקודיים הספציפיים שלהן בביולוגיה הציאנובקטריאלית עדיין אינם ידועים במידה רבה. כדי לעודד ולקדם את המחקר בתחום זה, מוצג פרוטוקול מפורט לבידוד, ריכוז וטיהור שלפוחיות חוץ-תאיות ציאנובקטריאליות. העבודה הנוכחית דנה במתודולוגיות שבודדו בהצלחה שלפוחיות מתרבויות גדולות של פרוכלורוקוק, סינכוקוק וסינצ'וציסטיס. מוצגות שיטות לכימות ואפיון דגימות שלפוחית מזנים אלה. כמו כן מתוארות גישות לבידוד שלפוחיות מדגימות שדה ימי. לבסוף, נדונים גם אתגרים אופייניים שנתקלים בהם עם טיהור שלפוחית ציאנובקטריאלית, שיקולים מתודולוגיים ליישומים שונים במורד הזרם והפשרות בין הגישות.
Introduction
שלפוחיות חוץ-תאיות (EVs) הן מבנים כדוריים, בקוטר של כ-20-400 ננומטר, המשוחררים על ידי כמעט כל האורגניזמים לסביבתם 1,2,3. שלפוחיות מופרדות על ידי דו-שכבת שומנים שאינן יכולות לשכפל את עצמן. בחיידקים גראם-שליליים, מבנים אלה נחשבים כמתעוררים בעיקר על ידי 'בליטה' של חלקים קטנים מהממברנה החיצונית. ובכל זאת, תהליכים אחרים, כולל תנועת פלגלר, תזה תאית והפרשת חומר הממברנה הפנימית והחיצונית, יכולים לייצר גםהם שלפוחיות 4,5. כלי רכב חשמליים יכולים להכיל ביומולקולות שונות, כולל שומנים, חלבונים מסיסים וממברנה, חומצות גרעין ומטבוליטים, ויכולים להעביר את החומר הזה בין תאים 4,5,6. בהינתן תכונות אלה, כלי רכב חשמליים נחקרים כדי להבין את תפקידם האפשרי במגוון רחב של תהליכים ביולוגיים, כולל תקשורת תאית, היווצרות ביופילם, העברת גנים אופקית, דינמיקה של פאגים-מארחים וחילופי חומרים מזינים 4,6.
ציאנובקטריה הם קבוצה גדולה ומגוונת של חיידקים גראם שליליים, כולל אורגניזמים חד-תאיים ונמרצים. הם מעניינים מנקודות מבט רבות, כולל הבנת הפיזיולוגיה והמגוון שלהם 7,8, פונקציות המערכת האקולוגית הקריטיות שהם משרתים 9,10, והתועלת שלהם לביוטכנולוגיה11,12. ציאנובקטריה נמצאים במגוון רחב של בתי גידול, בין אם כאורגניזמים חופשיים בסביבות ימיות, מים מתוקים ויבשתיים, או בקשרים סימביוטיים עם טחבים, שרכים, צמחים, או בחזזיות וספוגים13. הם משמשים כיצרנים ראשוניים חיוניים במערכות אקולוגיות ימיות, ומייצרים חמצן ופחמן אורגני באמצעות פוטוסינתזה חמצנית 9,10, וחלקם מסוגלים לקבע חנקן אטמוספרי גם7. ציאנובקטריה ימית ומים מתוקים, כולל פרוכלורוקוק, סינכוקוקוס וסינצ'וציסטיס, מייצרים כלי רכב חשמליים בתנאי מעבדה 14,15,16, וניתן למצוא שלפוחית ציאנובקטריאלית גם בסביבות טבעיות 14,17. התפקודים הביולוגיים והאקולוגיים של שלפוחיות ציאנובקטריאליות אינם ידועים, אך מחקר נוסף בתחום זה עשוי לספק תובנות חדשות לשאלות על פיזיולוגיה ציאנובקטריאלית, התמיינות, אסטרטגיות תקשורת, אבולוציה ואינטראקציות טרופיות. בנוסף, היכולת של כלי רכב חשמליים ציאנובקטריאליים לשאת קטגוריות מגוונות של ביומולקולות עשויה להיות בעלת יישומים מסחריים18,19.
הפרוטוקול הנוכחי מתאר שיטות לבידוד ואפיון של בועיות מתרביות ציאנובקטריאליות ומדגימות שדה כדי לאפשר ולעודד בחינה רחבה יותר של ביולוגיה של שלפוחית חוץ-תאית ציאנובקטריאלית. בעוד שזרימת העבודה המתוארת כאן מקבילה לפרוטוקולים לבידוד ואפיון של כלי רכב חשמליים מחיידקים אחרים, תרביות ציאנובקטריאליות ודגימות שדה מכילות בדרך כלל ריכוזי תאים ושלפוחית נמוכים יותר ממה שנצפה בדרך כלל במערכות מודל הקשורות למארח או פתוגניות 20,21,22. לפיכך, מחקרים על כלי רכב חשמליים ציאנובקטריאליים דורשים שיקולים ואופטימיזציות מיוחדות לטיפוח ובידוד שלפוחית, המשתנים עוד יותר בין זנים לרקע תקשורתי. מכיוון שאף פרוטוקול יחיד לא יעבוד באותה מידה עבור כל הזנים, תנאי הגדילה והיישומים במורד הזרם, אנו מספקים אפשרויות מרובות ודנים בפשרות הכרוכות בכך, כך שחוקרים יוכלו לקבוע את הגישות המתאימות ביותר להתמודדות עם שאלות הניסוי שלהם.
Protocol
הזנים הציאנובקטריאליים מתקבלים מכמה אוספי תרביות (ראו דיון לפרטים).
1. גידול ציאנובקטריאלי
- טפחו ציאנובקטריה ימית פרוכלורוקוק וסינצ'וקוקוס בעקבות השלבים הבאים.
- טפחו זנים פרוכלורוקוק וסינכוקוקוס בבקבוקי פוליקרבונט באמצעות תווך מתאים כגון Pro99 או SN (ראו טבלת חומרים). לפרטים, ראה הפניות23,24 שפורסמו בעבר.
- התאקלמו בין התרבויות על ידי גידולן על פני שתיים עד שלוש העברות (1:20 דילולים של תרבות למדיה רעננה עבור כל מעבר) בתנאי הטמפרטורה וההקרנה הרצויים הנדרשים לניסוי.
הערה: תנאי גדילה אופייניים23,25 כוללים טמפרטורות בין 15-30 מעלות צלזיוס בהקרנה בין 8-150 μmol פוטונים m-2 s-1, אך סובלנות הזנים האינדיבידואליים והאופטימה משתנים מאוד26 ויש להגדירם על סמך הנחיות מההוראות או הספרות הרלוונטיות לאיסוף תרבויות. עקוב אחר קצב הצמיחה באמצעות פלואורסצנציה של תרביות או ציטומטריה של זרימה נחשב23, והבטח שהתרביות יגדלו בקצב אקספוננציאלי עקבי במצב יציב לפני תחילת הניסוי. - בצע סדרה של העברות הדרגתיות עוקבות מנפחים קטנים יותר לגדולים יותר ברגע שהתאים מגיעים לשלב אקספוננציאלי מאוחר (לדוגמה, 20 מ"ל < 250 מ"ל < 2 ליטר < 10 L < 20 L).
הערה: לא ניתן לחסן ישירות תרבויות בנפח גדול מכמויות קטנות של תרבות מתחילה. שים לב שתרביות גדולות יותר עשויות לדרוש תוספת של מאגרים (כגון 1 mM HEPES, pH 7.5 או 3.75 mM TAPS, pH 8), יחד עם תוספת נתרן ביקרבונט או מבעבע עם אוויר סטרילי24.
- לטפח ציאנובקטריום מים מתוקים Synechocystis sp. PCC 6803.
- הכן תרבית של Synechocystis sp. PCC 6803 שתשמש כ- inoculum על ידי טיפוחה עם אוורור (אוויר מבעבע ב- 1 L / min), בטמפרטורה של 30 ° C, תחת אור של 16 שעות (ספירת פוטונים של 50 μmol m-2 s-1) / 8 שעות משטר כהה, עד לצפיפות אופטית ב- 730 ננומטר (OD730) של 1.0 (פאזה מעריכית) ב- BG11 בינוני27.
- לחסן 30 מ"ל של תרבות זו Synechocystis sp. PCC 6803 ב 570 מ"ל של BG11 בינוני ל OD730 של 0.05 ב 1 L זכוכית בקבוקי כביסה גז.
- אפשר לתאים לגדול עם אוורור, בטמפרטורה של 30 מעלות צלזיוס, תחת אור של 16 שעות (ספירת פוטונים של 50 מיקרומול m-2 s-1) / 8 שעות משטר כהה, עד OD730 סופי של 1.0-1.5.
2. הפרדת ביומסה ציאנובקטריאלית מחלק החלקיק הקטן (שלפוחית)
הערה: ראשית, מומלץ להפריד בין תאים לסופרנטנט באמצעות פיזור צנטריפוגלי של תאים. עם זאת, כאשר נפחי התרביות גדולים מכדי שזה יהיה אפשרי, ניתן לדלג על צנטריפוגה ולהמשיך ישירות לסינון תרביות שלמות באמצעות סינון קפסולה (שלב 2.4).
- בצע צנטריפוגה כדי להפריד תאים (הטוב ביותר עבור נפחים של עד ~ 4 L, בהתאם לקיבולת הצנטריפוגה הזמינה).
- אוטוקלאב או לשטוף ולנקות ביסודיות את בקבוקי הצנטריפוגה באמצעות מים מסוג I בדרגה אולטרה-פורה (ראו טבלת חומרים), מה שמבטיח שלא יישארו שאריות של סבון או חומר אחר.
- טען דגימות תרבית למספר מתאים של בקבוקי צנטריפוגה ואיזן אותן.
- תרבויות ספין עבור >10,000 x g ב 4 °C (64 °F) למשך 10 דקות. אם הסופרנאטנט נשאר עכור בעליל, הגדילו את תנאי הצנטריפוגה ל-20 דקות במהירות המרבית ותנסו שוב.
- דקאנט או פיפטן בזהירות סופרנאטנט לתוך כלי נקי והמשך לאחת מאפשרויות הסינון הבאות שהוזכרו בשלבים 2.2-2.4.
- אפשרות 1: בצע סינון מזרקים באמצעות מסנני 0.2 מיקרומטר (עבור נפחי דגימה עד ~ 50 מ"ל).
- מלאו מזרק סטרילי של 50 מ"ל במדיום תרבית נטול תאים ברובו, וסננו אותו דרך מסנן פוליאתרסולפון (PES) בגודל 0.2 (או 0.45) μm (PES) (ראו טבלת חומרים). אספו את התסנין בכלי קיבול נקי ומעוקר.
- חזור על שלב זה עד שהמסנן נסתם (לדוגמה, קשה לדחוף אותו עם המזרק). החלף במסנן חדש, והמשך עד שהדגימה תסונן ביסודיות.
- אפשרות 2: לבצע סינון ואקום של 0.2 מיקרומטר (עד ~4 ליטר).
- שטפו ונקו היטב את מנגנון הוואקום באמצעות מים מסוג I - אולטרה-פורה, המחברים אותו למלכודת ואקום ולמשאבה (ראו טבלת חומרים).
- הכנס מסנן של 0.2 מיקרומטר בקוטר מתאים והידק את מנגנון הוואקום.
- הוסף כמות קטנה של דגימת תרבית, כדי להבטיח שלחץ הוואקום יישאר <10 psi.
- המשך לסנן את התרבות במרווחים קטנים עד להשלמתה. אם קצב הסינון מאט באופן משמעותי, עצרו את הוואקום והחליפו את המסנן.
- אספו את השבר <0.2 מיקרומטר המכיל שלפוחיות למיכל נקי.
- אפשרות 3: לבצע סינון כמוסה של 0.2 מיקרומטר (עבור נפחי דגימה > ~ 4 ליטר)
- יש לנקות צינורות גמישים בגודל מתאים וכלי איסוף על ידי שטיפה במים וחומרי ניקוי קלים. יש לשטוף את החומר במים מזוקקים ומדשנים.
הערה: לפני השימוש, יש לשטוף את החומר עם מים מסוג I - אולטרה פור. - מקם את התרבות כך שתסונן במיקום מאובטח ומוגבה עם כלי האיסוף הסופי למטה. חברו יציאת מסנן קפסולה של 0.2 מיקרומטר (ראו טבלת חומרים) לחתיכת צינור אחת והניחו אותה בכלי איסוף.
- מכניסים צינור נוסף לתוך הדגימה, מתחילים סיפון כבידה על ידי משיכת דגימה כלשהי לתוך הצינורות עם מזרק, ומחברים את הצינורות למסנן הקפסולה. השתמש בפתח האוורור כדי לשחרר עודפי אוויר ולמלא את התא בסופרנאטנט.
- אפשרו לחומר לעבור דרך הקפסולה עד שהדגימה מסוננת היטב. אם קצב הזרימה הופך להיות איטי מדי (<~1/10מקצב הזרימה ההתחלתי, או יוצא בירידה לעומת זרם הזורם ברציפות), המתן או הפעיל כוח עדין עם משאבה פריסטלטית עד שתתגבר הלחץ האחורי. לחלופין, שחזרו באופן חלקי את קצבי הזרימה על ידי ניתוק זמני של המסנן, ניפוח לאחור של ביומסה מצטברת מצד הזרימה עם מים אולטרה-נקיים עד שהחומר כבר אינו עכור בעליל, ולאחר מכן הפעל מחדש את תהליך הסינון.
- יש לנקות צינורות גמישים בגודל מתאים וכלי איסוף על ידי שטיפה במים וחומרי ניקוי קלים. יש לשטוף את החומר במים מזוקקים ומדשנים.
3. ריכוז דגימת השלפוחית
- אפשרות 1: לבצע סינון אולטרה צנטריפוגלי לריכוז נפח קטן (<500 מ"ל) של דגימות.
- יש לשטוף את הריכוזים הצנטריפוגליים של 15-20 מ"ל אולטרה-סינון לפי בחירה עם מים מסוג I - אולטרה-פורה.
- טען את הריכוזים לתוך הצנטריפוגה וסובב ב 4,400 x g ב 4 °C (64 °F). בטל את הריצה וחזור על שלב זה לפחות פעמיים נוספות.
- טענו את דגימת העל לרכזים שטופי מים וסובבו באותם תנאים. בהתאם למטרות הניסוי, ניתן להשליך או לאסוף את תפיח הדגימה לצורך ריכוז נוסף (עם ריכוזים עם מגבלת משקל מולקולרית נומינלית של 3 kDa) וניתוח.
- חזור על שלב זה עד שהדגימה מרוכזת לנפח סופי של ~ 15-30 מ"ל.
- אפשרות 2: לבצע סינון זרימה משיק (TFF) לריכוז נפח גדול (>500 מ"ל) של דגימה.
- הגדר את מנגנון ה- TFF בהתאם להנחיות היצרן (ראה טבלת חומרים). חברו משאבה פריסטלטית לקו הכניסה והניחו מהדקים מתכווננים על קו הכניסה החוזרת. לחטא את ה- TFF כפי שהומלץ על ידי היצרן, ולאחר מכן לשטוף את המכשיר עם 1 L של סוג I - מים בדרגה אולטרה-אפורה.
הערה: יש להכניס את קווי הצריכה והכניסה מחדש למאגר דגימה נקי (בקבוק זכוכית). יש לכוון את קווי התסיסה לכלי פסולת או לכיור. - הוסף <0.2 מיקרומטר תסנין למאגר הדגימה. הגדילו באיטיות את מהירות המשאבה ואת רמות הלחץ האחורי בקו הכניסה החוזרת כדי להגדיל את התפוקה מקווי התסיסים.
- ממשיכים להפעיל את ה-TFF, וממלאים מחדש את המאגר בתרבית עם הסרת החומר. הימנעו מלהניח לקו הכניסה לצאת מהדגימה במהלך העיבוד כדי להימנע מהכנסת בועות אוויר. ודא שלחץ ההזנה לא יעלה על כ-10 psi ושה-retentate זורם החוצה מה-TFF בקצב עקבי בחזרה למאגר.
- הפסיקו לרכז את הדגימה ברגע שהנפח במאגר מגיע לכמות הנמוכה ביותר האפשרית הדרושה כדי לשמור על זרימה לקו הכניסה מבלי להכניס בועות אוויר.
- סגור את קו הזרימה באמצעות מהדק. הסר את הלחץ האחורי על קו ה-retentate ושחזר את ה-supernatant המרוכז דרך המסנן למשך כ-10 דקות, ובכך הפחית את קצב הסירקולציה ל-20-40 מ"ל/דקה כדי למקסם את ההתאוששות.
- הזז את הקו החוזר לכלי נקי, הסר את קו הצריכה מהדגימה ואסוף את החומר המרוכז. שחזרו כל חומר שנותר במאגר הדגימה באמצעות פיפטה.
- סנן את חומר העל המרוכז דרך מסנן מזרק של 0.2 מיקרומטר (שלב 2.2) כדי להבטיח שלא יישארו תאים.
הערה: שלב 3.2.7 הוא אופציונלי. - במידת הצורך, אחסנו את התרכיז הסופי בטמפרטורה של 4 מעלות צלזיוס למשך כ-3 שבועות לפני המעבר לטיהור שלפוחית (שלב 4).
- הגדר את מנגנון ה- TFF בהתאם להנחיות היצרן (ראה טבלת חומרים). חברו משאבה פריסטלטית לקו הכניסה והניחו מהדקים מתכווננים על קו הכניסה החוזרת. לחטא את ה- TFF כפי שהומלץ על ידי היצרן, ולאחר מכן לשטוף את המכשיר עם 1 L של סוג I - מים בדרגה אולטרה-אפורה.
4. בידוד וטיהור שלפוחית
- גלולה ישירות על ידי ultracentrifugation בעקבות השלבים הבאים.
- מקם את דגימת תרבית <0.2 מיקרומטר המרוכזת בצינור אולטרה-צנטריפוג' נקי. הוסף מדיה נקייה או מאגר לפי הצורך כדי להבטיח שהצינור מלא לחלוטין.
הערה: אם דגימת התרבית הסופית גדולה מכדי להתאים לצינור אחד, או שהם מכניסים את החומר בצינורות מרובים לשילוב לפני צעדי הכביסה או מכדור באופן סדרתי באותו צינור. - במידת הצורך, צור איזון וסובב במהירות של ~ 100,000 x g במשך 3 שעות ב- 4 ° C.
- בזהירות להסיר את supernatant עם פיפטה. בעוד שכדורי שלפוחית ציאנובקטריאליים יכולים להראות צביעה מסוימת, הם לעתים קרובות בלתי נראים.
- שטפו את החומר הנגוע על-ידי הוספת מדיית תרבית טרייה או חיץ שטיפה כגון 1x מלוחים עם חציץ פוספט (PBS) (ראו דיון) לצינור האולטרה-צנטריפוג', ערבבו על ידי צנרת עדינה וסובבו שוב כמו בשלב 4.1.2. חזור על תהליך הכביסה בפעם השנייה.
- בצעו שימוש חוזר בכדור הסופי בתרבית טרייה על ידי פיפטה חוזרת ונשנית אך עדינה מעלה ומטה סביב תחתית הצינור עם פיפטה של 1 מ"ל. מעבירים לכלי נקי.
- מקם את דגימת תרבית <0.2 מיקרומטר המרוכזת בצינור אולטרה-צנטריפוג' נקי. הוסף מדיה נקייה או מאגר לפי הצורך כדי להבטיח שהצינור מלא לחלוטין.
- בצע אולטרה-צנטריפוגציה של שיפוע צפיפות.
- הכן מניות יודיקסנול (ראה טבלת חומרים) על-ידי יצירת גרסה מרוכזת פי 4 של רקע המאגר הרצוי עבור המדגם (ראה דיון).
- ערבבו חלק אחד של מאגר 4x עם שלושה חלקים של 60% מלאי יודיקסנול כדי ליצור פתרון יודיקסנול של 45%.
- לדלל 45% יודיקסנול עם נפחים של 1x buffer כדי ליצור מלאי של מדיה הדרגתית ב 40%, 35%, 30%, 25%, 20%, 15%, ו 10% ריכוזי יודיקסנול סופיים.
הערה: הכמות הכוללת הדרושה תשתנה בהתאם לקיבולת של הרוטור/צינורות ultracentrifuge. - הגדר שיפוע צפיפות ultracentrifuge על ידי כיסוי קפדני של כמויות שוות של 45%, 40%, 35%, 30%, 30%, 25%, 20%, 15%, 10%, ו- 0% ioxidinol לתוך צינור ultracentrifuge כך שכל נפח הצינור מנוצל.
הערה: דגימת השלפוחית החוץ-תאית שיש לטהר צריכה להיות ממוקמת בחלק העליון של השיפוע כחלק משכבת ה-0% יודיקסנול. אם הנפח הסופי של דגימת השלפוחית עולה על גודל השכבה של 0%, ערבבו כל דגימת שלפוחית עודפת עם מספיק 45% יודיקסנול ו/או מאגר כדי ליצור את הנפח הנדרש של מניות האופטיפרפ בריכוז של 10% ומעלה, והשתמשו בהן במיקום המתאים בשיפוע. - סובב את השיפוע ב- ~ 100,000 x g ב- 4 ° C למשך 6 שעות.
- אסוף שברים (בדרך כלל 0.5 מ"ל כל אחד עבור שיפוע של כ-4.5 מ"ל) על ידי צנרת זהירה או שימוש במלקט שברים (ראו טבלת חומרים).
- קבע את הצפיפות של כל שבר (ב-g/mL) באמצעות איזון אנליטי ופיפטה מכוילת למדידת המשקל של נפח דגימה ידוע. הסר את הדגימה מהצינור, קבע את המשקל והחזיר את הדגימה ישירות.
- לדלל שברים בודדים בצינור ultracentrifuge חדש עם חיץ נקי ולשטוף את החומר כאמור בשלבים 4.1.2-4.1.4. לחלופין, השתמש בדיאליזה או בעמודות אולטרה-סינון כדי לשחזר חלקיקים.
הערה: שלפוחיות חוץ-תאיות ציאנובקטריאליות נודדות בדרך כלל לצפיפות מצוף של ~1.14-1.19 גרם/מ"ל ביודיקסנול.
- אחסנו את הבועיות בטמפרטורה של 4 מעלות צלזיוס אם יש להשתמש בהן תוך 1-3 שבועות. הקפיאו את הבועיות בטמפרטורה של -20 °C (75 °F) או 80 ° C - אם לא נעשה בהן שימוש במשך זמן רב יותר מאותה תקופה.
5. אפיון הבועיות המבודדות
- בצע מיקרוסקופיית אלקטרונים של העברת כתמים שלילית (ראה טבלת חומרים) (TEM; גודל חלקיקים, מבנה, טוהר).
- כדי לשפר את איכות התמונה, זוהר לפרוק את פני השטח של רשת TEM מצופה לשעבר באמצעות מערכת פריקה זוהרת בהתאם להנחיות היצרן (ראה טבלת חומרים).
- יש למרוח בזהירות ~ 5 μL של דגימת השלפוחית ולהניח לשבת במשך 5 דקות.
הערה: דגימות עם ריכוזי שלפוחית >109 מ"ל-1 יתנו בדרך כלל את התוצאות הטובות ביותר; בדוגמאות מדוללות יותר יהיו מעט שלפוחיות לכל תמונה. - הסר את הדגימה על-ידי נגיעה בקצה הרשת בפיסת נייר סינון נקייה.
- טפטפו טיפה של 20-50 מיקרול ליטר של 2% אורניל אצטט (ראו טבלת חומרים) על משטח שטוח המכוסה בסרט פלסטיק, והניחו את הרשת המרחפת מעליו במשך 2 דקות.
- מוציאים אורניל אצטט באמצעות נייר סינון וצפים לזמן קצר על טיפת מים אולטרה-פורים לשטיפה. חזרו על שטיפת המים בפעם השנייה.
הערה: הרשת היבשה הסופית מוכנה להדמיה לאחר שלב 5.1.5.
- בצע צביעת חתך דקה במיוחד עבור TEM (גודל חלקיק, מבנה פנימי).
- בצעו שימוש חוזר בכדור משלב 4.1.5 עם 1 מ"ל של 2.5% גלוטארלדהיד ב-0.1 מ' חיץ נתרן קקודילאט (pH 7) (ראו טבלת חומרים) וקבעו את הדגימה במשך 2 שעות בטמפרטורה של 4 מעלות צלזיוס.
- סובבו ב-~100,000 x גרם במשך שעה אחת ב-4 מעלות צלזיוס.
- שטפו את הכדור בזהירות עם 0.1 מ' חיץ סודיום קקודילט (pH 7), ולאחר מכן סובבו במהירות של כ-100,000 x גרם למשך שעה אחת בטמפרטורה של 4 מעלות צלזיוס.
- תקן את הכדור עם 1 מ"ל של 1% אוסמיום טטרוקסיד (ראה טבלת חומרים) (מוכן ב 0.1 M נתרן cacodylate buffer) במשך 1 שעה, ולאחר מכן לשטוף כמו בשלב 5.2.3.
- לייבש את הדגימה עם 1 מ"ל של סדרה עולה של אתנול (50%, 70%, 90%, ופעמיים באתנול מוחלט) בשלבים של 10 דקות כל אחד בטמפרטורה של 4 מעלות צלזיוס.
- הוסיפו 250 μL של שרף אפוקסי (ראו טבלת חומרים) מעורבב עם אתנול מוחלט (1:1) לכדור והדגירה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס.
- מעבירים את הכדור ל-500 μL של שרף טהור למשך 24 שעות. לאחר מכן, דגירה של השרף בטמפרטורה של 65 מעלות צלזיוס למשך 48 שעות.
הערה: השרף מוכן כעת לחתך לפי ultramicrotome, בהתאם להוראות היצרן (ראה טבלת חומרים). - הכתימו את הרשתות המכילות מקטעים עם 2% אורניל אצטט (ב-50% אתנול) למשך 5 דקות. שטפו את המגלשות בעדינות תחת מים זורמים שעברו דה-יוניזציה במשך 10-15 שניות כל אחת. מניחים טיפת עופרת ציטראט (ראו טבלת חומרים) ומכתימים עוד 5 דקות.
- לשטוף כמו קודם, להסיר את המים על ידי כתם הרשת על נייר סינון, ולייבש את הרשתות באוויר. הצג באופן חזותי לפי TEM בהתאם להנחיות היצרן (ראה טבלת חומרים).
- בצע ניתוח מעקב אחר ננו-חלקיקים (NTA) (גודל חלקיקים, ריכוז).
- באמצעות נייר עדשה, נגבו בזהירות כל אבק או חומר נראה לעין מהשטוח האופטי. בדוק אם כל טבעות ה- O והחותמות האחרות נקיות ושלמות. הפעל את המכשיר והפעל את התוכנה.
- באמצעות מזרק נקי, למלא את החדר עם מים טהורים במיוחד. ודא שלא קיימות בועות אוויר.
- לחץ על התחל מצלמה והדמיין את האזור האופטימלי של החדר על 'טביעת האגודל'. התאם את שלב המיקרוסקופ אופקית או אנכית לפי הצורך כך שעוצמת האות תהיה אחידה באזור התמונה. הזז את אזור ההדמיה אופקית ביחס להדפסת האגודל (ימינה, לכיוון הקו האנכי), ומצא אזור קרוב עם אות רקע נמוך.
- החלק את המחוונים 'רווח מסך' ו'רמת המצלמה' למקסימום, ולאחר מכן הורד לרמה הנמוכה ביותר כדי לראות את החלקיקים העמומים ביותר.
הערה: הגדרות אופייניות עבור שלפוחיות ציאנובקטריאליות משתמשות ברווח מסך של 7 וברמת מצלמה בין 10-12. - התאם את המיקוד לפי הצורך כדי להבטיח שהחלקיקים ייראו בערך באותה מידה על פני שדה הראייה. המשיכו לדחוף מים נקיים במיוחד דרך התא עד שתאשרו ויזואלית שהתא נקי.
- מוציאים את שאריות המים מהתא באמצעות מזרק אחר.
- בחנו דגימה של המדיה/מאגר שהדגימה שלכם נמצאת בו כדי לקבוע את ריכוז חלקיקי הרקע על ידי מילוי התא במדיה/חיץ באמצעות מזרק נקי של 1 מ"ל.
- בחר מדידה סטנדרטית מהתיבה הנפתחת SOP . שנה הגדרות כדי לאסוף לפחות שלושה שכפולים טכניים של סרטוני 60 שניות כל אחד. לחץ על צור והפעל סקריפט ופעל ופעל לפי ההנחיות. לדחוף ~ 100 μL של דגימה לתוך החדר בין שכפולים.
- עם השלמת הרכישה, הסר את החיץ השיורי עם מזרק, שטפו 3-5 מ"ל של מים טהורים במיוחד דרך התא, והסירו את המים הנותרים.
- הוסף את דגימת השלפוחית לתא באמצעות מזרק 1 מ"ל ואשר את הגדרות הרכישה. אם ספירת החלקיקים אינה בטווח הליניארי של המכשיר (בדרך כלל בין 20-80 חלקיקים/מסגרת), יהיה צורך לדלל או לרכז את הדגימה. לדחוף לפחות 500 μL של דגימה לתוך החדר לפני איסוף נתונים.
- אסוף נתוני וידאו כמו בשלב 5.3.8, הקפד לנקות את התא עם מים טהורים במיוחד בין דגימות שונות.
- אסוף את כל הדגימות הבאות מאותו אורגניזם/ניסוי באמצעות הגדרות מצלמה זהות כדי להבטיח השוואה של נתונים; לשינויים בהגדרת רמת המצלמה יכולה להיות השפעה ניכרת על הערכים הסופיים שהתקבלו.
- קבע פרמטרים של חלקיקים באמצעות סעיף הניתוח של התוכנה. בחר ניתוח > Open Experiment וטען את הקובץ לדוגמה. בחר 'תעבד קבצים נבחרים' והמתן להשלמת הניתוח. הקפד להשתמש באותו סף זיהוי עבור כל הדגימות הבאות מאותו ניסוי.
הערה: מכיוון ששפוחיות ציאנובקטריאליות הן לעתים קרובות עמומות, בדרך כלל יהיה צורך להתאים את סף האיתור לערך הרגיש ביותר (הנמוך ביותר).
- בצע פיזור אור דינמי (DLS) (גודל חלקיק, פוטנציאל זטה).
- סנן דרך מסנן בגודל נקבובית של 0.2 מיקרומטר עבור כל דגימה שנכנסת ל-DLS כדי לסנן חלקיקים גדולים שמפריעים למדידות.
- הוסיפו 1 מ"ל של המדיה/חיץ לתוך קובט נקי כדי לבחון צבירות אפשריות או ננו-חלקיקים אחרים המגיעים מהתקשורת. שים את הקובט עם הצד הקפוא בצד שמאל לתוך דגימת המיקרו, וסגור את המכסה. תן לדגימה להתאזן במשך 5 דקות לפחות.
- הזן את מקדם השבירה של החומר ואת ספיגת החומר אם הם שונים באופן משמעותי מברירת המחדל של מים.
הערה: לתכונות החומר תהיה השפעה מועטה מאוד אם הבועיות קטנות מ-100 ננומטר. כאשר מודדים את פוטנציאל פני השטח (פוטנציאל זטה) של כלי רכב חשמליים, יש לבצע שימוש חוזר בשלפוחיות במדיית הצמיחה המקורית. - לחץ על לוח הבקרה של המכשיר כדי לבדוק את הקריאות ולהתחיל ברכישת נתונים על ידי לחיצה על הסמל הירוק. אם הערכים נראים טוב והמדיה/מאגר שלך אינם מכילים צבירות או חלקיקים אחרים, אתה מוכן כעת למדוד את הדגימה שלך.
- הוסף 1 מ"ל של דגימת שלפוחית לתוך cuvette נקי ואסוף נתונים כאמור בשלב 5.4.4. אסוף לפחות שלושה שכפולים טכניים למשך 10 דקות כל אחד.
- בצע ניתוח ליפופוליסכריד (LPS) כדי לאשר כי כלי הרכב החשמליים הגרם-שליליים נמצאים במדגם.
- דגימת שלפוחית מפורקת חום בטמפרטורה של 95 מעלות צלזיוס למשך 10 דקות במאגר דגימות לאמלי סטנדרטי 1x Laemmli (ראה טבלת חומרים).
- דגירה עם פרוטאז מסוג 0.2 U מסוג XIV מ- Streptomyces griseus (ראה טבלת חומרים) בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות כדי להסיר גליקופרוטאינים מזהמים.
- דגימות מטופלות נפרדות על ידי אלקטרופורזה על דנטורציה של 16% (w/v) ג'לים SDS-polyacrylamide בעקבות פרוטוקול16 שפורסם בעבר.
- כדי לזהות LPS, הכתימו את הג'ל בערכות צביעה זמינות מסחרית או בטכניקת צביעת כסף שונה28. לכמת את השפע היחסי של LPS על ידי ניתוח דחיסות של ג'לים מוכתמים לפי הפניות שפורסמו בעבר 29,30.
6. מדידות קצב ייצור שלפוחית
- באמצעות ניתוח מעקב אחר ננו-חלקיקים כמו בשלב 5.3, או בטכנולוגיה מקבילה, מודדים את ריכוז החלקיקים במדיית הגדילה של הניסוי. אם נמצאה ספירת חלקיקים גבוהה, יש לסנן דרך מסנן נקבוביות של 0.1 מיקרומטר ולבדוק שוב.
הערה: כדי למזער את השגיאה, ריכוז חלקיקי הרקע במדיה צריך להיות פחות מ-10% מריכוז החלקיקים שנמצא בתרביות בצפיפות הנמוכה ביותר. - התאקלמו בתרבית על ידי גידול תאים עבור לפחות שתי העברות סדרתיות רצופות בתנאי המדיה והסביבה הרצויים לניסויים כמו בשלב 1.1.2. יש להעביר תרבויות בעודן בשלב הצמיחה האקספוננציאלי. להבטיח ששיעורי צמיחת התרבות הנמדדים יהיו עקביים בכל ההעברות; אם לא, המשך להעביר תרבויות עד ששיעורי הצמיחה ניתנים לשחזור.
- אסוף דגימות במסלול הזמן בעת החיסון ומרווחים מתוזמנים באופן קבוע על פני עקומת הגדילה לשלב הנייח המוקדם. נקודות זמן מדשדשות כדי לקבל לפחות 3-4 דגימות שנאספו על פני כל טווח הגידול האקספוננציאלי. כדי לדגום בכל נקודת זמן, בצע את השלבים הבאים.
- סנן 1 מ"ל או יותר של תרבית ישירות דרך מסנן מזרק נקי וסטרילי של 0.2 מיקרומטר ושמר את התסיס כדי למדוד את ריכוז הבועיות כמו בשלב 5.3. הקפיאו את דוגמאות מהלך הזמן אם תרצה בכך. השתמש בפלואורסצנציה יחסית כדי לעקוב אחר דינמיקה של צמיחת תרבויות.
- שמור מדגם של התרבות כולה כדי לקבוע את גודל האוכלוסייה בשיטה המתאימה לאורגניזם (ציטומטריית זרימה; ציפוי מושבה; או אחר).
- קבל מדידות של תאים וחלקיקים דמויי שלפוחית (לכל מ"ל) בכל נקודת זמן.
- זהה את נקודות הזמן שהתרחשו במהלך שלב הצמיחה האקספוננציאלית. כדי לחשב את r, מספר הבועיות המיוצרות לכל תא לדור, בין שתי נקודות במהלך צמיחה מעריכית (בדרך כלל ההתחלה והסוף של מסלול הזמן), השתמש במשוואה המופיעה בקובץ משלים 1.
הערה: שיטה זו תקפה רק במהלך תנאי צמיחה במצב יציב; הנחות היסוד ונגזרות החישוב מפורטות בהפניה14.
תוצאות
איור 1 מציג סקירה כללית של תהליך בידוד השלפוחית הציאנובקטריאלית, ומדגיש היבטים מרכזיים של הפרוטוקול המתואר כאן. יש לציין במיוחד את השלבים המפרטים את ההפרדה של ביומסה ציאנובקטריאלית מחלק החלקיק הקטן (שלפוחית), תוך ריכוז דגימת השלפוחית ובידוד וטיהור השלפוחית (איור 1, שלבים 2 עד 4), שהם קריטיים להשגת תכשירים הניתנים לשחזור של שלפוחית. איור 2 מציג תוצאות מייצגות מהבידוד והאפיון של שלפוחיות חוץ-תאיות מהציאנובקטריום Synechocystis sp. PCC 6803. הממברנה החיצונית של ציאנובקטריום זה הוכחה כמכילה קרוטנואידים31, המעניקים צבע כתום אופייני לדגימות של בועיות שנאספו על ידי כדור ישיר דרך אולטרה-צנטריפוגציה (איור 2A). ברגע שכדור השלפוחית עובר החייאה, ניתן לבחון את הבועיות על ידי מיקרוסקופ אלקטרונים (TEM), בין אם על ידי צביעה שלילית של דגימות עם אורניל אצטט (איור 2B) או על ידי תצפית על מקטעי אולטרה-טימין (איור 2C). ניתן להעריך את התפלגות וריכוז גודל השלפוחית באמצעות פיזור אור דינמי (DLS) (איור 2D) וניתוחי מעקב אחר ננו-חלקיקים (NTA) (איור 2E). עם הפרוטוקול המתואר, בדרך כלל ~ 3.5 ± 1.0 x 108 ננו-חלקיקים למ"ל התקבלו בתרבית גדלה באופן אקספוננציאלי של Synechocystis sp. PCC 6803 ב OD730 של 1.0. ניתוחים ביוכימיים של כלי רכב חשמליים מבודדים יכולים להתבצע כדי להשלים את האפיון הפיזיקלי של הבועיות המבודדות. לדוגמה, בועיות Synechocystis sp. PCC 6803 מטוהרות הופרדו על ג'ל SDS-פוליאקרילאמיד והוכתמו עבור ליפופוליסכרידים (LPS; איור 2F). מכיוון ש-LPS הם ספציפיים לממברנה החיצונית32, זיהוי LPS יכול לאמת את נוכחותם של בועיות הקשורות לממברנה ולשמש סמן לניתוח תכולת שלפוחית יחסית בין תכשירים מאותו זן33. בדיקה של השפע היחסי של משקל מולקולרי נמוך לעומת גבוה LPS יכולה להצביע על שינויים בהרכב השלפוחית בין דגימות34,35.
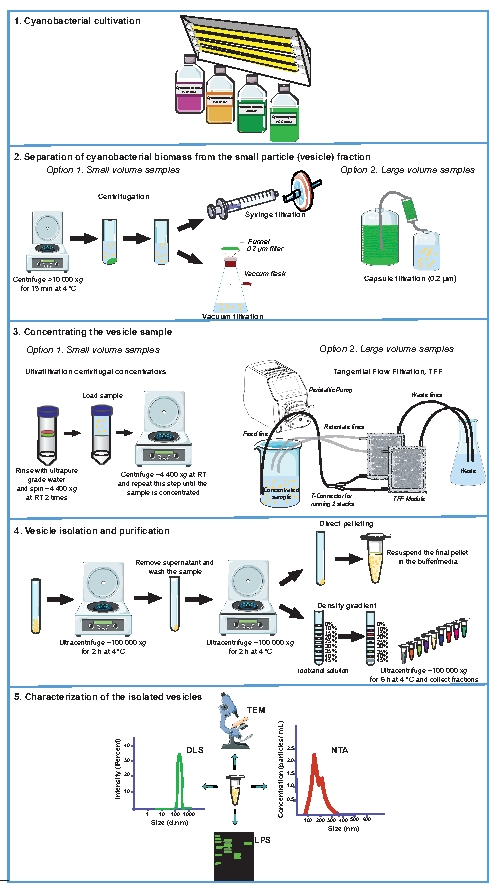
איור 1: הליכים ניסיוניים המשמשים לבידוד ואפיון של ר"ח ציאנובקטריאלי. ייצוגים סכמטיים של תרביות גידול (1) והפרדת ביומסה ציאנובקטריאלית ממדיום הגידול (2). דגימות נטולות תאים המכילות שלפוחיות מרוכזות (3), ואז כלי הרכב החשמליים מבודדים ומטוהרים (4). בהתאם ליישום, ניתן לאפיין תכשירי שלפוחית באמצעות אחד או שילוב של מיקרוסקופ אלקטרונים הולכה (TEM), ניתוח מעקב אחר ננו-חלקיקים (NTA), פיזור אור דינמי (DLS) ופרופיל ליפופוליסכריד (LPS) (5). RT, טמפרטורת החדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: תוצאות מייצגות של בידוד השלפוחית החוץ-תאית ואפיון עבור הציאנובקטריום Synechocystis sp. PCC 6803. (A) תצלום של גלולת השלפוחית החוץ-תאית (גלולת רכב חשמלי) שהתקבלה לאחר אולטרה-צנטריפוגציה של המדיום החוץ-תאי המרוכז נטול התאים מתרבית Synechocystis sp. PCC 6803 בגודל 600 מ"ל שגדלה ל-OD730 של 1.0-1.5. שימו לב לצבע הכתום הטיפוסי של גלולת השלפוחית שמקורה בקרוטנואידים שנמצאו בקרום החיצוני. (ב,ג) צילומי מיקרוסקופיית אלקטרונים (TEM) של מקטעים מוכתמים שלילית (B) ואולטרה-טווין (C) של דגימות שלפוחית Synechocystis sp. PCC 6803. סרגלי קנה מידה: 200 ננומטר ו-50 ננומטר, בהתאמה. דגימות הודגמו על מיקרוסקופ אלקטרונים תמסורת המופעל במהירות של 80 קילו-וולט. (D) תרשים טיפוסי של פיזור אור דינמי (DLS) המתאר את התפלגות נפח השלפוחית כפונקציה של קוטר השלפוחית (ב- nm). קווים צבעוניים מציינים נתונים משלוש מדידות שכפול טכניות של אותה דגימה. (E) נתוני ניתוח מעקב אחר ננו-חלקיקים מייצגים (NTA) של התפלגות גודל השלפוחית החוץ-תאית של Synechocystis (ב-nm). הקו השחור מציין את הממוצע של שלושה שכפולים טכניים, והקווים האדומים מייצגים את שגיאת התקן של הממוצע. (F) פרופיל ליפופוליסכרידים (LPS) זוהה לאחר הפרדת הכנת השלפוחית על ידי אלקטרופורזה על ג'ל SDS-polyacrylamide של 16% (w/v) וצביעה באמצעות ערכת צביעה מסחרית של LPS. ניתן לזהות LPS במשקל מולקולרי נמוך וגבוה, המתאים לצורות LPS גסות וחלקות, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קובץ משלים 1: משוואה לחישוב r. מספר הבועיות המיוצרות לכל תא לדור בין שתי נקודות במהלך הגדילה האקספוננציאלית (בדרך כלל ההתחלה והסוף של מסלול הזמן) נקבע באמצעות משוואה זו. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
שיקולים כלליים
הפרוטוקול (איור 1) מוצג כמערכת של אפשרויות כדי להדגיש שאין שיטה של 'מידה אחת שמתאימה לכולם' לעבודה עם שלפוחיות חוץ-תאיות ציאנובקטריאליות. חוקרים המעוניינים בכך יכולים להשתמש בחלקים של פרוטוקול זה התואמים ומתאימים לאורגניזם המודל המסוים שלהם, לשאלות/מטרות ניסיוניות ולזמינות הציוד. כל הגישות לבידוד שלפוחית כרוכות בפשרות ויגרמו באופן בלתי נמנע למידה מסוימת של הטיה. בעוד שיש לשאוף למזער זאת במידת האפשר, השיקול המכריע ביותר הוא להבטיח שהמתודולוגיה המפורטת שבה נעשה שימוש תדווח על פי הנחיות MISEV מתאימות (מידע מינימלי למחקרים על שלפוחית חוץ-תאית)36.
צמיחת תרבות
ניתן להשיג בקלות תרביות ציאנובקטריאליות מאחד מאוספי התרביות הרבים הזמינים ברחבי העולם. כמה דוגמאות הן אוסף תרביות רוסקוף (Station Biologique de Roscoff, צרפת), אוסף תרביות הפסטר (מכון פסטר, פריז, צרפת), והמרכז הלאומי לאצות ימיות ומיקרוביוטה של פרובסולי-גילארד (NCMA, מיין, ארה"ב). יש לטפח את הזן הציאנובקטריאלי המועדף בתנאים הבינוניים והסביבתיים המתאימים, המשתנים באופן משמעותי בין זנים שונים. רשימה של מדיה נפוצה לגידול ציאנובקטריאלי ניתן למצוא באתרי איסוף תרביות או בפרסומים אחרים 37,38,39.
עבודה עם שלפוחיות חוץ-תאיות ציאנובקטריאליות מציבה כמה אתגרים ייחודיים בהשוואה למתודולוגיות שדווחו עבור הטרוטרופים טיפוסיים רבים במעבדת מודלים. לתרביות ציאנובקטריאליות יש ריכוזי שלפוחית בסדרי גודל נמוכים יותר מאלו שנמצאו במיקרובים אחרים כגון Escherichia coli 14,16,40. הבדלים אלה, הנובעים ככל הנראה מצפיפות תאים נמוכה יותר ו/או משיעורי ייצור שלפוחית נמוכים יותר, פירושם שייתכן שיידרשו תרביות גדולות יחסית (כ-1-20 ליטר ומעלה) כדי להניב מספיק חומר לניתוחים בתפזורת. לפיכך, חוקרים מוזמנים לבחון את תפוקת השלפוחית מתרבויות בקנה מידה קטן יותר כדי לקבוע כמה חומר יהיה נחוץ כדי להשיג את מטרות הקצה הרצויות להם. יש להדגיש גם את החשיבות של קביעה אם למדיה המשמשת לניסוי יש רקע חלקיקי הניתן לזיהוי לפני תחילת כל ניסוי, שכן חומר זה עלול לבלבל את כימות אוכלוסיית השלפוחית, להפחית את הרגישות של מדידות ריכוז/גודל שלפוחית, או לזהם את תכשירי השלפוחית הסופיים.
אתגר נוסף לתחום הוא שלא כל הציאנובקטריה גדלה היטב, או בכלל, בתרבית טהורה. עד שהם הופכים לאקסניים, פרשנויות של מאפייני שלפוחית פיזיקליים, קצבי ייצור או תכנים אינם יכולים בהכרח להוביל למסקנות ברורות לגבי שלפוחיות המיוצרות על ידי זן אחד בקהילה. כמו כן, מומלץ לחוקרים לבחון אילו סוגים אחרים של חלקיקים יכולים להיות נוכחים, ועלולים להתבלבל עם בועיות על ידי כלים ספציפיים לניתוח ננו-חלקיקים, שאינם יכולים בהכרח להבחין בין סוגי חלקיקים שונים. לדוגמה, ייתכן שיהיה חיוני לוודא שהזן שבו נעשה שימוש חסר נבואה, בין אם באמצעות ריצוף גנום, מבחני אינדוקציה או אמצעים אחרים או שאינו משחרר סוגים אחרים של חומר חלקיקי. מניסיוננו, רוב הבועיות הציאנובקטריאליות הן בקוטר <0.2 מיקרומטר, אך כאשר מסתכלים על זן חדש או על מצב גדילה חדש, יש לוודא אם שימוש במסנן בגודל נקבובית של 0.45 מיקרומטר משנה את התפלגות הגודל של חלקיקים מטוהרים.
היבטים רבים של תנאי התרבות יכולים להשפיע על ייצור שלפוחית ותכולתה 41,42. לפיכך, התנאים הפיזיקליים והכימיים המשמשים לצמיחת תרבית (כולל הקרנת אור, טמפרטורה והרכב מדיה) צריכים להיות מתועדים ומבוקרים במידה האפשרית כדי להבטיח את יכולת השחזור של התוצאות. כל ניתוח כימי של תכולת השלפוחית חייב לקחת בחשבון את הרכב הרקע, במיוחד בעת ביצוע ניתוחים בסגנון '-omics' בתפוקה גבוהה. זה יכול להיות קריטי במיוחד כאשר משתמשים במדיה לא מוגדרת, כגון אלה המבוססים על רקע מי ים טבעיים או בתוספת תמצית שמרים או טריפטון. שימוש במדיום גדילה מוגדר עשוי להיות עדיף בהתאם למטרות הניסוי.
חוקרים צריכים לעקוב בקפידה אחר דינמיקת גידול התרבית במרווחי זמן קבועים כדי להבטיח שהם יודעים היכן בשלב הצמיחה נמצאת תרבית אצווה נתונה ולא רק לאסוף דגימות לאחר פרק זמן שרירותי. הרכב השלפוחית יכול להשתנות בין שלבי גדילה שונים, במיוחד בין שלבים מעריכיים ונייחים41,42. לדוגמה, לפחות חלק מהשרידים שנדגמו בשלב הנייח עשויים לנבוע ממנגנון תאי אחר, כגון תזה תאית, שלא יתרחש במהלך גדילה מעריכית. אמנם זה עדיין עשוי להיות עניין ביולוגי רב, אבל זה חיוני כדי לדעת את המדגם. אם תרבית ציאנובקטריאלית מגיעה לשלב הגדילה הרצוי בתקופה שבה לא ניתן להמשיך ישירות לריכוז הדגימה, מומלץ להפריד את התאים מחלק <0.2 מיקרומטר באופן מיידי (עם צנטריפוגה ו/או סינון ישיר של 0.2 מיקרומטר), ולאחר מכן לאחסן את התסיס ללא תאים בטמפרטורה של 4 מעלות צלזיוס. החומר יכול להיות מאוחסן בדרך זו במשך ימים עם השפעה מועטה עד אפסית על הריכוז או התפלגות הגודל של שלפוחיות.
טיהור שלפוחית
הצורך התכוף לבודד בועיות מתרביות נפח משמעותיות הוא חיוני בזרימת העבודה של בידוד שלפוחית ציאנובקטריאלית. בעת עבודה עם כמויות גדולות יותר של חומר, יהיה צורך לרכז את הבועיות לפני זרימות עבודה של הפרדה במורד הזרם. בדרך כלל מומלץ לרכזים (קרום מסנן זרימה משיק או עמודים צנטריפוגליים) עם מגבלת משקל מולקולרית נומינלית של 100 kDa, מכיוון שהם מאפשרים הפרדה מחומר מסיס עם משקל מולקולרי נמוך תוך שמירה על זמני ריכוז סבירים, אך מסנני 30 kDa משמשים לעתים קרובות גם בהצלחה. בעוד שכמה שיטות שאינן מבוססות על אולטרה-צנטריפוגציה של טיהור שלפוחית (למשל, כרומטוגרפיית אי-הכללת גודל, מערכות מבוססות מיקרופלואידיות, טכניקות ללכידת זיקה וגישות מבוססות משקעים) הופכות פופולריות בתחום השלפוחית החוץ-תאית, מניסיוננו, גישות אלה יכולות לגרום לירידה בתפוקות ובדרך כלל אינן עולות בקנה אחד עם נפחי התרביות הדרושים.
חוקרים צריכים לשקול את הרכב הרקע של יודיקסנול ואת מאגרי הכביסה/החייאה המשמשים במהלך טיהור השלפוחית כדי לוודא שהם תואמים ליישומים הרצויים במורד הזרם. במקרים רבים, ניתן לערוך את דגימת השלפוחית הסופית במדיית גדילה או חיץ מוגדר הדומה בהרכבו למדיום הגידול (למשל, מי ים טבעיים לעומת מלאכותיים). עם זאת, ייתכן שהדבר לא יתאפשר עם שלפוחיות ציאנובקטריאליות ימיות, מה שידרוש מניפולציה ניסיונית נוספת לצורך ניתוח, שכן ריכוזי מלחים גבוהים הדומים לרמות מי הים יכולים לעכב תגובות אנזימטיות רבות. במקרים כאלה, מאגרי מעבדה סטנדרטיים כגון 0.2 מיקרומטר מסוננים, 1x PBS בדרך כלל פועלים היטב לשמירה על היציבות של שלפוחיות ציאנובקטריאליות ימיות ויכולים להיות תואמים יותר לתהליכי ניסוי במורד הזרם.
טיהור שיפוע צפיפות יכול להיחשב אופציונלי בהתאם למטרות הניסוי ולהרכב התרבית, אך מומלץ בחום להפקת דגימה טהורה וניתנת לשחזור קפדנית יותר. אוכלוסיות EV הן הטרוגניות וניתן למצוא אותן במגוון של צפיפויות מצוף, המשתנות עוד יותר לפי מתח, תנאי גדילה וגורמים אחרים 4,5,6. הצפיפויות המפורטות לעיל מייצגות את אלה שנמצאות בדרך כלל עבור שלפוחיות מתרביות ציאנובקטריאליות ודגימות שדה ביודיקסנול, אך התוצאות עשויות להשתנות. ניתן להשתמש בחומרים גרדיאנטים אחרים בעלי צפיפות כגון סוכרוז ו-CsCl עבור שלפוחיות, אך הם ינודדו לצפיפויות מצוף שונות ברקעים אלה. רקעי מדיה הדרגתיים שונים יכולים להטות את ההתאוששות של נגיפים סגוריםבשומנים 43 ועשויים להשפיע על התאוששות שלפוחיות מזנים שונים.
שלפוחית יכולה ללכת לאיבוד במספר נקודות באמצעות בידוד השלפוחית, ותהליך טיהור הדרגתי המתואר כאן, מה שמפחית את התשואות ומגדיל את כמות החומר ההתחלתי הדרוש כדי להשיג תפוקת שלפוחית סופית נתונה עבור יישומים במורד הזרם. יש לנקוט בזהירות מיוחדת בעת עבודה עם כדורי שלפוחית לאחר ultracentrifugation. בעוד שלפוחיות ציאנובקטריאליות מסוימות יכולות להיות קרוטנואידים או תרכובות אחרות שעשויות להעניק לדגימות שלפוחית כמות מסוימת של פיגמנטציה (איור 2), בהתאם לזן או לכמות החומר, הן לא בהכרח צפויות להיות מסוגלות לדמיין את גלולת הבועיות ישירות. שים לב היכן הכדור צפוי לקבל את סוג הרוטור הצנטריפוגה המשמש. במידת האפשר, דגימות שלפוחית מטוהרות מוצעות להיבדק על ידי מיקרוסקופיית אלקטרונים כדי לאמת את הרכב החומר הסופי שהתגלה.
ההשפעה של תנאי האחסון על שלפוחיות ותכולתן נותרה שאלה פתוחה. למרות שנמצא כי לאחסון אין השפעה ניכרת על גודל השלפוחית הציאנובקטריאלית או הריכוז14, הפונקציונליות של תכשירי שלפוחית מבודדים עשויה להשתנות עם הזמן44. אמנם יש להימנע ממחזורי הקפאה/הפשרה במידת האפשר, אך ההשפעה של דגימות הקפאה על המספרים והגדלים הכוללים של השלפוחית נראית מינימלית. יש להיות מודעים לפוטנציאל של מחזורי הפשרה בהקפאה להשפיע על הרכב תכולת השלפוחית, כגון אורך חומצות גרעין הקשורות לשלפוחית או יציבות החלבונים.
שלפוחיות מ- field sבשפע
השיטות הנוכחיות לבידוד שלפוחיות חוץ-תאיות מסביבות ימיות טבעיות דומות מבחינה רעיונית ותפעולית לאלה המתוארות כאן עבור תרביות בעלות נפח גדול. ובכל זאת, הם יכולים לדרוש כמויות גדולות עוד יותר של חומר. דגימות שדה כאלה יכולות לכלול איסוף, סינון וריכוז של מאות עד אלפי ליטרים של מים כדי להשיג מספיק חומר לניתוח. בהתאם לעכירות הדגימה שבה נעשה שימוש, ייתכן שיהיה צורך בשילוב של שלב טרום סינון אחד או יותר לפני מסנן 0.2 מיקרומטר. מכשיר ה- TFF הספציפי המשמש צריך להיות מתאים לעבודה עם נפחים כה גדולים בפרק זמן סביר (באופן אידיאלי בסדר השעות) ומבלי להפעיל לחץ מוגזם על המדגם. בפועל, לעתים קרובות זה כרוך בשימוש בשטח פנים כולל גדול בהרבה מזה שניתן ליישם על דגימות מבוססות תרבית, כמו גם צינורות בקוטר גדול יותר כדי להקל על קצבי זרימה מוגברים. שטח פנים מוגבר זה של המסנן יוביל ככל הנראה לעלייה שולית באובדן החלקיקים בהשוואה לסידורי TFF קטנים יותר ולנפח סופי גדול יותר של תרכיז; עם זאת, חששות אלה חייבים להיות מאוזנים עם שיקולים של זמן עיבוד כולל. במצבים כגון הפלגה אוקיינוגרפית ממושכת שבה הדגימות לא יחזרו למעבדה במשך ימים רבים לאחר הדגימה, אנו ממליצים לבצע סינון ראשוני של 0.2 מיקרומטר ושלבי TFF בשטח. נפח קטן יותר זה של חומר מרוכז יכול להיות מאוחסן לאחר מכן בטמפרטורה של 4 °C או -80 °C על הלוח (בהתאם לזמינות ולשיקולים אנליטיים במורד הזרם) עד שהוא מוחזר למעבדה לעיבוד סופי.
בידוד והפרדה של שלפוחיות חוץ-תאיות מחלקיקים קטנים אחרים, אורגניים ואנאורגניים כאחד, יכולים להיות מאתגרים, והשיטות להפרדת חלקיקים שונים עדיין אינן מושלמות. לדוגמה, ייתכן ששיפועים של צפיפות יודיקסנול לא יפרידו בקלות בין כל סוגי הבועיות והווירוסים הקיימים במדגם נתון. מכיוון שסוגי החלקיקים המבלבלים, ותכונותיהם הפיזיקליות, ישתנו בין אתרי הדגימה, כיום לא ניתן לספק פרוטוקול שיחלק בחוזקה את כל סוגי החלקיקים הימיים הקטנים. ניסוי וטעייה הם חיוניים, ויידרשו ניסויים עם טווח היודיקסנול המשמש בתנאי השיפוע והאולטרא-צנטריפוגציה כדי למקסם את ההפרדה; ייתכן שיידרש גם אוסף של שברי צפיפות בנפח קטן יותר, שנפתרו בצורה עדינה יותר. בהתאם להקשר, שימוש במעברי צבע CsCl במקום יודיקסנול עשוי לסייע בהפרדת חלקיקים סביבתיים45. ובכל זאת, השינוי בתנאים האוסמוטיים עלול להוביל להטיות במוצרים הסופיים שהתאוששו, כפי שפורט לעיל.
אפיון שלפוחית
מכשירי ניתוח ננו-חלקיקים עדיין אינם זמינים באופן שגרתי במעבדות מעבדה מיקרוביולוגיות, אך הם הופכים לזמינים יותר ויותר. לכל המתודולוגיות יש יתרונות וחסרונות, ואנחנו לא תומכים באופן ספציפי בפלטפורמה אחת כטובה יותר מכל האחרות לעבודת שלפוחית ציאנובקטריאלית; ואכן, לכולם יש פשרות מסוימות הנוגעות לעלויות, רזולוציה, קלות שימוש, מגבלות זיהוי, תאימות עם רקעים שונים של מדיית צמיחה/מאגר, ויכולת שחזור נתונים. בנוסף למכשירים המבוססים על ניתוח מעקב אחר ננו-חלקיקים שתוארו לעיל, ניתן ליישם גישות אחרות, כולל ציטומטריה של זרימה ננו-זרימה, חישת פולסים התנגדותיים מיקרופלואידיים וחישת פולסים התנגדותיים מתכווננים, 46,47. משתמשים צריכים להיות זהירים ללמוד את פרטי המכשור הזמין שלהם ולוודא שהוא עובד היטב עם המערכת שלהם, מכיוון שנתקלנו בקשיים בעת שימוש בפלטפורמות מסוימות עם מדיה מבוססת מי ים. אנו מעודדים את התחום להתקדם לעבר אפיון כמותי של גודל השלפוחית, הריכוזים וקצב הייצור. מדידת ריכוזי השלפוחית על בסיס חלקיק בסיסי למ"ל, ולא במונחים של תכולת חלבון או מדדים אחרים, תאפשר שילוב של בועיות למסגרות כמותיות יותר ותאפשר בין-קומפריזונים בין זנים ותנאים. נדרשים מאמצים נוספים לשיפור היכולת לכייל מדידות ריכוז עבור חלקיקי <100 ננומטר.
העובדה שמדידות קצב ייצור שלפוחית נעשות ישירות מתרבית מסוננת של 0.2 מיקרומטר כדי למזער הפסדי חלקיקים תהיה קשורה לשלבי טיהור אחרים שתוארו לעיל. עם זאת, משמעות הדבר היא שהגישה אינה מבחינה בהכרח בין שלפוחיות חוץ-תאיות ממשיות לבין חלקיקים קטנים אחרים המצויים בתרביות. רק ספירת חלקיקים בטווחי גודל ספציפיים (לדוגמה, קוטר 50-250 ננומטר) עשויה לסייע בהחרגת חלק מהחלק מהחריגות, אך יש צורך באישור חזותי לכך שתכולת תרבית <0.2 מיקרומטר דחוסה נראית כבועיות הקשורות לממברנה (על ידי TEM או גישות אחרות) כדי להיות מסוגלים לטעון במפורש שאדם מודד את ייצור הבועיות בניגוד לייצור של חלקיקים דמויי שלפוחית.
גורם חיוני באפיון שלפוחית הוא לוודא שמדגם השלפוחית מנותח בטווח הרגישות הליניארי המתאים של מכשיר ניתוח הננו-חלקיקים. כאשר דגימה מרוכזת מדי, זה פשוט לדלל את החומר עם מאגר נקי ולנתח אותו מחדש. מצד שני, צפיפות התאים ו/או השלפוחית הנמוכה יחסית של תרביות ציאנובקטריאליות מסוימות יכולה לעתים להניב תכשירי שלפוחית שנמצאים מתחת לגבולות הגילוי של מכשירים מסוימים. במקרים שבהם זה קורה עם טיהור שלפוחית בתפזורת, ניתן לשקול גידול תרביות נפח גדולות יותר, פיזור מחדש והחזרת החומר הסופי בנפח קטן יותר, או הערכה אם יש שלב בתהליך הבידוד שבו מתרחשים הפסדים מוגזמים וניתן למתן אותם. כאשר מודדים את שיעורי ייצור השלפוחית, התיקונים אינם בהכרח פשוטים כל כך. ניתן לרכז דגימות במידת הצורך, אך הראשונה צריכה לראות אם התאמות למדיה עלולות לגרום לצפיפות תאים גבוהה יותר או שניתן יהיה לקבל דגימות מרוכזות מספיק מנקודות זמן מאוחרות יותר במהלך השלב האקספוננציאלי שבו הריכוזים יהיו גבוהים יותר.
מגבלות
כמו בכל פרוטוקול, לבידוד שלפוחית באמצעות גישות אלה יש מגבלות ברורות. גישות אלה אינן מסתמכות על הבטחתן כי הכנה טהורה לחלוטין של שלפוחיות תהיה מבודדת. גם תרביות וגם דגימות שדה עשויות להכיל חומרים אחרים, הנודדים באופן דומה לשלפוחיות בדרגות צפיפות. ובכל זאת, לכל הפחות, סוגים אלה של מתודולוגיות טיהור נוספות חיוניים להבטחת קפדנות ושכפול של ניתוח שלפוחית. בעוד שאנו מתארים גישות לבידוד שלפוחית בהקשר של ציאנובקטריה, תרביות של מיקרובים רבים אחרים יכילו גם שלפוחיות בריכוזים נמוכים יחסית, וההליכים המתוארים כאן צריכים להיות ישימים באופן כללי. הצפי הוא ששיטות אלה ישמשו לא כפרוטוקול קבוע אלא כנקודת מוצא לעידוד התקדמות עתידית בעבודה עם בועיות חוץ-תאיות ממיקרובים מגוונים. נדרשים מאמצים עתידיים למזג שיטות אלה עם גישות אחרות כגון עמודות אי-הכללת גודל או פיצול זרימת שדה אסימטרי כדי לשפר את ההבחנה וההפרדה של קטגוריות שונות של חלקיקים קטנים מתרביות ומדגימות סביבתיות. אנו גם מקווים שטכניקות אלה יוכלו להמשיך להתפתח לצד שיפורים בטכנולוגיות אפיון ננו-חלקיקים כדי לשפר את היכולת לבחון את ההטרוגניות בתוך אוכלוסיות שלפוחית, את תוכנן ואת תפקידן התפקודי המדויק בסביבה.
Disclosures
המחברים מצהירים על היעדר ניגודי עניינים.
Acknowledgements
המחברים מכירים בתמיכת הפלטפורמות המדעיות של i3S "Biointerfaces וננו-טכנולוגיה", ו"היסטולוגיה ומיקרוסקופיית אלקטרונים", חברה בפלטפורמה הפורטוגזית של התשתית הלאומית של הדמיה ביולוגית (PPBI-POCI-01-0145-FEDER-022122). אנו מודים גם לפרופ' J. A. Gonzalez-Reyes (אוניברסיטת קורדובה, ספרד) על עזרתו לייעל את פרוטוקול צביעת החלק הדק במיוחד עבור TEM, ולד"ר ססיליה דוראייס וד"ר אנה ריטה פינטו (אוניברסיטת פורטו, פורטוגל) על ניתוח המעקב אחר ננו-חלקיקים.
עבודה זו מומנה על ידי הקרן הלאומית למדע של ארה"ב (OCE-2049004 ל- SJB), על ידי Fundo Europeu de Desenvolvimento Regional (FEDER) באמצעות התוכנית האופרציונלית של תחרות 2020 לתחרותיות ובינאום (POCI), פורטוגל, 2020, ועל ידי קרנות פורטוגזיות באמצעות Fundação para a Ciência e a Tecnologia /Ministério da Ciência, Tecnologia e Ensino Superior במסגרת הפרויקט POCI-01-0145-FEDER-029540 (PTDC/BIA-OUT/29540/2017 ל- PO). Fundação para a Ciência e a Tecnologia מוכר מאוד גם עבור מלגת הדוקטורט SFRH/BD/130478/2017 (SL), ומענק חוקר FCT IF/00256/2015 (PO). מ.כ.מ.-מ. נתמך על ידי מלגת מארי סקלודובסקה-קירי (פאנל שילוב מחדש) במסגרת תוכנית המסגרת של Horizon 2020 (H2020-MSCA-IF-2018-RI-844891).
Materials
| Name | Company | Catalog Number | Comments |
| 1x Phosphate buffered saline (PBS), pH 7.4 | Home-made buffer | --- | Standard wash/storage buffer which can be used with vesicles; can be made in lab or purchased commercially |
| 2% Uranyl acetate solution | Electron Microscopy Sciences | 22400-2 | Negative staining - TEM |
| 4x Laemmli Sample Buffer | Bio-Rad | 161-0747 | Denaturation of vesicle sample prior to proteolysis, required for lipopolysaccharides (LPS) staining |
| Amicon Ultra Centrifugal Filters (100 kDa) | Merck | UFC9100XX | Alternative option for centrifugal ultrafiltration |
| BG11 medium | Home-made medium | --- | Medium for cultivation of Synechocystis sp. PCC 6803 |
| Carbon Support Film 200 Mesh, copper. CF200-Cu | Electron Microscopy Sciences | 71150 | Transmission electron microscopy (TEM) grid |
| easiGlow Glow Discharge Cleaning System | Ted Pella | 91000 | Commercial TEM grid glow discharger |
| EMbed 812 epoxy resin | Electron Microscopy Sciences | 14120 | Ultra-thin sections - TEM |
| Filter holder for vacuum system | Thermo Fisher Scientific | 300-4000 | Reusable units with filter membrane support plates |
| Glutaraldehyde Grade I | Sigma-Aldrich | G5882-10X1ml | Ultra-thin sections - TEM |
| HEPES [N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) sodium salt] | Sigma-Aldrich | H7006 | Buffering agent for cyanobacterial growth media |
| Lead Citrate, Trihydrate | Electron Microscopy Sciences | 17800 | Stain for use in electron microscopy |
| Macrosep Advance Centrifugal Devices with Omega Membrane 100K | Pall | MAP100C36 | For centrifugal ultrafiltration of small volume samples |
| Millipore Pellicon 3 TFF Module | EMD Millipore | XX42P0060 or XX42P0080 | Alternative TFF option for concentrating large volume samples |
| Milli-Q Reference Water Purification System | Merck | Z00QSV0WW | Water purification system for obtaining type I ultrapure grade water |
| NanoSight | Malvern Panalytical | LM14 or NS300 | Nanoparticle tracking analysis |
| Optima L80 XP Ultracentrifuge | Beckman Coulter | L80 XP | Ultracentrifuge (or similar model) |
| OptiPrep / Iodixanol | Sigma-Aldrich | D1556 | Density gradient media |
| Osmium Tetroxide Reagent Plus | Sigma-Aldrich | 201030 | Ultra-thin sections - TEM |
| Pall Centramate PE TFF holder | Pall Corporation | FS002K10 | TFF module good for concentrating 10s-100s of L of sample; requires additional 30 or 100 kDa filter modules to scale with your estimated volumes |
| Peristaltic pump Masterflex L/S | Cole-Parmer | 07559-07 | Pump for driving large-scale TFF modules |
| Piston Gradient Fractionator | Biocomp Instruments | 152-001 | Automated density gradient fractionation |
| Polycarbonate tubes for the 70 Ti rotor | Beckman Coulter | 355618 | Reusable ultracentrifuge polycarbonate aluminum tubes with cap assembly |
| Pro99 medium | Home-made medium | --- | Medium for cultivation of Prochlorococcus |
| Pro-Q Emerald LPS Gel Stain Kit | Thermo Fisher Scientific | P20495 | LPS staining |
| SN medium | Home-made medium | --- | Medium for cultivation of cyanobacterial marine strains such as Synechococcus |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250-100G | Buffering agent in the preparation of vesicles samples for TEM |
| SW32Ti swinging bucket rotor | Beckman Coulter | 369650 | Ultracentrifuge rotor, holds 6x ~40 mL tubes; good for pelleting of bulk material |
| SW60Ti swinging bucket rotor | Beckman Coulter | 335650 | Ultracentrifuge rotor, holds 6x ~4.5 mL tubes; good for gradient purifications and final vesicle washes |
| Syringe 1mL Luer | BD Plastipak | 303172 | For vesicle isolation and loading samples into nanparticle tracking analysis (NTA) equipment |
| Syringe filter 0.2 µm | Pall Corporation | 4602 | For vesicle isolation from cultures |
| TAPS [N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid] | Sigma-Aldrich | T5130 | Buffering agent for cyanobacterial growth media |
| Transmission electron microscope | JEOL | JEM-1400 | Or similar microscope |
| Type 70 Ti Fixed-Angle Titanium Rotor | Beckman Coulter | 337922 | Ultracentrifuge rotor, holds 8x ~39 mL tubes; good for pelleting of bulk material |
| Type XIV protease from Streptomyces griseus | Sigma-Aldrich | P5147 | Enzyme for proteolysis of EVs proteins, required for LPS staining |
| UltraClear tubes for the SW32Ti rotor | Beckman Coulter | 344058 | Single use ultracentrifuge tubes |
| UltraClear tubes for the SW60Ti rotor | Beckman Coulter | 344062 | Single use ultracentrifuge tubes |
| Ultramicrotome PowerTome XL, PT-PC | RMC Products, Boeckeler Instruments | 75501 | Microtome for ultra-thin sections - TEM |
| Universal 320 R centrifuge | Hettich | Z654736 | This or any similar general-purpose benchtop/floor standing centrifuge can be used for pelleting cells |
| Vacuum apparatus | KNF Neuberger | N026.3 AT.18 | Or any similar vacuum pump and trap |
| Vivaflow 200 100,000 MWCO PES | Sartorius | VF20P4 | TFF module, good for 2-3L. You can connect different modules for higher volume (figure 1). |
| Whatman Polycap TC Capsule filter (0.2/0.2µm) | Cytiva | 6717-9502 | Capsule filter for filtering large volumes of liquid |
| Zetasizer | Malvern Panalytical | Zetasizer Nano ZS | Dynamic light scattering (DLS) instrument |
References
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Coelho, C., Casadevall, A. Answers to naysayers regarding microbial extracellular vesicles. Biochemical Society Transactions. 47 (4), 1005-1012 (2019).
- Schwechheimer, C., Kuehn, M. J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions. Nature Reviews Microbiology. 13 (10), 605-619 (2015).
- Toyofuku, M., Nomura, N., Eberl, L. Types and origins of bacterial membrane vesicles. Nature Reviews Microbiology. 17 (1), 13-24 (2019).
- Kulp, A., Kuehn, M. J. Biological Functions and Biogenesis of Secreted Bacterial Outer Membrane Vesicles. Annual Review of Microbiology. 64 (1), 163-184 (2010).
- Berman-Frank, I., Lundgren, P., Falkowski, P. Nitrogen fixation and photosynthetic oxygen evolution in cyanobacteria. Research in Microbiology. 154 (3), 157-164 (2003).
- Flores, E., Herrero, A. Compartmentalized function through cell differentiation in filamentous cyanobacteria. Nature Reviews Microbiology. 8 (1), 39-50 (2010).
- Flombaum, P., et al. Present and future global distributions of the marine cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9824 (2013).
- Biller, S. J., Berube, P. M., Lindell, D., Chisholm, S. W. Prochlorococcus: the structure and function of collective diversity. Nature Reviews Microbiology. 13 (1), 13-27 (2015).
- Abed, R. M. M., Dobretsov, S., Sudesh, K. Applications of cyanobacteria in biotechnology. Journal of Applied Microbiology. 106 (1), 1-12 (2009).
- Lea-Smith, D. J., et al. Editorial: Exploring the growing role of cyanobacteria in industrial biotechnology and sustainability. Frontiers in Microbiology. 12, 1963 (2021).
- Garcia-Pichel, F., Zehr, J. P., Bhattacharya, D., Pakrasi, H. B. What's in a name? The case of cyanobacteria. Journal of Phycology. 56 (1), 1-5 (2020).
- Biller, S. J., et al. Bacterial vesicles in marine ecosystems. Science. 343 (6167), 183 (2014).
- Pardo, Y. A., Florez, C., Baker, K. M., Schertzer, J. W., Mahler, G. J. Detection of outer membrane vesicles in Synechocystis PCC 6803. FEMS Microbiology Letters. 362 (20), (2015).
- Oliveira, P., et al. The versatile TolC-like Slr1270 in the cyanobacterium Synechocystis sp. PCC 6803. Environmental Microbiology. 18 (2), 486-502 (2016).
- Biller, S. J., et al. Membrane vesicles in sea water: heterogeneous DNA content and implications for viral abundance estimates. The ISME Journal. 11 (2), 394-404 (2017).
- Yin, H., et al. Synechococcus elongatus PCC7942 secretes extracellular vesicles to accelerate cutaneous wound healing by promoting angiogenesis. Theranostics. 9 (9), 2678-2693 (2019).
- Lima, S., Matinha-Cardoso, J., Tamagnini, P., Oliveira, P. Extracellular vesicles: An overlooked secretion system in cyanobacteria. Life. 10 (8), 129 (2020).
- Gupta, S., Marcela Rodriguez, G. Isolation and characterization of extracellular vesicles produced by iron-limited mycobacteria. Journal of Visualized Experiments: JoVE. (152), e60359 (2019).
- Jung, A. L., et al. Legionella pneumophila outer membrane vesicles: Isolation and analysis of their pro-inflammatory potential on macrophages. Journal of Visualized Experiments: JoVE. (120), e55146 (2017).
- Fantappiè, L., et al. Antibody-mediated immunity induced by engineered Escherichia coli OMVs carrying heterologous antigens in their lumen. Journal of Extracellular Vesicles. 3 (1), (2014).
- Moore, L. R., et al. Culturing the marine cyanobacterium Prochlorococcus. Limnology and Oceanography: Methods. 5 (10), 353-362 (2007).
- Rippka, R., et al. Prochlorococcus marinus Chisholm et al. 1992 subs. Pastoris subs. nov. Strain PCC 9511, the first axenic chlorophyll a2/b2-containing cyanobacterium (Oxyphotobacteria). International Journal of Systematic and Evolutionary Microbiology. 50 (5), 1833 (2000).
- Moore, L. R., Chisholm, S. W. Photophysiology of the marine cyanobacterium Prochlorococcus: Ecotypic differences among cultured isolates. Limnology and Oceanography. 44 (3), 628 (1999).
- Partensky, F., Blanchot, J., Vaulot, D., Charpy, L., Larkum, A. W. D. . Bulletin de l'Institut Océanographique de Monaco, (n spécial 19). , 457-475 (1999).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Fomsgaard, A., Freudenberg, M. A., Galanos, C. Modification of the silver staining technique to detect lipopolysaccharide in polyacrylamide gels. Journal of Clinical Microbiology. 28 (12), 2627-2631 (1990).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Peterson, T. Densitometric analysis using NIH image. North American Vascular Biology Organization (NAVBO) eNewsletter. 16 (3), (2010).
- Jürgens, U. J., Weckesser, J. Carotenoid-containing outer membrane of Synechocystis sp. strain PCC6714. Journal of Bacteriology. 164 (1), 384-389 (1985).
- Whitfield, C., Trent, M. S. Biosynthesis and export of bacterial lipopolysaccharides. Annual Review of Biochemistry. 83 (1), 99-128 (2014).
- McBroom, A. J., Johnson, A. P., Vemulapalli, S., Kuehn, M. J. Outer membrane vesicle production by Escherichia coli is independent of membrane instability. Journal of Bacteriology. 188 (15), 5385-5392 (2006).
- Kadurugamuwa, J. L., Beveridge, T. J. Virulence factors are released from Pseudomonas aeruginosa in association with membrane vesicles during normal growth and exposure to gentamicin: a novel mechanism of enzyme secretion. Journal of Bacteriology. 177 (14), 3998-4008 (1995).
- Nguyen, T. T., Saxena, A., Beveridge, T. J. Effect of surface lipopolysaccharide on the nature of membrane vesicles liberated from the Gram-negative bacterium Pseudomonas aeruginosa. Journal of Electron Microscopy. 52 (5), 465-469 (2003).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Norena-Caro, D. A., Malone, T. M., Benton, M. G. Nitrogen sources and iron availability affect pigment biosynthesis and nutrient consumption in Anabaena sp. UTEX 2576. Microorganisms. 9 (2), 431 (2021).
- Rippka, R. Isolation and purification of cyanobacteria. Methods in Enzymology. , 3-27 (1988).
- Van Alphen, P., Abedini Najafabadi, H., Branco dos Santos, F., Hellingwerf, K. J. Increasing the photoautotrophic growth rate of Synechocystis sp. PCC 6803 by identifying the limitations of its cultivation. Biotechnology Journal. 13 (8), 1700764 (2018).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA. mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12 (383), (2021).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209 (2019).
- Soares, N. C., et al. Associating growth-phase-related changes in the proteome of Acinetobacter baumannii with increased resistance to oxidative stress. Journal of Proteome Research. 9 (4), 1951-1964 (2010).
- Thurber, R. V., Haynes, M., Breitbart, M., Wegley, L., Rohwer, F. Laboratory procedures to generate viral metagenomes. Nature Protocols. 4 (4), 470-483 (2009).
- Dell'Annunziata, F., et al. Outer membrane vesicles derived from Klebsiella pneumoniae are a driving force for horizontal gene transfer. International Journal of Molecular Sciences. 22 (16), 8732 (2021).
- Linney, M. D., Schvarcz, C. R., Steward, G. F., DeLong, E. F., Karl, D. M. A method for characterizing dissolved DNA and its application to the North Pacific Subtropical Gyre. Limnology and Oceanography: Methods. 19 (3), 210-221 (2021).
- Arab, T., et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms. Journal of Extracellular Vesicles. 10 (6), 12079 (2021).
- Cimorelli, M., Nieuwland, R., Varga, Z., vander Pol, E. Standardized procedure to measure the size distribution of extracellular vesicles together with other particles in biofluids with microfluidic resistive pulse sensing. PLoS ONE. 16 (4), 0249603 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved