Method Article
تمرير سريع وفعال من حيث التكلفة وخالي من الإنزيم للخلايا الجذعية البشرية متعددة القدرات على الخلايا المغذية عن طريق إزالة الالتصاق بوساطة حمض الإيثيلين ديامينيترايتيك
In This Article
Summary
لتجنب القيود المرتبطة بالمرور الأنزيمي أو الميكانيكي للخلايا الجذعية الجنينية البشرية (hESCs) والخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSCs) المزروعة على الخلايا المغذية ، أنشأنا طريقة سريعة وفعالة وفعالة من حيث التكلفة وعالية الغلة لحصاد مستعمرات hESC أو hiPSC التي يتم الاحتفاظ بها على طبقة الخلايا المغذية من الخلايا الليفية القلفة البشرية باستخدام عدم الالتصاق بوساطة EDTA.
Abstract
تم استزراع الخلايا الجذعية البشرية متعددة القدرات (الخلايا الجذعية الجنينية البشرية ، hESCs ، والخلايا الجذعية متعددة القدرات المستحثة بشريا ، hiPSCs) في الأصل على أنواع مختلفة من الخلايا المغذية للصيانة في حالة غير متمايزة في الثقافة طويلة الأجل. تم استبدال هذا النهج إلى حد كبير ببروتوكولات الاستزراع الخالية من التغذية ، ولكن هذه الكواشف تنطوي على كواشف أكثر تكلفة ويمكن أن تعزز الانتقال إلى حالة مهيأة ، مما يحد من قدرة الخلايا على التمايز. في كل من الظروف الخالية من المغذيات والخالية من المغذيات ، يعد حصاد مستعمرات hESC أو hiPSC للمرور إجراء ضروريا لتوسيع الثقافات.
لتوفير إجراء سهل وعالي الإنتاجية لتمرير hESCs / hiPSCs المزروعة على الخلايا المغذية ، أنشأنا طريقة حصاد باستخدام إزالة الالتصاق المستنبطة بواسطة حمض الإيثيلين ديامينيترايتيك (EDTA). لقد قمنا بتقييم إنتاجية وجودة الخلايا المارة الناتجة من خلال مقارنة هذا النهج بنهج الحصاد الميكانيكي الأصلي ، حيث يتم عزل المستعمرات بمشرط تحت المجهر (تم اختيار الحصاد الميكانيكي كمقارنة لتجنب تباين الكاشف المرتبط بالحصاد الأنزيمي).
في مجموعة واحدة من التجارب ، تم الحفاظ على خطين مختلفين من hESC على طبقة خلية مغذية من الخلايا الليفية القلفة البشرية. تم إخضاع كل خط لمقاطع متعددة باستخدام الحصاد القائم على EDTA أو الحصاد الميكانيكي وتم تقييمه لحجم المستعمرة ومورفولوجيتها ، وكثافة الخلية ، وتعبير علامة الجذعية ، والتمايز إلى الطبقات الجرثومية الثلاث في الأجسام الجنينية ، والانحرافات الجينومية. في مجموعة أخرى من التجارب ، استخدمنا الحصاد القائم على EDTA على خطين مختلفين من hiPSC وحصلنا على نتائج مماثلة. أدى عدم الالتصاق الناجم عن EDTA إلى توفير الوقت وإعطاء عائد أعلى من المستعمرات ذات الحجم الأكثر ملاءمة والتشكل الأكثر اتساقا مقارنة بالحصاد الميكانيكي. كان أيضا أسرع من الحصاد الأنزيمي وليس عرضة لتقلب دفعة الإنزيم. تسهل طريقة إزالة الالتصاق المستحثة ب EDTA أيضا نقل خطوط hESC / hiPSC من الثقافة القائمة على الخلايا المغذية إلى ظروف خالية من وحدة التغذية إذا رغبت في ذلك للاستخدام والتحليل النهائي.
Introduction
الصيانة المناسبة ل hESCs و hiPSCs في المختبر هي منهجية أساسية ومريحة للعديد من طرق البحث في الخلايا البشرية وعلم الأحياء التنموي. نظرا للدافع المتأصل ل hESCs و hiPSCs للتمييز ، فإن الحفاظ على الحالة غير المتمايزة في المختبر يتطلب عناية واهتماما خاصين. وبالتالي ، فإن تطوير بروتوكولات فعالة من حيث التكلفة لصيانة وتمرير hESCs و hiPSCs بأقل قدر ممكن من التباين المنهجي له فائدة عامة كبيرة.
في الأصل ، تم استزراع hESCs و hiPSCs على أنواع مختلفة من الخلايا المغذية للمساعدة في الثقافة طويلة الأجل والحفاظ على الحالة غير المتمايزة1،2،3. في الآونة الأخيرة ، أصبحت الثقافة في ظل ظروف خالية من التغذية هي القاعدة ، لأنها تتجنب التعامل مع الخلايا المغذية تماما4. ومع ذلك ، لا تزال بعض المختبرات والمرافق الأساسية تزرع hESCs أو hiPSCs على الخلايا المغذية. تعتبر الاستزراع الخالي من التغذية أكثر تكلفة لأنه يتطلب استخدام وسائط استزراع ذات تركيبات خاصة وشكل من أشكال طلاء سطح الاستزراع لضمان التصاق المستعمرة (مكونات المصفوفة الرئيسية خارج الخلية [ECM] أو مركب ECM التجاري ، أو باستخدام الألواح المطلية المتاحة تجاريا). النفقات ليست تافهة وتمثل عائقا ماليا محتملا لبعض المختبرات المهتمة بمتابعة البحث والتطوير القائم على hESC أو hiPSC. علاوة على ذلك ، تميل الثقافة في ظل ظروف خالية من التغذية إلى دفع hESCs و hiPSCs إلى حالة أقل سذاجة مما يتم الحفاظ عليه في الخلايا المغذية5 ، وهذا يمكن أن يضر بالتمايز اللاحق ويؤدي إلى اختلافات وراثية6.
تاريخيا ، تضمن مرور hESCs و hiPSCs المستزرعة على الخلايا المغذية الحصاد الميكانيكي - باستخدام مشرط لاستئصال المستعمرات تحت المجهر7 - ولكن تم استبدال هذا لاحقا إلى حد كبير بالهضم الأنزيمي مع أو بدون كشط لطيف لعزل المستعمرات أو الخلايا المنفصلة. الحصاد الميكانيكي ممل ويتطلب جراحة مجهرية دقيقة. يمكن أن يختلف الحصاد الأنزيمي في الكفاءة بسبب اختلافات الإنزيم من دفعة إلى أخرى ويميل إلى تفضيل التفكك الكامل ، مما يعزز موت الخلايا ما لم يتم التصدي له بواسطة مثبطات ROCK 8,9 ويزيد من حدوث الأنماط النووية غير الطبيعية9.
للاستفادة من انخفاض النفقات وإمكانية التمايز الأكبر لزراعة hESCs و hiPSCs على خلايا التغذية مع تجنب عيوب الحصاد الميكانيكي والأنزيمي ، أنشأنا طريقة سريعة وفعالة وفعالة من حيث التكلفة وعالية الغلة لحصاد مستعمرات hESC و hiPSC التي يتم الحفاظ عليها على طبقة مغذية من الخلايا الليفية القلفة البشرية باستخدام عدم الالتصاق بوساطة EDTA. لقد قارنا المحصول والتباين وجودة الخلايا الجذعية بتلك التي تم الحصول عليها من خلال الحصاد الميكانيكي (لم نقارن بالهضم الأنزيمي بسبب التباين الإضافي الذي يستلزمه هذا النهج). نلاحظ أن إزالة الالتصاق بوساطة EDTA تعمل أيضا بشكل جيد لنقل المستعمرات من الثقافة القائمة على التغذية إلى الظروف الخالية من التغذية ، إذا رغبت في ذلك للاستخدام والتحليلات النهائية. توفر هذه الطريقة انتقالا بطريقة تمرير متسقة ، نظرا لأن إزالة الالتصاق الناتجة عن EDTA هي طريقة شائعة تستخدم للثقافات الخالية من التغذية.
Protocol
راجع جدول المواد للحصول على تفاصيل حول جميع المواد والكواشف والأدوات المستخدمة في هذا البروتوكول.
1. زراعة الخلايا الليفية البشرية وإعداد طبقة الخلايا المغذية
- البذور 0.5 × 106 خلايا ليفية من القلفة البشرية (تسمى فيما يلي "الخلايا المغذية") لكل قارورة ثقافة T-75 (عدد القوارير حسب الحاجة) مع 20 مل من وسط Dulbecco المعدل من Iscove (IMDM) مع (w /) 10٪ مصل بقري جنيني (FBS) ، يسمى فيما بعد "وسط الخلية المغذية".
- عندما تصل الخلايا المغذية إلى التقاء 90٪ ، قم بإزالة الوسط ، واغسل 3x ب 10 مل من محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco لكل قارورة لتجنب تثبيط التربسين بواسطة عوامل في الوسط. أضف 2 مل من التربسين-EDTA إلى كل دورق ، وضع القارورة (القارورات) في حاضنة 37 درجة مئوية / 5٪ CO2 لمدة 5 دقائق أو حتى تنفصل الخلايا المغذية عن الدورق (الدورق). لاحظ انفصال الخلايا تحت المجهر كمجاميع عائمة من الخلايا أو الخلايا المفردة.
- أضف 5 مل من وسط خلية التغذية الطازج الذي تم تسخينه مسبقا إلى كل قارورة لتعطيل التربسين-EDTA ، وقم بتعليق خلايا التغذية برفق عن طريق الماصة.
- انقل الخلايا المغذية إلى أنبوب طرد مركزي سعة 15 مل. قم بتغطية الأنبوب ، وحبيبات الخلايا المغذية عن طريق الطرد المركزي عند 200 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية بعناية دون إزعاج حبيبات خلية التغذية. بعد ذلك ، أعد تعليق الحبيبات بعناية في 4 مل من وسط خلية التغذية الطازجة. تأكد من إعادة تعليق خلايا التغذية تماما قبل العد باستخدام غرفة عد الخلايا أو أي جهاز عد خلايا آخر.
- أضف 0.5 × 106 خلايا مغذية إلى العدد المطلوب من قوارير ثقافة T-75 الجديدة للتوسع ، وأضف 20 مل من وسط خلية التغذية الطازجة إلى كل قارورة. احتضان قارورة (قوارير) الاستزراع في حاضنة CO2 37 درجة مئوية / 5٪ حتى تصل الخلايا المغذية إلى التقاء 90٪.
ملاحظة: يمكن استخدام خلايا التغذية حتى مرور 25 على الأقل. - احسب عدد الخلايا المغذية المطلوبة لعدد أطباق زراعة الأنسجة 35 مم التي سيتم استخدامها لزراعة hESCs / hiPSCs.
ملاحظة: عادة ما تكون 3.0 × 105 خلايا مغذية لكل طبق زراعة الأنسجة كافية لتوليد طبقة متقاربة من الخلايا المغذية. - لتجنب تكاثر الخلايا المغذية ، تأكد من إيقافها انقساميا بإحدى طريقتين.
ملاحظة: بالنسبة لكلتا الطريقتين ، يمكن إنشاء مجموعة كبيرة من خلايا التغذية الموقوفة انقساميا وتجميدها في حصص لاستخدامها لاحقا.- قم بإجراء الاعتقال الانقسامي عن طريق تشعيع جاما عن طريق نقل جميع الخلايا المغذية اللازمة إلى أنبوب طرد مركزي سعة 50 مل وتزويدها بوسط خلية مغذية إلى حجم إجمالي قدره 5 مل. انقل على الفور في درجة حرارة الغرفة إلى آلة تشعيع جاما ، وقم بتشعيعه لإيقاف الخلايا المغذية انقساميا (300 كيلو فولت و 10 مللي أمبير لمدة 20 دقيقة).
ملاحظة: يمكن أن يؤدي التأخير في النقل إلى ربط غير مرغوب فيه لخلايا التغذية بجدار أنبوب الطرد المركزي سعة 50 مل. إذا تطلب النقل أكثر من بضع دقائق ، فتأكد من بقاء خلايا التغذية معلقة أثناء النقل عن طريق تحريك الأنبوب باستمرار. - إجراء السكتة الانقسامية باستخدام ميتوميسين C عن طريق نقل جميع الخلايا المغذية اللازمة في 5 مل من وسط الخلية المغذية إلى أنبوب طرد مركزي 50 مل ، ثم إضافة 15 مل من وسط الخلية المغذية التي تحتوي على 20 ميكروغرام / مل ميتوميسين C ، واحتضانها في حاضنة CO2 37 درجة مئوية / 5٪ لمدة 3 ساعات. أضف 20 مل من 37 درجة مئوية PBS ، وقم بتجميع الخلايا عن طريق الطرد المركزي عند 200 × جم لمدة 5 دقائق ، وكرر غسل PBS مرتين إضافيتين ، وأعد التعليق في وسط خلية التغذية.
- قم بإجراء الاعتقال الانقسامي عن طريق تشعيع جاما عن طريق نقل جميع الخلايا المغذية اللازمة إلى أنبوب طرد مركزي سعة 50 مل وتزويدها بوسط خلية مغذية إلى حجم إجمالي قدره 5 مل. انقل على الفور في درجة حرارة الغرفة إلى آلة تشعيع جاما ، وقم بتشعيعه لإيقاف الخلايا المغذية انقساميا (300 كيلو فولت و 10 مللي أمبير لمدة 20 دقيقة).
- بعد أن يتم القبض على الخلايا المغذية انقساميا ، عد إلى غطاء زراعة الأنسجة ، وقم بإخراج الخلايا المغذية عند 3.0 × 105 خلايا لكل طبق زراعة أنسجة 35 مم ، على النحو التالي. تأكد من إعادة شفط الخلايا المغذية بالكامل ، وأضف وسط خلية التغذية للوصول إلى تركيز خلية مغذية يبلغ 1.5 × 105 لكل مل ، وأضف 2 مل من معلق خلية التغذية هذا إلى كل طبق زراعة أنسجة 35 مم.
- انقل أطباق الاستزراع إلى حاضنة 37 درجة مئوية / 5٪ CO2 . لضمان التوزيع المتساوي للخلايا المغذية ، حرك أطباق الاستزراع ببطء ولكن بثبات على رف الحاضنة للأمام والخلف 3x ، متبوعا بإيقاف مؤقت ، ثم قم بتنفيذ نفس الإجراء من اليسار إلى اليمين 3x. لا تحرك الأطباق مرة أخرى ، وأغلق باب الحاضنة برفق.
- بعد 24 ساعة ، قم بالتبديل من وسط خلية التغذية إلى IMDM مع استبدال المصل بنسبة 10٪ (SR). استبدل هذه الوسيلة بعد ذلك كل يوم ثالث. خلايا التغذية جاهزة للاستخدام بعد أول 3 أيام.
2. الحصاد الميكانيكي لمستعمرات hESC أو hiPSC
- وسط hESC المسخن يتكون من 80٪ من وسط النسر المعدل من Dulbecco (DMEM) ، 20٪ ريال سعودي ، 1 مللي متر بديل الجلوتامين 100x ، 1 mM من الأحماض الأمينية غير الأساسية (NEAA) ، 1 mM البنسلين / الستربتومايسين (P / S) ، 0.1 mM 2-mercaptoethanol ، و 10 نانوغرام / مل عامل نمو الخلايا الليفية الأساسية (bFGF). يستخدم وسط hESC لثقافة إما hESCs أو hiPSCs على الخلايا المغذية.
- خذ أطباق زراعة الأنسجة الطازجة مقاس 35 مم التي تحتوي على خلايا مغذية موقوفة انقساميا ، واستبدل وسط الخلية المغذية ب 1.2 مل من وسط hESC الذي يحتوي على bFGF قبل 30 دقيقة على الأقل من نقل مستعمرات hESC / hiPSC.
- ضع طبقا مستزرعا يحتوي على مستعمرات hESC / hiPSC على خلايا مغذية تم إيقافها ميتوتيا تحت المجهر مع تكبير 10x يوضع داخل غطاء التدفق الصفحي. استخدم مشرطا معقما للقطع بعناية حول محيط كل مستعمرة ثم قطع كل مستعمرة إلى 5-6 قطع متساوية تقريبا. ارفع قطع المستعمرة بعناية بطرف شفرة المشرط بحيث تنفصل عن طبقة الخلية المغذية وتطفو بحرية في الوسط.
- حاول تجنب مناطق المستعمرات التي تحتوي على خلايا متمايزة ، والتي تظهر كجزر من الخلايا الأصغر ذات النوى الأقل تميزا مقارنة ب hESCs / hiPSCs داخل مستعمرة.
- انقل المستعمرات العائمة بحرية باستخدام ماصة سعة 1 مل إلى أطباق الاستزراع الجديدة التي تحتوي على الخلايا المغذية. حاول إبقاء المستعمرات منفصلة حتى لا تنمو في بعضها البعض لاحقا. انقل أطباق الاستزراع بعناية إلى حاضنة الخلايا ، وتجنب إزعاج الأطباق حتى اليوم التالي.
- في اليوم التالي ، أضف بعناية 600 ميكرولتر من وسط hESC الذي يحتوي على bFGF إلى الحجم النهائي 1.8 مل. استبدل وسيط hESC + bFGF كل يوم بعد ذلك حتى المقطع التالي (بشكل عام بعد أسبوع 1).
3. حصاد مستعمرات hESC أو hiPSC باستخدام عدم الالتصاق بوساطة EDTA
- خذ أطباق استزراع طازجة مع خلايا مغذية تم إيقافها ميتوتو ، وقم بالتبديل من IMDM w / 10٪ SR إلى 1.2 مل من وسط hESC + bFGF المسخن مسبقا قبل 30 دقيقة على الأقل من نقل المستعمرات.
- تعامل مع طبق استزراع واحد يحتوي على مستعمرات hESC أو hiPSC في كل مرة. قم بإزالة وسط hESC + bFGF ، واغسل المستعمرات ب 1 مل من DPBS بدرجة حرارة الغرفة للتخلص من أي خلايا غير متصلة محتملة وحطام الخلايا. أضف 1 مل من 0.5 مليمتر EDTA ، واحتضانها لمدة دقيقة واحدة عند 37 درجة مئوية. إذا كان غطاء التدفق الصفحي يحتوي على لوحة تدفئة ، فقم بتنفيذ هذه الخطوة والخطوات الواردة في القسم 4 على لوحة التسخين لتحسين عدم الالتصاق.
- بعد الحضانة لمدة دقيقة واحدة ، قم بإزالة محلول EDTA ، وأضف بعناية 1 مل من وسط hESC + bFGF باستخدام ماصة 1 مل. سحن بلطف مع نفس ماصة لتحرير المستعمرات من طبقة خلية التغذية. استمر في الطحن بعناية حتى ترتخي طبقة الخلية المغذية وتطوى على نفسها في كتلة منفصلة. اسحب طبقة خلية التغذية بعيدا باستخدام طرف الماصة.
- انقل مستعمرات hESC / hiPSC المعلقة باستخدام ماصة جديدة سعة 1 مل إلى أطباق استزراع جديدة تحتوي على الخلايا المغذية ووسط hESC + bFGF ، مع الانقسام بنسبة 1: 5. تميل المستعمرات إلى التوزيع بالتساوي داخل كل طبق استزراع جديد ، ولكن تسهل ذلك عن طريق تحريك الطبق برفق من جانب إلى آخر. استبدل وسيط hESC + bFGF كل يوم بعد ذلك حتى المقطع التالي (بشكل عام بعد أسبوع 1).
النتائج
في المقايسات والمقارنات الموثقة أدناه ، استخدمنا خطين hESC (H9 و HS429 ، من WiCell ومعهد Karolinska ، على التوالي) وخطين hiPSC (NCS001 و NCS002 ، وكلاهما تم إنشاؤه بواسطة المرفق الأساسي النرويجي للخلايا الجذعية البشرية متعددة القدرات). البيانات الواردة في الأشكال والجداول مأخوذة من خطوط hESC ، ولكن تم الحصول على نتائج مماثلة تماما من خطوط hiPSC.
في أيدينا ، أدى الحصاد الميكانيكي إلى تقسيم المستعمرات إلى ما يقرب من خمس إلى ست كتل قطرها ~ 200-250 ميكرومتر ، بينما مع عدم الالتصاق الناجم عن EDTA متبوعا بالتثليج ، تم تقسيم كل مستعمرة إلى ~ 10-20 كتل قطرها ~ 60 ميكرومتر. نقدر أن عدد الخلايا في كل كتلة تم حصادها بواسطة EDTA هو ~ 20. نظرا لأنه من غير العملي تقسيم مستعمرة إلى كتل بهذا الحجم باستخدام مشرط ، في هذا الصدد ، يكون عدم الالتصاق الناجم عن EDTA متفوقا ، لأنه يولد كتلا بحجم أكثر ملاءمة لبقاء خلايا المستعمرة10,11.
كانت مستعمرات hESC / hiPSC التي تم حصادها باستخدام EDTA أكثر تجانسا في الحجم والشكل مقارنة بالمستعمرات التي تم حصادها ميكانيكيا (الشكل 1A-F). وذلك لأن القطع المطلوب للحصاد الميكانيكي يولد حواف غير متساوية وأحجام تكتل متفاوتة. لتقييم هذا كميا ، قمنا بتقييم دائرية المستعمرة (كمقياس لمدى تقريب حواف المستعمرة ؛ تشير القيمة 1 إلى دائرة مثالية) بعد 5 أيام من المرور باستخدام بروتوكول ImageJ-win6412. كانت دائرية المستعمرة أقل بكثير في المستعمرات التي تم حصادها ميكانيكيا (الحصاد الميكانيكي: 0.61 ± 0.10 ؛ الحصاد القائم على EDTA: 0.84 ± 0.01 ؛ ن = 10 ، ع < 0.001 ، مان ويتني U-test ، U = 10).
كانت كثافة الخلايا في المستعمرات المحصودة والمعاد طلاؤها ، وهو مقياس لتفاعلات الخلايا الخلوية بعد الحصاد أثناء تكوين المستعمرة ، مماثلة للحصاد القائم على EDTA والحصاد الميكانيكي (الجدول 1 والشكل 1G ، H). كان لدى المستعمرات التي تم حصادها ميكانيكيا ميل أكبر لتطوير النخر في مناطقها الوسطى (الشكل 1J). كان هذا على الأرجح بسبب التباين في الشكل ، وخاصة حجم كتل الخلايا المعزولة ميكانيكيا ، كما هو الحال عندما تكون هذه الكتل كبيرة جدا ، يمكن أن تطوى بسهولة على نفسها عند نقلها إلى أطباق استزراع جديدة. لم يكن هذا هو الحال مع المستعمرات التي تم حصادها باستخدام EDTA ، والتي أظهرت بشكل موحد مظهرا شفافا بحواف مميزة (الشكل 1I).
باستخدام الحصاد القائم على EDTA ، تمكنا من جمع جميع المستعمرات التي تم إنشاؤها في بئر في غضون 2-3 دقائق. باستخدام الحصاد الميكانيكي ، سيكون جمع كل المستعمرات في البئر مملا ويستغرق وقتا طويلا. تمكنا عادة من جمع ~ 30٪ فقط ، أو ~ 20-25 مستعمرة ، باستخدام الحصاد الميكانيكي ، واستغرق ذلك ~ 20 دقيقة. وبالمثل ، باستخدام هضم الكولاجيناز متبوعا بالكشط اللطيف ، كان من الصعب عادة حصاد جميع المستعمرات ، على الرغم من أن الإجراء الإجمالي استغرق بضع دقائق فقط. وبالتالي ، فإن الحصاد القائم على EDTA سريع أو أسرع من الحصاد الأنزيمي وأكثر كفاءة من الحصاد الميكانيكي أو الأنزيمي.
لتقييم تأثير طرق الحصاد المختلفة على الجذع وتعدد القدرات ، قمنا أولا بإخضاع المستعمرات التي تم الحصول عليها بعد 20 ممرا باستخدام الحصاد القائم على EDTA أو الحصاد الميكانيكي لتحليل qPCR (الشكل 2) والتلوين الكيميائي المناعي (الشكل 3 والشكل 4) لعلامات الجذعية. أظهرت المستعمرات التي تم الحصول عليها باستخدام أي من الطريقتين تعبيرا مستقرا عن علامات الجذعية على مستوى mRNA والبروتين. ثم قمنا بتقييم تعدد القدرات عن طريق التمايز إلى الطبقات الجرثومية الثلاث في الأجسام الجنينية (الشكل 5 والشكل 6). احتوت الأجسام الجنينية المتولدة من hESCs أو hiPSCs التي تم الحصول عليها بعد 20 ممرا باستخدام أي من الطريقتين على خليط من الخلايا التي تعبر عن علامات تم تقييمها بشكل شائع للأديم الظاهر والأديم المتوسط والأديم الباطن.
أخيرا ، قمنا بتقييم حدوث الانحرافات الجينومية في hESCs و hiPSCs التي تم تمريرها بواسطة كل طريقة باستخدام التحليل الجيني القائم على qPCR (انظر جدول المواد). أظهرت المستعمرات التي تم الحصول عليها بعد 20 ممرا باستخدام أي من طريقتي الحصاد بعض الأمثلة على الانحراف المتواضع عن نمط كروموسومي مرجعي ثنائي الصيغة الصبغية (كانت التشوهات التي تم تقييمها هي تلك المرتبطة عادة بإعادة برمجة hiPSCs ولكن يمكن الحصول عليها أيضا في hESCs) (الشكل 7). ومع ذلك ، كان نمط هذه الانحرافات هو نفسه بشكل أساسي في المستعمرات التي تم الحصول عليها بعد أي من طريقتي الحصاد ، مما يشير إلى أنها لم تكن مرتبطة بطريقة الحصاد.
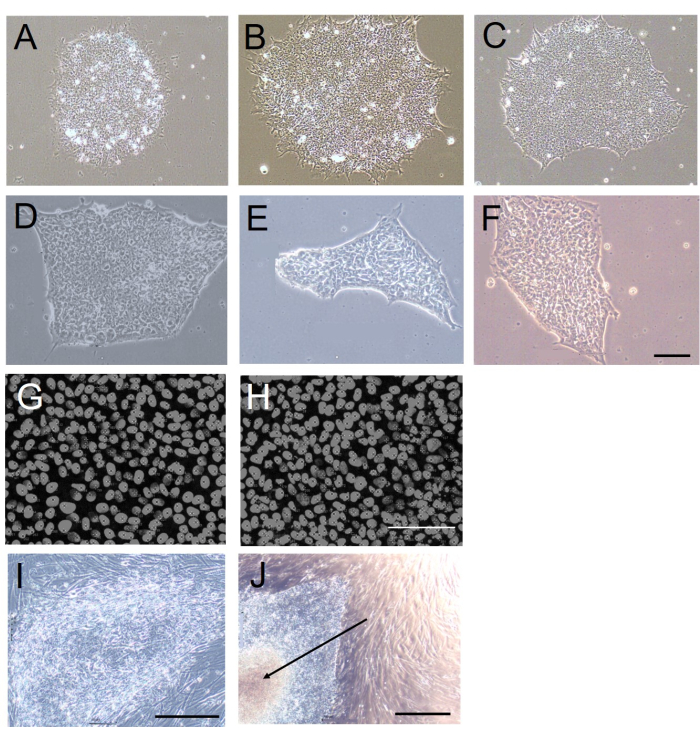
الشكل 1: مورفولوجيا المستعمرة وكثافة الخلايا بعد الحصاد الميكانيكي أو القائم على EDTA. (A-F) صور برايت فيلد تمثيلية لمستعمرات H9 hESC التي تم إنشاؤها في ثقافة خالية من التغذية لمدة 5 أيام بعد 20 ممرا باستخدام الحصاد الميكانيكي القائم على (A-C) أو (D-F). (ز ، ح) صور مضان تمثيلية لكثافة الخلية في مستعمرات H9 hESC التي تم إنشاؤها بعد 20 ممرا باستخدام (G) القائم على EDTA أو (H) الحصاد الميكانيكي. نواة الخلية ملطخة ب DAPI. (ط، ي) صور برايت فيلد تمثيلية لمستعمرات H9 hESC التي تم إنشاؤها بعد 20 ممرا باستخدام (I) الحصاد الميكانيكي القائم على EDTA أو (J). لاحظ المنطقة الوسطى الميتة في المستعمرة التي يتم حصادها ميكانيكيا (السهم في J). تم الحصول على جميع الصور بعد 5 أيام من مرور 20. قضبان المقياس = 100 ميكرومتر. الاختصارات: hESC = الخلايا الجذعية الجنينية البشرية. EDTA = حمض الإيثيلين ديامينيترايتيك ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
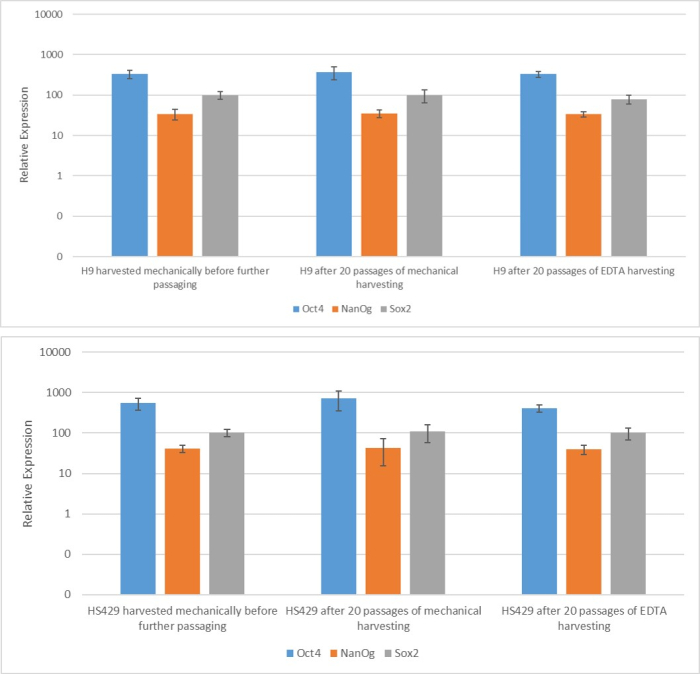
الشكل 2: التعبير عن علامة الجذعية mRNA في خطين hESC (H9 و HS429) المتولدة بعد الحصاد القائم على EDTA أو الميكانيكي. تفاعل البلمرة الكمي المتسلسل في الوقت الحقيقي للعلامات المشار إليها في H9 (اللوحة العلوية) و HS429 (اللوحة السفلية) hESCs بعد مرور واحد باستخدام الحصاد الميكانيكي ، وبعد 20 ممرا باستخدام الحصاد الميكانيكي ، وبعد 20 ممرا باستخدام الحصاد القائم على EDTA (تخفيف 1: 5). مستوى التعبير متعلق بمستوى جين التدبير المنزلي ACTB (بيتا أكتين). تشير أشرطة الخطأ إلى الانحراف المعياري. الاختصارات: hESC = الخلايا الجذعية الجنينية البشرية. EDTA = حمض الإيثيلين ديامينيترايتيك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
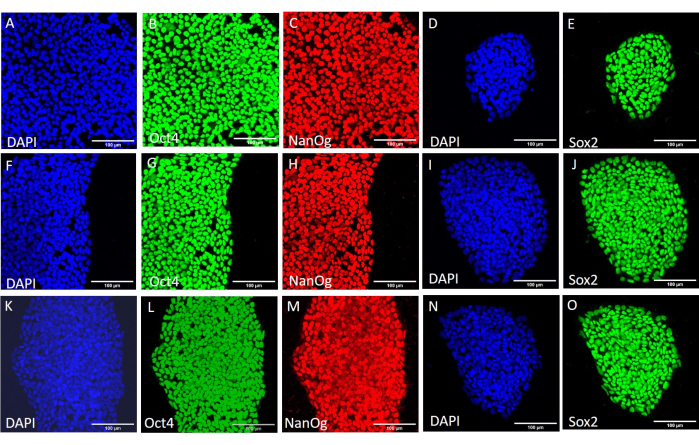
الشكل 3: التعبير عن بروتينات علامة الجذعية في خط H9 hESC بعد ظروف الحصاد المختلفة. تلطيخ المناعة التمثيلي لمستعمرات H9 hESC التي تم حصادها ميكانيكيا (A-E) قبل المرور الإضافي ، (F-J) بعد 20 ممرا باستخدام الحصاد الميكانيكي ، و (K-O) بعد 20 ممرا باستخدام الحصاد القائم على EDTA. قضبان المقياس = 100 ميكرومتر. الاختصارات: hESC = الخلايا الجذعية الجنينية البشرية. EDTA = حمض الإيثيلين ديامينيترايتيك ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
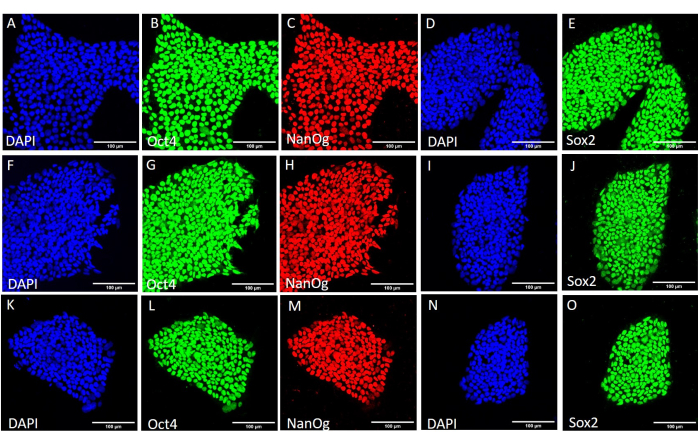
الشكل 4: التعبير عن بروتينات علامة الساق في خط HS429 hESC بعد ظروف الحصاد المختلفة. تلطيخ المناعة التمثيلي لمستعمرات HS429 hESC التي تم حصادها ميكانيكيا (A-E) قبل المرور الإضافي ، (F-J) بعد 20 ممرا باستخدام الحصاد الميكانيكي ، و (K-O) بعد 20 ممرا باستخدام الحصاد القائم على EDTA. قضبان المقياس = 100 ميكرومتر. الاختصارات: hESC = الخلايا الجذعية الجنينية البشرية. EDTA = حمض الإيثيلين ديامينيترايتيك ؛ DAPI = 4 '، 6-دياميدينو -2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
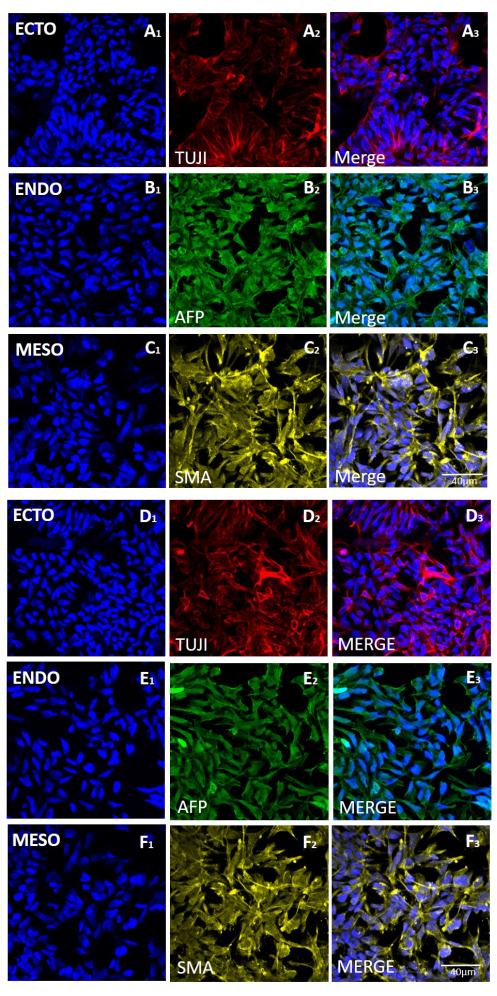
الشكل 5: التعبير عن علامات الطبقات الجرثومية الثلاث في الأجسام الجنينية المتولدة من خط H9 hESC بعد الحصاد الميكانيكي أو القائم على EDTA. تلطيخ التألق المناعي التمثيلي لعلامات (الصفوف A و D) الأديم الظاهر (ECTO ، TUJI) ، (الصفوف B و E) الأديم الباطن (ENDO ، AFP) ، و (الصفوف C و F) الأديم المتوسط (MESO ، SMA). تم إنشاء EBs (A-C) بعد 20 ممرا من الحصاد الميكانيكي أو (D-F) بعد 20 ممرا من الحصاد القائم على EDTA. قضبان المقياس = 40 ميكرومتر. الاختصارات: hESC = الخلايا الجذعية الجنينية البشرية. EDTA = حمض الإيثيلين ديامينيترايتيك ؛ EBs = الأجسام الجنينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
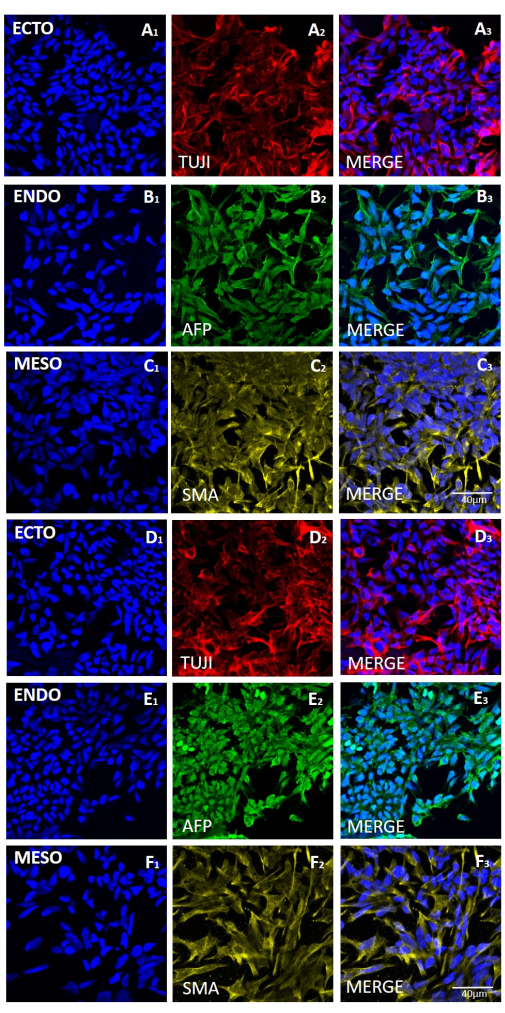
الشكل 6: التعبير عن علامات الطبقات الجرثومية الثلاث في الأجسام الجنينية المتولدة من خط HS429 hESC بعد الحصاد الميكانيكي أو القائم على EDTA. تلطيخ التألق المناعي التمثيلي لعلامات (الصفوف A و D) الأديم الظاهر (ECTO ، TUJI) ، (الصفوف B و E) الأديم الباطن (ENDO ، AFP) ، و (الصفوف C و F) الأديم المتوسط (MESO ، SMA). تم إنشاء EBs (A-C) بعد 20 ممرا من الحصاد الميكانيكي (A-C) أو (D-F) بعد 20 ممرا من الحصاد القائم على EDTA. قضبان المقياس = 40 ميكرومتر. الاختصارات: hESC = الخلايا الجذعية الجنينية البشرية. EDTA = حمض الإيثيلين ديامينيترايتيك ؛ EBs = الأجسام الجنينية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
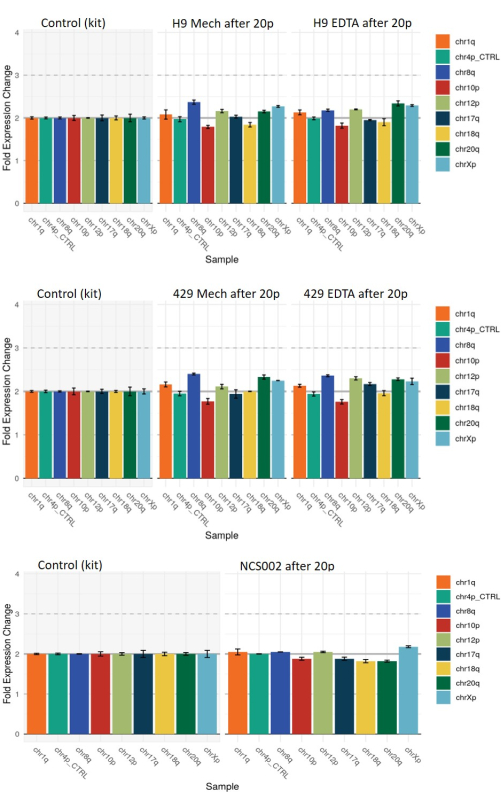
الشكل 7: التحليل الجيني القائم على qPCR للانحرافات الجينومية الشائعة في خطوط HS9 و HS429 ESC وخط NCS002 iPSC بعد 20 ممرا باستخدام الحصاد الميكانيكي أو القائم على EDTA. يمثل خط الأساس عند القيمة 2 ثنائية الصيغة الصبغية الطبيعية في جميع علامات الكروموسومات. تمثل القيمة 1 أو 3 خسارة أو ربحا ، على التوالي ، لعلامة الكروموسومات المشار إليها في جميع الخلايا. تشير القيم الوسيطة بين 1 و 2 أو بين 2 و 3 إلى وجود خسارة أو كسب للعلامة المشار إليها في جزء من الخلايا. لاحظ أن نمط الانحرافات متشابه في شرطي الحصاد. الاختصارات: ESC = الخلايا الجذعية الجنينية. EDTA = حمض الإيثيلين ديامينيترايتيك ؛ iPSC = الخلايا الجذعية المستحثة متعددة القدرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| كثافة الخلية (الخلايا / مم2) | ||
| إتش9 | دني | stdev |
| الحصاد الميكانيكي قبل مرور المزيد | 3918 | 263.3 |
| الحصاد الميكانيكي 20 مرة | 3868 | 197.7 |
| حصاد EDTA 20 مرة | 4080 | 127.8 |
| HS429 | دني | stdev |
| الحصاد الميكانيكي قبل مرور المزيد | 5249 | 565.4 |
| الحصاد الميكانيكي 20 مرة | 5247 | 726.3 |
| حصاد EDTA 20 مرة | 4963 | 448.8 |
الجدول 1: مقارنة كثافات الخلايا في المستعمرات من خطي hESC (H9 و HS429) المتولدة بعد الحصاد القائم على EDTA أو الميكانيكي. تم تقييم كثافة الخلايا إما بعد مرور واحد باستخدام الحصاد الميكانيكي ، أو بعد 20 ممرا باستخدام الحصاد الميكانيكي ، أو بعد 20 ممرا باستخدام الحصاد القائم على EDTA (عند تخفيف 1: 5). في جميع الحالات ، n = 5 مستعمرات.
Discussion
لقد وصفنا طريقة سريعة وفعالة من حيث التكلفة لحصاد hESCs و hiPSCs المزروعة على خلايا التغذية باستخدام عدم الالتصاق بوساطة EDTA وقارنا هذا في المقام الأول بالطريقة التقليدية للحصاد الميكانيكي باستخدام مشرط. قارنا أيضا الحصاد القائم على EDTA بالحصاد الأنزيمي فيما يتعلق بسرعة الطريقة ولكن ليس جوانب جودة المستعمرة الناتجة. والسبب في ذلك هو أن الحصاد الأنزيمي بطبيعته أكثر تغيرا وقد تم ربطه بارتفاع معدل انتشار الانحرافات الجينومية5 ، مما قد يحجب الاختلافات بين الطرق.
لقد أثبتنا أن الحصاد القائم على EDTA أسرع وأكثر كفاءة من أي من الطرق الأخرى ويولد مستعمرات أصغر وأكثر تجانسا من الناحية الشكلية من الحصاد الميكانيكي. هذه الميزة الأخيرة مفيدة فيما يتعلق ببقاء الخلايا ، حيث أن الكتل الأكبر التي تم الحصول عليها من خلال الحصاد الميكانيكي عرضة للنخر المركزي ، في حين أن الهضم الأنزيمي يميل إلى توليد hESCs و hiPSCs المعزولة ، والتي تكون أكثر عرضة لموت الخلايا المبرمج وتتطلب علاجا إضافيا ، على سبيل المثال مع مثبطات ROCK ، للبقاء على قيد الحياة. يمكن استخدام الحصاد القائم على EDTA لما لا يقل عن 20 ممرا طرق الحصاد الميكانيكية القائمة على EDTA قابلة للمقارنة عندما يتعلق الأمر بكثافة خلايا المستعمرة ، وتعبير mRNA والبروتين عن جينات الجذعية ، وتمايز الطبقات الجرثومية الثلاث في الأجسام الجنينية ، والتشوهات الجينومية. إذا كان الهدف هو الكفاءة ، وإنتاجية أعلى ، وتنوع أقل ، ومعالجة ألطف ل hESCs و hiPSCs ، فإن الحصاد القائم على EDTA هو الأفضل.
نلاحظ أيضا أن الحصاد القائم على EDTA ل hESCs و hiPSCs المستزرعة على الخلايا المغذية هو طريقة غير مكلفة للحفاظ على حالة أكثر سذاجة ويوفر انتقالا سلسا من الثقافة القائمة على التغذية إلى الثقافة الخالية من التغذية حيث يكون ذلك مرغوبا فيه.
الخطوات الحاسمة داخل البروتوكول
أهم خطوات عدم الالتصاق بوساطة EDTA هي قسم البروتوكول 3 (الحضانة في محلول EDTA) والقسم 4 (التثليج). إذا كان التعرض لمحلول EDTA أطول من 1 دقيقة ، يزداد خطر التفكك الكامل للخلايا المفردة. يمكن أن يحدث هذا أيضا إذا كان التثليج مطولا جدا أو قاسيا جدا. يتأثر الأخير بحجم طرف الماصة. يعد استخدام ماصات زراعة الخلايا سعة 1 مل كما هو موضح هنا أمرا مثاليا. يعد استخدام نوع مختلف من الماصة بقطر طرف أصغر أمرا محفوفا بالمخاطر.
استكشاف الاخطاء
إذا استمرت الخلايا المغذية في التكاثر ، فلن يكون الاعتقال الانقسامي فعالا ، ويجب أخذ دفعة جديدة وإعادة تشغيل الإجراء. إذا لم ترتخي المستعمرات من طبقة الخلايا المغذية ، فيجب على المرء التأكد من عدم وجود Ca2+ في EDTA وأن طبق الاستزراع الذي يحتوي على المستعمرات يتم شطفه جيدا باستخدام PBS لإزالة أي وسط زراعة خلية متبقي قبل إضافة EDTA. يمكن أن ينشأ الكثير من التفكك ، الذي يولد خلايا معزولة أو كتل خلوية صغيرة جدا ، بسبب التثليج المفرط ويعرض للخطر إنشاء مستعمرات جديدة. يجب تحديد درجة التثليج تجريبيا في التشغيل التجريبي للبروتوكول للتأكد من أن كتل الخلايا الناتجة يبلغ قطرها ~ 60 ميكرومتر. إذا انفصلت طبقة التغذية تلقائيا عن طبق الاستزراع ، خاصة قبل أن تكون hESCs / hiPSCs جاهزة للحصاد ، فقد يكون ذلك بسبب عدم استخدام خلايا التغذية في غضون ~ 7 أيام بعد تحضيرها. لذلك ، يجب مراقبة الإطار الزمني لاستخدام الخلايا المغذية بعناية. إذا انفصلت طبقة التغذية أثناء التعرض ل EDTA (وهو أمر لم نلاحظه مطلقا مع خلايا التغذية المستخدمة هنا) ، فيجب تغيير نوع خلية التغذية أو طريقة استزراعها.
حدود التقنية
القيد الرئيسي لهذه التقنية هو أنها تتطلب فحصا بصريا لعملية عدم الالتصاق لتحقيق نتيجة ناجحة. هذا يعني أنه يجب على المستخدمين تعلم كيفية تحديد متى تتحرر المستعمرات من طبقة الخلية المغذية وتفكك طبقة الخلية المغذية من الركيزة. ومع ذلك ، هذا ليس بالأمر الصعب ، وفي تجربتنا ، يمكن للمستخدمين الجدد لهذه التقنية إتقانها في غضون تجربتين.
هناك أيضا احتمال متأصل بأن تكون hESCs أو hiPSCs المحصودة ملوثة بعدد قليل من الخلايا المغذية. إذا كان القصد هو الانتقال إلى ظروف غير مغذية أو عزل hESCs أو hiPSCs للمقايسات ، فإن هذا التلوث من شأنه أن يضر بالنقاء. نلاحظ أنه مع الخلايا المغذية المستخدمة هنا (الخلايا الليفية القلفة البشرية) ، من الصعب للغاية فصل طبقة الخلايا المغذية ، حتى مع الهضم الأنزيمي (غير معروض). نظرا لإزالة طبقة الخلايا المغذية غير المنفصلة بالكامل ، فمن المحتمل أن يكون تلوث hESCs أو hiPSCs المحصود ضئيلا. علاوة على ذلك ، نظرا لأن الخلايا المغذية يتم إيقافها انقساميا ، فإن أي تلوث سيتضاءل في النهاية إلى الصفر مع مرور المزيد من hESCs أو hiPSCs.
الأهمية فيما يتعلق بالأساليب الحالية
المعيار الحالي لزراعة hESCs و hiPSCs هو القيام بذلك في ظل ظروف خالية من التغذية ، حيث ينتشر استخدام EDTA للمرور. تعتمد الثقافة الخالية من التغذية على استخدام الوسائط المصممة خصيصا وركائز الثقافة التي تضمن الالتزام. تستلزم هذه الكواشف نفقات إضافية قد تتجاوز بعض ميزانيات المختبرات. بالإضافة إلى ذلك ، ارتبطت الثقافة في ظل ظروف خالية من التغذية بإمكانية تمايز مضطربة بسبب عدم وجود عوامل محددة في وسائط الثقافة الخالية من التغذية وما ينتج عن ذلك من انتقال من الحالة الساذجة إلى الحالة المهيأة. إن النمو على الخلايا المغذية الموقوفة انقساميا يتجنب هذا الانتقال ويمكن أن يخفض التكاليف الإجمالية إلى مستوى يمكن التحكم فيه ، وبالتالي يسهل الاستخدام الأوسع للخلايا الجذعية متعددة القدرات في الأبحاث المختبرية.
Disclosures
جويل سي جلوفر هو المدير وهيج برينكر فيجردينجستاد هو المدير اليومي للمرفق النرويجي الأساسي للخلايا الجذعية البشرية متعددة القدرات. ليس لدى المؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر للكشف عنه.
Acknowledgements
نشكر لارس موين على المساعدة خلال التجارب الأولية والمرفق النرويجي الأساسي للخلايا الجذعية البشرية متعددة القدرات في المركز النرويجي لأبحاث الخلايا الجذعية ، مستشفى جامعة أوسلو ، على استخدام المرافق. تم الحصول على خط H9 hESC من WiCell ، وتم الحصول على خط HS429 hESC من Outi Hovatta في معهد كارولينسكا. وقد استخدم كلاهما وفقا لاتفاقات نقل المواد. تم إنشاء خطوط NCS001 و NCS002 hiPSC بواسطة المرفق الأساسي النرويجي للخلايا الجذعية البشرية متعددة القدرات. تم تنفيذ إعادة البرمجة وجميع الأعمال المبلغ عنها هنا بموافقة لجنة الأخلاقيات الإقليمية لجنوب شرق النرويج (الموافقة REK 2017/110).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA pH 8.0 | Invitrogen | 15575020 | |
| 15 mL centrifuge tubes | Sarstedt | 62.554.502 | |
| 2-mercaptoethanol | Gibco | 31350-010 | |
| 50 mL centrifuge tubes | Sarstedt | 62.547.254 | |
| Basic fibroblast growth factor (bFGF) | PeproTech | AF-100-18B-250UG | |
| Brand Bürker Chamber | Fisher Scientific | 10628431 | |
| Disposable scalpels no.15 | Susann-Morton | 505 | |
| DPBS (1x) without Ca/Mg | Gibco | 14190-094 | |
| Easy Grip tissue culture dish, 35 x 10 mm | Falcon | 353001 | |
| Eppendorf pipette 1 mL | Eppendorf | ||
| Eppendorf pipette 200 μL | Eppendorf | ||
| FBS (Fetal Bovine Serum) | Gibco | 10270-106 | |
| Filter tip 1,000 μL | Sarstedt | 70.1186.210 | |
| Filter tip 200 μL | Sarstedt | 70.760.211 | |
| Gamma Cell 3000 ELAN irradiation machine (alternatively, use Mitomycin C to arrest proliferation) | Best Theratronics | BT/MTS 8007 GC3000E | |
| Glutamax 100x | Gibco | 35050-038 | |
| Growth Factor Reduced Matrixgel | Corning | 734-0269 | |
| H9 hESC line | WiCell | WAe009-A | |
| hPSC Genetic Analysis Kit | Stem Cell Technologies | #07550 | |
| HS429 hESC line | ECACC | KIe024-A | |
| Human Foreskin Fibroblasts -CRL2429 line | ATTC | CRL2429 | |
| IMDM (1x) | Gibco | 21980-032 | |
| iPSC lines | Norwegian Core Facility for Human Pluripotent Stem Cells | NCS001 & NCS002 | |
| Knockout DMEM | Gibco | 10829-018 | |
| Laser Scanning Confocal Microscope or equivalent (we use the LSM 700 from Zeiss) | Zeiss | ||
| Microscope | CETI | ||
| Mitomycin C | Sigma Aldrich | M4287 | |
| Non-essential amino acids (NEAA) | Gibco | 11140.035 | |
| Pipettes, plastic 10 mL | Sarstedt | 86.1254.001 | |
| Pipettes, plastic, 5 mL | Sarstedt | 86.1253.001 | |
| Serum Replacement (SR) | Gibco | 10828-028 | |
| Sterile filters 0.22 um | Sarstedt | 83.1826.102 | |
| T-75 culture flask | ThermoScientific | 156499 | |
| Trypan Blue Stain (0.4 %) | Gibco | 15250-061 | |
| Trypsin-EDTA, 500 mL | Gibco | 25300062 |
References
- Skottman, H., Hovet, O. Culture conditions for human embryonic stem cells. Reproduction. 132 (5), 691-698 (2006).
- Hovatta, O., et al. A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Human Reproduction. 18 (7), 1404-1409 (2003).
- Desai, N., Rambhia, P., Gishto, A. Human embryonic stem cell cultivation: historical perspective and evolution of xeno-free culture systems. Reproductive Biology and Endocrinology. 13, 9 (2015).
- Villa-Diaz, L. G., et al. Synthetic polymer coatings for long-term growth of human embryonic stem cells. Nature Biotechnology. 28 (6), 581-583 (2010).
- Watanabe, M., et al. TGFb superfamily signaling regulates the state of human stem cell pluripotency and capacity to create well-structured telencephalic organoids. Stem Cell Reports. 17 (10), 2220-2238 (2022).
- Garitaonandia, I., et al. Increased risk of genetic and epigenetic instability in human embryonic stem cells associated with specific culture conditions. PLoS One. 10 (2), e0118307 (2015).
- Inzunza, J., et al. Derivation of human embryonic stem cell lines in serum replacement medium using postnatal human fibroblasts as feeder cells. Stem Cells. 23, 544-549 (2005).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Rivera, T., Zhao, Y., Ni, Y., Wang, J. Human-induced pluripotent stem cell culture methods under cGMP conditions. Current Protocols in Stem Cell Biology. 54 (1), 117 (2020).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Molecular Therapy. Methods & Clinical Development. 23, 569-581 (2021).
- Meng, G., Rancourt, D. E. Derivation and maintenance of undifferentiated human embryonic stem cells. Methods in Molecular Biology. 873, 69-90 (2012).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved