A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس الكمي التجريبي للتفاعلات بين أنظمة توصيل الدواء والخلايا في المختبر: دليل لتقييم الطب النانوي قبل السريري
In This Article
Summary
يتم توضيح سير العمل للقياس الكمي المطلق للتفاعلات بين الخلايا الناقلة للأدوية باستخدام قياس التدفق الخلوي للسماح بتقييم عقلاني أفضل لأنظمة توصيل الأدوية الجديدة. ينطبق سير العمل هذا على ناقلات المخدرات من أي نوع.
Abstract
يتعلق أحد المكونات الرئيسية لتصميم أنظمة توصيل الأدوية بكيفية تضخيم أو تخفيف التفاعلات مع أنواع معينة من الخلايا. على سبيل المثال ، قد يعمل العلاج الكيميائي بجسم مضاد لتعزيز الارتباط بالخلايا السرطانية ("الاستهداف") أو يعمل باستخدام البولي إيثيلين جلايكول للمساعدة في التهرب من التعرف على الخلايا المناعية ("التخفي"). حتى على المستوى الخلوي ، يعد تحسين ربط وامتصاص حامل الدواء مشكلة تصميم بيولوجية معقدة. ومن ثم، من المفيد فصل مدى قوة تفاعل الناقل الجديد مع الخلية عن الفعالية الوظيفية لبضاعة الناقل بمجرد تسليمها إلى تلك الخلية.
لمواصلة مثال العلاج الكيميائي ، فإن "مدى ارتباطها بخلية سرطانية" هي مشكلة منفصلة عن "مدى نجاحها في قتل خلية سرطانية". المقايسات الكمية في المختبر لهذا الأخير راسخة وعادة ما تعتمد على قياس الجدوى. ومع ذلك ، فإن معظم الأبحاث المنشورة حول تفاعلات الناقل الخلوي هي نوعية أو شبه كمية. بشكل عام ، تعتمد هذه القياسات على وضع العلامات الفلورية للناقل ، وبالتالي الإبلاغ عن التفاعلات مع الخلايا في الوحدات النسبية أو التعسفية. ومع ذلك ، يمكن توحيد هذا العمل وجعله كميا تماما مع عدد صغير من تجارب التوصيف. مثل هذا القياس الكمي المطلق ذو قيمة ، لأنه يسهل المقارنات العقلانية بين الطبقات وداخلها لأنظمة توصيل الأدوية المختلفة - الجسيمات النانوية ، والجسيمات الدقيقة ، والفيروسات ، واتحادات الأجسام المضادة والأدوية ، والخلايا العلاجية المهندسة ، أو الحويصلات خارج الخلية.
علاوة على ذلك ، يعد القياس الكمي شرطا أساسيا للتحليلات التلوية اللاحقة أو في مناهج نمذجة السيليكو . في هذه المقالة ، يتم تقديم أدلة الفيديو ، بالإضافة إلى شجرة قرار حول كيفية تحقيق القياس الكمي في المختبر لأنظمة توصيل الأدوية الحاملة ، والتي تأخذ في الاعتبار الاختلافات في حجم الناقل وطريقة وضع العلامات. بالإضافة إلى ذلك ، تتم مناقشة المزيد من الاعتبارات للتقييم الكمي لأنظمة توصيل الأدوية المتقدمة. يهدف هذا إلى أن يكون بمثابة مورد قيم لتحسين التقييم العقلاني والتصميم للجيل القادم من الطب.
Introduction
اجتذب تصميم تركيبات توصيل الأدوية التي تظهر سلوكا محددا ومصمما اعتمادا على نوع الخلية التي تواجهها اهتماما بحثيا كبيرا. تشمل تركيبات توصيل الأدوية المحتملة أو "الناقلات" تركيبات الدهون ، أو المواد غير العضوية المزروعة بالنانو ، أو التجمعات البوليمرية ، أو الحويصلات خارج الخلية ، أو الخلايا البكتيرية الوظيفية ، أو الفيروسات المعدلة. كل هذه يمكن أن تظهر خصوصية العضو أو الأنسجة أو الخلية بسبب الخصائص الفيزيائية أو خصائص السطح أو الوظائف الكيميائية الهندسية مثل ارتباط الجسم المضاد 1,2.
تتمثل الخطوة المنتشرة في كل مكان تقريبا في تقييم الناقل في المختبر في احتضان الخلايا بتعليق يحتوي على الناقل المحمل بالمخدرات المذكور. بعد الحضانة ، يتم قياس أداء الناقل من خلال قراءة وظيفية لأداء شحنة الدواء ، على سبيل المثال ، كفاءة النقل أو السمية. القراءات الوظيفية مفيدة ، لأنها مقياس نهائي لفعالية الناقل. ومع ذلك ، بالنسبة لبنيات توصيل الأدوية الأكثر تعقيدا ، من المهم بشكل متزايد تجاوز القراءات الوظيفية وتحديد درجة تفاعل الناقل مع الخلية محل الاهتمام بشكل منفصل. هناك عدة أسباب لذلك.
أولا، هناك اهتمام متزايد باكتشاف (وتحسينها بشكل متكرر) تكنولوجيات الناقل "المنصات"، التي يمكن أن تحمل مجموعة متنوعة من البضائع. على سبيل المثال ، يمكن للجسيمات النانوية الدهنية (LNPs) المصممة لتغليف الحمض النووي الريبي تبادل تسلسل RNA بآخر مع بعض المحاذير3. ومن ثم، ومن أجل تحسين تكنولوجيا الناقل بصورة متكررة، من الأهمية بمكان قياس أدائها بشكل مستقل عن وظيفة الشحنة. ثانيا، قد لا تكون القراءات الوظيفية مباشرة بالنسبة للبضاعة محل الاهتمام، مما يقوض القدرة على تكرار تركيبات الناقل وتقييمها بسرعة. في حين يمكن للمرء أن يؤدي في المختبر الأمثل باستخدام شحنة نموذجية مع قراءة وظيفية مباشرة (على سبيل المثال ، مضان) ، فإن تغيير الشحنة يمكن أن يغير الاستجابة البيولوجية للناقل4 وبالتالي قد لا يسفر عن نتائج تمثيلية. ثالثا ، تم تصميم العديد من الناقلات للتفاعل مع نوع معين من الخلايا واستيعابها. ويمكن، بل وينبغي، التمييز بين قدرة الناقل على الاستهداف هذه وأداء شحنته العلاجية بعد الاستهداف. لمواصلة مثال LNP ، قد تكون شحنة الحمض النووي الريبي قوية للغاية ، ولكن إذا كان LNP غير قادر على الارتباط بالخلية ، واستيعابه ، وإطلاق الحمض النووي الريبي ، فلن يلاحظ أي تأثير وظيفي في المصب. يمكن أن يكون هذا مشكلة خاصة بالنسبة للناقلات التي تهدف إلى استهداف أنواع الخلايا التي يصعب نقلها ، مثل الخلايا التائية5. على العكس من ذلك ، يمكن أن يستهدف LNP بشكل فعال للغاية ، لكن شحنة الحمض النووي الريبي قد لا تعمل. لن يتمكن الفحص النهائي الذي يقيس فقط وظائف الشحن من التمييز بين هاتين الحالتين ، مما يعقد تطوير وتحسين أنظمة توصيل الأدوية الناقلة.
في هذا العمل ، تتم مناقشة كيفية تحديد ارتباط الناقل بشكل مطلق. الارتباط هو مصطلح يشير إلى درجة التفاعل المقاسة تجريبيا بين الناقل والخلية. لا يفرق الارتباط بين ربط الغشاء والاستيعاب - قد يرتبط الناقل لأنه مرتبط بسطح الخلية أو لأن الخلية قد استوعبته. يقاس الارتباط عادة كجزء من تجارب حضانة حامل الخلية. تاريخيا ، تم الإبلاغ عن الارتباط إما في وحدات الفلورسنت التعسفية (عادة "متوسط شدة التألق" أو MFI) أو ك "ارتباط النسبة المئوية" ، وهي مقاييس تمت مناقشة حدودها سابقا6. باختصار ، هذه القياسات غير قابلة للمقارنة بين التجارب والمختبرات وناقلات الأدوية بسبب الاختلافات في البروتوكولات التجريبية ، وإعدادات مقياس التدفق الخلوي ، وشدة وضع العلامات على ناقلات مختلفة. وقد بذلت جهود للتغلب على الأول عن طريق معايرة مقياس الخلوي ، وبالتالي تحويل المقياس النسبي ل MFI إلى مقياس كمي تماما للتألق7. ومع ذلك ، فإن هذه الطريقة لا تأخذ في الاعتبار التباين في كثافة وضع العلامات لمختلف شركات النقل ، وبالتالي ، لا تسمح بالمقارنة المنطقية لأداء الناقل المختلفة في خلية مستهدفة من الاختيار8.
هنا ، يتم توضيح كيفية التحويل عمليا من وحدات الفلورسنت النسبية التعسفية إلى المقياس الكمي المطلق ل "عدد الناقلات لكل خلية" من خلال إجراء عدد صغير من تجارب التوصيف الإضافية. إذا كان هناك مقياس آخر لتركيز الموجة الحاملة (على سبيل المثال ، كتلة الموجة الحاملة لكل خلية أو حجم الموجة الحاملة لكل خلية) ، فمن السهل التحويل من الناقلات لكل خلية ، بشرط أن يتم توصيف الناقل. للإيجاز وتجنب المصطلحات ، يتم استخدام كلمة "الناقل" في هذا العمل للإشارة إلى مجموعة واسعة من هياكل توصيل الأدوية. تقنيات القياس الكمي هذه قابلة للتطبيق بنفس القدر ، سواء تم تطبيقها على جسيمات الذهب المهندسة بالنانو أو البكتيريا المهندسة بيولوجيا.
بعض الحقائق تمكن من التحويل من وحدات الفلورسنت التعسفية إلى ناقلات لكل خلية. أولا ، تتناسب شدة التألق المقاسة مع تركيز الفلوروفور9 (أو الناقل المسمى بالفلورسنت) ، بافتراض أن التألق يقع ضمن حدود الكشف للأداة وأن إعدادات الأجهزة هي نفسها. وبالتالي ، إذا كان مضان الناقل ومضان العينة معروفين ، فيمكن للمرء تحديد عدد الناقلات الموجودة في تلك العينة إذا تم إجراء جميع القياسات في نفس الإعدادات والظروف. ومع ذلك ، خاصة بالنسبة للناقلات الأصغر ، قد لا يكون من الممكن قياس مضان الناقل ، والتألق الذاتي للخلية ، ومضان الخلية المرتبط بالناقلات على نفس الجهاز بنفس الإعدادات. في هذه الحالة ، هناك مطلب ثان لجعل من الممكن التحويل بين التألق المقاس على أداة واحدة والتألق المقاس على جهاز آخر. للقيام بذلك ، يمكن إنشاء منحنى قياسي لتركيز الفلوروفور لقياس شدة التألق على كلا الجهازين ، مع الاستفادة من جزيئات الفلوروكروم القابل للذوبان المكافئ (MESF) المعيار9. يسمح هذا بعد ذلك بقياس مضان الناقل بكميات كبيرة على مقياس غير خلوي ، وهو قياس يمكن إجراؤه على ناقلات من أي حجم أو خاصية. عندما يتم إجراء هذا التقدير الكمي السائب على تعليق ناقل بتركيز معروف ، يمكن مرة أخرى حساب عدد الناقلات لكل خلية من العينة.
بينما يوضح هذا العمل عملية قياس ارتباط الناقل (على النحو الذي تحدده شدة التألق المقاسة) ، يمكن إجراء بروتوكول مماثل لمقاييس أخرى للتفاعل بين الخلية والناقل (على سبيل المثال ، بروتوكول تجريبي يميز الناقلات الداخلية والحاملة الغشائية). بالإضافة إلى ذلك ، سيكون هذا البروتوكول هو نفسه إلى حد كبير إذا تم قياس الارتباط من خلال مقايسة غير فلورية (على سبيل المثال ، من خلال قياس الكتلة الخلوية).
Protocol
1. اختيار الدفق المناسب
- اتبع شجرة القرار الموضحة في الشكل 1 لتحديد أفضل سير عمل (دفق) (الشكل 2) للإعداد التجريبي المستخدم. ارجع إلى المناقشة للحصول على مزيد من التعليقات حول اختيار البث هذا.
- إذا كنت تتبع دفق مقياس الخلايا، فتابع الخطوات 2.1.1-2.2.7. إذا كنت تتبع البث المجمع، فتابع الخطوات 3.1.1.1-3.1.5.7.
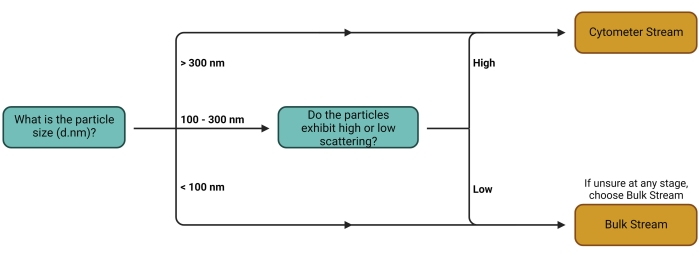
الشكل 1: شجرة قرار دفق العمل. يعتمد القرار بشأن أي Stream يجب استخدامه بشكل أساسي على نوع اهتمام الناقل. يمكن بسهولة اكتشاف الناقلات والناقلات الأكبر حجما ذات خصائص التشتت العالية بشكل فردي على أجهزة قياس الخلايا ، مما يجعلها مناسبة للقياس الكمي باستخدام تيار مقياس الخلايا. الدفق السائب مناسب لجميع أنواع شركات النقل الأخرى. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
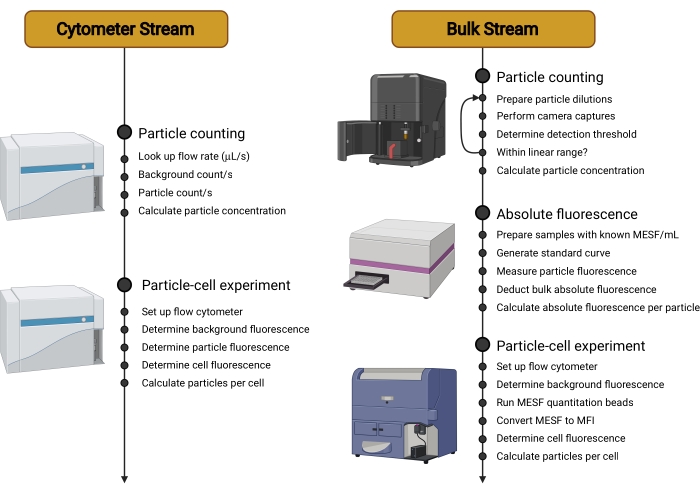
الشكل 2: نظرة عامة على مسارات العمل. ينقسم هذا البروتوكول إلى تيارين مختلفين. يستخدم تيار مقياس الخلايا مقياسا خلويا حساسا لحساب الناقلات في التعليق ، وقياس مضانها الفردي ، ثم تحديد مضان الخلايا المحتضنة بالناقلات. يستخدم Bulk Stream تقنيات غير قائمة على القياس الخلوي ، مثل تحليل تتبع الجسيمات النانوية ، لحساب الناقلات في التعليق. ثم يتم قياس مضان الناقل الفردي باستخدام قارئ الصفائح الدقيقة أو مقياس الطيف الفلوري. لذلك ، يقتصر استخدام مقياس التدفق الخلوي على قياس التألق النهائي للخلايا المحتضنة بالناقلات ، وهو قياس يمكن إجراؤه على نطاق أوسع من أجهزة قياس الخلايا وهو مستقل عن نوع الناقل المستخدم. الاختصارات: MESF = جزيئات الفلوروكروم القابل للذوبان المكافئ ؛ MFI = متوسط شدة التألق. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
2. تيار مقياس الخلايا
- عد الناقل
ملاحظة: يمكن استخدام أي مقياس تدفق خلوي لهذا القياس ، بشرط أن يكون معدل التدفق (ميكرولتر / ثانية) معروفا. إذا كان معدل التدفق غير معروف ولا يمكن تحديده ، فلا تتابع هذه الخطوة. بدلا من ذلك ، تابع الخطوة 3.1. يسمح عد الناقلات المعلقة بتحديد دقيق وقابل للتكرار لعدد الناقلات المحتضنة في كل تجربة خلوية.- قم بإعداد مقياس الخلايا للكشف عن الناقلات ، عن طريق قناة التشتت البصري (عادة التشتت الجانبي [SSC]) والتألق. تأكد من ضبط العتبة للسماح باكتشاف شركات النقل.
ملاحظة: قد تكون هناك حاجة إلى التكرار من خلال قنوات تشتت بصرية مختلفة إذا لم يوفر SSC إشارة واضحة (على سبيل المثال ، التشتت الأمامي [FSC]). - قم بتشغيل عينة مخففة فقط لتحديد عدد أحداث الخلفية في كل من SSC وقنوات الفلورسنت.
ملاحظة: عدد الأحداث المثالية في الخلفية هو <100 حدث/حدث. - إعداد الناقلات لقياس التدفق الخلوي.
- تأكد من تعليق الناقلات بشكل جيد عن طريق الدوامة أو الصوتنة ، اعتمادا على نظام الناقل المعني.
- إذا أمكن ، تأكد من أن تركيز الناقل يتراوح بين 1000 ناقل / ميكرولتر و 10000 ناقل / ميكرولتر. يعد عدد الأحداث من واحد إلى أمرين من حيث الحجم أعلى من الخلفية بداية جيدة. إذا كان ترتيب حجم تركيز الناقل غير معروف ، فإن البداية الجيدة هي إعداد تخفيف 1: 1,000 من المخزون. استخدم النتائج الأولية كملاحظات لإبلاغ تخفيفات العينات المستقبلية.
ملاحظة: يكون التعليق الغائم شديد التركيز بشكل عام.
- قم بتحميل عينة الناقل الأولى على مقياس الخلايا وابدأ التسجيل.
- مقارنة عدد الأحداث الناتجة عن كل من SSC وقنوات التألق ؛ يجب أن تكون هذه متساوية تقريبا (فرق <10٪). إذا لم يكن الأمر كذلك ، فتحقق من إعدادات مقياس الخلايا ، على سبيل المثال ، إعدادات أنبوب المضاعف الضوئي (PMT) وشدة الليزر لقناة الفلورسنت. بدلا من ذلك ، استخدم طرقا أخرى مثل الفحص المجهري متحد البؤر للتحقق من أن الملصقات الفلورية للناقلات موجودة وموحدة.
- كرر الخطوات 2.1.3-2.1.5 مرتين إضافيتين أو أكثر مع تخفيفات مختلفة من المخزون. تأكد من أن عدد الأحداث في كل عينة أعلى بترتيب واحد على الأقل من حيث الحجم من عدد الأحداث في الخلفية.
- تحقق من أن ثلاث عينات أو أكثر تظهر اتجاها خطيا ، أي أن تخفيف العينة المزدوج يجب أن يؤدي إلى انخفاض مزدوج في تركيز الناقل المقاس.
- استخدم العينات ضمن النطاق الخطي وعوامل التخفيف المقابلة ومعدل تدفق مقياس الخلايا المعروف لحساب تركيز حامل المخزون وفقا للمعادلة (1):
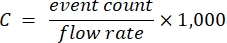 (1)
(1)
حيث C هو تركيز ناقل الأسهم في الناقلات / مل. يوصى باستخدام عدد الأحداث المستمدة من اكتشاف التشتت البصري بدلا من التألق.
- قم بإعداد مقياس الخلايا للكشف عن الناقلات ، عن طريق قناة التشتت البصري (عادة التشتت الجانبي [SSC]) والتألق. تأكد من ضبط العتبة للسماح باكتشاف شركات النقل.
- قراءة قياس التدفق الخلوي لتجربة الخلية الحاملة ، بما في ذلك تحديد شدة التألق لكل ناقل
ملاحظة: من الناحية المثالية ، سيتم تحديد شدة الفلورسنت لكل ناقل في أقرب وقت ممكن من تجربة الخلية الحاملة. هذا للتأكد من أن MFIs التي تم الحصول عليها للناقلات الفردية يمكن مقارنتها مباشرة بمؤسسات التمويل الأصغر للخلايا المرتبطة بالناقلات. من الناحية العملية ، عادة ما يولد مقياس الخلايا نتائج مماثلة عند استخدامه في أيام متتالية باستخدام نفس الفولتية PMT ، ولكن لا يمكن ضمان ذلك.- صمم تجربة الخلية الحاملة. استخدم تركيز الناقل المحدد في الخطوة 2.1 لإدارة الجرعة المطلوبة من الناقلات.
- قم بإعداد مقياس التدفق الخلوي لتجربة الخلية الحاملة النهائية من خلال تحديد إعدادات الجهد PMT المثلى في القنوات ذات الصلة. قم بتعيين الحدود للسماح باكتشاف شركة الاتصالات.
- قم بتشغيل الناقلات في التعليق لتحديد شدة التألق لكل ناقل في ظل إعدادات PMT الحالية.
- إذا لزم الأمر ، قم بتغيير عتبات مقياس الخلايا لاكتشاف الخلايا وليس الناقلات.
- قم بتشغيل عينة تحكم سلبية - خلايا غير محتضنة بناقلات - لتحديد مضان الخلفية (التألق الذاتي) للخلايا.
- قم بتشغيل عينات الخلية الحاملة لتحديد شدة التألق لكل خلية. هذا التألق هو مزيج خطي من التألق الذاتي الخلوي ووجود ناقلات الفلورسنت.
- احسب عدد الناقلات لكل خلية باستخدام المعادلة التالية (2):
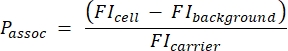 (2)
(2)
حيث Passoc هو عدد الناقلات المرتبطة لكل خلية ، وخلية FI هي MFI للخلايا المحتضنة مع الناقلات ، وخلفية FI هي MFI للخلايا غير المحتضنة مع الناقلات ، و FIcarrier هي MFI للناقلات المعلقة.
3. الدفق السائب
- عد الناقل: تحليل تتبع الجسيمات النانوية
ملاحظة: في التدفق السائب ، يعد عد الناقل خطوة ضرورية لتحديد كثافة التألق المطلقة لكل ناقل (انظر الخطوة 3.1.4). بالإضافة إلى ذلك ، يسمح حساب الناقلات المعلقة بتحديد دقيق وقابل للتكرار لعدد الناقلات المحتضنة في كل تجربة خلوية.- اعداد
- قم بتركيب خلية التدفق على وحدة الليزر وقفل وحدة الليزر بأكملها في مكانها داخل الجهاز.
- ببطء (ليس أسرع من 0.1 مل / ثانية) اغسل خلية التدفق ب ~ 1 مل من الماء المقطر. إذا تشكلت فقاعات داخل خلية التدفق ، فقم بسحب التعليق جزئيا لدمج الفقاعة مع واجهة الهواء والسائل قبل المتابعة.
- ابدأ تشغيل الكاميرا في منتصف الطريق تقريبا من خلال التنظيف ؛ تأكد من التأكد من غسل حطام الناقل. حدد التقاط لفتح علامة التبويب إعدادات الالتقاط وانقر فوق بدء تشغيل الكاميرا.
- تجفيف النظام مع 1 مل من الهواء. إذا كانت أي ناقلات ثابتة مرئية على الشاشة ، فقم بتنظيف خلية التدفق وفقا لتعليمات الشركة المصنعة.
- قم بإعداد الناقلات لتحليل تتبع الجسيمات النانوية من خلال التأكد من تعليق الناقلات جيدا عن طريق الدوامة أو الصوتنة ، اعتمادا على نظام الناقل المعني. إذا كان ترتيب حجم تركيز المخزون غير معروف ، فقم بإعداد تخفيف 1: 100 من المخزون واستخدم النتائج الأولية كملاحظات لإبلاغ تخفيفات العينة المستقبلية. قم بتخفيف الناقلات في الماء وليس في محلول ملحي مخزن بالفوسفات (PBS) لتحضير ~ 0.6-1 مل على الأقل من كل عينة بتركيز ناقل يتراوح بين 1 × 107 ناقلات / مل و 1 × 109 ناقلات / مل.
ملاحظة: يكون التعليق الغائم شديد التركيز بشكل عام. يمكن أن تولد المخازن المؤقتة والأملاح ضوضاء عالية في الخلفية.
- قياس
- أخرج وحدة الليزر وضعها في وضع مستقيم.
- ارسم عينة الناقل الأولى في حقنة سعة 1 مل. قم بتوصيل المحقنة بمدخل الأنبوب وقم بتحميل العينة بعناية في خلية التدفق. إذا تشكلت فقاعات داخل خلية التدفق ، فقم بسحب التعليق جزئيا لدمج الفقاعة مع واجهة الهواء والسائل قبل المتابعة. تأكد من ملء خلية التدفق بأكملها بالسائل ، ثم توقف مؤقتا.
- اضبط تركيز الكاميرا إذا لزم الأمر لتصور شركات النقل الفردية. قم بإجراء تعديلات التركيز الخشن باستخدام المقبض الدوار على الجانب الأيمن من الجهاز. قم بإجراء تعديلات أدق عن طريق تحديد علامة التبويب الأجهزة | مضخات / المرحلة. قم بتغيير التركيز عن طريق ضبط شريط تمرير التركيز .
- اضبط مستوى الكاميرا للتأكد من عدم وجود تشبع. ضمن علامة التبويب التقاط ، حدد مستوى الكاميرا الأمثل عن طريق ضبط شريط التمرير.
- إذا كانت الأداة مزودة بهذا الملحق ، فقم بتحميل المحقنة التي تحتوي على عينة الحامل في مضخة المحقنة لضمان التدفق المستمر للعينة أثناء القياسات.
- ضمن علامة التبويب SOP ، حدد القياس القياسي لالتقاط خمس لقطات مدة كل منها 30 ثانية. أدخل اسم الملف الأساسي ، وإذا رغبت في ذلك ، أضف معلومات عينة إضافية بالنقر فوق الزر خيارات متقدمة (الذي يفتح حوارا مشروطا مع مجموعة متنوعة من الخيارات).
ملاحظة: إذا تم إدخال عامل تخفيف، ضبط قياس تركيز الناقل النهائي تلقائيا بواسطة البرنامج. ينصح بإدخال هذا العامل. بدلا من ذلك ، قم بإجراء الضبط يدويا ، مما يسهل التحليل ويسمح بتقييم ما إذا كان كل تخفيف يقع ضمن النطاق الديناميكي للأداة (الخطوة 3.1.3.4). - اضغط على إنشاء وتشغيل البرنامج النصي وانتظر حتى تظهر نافذة منبثقة تطلب منك الرجاء تقدم العينة.
- في حالة استخدام مضخة المحقنة، حدد علامة التبويب الأجهزة | علامة تبويب مضخة الحقنة | اضبط معدل التسريب على 30-80 واضغط على Infuse. إذا لم تكن تستخدم مضخة المحقنة ، فقم بتقدم العينة يدويا.
- في النافذة المنبثقة، حدد موافق لبدء الالتقاط. بعد كل من اللقطات الخمس ، عندما تظهر النافذة المنبثقة الرجاء التقدم للعينة مرة أخرى ، تحقق من أن العينة لا تزال تتحرك عبر خلية التدفق ، إما يدويا أو عبر مضخة المحقنة. ثم حدد موافق لمتابعة الالتقاط التالي.
ملاحظة: بعد خمس عمليات التقاط ، يفتح البرنامج تلقائيا علامة التبويب العملية ويفتح نافذة منبثقة تطلب ضبط إعدادات العملية.
- تحليل
- في علامة التبويب العملية ، اضبط شريط تمرير عتبة الكشف (بين 4 و8) لتحديد شركات النقل المميزة المرئية على الشاشة بشكل صحيح. اضبط كسب الشاشة أيضا للمساعدة في التصور ؛ لن يؤثر على تحليل المصب. استخدم شريط التمرير أسفل شاشة الالتقاط للتمرير عبر إطارات متعددة من الفيديو للمساعدة في إعداد عتبة الكشف.
ملاحظة: يجب تعيين عتبة الكشف مرة واحدة ، وبعد ذلك ، يجب عدم تغييرها بين القياسات أو العينات. - في النافذة المنبثقة (ملاحظة بعد الخطوة 3.1.2.9)، اضغط على موافق لبدء تحليل التتبع. راقب تقدم التحليل بالنقر فوق علامة التبويب تحليل | علامة تبويب تحليل واحدة .
- بمجرد الانتهاء من التحليل، ابحث عن مطالبة إعدادات التصدير لتظهر فيها، حيث يجب تحديد تضمين PDF وتضمين ملخص التجربة بشكل افتراضي. حدد أي تنسيقات تصدير أخرى حسب الرغبة.
- في قسم النتائج من تصدير بيانات PDF ، للتأكد من أن التركيز المقاس موثوق به ، تحقق من أن تركيز الموجة الحاملة المقاس يتراوح بين 1 × 107 ناقلات / مل و 1 × 109 ناقلات / مل - النطاق الديناميكي للأداة - وتحقق من وجود أي رسائل خطأ أو رسائل تحذير أسفل نتيجة قياس التركيز.
- كرر الخطوات 3.1.2.1-3.1.3.4 مرتين أو أكثر مع تخفيفات مختلفة من المخزون. تأكد من أن تركيز كل عينة يقع ضمن النطاق الخطي للأداة.
- حدد ثلاث عينات أو أكثر تظهر اتجاها خطيا ، أي أن تخفيف العينة من شقين يجب أن يؤدي إلى انخفاض مزدوج في تركيز الناقل المقاس. استخدم العينات المحددة وعوامل التخفيف المقابلة لحساب تركيز حامل المخزون.
- في علامة التبويب العملية ، اضبط شريط تمرير عتبة الكشف (بين 4 و8) لتحديد شركات النقل المميزة المرئية على الشاشة بشكل صحيح. اضبط كسب الشاشة أيضا للمساعدة في التصور ؛ لن يؤثر على تحليل المصب. استخدم شريط التمرير أسفل شاشة الالتقاط للتمرير عبر إطارات متعددة من الفيديو للمساعدة في إعداد عتبة الكشف.
- تحديد شدة التألق المطلقة لكل ناقل
ملاحظة: نظرا لأنه لا يمكن وصف مضان الناقلات الفردية في هذا التيار بشكل مباشر ، يتم تحديد كثافة التألق بكميات كبيرة. تعتمد هذه الطريقة على حقيقة أن شدة التألق مرتبطة خطيا بتركيز الفلوروكروم وفقا لقانون لامبرت بير. عندما يتم هذا التحديد الكمي للناقلات المعلقة على تعليق بتركيز ناقل معروف (انظر الخطوة 3.1) ، يمكن اشتقاق التألق لكل ناقل. يمكن القيام بهذه الخطوة إما على قارئ لوحة مضان أو مقياس الطيف. تتم مقارنة شدة التألق بمنحنى قياسي للعينات ذات التألق المطلق المعروف ، المعطى بعدد MESFs.- استخدم محلول الفلوروكروم الحر لتسمية الناقل: أعد تعليق الصبغة في المخزن المؤقت المناسب (على سبيل المثال ، DMSO) وقم بإجراء المزيد من التخفيفات في نفس المخزن المؤقت مثل مخفف الناقل. بدلا من ذلك ، استخدم محلول جسم مضاد مقترن بالفلوروكروم. احسب تركيز محلول المخزون (MESF / mL) من التركيز في mg / mL ، والوزن الجزيئي في mg / mole ، ورقم Avogadro باستخدام المعادلة (3). قم بإجراء تخفيف تسلسلي في مخفف الناقل لإنشاء عينات منحنى قياسية.
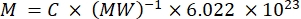 (3)
(3)
ملاحظة: استخدم الجسم المضاد المترافق بالفلوروكروم فقط إذا كانت درجة وضع العلامات ، أي النسبة المولية بين الفلوروكروم والجسم المضاد في المحلول ، معروفة. في البداية ، قم بإنشاء منحنى قياسي بنطاق واسع ، حيث لا تزال شدة مضان عينة الناقل غير معروفة. من هنا ، قم بتضييقه ليشمل النطاق المطلوب. - تحضير عينات الناقل.
ملاحظة: أفضل ممارسة هي اختبار اثنين أو أكثر من التخفيفات الحاملة للتحقق من أن القياسات خطية وتقع ضمن نطاق المنحنى القياسي. - قم بقياس مضان الأحجام المتساوية لكل عينة ، أي منحنيات الناقل والمنحنيات القياسية.
- قم بإنشاء منحنى قياسي وخصم كثافة التألق المطلقة السائبة في MESF / mL لعينات الناقل المقاسة.
- احسب شدة التألق المطلقة لكل ناقل (MESF / الناقل) بقسمة التألق السائب (MESF / mL) على تركيز الناقل (الناقلات / مل) كما في المعادلة (4):
 (4)
(4)
- استخدم محلول الفلوروكروم الحر لتسمية الناقل: أعد تعليق الصبغة في المخزن المؤقت المناسب (على سبيل المثال ، DMSO) وقم بإجراء المزيد من التخفيفات في نفس المخزن المؤقت مثل مخفف الناقل. بدلا من ذلك ، استخدم محلول جسم مضاد مقترن بالفلوروكروم. احسب تركيز محلول المخزون (MESF / mL) من التركيز في mg / mL ، والوزن الجزيئي في mg / mole ، ورقم Avogadro باستخدام المعادلة (3). قم بإجراء تخفيف تسلسلي في مخفف الناقل لإنشاء عينات منحنى قياسية.
- تجربة الخلية (بما في ذلك تحديد شدة التألق المكافئة لكل ناقل)
ملاحظة: في هذه الخطوة ، يتم استخدام حبات قياس التدفق الخلوي لتوليد منحنى قياسي للعلاقة بين MESF و MFI. تتكون حبات القياس الكمي هذه من مجموعات خرزة متعددة مع عدد معروف من MESF لكل حبة ، ويمكن اكتشاف هذه الخرزات الفردية بواسطة أي مقياس خلوي. من الناحية المثالية ، يتم تحديد المنحنى القياسي MESF في نفس الوقت الذي يتم فيه قراءة تجارب الخلية الحاملة. هذا للتأكد من أن قيم MFI المحسوبة لشركات النقل الفردية يمكن مقارنتها مباشرة ب MFI للخلايا المرتبطة بالناقلات. من الناحية العملية ، عادة ما يولد مقياس الخلايا نتائج مماثلة عند استخدامه في أيام متتالية باستخدام نفس الفولتية PMT ، ولكن لا يمكن ضمان ذلك.- صمم تجربة الخلية الحاملة. استخدم تركيز الناقل المحدد في القسم 3.1.3 لإدارة الجرعة المطلوبة من الناقلات.
- قم بإعداد مقياس التدفق الخلوي لتجربة الخلية الحاملة النهائية من خلال تحديد إعدادات الجهد PMT المثلى في القنوات ذات الصلة.
- قم بتشغيل عينة تحكم سلبية ، أي الخلايا غير المحتضنة بناقلات ، لتحديد مضان الخلفية.
- تحضير وإعادة تعليق حبات قياس التدفق الخلوي. استخدم نفس المخزن المؤقت المستخدم لعينات الخلية (على سبيل المثال ، PBS). إذا تم توفير مجموعات الخرزة بشكل منفصل ، فقم بتجميعها معا.
- قم بتشغيل عينة حبة قياس التدفق الخلوي.
- قم بتشغيل عينات الخلية الحاملة لتحديد شدة التألق لكل خلية.
- استخدم عينة حبة القياس الكمي لإنشاء منحنى قياسي يحول شدة التألق المطلقة (MESF) إلى MFI. استخدم هذا المنحنى القياسي والنتائج من الخطوة 3.1.4 لحساب MFI النظري لشركات النقل. احسب عدد الناقلات لكل خلية باستخدام المعادلة (5):
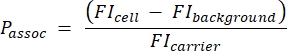 (5)
(5)
حيث Passoc هو عدد الناقلات المرتبطة لكل خلية ، وخلية FI هي MFI للخلايا المحتضنة مع الناقلات ، وخلفية FI هي MFI للخلايا غير المحتضنة مع الناقلات ، و FIcarrier هي MFI المحسوبة للناقلات المعلقة (الخطوة 3.1.4).
- اعداد
النتائج
كما نوقش سابقا ، تتطلب أنواع ناقلات المخدرات المختلفة استخدام تقنيات مختلفة للقياس الكمي المطلق لارتباط حامل الخلية. على سبيل المثال ، 633 نانومتر من جزيئات البولي (حمض الميثاكريليك) (PMASH) ذات القشرة الأساسية كبيرة وكثيفة بما يكفي للكشف باستخدام مقياس التدفق الخلوي الحساس. على هذا الن...
Discussion
أصبح توصيف التفاعلات بين ناقلات المخدرات والخلايا ذا أهمية متزايدة في تطوير أنظمة جديدة لتوصيل الأدوية. على وجه التحديد ، للسماح بالتقييم والمقارنة العقلانيين لمختلف هياكل الناقل ، فإن القياس الكمي المطلق لأداء الناقل المذكور للتفاعل مع الخلايا المستهدفة وغير المستهدفة أمر بالغ الأهمي...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
وحظي هذا العمل بدعم المجلس الوطني الأسترالي للبحوث الصحية والطبية (NHMRC; منحة البرنامج رقم GNT1149990) ، المركز الأسترالي لأبحاث فيروس نقص المناعة البشرية والتهاب الكبد (ACH2) ، بالإضافة إلى هدية من تركة ريجان لويز لانجلوا. تقر F.C. بمنح زمالة الأبحاث الرئيسية العليا للمجلس الوطني للصحة والبحوث الطبية (NHMRC) (GNT1135806). تم إنشاء الشكل 1 والشكل 2 باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 C2 Maleimide | Invitrogen | A20347 | pH-stable dye used to label 150 nm, 235 nm, or 633 nm PMASH carriers; example of good dye to use in cell-carrier association studies |
| Apogee A50 Microflow | Apogee | Sensitive flow cytometer capable of detecting small carriers for counting | |
| CytoFLEX S Flow Cytometer | Beckman Coulter | Sensitive flow cytometer capable of detecting small carriers for counting and read out for final cell-barrier experiments | |
| FCS Express | De Novo Software | Software used to analyze flow cytometry data, i.e., perform gating and derive median fluorescence intensity values of populations of choice. Alternatives include FlowJo, OMIQ, Python | |
| Infinite 200 PRO | Tecan Lifesciences | Standard microplate reader instrument used for bulk fluorescence measurements of carriers in solution | |
| LSRFortessa Cell Analyzer | BD Biosciences | Less sensitive flow cytometer, but one more generally available to researchers. Can be used to read out final cell-carrier experiment | |
| NanoSight NS300 | Malvern Panalytical | Instrument used for Nanoparticle Tracking Analysis | |
| Prism 8 | GraphPad | Software used to graph and calculate standard curves. Alternatives include Microsoft Excel, Origin, Minitab, Python amongst many others | |
| Quantum MESF kits Alexa Fluor 647 | Bangs Laboratories | 647 | Absolute quantitation beads for flow cytometery. Used to convert fluorescence intensities measured in bulk on a microplate reader to fluorescence intensities measured on a flow cytometer using the MESF standard |
References
- Conde, J., et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Frontiers in Chemistry. 2, 48 (2014).
- Cheng, Q., et al. Selective ORgan Targeting (SORT) nanoparticles for tissue specific mRNA delivery and CRISPR/Cas gene editing. Nature Nanotechnology. 15 (4), 313-320 (2020).
- Jackson, N. A. C., Kester, K. E., Casimiro, D., Gurunathan, S., DeRosa, F. The promise of mRNA vaccines: A biotech and industrial perspective. npj Vaccines. 5 (1), 1-6 (2020).
- Press, A. T., et al. Cargo-carrier interactions significantly contribute to micellar conformation and biodistribution. NPG Asia Materials. 9 (10), 444 (2017).
- Cevaal, P. M., et al. In vivo T cell-targeting nanoparticle drug delivery systems: Considerations for rational design. ACS Nano. 15 (3), 3736-3753 (2021).
- Faria, M., Johnston, S. T., Mitchell, A. J., Crampin, E., Caruso, F. Bio-nano science: Better metrics would accelerate progress. Chemistry of Materials. 33 (19), 7613-7619 (2021).
- Shin, H., Kwak, M., Geol Lee, T., Youn Lee, J. Quantifying the level of nanoparticle uptake in mammalian cells using flow cytometry. Nanoscale. 12 (29), 15743-15751 (2020).
- Lozano-Andrés, E., et al. Considerations for MESF-bead based assignment of absolute fluorescence values to nanoparticles and extracellular vesicles by flow cytometry. bioRxiv. , (2021).
- Schwartz, A., et al. Formalization of the MESF unit of fluorescence intensity. Cytometry. Part B, Clinical Cytometry. 57 (1), 1-6 (2004).
- Faria, M., et al. Revisiting cell-particle association in vitro: A quantitative method to compare particle performance. Journal of Controlled Release. 307, 355-367 (2019).
- Chen, A. K., Cheng, Z., Behlke, M. A., Tsourkas, A. Assessing the sensitivity of commercially available fluorophores to the intracellular environment. Analytical Chemistry. 80 (19), 7437-7444 (2008).
- Comfort, N., et al. Nanoparticle tracking analysis for the quantification and size determination of extracellular vesicles. Journal of Visualized Experiments. (169), e62447 (2021).
- Cui, J., et al. Immobilized particle imaging for quantification of nano- and microparticles. Langmuir. 32 (14), 3532-3540 (2016).
- Shang, J., Gao, X. Nanoparticle counting: Towards accurate determination of the molar concentration. Chemical Society Reviews. 43 (21), 7267-7278 (2014).
- Thomas, D. G., et al. ISD3: A particokinetic model for predicting the combined effects of particle sedimentation, diffusion and dissolution on cellular dosimetry for in vitro systems. Particle and Fibre Toxicology. 15 (1), 6 (2018).
- Johnston, S. T., Faria, M., Crampin, E. J. Isolating the sources of heterogeneity in nano-engineered particle-cell interactions. The Journal of the Royal Society Interface. 17 (166), 20200221 (2020).
- Ahmed-Cox, A., et al. Spatio-temporal analysis of nanoparticles in live tumor spheroids impacted by cell origin and density. Journal of Controlled Release. 341, 661-675 (2022).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved