Method Article
طريقة جديدة لتحديد النشاط الطولي المضاد للبكتيريا للمواد التي تتخلص من الأدوية
In This Article
Summary
هنا ، نقدم بروتوكولا لتقييم الفعالية المضادة للبكتيريا لبوليمر محمل بالمضادات الحيوية لمحاكاة التطبيق السريري الوقائي باستخدام مقايسة الجدوى الميكروبية المضيئة القائمة على ATP المتاحة تجاريا في الوقت الفعلي. تتيح هذه الطريقة مراقبة النشاط الطولي للمواد المحملة بالأدوية ويمكن تكييفها على نطاق واسع لاختبار منصات توصيل الأدوية المضادة للميكروبات.
Abstract
يستخدم البولي إيثيلين عالي الوزن الجزيئي (UHMWPE) على نطاق واسع في تقويم المفاصل الكلي كسطح حامل. تشكل التهابات المفاصل حول الأطراف الاصطناعية ، والتي يحدث معظمها بعد فترة وجيزة من استبدال المفصل ، ما يقرب من 25٪ من إجمالي جراحات مراجعة الركبة ، ويشكل القضاء التام على العدوى البكتيرية تحديا كبيرا. وتتمثل إحدى الطرق الواعدة لمعالجة هذه المشكلة في ضمان التسليم المحلي المستدام لتركيزات المضادات الحيوية الكافية لتثبيط البكتيريا لدعم الوقاية الروتينية الجهازية بالمضادات الحيوية. هناك أبحاث متزايدة في تطوير أجهزة محلية فعالة لتوصيل الأدوية. على الرغم من أنه يمكن استخدام طرق الاختبار المضادة للبكتيريا للأدوية لاختبار الفعالية المضادة للبكتيريا للمواد المحملة بالأدوية ، إلا أنها تفتقر إلى توفير بيانات فعالية مضادة للبكتيريا في الوقت الفعلي والطولية يمكن ربطها بملامح الشطف للمضادات الحيوية من هذه الأجهزة. هنا ، نبلغ عن منهجية مباشرة ومتعددة الاستخدامات لتحديد الفعالية المضادة للبكتيريا لغرسات UHMWPE المحملة بالمضادات الحيوية. يمكن استخدام هذه المنهجية كمنصة لتجنب الثقافة البكتيرية في كل نقطة زمنية من تجربة طويلة ويمكن أيضا تكييفها مع أجهزة توصيل الأدوية المحلية الأخرى.
Introduction
هشاشة العظام هي حالة تنكسية كبيرة تصيب 500 مليون بالغ في جميع أنحاء العالم1. المعيار الذهبي في علاج التهاب المفاصل في المرحلة النهائية هو استبدال المفاصل الكلي ، والذي من المتوقع أن يتم إجراؤه في أكثر من مليوني مريض سنويا في الولايات المتحدة وحدها بحلول عام 20302 ، مع زيادة الطلب العالمي أيضا بشكل كبير 3,4. يتضمن الإجراء استبدال الأسطح الغضروفية المفصلية للمفاصل بمواد اصطناعية حاملة مصنوعة من المعدن / السيراميك والبولي إيثيلين عالي الوزن الجزيئي عالي التشابك (UHMWPE). تعمل عمليات استبدال المفاصل الكلية على تحسين نوعية الحياة بشكل كبير للمرضى الذين يعانون من التهاب المفاصل5 ، ولكن المضاعفات الكبيرة التي تعرض أداء الغرسات ورضا المرضى للخطر هي عدوى المفصل حول الأطراف الاصطناعية (PJI) ، والتي تمثل 15٪ -25٪ من جراحات المراجعة6. يعتقد أن سبب العدوى في معظم الحالات هو التلوث الميكروبي لموقع الزرع أثناء الجراحة7. ثم يتوسع السكان الملوثون على أسطح الزرعوالأنسجة 8. يتم تشغيل الجهاز المناعي المضيف استجابة لذلك ، ولكن معدل النمو وتكوين الأغشية الحيوية للكائنات الملوثة يمكن أن يمكنها من التهرب من الخلايا المناعية ، مما قد يؤدي إلى زيادة عاصفة السيتوكين والكيموكين دون القضاء على البكتيريا9،10،11. العدوى العميقة الناتجة عن العظام تعرض للخطر تثبيت وأداء الغرسة وكذلك صحة المريض12.
المكورات العنقودية الذهبية والمكورات العنقودية سلبية التخثر هي الكائنات المسببة السائدة ل PJI13. شدة عدوى المكورات العنقودية عالية بسبب مقاومتها المتزايدة للمضادات الحيوية ، وتكوين الأغشية الحيوية ، والقدرة على الاستمرار كمتغيرات مستعمرة صغيرة14،15،16. تحدث العدوى المرتبطة بالزرع بسبب التصاق الكائنات الحية الدقيقة على سطح الغرسة وإنشاء مصفوفة بيوفيلم معقدة تمكن البكتيريا من التهرب من العوامل المناعية الضارة للمضيف والتركيزات الفعالة للمضادات الحيوية14،15،16. تشمل طرق العلاج التقليدية تركيبات المضادات الحيوية عن طريق الوريد والفم لفترة طويلة17. ومن العيوب الرئيسية لهذا النهج انخفاض التوافر البيولوجي للدواء في موقع العدوى وصعوبة تحقيق تركيزات كافية من المضادات الحيوية للقضاء على البكتيريا باستمرار خلال فترة العلاج ، مما يؤدي في كثير من الأحيان إلى نتائج سيئة18. لمعالجة أوجه القصور هذه ، تم تصميم غرسة UHMWPE موضعية تعمل بكامل طاقتها لضمان الإطلاق المستمر لتركيزات فعالة من المضادات الحيوية في مساحة المفصل19. يستخدم الشطف الموضعي من الغرسة المحملة بالأدوية كأداة تكميلية لمنع نمو واستعمار أي بكتيريا متبقية بعد إزالة الزرع وتنضير الأنسجة. يمكن إجراء اختبار مضاد للبكتيريا في المختبر لهذا UHMWPE المحمل بالمضادات الحيوية عن طريق احتضان المادة مباشرة مع البكتيريا وتحديد كمية البكتيريا بطريقة لوحة الانتشار20,21. بدلا من ذلك ، يمكن اختبار حصص الوسائط المخففة ضد البكتيريا باستخدام طرق مثل طريقة نشر قرص أجار ، وطرق تخفيف المرق ، واختبار قتل الوقت22. تعتمد كل هذه الطرق على مراقبة النمو حوالي 16-18 ساعة بعد جمع الحصص عن طريق عد المستعمرات وقياسات التعكر. يمكن قياس شطف المضادات الحيوية من هذه الأجهزة طوليا باستخدام هذه الطرق في المختبر. ومع ذلك ، لتحديد القيمة الانتقالية لملفات تعريف التركيز هذه ، هناك حاجة إلى طريقة قوية في الوقت الفعلي في المختبر لتقييم النشاط المضاد للبكتيريا.
تم تطوير مقايسة الجدوى الميكروبية المستخدمة في هذه الدراسة لتحديد كمية البكتيريا القابلة للحياة عن طريق قياس التلألؤ المقابل للأدينوسين ثلاثي الفوسفات (ATP) المنطلق من خلية بكتيرية حية باستخدام تقنية الكشف القائمة على لوسيفيرين-لوسيفيراز. يعمل ATP ، باعتباره عملة الطاقة للخلايا الحية ، كمؤشر مباشر للخلايا القابلة للحياة من الناحية الفسيولوجية. يقوم الكاشف بإجراء تحلل الخلايا ، الذي يطلق جزيئات ATP من خلايا قابلة للحياة يتم اكتشافها بعد ذلك في شكل تلألؤ. هذا التلألؤ له علاقة مباشرة بنسبة الخلايا البكتيرية القابلة للحياة داخل العينة23. هذا اختبار في الوقت الفعلي ، بسيط ، متعدد الاستخدامات ، سريع ، قائم على الكاشف الفردي يمكن تكييفه في مجموعة متنوعة من تصميمات وظروف الفحص مع كل من الكائنات الحية الدقيقة إيجابية الجرام وسالبة الجرام. نبلغ هنا عن طريقة لتحديد النشاط المضاد للبكتيريا في الوقت الفعلي ل UHMWPE المحملة بالمضادات الحيوية المحتضنة بسلالات مخبرية وسريرية من S. aureus باستخدام مقايسة قتل الوقت المعدلة بناء على مقايسة الجدوى الميكروبية (على سبيل المثال ، BacTiter Glo). بينما يتم وصف المنهجية بمادة زرع محددة وتطبيق محدد لتقويم العظام ، يمكن أن توفر الطريقة منصة لاختبار أجهزة توصيل أخرى محملة بالمضادات الحيوية مع التطبيقات السريرية.
Protocol
1. إعداد الكواشف
- تحضير مرق مولر هينتون (MHB): قم بإذابة 22 جم من MHB المعدل بالكاتيون في 1 لتر من الماء منزوع الأيونات. الأوتوكلاف الوسائط عند 121 درجة مئوية وضغط 15 رطلا لمدة 20 دقيقة ، مع التأكد من تغطية الزجاجة بشكل فضفاض. يحفظ المرق المعقم المحضر على حرارة 4 درجات مئوية حتى الاستخدام.
- تحضير أجار الصويا التربتيكي (TSA): قم بإذابة 20 جم من مسحوق TSA في 500 مل من الماء منزوع الأيونات. الأوتوكلاف خليط أجار على حرارة 121 درجة مئوية و 15 رطلا لمدة 20 دقيقة. انقل الوسائط المعقمة إلى حمام مائي بدرجة حرارة 55 درجة مئوية لخفض درجة حرارة الأجار المنصهر. صب أجار محضر مبرد على أطباق بتري معقمة (~ 15 مل) ، واتركه يتصلب. قم بتخزين ألواح الآجار الصلبة المقلوبة لتجنب التكثيف.
- تحضير مرق الصويا التربتيكي (TSB): قم بإذابة 15 جم من مسحوق TSB في 500 مل من الماء منزوع الأيونات. الأوتوكلاف خليط المرق على حرارة 121 درجة مئوية و 15 رطلا لمدة 20 دقيقة. يحفظ المرق المعقم المحضر على حرارة 4 درجات مئوية حتى الاستخدام.
- محلول ملحي مخزن بالفوسفات (PBS): تم شراء الأوتوكلاف تجاريا 1x PBS عند 121 درجة مئوية و 15 رطلا لمدة 20 دقيقة قبل الاستخدام المعقم.
- إعداد كاشف فحص الجدوى الميكروبية: موازنة محتويات الفحص مع درجة حرارة الغرفة. امزج 10 مل من المخزن المؤقت مع مسحوق الكاشف المضيء المجفف بالتجميد ، وقم بتخزين الكاشف المحضر في -20 درجة مئوية على شكل 1 مل من القسامة. قبل كل نقطة زمنية ، قم بإذابة الكاشف الحساس للضوء ، وأحضره إلى درجة حرارة الغرفة.
- محلول مخزون كبريتات الجنتاميسين: قم بإذابة 80 مجم من كبريتات الجنتاميسين (GS) في 10 مل من 1x PBS. دوامة محلول الدواء جيدا للحصول على محلول مخزون GS 8 مجم / مل.
- محلول مخزون فانكومايسين هيدروكلوريد: قم بإذابة 10 مجم من مسحوق فانكومايسين هيدروكلوريد جيدا في 10 مل من الماء منزوع الأيونات للحصول على محلول مخزون 1 مجم / مل.
- محلول عازلة حمض البوريك: قم بإذابة 24.7 جم (0.4 م) من حمض البوريك في 900 مل من الماء منزوع الأيونات. اضبط الرقم الهيدروجيني للمحلول على 10.4 بمحلول هيدروكسيد الصوديوم 50٪ (وزن / حجم). بالإضافة إلى هذه الخطوة ، أضف الماء منزوع الأيونات لجعله 1 لتر.
- كاشف O-pthaldialdehyde (OPA): قم بإذابة 0.2 جم من OPA في 1 مل من الميثانول. أضف 19 مل من محلول حمض البوريك 0.4 متر (درجة الحموضة 10.4) إلى محلول OPA. أضف 0.4 مل من 2-ميركابتوإيثانول إلى خليط حمض البوريك OPA. قم بتغطية قارورة الكاشف بورق الألمنيوم ، واحفظها في درجة حرارة 4 درجات مئوية للاستخدام لمدة تصل إلى 2-3 أيام بعد التحضير.
تنبيه: تجنب ملامسة الجلد والعينين والملابس. يجب إجراء مناولة كواشف OPA و 2 mercaptoethanol فقط تحت غطاء دخان مع تهوية عادم مناسبة أثناء ارتداء معدات الحماية الشخصية المناسبة. تجنب استنشاق الأبخرة أو الغبار أو الهباء الجوي.
2. إعداد UHMWPE البكر والمخدرات المحملة
- ينخل 2 جم من كل من كبريتات الجنتاميسين ومساحيق هيدروكلوريد فانكومايسين مع غربال (حجم مسام 75 ميكرومتر) ، ويجفف عند 45 درجة مئوية في فرن مفرغ (<0.1 ضغط جوي) لمدة 18-24 ساعة.
- امزج الدواء المجفف مع مسحوق UHMWPE بنسبة 7٪ وزن / وزن (1.12 جم من المضادات الحيوية + 14.88 جم من UHMWPE) في وعاء باستخدام خلاط ميكانيكي لمدة 5 دقائق.
- سخن قالبا مخصصا من الألومنيوم البرونزي (85 مم × 50 مم) مع ألواح إدراج من الفولاذ المقاوم للصدأ إلى 180 درجة مئوية في فرن حراري لمدة 1 ساعة. سخني ألواح المكبس إلى 170 درجة مئوية.
- أضف المسحوق المخلوط إلى القالب ، واضغطه عند 10 ميجا باسكال ، 170 درجة مئوية لمدة 10 دقائق ، تليها دورة تبريد بالماء لمدة 45 دقيقة عند 10 ميجا باسكال.
- قم بإزالة كتلة UHMWPE المقولبة (~ 3.5 مم) من المكبس باستخدام مكبس هيدروليكي.
- قم بطحن الأسطح العلوية والسفلية للكتلة باستخدام التحكم العددي المحوسب (CNC) لإزالة أي مخالفات وملوثات سطحية.
- قطع الكتلة إلى شرائط 3 مم × 5 مم × 20 مم باستخدام CNC.
- تحضير UHMWPE البكر (بدون إضافة المضادات الحيوية) باستخدام نفس المنهجية كما هو موضح كعنصر تحكم للدراسة.
الشكل التكميلي 1: أجزاء من القالب المستخدم لقولبة عينات UHMWPE. (أ) لوحة إدراج الفولاذ المقاوم للصدأ ؛ (ب) تجويف العفن؛ (ج) المكبس؛ (د) اللوح الخلفي الرجاء الضغط هنا لتنزيل هذا الملف.
3. تحديد حركية الشطف ل UHMWPE المحملة بالأدوية
- ضع شريطا مقاس 3 مم × 5 مم × 20 مم في حقنة سعة 3 مل بقفل Luer وإبرة 25 جرام.
- اغسل الشريط عن طريق ملء المحقنة بالماء منزوع الأيونات وقلب المحقنة عدة مرات.
- املأ المحقنة بالماء منزوع الأيونات حتى تخرج 2 مل.
- ضع إعداد المحقنة على شاكر عند 100 دورة في الدقيقة في درجة حرارة الغرفة.
- في كل نقطة زمنية (6 ساعات ، 1 يوم ، 2 أيام ، 3 أيام ، 1 أسبوع) ، اجمع المحلول في قارورة سعة 2 مل.
- في كل نقطة زمنية ، اغسل الشريط عن طريق ملء المحقنة بالماء منزوع الأيونات وقلب المحقنة. تخلص من المحلول ، واملأ المحقنة بالماء غير المتأين حتى تخرج 2 مل لمواصلة التجربة حتى النقطة الزمنية التالية.
4. تحديد تركيز فانكومايسين
- الكشف عن تركيز الفانكومايسين طيفيا في الماء منزوع الأيونات عند ذروة طول موجة امتصاص 280 نانومتر.
- قم بإعداد معايير نطاق التركيز المعروفة عن طريق إضافة 100 ميكرولتر من محلول مخزون 1 مجم / مل إلى لوحة بئر UV 96 والتخفيف المتسلسل باستخدام 100 ميكرولتر من الماء منزوع الأيونات للحصول على ستة مستويات من التركيزات المعروفة (1 مجم / مل إلى 0.03125 مجم / مل).
- انقل 100 ميكرولتر من المواد العازلة إلى ألواح 96 بئرا شفافة للأشعة فوق البنفسجية ، وحدد التركيز عند 280 نانومتر باستخدام قارئ الصفائح الدقيقة.
- قم بإنشاء منحنى معايرة عن طريق رسم تركيزات الدواء المعروفة مقابل قيم الامتصاص المقابلة. احسب تركيز الدواء غير المعروف في المحلول باستخدام المعادلة الخطية الناتجة عن منحنى المعايرة.
- تحديد كتلة الدواء عن طريق ضرب التركيز مع حجم eluent (~ 1.7 مل).
- احسب إطلاق الدواء التراكمي (ملغ) في نقطة زمنية عن طريق جمع إطلاق الدواء من جميع النقاط الزمنية السابقة.
- تطبيع إطلاق الدواء إلى مساحة سطح الشريط (3.5 سم 2) لتحديد إطلاق الدواء التراكمي لكل سنتيمتر مربع (سم2) من الزرع.
5. تحديد تركيز الجنتاميسين بطريقة وسم OPA 27
- إعداد حلول GS القياسية لإجراء فحص OPA.
- نقل 1 مل من محلول GS 80 ميكروغرام / مل إلى أنبوب طرد مركزي.
- أضف 500 ميكرولتر من PBS إلى خمسة أنابيب طرد مركزي أخرى.
- قم بإجراء تخفيف تسلسلي باستخدام هذه الأنابيب للحصول على تركيزات GS تبلغ 80 ميكروغرام / مل ، و 40 ميكروغرام / مل ، و 20 ميكروغرام / مل ، و 10 ميكروغرام / مل ، و 5 ميكروغرام / مل ، و 2.5 ميكروغرام / مل. هذه بمثابة حلول المعايرة للفحص.
- في صفيحة 96 بئرا واضحة ، أضف 80 ميكرولتر من PBS إلى البئر A-1 و 80 ميكرولتر من حلول المعايرة إلى الآبار A-2 إلى A-7 بتركيز تصاعدي. هذا بمثابة معايرة داخلية للفحص.
- أضف 80 ميكرولتر من كل عينة إلى الآبار الفارغة في ثلاث نسخ لتحليلها في نفس اللوحة المكونة من 96 بئرا. حدد عدد العينات لكل صفيحة بئر ب <50 بحيث يكون توقيت إضافة محلول OPA إلى العينات هو نفسه تقريبا لجميع العينات ولتجنب التبخر.
- أضف كاشف OPA إلى جميع المعايير وحلول العينات.
- في غطاء الدخان ، املأ خزان كاشف سعة 25 مل بالميثانول.
- أضف 8 مل من الميثانول و 1 مل من محلول OPA المحضر إلى خزان كاشف ثان (القسم 1.8). امزج المحلول جيدا عن طريق السحب لأعلى ولأسفل.
- باستخدام ماصة ميكرومية متعددة القنوات سعة 100 ميكرولتر ، أضف 48 ميكرولتر من الميثانول من الخزان الأول إلى جميع الآبار المحتوية على عينة في لوحة 96 بئرا.
- بالإضافة إلى هذه الخطوة ، أضف 72 ميكرولتر من محلول OPA المخفف من الخزان الثاني إلى جميع الآبار المحتوية على عينة في لوحة 96 بئرا. احتضان لوحة البئر لمدة 10 دقائق في درجة حرارة الغرفة.
- قم بقياس شدة التألق (إثارة 340 نانومتر ، انبعاث 455 نانومتر) باستخدام قارئ microplate مباشرة بعد حضانة 10 دقائق.
- ارسم منحنى المعايرة باستخدام قراءات الشدة للمحاليل ذات التركيزات المعروفة ل GS. أضف خطا خطيا لتحديد أفضل ملاءمة وإنشاء المعادلة المقابلة.
- احسب تركيز الدواء في المحلول من منحنيات المعايرة الناتجة عن رسم تركيزات الدواء المعروفة مقابل قيم الامتصاص المقابلة.
- احسب كتلة الدواء بضرب التركيز في الحجم المخفف (~ 1.7 مل).
- حدد إطلاق الدواء التراكمي (ملغ) في نقطة زمنية عن طريق جمع إطلاق الدواء من جميع النقاط الزمنية السابقة.
- تطبيع إطلاق الدواء إلى مساحة سطح الشريط (3.5 سم 2) لتحديد إطلاق الدواء التراكمي لكل سنتيمتر مربع (سم2) من الزرع.
6. إعداد البكتيريا
ملاحظة: تم استخدام سلالات S. aureus التالية في هذه الدراسة: سلالة النوع 12600 ، السلالات السريرية L1101 و L1163 (تم الحصول عليها من الدكتور كيري لابلانتي في جامعة رود آيلاند). وترد في الجدول 1 ملامح حساسية هذه السلالات.
| السلالات البكتيرية | جنتاميسين ميك | فانكومايسين ميك | |
| ATCC 12600 | ≤1 ميكروغرام / مل (حساس) | ≤0.5 ميكروغرام / مل (حساس) | |
| L1101 (سلالة سريرية) | ≥16 ميكروغرام / مل (مقاومة) | 8 ميكروغرام / مل (متوسط) | |
| L1163 (سلالة سريرية) | ≤1 ميكروغرام / مل (حساس) | 8 ميكروغرام / مل (متوسط) | |
الجدول 1: ملامح الحساسية للمضادات الحيوية للضوابط والسلالات السريرية للمكورات العنقودية الذهبية .
تنبيه: تم تنفيذ جميع الخطوات التي تنطوي على التعامل مع الثقافات البكتيرية والمعلقات في مساحة مختبر BSL-2 داخل خزانة السلامة البيولوجية من النوع A2 من الفئة الثانية.
- قم بإذابة المخزونات البكتيرية من -80 درجة مئوية على ألواح TSA لتسهيل نمو المكورات العنقودية الذهبية. احتضان الألواح بشكل ثابت طوال الليل عند 35 درجة مئوية.
- نقل اثنين إلى ثلاث مستعمرات من مزارع صفيحة الآجار المزروعة بين عشية وضحاها إلى 1 مل من TSB المعقم ، واحتضانها بشكل ثابت طوال الليل عند 35 درجة مئوية.
- نقل 100 ميكرولتر من البكتيريا إلى لوحة 96 بئر واضحة لقياس التعكر طيفي عن طريق تحديد الامتصاص عند 600 نانومتر.
- قم بتخفيف البكتيريا 10000 مرة باستخدام MHB المعقم قبل تحديد عدد البكتيريا القابلة للحياة باستخدام مقايسة الإنارة.
7. إجراء مقايسة الجدوى الميكروبية في الوقت الحقيقي
- قم بإجراء الفحص القائم على التلألؤ باستخدام ألواح 96 بئر بيضاء غير شفافة.
- امزج 100 ميكرولتر من المعلقات البكتيرية المخففة مع 100 ميكرولتر من كاشف الفحص المحضر في القسم 1.5.
- ضع غطاء مغطى بورق الألمنيوم فوق الصفيحة المعدة المكونة من 96 بئرا ، واحتضنها لمدة 5 دقائق مع اهتزاز 100 دورة في الدقيقة.
- قم بقياس التلألؤ على الفور باستخدام قارئ الألواح الدقيقة باستخدام الإعدادات التالية في برنامج Gen5 3.11.
- انقر فوق جديد لإعداد بروتوكول في نافذة إدارة المهام .
- حدد Costar 96 أبيض معتم في القائمة المنسدلة لنوع اللوحة.
- انقر فوق قراءة ضمن قائمة تحديد الخطوات > الإجراءات .
- انقر فوق التلألؤ داخل نافذة طريقة القراءة . احتفظ بخيارات الألياف نقطة النهاية / الحركية والتلألؤ محددة ضمن نوع القراءة ونوع البصريات ، على التوالي. انقر فوق موافق.
- احتفظ بإعدادات <الافتراضية> في نافذة خطوة القراءة (الكسب = 135؛ وقت التكامل = 1 ثانية؛ ارتفاع القراءة = 4.5 مم). انقر فوق موافق.
- تظهر نافذة تخطيط اللوحة جاهزة للتشغيل. تحقق من مربع استخدام الغطاء في نافذة لوحة التحميل ، وانقر فوق موافق.
- ضع لوحة 96 بئرا في الجهاز لقراءة قيم التلألؤ.
8. توليد التلألؤ مقابل منحنى قياسي قابل للتطبيق لكل سلالة بكتيرية
ملاحظة: استزراع وتعداد جميع سلالات المكورات العنقودية الذهبية وفقا للمنهجية الموضحة في القسم 6.
- تحضير معلقات بكتيرية مخففة بشكل متسلسل لتكون بمثابة معايير.
- تعداد المعلق البكتيري الذي ينمو طوال الليل عن طريق قياس التعكر طيفيا.
- جهاز طرد مركزي عند 6000 × جم لمدة 5 دقائق لتكوير البكتيريا ، وإعادة تعليق الحبيبات في MHB المعقم لضبط التركيز على 1 × 109 CFU / mL.
- قم بتخفيف 100 ميكرولتر من التعليق الأنيق باستخدام 900 ميكرولتر من MHB ، وقم بإجراء تخفيف تسلسلي 10 أضعاف للوصول إلى 1 × 101 CFU / mL.
- قم بإجراء مقايسة التلألؤ على المعلقات البكتيرية المحضرة كما هو موضح في القسم 7.
- استخدم MHB المعقم كعنصر تحكم فارغ للتجربة، واطرح قيمة التلألؤ الفارغة من قيم تلألؤ عينة الاختبار.
- ارسم السجل (CFU) مقابل السجل (التلألؤ) لإنشاء منحنى قياسي. سجل المعادلة وقيمة R2 .
- حدد CFU / mL المقابلة لقيم التلألؤ باستخدام المعادلة الخاصة بالإجهاد طوال فترة الدراسة.
9. إعداد دراسة النشاط المضاد للبكتيريا يعتمد على الوقت
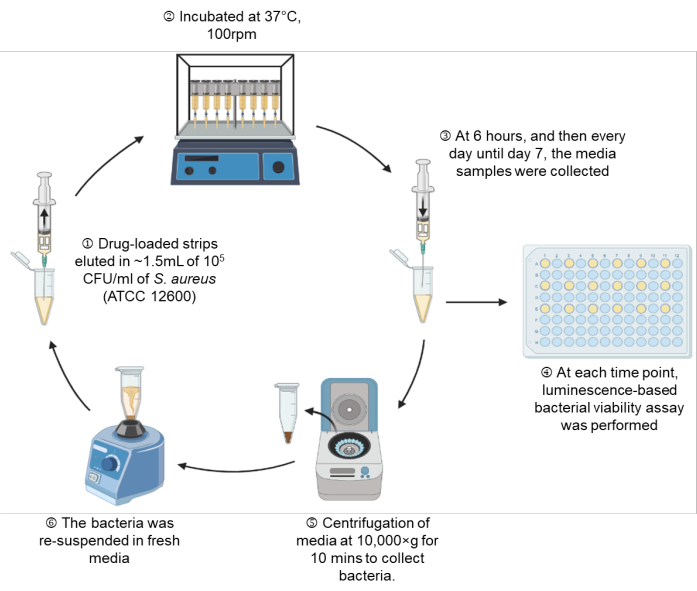
الشكل 1: تمثيل تخطيطي للإعداد التجريبي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
- استزرع البكتيريا بين عشية وضحاها في 1 مل من مرق TSB.
- قم بتخفيف المعلق البكتيري المزروع طوال الليل إلى 105 CFU / mL في MHB المعقم (القسم 6) ، وتحقق من عدد البكتيريا القابلة للحياة باستخدام وحدات التلألؤ قبل بدء التجربة (القسم 7).
- ضع شرائط UHMWPE البكر وشرائط UHMWPE المحملة بالأدوية (3 مم × 5 مم × 10 مم ، نصف أبعاد الشرائط المعدة لدراسات الشطف في القسم 2) داخل حقنة 3 مل.
- ارسم MHB الذي يحتوي على 10 5 CFU / mL في المحقنة من خلال الإبرة المرفقة حتى علامة1.5 مل ، وهو ما يعادل 1.35 مل من MHB (الشكل 1: الخطوة 1).
- ضع إعداد المحقنة على حاضنة اهتزاز (100 دورة في الدقيقة) عند 37 درجة مئوية حتى النقاط الزمنية المحددة وهي 6 ساعات ، اليوم 1 ، اليوم 2 ، اليوم 3 ، اليوم 4 ، اليوم 5 ، اليوم 6 ، واليوم 7 (الشكل 1: الخطوة 2).
- في كل نقطة زمنية محددة ، أخرج إعداد المحقنة ، وقم بإجراء فحص الجدوى الميكروبية في الوقت الفعلي وفقا للقسم 7 على 100 ميكرولتر من المعلق البكتيري (الشكل 1: الخطوة 3-4).
- حدد عدد البكتيريا القابلة للحياة للنقاط الزمنية 6 ساعات واليوم 1 واليوم 2 واليوم 3 واليوم 7. حدد CFU / mL من وحدات التلألؤ باستخدام المنحنى القياسي المقابل.
- تحقق من عدم وجود بكتيريا قابلة للحياة في العينات التي أظهرت قيم تلألؤ أقل من حد الكشف عن طريق تنفيذ طريقة لوحة الانتشار على ألواح TSA والحضانة عند 35 درجة مئوية طوال الليل. تحقق من وجود مستعمرات في اليوم التالي.
- قم بطرد مركزي للتعليق البكتيري المتبقي عند 10000 × جم لمدة 10 دقائق ، وقم بشفط الوسائط المستهلكة برفق. بالنسبة للأنابيب التي لا يتم فيها ملاحظة الكريات بصريا بسبب النشاط المضاد للبكتيريا للأدوية ، اترك 100 ميكرولتر في الأنبوب لضمان عدم إزعاج الحبيبات غير المرئية (الشكل 1: الخطوة 5).
- أعد تعليق البكتيريا المحببة في MHB الطازج ، واسحب المعلق البكتيري إلى نفس إعداد المحقنة من خلال الإبرة المرفقة (الشكل 1: الخطوة 6).
10. القياس الكمي للبكتيريا الملتصقة على سطح UHMWPE
- استرجع أسطح UHMWPE البكر وأسطح UHMWPE المحملة بالأدوية من إعداد المحقنة بعد الانتهاء من الدراسة في اليوم 7.
- انقل الأسطح إلى أنابيب سعة 1.5 مل ، واشطفها ب 1 مل من برنامج تلفزيوني معقم (ثلاث مرات).
- قم بتنشيط السطح لمدة 40 دقيقة في 1 مل من برنامج تلفزيوني معقم. تحديد صلاحية البكتيريا الملتصقة عن طريق إجراء مقايسة التلألؤ على 100 ميكرولتر من العينة الصوتية ، كما هو موضح في القسم 7.
النتائج
بعد البروتوكول ، تم تشكيل UHMWPE مع الجنتاميسين والفانكومايسين بنسبة 7٪ وزن / وزن واستخلصه في الماء منزوع الأيونات. تم تحديد تركيز الدواء في eluent من المادة في 6 ساعات ، 1 يوم ، 2 أيام ، 3 أيام ، و 1 أسبوع. أظهر إطلاق الدواء من الفانكومايسين و UHMWPE المحمل بالجنتاميسين إطلاق انفجار عند 6 ساعات متبوعا بمعدل إطلاق ثابت مع تركيز إطلاق أكبر من الحد الأدنى للتركيز المثبط (MIC) حتى 7 أيام (الشكل 2 ، الجدول 2).
قبل الدراسة المضادة للبكتيريا ، تم إنشاء منحنى قياسي لربط وحدات التلألؤ ب CFU / mL للبكتيريا لكل سلالة S. aureus (ATCC 12600 و L1101 و L1163). تم رسم قيم اللوغاريتم (التلألؤ) المقابلة مقابل السجل (CFU / mL) لإنشاء منحنى قياسي (الشكل 3). كانت قيم R2 المحسوبة 0.997 و 0.996 و 0.994 ل ATCC 12600 و L1101 و L1163 على التوالي ، مما يشير إلى ملاءمة قوية لنطاق التركيز. تم استخدام المعادلة المشتقة لاحقا لحساب الصلاحية البكتيرية في جميع التجارب. أظهر ATCC 12600 و L1101 حدا للكشف في نطاق 1 × 102-1 × 103 CFU / mL. من ناحية أخرى ، تبين أن حد الكشف عن سلالة L1163 هو 1 × 104 CFU / mL.
تم إجراء اختبار النشاط المضاد للبكتيريا المعتمد على الوقت باستخدام 1 × 105 CFU / mL كلقاح أولي ل 12600 و L1163 و L1101 ، والتي تعرضت ل 7٪ وزن / وزن من المواد المحملة بالأدوية لمدة أسبوع واحد. في كل نقطة زمنية (6 ساعات ، 1 يوم ، 2 أيام ، 3 أيام ، 1 أسبوع) ، تم تحديث الوسط ، وتم إعادة تعليق السكان البكتيريين. استمر تعرض البكتيريا للإفراج اللاحق عن الأدوية من المادة حتى النقطة الزمنية التالية. أظهر UHMWPE مع 7٪ وزن / وزن فانكومايسين و UHMWPE مع 7٪ وزن / وزن جنتاميسين انخفاضا >3log ل ATCC 12600 الحساس بدءا من 6 ساعات ، ولوحظ الاستئصال الكامل (لا نمو مستعمرة) في نهاية 3 أيام (الشكل 4 أ). بالنسبة للسلالة L1163 الحساسة للجنتاميسين والفانكومايسين المتوسط ، تسببت كلتا المادتين المحملتين بالأدوية في انخفاض >3log في 6 ساعات ، ولوحظ الاستئصال التام (لا نمو مستعمرة) في اليوم الأول من التجربة (الشكل 4B). بالنسبة للسلالة L1101 المقاومة للجنتاميسين والفانكومايسين ، لم يؤثر شطف الجنتاميسين من UHMWPE على الصلاحية البكتيرية ل L1101 (الشكل 4C). تكاثرت البكتيريا ، واستقر السكان في غضون 6 ساعات في وجود UHMWPE البكر دون شطف المضادات الحيوية. في وجود UHMWPE المحملة بالجنتاميسين ، وصل السكان إلى مستوى نمو مماثل في اليوم 2. على العكس من ذلك ، فإن شطف الفانكومايسين من UHMWPE قلل بشكل كبير من صلاحية البكتيريا (>3log) عند 6 ساعات ، وتم إثبات فقدان الصلاحية الكاملة (عدم نمو المستعمرة) بحلول اليوم 4.
لم تظهر أسطح كل من UHMWPE المحملة بالجنتاميسين والفانكومايسين أي بكتيريا ملتصقة قابلة للحياة عند تعرضها لسلالات حساسة ومقاومة متوسطة بعد اليوم 7 أو الاستئصال الكامل ، أيهما جاء أولا. كانت بعض البكتيريا القابلة للحياة (1 × 105 CFU / mL) موجودة على UHMWPE المحمل بالجنتاميسين المعرضة ل L1101 المقاوم للجنتاميسين. وبالمثل ، تم استرداد ما يقرب من 1 × 10 5 CFU / mL من البكتيريا الملتصقة القابلة للحياة من PE البكر الضابط (الشكل 5).
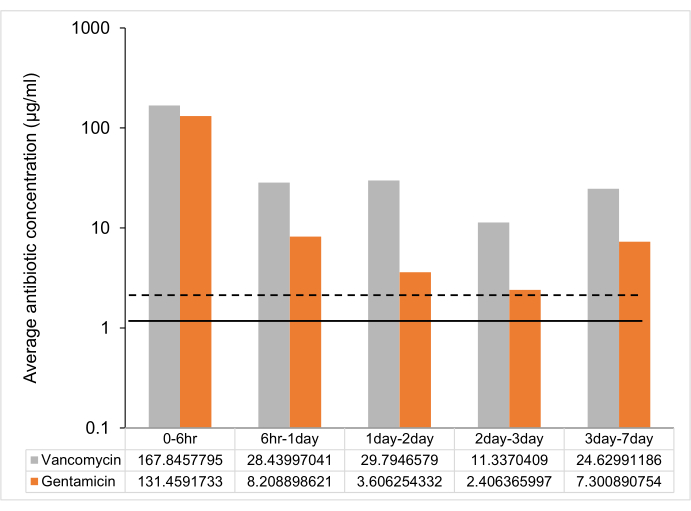
الشكل 2: متوسط إطلاق المضادات الحيوية المعتمد على الوقت من 7٪ وزن / وزن شريط UHMWPE المحمل بالمضادات الحيوية. متوسط إطلاق المضادات الحيوية بين النقاط الزمنية من شريط UHMWPE محمل بالجنتاميسين والفانكومايسين بنسبة 7٪ (3 مم 3 × 5 مم 3 × 10 مم3 ~ 2 سم2 مساحة السطح). يظهر الميكروفون ضد سلالة التحكم ATCC 12600 كخط منقط للجنتاميسين وخط صلب للفانكومايسين. تمثل أشرطة الخطأ الانحراف المعياري للمتوسط من ستة مكررات (n = 6). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
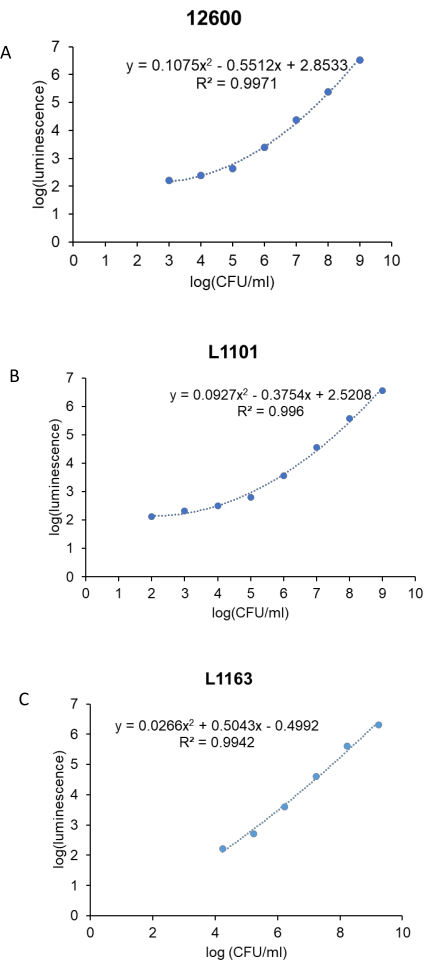
الشكل 3: المنحنى القياسي لمقايسة الإنارة في الوقت الفعلي لجميع سلالات المكورات العنقودية الذهبية . تم رسم السجل (التلألؤ) مقابل السجل (CFU / mL) لإنشاء منحنيات قياسية للتحكم ، (A) ATCC 12600 ، والسلالات السريرية ، (B) L1101 و (C) L1163. يشار إلى المعادلات التي تصف خط أفضل ملاءمة وقيم R2 المقابلة على المؤامرات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
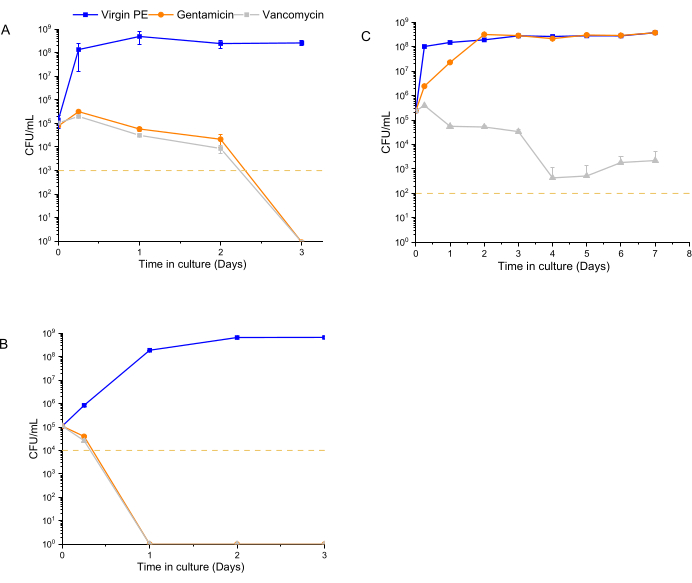
الشكل 4: تحديد الصلاحية البكتيرية باستخدام مقايسة الإنارة ل 7٪ وزن / وزن جنتاميسين و 7٪ وزن / وزن فانكومايسين UHMWPE. يظهر النشاط المضاد للبكتيريا المعتمد على الوقت للجنتاميسين والفانكومايسين المستخلصين من UHMWPE ضد سلالات التحكم ، (A) ATCC 12600 ، والسلالات السريرية ، (B) L1163 و (C) L1101. خدم Virgin 1020 PE كعنصر تحكم للتجربة. يشير الخط الأصفر في المخططات إلى حد الكشف عن سلالة S. aureus المعنية. يتم عرض البيانات كمتوسط ± الانحراف المعياري (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
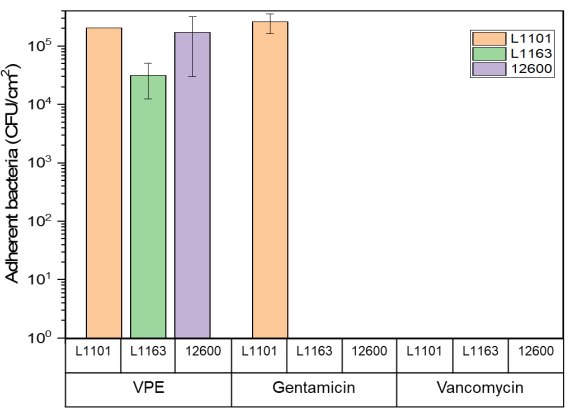
الشكل 5: يتم تحديد صلاحية البكتيريا الملتصقة باستخدام مقايسة Glo المضاءة ل 7٪ وزن / وزن محملة بالجنتاميسين و 7٪ وزن / وزن UHMWPE المحملة بالفانكومايسين ضد جميع سلالات S. aureus. يشير الرسم البياني الشريطي إلى البكتيريا الملتصقة (CFU) المستردة لكل سنتيمتر مربع (سم2) من 7٪ محملة بالجنتاميسين و 7٪ UHMWPE محملة بالفانكومايسين في نهاية فترة الدراسة لجميع السلالات التي تم اختبارها. تظهر الأشرطة البيانات كمتوسط ± الانحراف المعياري (n = 3). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| النقاط الزمنية | فانكومايسين | الجنتاميسين |
| تركيز الذروة (ميكروغرام / مل) | تركيز الذروة (ميكروغرام / مل) | |
| 0 - 6 ساعات | 336 ± 72 | 263 ± 24 |
| 6 ساعات -1 يوم | 57 ± 18 | 16 ± 2 |
| 1 يوم - 2 يوم | 60 ± 18 | 7 ± 1 |
| 2 يوم - 3 يوم | 23 ± 6 | 5 ± 0.4 |
| 3 أيام - 7 أيام | 49 ± 20 | 15 ± 1 |
الجدول 2: ذروة تركيز الدواء (ميكروغرام/مل) في نقاط زمنية مختلفة. يتم عرض البيانات كمتوسط ± الانحراف المعياري (n = 6).
الشكل التكميلي 2: اضمحلال إشارة التلألؤ خلال فترة 10 دقائق من إضافة كاشف الفحص إلى العينة. يظهر فرق ±5٪ في الإشارة كخط منقط الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يعد الإيصال الموضعي المستمر للمضادات الحيوية أداة ضرورية في إدارة التهابات المفاصل حول الأطراف الاصطناعية. المضادات الحيوية الجهازية هي الاستراتيجية الأساسية في القضاء على العدوى البكتيرية ، ويستخدم الشطف الموضعي كأداة تكميلية لمنع نمو واستعمار أي بكتيريا متبقية بعد إزالة الزرع وتنضير الأنسجة. الهدف من المنطقة الفعالة تحت المنحنى (التركيز على مدى فترة) للمضادات الحيوية مع الإدارة المحلية غير مفهوم جيدا. يمكن قياس شطف المضادات الحيوية من هذه الأجهزة طوليا في المختبر ؛ ومع ذلك ، لتحديد القيمة الانتقالية لملفات تعريف التركيز هذه ، هناك حاجة إلى طريقة قوية في المختبر لتقييم النشاط المضاد للبكتيريا. في هذه الورقة ، تم وصف إحدى هذه الطرق في الوقت الفعلي لتحديد النشاط المضاد للبكتيريا ل UHMWPE المحملة بالأدوية لاستخدامها كجهاز توصيل مستدام في استبدال المفاصل.
تعد المراقبة في الوقت الفعلي لصلاحية البكتيريا معلمة حاسمة للاهتمام ، وتفتقر الطرق الميكروبيولوجية التقليدية إلى الإطار لاستيعاب هذا الجانب المحدد من الدراسة. تم تطوير مقايسة الجدوى الميكروبية المستخدمة في هذه الدراسة لتحديد كمية البكتيريا القابلة للحياة عن طريق قياس التلألؤ المقابل للأدينوسين ثلاثي الفوسفات (ATP). للتحقيق المباشر في النشاط المعتمد على الوقت للمضادات الحيوية المستخلصة من مواد الزرع ، تم تحضين ثلاث سلالات مختلفة ذات ملامح مميزة للحساسية للمضادات الحيوية. كان الأساس المنطقي لاستخدام السلالات المختبرية والسريرية ذات المقاومة المتفاوتة للجنتاميسين والفانكومايسين هو فهم نطاق النشاط لتركيبة زرع معينة. علاوة على ذلك ، يعتمد النشاط المضاد للبكتيريا وفعاليته ضد هذه المجموعات المتميزة على توقيت الإعطاء. تركز الطريقة على جدوى الوقاية من هذه السلالات بناء على >70٪ من التهابات المفاصل المحيطة بالأطراف الصناعية التي تسببها تلوث الجرح في وقت الجراحة24.
كلقاح أولي لتطوير هذه الطريقة ، تم استخدام 1 × 105 CFU / mL. تم استخدام تركيزات ملوثة مختلفة للنماذج الحيوانية على الرغم من عدم معرفة الكثير عن حمل العدوى ذات الصلة سريريا ل PJI. تم إنشاء نماذج العدوى الحيوانية ل PJI بشكل روتيني باستخدام 1 × 105 CFU ، ويستخدم نطاق مماثل على نطاق واسع في الطرق الموحدة (CLSI) لتحديد النشاط المضاد للبكتيريا25،26،27. سمح لنا استخدام 1 × 105 CFU / mL كتركيز تلوث أولي بتقييم كل من معلمات النمو والاستئصال في نفس الوقت.
تقليديا ، يتم تحديد قيم MIC لتركيز مضاد حيوي ثابت لعدد معين من البكتيريا ، وتفشل في إثبات معدل العمل المضاد للبكتيريا. وبسبب هذا الجانب، لا توفر قيم MIC تمايزا كميا لوصف موجز النشاط المضاد للميكروبات28. تؤكد البيانات من الطريقة الحالية على ميزة تقييم حركية القتل المعتمدة على الإجهاد للمضادات الحيوية بدلا من استخدام MIC لاتخاذ قرارات الجرعات. باستخدام هذه الطريقة ، كان من الممكن التمييز بين كل من المدى والمعدل الذي أثرت به مواد الزرع على السلالات المختلفة. كان الجنتاميسين المستخلصة من شرائط المواد المزروعة فعالا في القضاء على L1163 في يوم واحد والقضاء على ATCC 12600 في 2-3 أيام ، لكنه لم يكن فعالا في القضاء على L1101 (الشكل 4). بالإضافة إلى النقص المتوقع في نشاط شطف الجنتاميسين ضد L1101 (MIC >32 ميكروغرام / مل) بسبب مقاومته المتأصلة للجنتاميسين (الشكل 4C) ، لوحظ استمرار المجموعات الفرعية عند التعرض للفانكومايسين ، والذي يظهر L1101 مقاومة متوسطة له. في المقابل ، تم القضاء على L1163 نهائيا في وجود UHMWPE المحمل بالفانكومايسين على الرغم من إظهار مقاومة متوسطة مماثلة للفانكومايسين مثل L1101 (لوحظ ميكروفون 8 ميكروغرام / مل لكلا السلالتين).
كانت الملاحظات التي تشير إلى أن معدل نشاط الجنتاميسين ضد 12600 و L1163 ، وهما معرضان للجنتاميسين مع قيم MIC مماثلة (لوحظ MIC قدره 1 ميكروغرام / مل لكلا السلالتين) ، وكذلك أن مدى نشاط الفانكومايسين ضد L1101 و L1163 المقاومين المتوسطين كان مختلفا (الشكل 4 أ ، ب) ، الفرضية القائلة بأن هذه الطريقة في الوقت الفعلي في وجود المادة المحملة يمكن أن تميز الاختلافات الطولية في النشاط.
بالإضافة إلى القيمة الانتقالية للنتائج في تفسير مدى فعالية تركيز معين ضد هذه البكتيريا ، هناك العديد من المزايا المنهجية التجريبية. (1) يتم تحديد تركيز البكتيريا على الفور في وقت معين ، على عكس الطرق التقليدية التي يتم فيها تحضين البكتيريا في المرق أو على أجار لمدة 18-24 ساعة لتحديد الصلاحية. يمكن أن توفر فترة النمو هذه وقتا إضافيا للبكتيريا للتعافي من إجهاد المضادات الحيوية ، مما يؤدي إلى مصدر إضافي محتمل للخطأ / التباين. (2) يتم استبدال الوسائط باستمرار مع الاحتفاظ بالبكتيريا ، والتي تشبه إلى حد كبير في ظروف الجسم الحي أكثر من الظروف الثابتة. (3) يتضمن هذا الفحص بطبيعته حركية إطلاق الدواء من الغرسة ، مما يسمح بالتنبؤ بالأداء بشكل أفضل. (4) تم تطوير الطريقة باستخدام المواد الاستهلاكية المتاحة بشكل شائع دون الحاجة إلى أي آلات محددة أو باهظة الثمن.
من الضروري وجود طرق اختبار قوية في المختبر لتقييم تطبيقات توصيل الأدوية قبل الشروع في الدراسات على الحيوانات في الجسم الحي والتجارب السريرية. يمكن تعديل هذا الفحص وتكييفه لاستيعاب مختلف الأساليب ومنصات توصيل الأدوية مثل الجسيمات والمواد الهلامية والأفلام وغيرها من المواد المحملة بالأدوية لتحديد كفاءة القضاء على البكتيريا في محاكاة في إعداد المختبر. يمكن إجراء تعديلات لإعداد العينة عن طريق التغيير إلى بيئة متوسطة مناسبة في المختبر ، والتي ثبت أنها تؤثر على نشاط العديد من المضادات الحيوية29,30.
تسهل هذه الطريقة أيضا تحديد البكتيريا الملتصقة القابلة للحياة ، وهو أمر واعد ، حيث أن الطرق التقليدية لتحديد الحد الأدنى من تركيز استئصال الأغشية الحيوية تستغرق وقتا طويلا وتقدم نتائج غير متسقة. ومع ذلك ، يجب اختبار الطريقة بدقة على الأغشية الحيوية لتطوير منهجية موثوقة وقوية لتحديد حساسيتها. يمكن أن تكون طريقة الإنارة القائمة على ATP حساسة بما يكفي للكشف عن أشكال قابلة للحياة من البكتيريا في الأغشية الحيوية بما في ذلك المثبتات ، والتي قد يتم اكتشافها أو لا يتم اكتشافها على صفيحة أجار كمستعمرات مرئية. مجتمعة ، تتمتع هذه المنصة متعددة الاستخدامات بالقدرة على دمج المعلمات ذات الصلة لتسجيل الملاحظات في الوقت الفعلي على النشاط المضاد للبكتيريا ومضاد الأغشية الحيوية للأدوية ذات الأهمية.
تخضع فعالية هذه الطريقة للجوانب التالية:
خصائص الشطف المحددة مسبقا وحجم العينة
يمكن تحديد ملف تعريف الشطف للمادة المحملة بالمضادات الحيوية في تجربة منفصلة قبل قياس النشاط المضاد للبكتيريا هذا بحيث يمكن تحديد كمية المواد المطلوبة لإجراء التجربة بنشاط في غضون فترة زمنية محددة.
تحديد الحاوية والحجم
من المهم ابتكار إعداد يمكن أن يستوعب فيه حجم وسائط التجربة كامل مساحة سطح نفس المادة ولضمان حجم كاف لإطلاق الدواء دون عائق من السطح المحمل بالدواء. استند الإعداد المستخدم إلى التجارب السابقة ، مما يضمن ظروف "الحوض المثالي" لهذه الأدوية المحبة للماء بحيث لا يعوق انتشارها قيود الذوبان.
خصائص وسائط النمو
يجب التحقق من اختيار وسائط النمو لضمان الاستقرار والأداء الأمثل للدواء (الأدوية) المختارة29. تم استخدام مرق مولر هينتون المعدل بالكاتيون (CAMHB) ، والذي يستخدم على نطاق واسع في طريقة تخفيف المرق ، لتحديد MIC للمضادات الحيوية المعروفة. يتيح الوسط النشاط الدوائي الأمثل دون تدخل تراكم الأيض الثانوي السام31. تم اختبار كاشف الفحص والإبلاغ عن استقراره في أنواع مختلفة من الوسائط ، بما في ذلك تلك التي تحتوي على مكونات المصل23,28. على الرغم من أن قيم وحدة التلألؤ النسبية قد تختلف عبر الوسائط المختلفة ، فقد ثبت أن مكونات الوسائط لا تتداخل مع الفحص32,33. تم تحسين الحجم التجريبي إلى 1.5 مل ، وهو قريب من حجم السائل الزليلي الموجود في مساحة مفصل الركبةالبالغ 34.
استقرار درجة الحرارة للفحص
يجب إجراء معالجة وإضافة كاشف الإنارة إلى الفحص بطريقة متسقة عبر التجارب. التغيرات في درجات الحرارة تغير حساسية الفحص ، لذلك من المهم احتضان الكاشف في درجة حرارة الغرفة لمدة 2 ساعة قبل إضافته إلى البكتيريا23.
وقت حضانة الكاشف
يتحلل التلألؤ من الكاشف مع مرور الوقت. يبلغ عمر النصف لإشارة الإنارة أكثر من 30 دقيقة ، وهو ما يعتمد إلى حد كبير على الوسط ونوع البكتيريا المستخدمة في التجربة23. بالإضافة إلى ذلك ، فإن أي اختلافات في وقت الحضانة (أي الوقت بين إضافة الكاشف إلى البكتيريا وقراءة التلألؤ) ستؤدي إلى قراءات غير متسقة لنفس تركيز البكتيريا. لوحظ اختلاف بنسبة 5٪ في إشارة الإنارة عند التقاطها في غضون 1 دقيقة بعد وقت الحضانة لمدة 5 دقائق وفقا لتعليمات الشركة الصانعة (الشكل التكميلي 2). مع أخذ هذه البيانات في الاعتبار ، تم تسجيل قراءات التلألؤ في غضون 1 دقيقة طوال فترة الدراسة للتأكد من أن فقدان الإشارة لم يكن أكثر من 5٪. علاوة على ذلك ، من المهم الحد من عدد العينات لكل لوحة لتقليل الخطأ الناتج عن تحلل التلألؤ من البئر الأول إلى البئر الأخير.
الحفاظ على السكان البكتيرية طوال فترة الدراسة
حاولت الطريقة نمذجة إزالة الدواء ودوران الحجم الزليلي من خلال الفصل المستمر للوسائط المستهلكة عن السكان البكتيريين في كل نقطة زمنية باستخدام الطرد المركزي عالي السرعة عند 10000 × جم لمدة 10 دقائق35. تضمن هذه الخطوة الحاسمة ترسيب جميع الخلايا البكتيرية القابلة للحياة وغير القابلة للحياة. علاوة على ذلك ، يتم إعادة تشكيل البكتيريا المترسبة بشكل موحد في MHB الطازج ونقلها إلى إعداد المحقنة ، مما يسهل الترحيل الكامل للميكروبات المصابة إلى الإعداد التجريبي. تعتمد قابلية استنساخ وموثوقية هذه الطريقة بشكل كبير على محاكاة التعرض المستمر للمضادات الحيوية للميكروبات المشتقة من اللقاح الأولي.
أحد القيود الرئيسية لهذه الطريقة هو أنها مقايسة شبه ثابتة لا تحاكي بدقة نصف عمر الدواء ودوران الزليلي المستمر. ومع ذلك ، فإن الاستبدال المتوسط المستمر يعوض جزئيا عن هذا القيد. كانت حساسية مقايسة الجدوى الميكروبية تعتمد على الإجهاد ، وتتراوح من 1 × 102-1 × 104 CFU / مل ، مما يحد من قدرة الكشف. علاوة على ذلك ، يجب رسم منحنى قياسي لكل كائن حي لأن نوع الإجهاد يساهم في حساسية وأداء الكاشف المضيء. قد تتأثر كل من ديناميكيات نمو البكتيريا ونشاط مركب الدواء المستخدم بالمكونات المتوسطة ، والتي يجب إجراء مزيد من التحقيق فيها.
Disclosures
يتلقى المؤلف الرئيسي (E.O.) الإتاوات الناشئة عن ترخيص الملكية الفكرية للشركات التالية: Corin و Iconacy و Renovis و Arthrex و ConforMIS و Meril Healthcare و Exactech. لا يوجد تضارب في المصالح مع أي من الدراسات المقدمة هنا.
Acknowledgements
تم تمويل هذا العمل جزئيا من قبل منحة المعاهد الوطنية للصحة رقم AR077023 (R01) ومختبر هاريس لجراحة العظام. يشكر المؤلفون الدكتورة كيري لابلانتي وفريقها في جامعة رود آيلاند على توفير السلالات السريرية L1101 و L1163.
Materials
| Name | Company | Catalog Number | Comments |
| 96 well plates - polystyrene, High Bind, white flat bottom wells, non-sterile, white, 100/cs | Corning, NY, USA | CLS3922-100EA | |
| 2-mercaptoethanol | Sigma Aldrich, Germany | ||
| ATCC 12600 | American Type culture Collection, VA, USA | ||
| BacTiter-Glo Microbial Cell Viability Assay | Promega Corporation, USA | G8231 | |
| BD Bacto Tryptic Soy Broth (Soybean-Casein Digest Medium) | Becton-Dickinson, USA | BD 211825 | purchased from Fisher Scientific, USA |
| BD Luer-Lok Syringe sterile, single use, 3 mL | BD, USA | 309657 | |
| BD Needle 5/8 in. single use, sterile, 25 G | BD, USA | 305122 | |
| BD BBL Dehydrated Culture Media: Mueller Hinton II Broth (Cation-Adjusted) | Becton-Dickinson, USA | B12322 | purchased from Fisher Scientific, USA |
| BD Difco Dehydrated Culture Media: Tryptic Soy Agar (Soybean-Casein Digest Agar) | Becton-Dickinson, USA | DF0369-17-6 | purchased from Fisher Scientific, USA |
| Boric Acid | Fisher Chemical, NJ, USA | ||
| Branson 1800 ultrasonic bath | Emerson, MO, USA | ||
| Corning Falcon Bacteriological Petri Dishes with Lid | Fisher Scientific, USA | 08-757-100D | |
| Gentamicin Sulfate | Fujian Fukang Pharmaceutical Co., Fuzhou, China | ||
| Greiner UV-Star 96 well plates | Sigma Aldrich, Germany | M3812-40EA | |
| Hydraulic press | Carver, Inc. Wabash, IN, USA | ||
| L1101 | Clinical strain from Dr Kerry Laplante, University of Rhode Island | ||
| L1163 | Clinical strain from Dr Kerry Laplante, University of Rhode Island | ||
| LSE benchtop shaking incubator | Corning, NY, USA | ||
| Methanol, Optima for HPLC, Fisher Chemical | Fisher Scientific, NJ, USA | A454-1 | |
| Napco CO2 6000 | Thermo Scientific, MA, USA | ||
| PBS, Phosphate Buffered Saline, 1X Solution, pH 7.4, Fisher BioReagents | Fisher Scientific, USA | BP24384 | |
| Phthaldiadehyde ≥97% (HPLC) | Sigma Aldrich, Germany | P1378-5g | |
| Plate reader (Synergy H1 | Biotek, VT, USA | ||
| press | Carver, Inc. Wabash, IN, USA | ||
| shaker Innova 2100 | New Brunswick Scientific, NJ, USA | ||
| ShopBot D2418 | ShopBot Tools, Inc., NC, USA | ||
| Sodium Hydroxide | Sigma Aldrich, Germany | ||
| Thermo Scientific Reagent Grade Deionized Water | Fisher Scientific, USA | 23-751628 | |
| UHMWPE | GUR1020, Celanese, TX, USA | ||
| Vancomycin Hydrochloride | Fagron, The Netherlands | 804148 | |
| WAB Turbula | WAB Turbula, Switzerland |
References
- Hunter, D. J., March, L., Chew, M. Osteoarthritis in 2020 and beyond: A Lancet Commission. Lancet. 396 (10264), 1711-1712 (2020).
- Sloan, M., Premkumar, A., Sheth, N. P. Projected volume of primary total joint arthroplasty in the U.S., 2014 to 2030. The Journal of Bone and Joint Surgery. American Volume. 100 (17), 1455-1460 (2018).
- Gao, J., Xing, D., Dong, S., Lin, J. The primary total knee arthroplasty: A global analysis. Journal of Orthopaedic Surgery and Research. 15 (1), 190 (2020).
- . UpToDate. Prosthetic joint infection: Treatment Available from: https://www.uptodate.com/contents/prosthetic-joint-infection-treatment (2022)
- Dapunt, U., Radzuweit-Mihaljevic, S., Lehner, B., Haensch, G. M., Ewerbeck, V. Bacterial infection and implant loosening in hip and knee arthroplasty: Evaluation of 209 cases. Materials. 9 (11), 871 (2016).
- Kamath, A. F., et al. Quantifying the burden of revision total joint arthroplasty for periprosthetic infection. The Journal of Arthroplasty. 30 (9), 1492-1497 (2015).
- Tande, A. J., Patel, R. Prosthetic joint infection. Clinical Microbiology Reviews. 27 (2), 302-345 (2014).
- Davidson, D. J., Spratt, D., Liddle, A. D. Implant materials and prosthetic joint infection: The battle with the biofilm. EFORT Open Reviews. 4 (11), 633-639 (2019).
- de Vor, L., Rooijakkers, S. H. M., van Strijp, J. A. G. Staphylococci evade the innate immune response by disarming neutrophils and forming biofilms. FEBS Letters. 594 (16), 2556-2569 (2020).
- Dapunt, U., Giese, T., Stegmaier, S., Moghaddam, A., Hänsch, G. M. The osteoblast as an inflammatory cell: Production of cytokines in response to bacteria and components of bacterial biofilms. BMC Musculoskeletal Disorders. 17, 243 (2016).
- González, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023 (2018).
- Dapunt, U., Giese, T., Prior, B., Gaida, M. M., Hänsch, G. M. Infectious versus non-infectious loosening of implants: activation of T lymphocytes differentiates between the two entities. International Orthopaedics. 38 (6), 1291-1296 (2014).
- Tai, D. B. G., Patel, R., Abdel, M. P., Berbari, E. F., Tande, A. J. Microbiology of hip and knee periprosthetic joint infections: A database study. Clinical Microbiology and Infection. 28 (2), 255-259 (2022).
- Foster, T. J. Antibiotic resistance in Staphylococcus aureus. Current status and future prospects. FEMS Microbiology Reviews. 41 (3), 430-449 (2017).
- Kranjec, C., et al. Staphylococcal biofilms: challenges and novel therapeutic perspectives. Antibiotics. 10 (2), 131 (2021).
- Kahl, B. C., Becker, K., Löffler, B. Clinical significance and pathogenesis of staphylococcal small colony variants in persistent infections. Clinical Microbiology Reviews. 29 (2), 401-427 (2016).
- Li, C., Renz, N., Trampuz, A. Management of periprosthetic joint infection. Hip & Pelvis. 30 (3), 138-146 (2018).
- Davis, J. S., et al. Predictors of treatment success after periprosthetic joint infection: 24-month follow up from a multicenter prospective observational cohort study of 653 patients. Open Forum Infectious Diseases. 9 (3), (2022).
- Suhardi, V. J., et al. A fully functional drug-eluting joint implant. Nature Biomedical Engineering. 1, 0080 (2017).
- Gil, D., Grindy, S., Muratoglu, O., Bedair, H., Oral, E. Antimicrobial effect of anesthetic-eluting ultra-high molecular weight polyethylene for post-arthroplasty antibacterial prophylaxis. Journal of Orthopaedic Research. 37 (4), 981-990 (2019).
- Robu, A., et al. Additives imparting antimicrobial properties to acrylic bone cements. Materials. 14 (22), 7031 (2021).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis. 6 (2), 71-79 (2016).
- BacTiter-Glo microbial cell viability assay instructions for use of products G8230, G8231, G8232 and G8233. <101/bactiter-glo-microbial-cell-viability-assay-protocol. Promega Corporation Available from: https://www.promega.com/resources/protocols/technical-bulletins/101/bactiter-glo-microbial-cell-viability-assay-protocol/ (2022)
- Izakovicova, P., Borens, O., Trampuz, A. Periprosthetic joint infection: Current concepts and outlook. EFORT Open Reviews. 4 (7), 482-494 (2019).
- López-Torres, I. I., Sanz-Ruíz, P., Navarro-García, F., León-Román, V. E., Vaquero-Martín, J. Experimental reproduction of periprosthetic joint infection: Developing a representative animal model. The Knee. 27 (3), 1106-1112 (2020).
- Carli, A. v., et al. Quantification of peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. The Journal of Bone and Joint Surgery. American Volume. 99 (6), 25 (2017).
- Humphries, R. M., et al. CLSI Methods Development and Standardization Working Group best practices for evaluation of antimicrobial susceptibility tests. Journal of Clinical Microbiology. 56 (4), 01934 (2018).
- Mueller, M., de la Peña, A., Derendorf, H. Issues in pharmacokinetics and pharmacodynamics of anti-infective agents: Kill curves versus MIC. Antimicrobial Agents and Chemotherapy. 48 (2), 369-377 (2004).
- Wijesinghe, G., et al. Influence of laboratory culture media on in vitro growth, adhesion, and biofilm formation of Pseudomonas aeruginosa and Staphylococcus aureus. Medical Principles and Practice. 28 (1), 28-35 (2019).
- Steixner, S. J. M., et al. Influence of nutrient media compared to human synovial fluid on the antibiotic susceptibility and biofilm gene expression of coagulase-negative Staphylococci In vitro. Antibiotics. 10 (7), 790 (2021).
- Sigma Aldrich. Mueller Hinton Broth (M-H Broth). Sigma Aldrich. , 70192 (2018).
- Thiriard, A., Raze, D., Locht, C. Development and standardization of a high-throughput Bordetella pertussis growth-inhibition assay. Frontiers in Microbiology. 11, 777 (2020).
- Clow, F., O'Hanlon, C. J., Christodoulides, M., Radcliff, F. J. Feasibility of using a luminescence-based method to determine serum bactericidal activity against Neisseria gonorrhoeae. Vaccines. 7 (4), 191 (2019).
- Kraus, V. B., Stabler, T. v., Kong, S. Y., Varju, G., McDaniel, G. Measurement of synovial fluid volume using urea. Osteoarthritis and Cartilage. 15 (10), 1217-1220 (2007).
- Gonçalves, F. D. A., de Carvalho, C. C. C. R. Phenotypic modifications in Staphylococcus aureus cells exposed to high concentrations of vancomycin and teicoplanin. Frontiers in Microbiology. 7, 13 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved