Method Article
약물 용출 물질의 종방향 항균 활성을 측정하는 새로운 방법
요약
여기서는 상업적으로 이용 가능한 실시간 ATP 기반 발광 미생물 생존도 분석을 사용하여 예방적 임상 적용을 시뮬레이션하기 위해 항생제 용출 고분자의 항균 효능을 평가하는 프로토콜을 제시합니다. 이 방법을 사용하면 약물 용출 물질의 종적 활성을 모니터링할 수 있으며 항균 약물 전달 플랫폼을 테스트하는 데 널리 적용할 수 있습니다.
초록
초고분자량 폴리에틸렌(UHMWPE)은 하중을 지지하는 표면으로 전체 관절 성형술에 널리 사용됩니다. 대부분이 관절 치환술 직후에 발생하는 인공 삽입물 주위 관절 감염은 전체 무릎 재수술의 거의 25%를 차지하며 세균 감염의 완전한 근절은 큰 도전 과제입니다. 이 문제를 해결하는 유망한 방법은 일상적인 전신 항생제 예방을 지원하기 위해 박테리아를 억제하기에 충분한 항생제 농도의 국소 지속적인 전달을 보장하는 것입니다. 효율적인 국소 약물 전달 장치 개발에 대한 연구가 증가하고 있습니다. 약물에 대한 확립된 항균 테스트 방법을 사용하여 약물 용출 물질의 항균 효능을 테스트할 수 있지만, 이러한 장치에서 항생제의 용출 프로파일과 상관관계를 가질 수 있는 실시간 및 종단적 항균 효능 데이터를 제공하는 측면에서는 부족합니다. 여기에서 우리는 항생제 용출 UHMWPE 임플란트의 항균 효능을 결정하기 위한 직접적이고 다양한 방법론을 보고합니다. 이 방법론은 긴 실험의 각 시점에서 박테리아 배양을 피하기 위한 플랫폼으로 사용할 수 있으며 다른 지역 약물 전달 장치에도 적용할 수 있습니다.
서문
골관절염은 전 세계 성인 5억 명을 괴롭히는 심각한 퇴행성 질환입니다1. 말기 관절염 치료의 황금 표준은 관절 전치환술로, 2030년까지 미국에서만 매년 200만 명 이상의 환자에게 시행될 것으로 예상되며, 전 세계 수요도 엄청나게 증가할 것으로 예상됩니다 3,4. 이 절차에는 관절의 관절 연골 표면을 금속/세라믹 및 고가교 초고분자량 폴리에틸렌(UHMWPE)으로 만든 하중 지지 합성 재료로 교체하는 것이 포함됩니다. 관절 전치환술은 관절염을 앓고 있는 환자의 삶의 질을 크게 향상시키지만5, 임플란트의 성능과 환자의 만족도를 위태롭게 하는 심각한 합병증은 삽입물 주위 관절 감염(periprosthetic joint infection, PJI)으로, 재수술의 15%-25%를 차지한다6. 대부분의 경우 감염의 원인은 수술 중 임플란트 부위의 미생물 오염으로 추정된다7. 오염 개체군은 임플란트와 조직 표면에서 팽창한다8. 숙주 면역계는 반응으로 촉발되지만, 오염된 유기체의 성장 속도와 생물막 형성은 면역 세포를 회피할 수 있게 하여 박테리아 9,10,11의 박멸 없이 사이토카인과 케모카인 폭풍을 증가시킬 수 있습니다. 이로 인한 뼈의 심부 감염은 임플란트의 고정과 성능뿐만 아니라 환자의 건강을 위태롭게 한다12.
황색포도상구균과 응고효소 음성 포도상구균은 피사리도박 중독의 주요 원인 유기체입니다13. 포도상 구균 감염의 중증도는 항생제에 대한 내성 증가, 생물막 형성 및 작은 콜로니 변이체로 지속되는 능력으로 인해 높습니다14,15,16. 임플란트 관련 감염은 임플란트 표면에 미생물이 부착되고 박테리아가 유해한 숙주 면역 인자와 효과적인 농도의 항생제를 피할 수 있도록 하는 복잡한 생물막 매트릭스의 형성으로 인해 발생합니다14,15,16. 종래의 치료 방법은 장기간 정맥 주사 및 경구 항생제 조합을 포함한다17. 이 접근법의 가장 큰 단점은 감염 부위에서 약물의 생체이용률이 낮고, 치료 기간 동안 지속적으로 박테리아를 박멸하기에 충분한 농도의 항생제를 투여하는 것이 어렵다는 점이며, 이는 종종 좋지 않은 결과를 초래한다18. 이러한 단점을 해결하기 위해, 완전한 기능을 갖춘 국소 약물 용출 UHMWPE 임플란트는 관절 공간으로 효과적인 농도의 항생제가 지속적으로 방출되도록 설계되었습니다19. 약물 용출 임플란트의 국소 용출은 임플란트 제거 및 조직의 괴사조직 제거 후 남아 있는 박테리아의 성장과 집락화를 방지하기 위한 보완 도구로 사용됩니다. 이 항생제 용출 UHMWPE의 시험관 내 항균 시험은 박테리아와 직접 물질을 배양하고 확산 플레이트 방법20,21에 의해 박테리아를 정량화함으로써 수행 될 수있다. 대안적으로, 용리액 배지의 분취량은 한천 디스크 확산 방법, 브로스 희석 방법 및 시간 사멸 테스트22와 같은 방법을 사용하여 박테리아에 대해 테스트할 수 있습니다. 이러한 모든 방법은 집락 계수 및 탁도 측정을 통해 분취량을 수집한 후 약 16-18시간 후에 성장 관찰에 의존합니다. 이러한 장치로부터의 항생제의 용출은 이러한 시험관 내 방법을 사용하여 종단적으로 정량화할 수 있습니다. 그러나 이러한 농도 프로파일의 번역 값을 결정하기 위해서는 항균 활성을 평가하기 위한 강력한 실시간 시험관 내 방법이 필요합니다.
본 연구에 사용된 미생물 생존율 분석은 루시페린-루시페라아제 기반 검출 기술을 이용하여 살아있는 박테리아 세포에서 방출되는 아데노신 삼인산(ATP)에 해당하는 발광을 측정하여 생존 가능한 박테리아의 정량화를 위해 개발되었습니다. 살아있는 세포의 에너지 통화인 ATP는 생리학적으로 생존 가능한 세포의 직접적인 지표 역할을 합니다. 시약은 세포 용해를 수행하여 생존 가능한 세포에서 ATP 분자를 방출한 다음 발광 형태로 검출합니다. 이러한 발광은 샘플(23) 내의 생존 가능한 박테리아 세포의 비율과 직접적인 상관관계를 갖는다. 이것은 그람 양성 및 그람 음성 미생물 모두를 사용하여 다양한 분석 설계 및 조건에 적용할 수 있는 실시간, 간단하고, 다재다능하고, 빠른 단일 시약 기반 분석입니다. 여기에서 우리는 미생물 생존력 분석(예: BacTiter Glo)을 기반으로 한 수정된 시간 사멸 분석을 사용하여 S. 아우레우스 의 실험실 및 임상 균주와 함께 배양된 항생제 용출 UHMWPE의 실시간 항균 활성을 결정하는 방법을 보고합니다. 방법론은 특정 임플란트 재료와 특정 정형외과 응용 프로그램으로 설명되지만, 이 방법은 임상 적용을 통해 다른 항생제 용출 전달 장치를 테스트하기 위한 플랫폼을 제공할 수 있습니다.
프로토콜
1. 시약의 제조
- Mueller-Hinton 브로스(MHB) 준비: 양이온 조절 MHB 22g을 탈이온수 1L에 녹입니다. 121°C 및 15lb 압력에서 20분 동안 매체를 오토클레이브하여 병의 뚜껑이 느슨하게 닫혀 있는지 확인합니다. 준비된 멸균 국물을 사용할 때까지 4 °C에서 보관하십시오.
- 트립신 대두 한천(TSA) 준비: TSA 분말 20g을 탈이온수 500mL에 녹입니다. 한천 혼합물을 121°C 및 15lb에서 20분 동안 오토클레이브합니다. 멸균 매체를 55°C 수조로 옮겨 용융된 한천의 온도를 낮춥니다. 식힌 준비된 한천을 멸균 페트리 접시(~15mL)에 붓고 굳힙니다. 응고된 한천 플레이트를 거꾸로 보관하여 결로를 방지하십시오.
- 트립신 콩 국물(TSB) 준비: TSB 분말 15g을 탈이온수 500mL에 녹입니다. 브로스 혼합물을 121°C 및 15lb에서 20분 동안 오토클레이브합니다. 준비된 멸균 국물을 사용할 때까지 4 °C에서 보관하십시오.
- 인산염 완충 식염수(PBS): 오토클레이브는 멸균 사용 전에 121°C 및 15lb에서 20분 동안 1x PBS를 상업적으로 구입했습니다.
- 미생물 생존력 분석 시약 준비: 분석 내용물을 실온으로 평형화합니다. 10 mL의 완충액을 동결건조된 발광 시약 분말과 혼합하고, 제조된 시약을 -20°C에서 1 mL 분취량으로 저장한다. 각 시점 전에 광과민성 시약을 해동하고 실온으로 가져옵니다.
- 겐타마이신 설페이트 원액: 80mg의 겐타마이신 설페이트(GS)를 1x PBS 10mL에 녹입니다. 약물 용액을 완전히 소용돌이쳐 8mg/mL GS 원액을 얻습니다.
- 반코마이신 염산염 원액: 반코마이신 염산염 분말 10mg을 탈이온수 10mL에 완전히 용해시켜 1mg/mL 원액을 얻습니다.
- 붕산 완충 용액: 24.7g(0.4M)의 붕산을 900mL의 탈이온수에 녹입니다. 10.4%(w/v) 수산화나트륨 용액으로 용액의 pH를 50로 조정합니다. 이 단계에 더 나아가 탈이온수를 첨가하여 1L로 만듭니다.
- O-프탈디알데히드 시약(OPA): 0.2g의 OPA를 메탄올 1mL에 녹입니다. OPA 용액에 0.4M 붕산 완충액(pH 10.4) 19mL를 추가합니다. 0.4 mL의 2- 메르 캅토 에탄올을 OPA- 붕산 혼합물에 첨가한다. 시약 바이알을 알루미늄 호일로 덮고 준비 후 최대 2-3일 동안 사용할 수 있도록 4°C에서 보관합니다.
주의 : 피부, 눈, 의복에 닿지 않게 주의하십시오. OPA 및 2 메르캅토 에탄올 시약의 취급은 적절한 개인 보호 장비를 착용하고 적절한 배기 환기가 가능한 흄 후드 아래에서만 수행해야합니다. 증기, 먼지 또는 에어로졸을 흡입하지 마십시오.
2. 처녀 및 약물 로딩 UHMWPE의 제조
- 겐타마이신 설페이트 및 반코마이신 하이드로클로라이드 분말을 각각 2 g (75 μm 공극 크기)으로 체로 치고, 진공 오븐 (<0.1 atm)에서 45°C에서 18-24시간 동안 탈수시킨다.
- 탈수된 약물을 7% w/w(항생제 1.12g + UHMWPE 14.88g)의 UHMWPE 분말과 기계식 혼합기를 사용하여 용기에 5분 동안 혼합합니다.
- 스테인리스 스틸 인서트 플레이트가 있는 알루미늄 청동 맞춤형 금형(85mm x 50mm)을 컨벡션 오븐에서 180°C로 1시간 동안 예열합니다. 프레스의 플래튼을 170°C로 예열합니다.
- 블렌딩된 분말을 몰드에 첨가하고, 10 MPa, 170°C에서 10분 동안 압축한 다음, 10 MPa에서 45분 동안 수냉 사이클을 수행하였다.
- 유압 프레스를 사용하여 프레스에서 성형된 UHMWPE 블록(~3.5mm)을 제거합니다.
- 컴퓨터 수치 제어(CNC)를 사용하여 블록의 상단 및 하단 표면을 밀링하여 표면의 불규칙성과 오염 물질을 제거합니다.
- CNC를 사용하여 블록을 3mm x 5mm x 20mm 스트립으로 자릅니다.
- 연구를 위한 대조군으로 설명된 것과 동일한 방법론을 사용하여 처녀 UHMWPE를 준비합니다(항생제 첨가 없이).
보충 그림 1 : UHMWPE 샘플 성형에 사용되는 금형 부품. (A) 스테인레스 스틸 인서트 플레이트; (b) 몰드 캐비티; (c) 플런저; (D) 백플레이트 이 파일을 다운로드하려면 여기를 클릭하십시오.
3. 약물 용출 UHMWPE의 용출 동역학 결정
- 3mm x 5mm x 20mm 스트립을 Luer 잠금 장치와 25G 바늘이 있는 3mL 주사기에 넣습니다.
- 주사기에 탈이온수를 채우고 주사기를 여러 번 뒤집어 스트립을 세척합니다.
- 주사기에 탈이온수를 최대 2mL 눈금까지 채웁니다.
- 실온에서 100rpm으로 셰이커에 주사기 설정을 놓습니다.
- 각 시점(6시간, 1일, 2일, 3일, 1주)에서 용리액을 2mL 바이알에 수집합니다.
- 각 시점에서 주사기에 탈이온수를 채우고 주사기를 뒤집어 스트립을 세척합니다. 용액을 버리고, 주사기를 탈이온수로 2 mL 눈금까지 채우고 다음 시점까지 실험을 계속한다.
4. 반코마이신 농도의 측정
- 280nm의 피크 흡수 파장에서 탈이온수에서 반코마이신 농도를 분광광도계로 검출합니다.
- UV 96웰 플레이트에 1mg/mL 원액 100μL를 추가하고 탈이온수 100μL를 사용하여 연속 희석하여 알려진 농도의 6가지 수준(1mg/mL - 0.03125mg/mL)을 얻어 알려진 농도 범위 표준물질을 준비합니다.
- 용리액 100μL를 UV-clear 96웰 플레이트로 옮기고 마이크로플레이트 리더를 사용하여 280nm에서 농도를 측정합니다.
- 해당 흡광도 값에 대해 알려진 약물 농도를 플로팅하여 검량선을 생성합니다. 검량선에 의해 생성된 선형 방정식을 사용하여 용리액에서 알 수 없는 약물 농도를 계산합니다.
- 농도에 용리액 부피(~1.7mL)를 곱하여 약물 질량을 측정합니다.
- 이전의 모든 시점에서 약물 방출을 합산하여 시점에서 누적 약물 방출(mg)을 계산합니다.
- 스트립의 표면적(3.5cm2)으로 약물 방출을 정규화하여 임플란트의 제곱센티미터당 누적 약물 방출을 결정한다.
5. OPA 태깅법에 의한 겐타마이신 농도의 측정 27
- OPA 분석을 수행하기 위해 GS 표준 용액을 준비합니다.
- 1μg/mL GS 용액 80mL를 원심분리기 튜브로 옮깁니다.
- 500 μL의 PBS를 5개의 원심분리기 튜브에 추가합니다.
- 이 튜브로 연속 희석을 수행하여 80μg/mL, 40μg/mL, 20μg/mL, 10μg/mL, 5μg/mL 및 2.5μg/mL의 GS 농도를 얻습니다. 이들은 분석을 위한 교정 솔루션 역할을 합니다.
- 투명한 96웰 플레이트에서 PBS 80μL를 웰 A-1에 추가하고 보정 용액 80μL를 웰 A-2 내지 A-7에 오름차순 농도로 추가합니다. 이것은 분석을 위한 내부 교정 역할을 합니다.
- 각 샘플 80μL을 빈 웰에 세 번 추가하여 동일한 96웰 플레이트에서 분석합니다. 웰 플레이트 당 샘플 수를 <50으로 제한하여 OPA 용액을 샘플에 추가하는 타이밍이 모든 샘플에 대해 거의 동일하고 증발을 방지하도록합니다.
- OPA 시약을 모든 표준물질 및 샘플 용액에 추가하십시오.
- 흄 후드에서 25mL 시약 저장소에 메탄올을 채웁니다.
- 메탄올 8mL와 준비된 OPA 용액 1mL를 두 번째 시약 저장소(섹션 1.8)에 추가합니다. 위아래로 피펫팅하여 용액을 완전히 혼합합니다.
- 멀티채널 100 μL 마이크로피펫을 사용하여 첫 번째 저장소의 메탄올 48 μL를 96웰 플레이트의 모든 시료 함유 웰에 추가합니다.
- 이 단계에 추가하여, 제2 저장소로부터 희석된 OPA 용액 72 μL를 96-웰 플레이트 내의 모든 샘플-함유 웰에 추가한다. 웰 플레이트를 실온에서 10분 동안 인큐베이션한다.
- 10분 배양 직후 마이크로플레이트 리더를 사용하여 형광 강도(여기 340 nm, 방출 455 nm)를 측정합니다.
- GS 농도가 알려진 용액에 대한 강도 판독값을 사용하여 검량선을 플로팅합니다. 선형 선을 추가하여 가장 적합한 선을 결정하고 해당 방정식을 생성합니다.
- 해당 흡광도 값에 대해 알려진 약물 농도를 표시하여 생성된 검량선에서 용리액의 약물 농도를 계산합니다.
- 농도에 용리액 부피(~1.7mL)를 곱하여 약물 질량을 계산합니다.
- 이전의 모든 시점에서 약물 방출을 합산하여 시점에서 누적 약물 방출(mg)을 결정합니다.
- 스트립의 표면적(3.5cm2)으로 약물 방출을 정규화하여 임플란트의 제곱센티미터당 누적 약물 방출을 결정한다.
6. 박테리아 준비
참고: 이 연구 에는 유형 균 주 12600, 임상 균주 L1101 및 L1163(로드 아일랜드 대학의 Kerry LaPlante 박사로부터 얻음)이 사용되었습니다. 이들 균주의 감수성 프로파일은 표 1에 제시되어 있다.
| 박테리아 균주 | 겐타마이신 MIC | 반코마이신 MIC | |
| ATCC 12600 인증 | ≤1 μg/mL (민감성) | ≤0.5μg/mL(민감도) | |
| L1101 (임상 균주) | ≥16 μg/mL (내성) | 8 μg/mL (중급) | |
| L1163 (임상 균주) | ≤1 μg/mL (민감성) | 8 μg/mL (중급) | |
표 1: 대조군 및 임상 S. 아우레우스 균주의 항생제 감수성 프로파일.
주의 : 박테리아 배양 및 현탁액 처리와 관련된 모든 단계는 Class II, Type A2 Biosafety Cabinet 내의 BSL-2 실험실 공간에서 수행되었습니다.
- 박테리아 스톡을 -80°C에서 TSA 플레이트로 해동하여 S. 아우레우스의 성장을 촉진합니다. 플레이트를 35°C에서 하룻밤 동안 정적으로 인큐베이션한다.
- 하룻밤 동안 성장한 한천 플레이트 배양물로부터 2 내지 3개의 콜로니를 1 mL의 멸균 TSB로 옮기고, 35°C에서 하룻밤 동안 정적으로 배양한다.
- 박테리아 100μL를 투명한 96웰 플레이트에 옮겨 600nm에서 흡광도를 측정하여 탁도를 분광광도계로 측정합니다.
- 발광 분석을 사용하여 생존 가능한 박테리아 수를 결정하기 전에 멸균 MHB를 사용하여 박테리아를 10,000배 희석합니다.
7. 실시간 미생물 생존율 분석 수행
- 백색 불투명 바닥 96웰 플레이트를 사용하여 발광 기반 분석을 수행합니다.
- 희석된 박테리아 현탁액 100μL를 섹션 1.5에서 제조된 분석 시약 100μL와 혼합합니다.
- 준비된 96-웰 플레이트 위에 알루미늄 호일로 덮인 뚜껑을 놓고 100rpm 흔들면서 5분 동안 배양합니다.
- Gen5 3.11 소프트웨어의 다음 설정을 사용하여 마이크로플레이트 리더로 발광을 즉시 측정합니다.
- New(새로 만들기)를 클릭하여 Task Manager(작업 관리자) 창에서 프로토콜을 설정합니다.
- 플레이트 유형(Plate Type) 드롭다운 메뉴에서 Costar 96 white opaque를 선택합니다.
- Select Steps > Actions(작업 선택) 메뉴에서 Read(읽기)를 클릭합니다.
- Read Method(메서드 읽기) 창에서 Luminescence(발광)를 클릭합니다. Read type(읽기 유형) 및 optics type(광학 유형)에서 각각 Endpoint/kinetic 및 Luminescence fiber 옵션을 선택한 상태로 유지합니다. 확인을 클릭합니다.
- 읽기 단계 창에서 <기본값> 설정을 유지합니다(게인 = 135, 통합 시간 = 1초, 읽기 높이 = 4.5mm). 확인을 클릭합니다.
- 플레이트 레이아웃 창이 실행 준비가 된 것으로 나타납니다. 로드 플레이트 창에서 뚜껑 사용 상자를 선택하고 확인을 클릭합니다.
- 96웰 플레이트를 기계에 넣어 발광 값을 읽습니다.
8. 각 박테리아 균주에 대한 발광 대 생존 수 표준 곡선 생성
참고: 섹션 6에 설명된 방법론에 따라 모든 S. 아우레우스 균주를 배양하고 열거합니다.
- 표준으로 사용하기 위해 연속적으로 희석 된 박테리아 현탁액을 준비하십시오.
- 하룻밤 동안 성장한 박테리아 현탁액을 분광광도계로 탁도를 측정하여 열거합니다.
- 6,000 × g 에서 5 분 동안 원심 분리하여 박테리아를 펠렛으로 만들고 펠릿을 멸균 MHB에 재현 탁하여 농도를 1 x 109 CFU / mL로 조정합니다.
- 900 μL의 MHB를 사용하여 100 μL의 순수 현탁액을 희석하고 1 x 101 CFU /mL에 도달하기 위해 10배 연속 희석을 수행합니다.
- 섹션 7에 설명된 대로 제조된 박테리아 현탁액에 대해 발광 분석을 수행합니다.
- 멸균 MHB를 실험용 블랭크 대조군으로 사용하고, 테스트 샘플 발광 값에서 블랭크 발광 값을 뺍니다.
- 로그(발광)에 대해 로그(CFU)를 플로팅하여 표준 곡선을 생성합니다. 방정식과R2 값을 기록한다.
- 연구 전반에 걸쳐 균주별 방정식을 사용하여 발광 값에 해당하는 CFU/mL를 결정합니다.
9. 시간 의존적 항균 활성 연구 설정
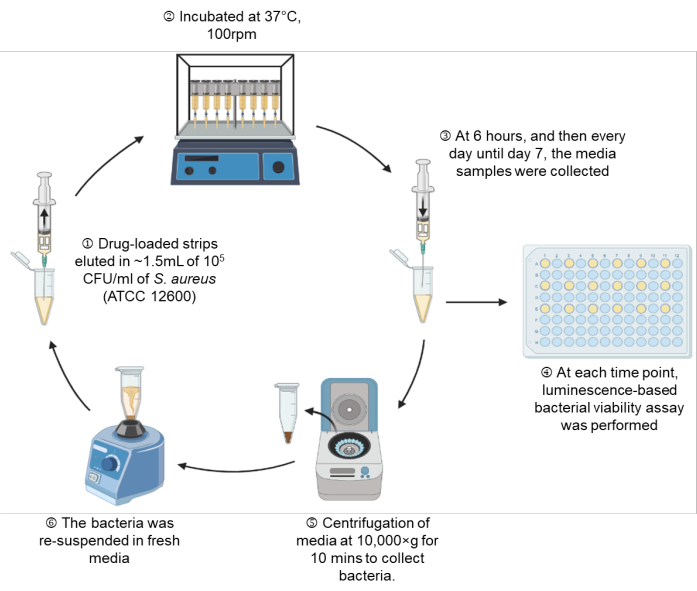
그림 1: 실험 설정의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- TSB 브로스 1mL에서 박테리아를 밤새 배양합니다.
- 하룻밤 동안 성장한 박테리아 현탁액을 멸균 MHB에서 105 CFU/mL로 희석하고(섹션 6), 실험 시작 전에 발광 단위를 사용하여 생존 가능한 박테리아 수를 확인합니다(섹션 7).
- 버진 UHMWPE 및 약물 로딩 UHMWPE 스트립(3mm x 5mm x 10mm, 섹션 2의 용출 연구를 위해 준비된 스트립 치수의 절반)을 3mL 주사기 내에 넣습니다.
- 부착된 바늘을 통해 105 CFU/mL가 들어 있는 MHB를 1.5mL 표시까지 주사기에 넣는데, 이는 MHB 1.35mL에 해당합니다(그림 1: 1단계).
- 37°C에서 6시간, 1일차, 2일차, 3일차, 4일차, 5일차, 6일차 및 7일의 표시된 시점이 될 때까지 진탕 배양기(100rpm)에 주사기 설정을 놓습니다(그림 1: 단계 2).
- 표시된 각 시점에서 주사기 설정을 꺼내고 100μL의 박테리아 현탁액에 대해 섹션 7에 따라 실시간 미생물 생존도 분석을 수행합니다(그림 1: 3-4단계).
- 6시간, 1일차, 2일차, 3일차 및 7일차 시점에 대한 생존 가능한 박테리아 수를 결정합니다. 해당 표준 곡선을 사용하여 발광 단위에서 CFU/mL를 측정합니다.
- TSA 플레이트에서 확산 플레이트 방법을 수행하고 35°C에서 밤새 배양하여 검출 한계 미만의 발광 값을 보인 샘플에 생존 가능한 박테리아가 없는지 확인합니다. 다음날 식민지가 있는지 확인하십시오.
- 남은 박테리아 현탁액을 10,000× g 에서 10분 동안 원심분리하고 사용한 배지를 부드럽게 흡인합니다. 약물의 항균 활성으로 인해 펠릿이 육안으로 관찰되지 않는 튜브의 경우 튜브에 100μL를 남겨 두어 보이지 않는 펠릿이 방해받지 않도록 합니다(그림 1: 5단계).
- 펠렛화된 박테리아를 신선한 MHB에 재현탁하고 부착된 바늘을 통해 동일한 주사기 설정으로 박테리아 현탁액을 다시 끌어냅니다(그림 1: 6단계).
10. UHMWPE 표면의 부착 박테리아 정량화
- 7일째 연구 완료 후 주사기 설정에서 처녀 UHMWPE 및 약물 로딩 UHMWPE 표면을 검색합니다.
- 표면을 1.5mL 튜브로 옮기고 1mL의 멸균 PBS로 헹굽니다(3회).
- 멸균 PBS 1mL에서 40분 동안 표면을 초음파 처리합니다. 섹션 7에 설명된 대로 초음파 처리된 샘플 100μL에 대해 발광 분석을 수행하여 부착 박테리아 생존력을 결정합니다.
결과
프로토콜에 따라 UHMWPE는 겐타마이신과 반코마이신을 7% w/w로 성형하고 탈이온수로 용리했습니다. 물질로부터의 용리액 중의 약물 농도는 6시간, 1일, 2일, 3일, 및 1주에서 측정되었다. 반코마이신 및 겐타마이신 부하 UHMWPE로부터의 약물 방출은 6시간에서 버스트 방출을 입증한 후 7일까지 최소 억제 농도(MIC)보다 큰 방출 농도로 꾸준한 방출 속도를 보였습니다(그림 2, 표 2).
항균 연구에 앞서, 각 S. 아우레우스 균주(ATCC 12600, L1101 및 L1163)에 대한 박테리아의 CFU/mL와 발광 단위를 연관시키기 위한 표준 곡선이 생성되었습니다. 해당 로그(발광) 값을 로그(CFU/mL)에 대해 플로팅하여 표준 곡선을 생성했습니다(그림 3). 계산된R2 값은 ATCC 12600, L1101 및 L1163에 대해 각각 0.997, 0.996 및 0.994였으며, 이는 농도 범위에 대한 강한 적합성을 나타낸다. 이후 도출된 방정식을 사용하여 모든 실험에서 박테리아 생존율을 계산했습니다. ATCC 12600 및 L1101은 1 x 102-1 x 103 CFU/mL 범위 내에서 검출 한계를 입증했습니다. 반면, L1163 균주에 대한 검출 한계는 1 x 104 CFU/mL로 나타났습니다.
시간 의존적 항균 활성 분석은 1주일 동안 7% w/w 약물 용출 물질에 노출된 12600, L1163 및 L1101에 대한 출발 접종물로 1 x 105 CFU/mL를 사용하여 수행되었습니다. 각 시점(6시간, 1일, 2일, 3일, 1주)에서 배지를 새로 고치고 박테리아 집단을 재현탁했습니다. 물질로부터 약물의 후속 방출에 대한 박테리아의 노출은 다음 시점까지 계속되었다. 7% w/w 반코마이신을 사용한 UHMWPE와 7% w/w 겐타마이신을 사용한 UHMWPE는 6시간에서 시작하여 감수성 ATCC 12600에 대해 >3log 감소를 입증했으며 3일 말에 완전한 박멸(콜로니 성장 없음)이 관찰되었습니다(그림 4A). 겐타마이신 감수성 및 반코마이신 중간 균주 L1163의 경우, 두 약물 용출 물질 모두 6시간에서 >3log 감소를 일으켰고, 실험 1일째에 완전한 박멸(콜로니 성장 없음)이 관찰되었습니다(그림 4B). 겐타마이신 내성 및 반코마이신 중간 균주 L1101의 경우 UHMWPE의 겐타마이신 용출은 L1101의 박테리아 생존력에 영향을 미치지 않았습니다(그림 4C). 박테리아가 증식하고 항생제 용출 없이 처녀 UHMWPE가 있는 상태에서 개체군이 6시간 이내에 안정화되었습니다. 겐타마이신 용출 UHMWPE가 있는 경우 개체군은 2일째에 유사한 성장 수준에 도달했습니다. 반대로, UHMWPE로부터의 반코마이신 용출은 6시간째에 박테리아 생존율(>3log)을 유의하게 감소시켰고, 4일째까지 완전한 생존율 손실(콜로니 성장 없음)이 입증되었다.
겐타마이신 용출 및 반코마이신 용출 UHMWPE의 표면은 7일 후 감수성 및 중간 내성 균주에 노출되었을 때 생존 가능한 부착 박테리아를 나타내지 않았거나 둘 중 먼저 도래한 시점에 나타났습니다. 일부 생존 가능한 박테리아(1 x 105 CFU/mL)는 겐타마이신 내성 L1101에 노출된 겐타마이신 용출 UHMWPE에 존재했습니다. 유사하게, 약 1 x 10 5 CFU/mL의 생존 가능한 부착성 박테리아가 대조군 버진 PE에서 회수되었습니다(그림 5).
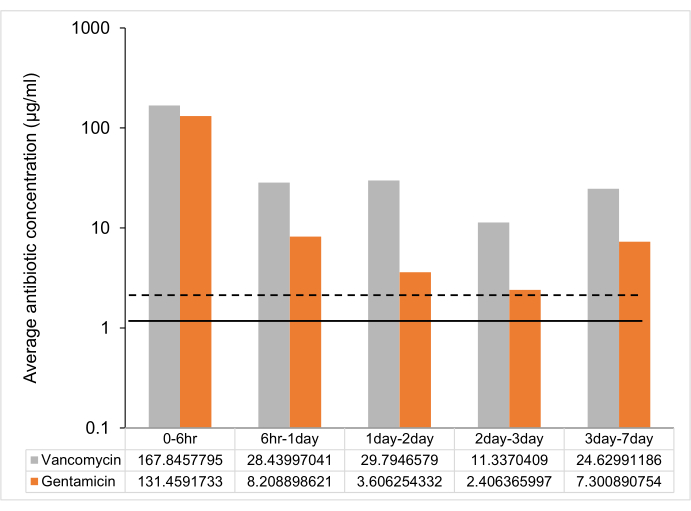
그림 2: 7% w/w 항생제 로딩 UHMWPE 스트립에서 시간 의존적 평균 항생제 방출. 7% w/w 겐타마이신 및 반코마이신 로딩 UHMWPE 스트립(3 mm 3 x 5 mm 3 x 10 mm 3 ~ 2cm2 표면적)으로부터의 시점 사이의 평균 항생제 방출. 대조군 균주 ATCC 12600에 대한 MIC는 겐타마이신에 대한 점선과 반코마이신에 대한 실선으로 표시됩니다. 오차 막대는 6번의 반복실험에서 얻은 평균의 표준 편차(n = 6)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
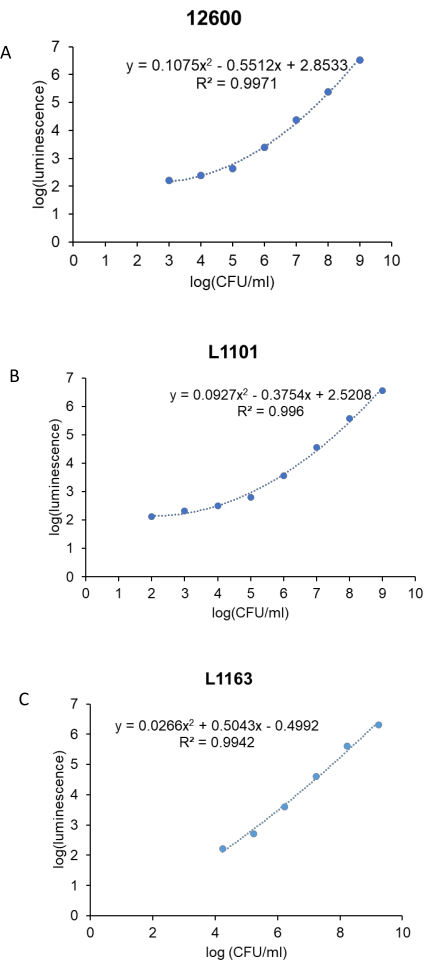
그림 3: 모든 S. 아우레우스 균주에 대한 실시간 발광 분석 표준 곡선. 로그(발광)를 로그(CFU/mL)에 대해 플롯팅하여 대조군, (A) ATCC 12600 및 임상 균주, (B) L1101 및 (C) L1163에 대한 표준 곡선을 생성했습니다. 최적 적합선과 대응하는R2 값을 설명하는 방정식이 플롯에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
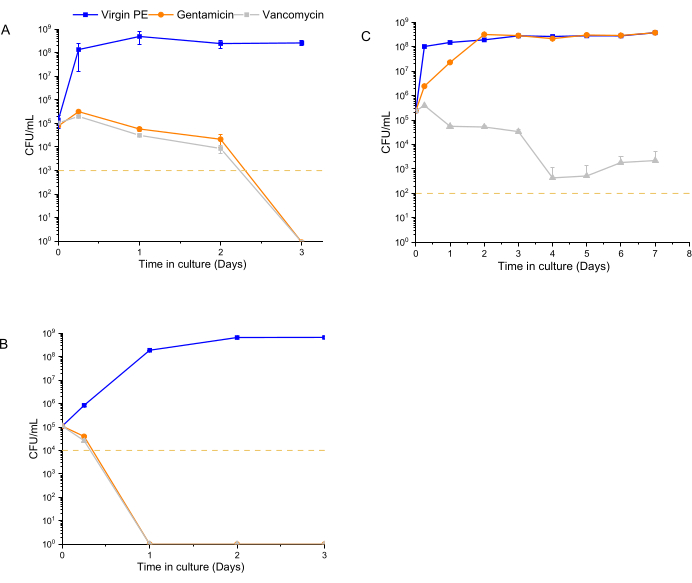
그림 4: 7% w/w 겐타마이신 용출 및 7% w/w 반코마이신 용출 UHMWPE에 대한 발광 분석을 사용하여 측정된 박테리아 생존력. 대조군 균주, (A) ATCC 12600 및 임상 균주, (B) L1163 및 (C) L1101에 대해 UHMWPE에서 용출된 겐타마이신 및 반코마이신의 시간 의존적 항균 활성을 나타냅니다. Virgin 1020 PE는 실험을 위한 대조군 역할을 했습니다. 그림의 노란색 선은 각 S. 아우레우스 균주에 대한 검출 한계를 나타냅니다. 데이터는 평균 ± 표준편차(n=3)로 나타내었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
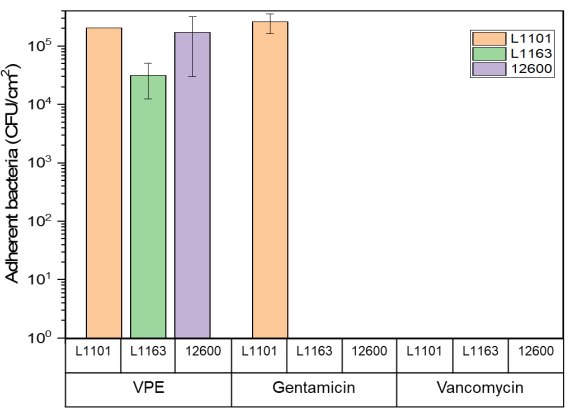
그림 5: 모든 S. 아우레우스 균주에 대해 7% w/w 겐타마이신 용출 및 7% w/w 반코마이신 용출 UHMWPE에 대한 발광 분석 Glo 분석을 사용하여 결정된 부착성 박테리아 생존율. 막대 차트는 테스트된 모든 균주에 대해 연구 기간이 끝날 때 7% 겐타마이신 부하 및 7% 반코마이신 부하 UHMWPE의 센티미터 제곱(cm2)당 회수된 부착 박테리아(CFU)를 나타냅니다. 막대는 데이터를 평균 ± 표준 편차(n = 3)로 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시점 | 반코마이신 | 겐타마이신 |
| 최고봉 농도 (μg/mL) | 최고봉 농도 (μg/mL) | |
| 0 - 6 시간 | 336 ± 72 | 263 ± 24 |
| 6 h -1 일 | 57 ± 18 | 16 ± 2 |
| 1 일 - 2 일 | 60 ± 18 | 7 ± 1 |
| 2 일 - 3 일 | 23 ± 6 | 5 ± 0.4 |
| 3 일 - 7 일 | 49 ± 20 | 15 ± 1 |
표 2: 다른 시점에서 피크 약물 농도(μg/mL). 데이터는 평균 ± 표준 편차(n=6)로 표시됩니다.
보충 그림 2: 샘플에 분석 시약을 첨가한 후 10 분 동안 발광 신호 감쇠. 신호의 ±5% 차이가 점선으로 표시됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
항생제의 국소적이고 지속적인 전달은 삽입물 주위 관절 감염 관리에 필요한 도구입니다. 전신 항생제는 세균 감염을 근절하는 주요 전략이며, 국소 용출은 임플란트 제거 및 조직의 괴사조직 제거 후 남아 있는 박테리아의 성장과 집락화를 방지하기 위한 보완 도구로 사용됩니다. 국소 투여를 통한 항생제에 대한 곡선 아래 유효 면적(일정 기간 동안의 농도)에 대한 목표는 잘 알려져 있지 않습니다. 이러한 장치로부터의 항생제의 용출은 시험관 내에서 종단적으로 정량화될 수 있다; 그러나 이러한 농도 프로파일의 번역 값을 결정하기 위해서는 항균 활성을 평가하기 위한 강력한 시험관 내 방법이 필요합니다. 본 논문에서는 관절 치환술에서 지속전달장치로 사용되는 약물용출 UHMWPE의 항균활성을 확인하기 위한 이러한 실시간 방법 중 하나를 설명한다.
박테리아 생존력의 실시간 모니터링은 중요한 관심 매개변수이며 기존의 미생물학적 방법은 연구의 이러한 특정 측면을 수용할 수 있는 프레임워크가 부족합니다. 본 연구에 사용된 미생물 생존율 분석은 아데노신 삼인산(ATP)에 해당하는 발광을 측정하여 생존 가능한 박테리아의 정량화를 위해 개발되었습니다. 임플란트 재료에서 용출된 항생제의 시간 의존적 활성을 직접 조사하기 위해 뚜렷한 항생제 감수성 프로파일을 가진 세 가지 다른 균주를 이들과 함께 배양했습니다. 겐타마이신과 반코마이신에 대한 다양한 내성을 가진 실험실 및 임상 균주를 사용하는 근거는 주어진 임플란트 제형의 활성 범위를 이해하는 것이었습니다. 또한, 이들 뚜렷한 집단에 대한 항박테리아 활성 및 효능은 투여 시기에 의존한다. 이 방법은 수술 당시 상처의 오염으로 인해 발생하는 삽입물 주위 관절 감염의 >70%를 기반으로 이러한 균주에 대한 예방 가능성에 초점을 맞춘다24.
이 방법을 개발하기 위한 시작 접종원으로 1 x 105 CFU/mL가 사용되었습니다. 동물 모델에는 다양한 오염 농도가 사용되었지만 PJI에 대한 임상적으로 관련된 감염 부하에 대해서는 알려진 바가 많지 않습니다. 삽입물 삽입물에 대한 동물 감염 모델은 1 x 105 CFU를 사용하여 일상적으로 확립되었으며, 유사한 범위가 항균 활성을 결정하기 위한 표준화된 방법(CLSI)에서 널리 사용된다25,26,27. 1 x 105 CFU/mL를 초기 오염 농도로 사용하여 성장 및 박멸 매개변수를 동시에 평가할 수 있었습니다.
통상적으로, MIC 값은 특정 수의 박테리아에 대한 일정한 항생제 농도에 대해 결정되며, 항균 작용 속도를 입증하지 못한다. 이러한 측면으로 인해, MIC 값은 항미생물 활성 프로파일을 설명하기 위한 정량적 분화를 제공하지 않는다28. 현재 방법의 데이터는 투여 결정을 내리기 위해 MIC를 사용하는 것보다 항생제의 균주 의존적 사멸 동역학을 평가하는 이점을 강조합니다. 이 방법을 사용하여 임플란트 재료가 다른 균주에 영향을 미치는 범위와 속도를 구별할 수 있었습니다. 임플란트 재료 스트립에서 용출된 겐타마이신은 L1163을 1일 만에 박멸하고 ATCC 12600을 2-3일 만에 박멸하는 데 효과적이었으나 L1101을 박멸하는 데는 효과가 없었습니다(그림 4). L1101(MIC >32μg/mL)에 대한 겐타마이신 용출의 활성 부족이 예상되었을 뿐만 아니라(그림 4C), L1101이 중간 내성을 나타내는 반코마이신에 노출되었을 때 하위 집단의 지속성이 관찰되었습니다. 대조적으로, L1163은 L1101과 유사한 반코마이신에 대한 중간 내성을 나타냈음에도 불구하고 반코마이신 용출 UHMWPE의 존재 하에서 결정적으로 박멸되었습니다(두 균주 모두에서 8μg/mL의 MIC가 관찰됨).
유사한 MIC 값(두 균주 모두에서 1μg/mL의 MIC가 관찰됨)으로 겐타마이신에 취약한 12600 및 L1163에 대한 겐타마이신의 활성률이 달랐을 뿐만 아니라 중간 내성 L1101 및 L1163에 대한 반코마이신의 활성 정도가 달랐다는 관찰 결과(그림 4A, B), 용출 물질이 있는 상태에서 이 실시간 방법이 활성의 종방향 차이를 구별할 수 있다는 가설을 뒷받침했습니다.
주어진 용출 농도가 이러한 박테리아에 대해 얼마나 효과적일 수 있는지 해석하는 결과의 번역 가치 외에도 몇 가지 실험적 방법론적 이점이 있습니다. (1) 박테리아 농도는 생존력을 결정하기 위해 박테리아를 18-24시간 동안 국물이나 한천에서 배양하는 기존 방법과 달리 주어진 시간에 즉시 결정됩니다. 이 성장 기간은 박테리아가 항생제 스트레스로부터 회복되는 데 추가 시간을 제공하여 오류/변동성의 추가 원인을 도입할 수 있습니다. (2) 배지는 박테리아를 유지하면서 지속적으로 교체되며, 이는 정적 조건보다 생체 내 조건과 더 유사합니다. (3) 이 분석에는 본질적으로 임플란트의 약물 방출 역학이 포함되어 있어 더 나은 성능 예측이 가능합니다. (4) 이 방법은 특정하거나 고가의 기계 없이 일반적으로 사용 가능한 소모품을 사용하여 개발되었습니다.
생체 내 동물 연구 및 임상 시험을 진행하기 전에 약물 전달 응용 분야를 평가하기 위한 강력한 체외 테스트 방법이 필요합니다. 이 분석은 입자, 젤, 필름 및 기타 약물 용출 물질과 같은 다양한 접근 방식과 약물 전달 플랫폼을 수용하도록 수정 및 조정하여 시뮬레이션된 시험관 내 설정에서 박테리아 박멸의 효율성을 결정할 수 있습니다. 변형은 적합한 시험관내 배지 환경으로 변경함으로써 샘플 셋업을 위해 수행될 수 있으며, 이는 여러 항생제의 활성에 영향을 미치는 것으로 나타났다29,30.
이 방법은 또한 생존 가능한 부착 박테리아 측정을 용이하게 하는데, 이는 최소 생물막 박멸 농도를 결정하는 기존 방법이 시간이 많이 걸리고 일관되지 않은 결과를 제공하기 때문에 유망합니다. 그러나 이 방법은 민감도를 결정하기 위한 신뢰할 수 있고 강력한 방법론을 개발하기 위해 생물막에 대해 엄격하게 테스트해야 합니다. ATP 기반 발광 방법은 한천 플레이트에서 가시적인 콜로니로 검출되거나 검출되지 않을 수 있는 지속자를 포함하여 생물막에서 생존 가능한 형태의 박테리아를 검출할 수 있을 만큼 충분히 민감할 수 있습니다. 종합하면, 이 다용도 플랫폼은 관련 매개변수를 통합하여 관심 약물의 항박테리아 및 항생물막 활성에 대한 실시간 관찰을 기록할 수 있는 잠재력을 가지고 있습니다.
이 방법의 효능은 다음과 같은 측면에 의해 결정됩니다.
사전 결정된 용리 특성 및 시료 크기
항생제 용출 물질의 용출 프로파일은 이러한 항균 활성 측정 전에 별도의 실험에서 확인할 수 있으며, 이를 통해 규정된 시간 내에 실험을 능동적으로 수행하는데 필요한 물질의 양을 결정할 수 있다.
용기 및 부피 결정
실험의 배지 부피가 동일한 물질의 전체 표면적을 수용할 수 있는 설정을 고안하고 약물 로딩 표면에서 약물의 방해받지 않는 방출을 위한 충분한 부피를 보장하는 것이 중요합니다. 사용된 설정은 이전 실험을 기반으로 하여 이러한 친수성 약물에 대한 "완벽한 싱크" 조건을 보장하여 용해도 제한으로 인해 확산이 방해받지 않도록 했습니다.
성장 배지 특성
선택한 약물의 안정성과 최적의 성능을 보장하기 위해 성장 배지 선택을 조사해야 합니다29. 배지 희석법에서 널리 사용되는 양이온 조절 Mueller Hinton broth(CAMHB)를 사용하여 공지된 항생제의 MIC를 확인하였다. 배지는 독성 2차 대사산물 축적(31)의 간섭 없이 최적의 약물 활성을 가능하게 한다. 분석 시약은 혈청 성분23,28을 가진 것을 포함하여 다양한 유형의 배지에서 테스트되고 안정한 것으로 보고되었습니다. 상대적 발광 단위 값이 상이한 매질에 걸쳐 변할 수 있지만, 매질의 성분은 분석(32,33)을 방해하지 않는 것으로 입증되었다. 실험 부피는 1.5mL로 추가로 최적화되었으며, 이는 성인 무릎 관절 공간34에 존재하는 활액 부피에 가깝습니다.
분석을 위한 온도 안정성
발광 시약의 취급 및 분석에 대한 첨가는 실험 전반에 걸쳐 일관된 방식으로 수행되어야 한다. 온도 변화는 분석의 민감도를 변화시키므로, 박테리아에 첨가하기 전에 시약을 실온에서 2시간 동안 배양하는 것이 중요하다23.
시약 배양 시간
시약의 발광은 시간이 지남에 따라 감쇠합니다. 발광 신호는 30분 이상의 반감기를 가지며, 이는 실험에 사용된 배지 및 박테리아의 종류에 크게 의존한다(23). 또한 배양 시간의 차이(즉, 박테리아에 시약을 추가하는 것과 발광을 판독하는 사이의 시간)는 동일한 농도의 박테리아에 대해 일관되지 않은 판독값을 초래합니다. 제조자의 지시에 따라 5분 배양 시간 후 1분 이내에 취했을 때 발광 신호에서 5% 차이가 관찰되었다(보충 그림 2). 이 데이터를 고려하여 신호 손실이 5%를 넘지 않도록 연구 전반에 걸쳐 발광 판독값을 1분 이내에 기록했습니다. 또한, 플레이트 당 샘플의 수를 제한하여 첫 번째 웰에서 마지막 웰까지 발광 감쇠로 인한 오차를 줄이는 것이 중요합니다.
연구 전반에 걸친 박테리아 개체군의 유지
이 방법은 10,000 x g 에서 10분35초 동안 고속 원심분리를 사용하여 각 시점에서 박테리아 개체군에서 사용한 배지를 지속적으로 분리하여 약물 제거율 및 활막 부피 회전율을 모델링하려고 시도했습니다. 이 중요한 단계는 모든 생존 가능한 박테리아 세포와 생존 불가능한 박테리아 세포의 침전을 보장합니다. 또한, 침전된 박테리아는 신선한 MHB에서 균일하게 재구성되고 주사기 설정으로 옮겨져 영향을 받는 미생물 집단이 실험 설정으로 완전히 이월되는 것을 용이하게 합니다. 이 방법의 재현성과 신뢰성은 초기 접종물에서 파생된 미생물 집단에 대한 항생제의 지속적인 노출을 시뮬레이션하는 데 크게 의존합니다.
이 방법의 주요 한계는 약물 반감기와 지속적인 활액 회전율을 정확하게 시뮬레이션하지 않는 반정적 분석이라는 것입니다. 그러나 지속적인 매체 교체는 이러한 한계를 부분적으로 보완합니다. 미생물 생존력 분석의 민감도는 1 x 102-1 x 104 CFU/mL 범위로 균주에 따라 달라 검출 능력을 제한했습니다. 또한, 균주 유형이 발광 시약의 감도와 성능에 기여하기 때문에 각 유기체에 대해 표준 곡선을 그려야 합니다. 박테리아 성장 역학과 사용된 약물 화합물의 활성은 모두 중간 성분의 영향을 받을 수 있으며 추가 조사가 필요합니다.
공개
선임 저자(E.O.)는 Corin, Iconacy, Renovis, Arthrex, ConforMIS, Meril Healthcare, Exactech와 같은 회사에 대한 지적 재산권 라이선스에서 발생하는 로열티를 받습니다. 여기에 제시된 연구와 이해 상충이 없습니다.
감사의 말
이 연구는 국립 보건원 보조금 번호 AR077023 (R01)과 Harris Orthopaedic Laboratory에서 부분적으로 자금을 지원했습니다. 저자들은 임상 균주 L1101 및 L1163을 제공 한로드 아일랜드 대학의 Kerry Laplante 박사와 그녀의 팀에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 96 well plates - polystyrene, High Bind, white flat bottom wells, non-sterile, white, 100/cs | Corning, NY, USA | CLS3922-100EA | |
| 2-mercaptoethanol | Sigma Aldrich, Germany | ||
| ATCC 12600 | American Type culture Collection, VA, USA | ||
| BacTiter-Glo Microbial Cell Viability Assay | Promega Corporation, USA | G8231 | |
| BD Bacto Tryptic Soy Broth (Soybean-Casein Digest Medium) | Becton-Dickinson, USA | BD 211825 | purchased from Fisher Scientific, USA |
| BD Luer-Lok Syringe sterile, single use, 3 mL | BD, USA | 309657 | |
| BD Needle 5/8 in. single use, sterile, 25 G | BD, USA | 305122 | |
| BD BBL Dehydrated Culture Media: Mueller Hinton II Broth (Cation-Adjusted) | Becton-Dickinson, USA | B12322 | purchased from Fisher Scientific, USA |
| BD Difco Dehydrated Culture Media: Tryptic Soy Agar (Soybean-Casein Digest Agar) | Becton-Dickinson, USA | DF0369-17-6 | purchased from Fisher Scientific, USA |
| Boric Acid | Fisher Chemical, NJ, USA | ||
| Branson 1800 ultrasonic bath | Emerson, MO, USA | ||
| Corning Falcon Bacteriological Petri Dishes with Lid | Fisher Scientific, USA | 08-757-100D | |
| Gentamicin Sulfate | Fujian Fukang Pharmaceutical Co., Fuzhou, China | ||
| Greiner UV-Star 96 well plates | Sigma Aldrich, Germany | M3812-40EA | |
| Hydraulic press | Carver, Inc. Wabash, IN, USA | ||
| L1101 | Clinical strain from Dr Kerry Laplante, University of Rhode Island | ||
| L1163 | Clinical strain from Dr Kerry Laplante, University of Rhode Island | ||
| LSE benchtop shaking incubator | Corning, NY, USA | ||
| Methanol, Optima for HPLC, Fisher Chemical | Fisher Scientific, NJ, USA | A454-1 | |
| Napco CO2 6000 | Thermo Scientific, MA, USA | ||
| PBS, Phosphate Buffered Saline, 1X Solution, pH 7.4, Fisher BioReagents | Fisher Scientific, USA | BP24384 | |
| Phthaldiadehyde ≥97% (HPLC) | Sigma Aldrich, Germany | P1378-5g | |
| Plate reader (Synergy H1 | Biotek, VT, USA | ||
| press | Carver, Inc. Wabash, IN, USA | ||
| shaker Innova 2100 | New Brunswick Scientific, NJ, USA | ||
| ShopBot D2418 | ShopBot Tools, Inc., NC, USA | ||
| Sodium Hydroxide | Sigma Aldrich, Germany | ||
| Thermo Scientific Reagent Grade Deionized Water | Fisher Scientific, USA | 23-751628 | |
| UHMWPE | GUR1020, Celanese, TX, USA | ||
| Vancomycin Hydrochloride | Fagron, The Netherlands | 804148 | |
| WAB Turbula | WAB Turbula, Switzerland |
참고문헌
- Hunter, D. J., March, L., Chew, M. Osteoarthritis in 2020 and beyond: A Lancet Commission. Lancet. 396 (10264), 1711-1712 (2020).
- Sloan, M., Premkumar, A., Sheth, N. P. Projected volume of primary total joint arthroplasty in the U.S., 2014 to 2030. The Journal of Bone and Joint Surgery. American Volume. 100 (17), 1455-1460 (2018).
- Gao, J., Xing, D., Dong, S., Lin, J. The primary total knee arthroplasty: A global analysis. Journal of Orthopaedic Surgery and Research. 15 (1), 190(2020).
- UpToDate. Prosthetic joint infection: Treatment. , Available from: https://www.uptodate.com/contents/prosthetic-joint-infection-treatment (2022).
- Dapunt, U., Radzuweit-Mihaljevic, S., Lehner, B., Haensch, G. M., Ewerbeck, V. Bacterial infection and implant loosening in hip and knee arthroplasty: Evaluation of 209 cases. Materials. 9 (11), 871(2016).
- Kamath, A. F., et al. Quantifying the burden of revision total joint arthroplasty for periprosthetic infection. The Journal of Arthroplasty. 30 (9), 1492-1497 (2015).
- Tande, A. J., Patel, R. Prosthetic joint infection. Clinical Microbiology Reviews. 27 (2), 302-345 (2014).
- Davidson, D. J., Spratt, D., Liddle, A. D. Implant materials and prosthetic joint infection: The battle with the biofilm. EFORT Open Reviews. 4 (11), 633-639 (2019).
- de Vor, L., Rooijakkers, S. H. M., van Strijp, J. A. G. Staphylococci evade the innate immune response by disarming neutrophils and forming biofilms. FEBS Letters. 594 (16), 2556-2569 (2020).
- Dapunt, U., Giese, T., Stegmaier, S., Moghaddam, A., Hänsch, G. M. The osteoblast as an inflammatory cell: Production of cytokines in response to bacteria and components of bacterial biofilms. BMC Musculoskeletal Disorders. 17, 243(2016).
- González, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023(2018).
- Dapunt, U., Giese, T., Prior, B., Gaida, M. M., Hänsch, G. M. Infectious versus non-infectious loosening of implants: activation of T lymphocytes differentiates between the two entities. International Orthopaedics. 38 (6), 1291-1296 (2014).
- Tai, D. B. G., Patel, R., Abdel, M. P., Berbari, E. F., Tande, A. J. Microbiology of hip and knee periprosthetic joint infections: A database study. Clinical Microbiology and Infection. 28 (2), 255-259 (2022).
- Foster, T. J. Antibiotic resistance in Staphylococcus aureus. Current status and future prospects. FEMS Microbiology Reviews. 41 (3), 430-449 (2017).
- Kranjec, C., et al. Staphylococcal biofilms: challenges and novel therapeutic perspectives. Antibiotics. 10 (2), 131(2021).
- Kahl, B. C., Becker, K., Löffler, B. Clinical significance and pathogenesis of staphylococcal small colony variants in persistent infections. Clinical Microbiology Reviews. 29 (2), 401-427 (2016).
- Li, C., Renz, N., Trampuz, A. Management of periprosthetic joint infection. Hip & Pelvis. 30 (3), 138-146 (2018).
- Davis, J. S., et al. Predictors of treatment success after periprosthetic joint infection: 24-month follow up from a multicenter prospective observational cohort study of 653 patients. Open Forum Infectious Diseases. 9 (3), (2022).
- Suhardi, V. J., et al. A fully functional drug-eluting joint implant. Nature Biomedical Engineering. 1, 0080(2017).
- Gil, D., Grindy, S., Muratoglu, O., Bedair, H., Oral, E. Antimicrobial effect of anesthetic-eluting ultra-high molecular weight polyethylene for post-arthroplasty antibacterial prophylaxis. Journal of Orthopaedic Research. 37 (4), 981-990 (2019).
- Robu, A., et al. Additives imparting antimicrobial properties to acrylic bone cements. Materials. 14 (22), 7031(2021).
- Balouiri, M., Sadiki, M., Ibnsouda, S. K. Methods for in vitro evaluating antimicrobial activity: A review. Journal of Pharmaceutical Analysis. 6 (2), 71-79 (2016).
- BacTiter-Glo microbial cell viability assay instructions for use of products G8230, G8231, G8232 and G8233. <101/bactiter-glo-microbial-cell-viability-assay-protocol. Promega Corporation. , Available from: https://www.promega.com/resources/protocols/technical-bulletins/101/bactiter-glo-microbial-cell-viability-assay-protocol/ (2022).
- Izakovicova, P., Borens, O., Trampuz, A. Periprosthetic joint infection: Current concepts and outlook. EFORT Open Reviews. 4 (7), 482-494 (2019).
- López-Torres, I. I., Sanz-Ruíz, P., Navarro-García, F., León-Román, V. E., Vaquero-Martín, J. Experimental reproduction of periprosthetic joint infection: Developing a representative animal model. The Knee. 27 (3), 1106-1112 (2020).
- Carli, A. v, et al. Quantification of peri-implant bacterial load and in vivo biofilm formation in an innovative, clinically representative mouse model of periprosthetic joint infection. The Journal of Bone and Joint Surgery. American Volume. 99 (6), 25(2017).
- Humphries, R. M., et al. CLSI Methods Development and Standardization Working Group best practices for evaluation of antimicrobial susceptibility tests. Journal of Clinical Microbiology. 56 (4), 01934(2018).
- Mueller, M., de la Peña, A., Derendorf, H. Issues in pharmacokinetics and pharmacodynamics of anti-infective agents: Kill curves versus MIC. Antimicrobial Agents and Chemotherapy. 48 (2), 369-377 (2004).
- Wijesinghe, G., et al. Influence of laboratory culture media on in vitro growth, adhesion, and biofilm formation of Pseudomonas aeruginosa and Staphylococcus aureus. Medical Principles and Practice. 28 (1), 28-35 (2019).
- Steixner, S. J. M., et al. Influence of nutrient media compared to human synovial fluid on the antibiotic susceptibility and biofilm gene expression of coagulase-negative Staphylococci In vitro. Antibiotics. 10 (7), 790(2021).
- Sigma Aldrich. Mueller Hinton Broth (M-H Broth). Sigma Aldrich. , 70192(2018).
- Thiriard, A., Raze, D., Locht, C. Development and standardization of a high-throughput Bordetella pertussis growth-inhibition assay. Frontiers in Microbiology. 11, 777(2020).
- Clow, F., O'Hanlon, C. J., Christodoulides, M., Radcliff, F. J. Feasibility of using a luminescence-based method to determine serum bactericidal activity against Neisseria gonorrhoeae. Vaccines. 7 (4), 191(2019).
- Kraus, V. B., Stabler, T. v, Kong, S. Y., Varju, G., McDaniel, G. Measurement of synovial fluid volume using urea. Osteoarthritis and Cartilage. 15 (10), 1217-1220 (2007).
- Gonçalves, F. D. A., de Carvalho, C. C. C. R. Phenotypic modifications in Staphylococcus aureus cells exposed to high concentrations of vancomycin and teicoplanin. Frontiers in Microbiology. 7, 13(2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유