Method Article
تقييم سلامة حاجز الأمعاء في الفئران باستخدام ديكستران المسمى بالفلوريسئين أيزوثيوسيانات
In This Article
Summary
في هذه الدراسة ، يتم إعطاء ديكستران المسمى بالفلوريسئين أيزوثيوسيانات (FITC) للفئران عن طريق التزويج الفموي لتقييم نفاذية الأمعاء في كل من الجسم الحي وفي عينات البلازما والبراز. نظرا لأن وظيفة حاجز الأمعاء تتأثر في العديد من عمليات المرض ، يمكن استخدام هذا الفحص المباشر والكمي في مجالات بحثية متنوعة.
Abstract
سلامة حاجز الأمعاء هي السمة المميزة لصحة الأمعاء. بينما يمكن تقييم سلامة حاجز الأمعاء باستخدام علامات غير مباشرة مثل قياس علامات التهاب البلازما والانتقال البكتيري إلى الطحال والغدد الليمفاوية ، فإن المعيار الذهبي يحدد بشكل مباشر قدرة الجزيئات المختارة على اجتياز الطبقة المخاطية للأمعاء نحو الدورة الدموية الجهازية. تستخدم هذه المقالة تقنية غير جراحية وفعالة من حيث التكلفة ومنخفضة العبء لتحديد ومتابعة نفاذية الأمعاء في الفئران في الوقت الفعلي باستخدام ديكستران المسمى بالفلوريسئين أيزوثيوسيانات (FITC-dextran). قبل تناول المكملات الفموية مع FITC-dextran ، يتم صيام الفئران. ثم يتم تقشيرها باستخدام FITC-dextran المخفف في محلول ملحي مخزن بالفوسفات (PBS). بعد ساعة واحدة من التزويج ، تخضع الفئران للتخدير العام باستخدام الأيزوفلوران ، ويتم تصور التألق في الجسم الحي في غرفة التصوير. تهدف هذه التقنية إلى تقييم التألق المتبقي في تجويف البطن والامتصاص الكبدي ، مما يوحي بالهجرة البابية لمسبار الفلورسنت. يتم جمع عينات الدم والبراز بعد 4 ساعات من التزويج الفموي ، ويتم التضحية بالفئران. ثم يتم طلاء عينات البلازما والبراز المخففة في برنامج تلفزيوني ، ويتم تسجيل التألق. ثم يتم حساب تركيز FITC-dextran باستخدام منحنى قياسي. في الأبحاث السابقة ، أظهر التصوير في الجسم الحي أن التألق ينتشر بسرعة إلى الكبد في الفئران ذات حاجز الأمعاء الأضعف الناجم عن نظام غذائي منخفض الألياف ، بينما في الفئران المكملة بالألياف لتقوية حاجز الأمعاء ، يتم الاحتفاظ بإشارة الفلورسنت في الغالب في الجهاز الهضمي. بالإضافة إلى ذلك ، في هذه الدراسة ، كان لدى الفئران الضابطة مضان مرتفع في البلازما وانخفاض مضان في البراز ، بينما عكسيا ، كان لدى الفئران المكملة بالأنسولين مستويات أعلى من إشارات التألق في الأمعاء ومستويات منخفضة في البلازما. باختصار ، يوفر هذا البروتوكول قياسات نوعية وكمية لنفاذية الأمعاء كعلامة على صحة الأمعاء.
Introduction
يلعب حاجز الأمعاء دورا مهما في كل من الصحة والمرض. يتطلب توازنا معقدا بين السماح للعناصر الغذائية المطلوبة بالتغلغل في الدورة الدموية من تجويف الأمعاء مع منع تغلغل الجزيئات المؤيدة للالتهابات في نفس الوقت ، مثل مسببات الأمراض أو المستضدات1. يمكن أن تحدث زيادة النفاذية بسبب العديد من اضطرابات الجهاز الهضمي ، مثل أمراض الكبد أو أمراض الأمعاء الالتهابية (IBDs)2,3. على سبيل المثال ، في التهاب القولون التقرحي (UC) ، وهو مرض التهاب الأمعاء ، يؤدي الالتهاب المزمن إلى انهيار الوصلات الضيقة ، والاضطراب اللاحق لحاجز الأمعاء ، ونقل البكتيريا ، مما قد يؤدي إلى إدامة الالتهاب المخاطي والجهازي4.
وبالتالي ، فإن سلامة حاجز الأمعاء هي علامة مهمة على صحة الأمعاء. ومع ذلك ، فإن الطرق الحالية لقياس نفاذية الأمعاء لها العديد من القيود. على سبيل المثال ، طرق قياس علامات التهاب البلازما أو الانتقال البكتيري إلى الطحال والغدد الليمفاوية غير مباشرة 5,6. يمكن أن تكون الطرق الأخرى غازية وتستغرق وقتا طويلا. توضح هذه المقالة مقايسة غير جراحية وفعالة من حيث التكلفة تقيس نفاذية الأمعاء بشكل مباشر وكمي. يستخدم هذا الفحص ديكستران المسمى بالفلوريسئين أيزوثيوسيانات (FITC-dextran) لمتابعة نفاذية الأمعاء في الوقت الفعلي عن طريق قياس التألق في الجسم الحي. بالإضافة إلى ذلك ، فإن قياس مستويات FITC-dextran في البلازما والبراز يحدد نفاذية الأمعاء (الشكل 1).
تم استخدام اختبار نفاذية FITC-dextran سابقا في العديد من السياقات المختلفة ، بما في ذلك النماذج الحيوانية لمرض باركنسون7 ، والإنتان8 ، والسكتة الدماغية9 ، وإصابة الحروق10. بالإضافة إلى ذلك ، تم استخدام هذا الاختبار مؤخرا للمساعدة في فهم كيفية تورط ميكروبيوم الأمعاء في عمليات المرض المختلفة وكيف يمكن استهدافه أو التلاعب به كعلاج محتمل. على سبيل المثال ، تم استخدامه لدراسة العلاجات القائمة على الميكروبيوم والميكروبيوم في الشيخوخة 11 ، و IBDs12 ، وسرطان القولون والمستقيم 13 ، واضطراب طيف التوحد11. نظرا لأن وظيفة حاجز الأمعاء متورطة في العديد من جوانب الصحة والمرض ، فقد تم استخدام هذا الفحص على نطاق واسع. بساطته النسبية وعبء الوقت المنخفض يجعله مثاليا لاختبار الظروف في الجسم الحي المشتبه في أنها تغير سلامة حاجز الأمعاء. نتائجه الكمية مفيدة لتحديد فعالية العلاج المحتمل.
في هذه الدراسة ، تم تقييم تأثير النظام الغذائي على وظيفة حاجز الأمعاء باستخدام مقايسة FITC-dexman. تمت مقارنة نفاذية الأمعاء للفئران التي تتلقى نظاما غذائيا ضابطا ونفاذية الأمعاء للفئران التي تتلقى نظاما غذائيا مكملا بالأنسولين. Inulin هو قليل السكاريد المفيد الذي ثبت أنه يحسن وظيفة حاجز الأمعاء12,13. بالنسبة لقياسات التألق في الجسم الحي (الخلفية) ، تم استخدام فأر إضافي غير معالج كعنصر تحكم سلبي وتلقى برنامج تلفزيوني بدلا من FITC-dextran. توضح هذه التجربة أن مقايسة FITC-dextran هي أداة قيمة لتقييم نفاذية الأمعاء.
Protocol
تم تنفيذ جميع الإجراءات وفقا لإرشادات المجلس الكندي لرعاية الحيوان بعد موافقة اللجنة المؤسسية لرعاية الحيوان التابعة ل CRCHUM. تم استخدام إناث الفئران BALB / c البالغة من العمر ثمانية أسابيع ، والتي تم الحصول عليها من مصدر تجاري (انظر جدول المواد) ، في هذه الدراسة. تلقت الحيوانات مكملات غذائية مع 10٪ الأنسولين بالوزن / الوزن لمدة 2 أسابيع. تلقت مجموعة مراقبة نظاما غذائيا مشابها يفتقر إلى مكمل الأنسولين. كان لدى الفئران إمكانية الوصول إلى النظام الغذائي. يتم عرض نظرة عامة على الفحص في الشكل 1.
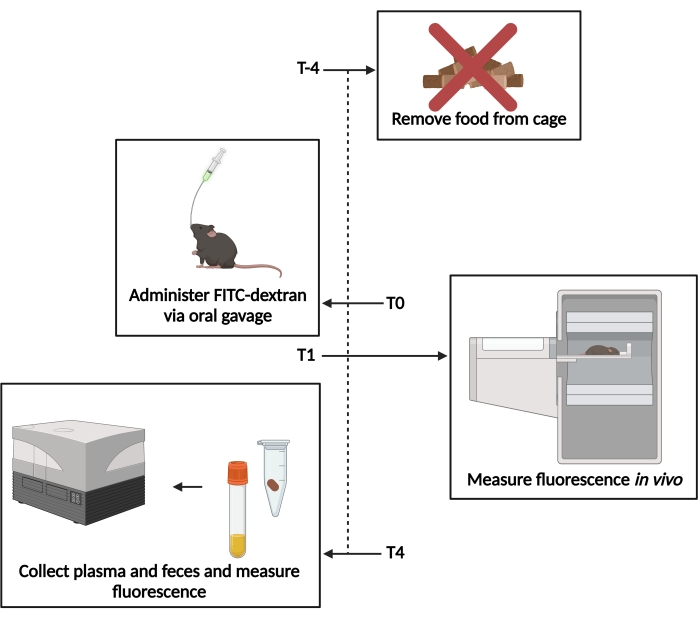
الشكل 1: رسم تخطيطي لمقايسة FITC-dexman. T−4- 4 ساعات قبل التزويج ، تمت إزالة الوصول إلى الطعام. T0- تم إعطاء FITC-dextran عن طريق التزويج الفموي. T1 - 1 ساعة بعد التزويج ، تم تقييم مضان في الجسم الحي . T4- 4 ساعات بعد التزويج ، تم جمع عينات البراز والبلازما ، وتم قياس التألق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إدارة FITC-dextran
- قبل إعطاء FITC-dextran ، قم بصيام الفئران لمدة 4 ساعات مع الحفاظ على الوصول إلى الماء.
ملاحظة: يفضل أن يبدأ الصيام في بداية دورة الضوء (في الصباح). يمكن نقل الفئران إلى قفص جديد بدون فراش أثناء الصيام للحد من coprophagy. - تحضير 200 ميكرولتر من 80 مجم · مل −1 4 كيلو دالتون FITC-dextran (انظر جدول المواد) المخفف في محلول ملحي معقم 1x مخزن بالفوسفات (PBS) (لكل فأر). قم بإعداد العينات حديثا قبل الإعطاء مباشرة ، واحتفظ بها محمية من الضوء.
- تطبيق 200 ميكرولتر من معلق FITC-dextran عن طريق التجويف الفموي لكل فأر باستخدام إبرة تجويف معقمة ومنحنية 38 مم 22 جم مع طرف على شكل كرة أو كمثرى (انظر جدول المواد). ابدأ مؤقتا بعد التزويج الأول ، وانتظر لمدة 5-10 دقائق قبل تحريك الماوس التالي للسماح بالقياسات في الجسم الحي (الخطوة 2) ، مع الحفاظ دائما على 1 ساعة بعد التزويج. احتفظ بنظام التعليق FITC-dextran المتبقي للمنحنى القياسي.
ملاحظة: مباشرة بعد التزويج ، يمكن استبدال الطعام لضمان تكوين البراز.
2. في الجسم الحي قياس مضان
- تخدير الفئران بعد 1 ساعة من التزويج باستخدام 2.5٪ إيزوفلوران أو مخدر بديل. تأكد من تخدير الحيوان بشكل مناسب عن طريق الضغط على إصبع القدم أو الذيل والتأكد من أن الحيوان لا يتفاعل.
- قم بإزالة الفراء من منطقة البطن باستخدام ماكينة حلاقة كهربائية ، وقم بتطبيق مرهم تشحيم العيون بسخاء على العينين لمنع الجفاف. ثم ضع الفئران بشكل فردي في غرفة التصوير مستلقية ظهريا.
ملاحظة: يجب تضمين ماوس تحكم واحد يستقبل PBS أو محلول ملحي بدلا من FITC-dextran لحساب الخلفية أثناء التصوير في الجسم الحي .
- قم بإزالة الفراء من منطقة البطن باستخدام ماكينة حلاقة كهربائية ، وقم بتطبيق مرهم تشحيم العيون بسخاء على العينين لمنع الجفاف. ثم ضع الفئران بشكل فردي في غرفة التصوير مستلقية ظهريا.
- تخيل الفئران باستخدام غرفة التصوير الفلوري (انظر جدول المواد). الحصول على صور لمنطقة البطن ، وتحديد طول الليزر عند 470 نانومتر والدقة عند 2.0 مم.
- ابدأ تشغيل الجهاز والبرنامج بالنقر مع الاستمرار فوق زر البدء . اسمح للنظام بالاحماء.
ملاحظة: قد يحتاج النظام إلى 20 دقيقة أو أكثر للإحماء ، لذلك يجب تشغيل الجهاز مبكرا حتى لا يتداخل مع تصوير الفئران عند 1 ساعة بعد التزجيج. - انقر فوق حالة الجهاز وتأكد من أن جميع الأجهزة التي تم تكوينها تظهر "موافق" قبل المتابعة.
- إذا لزم الأمر ، قم بتسخين الليزر المناسب بالنقر فوق التحكم بالليزر ثم النقر فوق زر اسم الليزر لليزر المطلوب.
- ابدأ دراسة جديدة بالنقر فوق دراسة جديدة. احفظ تحت الملف المناسب بالاسم المطلوب.
- انقر فوق خيارات الدراسة ، ثم أدخل معرف العينة ، واختر الليزر الصحيح والتجربة.
- افتح غرفة التصوير وضع الحيوان ظهريا على لوحة المسح. قم بتأمين الأطراف والذيل بشريط لاصق ، وتأكد من أن الأنف والفم مناسبان بشكل مريح في أنبوب التخدير ، مع الحفاظ على 2.5٪ إيزوفلوران.
- اضبط ارتفاع لوحة المسح بحيث تكون منطقة المسح بطنية قليلا من خط الوسط للحيوان. اضبط اللوحة عن طريق تدوير مقبض الضبط داخل غرفة التصوير. أغلق باب حجرة التصوير وأغلقه.
- حدد المنطقة المراد مسحها ضوئيا باستخدام أداة الرسم . قم بتضمين عرض البطن بالكامل من أعلى الكبد مباشرة إلى المستقيم. انقر فوق أداة التعديل لضبط المنطقة بمجرد رسمها.
- اضبط دقة المسح الضوئي على 2.0 مم ، ثم انقر فوق التالي. بمجرد اكتمال أتمتة الطاقة ، تأكد من صحة الإعدادات ، وقم بإجراء أي تعديلات مطلوبة. انقر فوق ابدأ لبدء الفحص.
- بمجرد اكتمال الفحص ، أخرج الحيوان من غرفة التصوير ، وضعه في حاضنة للحفاظ على درجة حرارة الجسم أثناء التعافي من التخدير.
- انقر فوق متابعة الدراسة للحفاظ على الإعدادات ، ثم كرر الخطوات 2.2.5-2.2.10 حتى يتم فحص جميع الفئران.
- انقر فوق زر الطاقة مع الاستمرار لمدة 3 ثوان لإيقاف تشغيل غرفة التصوير.
- ابدأ تشغيل الجهاز والبرنامج بالنقر مع الاستمرار فوق زر البدء . اسمح للنظام بالاحماء.
- قم بتقييم التألق من خلال مقارنة مضان البطن لكل وفأرة التحكم على صور ذات مقياس موحد باستخدام برنامج مرتبط بنظام التصوير المستخدم (انظر جدول المواد).
- افتح ملفات الصور من خلال العثور عليها تحت اسم الملف المختار. افتح جميع الملفات التي تمت مزامنة الإعدادات في نفس الوقت.
- باستخدام شريط أدوات إعدادات الصورة، استخدم زري مزامنة الصورة ومقياس المزامنة لمزامنة إعدادات الصور، مما يسمح بإجراء مقارنة دقيقة.
- احفظ الصور بمقاييسها المعدلة.
3. قياس مضان في عينات البراز والبلازما
- جمع بيليه البراز من كل فأر في أنبوب معقم بعد 4 ساعات من التزجيج. الحفاظ على الأنابيب في الظلام على الجليد.
- تخدير الفئران عن طريق الحقن داخل الصفاق من 240 ملغ / مل من الصوديوم بنتوباربيتال (التخفيف ، 1: 100 ؛ انظر جدول المواد). يتم تطبيق الدواء بجرعة 0.03 مل/ غ من وزن الجسم.
- جمع عينات دم لا تقل عن 700 ميكرولتر في أنبوب مصنوع لجمع البلازما يحتوي على الهيبارين أو EDTA لمنع التجلط (انظر جدول المواد) عن طريق إدخال أنبوب شعري زجاجي في الضفيرة المداريةالخلفية 14.
ملاحظة: تشمل الطرق البديلة لجمع الدم ثقب القلب أو الانسحاب من الوريد الذيل. نظرا لأن هذا إجراء نهائي ، يجب القتل الرحيم للفئران عن طريق خلع عنق الرحم أو طريقة إنسانية بديلة. اتبع توصيات لجنة أخلاقيات الحيوان المحلية للقتل الرحيم.
- جمع عينات دم لا تقل عن 700 ميكرولتر في أنبوب مصنوع لجمع البلازما يحتوي على الهيبارين أو EDTA لمنع التجلط (انظر جدول المواد) عن طريق إدخال أنبوب شعري زجاجي في الضفيرة المداريةالخلفية 14.
- أجهزة الطرد المركزي عينات الدم عند 9390 × جم لمدة 10 دقائق في درجة حرارة الغرفة. نقل البلازما إلى أنبوب معقم جديد ، والاحتفاظ بها في الظلام على الجليد.
- تمييع 50 ملغ من عينات البراز في 200 ميكرولتر من 1x PBS وتخفيف البلازما 1: 2 مع 1x PBS. يمكن تعديل نسبة التخفيف بناء على شدة إشارة التألق.
- قم بإنشاء منحنى قياسي باستخدام التخفيفات التسلسلية ل FITC-dextran في 1x PBS. بدءا من أعلى تركيز 20 ملغ · مل − 1 FITC ديكستران ، مخفف بعامل 1: 1 بشكل متسلسل 7-10 مرات.
ملاحظة: وبالتالي ، يجب أن تقرأ التركيزات 20 مجم · مل − 1 ، 10 مجم · مل − 1 ، 5 مجم · مل − 1 ، 2.5 مجم · مل − 1 ، 1.25 مجم · مل − 1 ، 0.625 مجم · مل − 1 ، 0.3125 مجم · مل − 1 ، إلخ. - لوحة 100 ميكرولتر عينات ومعايير في لوحة سوداء غير شفافة 96 بئر. قم بتضمين PBS فارغا. اقرأ التألق على قارئ لوحة الفلورسنت (انظر جدول المواد) مع الامتصاص عند 530 نانومتر والإثارة عند 485 نانومتر.
ملاحظة: يمكن طلاء العينات والمعايير في نسختين أو ثلاث نسخ ، ثم يتم حساب متوسط قيم مضان لها. - تحديد تركيز FITC-dextran لكل عينة من خلال مقارنة التألق بالتركيزات المعروفة للمنحنى القياسي. في العينات ، اضرب التركيز في عامل التخفيف (الخطوة 3.5).
النتائج
أظهر تحليل التألق في الجسم الحي أن الفئران التي تلقت النظام الغذائي الضابط فقط كان لديها كمية كبدية أعلى من FITC-dextran ومستويات أعلى من التألق المتبقي في تجويف البطن مقارنة بالفئران التي تلقت النظام الغذائي المكمل بالأنسولين (الشكل 2 أ). كان بعض التألق مرئيا في أعور الفئران التي تلقت حمية الأنسولين ، ولكن كان هناك القليل من تناول الكبد أو انعدامه ، مما يشير إلى أن هذه الوجبات تحمي من زيادة نفاذية الأمعاء.
تعمل مستويات التألق في عينات البلازما والبراز على تعزيز وقياس نظيراتها في الجسم الحي . كان لدى الفئران التي تلقت النظام الغذائي المكمل بالأنسولين مستويات أقل بكثير من FITC-dextran في البلازما مقارنة بالفئران التي تلقت النظام الغذائي الشاهد فقط (الشكل 2 ب). يشير هذا إلى أنهم قد حسنوا وظيفة حاجز الأمعاء لأن كمية أقل من FITC-dextran يمكن أن تتخلل الحاجز المعوي في الدورة الدموية. بالتوافق ، كان لدى الفئران التي تلقت حمية الأنسولين مستويات أعلى بكثير من FITC-dextran في برازها من الفئران التي تلقت النظام الغذائي الضابط فقط (الشكل 2C). هذا يعزز أن لديهم وظيفة حاجز الأمعاء سليمة حيث بقي FITC-dextran في القولون حتى إفرازه ، كما يعتبر طبيعيا. تشير المستويات المنخفضة من FITC-dextran في براز الفئران الضابطة إلى أنه يتخلل الحاجز المعوي في الدورة الدموية بدلا من إفرازه بشكل مناسب. المستويات العالية من FITC-dextran في البلازما تعزز هذه النتيجة.
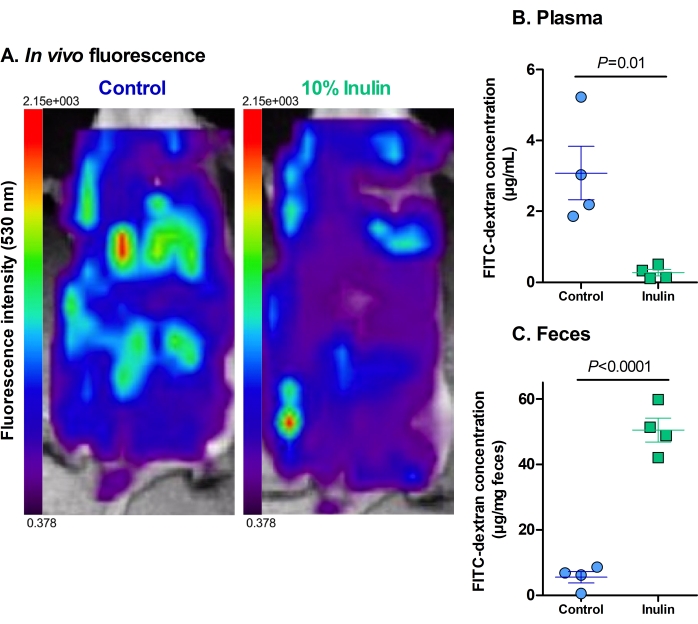
الشكل 2: المكملات الغذائية مع الأنسولين تقلل من انتقال FITC-dextran عبر حاجز الأمعاء. أ: التألق المتبقي والامتصاص الكبدي ل FITC-dextran. الأحمر = أعلى كثافة ؛ أرجواني داكن = أقل كثافة. الحد الأقصى للتألق 2.15 × 103 ، الحد الأدنى من التألق 0.378. (ب) التركيز البلازمي ل FITC-dextran. ف = 0.010. (ج) تركيز البراز من FITC-dextran. ف = 0.00003. N = 4 لكل مجموعة. يتم تمثيل البيانات كمتوسط ± SEM. تمثل كل نقطة ماوس واحد. اختبار t للطالب غير المقترن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وظيفة حاجز الأمعاء هي جزء لا يتجزأ من العديد من عمليات المرض المختلفة. وبالتالي ، فإن تقييم نفاذية الأمعاء بطريقة غير جراحية وفعالة من حيث التكلفة وقابلة للقياس الكمي أمر ضروري لتمثيل هذه الأمراض بدقة في النماذج الحيوانية. يوفر اختبار FITC-dextran إمكانية هذا التمثيل. ومع ذلك ، يتضمن هذا البروتوكول العديد من الخطوات الحاسمة التي يجب إكمالها بدقة للحصول على نتائج موثوقة. أولا ، من الضروري ضمان استخدام FITC-dextran ذي الحجم المناسب. لفحص نفاذية الجسم الحي ، 4 كيلو دالتون FITC-dextran هو الوزن الجزيئي الأمثل ، ومع زيادة الوزن الجزيئي ، تنخفض النفاذية15. وبالتالي ، فإن استخدام FITC-dextran بوزن جزيئي مختلف قد يوفر نتائج مربكة أو غير موثوقة. بالإضافة إلى ذلك ، من المهم ملاحظة وقت كل تجويف وضبط النقاط الزمنية لجمع البيانات في الجسم الحي وجمع البلازما والبراز وفقا لذلك. على سبيل المثال ، إذا تم قطع فأرين بفارق 10 دقائق ، فيجب أن تحدث قراءات مضان في الجسم الحي وجمع البراز والبلازما أيضا على بعد 10 دقائق. تسمح مقارنة التألق في نفس النقاط الزمنية بتمثيل أكثر دقة للاختلافات في النفاذية. علاوة على ذلك ، يجب أن يتناوب الترتيب الذي يتم به اختبار الحيوانات من مجموعات مختلفة لمنع تأثير التجميع بسبب التوقيت. بدلا من اختبار جميع الحيوانات في المجموعة أ أولا ، ثم جميع الحيوانات في المجموعة ب الثانية (AAABBB) ، يوصى بتبديل المجموعة بعد كل (ABABAB).
يمكن تعديل هذا الفحص ليشمل فقط تقييم عينات البلازما والبراز إذا كان هناك نقص في الوصول إلى جهاز التصوير. على الرغم من أن التصوير الفلوري المباشر في الجسم الحي يسمح بتصور المدخول الكبدي ومضان البطن المتبقي ، إلا أن تقييم التألق في عينات البلازما والبراز لا يزال يوفر قياسا كميا لنفاذية الأمعاء. علاوة على ذلك ، كما هو موضح في التجربة الموصوفة ، ترتبط مستويات التألق في البلازما والبراز جيدا بالتصوير في الجسم الحي . بالإضافة إلى ذلك ، يمكن تعديل هذا الفحص ليشمل التصوير في الجسم الحي فقط. هذا يسمح للحيوانات أن تبقى على قيد الحياة لمواصلة اختبار المعلمات الأخرى أو مراقبة كيفية تغير نفاذية الأمعاء مع مرور الوقت. وبالتالي ، فإن القدرة على تعديل هذا الفحص تجعله متاحا ، ولكنه لا يزال كميا. أخيرا ، تم استخدام جرعة 200 ميكرولتر من 80 مجم · مل −1 FITC-dextran لكل فأر سابقا وثبت أنها فعالة في الفئران ذات الاختلافات الصغيرة في وزن الجسم16. علاوة على ذلك ، من المهم ملاحظة أن جميع الفئران المستخدمة في قسم النتائج التمثيلية تزن حوالي 20 جراما ، مما يسمح باستخدام نفس الجرعة لكل فأر. ومع ذلك ، لحساب الاختلافات في وزن الجسم ، يمكن إعطاء FITC-dextran بجرعة 0.6-0.8 مجم / جم من وزن الجسم ، على سبيل المثال17. بشكل حاسم ، بغض النظر عن الجرعة المستخدمة ، من المهم الحد من الكمية التي يتم التخلص منها لكل فأر إلى أقل من 10 مل · كجم − 1 لمنع المضاعفات أو الانزعاج18.
على الرغم من أن اختبار FITC-dextran يوفر طريقة فعالة لتقييم وظيفة حاجز الأمعاء ، إلا أنه لا يزال لديه بعض القيود. أحد قيود هذا النموذج هو أنه يتطلب صيام الفئران لعدة ساعات ، مما يعني أنه لا يمكن الاعتماد على مقارنة هذه النتائج بتلك الموجودة في الفئران التي لم يتم صيامها. بالإضافة إلى ذلك ، قد يؤثر الصيام على النتائج في بعض النماذج التي تتطلب جداول تغذية صارمة ، مثل عند قياس نسبة الجلوكوز في الدم في النماذج الحيوانية لمرض السكري.
على الرغم من هذه القيود ، يظل اختبار FITC-dextran طريقة فعالة لتحليل نفاذية الأمعاء لأنها كمية ومتعددة الاستخدامات وفعالة من حيث التكلفة وأقل توغلا من العديد من الطرق الكلاسيكية. على سبيل المثال ، المجسات الشائعة المستخدمة لقياس نفاذية الأمعاء هي مجسات السكاريد الصغيرة أو Cr-EDTA ، والتي لها بعض المزايا19. ومع ذلك ، فإن بعض مجسات السكاريد لها نفاذية خاصة بالمنطقة فقط. نظرا لأنها تتحلل مائيا في الجزء البعيد من الأمعاء الدقيقة ، فإنها لا تقدم نظرة ثاقبة لنفاذية القولون19. من ناحية أخرى ، يمكن أن يوفر Cr-EDTA معلومات حول نفاذية القولون ولكنه يتطلب قياسات لمدة 24 ساعة ، مما يجعل العبء الزمني لهذه الطريقة أعلى بكثير من اختبار FITC-dextran20. علاوة على ذلك ، لا توفر أي من هذه الطرق التصوير المباشر في الجسم الحي لهذا الفحص. لذلك ، يوفر اختبار FITC-dextran خيارا بسيطا ومباشرا وفعالا نسبيا مقارنة بالطرق البديلة لقياس نفاذية الأمعاء.
أخيرا ، في عمليات المرض مثل IBDs4 ومرض الزهايمر21 وأمراض الكبد2 ، تعد نفاذية الأمعاء معلمة مهمة يمكن قياسها باستخدام مقايسة FITC-dextran لتحسين الدراسات. على سبيل المثال ، عند تطوير علاجات جديدة ، مثل العلاجات المناعية لمرض التهاب الأمعاء ، يمكن استخدام هذا الاختبار لاختبار فعالية العلاج للحفاظ على سلامة حاجز الأمعاء. بالنظر إلى أن ضعف وظيفة حاجز الأمعاء قد يكون متورطا في إدامة الالتهاب المزمن في جامعة كاليفورنيا ، على سبيل المثال ، من المهم فحص مدى جودة الحماية العلاجية من زيادة النفاذية4. هذا مثال واحد فقط ، لكن اختبار FITC-dextran هو طريقة يمكن الوصول إليها وقابلة للقياس الكمي لقياس نفاذية الأمعاء في العديد من مجالات وجوانب البحث المختلفة.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم إفصاحات.
Acknowledgements
تم تمويل هذا العمل بمنحة من مجلس أبحاث العلوم الطبيعية والهندسة في كندا (منحة RGPIN-2018-06442 إلى MMS). نشكر مرفق الحيوانات في CRCHUM والدكتور Junzheng Peng من منصة التنميط الظاهري للقلب والأوعية الدموية.
Materials
| Name | Company | Catalog Number | Comments |
| 50 ppm Fe Diet (10% Inulin) | Envigo Teklad | TD.190651 | Representative Results |
| 50 ppm Fe Diet (FeSO4) | Envigo Teklad | TD.190723 | Representative Results |
| BALB/c Mice 49-55 Days, Female | Charles River | 028BALB/C | Representative Results |
| BD 1 mL Syringe Tuberculin Slip Tip | Becton, Dickinson and Company | 309659 | For gavage |
| BD Microtainer Tubes - With LH (Lithium Heparin) | Becton, Dickinson and Company | 365965 | For plasma collection |
| Centrifuge 5420 | Eppendorf | S420KN605698 | |
| Curved Gavage Needle (Gavage Cannula) 7.7.0 38 mm x 22 G | Harvard Apparatus Canada | 34-024 | No longer available - A potential alternative is available at Instech Labs (FTP-22-38) |
| Euthanyl (Pentobarbital Sodium) 240 mg/mL | Bimeda-MTC Animal Health Inc. | 141704 | 1/100 dilution; Administered via intraperitoneal injection at 0.03 mL/g body weight |
| FITC-dextran 4 | TdB Labs | 20550 | |
| Heparinized Capillary Tubes | Kimble Chase Life Science and Research | 2501 | For retro-orbital blood collection |
| Microplate, PS, 96-well, Flat-bottom (Chimney Well), Black, Flutrac, Med. Binding | Greiner Bio-one | 655076 | |
| MiniARCO Clipper Kit | Kent Scientific | CL8787-KIT | For hair removal |
| Optix MX2 and Optix Optiview | Advanced Research Technologies | 2.02.00.6 | Fluorescence imaging machine and software |
| Phosphate Buffered Saline 1x (PBS) | Wisent Inc | 311-010-LL | |
| Puralube Vet Ointment | Dechra | 12920060 | Ophthalmic ointement to prevent eye damage during anesthesia |
| Spark Multiplate Reader | Tecan | 30086376 |
References
- König, J., et al. Human intestinal barrier function in health and disease. Clinical and Translational Gastroenterology. 7 (10), 196 (2016).
- Lorenzo-Zuniga, V., et al. Insulin-like growth factor I improves intestinal barrier function in cirrhotic rats. Gut. 55 (9), 1306-1312 (2006).
- Schwarz, B. T., et al. LIGHT signals directly to intestinal epithelia to cause barrier dysfunction via cytoskeletal and endocytic mechanisms. Gastroenterology. 132 (7), 2383-2394 (2007).
- Schmitz, H., et al. Altered tight junction structure contributes to the impaired epithelial barrier function in ulcerative colitis. Gastroenterology. 116 (2), 301-309 (1999).
- Fouts, D. E., Torralba, M., Nelson, K. E., Brenner, D. A., Schnabl, B. Bacterial translocation and changes in the intestinal microbiome in mouse models of liver disease. Journal of Hepatology. 56 (6), 1283-1292 (2012).
- Galipeau, H. J., Verdu, E. F. The complex task of measuring intestinal permeability in basic and clinical science. Neurogastroenterology and Motility. 28 (7), 957-965 (2016).
- Bordoni, L., et al. Positive effect of an electrolyzed reduced water on gut permeability, fecal microbiota and liver in an animal model of Parkinson's disease. PLoS One. 14 (10), 0223238 (2019).
- Wang, Q., Fang, C. H., Hasselgren, P. -. O. Intestinal permeability is reduced and IL-10 levels are increased in septic IL-6 knockout mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 281 (3), 1013-1023 (2001).
- Crapser, J., et al. Ischemic stroke induces gut permeability and enhances bacterial translocation leading to sepsis in aged mice. Aging. 8 (5), 1049-1063 (2016).
- Mal Earley, Z., et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS One. 10 (7), 0129996 (2015).
- Sharon, G., et al. Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice. Cell. 177 (6), 1600-1618 (2019).
- Schroeder, B. O., et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration. Cell Host & Microbe. 23 (1), 27-40 (2018).
- Hajjar, R., et al. Improvement of colonic healing and surgical recovery with perioperative supplementation of inulin and galacto-oligosaccharides. Clinical Nutrition. 40 (6), 3842-3851 (2021).
- JoVE. Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database. , (2022).
- Costantini, T. W., et al. Quantitative assessment of intestinal injury using a novel in vivo, near-infrared imaging technique. Molecular Imaging. 9 (1), 30-39 (2010).
- Thevaranjan, N., et al. Age-associated microbial dysbiosis promotes intestinal permeability, systemic inflammation, and macrophage dysfunction. Cell Host & Microbe. 21 (4), 455-466 (2017).
- Chassaing, B., Aitken, J. D., Malleshappa, M., Vijay-Kumar, M. Dextran sulfate sodium (DSS)-induced colitis in mice. Current Protocols in Immunology. 104, 1-14 (2014).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Arrieta, M. C., Bistritz, L., Meddings, J. B. Alterations in intestinal permeability. Gut. 55 (10), 1512-1520 (2006).
- von Martels, J. Z. H., Bourgonje, A. R., Harmsen, H. J. M., Faber, K. N., Dijkstra, G. Assessing intestinal permeability in Crohn's disease patients using orally administered 52Cr-EDTA. PLoS One. 14 (2), 0211973 (2019).
- Gonzalez-Escamilla, G., Atienza, M., Garcia-Solis, D., Cantero, J. L. Cerebral and blood correlates of reduced functional connectivity in mild cognitive impairment. Brain Structure and Function. 221 (1), 631-645 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved