Method Article
フルオレセインイソチオシアネート標識デキストランを用いたマウスの腸バリア完全性の評価
要約
本研究では、フルオレセインイソチオシアネート標識(FITC)デキストラン を経口強制 投与してマウスに投与し、 in vivo および血漿および糞便サンプルの両方で腸透過性を評価します。腸のバリア機能は多くの疾患プロセスで影響を受けるため、この直接的かつ定量的なアッセイは、さまざまな研究分野で使用できます。
要約
腸のバリアの完全性は、腸の健康の特徴です。腸バリアの完全性は、血漿炎症マーカーの測定や脾臓やリンパ節への細菌の転座などの間接マーカーを使用して評価できますが、ゴールドスタンダードは、選択した分子が腸粘膜層を通過して全身循環に向かう能力を直接定量化します。この記事では、非侵襲的で費用効果が高く、負担の少ない技術を使用して、フルオレセインイソチオシアネート標識デキストラン(FITC-デキストラン)を使用してマウスの腸透過性を定量化し、リアルタイムで追跡します。FITC−デキストランの経口補給の前に、マウスを絶食させる。次に、リン酸緩衝生理食塩水(PBS)で希釈したFITCデキストランで経管投与します。経管栄養の1時間後、マウスにイソフルランを用いた全身麻酔を行い、 in vivo 蛍光をイメージングチャンバー内で可視化する。この技術は、腹腔内の残留蛍光と肝取り込みを評価することを目的としており、これは蛍光プローブの門脈移動を示唆しています。経口強制投与の4時間後に血液および便サンプルを採取し、マウスを屠殺する。次に、PBSで希釈した血漿および糞便サンプルをメッキし、蛍光を記録します。次に、FITCデキストランの濃度を検量線を用いて計算する。以前の研究では、 in vivo イメージングにより、低繊維食によって誘導される腸の障壁が弱いマウスでは蛍光が肝臓に急速に広がることが示されていますが、腸のバリアを強化するために繊維を補給したマウスでは、蛍光シグナルは主に胃腸管に保持されます。さらに、この研究では、対照マウスは血漿蛍光が上昇し、便中の蛍光が減少しましたが、逆に、イヌリンを添加したマウスは腸内の蛍光シグナルのレベルが高く、血漿中の蛍光シグナルのレベルが低かった。要約すると、このプロトコルは、腸の健康のマーカーとして腸透過性の定性的および定量的測定を提供します。
概要
腸の障壁は、健康と病気の両方で重要な役割を果たしています。必要な栄養素を腸管腔から循環に浸透させると同時に、病原体や抗原などの炎症誘発性分子の侵入を防ぐことの間の複雑なバランスが必要です1。透過性の増加は、肝疾患や炎症性腸疾患(IBD)などの多くの胃腸障害によって引き起こされる可能性があります2,3。たとえば、IBDである潰瘍性大腸炎(UC)では、慢性炎症がタイトジャンクションの破壊、それに続く腸関門の破壊、および細菌の転座につながり、粘膜および全身の炎症を永続させる可能性があります4。
したがって、腸のバリアの完全性は、腸の健康の重要なマーカーです。しかしながら、腸透過性を測定するための現在の方法は、多くの制限を有する。例えば、血漿炎症マーカーまたは脾臓およびリンパ節への細菌転座を測定する方法は間接的である5,6。他の方法は侵襲的で時間がかかる可能性があります。この記事では、腸管透過性を直接かつ定量的に測定する非侵襲的で費用効果の高いアッセイについて説明します。このアッセイでは、フルオレセイン-イソチオシアネート標識デキストラン(FITC-デキストラン)を使用して、in vivoで蛍光を測定することにより、腸透過性をリアルタイムで追跡します。さらに、血漿および糞便中のFITCデキストランレベルを測定すると、腸透過性が定量化されます(図1)。
FITCデキストラン透過性アッセイは、パーキンソン病7、敗血症8、虚血性脳卒中9、および火傷10の動物モデルを含む、多くの異なる状況で以前に使用されてきました。さらに、このアッセイは最近、腸内細菌叢がさまざまな疾患プロセスにどのように関与しているか、および潜在的な治療法としてどのように標的化または操作されるかを理解するのに役立つように使用されています。たとえば、老化11、IBD12、結腸直腸癌13、および自閉症スペクトラム障害11におけるマイクロバイオームおよびマイクロバイオームベースの治療法の研究に使用されています。腸のバリア機能は健康と病気の多くの側面に関与しているため、このアッセイは広く使用されています。その比較的単純さと低い時間負担により、腸バリアの完全性を変化させる疑いのあるin vivo条件のテストに最適です。その定量的結果は、潜在的な治療の有効性を判断するのに役立ちます。
この研究では、腸バリア機能に対する食事の効果をFITCデキストランアッセイを使用して評価しました。対照食を投与したマウスの腸透過性とイヌリン添加食を投与したマウスの腸透過性を比較した。イヌリンは、腸のバリア機能を改善することが示されている有益なオリゴ糖です12,13。in vivo蛍光測定(バックグラウンド)では、さらに1匹の未処理マウスを陰性対照として使用し、FITCデキストランの代わりにPBSを投与した。この実験は、FITC-デキストランアッセイが腸透過性を評価するための貴重なツールであることを示しています。
プロトコル
すべての手順は、CRCHUMの施設内動物管理委員会による承認後、カナダ動物管理評議会のガイドラインに従って実行されました。商業的な情報源( 材料の表を参照)から入手した8週齢の雌のBALB / cマウスを本研究に使用しました。動物は2週間10%イヌリンwt / wtの栄養補助食品を受けました。対照群は、イヌリンサプリメントを欠いた同様の食事を受けました。マウスは食事に 自由 にアクセスできました。アッセイの概要を 図1に示します。
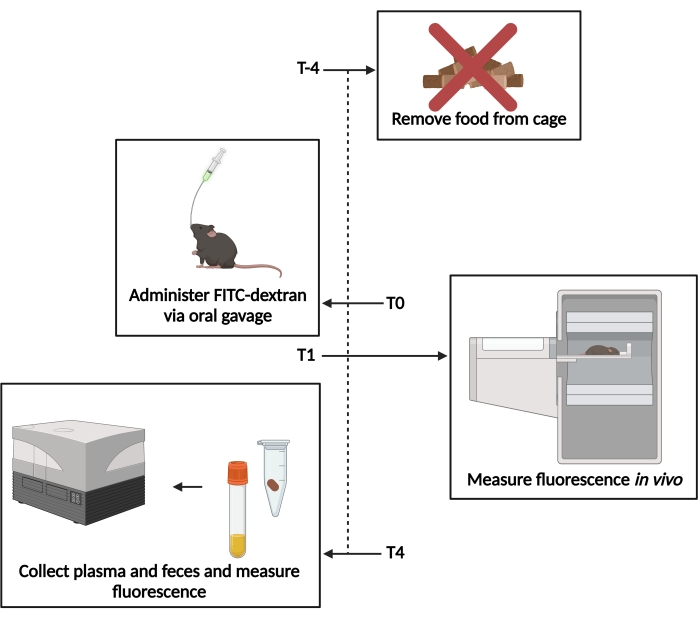
図1:FITCデキストランアッセイの概略図。経管栄養の4時間前にT−4-食物へのアクセスが除去された。T0-FITC−デキストランは、経口経管栄養を介して投与された。T1-経管栄養の1時間後、インビボ蛍光を評価した。T4-経管投与の4時間後、糞便および血漿サンプルを採取し、蛍光を測定した。この図の拡大版を表示するには、ここをクリックしてください。
1.FITCデキストランの投与
- FITC−デキストランを投与する前に、水への 自由 アクセスを維持しながらマウスを4時間絶食させる。
注:断食は、できれば光サイクルの開始時(朝)に開始する必要があります。マウスは、食作用を制限するために、絶食中に寝具なしで新しいケージに移されてもよい。 - 滅菌した1xリン酸緩衝生理食塩水(PBS)で希釈した80 mg·mL−1 4 kDaのFITCデキストラン( 材料の表を参照)を200 μL調製します(マウスあたり)。投与直前にサンプルを新たに調製し、光から保護してください。
- ボール型または洋ナシ型の先端を持つ38 mm 22 Gの滅菌された湾曲した経管栄養針を使用して、200 μLのFITCデキス トラン懸濁液を 経口強制投与して各マウスに投与します( 材料の表を参照)。最初の経管栄養後にタイマーを開始し、次のマウスを経管栄養化する前に5〜10分待って、 in vivo 測定を可能にし(ステップ2)、経管栄養後1時間を常に維持します。残りのFITCデキストラン懸濁液を標準曲線に保ちます。
注:経管投与の直後に、糞便の形成を確実にするために食物を交換することができます。
2. 生体内 蛍光測定
- 経管投与の1時間後に、2.5%イソフルランまたは代替麻酔薬を使用してマウスを麻酔します。.つま先や尻尾をつまんで動物が適切に麻酔をかけられていることを確認し、動物が反応しないようにします。
- 電気シェーバーを使用して腹部から毛皮を取り除き、乾燥を防ぐために眼科用潤滑軟膏を目にたっぷりと塗ります。次に、マウスを背側に横たわっているイメージングチャンバーに個別に配置します。
注: in vivo イメージング中のバックグラウンドを説明するために、FITCデキストランの代わりにPBSまたは生理食塩水を投与するコントロールマウスを1つ含める必要があります。
- 電気シェーバーを使用して腹部から毛皮を取り除き、乾燥を防ぐために眼科用潤滑軟膏を目にたっぷりと塗ります。次に、マウスを背側に横たわっているイメージングチャンバーに個別に配置します。
- 蛍光イメージングチャンバーを用いてマウスを画像化する( 材料の表を参照)。レーザーの長さを470 nm、解像度を2.0 mmに設定して、腹部の画像を取得します。
- スタートボタンをクリックしたままにして、マシンとソフトウェアを起動します。システムをウォームアップします。
注意: システムのウォームアップには20分以上かかる場合があるため、経管投与後1時間でマウスのイメージングを妨げないように、マシンを早めに起動する必要があります。 - [ デバイスの状態 ]をクリックし、続行する前に、構成されているすべてのデバイスが「OK」と表示されていることを確認します。
- 必要に応じて、[レーザー 制御 ]をクリックして適切なレーザーをウォームアップし、目的のレーザー の[レーザー名 ]ボタンをクリックしてください。
- 新しい試験をクリックして、 新しい試験を開始します。適切なファイルの下に目的の名前で保存します。
- 研究オプションをクリックし、試験片IDを入力して、正しいレーザーと実験を選択します。
- イメージングチャンバーを開き、動物をスキャンプレートの上に背側に置きます。手足と尾をテープで固定し、鼻と口が麻酔チューブにぴったりと収まるようにし、2.5%イソフルランを維持します。
- スキャン領域が動物の正中線からわずかに腹側になるように、スキャンプレートの高さを調整します。イメージングチャンバー内の調整ノブを回してプレートを調整します。イメージングチャンバーのドアを閉じてロックします。
- [描画] ツールを使用してスキャンする領域を選択します。肝臓のすぐ上から直腸までの腹部の全幅を含めます。[変更]ツールをクリックして、描画した領域を調整します。
- スキャン解像度を2.0 mmに設定し、[ 次へ]をクリックします。電源の自動化が完了したら、設定が正しいことを確認し、必要な調整を行います。[ 開始 ]をクリックしてスキャンを開始します。
- スキャンが完了したら、動物をイメージングチャンバーから取り出し、インキュベーターに入れて、麻酔から回復しながら体温を維持します。
- [ 調査を続行 ]をクリックして設定を維持し、すべてのマウスがスキャンされるまで手順2.2.5〜2.2.10を繰り返します。
- 電源ボタンをクリックして3秒間押し続けると、イメージングチャンバーの電源が切れます。
- スタートボタンをクリックしたままにして、マシンとソフトウェアを起動します。システムをウォームアップします。
- 使用した画像化システムに関連するソフトウェアを使用して、均一にスケーリングされた画像上の各動物および対照マウスの腹部蛍光を比較することにより蛍光を評価した( 材料の表を参照)。
- 選択したファイル名で画像ファイルを見つけて開きます。設定が同期されているすべてのファイルを同時に開きます。
- 画像設定ツールバーを使用して、[ 画像の同期 ] ボタンと [スケールの同期] ボタンを使用して画像の設定を同期し、正確な比較を可能にします。
- 調整した縮尺で画像を保存します。
3. 糞便および血漿中の蛍光測定
- 経管投与の4時間後に滅菌チューブに各マウスから糞便ペレットを採取する。チューブを氷の上で暗闇に保ちます。
- 240 mg / mLのペントバルビタールナトリウムの腹腔内注射 を介して マウスを麻酔します(希釈、1:100; 材料の表を参照)。0.03 mL / g体重の用量で投与します。.
- ガラス毛細管を眼窩後神経叢に挿入して凝固を防ぐために、ヘパリンまたはEDTAを含む血漿収集用に作られたチューブで少なくとも700μLの血液サンプルを収集します( 材料の表を参照)14。
注:採血の代替方法には、心臓穿刺または尾静脈からの離脱が含まれます。これは末期処置であるため、マウスは頸部脱臼または代替の人道的方法 を介して 安楽死させる必要があります。安楽死に関する地元の動物倫理委員会の推奨事項に従ってください。
- ガラス毛細管を眼窩後神経叢に挿入して凝固を防ぐために、ヘパリンまたはEDTAを含む血漿収集用に作られたチューブで少なくとも700μLの血液サンプルを収集します( 材料の表を参照)14。
- 血液サンプルを9,390 x g で室温で10分間遠心分離します。血漿を新しい滅菌チューブに移し、氷上で暗所に保管します。
- 50 mgの糞便サンプルを200 μLの1x PBSで希釈し、血漿を1x PBSで1:2に希釈します。希釈比は、蛍光シグナルの強度に基づいて変更することができる。
- 1x PBS中のFITCデキストランの段階希釈を使用して検量線を生成します。最高濃度の20 mg·mL−1 FITCデキストランから始めて、1:1の係数で連続して7〜10倍に希釈します。
注:したがって、濃度は20 mg·mL-1、10 mg·mL-1、5 mg·mL-1、2.5 mg·mL-1、1.25 mg·mL-1、0.625 mg·mL-1、0.3125 mg·mL-1などを読み取る必要があります。 - 100 μLのサンプルと標準物質を不透明な黒色の96ウェルプレートにプレートします。PBS ブランクを含めます。蛍光プレートリーダー( 材料表を参照)で、530 nmの吸収と485 nmの励起で蛍光を読み取ります。
注:サンプルと標準物質は、重複または三重にメッキすることができ、その後、それらの蛍光値が平均化されます。 - 蛍光を既知の標準曲線の濃度と比較することにより、サンプルあたりのFITCデキストランの濃度を決定します。サンプルでは、濃度に希釈係数を掛けます(ステップ3.5)。
結果
in vivo蛍光の分析は、対照食のみを投与されたマウスは、イヌリン添加食を摂取したマウスと比較して、FITCデキストランの肝臓摂取量が多く、腹腔内の残留蛍光レベルが高いことを示しました(図2A)。イヌリン食を投与されたマウスの盲腸にはいくらかの蛍光が見られましたが、肝摂取はほとんどまたはまったくなく、これらの食餌が腸透過性の増加から保護されていることを示しています。
血漿および糞便サンプルの蛍光レベルは、in vivo 対応物を強化し、定量化するために機能します。イヌリン添加食を投与されたマウスは、対照食のみを摂取したマウスと比較して、血漿中のFITCデキストランのレベルが有意に低かった(図2B)。これは、腸バリアを循環に浸透させるFITCデキストランが少ないため、腸バリア機能が改善されたことを示しています。一致して、イヌリン食を摂取したマウスは、対照食のみを摂取したマウスよりも糞便中のFITCデキストランのレベルが有意に高かった(図2C)。これは、正常と見なされるように、FITCデキストランが排泄されるまで結腸に留まるため、それらが無傷の腸バリア機能を持っていたことを補強します。対照マウスの糞便中のFITC−デキストランのレベルが低いことは、適切に排泄されるのではなく、腸管関門を通って循環に浸透したことを示している。血漿中の高レベルのFITCデキストランは、この発見を補強します。
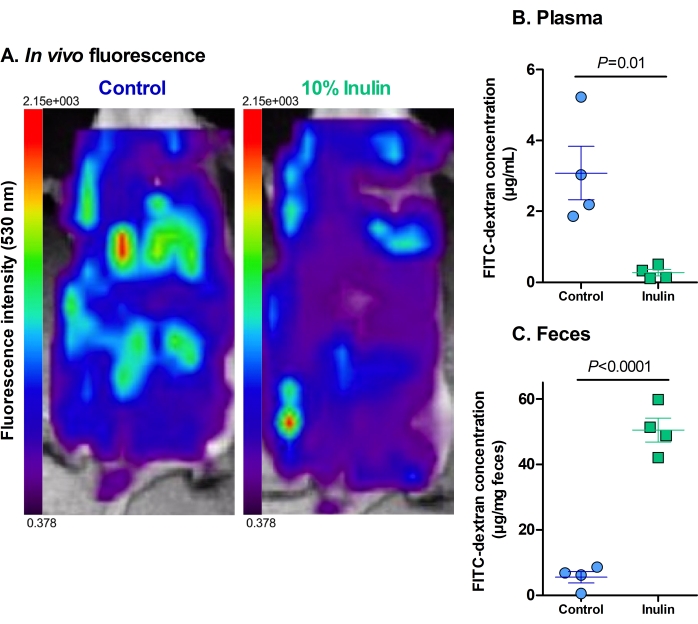
図2:イヌリンの栄養補助食品は、腸関門を通るFITCデキストランの転座を減少させます 。 (A)FITCデキストランの残留蛍光と肝取り込み。赤=最高強度。濃い紫=最低強度。最大蛍光は2.15 x 103、最小蛍光は0.378です。(B)FITCデキストランの血漿中濃度。 P = 0.010。(C)FITCデキストランの糞便濃度。 P = 0.00003。グループあたりN = 4。データはSEM±平均値として表されます。各ドットは 1 つのマウスを表します。対応のないスチューデントの t検定。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
腸のバリア機能は、多くの異なる疾患プロセスの不可欠な部分です。したがって、非侵襲的で費用効果が高く、定量化可能な方法で腸透過性を評価することは、動物モデルでこれらの疾患を正確に表現するために不可欠です。FITC-デキストランアッセイは、この表現の可能性を提供します。ただし、このプロトコルには、信頼できる結果を得るために正確に完了する必要があるいくつかの重要な手順が含まれます。第一に、適切なサイズのFITCデキストランの使用を確保することが不可欠です。 生体内 透過性を調べるには、4kDaのFITC−デキストランが最適な分子量であり、分子量が増加するにつれて透過性は低下する15。したがって、異なる分子量のFITC−デキストランを使用すると、混乱を招くか、信頼性の低い結果が得られる可能性があります。さらに、各経管栄養の時間に注意し、 それに応じてin vivo データ収集と血漿および糞便の収集の時点を調整することが重要です。例えば、2匹のマウスを10分間隔で経管投与する場合、 in vivo 蛍光測定値および糞便および血漿の収集も10分間隔で行われなければならない。同じ時点での蛍光を比較することで、透過性の違いをより正確に表現できます。さらに、異なるグループの動物がテストされる順序は、タイミングによるクラスタリング効果を防ぐために交互にする必要があります。最初にグループAのすべての動物をテストし、次にグループBのすべての動物を2番目にテストする代わりに(AAABBB)、各動物の後にグループを切り替えることをお勧めします(ABABAB)。
このアッセイは、イメージングマシンへのアクセスが不足している場合、血漿および糞便サンプルの評価のみを含むように変更できます。 in vivoでの 直接蛍光イメージングでは、肝摂取量と腹部残留蛍光を視覚化できますが、血漿および糞便サンプルの蛍光を評価することで、腸透過性の定量的測定が可能になります。さらに、記載された実験によって実証されるように、血漿および糞便中の蛍光レベルは、 インビボ イメージングとよく相関する。さらに、このアッセイは、 インビボ イメージングのみを含むように変更することができる。これにより、動物を生かして他のパラメータをテストし続けたり、腸透過性が時間の経過とともにどのように変化するかを監視したりすることができます。したがって、このアッセイを変更する機能により、アクセス可能になりますが、それでも定量的です。最後に、各マウスに与えられた80mg・mL−1 FITC−デキストランの200μLの投与量は以前に使用されており、体重のわずかな違いがあるマウスに有効であることが示されました16。さらに、代表的な結果セクションで使用したすべてのマウスの体重は約20 gであり、各マウスに同じ投与量を使用できることに注意することが重要です。しかしながら、体重の違いを説明するために、FITC−デキストランは、0.6〜0.8mg/g体重、例えば17の用量で投与することができる。重要なのは、使用する投与量に関係なく、合併症や不快感を防ぐために、各マウスに強制投与される量を10mL・kg−1 未満に制限することが重要です18。
FITCデキストランアッセイは、腸のバリア機能を評価するための効果的な方法を提供しますが、それでもいくつかの制限があります。このモデルの1つの制限は、マウスを数時間絶食させる必要があるため、これらの結果を絶食していないマウスの結果と比較することは信頼できないことを意味します。さらに、絶食は、糖尿病の動物モデルで血糖値を測定する場合など、厳密な摂食スケジュールを必要とする特定のモデルの結果に影響を与える可能性があります.
これらの制限にもかかわらず、FITC-デキストランアッセイは、定量的で、用途が広く、費用対効果が高く、多くの古典的な方法よりも侵襲性が低いため、腸透過性を分析するための効果的な方法であり続けています。例えば、腸透過性を測定するために使用される一般的なプローブは、いくつかの利点を有する低糖プローブまたはCr−EDTAである19。しかしながら、一部の糖プローブは領域特異的透過性のみを有する。それらは小腸の遠位部で加水分解されるため、結腸透過性についての洞察を提供しません19。一方、Cr-EDTAは結腸透過性に関する情報を提供できますが、24時間の測定が必要であり、この方法の時間的負担はFITC-デキストランアッセイ20よりもはるかに高くなります。さらに、これらの方法のいずれも、このアッセイの直接 的なインビボ イメージングを提供しない。したがって、FITC-デキストランアッセイは、腸透過性を測定するための代替方法と比較して、比較的単純で直接的かつ効果的なオプションを提供します。
最後に、IBD4、アルツハイマー病21、肝疾患2などの疾患プロセスでは、腸透過性は、研究を改善するためにFITCデキストランアッセイを使用して測定できる重要なパラメーターです。例えば、IBDの免疫療法などの新規治療法の開発において、このアッセイは、腸バリアの完全性を維持するための治療の有効性を試験するために使用することができる。腸バリア機能の障害がUCの慢性炎症の永続に関与している可能性があることを考慮すると、たとえば、治療が透過性の増加からどれだけうまく保護するかを調べることが重要です4。これはほんの一例ですが、FITC-デキストランアッセイは、研究のさまざまな分野や側面で腸透過性を測定するためのアクセス可能で定量化可能な方法です。
開示事項
著者は、開示がないことを宣言します。
謝辞
この作業は、カナダ自然科学工学研究評議会からの助成金(MMSへの助成金RGPIN-2018-06442)によって資金提供されました。CRCHUMの動物施設と心臓血管表現型プラットフォームのJunzheng Peng博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 50 ppm Fe Diet (10% Inulin) | Envigo Teklad | TD.190651 | Representative Results |
| 50 ppm Fe Diet (FeSO4) | Envigo Teklad | TD.190723 | Representative Results |
| BALB/c Mice 49-55 Days, Female | Charles River | 028BALB/C | Representative Results |
| BD 1 mL Syringe Tuberculin Slip Tip | Becton, Dickinson and Company | 309659 | For gavage |
| BD Microtainer Tubes - With LH (Lithium Heparin) | Becton, Dickinson and Company | 365965 | For plasma collection |
| Centrifuge 5420 | Eppendorf | S420KN605698 | |
| Curved Gavage Needle (Gavage Cannula) 7.7.0 38 mm x 22 G | Harvard Apparatus Canada | 34-024 | No longer available - A potential alternative is available at Instech Labs (FTP-22-38) |
| Euthanyl (Pentobarbital Sodium) 240 mg/mL | Bimeda-MTC Animal Health Inc. | 141704 | 1/100 dilution; Administered via intraperitoneal injection at 0.03 mL/g body weight |
| FITC-dextran 4 | TdB Labs | 20550 | |
| Heparinized Capillary Tubes | Kimble Chase Life Science and Research | 2501 | For retro-orbital blood collection |
| Microplate, PS, 96-well, Flat-bottom (Chimney Well), Black, Flutrac, Med. Binding | Greiner Bio-one | 655076 | |
| MiniARCO Clipper Kit | Kent Scientific | CL8787-KIT | For hair removal |
| Optix MX2 and Optix Optiview | Advanced Research Technologies | 2.02.00.6 | Fluorescence imaging machine and software |
| Phosphate Buffered Saline 1x (PBS) | Wisent Inc | 311-010-LL | |
| Puralube Vet Ointment | Dechra | 12920060 | Ophthalmic ointement to prevent eye damage during anesthesia |
| Spark Multiplate Reader | Tecan | 30086376 |
参考文献
- König, J., et al. Human intestinal barrier function in health and disease. Clinical and Translational Gastroenterology. 7 (10), 196 (2016).
- Lorenzo-Zuniga, V., et al. Insulin-like growth factor I improves intestinal barrier function in cirrhotic rats. Gut. 55 (9), 1306-1312 (2006).
- Schwarz, B. T., et al. LIGHT signals directly to intestinal epithelia to cause barrier dysfunction via cytoskeletal and endocytic mechanisms. Gastroenterology. 132 (7), 2383-2394 (2007).
- Schmitz, H., et al. Altered tight junction structure contributes to the impaired epithelial barrier function in ulcerative colitis. Gastroenterology. 116 (2), 301-309 (1999).
- Fouts, D. E., Torralba, M., Nelson, K. E., Brenner, D. A., Schnabl, B. Bacterial translocation and changes in the intestinal microbiome in mouse models of liver disease. Journal of Hepatology. 56 (6), 1283-1292 (2012).
- Galipeau, H. J., Verdu, E. F. The complex task of measuring intestinal permeability in basic and clinical science. Neurogastroenterology and Motility. 28 (7), 957-965 (2016).
- Bordoni, L., et al. Positive effect of an electrolyzed reduced water on gut permeability, fecal microbiota and liver in an animal model of Parkinson's disease. PLoS One. 14 (10), 0223238 (2019).
- Wang, Q., Fang, C. H., Hasselgren, P. -. O. Intestinal permeability is reduced and IL-10 levels are increased in septic IL-6 knockout mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 281 (3), 1013-1023 (2001).
- Crapser, J., et al. Ischemic stroke induces gut permeability and enhances bacterial translocation leading to sepsis in aged mice. Aging. 8 (5), 1049-1063 (2016).
- Mal Earley, Z., et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS One. 10 (7), 0129996 (2015).
- Sharon, G., et al. Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice. Cell. 177 (6), 1600-1618 (2019).
- Schroeder, B. O., et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration. Cell Host & Microbe. 23 (1), 27-40 (2018).
- Hajjar, R., et al. Improvement of colonic healing and surgical recovery with perioperative supplementation of inulin and galacto-oligosaccharides. Clinical Nutrition. 40 (6), 3842-3851 (2021).
- JoVE. Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database. , (2022).
- Costantini, T. W., et al. Quantitative assessment of intestinal injury using a novel in vivo, near-infrared imaging technique. Molecular Imaging. 9 (1), 30-39 (2010).
- Thevaranjan, N., et al. Age-associated microbial dysbiosis promotes intestinal permeability, systemic inflammation, and macrophage dysfunction. Cell Host & Microbe. 21 (4), 455-466 (2017).
- Chassaing, B., Aitken, J. D., Malleshappa, M., Vijay-Kumar, M. Dextran sulfate sodium (DSS)-induced colitis in mice. Current Protocols in Immunology. 104, 1-14 (2014).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Arrieta, M. C., Bistritz, L., Meddings, J. B. Alterations in intestinal permeability. Gut. 55 (10), 1512-1520 (2006).
- von Martels, J. Z. H., Bourgonje, A. R., Harmsen, H. J. M., Faber, K. N., Dijkstra, G. Assessing intestinal permeability in Crohn's disease patients using orally administered 52Cr-EDTA. PLoS One. 14 (2), 0211973 (2019).
- Gonzalez-Escamilla, G., Atienza, M., Garcia-Solis, D., Cantero, J. L. Cerebral and blood correlates of reduced functional connectivity in mild cognitive impairment. Brain Structure and Function. 221 (1), 631-645 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved