Method Article
使用荧光素-异硫氰酸酯标记的葡聚糖评估小鼠肠道屏障完整性
摘要
在本研究中,通过口服强饲法 将 荧光素-异硫氰酸酯标记的(FITC)葡聚糖施用于小鼠,以评估 体内 以及血浆和粪便样品中的肠道通透性。由于肠道屏障功能在许多疾病过程中受到影响,这种直接和定量的测定可用于不同的研究领域。
摘要
肠道屏障完整性是肠道健康的标志。虽然可以使用间接标志物来评估肠道屏障完整性,例如测量血浆炎症标志物和细菌易位到脾脏和淋巴结,但金标准直接量化了选定分子穿过肠粘膜层走向体循环的能力。本文使用一种非侵入性、经济高效且低负担的技术,使用荧光素-异硫氰酸酯标记的葡聚糖(FITC-葡聚糖)实时量化和跟踪小鼠的肠道通透性。在口服补充FITC-葡聚糖之前,禁食小鼠。然后用在磷酸盐缓冲盐水(PBS)中稀释的FITC-葡聚糖管饲。管饲后一小时,使用异氟醚对小鼠进行全身麻醉,并在成像室中观察 体内 荧光。该技术旨在评估腹腔中的残留荧光和肝脏摄取,这表明荧光探针的门脉迁移。口服强饲后4小时收集血液和粪便样品,并处死小鼠。然后将在PBS中稀释的血浆和粪便样品铺板,并记录荧光。然后使用标准曲线计算FITC-葡聚糖的浓度。在先前的研究中, 体内 成像显示,在低纤维饮食诱导的肠道屏障较弱的小鼠中,荧光迅速扩散到肝脏,而在补充纤维以加强肠道屏障的小鼠中,荧光信号主要保留在胃肠道中。此外,在这项研究中,对照小鼠的血浆荧光升高,粪便中的荧光降低,而相反,补充菊粉的小鼠肠道中的荧光信号水平较高,血浆中的荧光信号水平较低。总之,该协议提供了肠道通透性的定性和定量测量,作为肠道健康的标志物。
引言
肠道屏障在健康和疾病中都起着重要作用。它需要在允许所需的营养物质从肠腔渗透到循环中与同时防止促炎分子(如病原体或抗原)渗透之间取得复杂的平衡1。通透性增加可由许多胃肠道疾病引起,例如肝病或炎症性肠病(IBD)2,3。例如,在溃疡性结肠炎(UC)(一种IBD)中,慢性炎症导致紧密连接破裂,随后肠道屏障破坏以及细菌易位,可能使粘膜和全身炎症永久化4。
因此,肠道屏障完整性是肠道健康的重要标志。然而,目前用于测量肠道通透性的方法有许多局限性。例如,测量血浆炎症标志物或细菌易位到脾脏和淋巴结的方法是间接的5,6。其他方法可能是侵入性和耗时的。本文介绍了一种直接定量测量肠道通透性的非侵入性且具有成本效益的检测方法。该测定使用荧光素-异硫氰酸酯标记的葡聚糖(FITC-葡聚糖)通过测量 体内荧光来实时跟踪肠道通透性。此外,测量血浆和粪便中的FITC-葡聚糖水平可以量化肠道通透性(图1)。
FITC-葡聚糖通透性测定以前已在许多不同的环境中使用,包括帕金森病7,败血症8,缺血性卒中9和烧伤10的动物模型。此外,该测定最近已被用于帮助了解肠道微生物组如何可能与不同的疾病过程有关,以及如何将其靶向或操纵为潜在的治疗方法。例如,它已被用于研究衰老11,IBDs12,结直肠癌13和自闭症谱系障碍11中的微生物组和基于微生物组的治疗方法。由于肠道屏障功能与健康和疾病的许多方面有关,因此该测定已被广泛使用。其相对简单和低时间负担使其成为测试怀疑会改变肠道屏障完整性的体内条件的理想选择。其定量结果有助于确定潜在治疗的有效性。
在这项研究中,使用FITC-葡聚糖测定法评估饮食对肠道屏障功能的影响。比较接受对照饮食的小鼠的肠道通透性和接受菊粉补充饮食的小鼠的肠道通透性。菊粉是一种有益的低聚糖,已被证明可以改善肠道屏障功能12,13。对于 体内 荧光测量(背景),使用另外一只未经处理的小鼠作为阴性对照并接受PBS而不是FITC-葡聚糖。该实验表明,FITC-葡聚糖测定是评估肠道通透性的宝贵工具。
研究方案
所有程序均按照加拿大动物护理理事会的指导方针进行,并经CRCHUM机构动物护理委员会批准。从商业来源获得的八周龄雌性BALB / c小鼠(见 材料表)用于本研究。动物接受膳食补充剂10%菊粉wt/wt,持续2周。对照组接受了缺乏菊粉补充剂的类似饮食。小鼠可以 随意 进入饮食。该测定的概述如图 1所示。
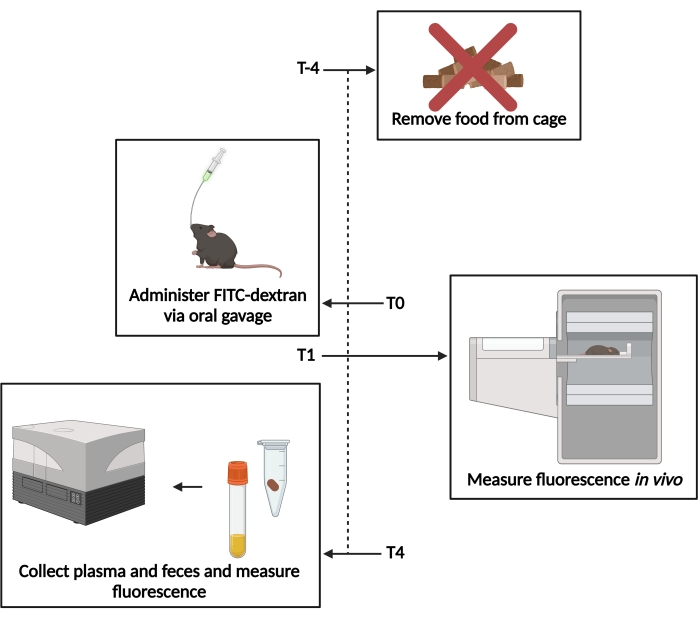
图1:FITC-葡聚糖测定示意图。在管饲前T-4-4小时,去除食物通道。 T0-FITC右旋糖酐 通过 口服强饲法给药。管饲后 T1 - 1小时,评估 体内 荧光。管饲后 T4-4小时,收集粪便和血浆样品,并测定荧光。 请点击此处查看此图的大图。
1. 右旋糖酐的给药
- 在施用FITC-葡聚糖之前,将小鼠禁食4小时,同时保持 随意 获得水。
注意:禁食最好在光照周期开始时(早上)开始。在禁食期间,可以将小鼠转移到没有垫料的新笼子中,以限制粪便。 - 制备 200 μL 80 mg·mL−1 4 kDa FITC-葡聚糖(参见 材料表),用无菌 1x 磷酸盐缓冲盐水 (PBS) 稀释(每只小鼠)。在给药前立即新鲜制备样品,并使其避光。
- 使用带有球形或梨形尖端的38mm 22G灭菌弯曲管饲针通过口服管饲法 向 每只小鼠施用200μLFITC-葡聚糖悬浮液(参见 材料表)。在第一次管饲后启动计时器,并在管饲下一只小鼠之前等待5-10分钟以允许 体内 测量(步骤2),始终保持管饲后1小时。将剩余的FITC-葡聚糖悬浮液保留为标准曲线。
注意:在管饲后,可以立即更换食物以确保粪便的形成。
2. 体内 荧光测量
- 在管饲后1小时使用2.5%异氟醚或替代麻醉剂麻醉小鼠。通过捏住脚趾或尾巴并确保动物没有反应来确认动物已适当麻醉。
- 使用电动剃须刀去除腹部的皮毛,并在眼睛上大量涂抹眼科润滑软膏以防止干燥。然后,将小鼠单独放置在背侧的成像室中。
注意:必须包括一个对照小鼠,该对照小鼠接受PBS或生理盐水而不是FITC-葡聚糖,以考虑 体内 成像期间的背景。
- 使用电动剃须刀去除腹部的皮毛,并在眼睛上大量涂抹眼科润滑软膏以防止干燥。然后,将小鼠单独放置在背侧的成像室中。
- 使用荧光成像室对小鼠进行成像(参见 材料表)。获取腹部区域的图像,将激光长度设置为470 nm,分辨率设置为2.0 mm。
- 通过单击并按住启动按钮 启动 机器和软件。让系统预热。
注意:系统可能需要20分钟或更长时间才能预热,因此必须尽早启动机器,以免干扰管饲后1小时对小鼠的成像。 - 单击 设备状态 并确保所有配置的设备都显示"确定",然后再继续。
- 如果需要,通过单击激光 控制 ,然后单击所需激光器的 激光名称 按钮来预热相应的激光器。
- 通过单击"新研究"开始 新研究。保存在具有所需名称的相应文件下。
- 单击 研究选项,然后输入 标本 ID,然后选择正确的激光和实验。
- 打开成像室并将动物背侧放在扫描板上。用胶带固定四肢和尾巴,并确保鼻子和嘴巴紧贴麻醉管,保持2.5%异氟醚。
- 调整扫描板的高度,使扫描区域与动物的中线略微腹侧。通过转动成像室内的调节旋钮来调整板。关闭并锁定成像室门。
- 使用 "绘制 "工具选择要扫描的区域。包括从肝脏上方到直肠的整个腹部宽度。点击 修改 绘制后调整区域。
- 将扫描分辨率设置为 2.0 毫米, 然后单击下一步。电源自动化完成后,请确保设置正确,并进行所需的任何调整。单击 开始 开始扫描。
- 扫描完成后,将动物从成像室中取出,并将其放入培养箱中以在从麻醉中恢复的同时保持体温。
- 单击 继续研究 以保持设置,然后重复步骤2.2.5-2.2.10,直到扫描完所有小鼠。
- 单击电源按钮并按住3秒钟以关闭成像室的电源。
- 通过单击并按住启动按钮 启动 机器和软件。让系统预热。
- 通过使用与所用成像系统相关的软件在均匀比例的图像上比较每只动物和对照小鼠的腹部荧光来评估荧光(参见 材料表)。
- 通过在所选文件名下找到图像文件来打开它们。同时打开所有具有同步设置的文件。
- 使用图像设置工具栏,使用同步图像和同步比例按钮同步图像的设置,以便进行准确的比较。
- 使用调整后的刻度保存图像。
3. 粪便样本和血浆中的荧光测量
- 管饲后4小时在无菌管中收集每只小鼠的粪便沉淀。将试管放在冰上黑暗中。
- 通过腹膜内注射240mg / mL戊巴比妥钠(稀释,1:100;参见材料表)麻醉小鼠。以 0.03 mL/g 体重的剂量给药。
- 通过将玻璃毛细管插入眶后神经丛14,在用于血浆收集的含有肝素或EDTA的管中收集至少700μL的血液样品以防止凝血(参见材料表)。
注意:采血的替代方法包括心脏穿刺或从尾静脉抽出。由于这是一个终末期手术,小鼠需要通过颈椎脱位或其他人道方法 实施 安乐死。遵循当地动物伦理委员会关于安乐死的建议。
- 通过将玻璃毛细管插入眶后神经丛14,在用于血浆收集的含有肝素或EDTA的管中收集至少700μL的血液样品以防止凝血(参见材料表)。
- 在室温下以9,390× g 离心血液样品10分钟。将血浆转移到新的无菌管中,并将其放在冰上。
- 在 200 μL 1x PBS 中稀释 50 mg 粪便样品,并用 1x PBS 以 1:2 稀释血浆。稀释比例可以根据荧光信号的强度进行修改。
- 使用1x PBS中FITC-葡聚糖的连续稀释液生成标准曲线。从最高浓度20 mg·mL−1 FITC葡聚糖开始,按1:1的系数连续稀释7-10倍。
注:因此,浓度必须为20 mg·mL−1、10 mg·mL−1、5 mg·mL−1、2.5 mg·mL−1、1.25 mg·mL−1、0.625 mg·mL−1、0.3125 mg·mL−1等。 - 在不透明的黑色 96 孔板中接种 100 μL 样品和标准品。包括 PBS 空白。在荧光板读数器(参见 材料表)上读取荧光,吸收在530nm处,激发波长为485nm。
注意:样品和标准品可以一式两份或一式三份接种,然后对其荧光值求平均值。 - 通过将荧光与标准曲线的已知浓度进行比较,确定每个样品的FITC-葡聚糖浓度。在样品中,将浓度乘以稀释因子(步骤3.5)。
结果
体内荧光分析表明,与接受菊粉补充饮食的小鼠相比,仅接受对照饮食的小鼠肝脏摄入FITC-葡聚糖和腹腔中残留荧光水平更高(图2A)。在接受菊粉饮食的小鼠的盲肠中可以看到一些荧光,但几乎没有肝脏摄入量,表明这些饮食可以防止肠道通透性增加。
血浆和粪便样品中的荧光水平有助于增强和量化其 体内 对应物。与仅接受对照饮食的小鼠相比,接受菊粉补充饮食的小鼠血浆中FITC-葡聚糖的水平显着降低(图2B)。这表明它们改善了肠道屏障功能,因为较少的FITC-葡聚糖可以渗透到肠道屏障中。一致地,接受菊粉饮食的小鼠粪便中FITC-葡聚糖的水平明显高于仅接受对照饮食的小鼠(图2C)。这强化了它们具有完整的肠道屏障功能,因为FITC-葡聚糖在排泄之前一直留在结肠中,这被认为是正常的。对照小鼠粪便中FITC-葡聚糖水平较低,表明它通过肠道屏障渗透到循环中,而不是被适当排泄。血浆中高水平的FITC-葡聚糖强化了这一发现。
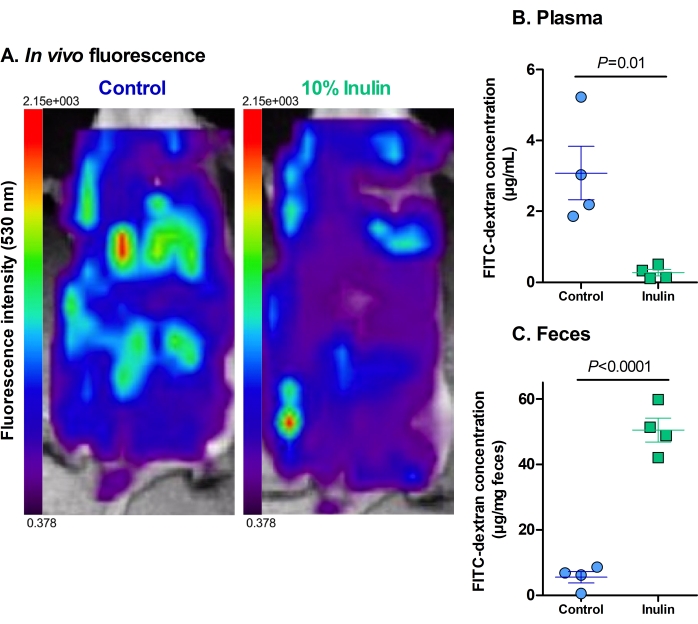
图 2:膳食补充菊粉可减少 FITC-葡聚糖通过肠道屏障的易位 。 (A)FITC-葡聚糖的残留荧光和肝脏摄取。红色 = 最高强度;深紫色 = 最低强度。最大荧光为2.15×103,最小荧光为0.378。(B)FITC-葡聚糖的血浆浓度。 P = 0.010。(C)FITC-葡聚糖的粪便浓度。 P = 0.00003。N = 每组 4 个。数据表示为平均± SEM。每个点代表一个鼠标。未配对学生的 t 检验。 请点击此处查看此图的大图。
讨论
肠道屏障功能是许多不同疾病过程不可或缺的一部分。因此,以非侵入性、成本效益和可量化的方式评估肠道通透性对于在动物模型中准确表示这些疾病至关重要。FITC葡聚糖测定为这种表示提供了可能性。然而,该协议涉及几个关键步骤,必须准确完成才能获得可靠的结果。首先,确保使用适当大小的FITC-葡聚糖至关重要。为了检查 体内 渗透性,4 kDa FITC-葡聚糖是最佳分子量,随着分子量的增加,渗透率降低15。因此,使用不同分子量的FITC-葡聚糖可能会提供令人困惑或不可靠的结果。此外,重要的是要注意每个管饲的时间,并相应地调整 体内 数据收集以及血浆和粪便收集的时间点。例如,如果两只小鼠相隔10分钟强饲, 体内荧光读数 以及粪便和血浆的收集也必须间隔10分钟发生。比较同一时间点的荧光可以更准确地表示渗透率的差异。此外,应交替测试来自不同组的动物的顺序,以防止由于时间原因而产生聚类效应。与其先测试A组的所有动物,然后再测试B组的所有动物(AAABBB),建议在每只动物(ABABAB)之后切换组。
如果无法使用成像机,可以修改该测定以仅包括血浆和粪便样本的评估。虽然 体内 直接荧光成像可以可视化肝脏摄入量和残留腹部荧光,但评估血浆和粪便样本中的荧光仍然可以定量测量肠道通透性。此外,如所描述的实验所示,血浆和粪便中的荧光水平与 体内 成像密切相关。此外,可以修改该测定以仅包括 体内 成像。这使得动物可以保持活力,以继续测试其他参数或监测肠道通透性如何随时间变化。因此,修改该测定的能力使其易于访问,但仍然是定量的。最后,先前已使用给予每只小鼠的200μL80mg·mL−1 FITC-葡聚糖的剂量,并证明对体重差异很小的小鼠有效16。此外,重要的是要注意,代表性结果部分中使用的所有小鼠的重量约为20g,允许对每只小鼠使用相同的剂量。然而,为了解释体重的差异,FITC-葡聚糖可以以0.6-0.8mg / g体重的剂量施用,例如17。至关重要的是,无论使用何种剂量,重要的是将每只小鼠的管饲量限制在小于10mL·kg−1 ,以防止并发症或不适18。
尽管FITC-葡聚糖测定为评估肠道屏障功能提供了一种有效的方法,但它仍然存在一些局限性。该模型的一个局限性是它需要禁食小鼠几个小时,这意味着将这些结果与未禁食小鼠的结果进行比较是不可靠的。此外,禁食可能会影响某些需要严格喂养时间表的模型的结果,例如在糖尿病动物模型中测量血糖时.
尽管存在这些局限性,FITC-葡聚糖测定仍然是分析肠道通透性的有效方法,因为它比许多经典方法定量、通用、经济高效且侵入性更小。例如,用于测量肠道通透性的常见探头是小糖探针或Cr-EDTA,它们具有一些优点19。然而,一些糖类探针仅具有区域特异性的渗透性。由于它们在小肠的远端部分水解,因此无法深入了解结肠通透性19。另一方面,Cr-EDTA可以提供有关结肠通透性的信息,但需要测量24小时,使得该方法的时间负担远高于FITC-葡聚糖测定20的时间负担。此外,这些方法均不提供该测定的直接 体内 成像。因此,与测量肠道通透性的替代方法相比,FITC葡聚糖测定提供了一种相对简单、直接和有效的选择。
最后,在IBDs 4,阿尔茨海默病21和肝病2等疾病过程中,肠道通透性是一个重要的参数,可以使用FITC-葡聚糖测定法进行测量,以改善研究。例如,在开发新疗法(例如IBD的免疫疗法)时,该测定可用于测试该疗法维持肠道屏障完整性的功效。例如,考虑到肠道屏障功能受损可能与UC慢性炎症的延续有关,检查治疗方法对通透性增加的保护程度很重要4。这只是一个例子,但FITC-葡聚糖测定是一种可访问且可量化的方法,可以在许多不同领域和研究方面测量肠道通透性。
披露声明
作者声明他们没有披露。
致谢
这项工作由加拿大自然科学和工程研究理事会资助(授予RGPIN-2018-06442给MMS)。我们感谢CRCHUM的动物设施和心血管表型平台的Junzheng Peng博士。
材料
| Name | Company | Catalog Number | Comments |
| 50 ppm Fe Diet (10% Inulin) | Envigo Teklad | TD.190651 | Representative Results |
| 50 ppm Fe Diet (FeSO4) | Envigo Teklad | TD.190723 | Representative Results |
| BALB/c Mice 49-55 Days, Female | Charles River | 028BALB/C | Representative Results |
| BD 1 mL Syringe Tuberculin Slip Tip | Becton, Dickinson and Company | 309659 | For gavage |
| BD Microtainer Tubes - With LH (Lithium Heparin) | Becton, Dickinson and Company | 365965 | For plasma collection |
| Centrifuge 5420 | Eppendorf | S420KN605698 | |
| Curved Gavage Needle (Gavage Cannula) 7.7.0 38 mm x 22 G | Harvard Apparatus Canada | 34-024 | No longer available - A potential alternative is available at Instech Labs (FTP-22-38) |
| Euthanyl (Pentobarbital Sodium) 240 mg/mL | Bimeda-MTC Animal Health Inc. | 141704 | 1/100 dilution; Administered via intraperitoneal injection at 0.03 mL/g body weight |
| FITC-dextran 4 | TdB Labs | 20550 | |
| Heparinized Capillary Tubes | Kimble Chase Life Science and Research | 2501 | For retro-orbital blood collection |
| Microplate, PS, 96-well, Flat-bottom (Chimney Well), Black, Flutrac, Med. Binding | Greiner Bio-one | 655076 | |
| MiniARCO Clipper Kit | Kent Scientific | CL8787-KIT | For hair removal |
| Optix MX2 and Optix Optiview | Advanced Research Technologies | 2.02.00.6 | Fluorescence imaging machine and software |
| Phosphate Buffered Saline 1x (PBS) | Wisent Inc | 311-010-LL | |
| Puralube Vet Ointment | Dechra | 12920060 | Ophthalmic ointement to prevent eye damage during anesthesia |
| Spark Multiplate Reader | Tecan | 30086376 |
参考文献
- König, J., et al. Human intestinal barrier function in health and disease. Clinical and Translational Gastroenterology. 7 (10), 196(2016).
- Lorenzo-Zuniga, V., et al. Insulin-like growth factor I improves intestinal barrier function in cirrhotic rats. Gut. 55 (9), 1306-1312 (2006).
- Schwarz, B. T., et al. LIGHT signals directly to intestinal epithelia to cause barrier dysfunction via cytoskeletal and endocytic mechanisms. Gastroenterology. 132 (7), 2383-2394 (2007).
- Schmitz, H., et al. Altered tight junction structure contributes to the impaired epithelial barrier function in ulcerative colitis. Gastroenterology. 116 (2), 301-309 (1999).
- Fouts, D. E., Torralba, M., Nelson, K. E., Brenner, D. A., Schnabl, B. Bacterial translocation and changes in the intestinal microbiome in mouse models of liver disease. Journal of Hepatology. 56 (6), 1283-1292 (2012).
- Galipeau, H. J., Verdu, E. F. The complex task of measuring intestinal permeability in basic and clinical science. Neurogastroenterology and Motility. 28 (7), 957-965 (2016).
- Bordoni, L., et al. Positive effect of an electrolyzed reduced water on gut permeability, fecal microbiota and liver in an animal model of Parkinson's disease. PLoS One. 14 (10), 0223238(2019).
- Wang, Q., Fang, C. H., Hasselgren, P. -O. Intestinal permeability is reduced and IL-10 levels are increased in septic IL-6 knockout mice. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 281 (3), 1013-1023 (2001).
- Crapser, J., et al. Ischemic stroke induces gut permeability and enhances bacterial translocation leading to sepsis in aged mice. Aging. 8 (5), 1049-1063 (2016).
- Mal Earley, Z., et al. Burn injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS One. 10 (7), 0129996(2015).
- Sharon, G., et al. Human gut microbiota from autism spectrum disorder promote behavioral symptoms in mice. Cell. 177 (6), 1600-1618 (2019).
- Schroeder, B. O., et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration. Cell Host & Microbe. 23 (1), 27-40 (2018).
- Hajjar, R., et al. Improvement of colonic healing and surgical recovery with perioperative supplementation of inulin and galacto-oligosaccharides. Clinical Nutrition. 40 (6), 3842-3851 (2021).
- JoVE. Lab Animal Research. Blood Withdrawal I. JoVE Science Education Database. , JoVE. Cambridge, MA. (2022).
- Costantini, T. W., et al. Quantitative assessment of intestinal injury using a novel in vivo, near-infrared imaging technique. Molecular Imaging. 9 (1), 30-39 (2010).
- Thevaranjan, N., et al. Age-associated microbial dysbiosis promotes intestinal permeability, systemic inflammation, and macrophage dysfunction. Cell Host & Microbe. 21 (4), 455-466 (2017).
- Chassaing, B., Aitken, J. D., Malleshappa, M., Vijay-Kumar, M. Dextran sulfate sodium (DSS)-induced colitis in mice. Current Protocols in Immunology. 104, 1-14 (2014).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Arrieta, M. C., Bistritz, L., Meddings, J. B. Alterations in intestinal permeability. Gut. 55 (10), 1512-1520 (2006).
- von Martels, J. Z. H., Bourgonje, A. R., Harmsen, H. J. M., Faber, K. N., Dijkstra, G. Assessing intestinal permeability in Crohn's disease patients using orally administered 52Cr-EDTA. PLoS One. 14 (2), 0211973(2019).
- Gonzalez-Escamilla, G., Atienza, M., Garcia-Solis, D., Cantero, J. L. Cerebral and blood correlates of reduced functional connectivity in mild cognitive impairment. Brain Structure and Function. 221 (1), 631-645 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。