A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الفلور الوظيفي الموجه للموقع في الخلايا الأصلية لدراسة استثارة العضلات الهيكلية
In This Article
Summary
القياس الفلوري الوظيفي الموجه للموقع هو طريقة لدراسة حركات مجال البروتين في الوقت الفعلي. يسمح تعديل هذه التقنية لتطبيقها في الخلايا الأصلية الآن باكتشاف وتتبع حركات مستشعر الجهد الفردي من قنوات Ca2+ ذات الجهد الكهربائي في ألياف العضلات الهيكلية المعزولة بالفئران.
Abstract
كان القياس الفلوري الوظيفي الموجه للموقع هو التقنية المفضلة للتحقيق في العلاقة بين البنية والوظيفة للعديد من البروتينات الغشائية ، بما في ذلك القنوات الأيونية ذات الجهد الكهربائي. تم استخدام هذا النهج في المقام الأول في أنظمة التعبير غير المتجانسة لقياس التيارات الغشائية في وقت واحد ، والمظاهر الكهربائية لنشاط القنوات ، وقياسات التألق ، والإبلاغ عن إعادة ترتيب المجال المحلي. يجمع القياس الفلوري الوظيفي الموجه للموقع بين الفيزيولوجيا الكهربية والبيولوجيا الجزيئية والكيمياء والتألق في تقنية واحدة واسعة النطاق تسمح بدراسة عمليات إعادة الترتيب الهيكلية في الوقت الفعلي والوظيفة من خلال التألق والفيزيولوجيا الكهربية ، على التوالي. عادة ، يتطلب هذا النهج قناة غشاء مهندسة ذات بوابات الجهد تحتوي على سيستين يمكن اختباره بواسطة صبغة فلورية تفاعلية مع الثيول. حتى وقت قريب ، تم تنفيذ الكيمياء التفاعلية للثيول المستخدمة في وضع العلامات الفلورية الموجهة للموقع للبروتينات حصريا في بويضات Xenopus وخطوط الخلايا ، مما يحد من نطاق النهج إلى الخلايا الأولية غير القابلة للاستثارة. يصف هذا التقرير إمكانية تطبيق القياس الفلوري الوظيفي الموجه للموقع في خلايا العضلات الهيكلية البالغة لدراسة الخطوات المبكرة لاقتران الإثارة والانكماش ، وهي العملية التي يرتبط بها إزالة الاستقطاب الكهربائي للألياف العضلية بتنشيط تقلص العضلات. يصف هذا البروتوكول منهجيات تصميم ونقل قنوات Ca2 + المهندسة بالجهد (CaV1.1) إلى ألياف العضلات في المثنية الرقمية للفئران البالغة باستخدام التثقيب الكهربائي في الجسم الحي والخطوات اللاحقة المطلوبة لقياسات الفلور الوظيفية الموجهة للموقع. يمكن تكييف هذا النهج لدراسة القنوات الأيونية والبروتينات الأخرى. إن استخدام القياس الفلوري الوظيفي الموجه للموقع لعضلات الثدييات له أهمية خاصة لدراسة الآليات الأساسية للإثارة.
Introduction
تعد القدرة على تتبع عمليات إعادة ترتيب مطابقة القناة الأيونية استجابة لمحفز كهربائي معروف في خلية حية مصدرا للمعلومات القيمة لعلم وظائف الأعضاء الجزيئي1. القنوات الأيونية ذات بوابات الجهد هي بروتينات غشائية تستشعر التغيرات في الجهد عبر الغشاء ، وتتأثر وظيفتها أيضا بتغيرات الجهد2. سمح تطوير تقنيات مشبك الجهد في القرن الماضي لعلماء الفسيولوجيا بدراسة التيارات الأيونية التي تحملها القنوات الأيونية ذات بوابات الجهد في الوقت الفعلي استجابة لإزالة استقطاب الغشاء3. كان استخدام تقنية مشبك الجهد أمرا حاسما في فهم الخصائص الكهربائية للخلايا القابلة للإثارة مثل الخلايا العصبية والعضلات. في سبعينيات القرن العشرين ، سمح صقل مشبك الجهد للكشف عن تيارات البوابات (أو حركة الشحن) في قنوات الكالسيوم ذات الجهد الكهربائي (Ca V) والصوديوم (NaV) 4,5. تيارات البوابة هي تيارات سعوية غير خطية تنشأ من حركة مستشعرات الجهد استجابة للتغيرات في المجال الكهربائي عبر غشاء الخلية6. تعتبر تيارات البوابة مظهرا كهربائيا لإعادة الترتيب الجزيئي الذي يسبق أو يصاحب فتح القناة الأيونية7. في حين أن هذه القياسات الحالية توفر معلومات قيمة فيما يتعلق بوظيفة القناة ، فإن كل من التيارات الأيونية وتيارات البوابة هي قراءات غير مباشرة لإعادة ترتيب المطابقة بين الجزيئات وداخلها للقنوات ذات الجهدالكهربائي 7.
تم تطوير القياس الفلوري الوظيفي الموجه للموقع (FSDF ؛ يشار إليه أيضا باسم قياس فلورومترية مشبك الجهد ، VCF) في أوائل تسعينيات القرن العشرين8 ، ولأول مرة ، قدم القدرة على عرض التغييرات التوافقية المحلية مباشرة ووظيفة بروتين القناة في الوقت الحقيقي. باستخدام مزيج من طفرات القناة ، والفيزيولوجيا الكهربية ، وأنظمة التعبير غير المتجانسة ، من الممكن وضع علامة على الأجزاء المتحركة لقنوات أو مستقبلات معينة وتتبعها استجابة لمحفز التنشيط 9,10. تم استخدام هذا النهج على نطاق واسع لدراسة آليات استشعار الجهد في القنوات الأيونية ذات بوابات الجهد8،10،11،12،13،14،15،16،17،18،19. للاطلاع على مراجعات موثوقة، راجع10،20،21،22،23.
تتكون قنوات Ca V و NaV ، الحاسمة لبدء الإشارات الكهربائية وانتشارها ، من وحدة فرعية رئيسية α1 ، والتي تمتلك مسام مركزية وأربعة مجالات استشعار جهد غير متطابقة2. بالإضافة إلى هيكلها الأساسي المميز ، يتم التعبير عن قنوات Ca V و NaV كمعقدات متعددة الوحدات الفرعية مع وحدات فرعية مساعدة24. تتكون قنوات البوتاسيوم المعتمدة على الجهد (K V) من أربع وحدات فرعية تشبه مجالا واحدا من Na V أو CaV 25. يتم تشكيل الوحدة الفرعية α1 المكونة للمسام واستشعار الجهد لقنوات Ca V و NaV بواسطة تشفير ببتيد واحد لأربعة مجالات فردية من ستة قطاعات غشائية فريدة (S1-S6; الشكل 1 أ) 24,26. تشكل المنطقة المكونة من شرائح الغشاء S1 إلى S4 مجال استشعار الجهد (VSD) وتشكل الأجزاء عبر الغشاء S5 و S6 مجال المسام26. في كل VSD ، يحتوي S4 α-helix على أرجينين أو ليسين موجب الشحنة (الشكل 1A ، B) يتحرك استجابة لإزالة استقطاب الغشاء7. تدعم عدة عقود من البحث ونتائج الأساليب التجريبية المتنوعة للغاية الفرضية القائلة بأن شرائح S4 تتحرك إلى الخارج ، وتولد تيارات بوابات ، استجابة لإزالة استقطاب الغشاء6.
يقيس FSDF التغيرات الفلورية لصبغة تفاعلية ثيول مترافقة مع بقايا سيستين محددة (أي S4 α-helix) على قناة أيونية أو بروتين آخر ، تم هندسته عبر الطفرات الموجهة للموقع ، حيث تعمل القناة استجابة لإزالة استقطاب الغشاء أو المحفزاتالأخرى 10. في الواقع ، تم تطوير FSDF في الأصل للتحقيق فيما إذا كان الجزء S4 في قنوات KV ، المقترح أن يكون مستشعر الجهد الرئيسي للقناة ، يتحرك عندما تتحرك شحنات البوابة استجابة للتغيرات في إمكانات الغشاء 8,10. في حالة القنوات الأيونية ذات بوابات الجهد ، يمكن ل FSDF حل عمليات إعادة الترتيب التوافقي المستقلة ل VSDs الأربعة (تتبع VSD واحد في أي وقت) ، بالتزامن مع قياسات وظيفة القناة. في الواقع ، باستخدام هذا النهج ، تبين أن VSDs الفردية يبدو أنها تشارك بشكل مختلف في جوانب محددة من تنشيط القناة وتعطيلها12،27،28،29،30. إن تحديد مساهمة كل VSD في وظيفة القنوات له أهمية كبيرة ويمكن استخدامه لزيادة توضيح تشغيل القناة وربما تحديد أهداف جديدة لتطوير الأدوية.
كان استخدام FSDF في أنظمة التعبير غير المتجانسة مفيدا للغاية في تعزيز فهمنا لوظيفة القناة من منظور اختزالي10،23. ومثل العديد من النهج الاختزالية، فإنه يقدم مزايا ولكن له أيضا قيود. على سبيل المثال ، أحد القيود الرئيسية هو إعادة التكوين الجزئي لبيئة نانو القناة في النظام غير المتجانس. في كثير من الأحيان ، تتفاعل القنوات الأيونية مع العديد من الوحدات الفرعية الملحقة والعديد من البروتينات الأخرى التي تعدل وظيفتها31. من حيث المبدأ ، يمكن التعبير عن القنوات المختلفة ووحداتها الفرعية الملحقة في أنظمة غير متجانسة باستخدام تركيبات ترميز البروتين المتعددة أو البلازميدات متعددة السيسترونيك ، ولكن لا يمكن إعادة تشكيل بيئتها الأصلية بالكامل30,32.
نشرت مجموعتنا مؤخرا نوعا مختلفا من FSDF في ألياف العضلات الهيكلية المنفصلة الأصلية لدراسة الخطوات المبكرة لاقتران الإثارة والانكماش (ECC) 33,34 ، وهي العملية التي يرتبط بها إزالة الاستقطاب الكهربائي للألياف العضلية بتنشيط تقلص العضلات 35,36. لأول مرة ، سمح هذا النهج بتتبع حركة مستشعرات الجهد S4 الفردية من قناة L-type Ca2+ ذات الجهد الكهربائي (CaV1.1 ، والمعروفة أيضا باسم DHPR) في البيئة الأصلية لألياف العضلات المتمايزةللبالغين 37. تم تحقيق ذلك من خلال النظر في الخصائص المتعددة لهذا النوع من الخلايا ، بما في ذلك النشاط الكهربائي للخلية مما يسمح بإزالة الاستقطاب ذاتية الانتشار التي يسببها التحفيز السريع ، والقدرة على التعبير عن بلازميد cDNA من خلال التثقيب الكهربائي في الجسم الحي ، والتعبير الطبيعي العالي والتنظيم المجزأ للقنوات داخل الخلية ، وتوافقه مع التصوير عالي السرعة وأجهزة التسجيل الكهربية. في السابق ، استخدمنا مجهرا متحد البؤر لمسح الخط عالي السرعة كجهاز كشف37. الآن ، يتم تقديم تباين في التقنية باستخدام الصمام الثنائي الضوئي لاكتساب الإشارة. يمكن لنظام الكشف القائم على الصمام الثنائي الضوئي هذا أن يسهل تنفيذ هذه التقنية في مختبرات أخرى.
هنا ، يتم وصف بروتوكول خطوة بخطوة لاستخدام FSDF في الخلايا الأصلية لدراسة حركة مستشعر الجهد الفردي من CaV1.1. بينما تم استخدام قناة CaV1.1 كمثال في جميع أنحاء هذه المخطوطة ، يمكن تطبيق هذه التقنية على المجالات التي يمكن الوصول إليها خارج الخلية للقنوات الأيونية الأخرى أو المستقبلات أو البروتينات السطحية.
Protocol
تمت الموافقة على هذا البروتوكول من قبل لجنة رعاية واستخدام الحيوان المؤسسية بجامعة ميريلاند. تم تقسيم البروتوكول التالي إلى أقسام فرعية متعددة ، تتكون من (1) تصميم البناء الجزيئي واختيار صبغة تفاعل السيستين ، (2) التثقيب الكهربائي في الجسم الحي ، (3) تشريح العضلات وعزل الألياف ، (4) وصف إعداد الاستحواذ ، (5) تقييم النشاط الكهربائي الإيجابي للألياف الفلورية الخضراء المعززة (EGFP) وتلطيخ السيستين ، و (6) اكتساب الإشارات ومعالجتها. بالإضافة إلى ذلك ، في بداية كل قسم ، يتم تفصيل بعض الاعتبارات ذات الصلة عند تطبيق FSDF في الألياف العضلية الهيكلية. يجب تنفيذ جميع أقسام البروتوكول بمعدات الحماية الشخصية المناسبة ، بما في ذلك معطف المختبر والقفازات.
1. تصميم البناء الجزيئي واختيار صبغة تفاعل السيستين
- يعد تصميم البناء جزءا مهما من نجاح التجربة. أولا ، قم بإنشاء بنية CaV1.1 cDNA من النوع البري والموسومة بالفلورسنت وتقييم تعبيرها في نوع الخلية المناسب. بالنسبة للألياف العضلية ، يمكن تحقيق كفاءة نقل قوية باستخدام بلازميد يحمل محفز الفيروس المضخم للخلايا (CMV). في هذا البروتوكول ، تم استخدام بلازميد الأرنب EGFP-CaV1.1 المميزبالفعل 38.
ملاحظة: عند هندسة بنية cDNA لإدخال بقايا السيستين في قناة أيونية ذات جهد كهربائي ، يكون موضع السيستين أمرا بالغ الأهمية ويجب مراعاته بعناية. يجب أن يكون السيستين متاحا من الفضاء خارج الخلية للسماح بتفاعل صبغة اقتران الثيول (الشكل 1C ، D) ويجب أن يكون قريبا من منطقة S4 لتتبع حركته بدقة استجابة لإزالة الاستقطاب. ومع ذلك ، للسماح بتبريد مضان الصبغة استجابة لحركة البروتين ، يجب أن يكون الفلوروفور المترافق السيستين المدخلة في واجهة بيئتين مختلفتين (على سبيل المثال ، الغشاء والسائل خارج الخلية. الشكل 1E). بالإضافة إلى ذلك ، من الأهمية بمكان التأكد من أن السيستين المدرج لا يتداخل مع وظيفة البروتين. - للحصول على فكرة عن توطين السيستين المناسب ، اجمع معلومات عن بنية القناة أو من تجارب قياس الفلور الأخرى لبروتينات القناة الأخرى ذات الصلة. لتصميم تركيبات Ca V 1.1 المهندسة بالسيستين ، قم بتقييم بنية المجهر الإلكتروني بالتبريد (cryo-EM) للقناة26 وقارن إدخال السيستين للعمل السابق من القنوات ذات الصلة مثل CaV1.2 12 ، أو قنوات أخرى مثلShaker11 و NaChBac 39.
- بمجرد اختيار موضع السيستين المناسب ، استخدم مجموعة الطفرات التجارية الموجهة للموقع لإدخال بدائل السيستين. في البروتوكول الحالي ، تم تصميم تعديلات cysteines التالية بشكل مستقل على كل طرف خلوي من جزء استشعار الجهد S4 من CaV1.1: VSD-I (L159C) ، VSD-II (L522C) ، VSD-III (V893C) ، VSD-IV (S1231C) ، و UniProtKB: P07293 (الشكل 1B).
- بالنسبة لألياف العضلات الهيكلية ، استخدم 5-carboxytetramethylrhodamine methanethiosulfonate (MTS-5-TAMRA) ، والذي يظهر انتشارا مناسبا وسريعا في نظام غشاء النبيب المستعرض ، وهو غزو للغشاء السطحي والموقع السائد لقنوات CaV1.1. يظهر MTS-5-TAMRA انخفاضا في التألق عند الانتقال من الغشاء الدهني إلى بيئة مائية (الشكل 1E).
ملاحظة: تلطخ مشتقات Dylight أو Alexa-maleimide الغشاء السطحي ولكن ليس نظام النبيب المستعرض.
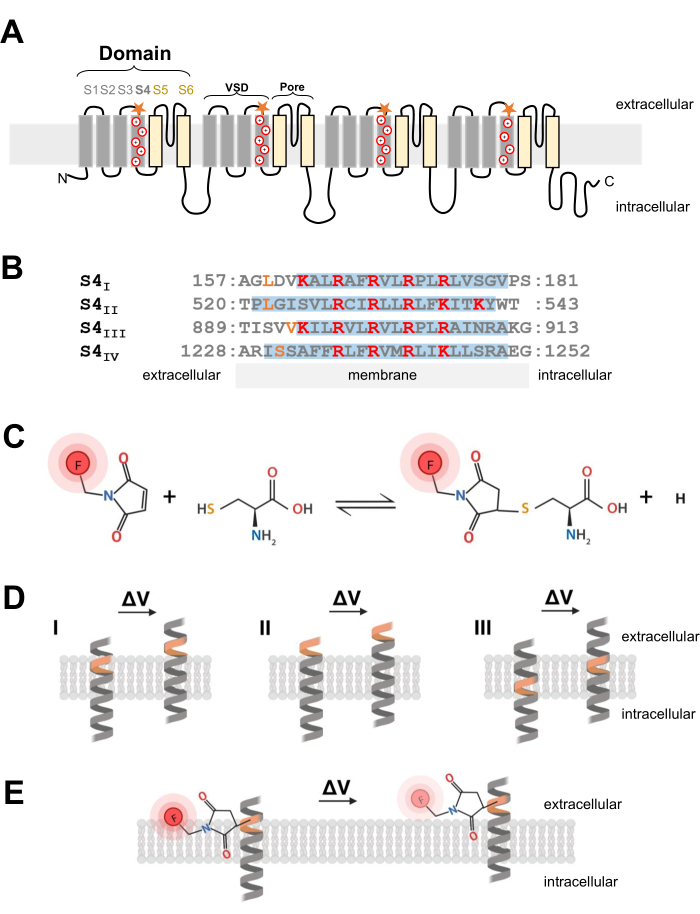
الشكل 1: رسم تخطيطي لتفاعل الثيول-سيستين عند واجهة الحلزون α عبر الغشاء. (أ) طوبولوجيا الغشاء من النوع L CaV 1.1. تمثل علامات الجمع البقايا الأساسية داخل الحلزون α S4 وتشير النجوم البرتقالية إلى الموقع الذي تم فيه إدخال السيستين عن طريق الطفرات الموجهة للموقع. (ب) محاذاة تسلسل S4I إلى S4IV للأرنب CaV1.1 (UniProtKB: P07293). يتم تمييز بقايا الأرجينين والليسين المشحونة إيجابيا والحرجة لاستشعار الجهد باللون الأحمر ، بينما يشار إلى بدائل السيستين المهندسة باللون البرتقالي. تم تكييف هذا الفريق من المرجع37. ج: تفاعل جزيء السيستين والثيول الفلوري. (د) رسم تخطيطي يوضح إدخال طفرات السيستين داخل حلزون α حساس للجهد عبر الغشاء. يجب دفن السيستين في الغشاء أثناء الراحة ويمكن الوصول إليه خارج الخلية بعد إزالة الاستقطاب (ΔV; I). من غير المحتمل أن يحدث تتبع السيستين عادة إذا كان السيستين المستهدف متاحا بالفعل من الفضاء خارج الخلية قبل إزالة الاستقطاب (II) أو إذا كان السيستين لا يمكن الوصول إليه من الفضاء خارج الخلية بعد إزالة الاستقطاب (III). (ه) بعد التفاعل مع جزيء الثيول الفلوري، تقلل حركة الحلزون α استجابة لإزالة الاستقطاب من انبعاث مضان MTS-5-TAMRA. يتم إنشاء الإشارة الفلورومترية من خلال حركة الحلزون S4 وحركة الصبغة اللاحقة بالنسبة لمستوى الغشاء والبيئة المائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. في الجسم الحي التثقيب الكهربائي
ملاحظة: أجريت تجارب التثقيب الكهربائي كما هو موضح سابقا38 مع تعديلات. في القسم التالي ، تم تصميم البروتوكول للتثقيب الكهربائي لوسادة قدم واحدة من الماوس. يجب تعديل الأحجام إذا تم إعداد كلا الكفوف.
- القسمة 25-100 ميكرولتر من محلول البلازميد عند 2-5 ميكروغرام / ميكرولتر في أنبوب 1.5 مل يوضع على الجليد.
- قم بإعداد محلول 0.5 مل من 2 مجم / مل هيالورونيداز في محلول ملحي معقم وقم بتصفية المحلول من خلال مرشح معقم منخفض الارتباط 0.2 ميكرومتر مركب على حقنة 1 مل. يخزن في أنبوب سعة 1.5 مل في درجة حرارة الغرفة.
- باستخدام جهاز تخدير معاير ، قم بتخدير الماوس باستخدام 3٪ -4.5٪ إيزوفلوران في O2 (1 لتر / دقيقة) عن طريق وضع الماوس في غرفة التخدير. تأكيد التخدير الكافي للحيوان عن طريق الضغط على طرف الذيل باستخدام زوج من الملقط. لا ينبغي ملاحظة أي رد فعل عند الوصول إلى التخدير الأمثل.
- أخرج الماوس من غرفة التخدير وضع قناع تخدير الأنف على الماوس. ضع الحيوان على ظهره على وسادة تسخين متساوية الحرارة مغطاة بوسادة مقعد معقمة. استمر في التخدير باستخدام قناع القوارض مع 3٪ إيزوفلوران في O2 (1 لتر / دقيقة).
- لمنع جفاف العين أثناء العملية ، ضع طبقة رقيقة من كريم المسيل للدموع الاصطناعي على عيون الحيوان بطرف قطني معقم. تطهير مخلب الحيوان باستخدام مسح معقم مشبع في الكحول الإيثيلي.
- باستخدام إبرة أنسولين معقمة بطول 0.5 بوصة 29 جم ، قم بنضح 20 ميكرولتر من محلول الهيالورونيداز. اخترق الجلد على مستوى الكعب وحرك الإبرة تحت الجلد نحو قاعدة أصابع القدم (الشكل 2 أ). احقن المحلول ببطء مع تحريك الإبرة تدريجيا للخلف. يجب ملاحظة بلعة أو نتوء تحت مخلب (الشكل 2B).
ملاحظة: اعتمادا على عمر الحيوان وحجم المخلب ، من المحتمل ألا يتم حقن الكمية الكاملة من المحلول. في كثير من الأحيان ، قد يحدث تسرب صغير من خلال نقطة الحقن. - كرر الخطوة 2.6 مع المخلب الآخر ، إذا رغبت في ذلك ، باستخدام إبرة معقمة أخرى بعد تطهير المخلب بشكل صحيح ، كما في الخطوة 2.5.
- افصل التخدير عن طريق إزالة الحيوان من قناع الأنف وإعادة الماوس إلى القفص مع إمكانية الوصول إلى الطعام والماء حسب الحاجة. يجب ملاحظة الشفاء التام من التخدير في ~ 5 دقائق. ضع الأنبوب الذي يحتوي على محلول البلازميد على المقعد للسماح له بالوصول إلى درجة حرارة الغرفة.
- بعد 1 ساعة ، قم بتخدير الحيوان مرة ثانية ، وضعه على وسادة التدفئة ، وقم بتطهير المخلب كما هو موضح في الخطوات 2.3-2.5.
- حقن 10-20 ميكرولتر من بنية cDNA ، باستخدام نفس التقنية الموضحة في الخطوة 2.6. الكمية الإجمالية للبناء المحقون هي 50-100 ميكروغرام لكل مخلب. كرر الإجراء مع مخلب المقابل إذا رغبت في ذلك باستخدام حقنة معقمة أخرى.
- احتفظ بالحيوان تحت التخدير على وسادة التسخين متساوية الحرارة لمدة 5 دقائق للسماح لمحلول cDNA بالانتشار بالتساوي عبر الأنسجة.
- قم بتشغيل جهاز التثقيب الكهربائي وقم بتوصيله بمجموعة الأقطاب الكهربائية المزدوجة ، على النحو الموصى به من قبل الشركة المصنعة.
- تطهير مجموعة القطب المزدوج باستخدام مسح مشبع في الكحول الإيثيلي. تثبيت مخلب بيد واحدة وأدخل أولا قطب كهربائي واحد تحت الجلد في الجزء الخلفي من الكعب. بعد ذلك ، أدخل القطب الثاني في قاعدة أصابع القدم ، مع التأكد من أن اتجاهات كلا القطبين عمودية على محور القدم (الشكل 2C). قم بتوجيه المسبار في وضع لا يقيد القدم أو الساق في اتجاه زاوي متطرف.
ملاحظة: يمكن تسهيل إدخال القطب باستخدام الملقط وشحذ أطراف الأقطاب الكهربائية بانتظام. اعتمادا على عمر الحيوان ، يمكن أن يختلف حجم المخلب ويجب تكييف تباعد القطب وفقا لذلك. - قم بإلكتروب العضلات عن طريق تطبيق 20 نبضة ، 20 مللي ثانية في المدة / لكل منها ، عند 1 هرتز. بالنسبة لإبر القطب المتباعدة عند 1 سم ، اضبط الجهد على ~ 100 فولت. يجب تكييف هذا إذا تم تعديل تباعد القطب الكهربائي للوصول إلى ~ 100 فولت / سم. يجب ملاحظة انثناء طفيف للأرقام أثناء توصيل النبض إذا تم وضع الأقطاب الكهربائية بشكل صحيح.
- كرر الخطوتين 2.13 و 2.14 مع مخلب الجانب المقابل إذا رغبت في ذلك.
- افصل التخدير وضع الحيوان في قفص ، معزولا عن رفيقه غير المكهرب مع الوصول إلى الطعام والماء لمدة 2 ساعة. يجب ملاحظة الشفاء التام من التخدير في ~ 10 دقائق. ضع الحيوان مرة أخرى داخل القفص.
ملاحظة: يعتمد التعبير عن بنية (تركيبات) cDNA بشكل كبير على البروتين المشفر. يمكن أن يؤثر دوران البروتين وكمية ونوعية cDNA ومروج البلازميد والمتغيرات الأخرى على تعبير البناء. في هذه التجربة ، يتطلب التعبير الأمثل للوحدة الفرعية α1S من CaV1.1 مع مروج CMV من 4 إلى 6 أسابيع ولكن يمكن اكتشافه من أسبوعين لمدة تصل إلى 12-15 شهرا.
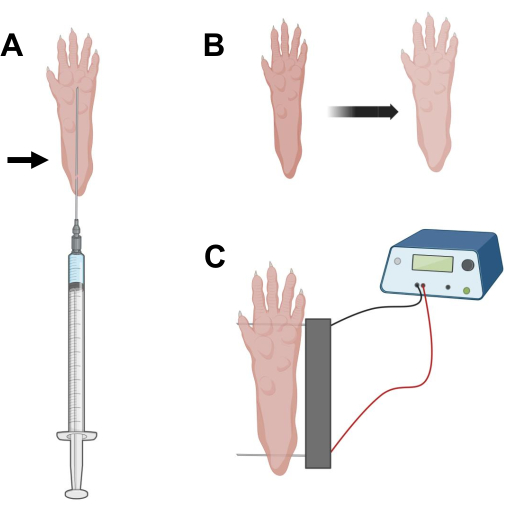
الشكل 2: رسم تخطيطي لحقن cDNA ووضع قطب التثقيب الكهربائي في وسادة قدم الماوس للتثقيب الكهربائي. أ: موضع إبرة الهيالورونيداز وحقن الحمض النووي المكمل (cDNA) تحت وسادة قدم الفأر. يشير السهم إلى نقطة الإدخال عبر الجلد. (ب) يجب ملاحظة تغير طفيف في لون الجلد وزيادة طفيفة في حجم المخلب بشكل عابر بعد الحقن. (ج) تحديد موضع صفيف الأقطاب الكهربائية للتثقيب الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تشريح العضلات وعزل الألياف
ملاحظة: تم إجراء تفكك الألياف العضلية الهيكلية كما هو موضح سابقا37،40،41 مع التعديلات. في القسم التالي ، يكون البروتوكول مناسبا لوسادتي قدم للماوس.
- قبل تفكك الألياف ، قم بإعداد اللوحة المغطاة بالجيلجارد عن طريق إضافة جزء واحد من عامل المعالجة إلى 10 أجزاء من المطاط الصناعي (٪ وزن / وزن) في طبق بتري بلاستيكي 60 مم للوصول إلى سمك ~ 5 مم. اترك اللوحة المغطاة بالمطاط الصناعي تعالج طوال الليل قبل الاستخدام. يمكن إعادة استخدامه عدة مرات إذا تم تخزينه وتطهيره بشكل صحيح باستخدام 70٪ من الكحول الإيثيلي قبل الاستخدام وبعده.
- تحضير 4 ملغ من كولاجيناز النوع الأول في 2 مل من وسط النسر الأساسي الدوار الأدنى (S-MEM) المكمل بمصل بقري جنيني بنسبة 10٪ (FBS ؛ التركيز النهائي 2 ملغ / مل). انقل المحلول إلى صفيحة بلاستيكية غير مغلفة مقاس 35 مم وضع الطبق في حاضنة عند 37 درجة مئوية ، 5٪ CO2.
ملاحظة: S-MEM عبارة عن تركيبة MEM معدلة بدون الجلوتامين والكالسيوم2+. يقلل غياب الكالسيوم2+ في هذه الخطوة من تقلص الألياف أثناء الهضم الأنزيمي والتثليج. - أضف 5 مل من S-MEM مع 10٪ FBS في لوحة بلاستيكية غير مغلفة 60 مم وتخزينها في الحاضنة عند 37 درجة مئوية ، 5٪ CO2.
- القتل الرحيم للحيوانات عن طريق الاختناق عن طريق CO2 متبوعا بخلع عنق الرحم. لتقليل التلوث أثناء عزل الخلايا الأولية ، اغمر جثة الحيوان في 70٪ كحول إيثيلي لمدة ~ 10 ثوان. قم بإزالة وتجفيف الذبيحة بورق ممتص وقطع القدمين بمقص بين الكاحل والركبة (الشكل 3 أ).
- قم بتثبيت قدم واحدة من الحيوان ، مع توجيه المخلب لأعلى ، مع دبابيس تشريح على اللوحة المغطاة بالمطاط الصناعي تحت مجهر تشريح عند تكبير 10x.
- باستخدام مقص التشريح والملاقط الدقيقة ، قم بإزالة الجلد من المخلب لفضح عضلة المثنية الرقمية (FDB) (الشكل 3 ب). لمنع جفاف الأنسجة، أضف قطرة من S-MEM 10٪ FBS إلى العضلات باستخدام ماصة 1000 ميكرولتر.
- على مستوى الكعب ، شق الوتر وقم بتشريح عضلة FDB بعناية من الكعب إلى أخمص القدمين (الشكل 3 ب). تجنب التوتر على العضلات قدر الإمكان أثناء إجراء التشريح. الكثير من القوة المطبقة على الأنسجة سيؤدي إلى تلف الألياف العضلية. ضع العضلات على الفور في محلول الكولاجيناز.
- كرر الخطوات 3.5-3.7 مع القدم المقابلة. ضع العضلة المقطعة في محلول كولاجيناز في حاضنة CO 2 37 درجة مئوية ، 5٪ CO2 لمدة ساعتين و 45 دقيقة إلى 3 ساعات و 15 دقيقة. تكييف وقت الحضانة اعتمادا على النشاط الأنزيمي كولاجيناز وعمر الحيوان.
- أثناء احتضان الأنسجة العضلية ، أضف 300 ميكرولتر من MEM البارد بدون مصل أو مضادات حيوية في وسط طبق زجاجي سفلي 35 مم. أضف 2 ميكرولتر من اللامينين البارد عند 1.20 مجم / مل مباشرة إلى MEM. كرر العملية لعدد الأطباق المطلوبة. ضع الأطباق في حاضنة زراعة الخلايا عند 37 درجة مئوية ، 5٪ CO2 لمدة 1 ساعة على الأقل للسماح ببلمرة اللامينين.
- عند اكتمال الهضم الأنزيمي ، انقل العضلة إلى طبق زراعة الخلايا 60 مم الذي يحتوي على S-MEM 10٪ FBS باستخدام ماصة باستور زجاجية كبيرة (5 مم) مصقولة بالنار ومصباح لاتكس.
- باستخدام ماصة باستور زجاجية أصغر (2 مم) مصقولة بالنار ومصباح لاتكس ، قم بسحن العضلات برفق تحت مجهر التشريح (الشكل 3C). يجب أن تبدأ الألياف العضلية المنفصلة في الانفصال عن الأنسجة وإطلاقها في المحلول.
ملاحظة: كقاعدة عامة ، يفضل دائما تقليل التثليج (15-30 ممرا ماصة) ، لأن الكثير من التثليج المطول يمكن أن يجهد أو حتى يتلف الألياف. - باستخدام زوج من الملقط الناعم ، قم بإزالة أي أنسجة غير عضلية ، مثل الأعصاب أو الأوتار أو الأوعية الدموية (الشكل 3 د).
- أضف 2 مل من MEM 2٪ FBS الدافئ إلى كل طبق سفلي زجاجي مطلي باللامينين مقاس 35 مم. باستخدام ماصة سعة 200 ميكرولتر وطرف ماصة بلاستيكي معقم ، انقل ألياف العضلات المنفصلة إلى الطبق السفلي الزجاجي المطلي باللامينين مقاس 35 مم (الشكل 3E).
ملاحظة: يعد تحقيق كثافة ألياف منخفضة والسماح بفصل الألياف جيدا عن بعضها البعض أمرا مهما لمنع تداخل الألياف. - ضع الطبق السفلي الزجاجي 35 مم في الحاضنة عند 37 درجة مئوية ، 5٪ CO2. يمكن استخدام الألياف في إطار زمني من 2-20 ساعة.
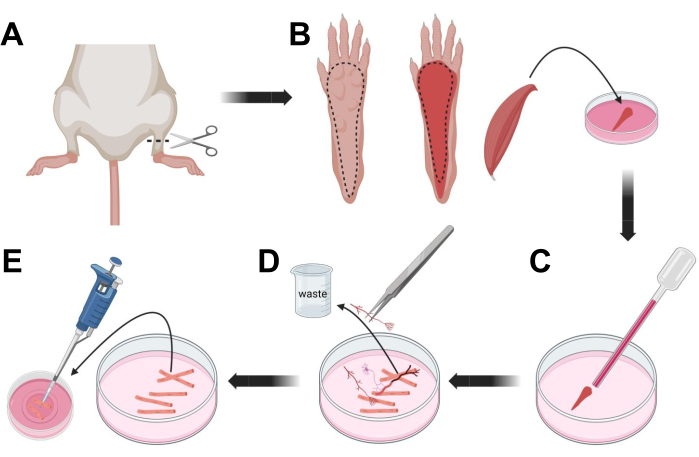
الشكل 3 ؛ تشريح الألياف FDB العضلات والتفكك. (أ) بعد تشريح القدم فوق مفصل الكاحل (الخط المتقطع) ، تتم إزالة الجلد الموجود أسفل مخلب القدم ، بعد الخط المتقطع لكشف عضلة FDB (B). يتم تشريح العضلات ووضعها في محلول كولاجيناز. ج: بعد الحضانة، تسحن العضلة لتتفكك وتحصل على ألياف عضلية منفردة. (د) تستخدم الملاقط الدقيقة لإزالة الأنسجة غير العضلية والحطام قبل نقل ألياف العضلات إلى طبق الاستزراع الزجاجي المطلي باللامينين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. وصف إعداد الاستحواذ
ملاحظة: إعداد الاستحواذ مشابه للإعداد الموصوف قبل42 مع التعديلات (الشكل 4 أ).
- قم بتشغيل جميع المكونات: الكمبيوتر ، محول AD / DA ومضخم مشبك المسار ، المجهر ، المرحلة الآلية ، المعالج (المعالجات) ، مصدر الطاقة للصمام الثنائي الضوئي ، مصدر الضوء ، مصراع الضوء ، مولد النبض ، ومحرر البروتوكول.
- قم بتنشيط منطق الترانزستور والترانزستور (TTL) الذي يقوم بتشغيل إشارة OUT من AD / DA للتحكم في مولد النبض ومصراع الضوء ومحرر البروتوكول.
- استخدم إشارة خرج TTL من مولد النبض وقم بتوصيله بقناة AD لمكبر الصوت للتحقق من التشغيل الزمني الدقيق. يجب تقييم التحكم الكافي في اتساق الزناد بعناية قبل التجربة لضمان تزامن الجهاز بشكل كاف.
ملاحظة: في حالة CaV1.1 ، توقع رؤية أقصى إشارة في أقل من 4-10 مللي ثانية بعد التحفيز (الوقت لتطوير حركة الشحن القصوى5). الإشارة سريعة ودقة زمنية دقيقة أمر بالغ الأهمية للمقارنة مع التدابير الأخرى ، مثل الكالسيوم العابر أو حركة الشحن المقاسة عبر مشبك الجهد. - لتركيز ضوء الإثارة في منطقة أو بقعة معينة من الألياف (الشكل 4 ب) ، استخدم الحجاب الحاجز الموجود في مسار ضوء الإثارة. يتيح ذلك الحصول على الإشارة فقط في منطقة تكون فيها إشارة EGFP-CaV1.1 قصوى (الشكل 4B).
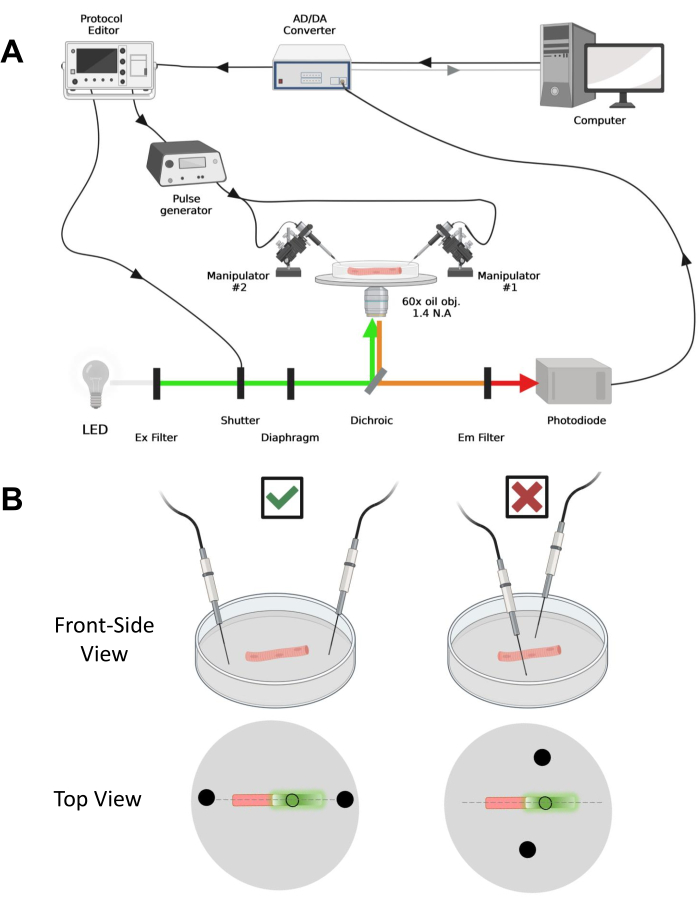
الشكل 4: وصف نظام التسجيل. (أ) رسم تخطيطي يوضح العلاقة بين المكونات المختلفة لنظام التسجيل. يتكون الإعداد من مجهر مقلوب مع مرحلة آلية ، ومصدر ضوء الصمام الثنائي الباعث للضوء (LED) ، ومصراع الضوء ، ودائرة مراقبة الضوء القائمة على الصمام الثنائي الضوئي حسب الطلب مع وظيفة المسار والانتظار43 ، ومحول AD / DA (من مضخم مشبك التصحيح) ، ومولد نبض تناظري ، ووحدة تحفيز مجال خارجي مقترنة بأقطاب التحفيز الميداني ، المتلاعبين الآليين ، والبرامج التجارية لاقتناء البروتوكولات ومزامنتها وتوليدها. يتكون قطب التحفيز الميداني من سلكين بلاتينيين ملحومين بكابلات نحاسية مرتبطة بمولد النبض عبر موصل BMC. يتم استخدام مرشحات الإثارة والانبعاثات المحددة للكشف عن كل من إشارات EGFP و MTS-5-TAMRA. لإثارة EGFP ، يتم استخدام مصباح زينون مع مرشح إثارة (Ex) 488 نانومتر (± 20 نانومتر) ومرشح LP510 نانومتر Em. بالنسبة ل MTS-5-TMRA ، يتم استخدام مصدر ضوء LED 530 نانومتر ومرشح LP550 nm Em. (B) منظر لألياف تعبر عن بنية EGFP-CaV1.1-cys مع أقطاب تحفيز ثنائية المجال (دوائر سوداء) موجهة بشكل صحيح (يسار) وغير صحيح (يمين) في المحور الرئيسي للألياف (خط متقطع). تمثل الدائرة السوداء غير المملوءة منطقة الاستحواذ بقطر يتم التحكم فيه بواسطة فتحة الحجاب الحاجز ، الموضوعة أمام مصدر الضوء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تقييم النشاط الكهربائي للألياف الإيجابية EGFP وتلطيخ السيستين
ملاحظة: يتم إجراء تحفيز مجال الألياف العضلية الهيكلية كما هو موضح قبل41 مع التعديلات. يستخدم هذا النهج من أجل (1) تحديد الألياف الصحية والوظيفية والمستجيبة كهربائيا ، (2) تلطيخ الألياف بصبغة الفلورسنت التفاعلية للسيستين ، و (3) تسجيل إشارة الفلورسنت استجابة لإمكانات الفعل المنتشرة. يجب إجراء كل خطوة من خطوات هذا القسم والخطوة التالية في بيئة منخفضة الإضاءة لتقليل تبييض صبغة الفلورسنت.
- ضع الطبق السفلي الزجاجي 35 مم الذي يحتوي على ألياف عضلية منفصلة على مرحلة المجهر. قم بإزالة وسائط الاستزراع بعناية باستخدام ماصة 1000 ميكرولتر واستبدلها ب 2 مل من محلول رينغر بدرجة حرارة الغرفة (انظر الجدول 1 للتكوين). قد تكون هناك حاجة إلى جولات متعددة من استبدال الوسائط لإزالة وسائط زراعة الخلايا الأصلية التي تحتوي على السيستين الحر بالكامل.
- باستخدام مناور ميكانيكي أو آلي ، ضع السلكين البلاتينيين بشكل عمودي على قاع الطبق. تأكد من محاذاة أطراف القطب بالنسبة للمحور الطولي للألياف وعلى بعد بضعة ملليمترات من نهايات الألياف ، وأن الفصل بين الأقطاب الكهربائية هو 5 مم (الشكل 4 ب). قم بضبط موضع القطب إما عن طريق تدوير الطبق أو تركيب كل قطب كهربائي على معالج دقيق مستقل (الشكل 4 ب).
- قم بتشغيل الضوء المرسل وابحث عن الألياف في مجال الرؤية باستخدام هدف 20x. انقل مكعب مرشح EGFP إلى مسار الضوء.
ملاحظة: باستخدام مجهر مجهز ب epifluorescence وهدف منخفض التكبير (2x) ، من الممكن تقييم كفاءة نقل البناء في العضلات بأكملها قبل تفكك الألياف من خلال تقييم تعبير EGFP (الشكل 5 أ). - باستخدام غالق ضوء يتم التحكم فيه عن بعد ، قم بتنشيط ضوء الإثارة 488 نانومتر لتحديد الألياف الإيجابية EGFP. قم بتخزين موقع الألياف x-y على الطبق باستخدام مرحلة المجهر الآلي. غالبا ما تكون إشارة EGFP غير متجانسة داخل الألياف (الشكل 4B). قم بتوسيط الموضع المحفوظ إلى ألمع إشارة EGFP.
- بعد تحديد الألياف الإيجابية EGFP ، ارجع إلى أول توطين محفوظ. باستخدام مفتاح التشغيل اليدوي ، قم بتوصيل نبضتين تحفيزيتين متسلسلتين لمدة 1 مللي ثانية وسعة 20 فولت. اضبط قطبية النبضات على التناوب.
- بعد التحفيز ، لاحظ انقباضات ألياف متجانسة متحدة المركز استجابة لنبضتين من القطبية المعاكسة. يشير الانكماش المحلي أو عدم وجود انكماش في الاستجابات لنبضات القطبية البديلة إلى استجابات سلبية محلية غير منتشرة أو غير قابلة للاستثارة41. استبعد هذه الألياف لبقية التجربة.
- أضف 2 ميكرولتر من محلول MTS-5-TAMRA سعة 10 مللي متر مباشرة إلى الطبق واخلطه برفق باستخدام ماصة 1000 ميكرولتر (تركيز نهائي 10 ميكرومتر). احرص على عدم تحريك الطبق ، وإلا ستفقد مواضع الألياف المخزنة. احتضان لمدة 4-5 دقائق للسماح بانتشار جزيء الثيول الفلوري في تجويف نظام النبيب المستعرض.
- تطبيق التحفيز المتكرر ثنائي القطب لاستحضار قطارات جهد الفعل المتتالية بمعدل 50 هرتز لمدة 300 مللي ثانية كل 1 ثانية لمدة 5 دقائق.
ملاحظة: توفر القطارات النبضية إمكانية الوصول إلى السيستين الذي يتم إدخاله في S4 من EGFP-CaV1.1 للتفاعل مع MTS-5-TAMRA. تعد قدرة الألياف على الانقباض ميكانيكيا استجابة للتحفيز مهمة لمحتوى تجويف النبيبات المستعرضة للدوران مع البيئة خارج الخلية. - قم بإزالة محلول التلوين من الطبق باستخدام ماصة سعة 1000 ميكرولتر واستبدلها ب 2 مل من محلول رينغر بدرجة حرارة الغرفة. قد تكون هناك حاجة إلى جولتين أو ثلاث جولات لإزالة MTS-5-TMRA غير المقترنة بالكامل. دع الألياف الملطخة تتعافى من بروتوكول التلوين لمدة 10 دقائق على الأقل.
- كما في الخطوة 5.6 ، أعد تقييم صحة الألياف والنشاط الكهربائي من خلال مراقبة تقلص الألياف المتماثل استجابة للقطبية المتناوبة. استبعاد الألياف التي لا تستجيب لكلا المحفزين من بقية التجربة.
- انقل مكعب مرشح MTS-5-TAMRA إلى مسار الضوء. باستخدام غالق الضوء الذي يتم التحكم فيه عن بعد ، قم بتنشيط ضوء الإثارة 533 نانومتر لتأكيد تلطيخ MTS-5-TAMRA المتجانس على الألياف.
ملاحظة: عند تلطيخ MTS-5-TMRA ، يتفاعل كل من السيستين الهندسي والداخلي مع مشتق ماليميد (الشكل 5B). وبالتالي ، من الصعب تقييم رد الفعل المناسب مع السيستين من الاهتمام. يتم التعبير عن CaV1.1 بشكل أساسي في النبيب المستعرض ، مما يشكل نمط نطاق مزدوج مميز. باستخدام مجهر متحد البؤر أو فوق التألق ، يمكن استخدام صورة x-y لتأكيد التلوين المناسب ودخول النبيب المستعرض وانتشار MTS-5-TAMRA (الشكل 5C).
6. اكتساب الإشارات ومعالجتها
ملاحظة: قبل إجراء القياسات الفلورية ، يجب تصميم اكتساب الإشارة بعناية للحصول على نسبة الإشارة / الضوضاء المثلى. تسمح معدلات أخذ العينات البطيئة بمزيد من الكشف عن الضوء مع تقليل عدد النقاط التي يمكن الحصول عليها أثناء إعادة ترتيب مطابقة البروتين. في حالة EGFP-CaV1.1-cys ، تحدث حركة الشحنة الناتجة عن شكل موجة جهد الفعل في ~ 1-10 مللي ثانية37. للحصول على نقاط متعددة لتتبع تطور الحركة بمرور الوقت ، تم ضبط الاستحواذ على 50 μs لكل نقطة.
- ضع الألياف في منتصف مجال الرؤية بنظام تكبير مناسب. لهذه التجارب ، تم استخدام هدف مقلوب بفتحة عددية 60x 1.4 زيت (NA). قم بتحسين الإضاءة وموضع الألياف باستخدام المرحلة الآلية والحجاب الحاجز لإلقاء الضوء على منطقة دائرية من قطر الألياف ، حيث تكون إشارة EGFP هي الحد الأقصى (الشكل 4B).
- بمجرد وضع الألياف للاكتساب ، قم بتوجيه سلكين بلاتينيين للتحفيز الميداني مثبتين بشكل مستقل في كل طرف من طرفي الألياف. قم بمحاذاة الأسلاك على المحور الرئيسي للألياف في خط مستقيم وباعدها بمقدار 5 مم مع الألياف الموجودة في المركز (الشكل 4 ب).
- اضبط مرشحات إثارة الاكتساب والانبعاثات على الإعدادات المناسبة ل MTS-5-TAMRA. ابدأ التجربة بتنفيذ البروتوكول المكتوب في برنامج الاستحواذ. تعمل هذه الخطوة على تشغيل جميع الأجهزة النهائية (مثل محرر البروتوكول ، مصراع الضوء ، مولد النبض).
ملاحظة: يسمح هذا البروتوكول بفترة وجيزة (أي 10 مللي ثانية) من اكتساب خط الأساس قبل تسليم التحفيز الميداني للسماح بإجراء قياسات لاحقة للتألق أثناء الراحة. - ابدأ جهدا واحدا أو مجموعة من جهود الفعل بنبضة 0.5 أو 1 مللي ثانية ، 20 فولت مربع. قلل من إجمالي وقت الاستحواذ قدر الإمكان لتجنب تبييض الإشارة.
ملاحظة: حتى في حالة التسجيل في مركز الألياف ، يمكن أن تحدث إشارة مضان مرتبطة بالحركة وقد يتم الخلط بينها وبين إشارة الفلورسنت بسبب التغيير المطابق للبروتين الفلوروفور (الشكل 5D). يجب تأخير الإشارة الناتجة عن الانكماش مقارنة بالوقت المتوقع لحركة الشحن بعد التحفيز37. - لمزيد من التمييز بين الإشارة الناشئة عن حركات S4 والإشارة الناتجة عن تقلص الألياف ، أضف 1 ميكرولتر من 100 mM N-benzyl-p-toluene sulphonamide (BTS ؛ 50 μM التركيز النهائي) إلى محلول التسجيل لتقليل الاستجابات المقلصة وتكرار الخطوة 6.4. تتوافق الإشارات المكتشفة للمرة الثانية بعد تجميد الألياف الدوائية مع الحركة الجزيئية للحلزون S4 الموسوم (الشكل 5D).
ملاحظة: لا ينبغي الكشف عن أي إشارة في التحكم EGFP-CaV1.1 بدون السيستين المصمم هندسيا بعد قمع الحركة باستخدام BTS. - باستخدام نفس الإعدادات ، احصل على إشارة مماثلة في موقع داخل الطبق حيث لا توجد ألياف عضلية أو حطام للحصول على قيمة مضان الخلفية.
- قم باستيراد الملفات التي تحتوي على المسار الزمني للتألق الخام [Fr (t)] من مضان الألياف والخلفية [Fb (t)] إلى برنامج تحليل البيانات. متوسط العمود الذي يحتوي على Fb(t) للحصول على قيمة Fb متجانسة. اطرح Fb من Fr (t) للحصول على قيم التألق المطلق [F (t)]. قم بتنعيم الإشارة الناتجة بوظيفة التنعيم إذا لزم الأمر.
ملاحظة: مع نظام الكشف هذا وتكرار الاستحواذ ، قررنا استخدام وظيفة متوسط مجاورة مع نافذة من 50 نقطة للتنعيم. - متوسط قيم خط الأساس F (t) في فترة زمنية قدرها 10 مللي ثانية قبل التحفيز للحصول على قيمة مضان الراحة (F0). اطرح F0 من F (t) الناعم للحصول على التغيير المطلق في التألق [ΔF (t)]. بعد ذلك ، للتعبير عن تغير التألق بمرور الوقت بالنسبة إلى مضان الراحة (ΔF / F0) ، قسم ΔF (t) على F0.
- لتقييم مدى تبييض الإشارة ، حدد نقطتين من إشارة ΔF / F0 بمرور الوقت ، قبل وبعد التحفيز وبعيدا عن الإشارة الفلورية. قم بملاءمة دالة خطية لهاتين النقطتين للحصول على تتبع خط الأساس. اطرح خط الأساس إلى ΔF / F0 بمرور الوقت لتصحيح تبييض الإشارة.
- اطرح من العمود الزمني التأخير بين بدء الاستحواذ وإشارة التغذية المرتدة من التحفيز ، ليكون t = 0 المقابلة لبدء التحفيز الكهربائي.
ملاحظة: للسماح بإجراء مقارنات متعددة للإشارة ، غالبا ما يكون مطلوبا تطبيع سعة الإشارة. يمكن استخدام طرق مختلفة اعتمادا على الغرض من التجربة. في قسم النتائج التالي ، كنا مهتمين بحركية الإشارة ، لذلك استخدمنا طريقة بسيطة تتكون من تطبيع كل إشارة بالحد الأدنى من القيمة التي تم الوصول إليها (أي الذروة السلبية الجارية).
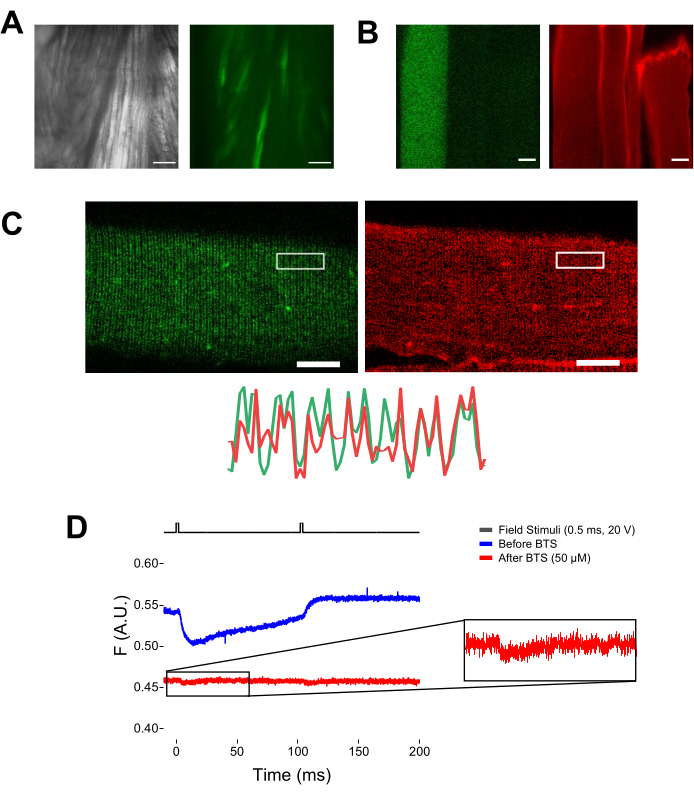
الشكل 5: تصوير الألياف العضلية التي تعبر عن EGFP-CaV1.1-cys بدون ومع تلطيخ MTS-5-TAMRA وسجل الفلورومتري الخام التمثيلي. (أ) أمثلة على الصور المرسلة (اليسرى) والفلورية (اليمنى) للعضلة المشرحة غير المنفصلة التي تعبر عن بنية EGFP-CaV1.1 VSD-III. شريط المقياس: 100 ميكرومتر. (B) صورة تمثيلية لألياف عضلية تعبر عن بنية EGFP-CaV1.1 VSD-III قبل (يسار) وبعد (يمين) تلطيخ MTS-5-TAMRA. كما أن السيستين الداخلي للألياف غير المنقولة ملطخة بالصبغة. شريط المقياس: 30 ميكرومتر. (C) تظهر الصورة متحدة البؤر لبنية EGFP-Ca V 1.1 VSD-III (يسار) وتلطيخ MTS-5-TAMRA (يمين) نمطا كلاسيكيا مزدوج النطاق مميزا لتوطين CaV1.1 على نظام النبيب المستعرض للألياف العضلية (أسفل). شريط المقياس: 25 ميكرومتر. (د) التسجيل الفلورومتري التمثيلي استجابة لاثنين من المحفزات وقياسه باستخدام الصمام الثنائي الضوئي قبل (الأثر الأزرق) وبعد (الأثر الأحمر) تجميد الألياف باستخدام سلفوناميد N-benzyl-p-toluene (BTS). يشير الخط الأسود العلوي إلى بروتوكول إزالة استقطاب الألياف عن طريق تحفيز المجال الخارجي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
عندما يتم تشغيل إمكانات الفعل المنتشرة استجابة لتحفيز المجال المتكرر ، فمن الممكن تتبع حركة مستشعر الجهد المحددة استجابة لتردد معين من إزالة الاستقطاب. كما هو موضح في الشكل 6A ، يمكن تتبع حركة الحلزونات الموسومة VSD-II استجابة لكل من إزالة الاستقطاب المتتالية المطبقة عند 10 ه?...
Discussion
هنا ، يتم وصف بروتوكول خطوة بخطوة لإجراء FSDF في ألياف العضلات لدراسة حركات مستشعر الجهد الفردي من قناة CaV1.1. على الرغم من أن عدد الخطوات وتنوع الأساليب التي يتم دمجها في هذه التقنية قد يبدو معقدا ، إلا أن معظم هذه التقنيات غالبا ما تستخدم بشكل روتيني في مختبرات الفيزياء الحيوية / علماء ?...
Disclosures
لم يبلغ المؤلفون عن أي تضارب في المصالح.
Acknowledgements
نشكر الدكتور ج. فيرغارا (جامعة كاليفورنيا ، لوس أنجلوس) على مشاركة البلازميد من النوع البري EGFP-CaV1.1 (أرنب). نشكر قسم ييل لمختبر إلكترونيات علم وظائف الأعضاء وخاصة هنريك أبيلدجارد لتصميم وبناء الصمام الثنائي الضوئي مع دائرة المسار والتعليق. تم دعم هذا العمل من خلال منح المعاهد الوطنية للصحة R01-AR075726 و R01-NS103777
Materials
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
References
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved