Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Funktionelle ortsgerichtete Fluorometrie in nativen Zellen zur Untersuchung der Erregbarkeit der Skelettmuskulatur
In diesem Artikel
Zusammenfassung
Die funktionelle ortsgerichtete Fluorometrie ist eine Methode zur Untersuchung von Proteindomänenbewegungen in Echtzeit. Die Modifikation dieser Technik für ihre Anwendung in nativen Zellen ermöglicht nun die Detektion und Verfolgung einzelner Spannungssensorbewegungen von spannungsabhängigen Ca2+ -Kanälen in murinen isolierten Skelettmuskelfasern.
Zusammenfassung
Die funktionelle ortsgerichtete Fluorometrie war die Technik der Wahl, um die Struktur-Funktions-Beziehung zahlreicher Membranproteine, einschließlich spannungsabhängiger Ionenkanäle, zu untersuchen. Dieser Ansatz wurde vor allem in heterologen Expressionssystemen verwendet, um gleichzeitig Membranströme, die elektrische Manifestation der Kanalaktivität und Fluoreszenzmessungen zu messen und lokale Domänenumlagerungen zu melden. Die funktionelle ortsgerichtete Fluorometrie kombiniert Elektrophysiologie, Molekularbiologie, Chemie und Fluoreszenz in einer einzigen, weitreichenden Technik, die es ermöglicht, strukturelle Umlagerungen und Funktionen durch Fluoreszenz bzw. Elektrophysiologie in Echtzeit zu untersuchen. In der Regel erfordert dieser Ansatz einen technisch hergestellten spannungsabhängigen Membrankanal, der ein Cystein enthält, das mit einem thiolreaktiven Fluoreszenzfarbstoff getestet werden kann. Bis vor kurzem wurde die Thiol-reaktive Chemie, die für die ortsgerichtete Fluoreszenzmarkierung von Proteinen verwendet wird, ausschließlich in Xenopus-Oozyten und Zelllinien durchgeführt, was den Anwendungsbereich des Ansatzes auf primäre, nicht erregbare Zellen einschränkte. Dieser Bericht beschreibt die Anwendbarkeit der funktionellen ortsgerichteten Fluorometrie in adulten Skelettmuskelzellen, um die frühen Schritte der Erregungs-Kontraktions-Kopplung zu untersuchen, den Prozess, durch den die elektrische Depolarisation von Muskelfasern mit der Aktivierung der Muskelkontraktion verbunden ist. Das vorliegende Protokoll beschreibt die Methoden zum Design und zur Transfektion von Cystein-modifizierten spannungsabhängigen Ca2+ -Kanälen (CaV1.1) in Muskelfasern des Flexor digitorum brevis adulter Mäuse mittels in vivo Elektroporation und die nachfolgenden Schritte, die für funktionelle ortsgerichtete Fluorometriemessungen erforderlich sind. Dieser Ansatz kann angepasst werden, um andere Ionenkanäle und Proteine zu untersuchen. Der Einsatz der funktionellen ortsgerichteten Fluorometrie von Säugetiermuskeln ist besonders relevant für die Untersuchung grundlegender Mechanismen der Erregbarkeit.
Einleitung
Die Fähigkeit, Konformationsänderungen von Ionenkanälen als Reaktion auf einen bekannten elektrischen Reiz in einer lebenden Zelle zu verfolgen, ist eine Quelle wertvoller Informationen für die molekulare Physiologie1. Spannungsabhängige Ionenkanäle sind Membranproteine, die Änderungen der Transmembranspannung wahrnehmen, und ihre Funktion wird auch durch Spannungsänderungen beeinflusst2. Die Entwicklung von Spannungszangentechniken im letzten Jahrhundert ermöglichte es Physiologen, Ionenströme, die von spannungsabhängigen Ionenkanälen als Reaktion auf die Membrandepolarisation übertragen werden, in Echtzeit zu untersuchen3. Der Einsatz der Voltage-Clamp-Technologie war entscheidend für das Verständnis der elektrischen Eigenschaften erregbarer Zellen wie Neuronen und Muskeln. In den 1970er Jahren ermöglichte die Verfeinerung der Spannungsklemme die Detektion von Gate-Strömen (oder Ladungsbewegungen) in spannungsabhängigen Kalzium- (Ca V) und Natrium- (NaV) Kanälen 4,5. Gating-Ströme sind nichtlineare kapazitive Ströme, die durch die Bewegung von Spannungssensoren als Reaktion auf Änderungen des elektrischen Feldes über die Zellmembran6 entstehen. Gating-Ströme werden als elektrische Manifestation molekularer Umlagerungen betrachtet, die der Ionenkanalöffnung7 vorausgehen oder diese begleiten. Während diese Strommessungen wertvolle Informationen über die Funktion des Kanals liefern, sind sowohl Ionenströme als auch Gating-Ströme indirekte Messwerte von inter- und intramolekularen Konformationsumlagerungen spannungsabhängiger Kanäle7.
Die funktionelle ortsgerichtete Fluorometrie (FSDF; auch als Voltage-Clamp-Fluorometrie bezeichnet, VCF) wurde in den frühen 1990er Jahren 8 entwickelt und ermöglichte es erstmals, lokale Konformationsänderungenund die Funktion eines Kanalproteins in Echtzeit direkt zu betrachten. Mit einer Kombination aus Kanalmutagenese, Elektrophysiologie und heterologen Expressionssystemen ist es möglich, die beweglichen Teile bestimmter Kanäle oder Rezeptoren als Reaktion auf den aktivierenden Stimulus fluoreszierend zu markieren und zu verfolgen 9,10. Dieser Ansatz wurde ausgiebig verwendet, um die Spannungsmessmechanismen in spannungsabhängigen Ionenkanälen 8,10,11,12,13,14,15,16,17,18,19 zu untersuchen. Maßgebliche Bewertungen finden Sie unter 10,20,21,22,23.
Die Ca-V- undNa-V-Kanäle, die für die Initiierung und Ausbreitung elektrischer Signale entscheidend sind, bestehen aus einerα1-Hauptuntereinheit, die eine zentrale Pore und vier nicht identische Spannungsmessdomänen2 besitzt. Zusätzlich zu ihrer ausgeprägten Primärstruktur werden Ca-V- und Na-V-Kanäle als Multi-Untereinheiten-Komplexe mit Hilfsuntereinheiten24 ausgedrückt. Spannungsabhängige Kaliumkanäle (K V) bestehen aus vier Untereinheiten, die wie eine einzelne Domäne von Na V oder CaV 25 aussehen. Die porenbildende und spannungsmessende α1-Untereinheit der Ca V- und NaV-Kanäle wird durch ein einzelnes Polypeptid gebildet, das für vier einzelne Domänen von sechs einzigartigen Transmembransegmenten kodiert (S1-S6; Abbildung 1A) 24,26. Der Bereich, der aus S1- bis S4-Transmembransegmenten besteht, bildet die Spannungssensordomäne (VSD) und die S5- und S6-Transmembransegmente bilden die Porendomäne26. In jedem VSD enthält die S4-α-Helix positiv geladenes Arginin oder Lysin (Abbildung 1A,B), die sich als Reaktion auf die Depolarisationder Membran bewegen 7. Mehrere Jahrzehnte Forschung und die Ergebnisse unterschiedlichster experimenteller Ansätze stützen die Annahme, dass sich S4-Segmente als Reaktion auf die Membrandepolarisation nach außen bewegen und Gating-Ströme erzeugen6.
FSDF misst die Fluoreszenzänderungen eines thiolreaktiven Farbstoffs, der an einen bestimmten Cysteinrest (d. h. die S4-α-Helix) auf einem Ionenkanal oder einem anderen Protein konjugiert ist, das durch gezielte Mutagenese erzeugt wird, da der Kanal als Reaktion auf Membrandepolarisation oder andere Reize funktioniert10. Tatsächlich wurde FSDF ursprünglich entwickelt, um zu untersuchen, ob sich das S4-Segment in KV-Kanälen, das als Hauptspannungssensor des Kanals vorgeschlagen wurde, bewegt, wenn sich die Anschnittladungen als Reaktion auf Änderungen des Membranpotentials 8,10 bewegen. Im Falle von spannungsabhängigen Ionenkanälen kann FSDF unabhängige Konformationsumlagerungen der vier VSDs (Verfolgung eines VSD zu einem bestimmten Zeitpunkt) gleichzeitig mit Kanalfunktionsmessungen auflösen. In der Tat wurde mit diesem Ansatz gezeigt, dass einzelne VSDs an bestimmten Aspekten der Kanalaktivierung und -inaktivierung unterschiedlich beteiligt zu sein scheinen 12,27,28,29,30. Die Identifizierung des Beitrags jedes VSD zur Funktion der Kanäle ist von hoher Relevanz und kann verwendet werden, um den Betrieb der Kanäle weiter aufzuklären und möglicherweise neue Ziele für die Arzneimittelentwicklung zu identifizieren.
Die Verwendung von FSDF in heterologen Expressionssystemen hat sich als äußerst hilfreich erwiesen, um unser Verständnis der Kanalfunktion aus einer reduktionistischen Perspektive zu erweitern10,23. Wie viele reduktionistische Ansätze bietet er Vorteile, hat aber auch Grenzen. Eine wesentliche Einschränkung ist beispielsweise die partielle Rekonstitution der Kanal-Nanoumgebung im heterologen System. Häufig interagieren Ionenkanäle mit zahlreichen akzessorischen Untereinheiten und zahlreichen anderen Proteinen, die ihre Funktion modifizieren31. Prinzipiell können verschiedene Kanäle und ihre akzessorischen Untereinheiten in heterologen Systemen unter Verwendung mehrerer proteinkodierender Konstrukte oder polycistronischer Plasmide exprimiert werden, aber ihre native Umgebung kann nicht vollständig rekonstituiert werden30,32.
Unsere Gruppe hat kürzlich eine Variante von FSDF in nativen dissoziierten Skelettmuskelfasern veröffentlicht, um frühe Schritte der Erregungs-Kontraktions-Kopplung (ECC) zu untersuchen33,34, den Prozess, durch den die elektrische Depolarisation von Muskelfasern mit der Aktivierung der Muskelkontraktion verbunden ist35,36. Dieser Ansatz ermöglichte zum ersten Mal die Bewegungsverfolgung einzelner S4-Spannungssensoren aus dem spannungsabhängigen L-Typ Ca2+ Kanal (CaV1.1, auch bekannt als DHPR) in der nativen Umgebung einer erwachsenen differenzierten Muskelfaser37. Dies wurde durch die Berücksichtigung mehrerer Eigenschaften dieses Zelltyps erreicht, einschließlich der elektrischen Aktivität der Zelle, die eine schnelle stimulationsinduzierte selbstpropagierende Depolarisation ermöglicht, der Fähigkeit, cDNA-Plasmide durch In-vivo-Elektroporation zu exprimieren, der natürlichen hohen Expression und Kompartimentorganisation der Kanäle innerhalb der Zelle und ihrer Kompatibilität mit Hochgeschwindigkeits-Bildgebungs- und elektrophysiologischen Aufzeichnungsgeräten. Früher haben wir ein konfokales Hochgeschwindigkeits-Zeilenrastermikroskop als Detektionsvorrichtung37 verwendet. Nun wird eine Variation der Technik vorgestellt, bei der eine Fotodiode zur Signalerfassung verwendet wird. Dieses auf Photodioden basierende Detektionssystem könnte die Implementierung dieser Technik in anderen Labors erleichtern.
Hier wird ein Schritt-für-Schritt-Protokoll zur Verwendung von FSDF in nativen Zellen für die Untersuchung der individuellen Bewegung von Spannungssensoren aus CaV1.1 beschrieben. Während der CaV1.1-Kanal in diesem Manuskript als Beispiel verwendet wurde, könnte diese Technik auf extrazellulär zugängliche Domänen anderer Ionenkanäle, Rezeptoren oder Oberflächenproteine angewendet werden.
Protokoll
Dieses Protokoll wurde vom Institutional Animal Care and Use Committee der University of Maryland genehmigt. Das folgende Protokoll wurde in mehrere Unterabschnitte unterteilt, bestehend aus (1) dem Design des molekularen Konstrukts und der Auswahl des Cystein-reagierenden Farbstoffs, (2) der In-vivo-Elektroporation , (3) der Muskeldissektion und Faserisolierung, (4) der Beschreibung des Erfassungsaufbaus, (5) der Bewertung der positiven elektrischen Faseraktivität des verstärkten grün fluoreszierenden Proteins (EGFP) und der Cysteinfärbung sowie (6) der Signalerfassung und -verarbeitung. Darüber hinaus werden zu Beginn jedes Abschnitts einige relevante Überlegungen zur Anwendung von FSDF in einer Skelettmuskelfaser detailliert beschrieben. Alle Protokollabschnitte sollten mit geeigneter persönlicher Schutzausrüstung, einschließlich Laborkittel und Handschuhen, durchgeführt werden.
1. Molekulares Konstruktdesign und Cystein-reagierende Farbstoffauswahl
- Das Konstruktdesign ist ein entscheidender Teil des Erfolgs des Experiments. Generieren Sie zunächst ein Wildtyp-, fluoreszenzmarkiertes CaV1.1 cDNA-Konstrukt und bewerten Sie dessen Expression im entsprechenden Zelltyp. Für Muskelfasern kann eine starke Transfektionseffizienz durch die Verwendung eines Plasmids erreicht werden, das einen Cytomegalievirus-Promotor (CMV) trägt. In diesem Protokoll wurde ein bereits charakterisiertes Kaninchen-EGFP-CaV1.1-Plasmid verwendet38.
HINWEIS: Bei der Entwicklung des cDNA-Konstrukts, um einen Cysteinrest in einen spannungsabhängigen Ionenkanal einzuführen, ist die Cysteinposition entscheidend und sollte sorgfältig berücksichtigt werden. Das Cystein sollte vom extrazellulären Raum aus zugänglich sein, um eine Thiol-konjugierte Farbstoffreaktion zu ermöglichen (Abbildung 1C, D), und es sollte sich proximal in der S4-Region befinden, um seine Bewegung als Reaktion auf die Depolarisation genau zu verfolgen. Um jedoch eine Farbstofffluoreszenzlöschung als Reaktion auf Proteinbewegungen zu ermöglichen, sollte sich der eingeführte Cystein-konjugierte Fluorophor an der Grenzfläche von zwei verschiedenen Umgebungen befinden (z. B. Membran und extrazelluläre Flüssigkeit; Abbildung 1E). Darüber hinaus ist darauf zu achten, dass das eingesetzte Cystein die Proteinfunktion nicht beeinträchtigt. - Um eine Vorstellung von der korrekten Cysteinlokalisierung zu erhalten, sammeln Sie Informationen über die Kanalstruktur oder aus anderen Fluorometrie-Experimenten anderer verwandter Kanalproteine. Für das Design von Cystein-modifizierten Ca V1.1-Konstrukten wird die aufgelöste Kryo-Elektronenmikroskopie-Struktur (Kryo-EM) des Kanals26 bewertet und die Cysteininsertion früherer Arbeiten aus verwandten Kanälen wie CaV1.2 12 oder anderen Kanälen wie Shaker11 und NaChBac39 verglichen.
- Sobald die richtige Cysteinposition gewählt ist, verwenden Sie ein kommerzielles Mutagenese-Kit zur Durchführung von Cysteinsubstitutionen. Im vorliegenden Protokoll wurden die folgenden Cystein-Modifikationen unabhängig voneinander an jedem zytosolischen Ende des S4-Spannungsmesssegments von CaV1.1 entwickelt: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) und UniProtKB: P07293 (Abbildung 1B).
- Verwenden Sie für Skelettmuskelfasern 5-Carboxytetramethylrhodaminmethanethiosulfonat (MTS-5-TAMRA), das eine ordnungsgemäße und schnelle Diffusion in das transversale Tubulusmembransystem aufweist, bei dem es sich um eine Einstülpung der Oberflächenmembran und die vorherrschende Position von CaV1.1-Kanälen handelt. MTS-5-TAMRA zeigt eine Abnahme der Fluoreszenz beim Übergang von der Lipidmembran in eine wässrige Umgebung (Abbildung 1E).
Anmerkungen: Dylight- oder Alexa-Maleimid-Derivate färben die Oberflächenmembran, aber nicht das transversale Tubulussystem.
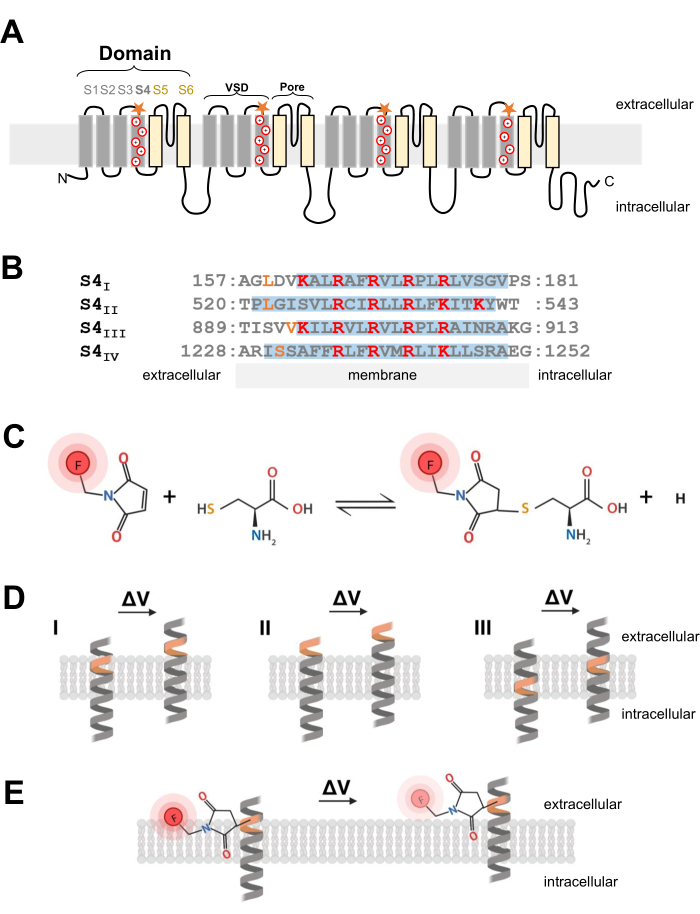
Abbildung 1: Schematische Darstellung der Thiol-Cystein-Reaktion an der Grenzfläche einer Transmembran-α-Helix. (A) L-Typ CaV 1.1 Membrantopologie. Die Pluszeichen repräsentieren basische Reste innerhalb der S4-α-Helix und die orangefarbenen Sterne zeigen den Ort an, an dem Cystein durch gezielte Mutagenese eingeführt wurde. (B) Sequenzangleichung von S4I zu S4IV von Kaninchen CaV1.1 (UniProtKB: P07293). Positiv geladene Arginin- und Lysinreste, die für die Spannungsmessung entscheidend sind, sind rot hervorgehoben, während technisch hergestellte Cysteinsubstitutionen orange gekennzeichnet sind. Diese Tafel wurde von der Referenz37 übernommen. (C) Cystein-Thiol-Fluoreszenzmolekülreaktion. (D) Diagramm zur Darstellung der Insertion der Cysteinmutagenese in eine spannungsempfindliche Transmembran-α-Helix. Cystein sollte in Ruhe in der Membran vergraben und nach der Depolarisation extrazellulär zugänglich sein (ΔV; I). Es ist typischerweise unwahrscheinlich, dass Cystein nachfährt, wenn das Zielcystein bereits vor der Depolarisation aus dem extrazellulären Raum zugänglich ist (II) oder wenn das Cystein nach der Depolarisation nicht mehr aus dem extrazellulären Raum zugänglich ist (III). (E) Nach der Reaktion mit dem thiolfluoreszierenden Molekül verringert die Bewegung der α-Helix als Reaktion auf die Depolarisation die Fluoreszenzemission von MTS-5-TAMRA. Das fluorometrische Signal wird durch die Bewegung der S4-Helix und die anschließende Farbstoffbewegung relativ zur Ebene der Membran und der wässrigen Umgebung erzeugt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. In-vivo-Elektroporation
ANMERKUNG: Elektroporationsexperimente wurden wie zuvor beschrieben38 mit Modifikationen durchgeführt. Im folgenden Abschnitt wird das Protokoll für die Elektroporation eines Fußballens der Maus entwickelt. Das Volumen muss angepasst werden, wenn beide Pfoten vorbereitet sind.
- Aliquot 25-100 μl Plasmidlösung bei 2-5 μg/μl in einem 1,5-ml-Röhrchen auf Eis.
- Bereiten Sie eine 0,5-ml-Lösung mit 2 mg/ml Hyaluronidase in steriler Kochsalzlösung vor und filtrieren Sie die Lösung durch einen 0,2-μm-Sterilfilter mit geringer Proteinbindung, der auf einer 1-ml-Spritze montiert ist. In einem 1,5-ml-Röhrchen bei Raumtemperatur lagern.
- Anästhesieren Sie eine Maus mit einem kalibrierten Anästhesiegerät mit 3%-4,5% Isofluran inO2 (1 l/min), indem Sie die Maus in die Anästhesiekammer legen. Bestätigen Sie eine ausreichende Betäubung des Tieres, indem Sie die Schwanzspitze mit einer Pinzette zusammendrücken. Es sollte keine Reaktion beobachtet werden, wenn die optimale Anästhesie erreicht ist.
- Nehmen Sie die Maus aus der Narkosekammer und legen Sie eine Anästhesie-Nasenmaske über die Maus. Legen Sie das Tier auf den Rücken auf ein isothermes Heizkissen, das mit einer sterilen Bankunterlage bedeckt ist. Setzen Sie die Narkose mit der Nagetiermaske mit 3% Isofluran inO2 (1 l/min) fort.
- Um ein Austrocknen der Augen während des Eingriffs zu verhindern, tragen Sie eine feine Schicht künstlicher Tränencreme mit einer sterilen Wattestäbchen auf die Augen des Tieres auf. Desinfizieren Sie die Pfote des Tieres mit einem sterilen, mit Ethylalkohol getränkten Tuch.
- Mit einer 0,5 Zoll langen sterilen 29 g Insulinnadel 20 μl Hyaluronidaselösung aspirieren. Dringen Sie auf Höhe der Ferse in die Haut ein und schieben Sie die Nadel subkutan in Richtung Zehenansatz (Abbildung 2A). Injizieren Sie die Lösung langsam, während Sie die Nadel schrittweise nach hinten bewegen. Unter der Pfote sollte ein Bolus oder eine Beule beobachtet werden (Abbildung 2B).
Anmerkungen: Abhängig vom Alter des Tieres und der Größe der Pfote ist es wahrscheinlich, dass nicht die volle Menge der Lösung injiziert wird. Oft kann ein kleines Leck an der Injektionsstelle auftreten. - Wiederholen Sie Schritt 2.6 mit der anderen Pfote, falls gewünscht, mit einer anderen sterilen Nadel nach ordnungsgemäßer Pfotendesinfektion, wie in Schritt 2.5.
- Trennen Sie die Narkose, indem Sie das Tier von der Nasenmaske nehmen, und bringen Sie die Maus in den Käfig zurück, mit Zugang zu Futter und Wasser nach Belieben. Die vollständige Genesung von der Narkose sollte in ~5 Minuten beobachtet werden. Stellen Sie das Röhrchen mit der Plasmidlösung auf den Tisch, damit es Raumtemperatur erreichen kann.
- Nach 1 h betäuben Sie das Tier ein zweites Mal, legen Sie es auf das Heizkissen und desinfizieren Sie die Pfote wie in den Schritten 2.3-2.5 beschrieben.
- Injizieren Sie 10-20 μl des cDNA-Konstrukts mit der gleichen Technik, die in Schritt 2.6 beschrieben ist. Die Gesamtmenge des injizierten Konstrukts beträgt 50-100 μg pro Pfote. Wiederholen Sie den Vorgang mit der kontralateralen Pfote, falls gewünscht, mit einer anderen sterilen Spritze.
- Halten Sie das Tier 5 Minuten lang unter Narkose auf dem isothermen Heizkissen, damit sich die cDNA-Lösung gleichmäßig im Gewebe verteilen kann.
- Schalten Sie das Gerät des Elektroporationsgeräts ein und schließen Sie es wie vom Hersteller empfohlen an das Doppelelektrodenarray an.
- Desinfizieren Sie das Doppelelektrodenarray mit einem mit Ethylalkohol getränkten Tuch. Stabilisieren Sie die Pfote mit einer Hand und führen Sie zunächst eine Elektrode unter die Haut an der Rückseite der Ferse ein. Führen Sie dann die zweite Elektrode an der Basis der Zehen ein und achten Sie darauf, dass die Ausrichtung beider Elektroden senkrecht zur Fußachse steht (Abbildung 2C). Richten Sie die Sonde in einer Position aus, die den Fuß oder das Bein nicht in einer extremen Winkelausrichtung einschränkt.
Anmerkungen: Das Einsetzen der Elektroden kann durch die Verwendung einer Pinzette und durch regelmäßiges Schärfen der Elektrodenspitzen erleichtert werden. Je nach Alter des Tieres kann die Größe der Pfote variieren und der Elektrodenabstand sollte entsprechend angepasst werden. - Elektroporieren Sie die Muskeln, indem Sie 20 Impulse mit einer Dauer von jeweils 20 ms bei 1 Hz anwenden. Stellen Sie für Elektrodennadeln im Abstand von 1 cm die Spannung auf ~100 V ein. Dies sollte angepasst werden, wenn der Elektrodenabstand auf ~100 V/cm geändert wird. Eine leichte Biegung der Finger sollte während der Impulsabgabe beobachtet werden, wenn die Elektroden richtig positioniert sind.
- Wiederholen Sie die Schritte 2.13 und 2.14 bei Bedarf mit der kontralateralen Pfote.
- Trennen Sie die Narkose und legen Sie das Tier für 2 Stunden in einen Käfig, isoliert von seinem nicht elektroporierten Gegenpartner mit Zugang zu Futter und Wasser ad libitum . Die vollständige Genesung von der Narkose sollte in ~10 Minuten beobachtet werden. Setzen Sie das Tier wieder in den Käfig.
HINWEIS: Die Expression von cDNA-Konstrukten hängt stark vom kodierten Protein ab. Proteinumsatz, Quantität und Qualität von cDNA, Plasmidpromotor und andere Variablen können die Konstruktexpression beeinflussen. In diesem Experiment benötigt die optimale Expression der α1S-Untereinheit von CaV1.1 mit einem CMV-Promotor 4 bis 6 Wochen, kann aber ab 2 Wochen für bis zu 12-15 Monate nachgewiesen werden.
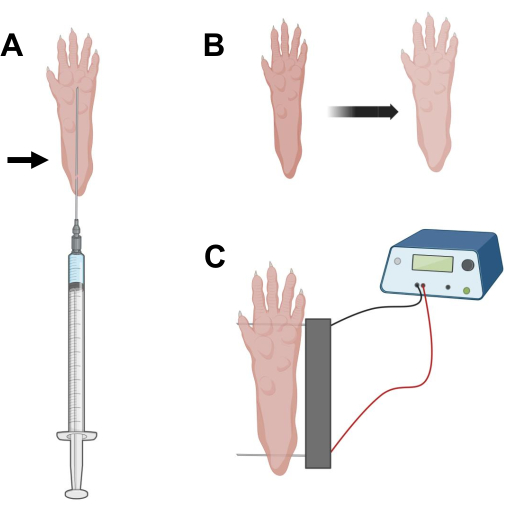
Abbildung 2: Diagramm der cDNA-Injektion und Elektroporation Positionierung der Elektroporationselektrode in einem Mausfußpolster für die Elektroporation. (A) Nadelposition für die Hyaluronidase- und cDNA-Injektion unter einem Mausfußballen. Der Pfeil zeigt die Einstichstelle durch die Haut an. (B) Eine leichte Verfärbung der Haut und eine leichte Vergrößerung der Pfote sollten nach der Injektion vorübergehend beobachtet werden. (C) Positionierung des Elektrodenträgers für die Elektroporation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Muskeldissektion und Faserisolierung
HINWEIS: Die Dissoziation der Skelettmuskelfasern wurde wie zuvor beschrieben durchgeführt 37,40,41 mit Modifikationen. Im folgenden Abschnitt ist das Protokoll für zwei Fußballen der Maus geeignet.
- Bereiten Sie vor der Faserdissoziation die mit Sylgard bedeckte Platte vor, indem Sie einen Teil Härter zu 10 Teilen Elastomer (% w/w) in einer 60-mm-Kunststoff-Petrischale hinzufügen, um eine Dicke von ~5 mm zu erreichen. Lassen Sie die mit Elastomer überzogene Platte vor der Verwendung über Nacht aushärten. Dies kann bei sachgemäßer Lagerung und Desinfektion mit 70% Ethylalkohol vor und nach Gebrauch mehrfach wiederverwendet werden.
- Bereiten Sie 4 mg Kollagenase Typ I in 2 ml spinner minimum essential eagle's medium (S-MEM) zu, ergänzt mit 10 % fetalem Kälberserum (FBS; Endkonzentration von 2 mg/ml). Übertragen Sie die Lösung auf eine unbeschichtete 35-mm-Kunststoffplatte und stellen Sie die Schale in einen Inkubator bei 37 °C, 5 % CO2.
HINWEIS: S-MEM ist eine modifizierte MEM-Formulierung ohne Glutamin und Ca2+. Das Fehlen von Ca2+ in diesem Schritt reduziert die Faserkontraktur während der enzymatischen Verdauung und Verreibung. - 5 ml S-MEM ergänzt mit 10% FBS in eine 60 mm unbeschichtete Kunststoffplatte geben und im Inkubator bei 37 °C, 5 % CO2 lagern.
- Euthanasieren Sie die Tiere durch Ersticken über CO2 mit anschließender Zervixluxation. Um die Kontamination während der Isolierung der primären Zellen zu reduzieren, tauchen Sie den Tierkadaver ~10 s lang in 70%igen Ethylalkohol. Entfernen und trocknen Sie den Kadaver mit saugfähigem Papier und schneiden Sie die Füße mit einer Schere zwischen Knöchel und Knie (Abbildung 3A).
- Einen Fuß des Tieres mit der Pfote nach oben mit Sezierstiften auf der mit Elastomer überzogenen Platte unter einem Präpariermikroskop bei 10-facher Vergrößerung festnageln.
- Entfernen Sie mit einer Sezierschere und einer feinen Pinzette die Haut von der Pfote, um den Musculus flexor digitorum brevis (FDB) freizulegen (Abbildung 3B). Um einer Austrocknung des Gewebes vorzubeugen, geben Sie mit einer 1.000-μl-Pipette einen Tropfen S-MEM 10% FBS in den Muskel.
- Auf Höhe der Ferse wird die Sehne eingeschnitten und der FDB-Muskel von der Ferse bis zu den Zehen vorsichtig präpariert (Abbildung 3B). Vermeiden Sie Verspannungen auf den Muskel so weit wie möglich, während Sie die Dissektion durchführen. Zu viel Kraft, die auf das Gewebe ausgeübt wird, führt zu einer Schädigung der Muskelfasern. Legen Sie den Muskel sofort in die Kollagenase-Lösung.
- Wiederholen Sie die Schritte 3.5-3.7 mit dem kontralateralen Fuß. Legen Sie den präparierten Muskel in die Kollagenaselösung in einen 37 °C, 5% CO 2 -Inkubator für2 h 45 min bis 3 h 15 min. Passen Sie die Inkubationszeit an die enzymatische Aktivität der Kollagenase und das Alter des Tieres an.
- Während das Muskelgewebe inkubiert, geben Sie 300 μl kaltes MEM ohne Serum oder Antibiotika in die Mitte einer 35-mm-Glasbodenschale. Geben Sie 2 μl kaltes Laminin mit 1,20 mg/ml direkt in das MEM. Wiederholen Sie den Vorgang für die Anzahl der gewünschten Gerichte. Stellen Sie die Schalen für mindestens 1 h bei 37 °C, 5 % CO2 in den Zellkultur-Inkubator, um eine Lamininpolymerisation zu ermöglichen.
- Wenn der enzymatische Aufschluss abgeschlossen ist, wird der Muskel mit einer Pasteurpipette aus feuerpoliertem Glas mit großer Bohrung (5 mm) und einer Latexbirne in die 60-mm-Zellkulturschale mit S-MEM 10% FBS überführt.
- Mit einer Pasteurpipette aus feuerpoliertem Glas mit kleinerer Bohrung (2 mm) und einem Latexkolben wird der Muskel unter einem Präpariermikroskop vorsichtig verreibt (Abbildung 3C). Dissoziierte Muskelfasern sollten sich vom Gewebe lösen und in der Lösung freigesetzt werden.
HINWEIS: Als Faustregel gilt, dass eine geringere Verreibung (15-30 Pipettenpassagen) immer bevorzugt wird, da eine zu lange Verreibung die Fasern belasten oder sogar beschädigen kann. - Entfernen Sie mit einer feinen Pinzette jegliches Nicht-Muskelgewebe wie Nerven, Sehnen oder Blutgefäße (Abbildung 3D).
- Fügen Sie 2 ml warmes MEM 2% FBS zu jeder 35 mm lamininbeschichteten Glasbodenschale hinzu. Übertragen Sie die dissoziierten Muskelfasern mit einer 200-μl-Pipette und einer sterilen Pipettenspitze aus Kunststoff in die 35-mm-lamininbeschichtete Glasbodenschale (Abbildung 3E).
Anmerkungen: Es ist wichtig, eine geringe Faserdichte zu erreichen und eine gute Trennung der Fasern voneinander zu ermöglichen, um eine Überlappung der Fasern zu vermeiden. - Stellen Sie die 35-mm-Glasbodenschale bei 37 °C, 5 % CO2 in den Inkubator. Fasern können in einem Zeitrahmen von 2-20 h verwendet werden.
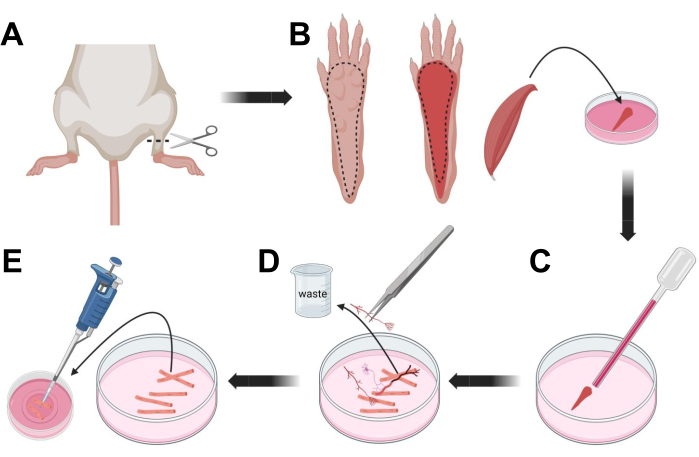
Abbildung 3; Dissektion und Dissoziation von Muskel-FDB-Fasern. (A) Nach der Fußdissektion oberhalb des Knöchelgelenks (gestrichelte Linie) wird die Haut unter der Fußpfote entfernt, wobei der gestrichelten Linie gefolgt wird, um den FDB-Muskel freizulegen (B). Der Muskel wird präpariert und in Kollagenaselösung gelegt. (C) Nach der Inkubation wird der Muskel verreibt, um zu dissoziieren und einzelne Muskelfasern zu erhalten. (D) Eine feine Pinzette wird verwendet, um Nicht-Muskelgewebe und Ablagerungen zu entfernen, bevor Muskelfasern in die lamininbeschichtete Kulturschale mit Glasboden übertragen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Beschreibung des Erfassungs-Setups
ANMERKUNG: Der Erfassungsaufbau ist vergleichbar mit dem vor42 beschriebenen mit Modifikationen (Abbildung 4A).
- Schalten Sie alle Komponenten ein: Computer, AD/DA-Wandler und Pfadklemmenverstärker, Mikroskop, motorisierter Tisch, Manipulator(en), Stromversorgung für die Fotodiode, Lichtquelle, Lichtverschluss, Impulsgenerator und Protokolleditor.
- Aktivieren Sie die Transistor-Transistor-Logik (TTL), die das OUT-Signal vom AD/DA auslöst, um den Impulsgeber, den Lichtverschluss und den Protokolleditor zu steuern.
- Verwenden Sie das TTL-Ausgangssignal des Impulsgenerators und schließen Sie es an einen AD-Kanal des Verstärkers an, um eine präzise zeitliche Triggerung zu überprüfen. Eine adäquate Kontrolle der auslösenden Konsistenz sollte vor dem Experiment sorgfältig bewertet werden, um eine adäquate Synchronisation der Geräte zu gewährleisten.
HINWEIS: Im Fall von CaV1.1 ist zu erwarten, dass das maximale Signal in weniger als 4-10 ms nach der Stimulation zu sehen ist (Zeit bis zur Entwicklung der maximalen Ladungsbewegung5). Das Signal ist schnell und eine präzise zeitliche Auflösung ist entscheidend für den Vergleich mit anderen Messgrößen, wie z. B. Kalziumtransienten oder Ladungsbewegungen, die über eine Spannungszange gemessen werden. - Um das Anregungslicht auf einen bestimmten Bereich oder Punkt der Faser zu fokussieren (Abbildung 4B), verwenden Sie eine Blende, die im Anregungslichtpfad positioniert ist. Dies ermöglicht die Signalerfassung nur in einem Bereich, in dem das EGFP-CaV1.1-Signal maximal ist (Abbildung 4B).
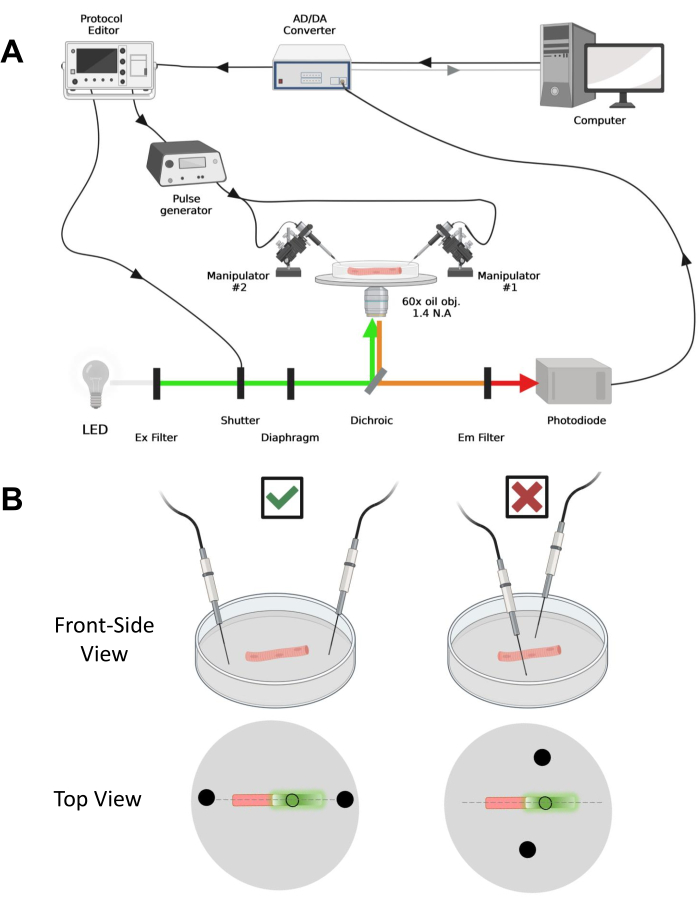
Abbildung 4: Beschreibung des Aufzeichnungssystems . (A) Diagramm, das die Verbindung zwischen den verschiedenen Komponenten des Aufzeichnungssystems veranschaulicht. Der Aufbau besteht aus einem inversen Mikroskop mit einem motorisierten Tisch, einer Leuchtdiode (LED)-Lichtquelle, einem Lichtverschluss, einer speziell angefertigten photodiodenbasierten Lichtüberwachungsschaltung mit einer Track-and-Hold-Funktion43, einem AD/DA-Wandler (aus einem Patch-Clamp-Verstärker), einem analogen Impulsgenerator, einer externen Feldstimulationseinheit, die mit Feldstimulationselektroden gekoppelt ist, Motorisierte Manipulatoren und kommerzielle Software für die Erfassung, Synchronisation und Generierung von Protokollen. Die Elektrode für die Feldstimulation besteht aus zwei Platindrähten, die mit Kupferkabeln verschweißt sind, die über einen BMC-Stecker mit dem Impulsgeber verbunden sind. Spezielle Anregungs- und Emissionsfilter werden verwendet, um sowohl EGFP- als auch MTS-5-TAMRA-Signale zu detektieren. Zur Anregung von EGFP wird eine Xenonlampe mit einem 488 nm (± 20 nm) Anregungsfilter (Ex) und einem LP510 nm Em-Filter verwendet. Für MTS-5-TAMRA wird eine 530 nm LED-Lichtquelle und ein LP550 nm Em-Filter verwendet. (B) Ansicht einer Faser, die ein EGFP-CaV1.1-cys-Konstrukt exprimiert, wobei die Zweifeld-Stimulationselektroden (schwarze Kreise) richtig (links) und falsch (rechts) in der Hauptachse der Fasern ausgerichtet sind (gestrichelte Linie). Der schwarze, ungefüllte Kreis stellt den Erfassungsbereich mit einem Durchmesser dar, der durch die Blendenöffnung vor der Lichtquelle gesteuert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Beurteilung der EGFP-positiven elektrischen Faseraktivität und der Cysteinfärbung
HINWEIS: Die Stimulation des Skelettmuskelfaserfeldes wird wie zuvor beschrieben41 mit Modifikationen durchgeführt. Dieser Ansatz wird verwendet, um (1) gesunde, funktionelle und elektrisch ansprechende Fasern zu identifizieren, (2) die Fasern mit dem Cystein-reaktiven Fluoreszenzfarbstoff zu färben und (3) das Fluoreszenzsignal als Reaktion auf das propagierte Aktionspotential aufzuzeichnen. Jeder Schritt dieses Abschnitts und der folgende sollte in einer Umgebung mit schlechten Lichtverhältnissen durchgeführt werden, um das Ausbleichen von Fluoreszenzfarbstoffen zu reduzieren.
- Stellen Sie die 35-mm-Glasbodenschale mit den dissoziierten Muskelfasern auf den Tisch des Mikroskops. Entfernen Sie das Nährmedium vorsichtig mit einer 1.000-μl-Pipette und ersetzen Sie es durch 2 ml Ringer-Lösung bei Raumtemperatur (Zusammensetzung siehe Tabelle 1 ). Möglicherweise sind mehrere Runden des Medienaustauschs erforderlich, um das ursprüngliche Zellkulturmedium, das freie Cystone enthält, vollständig zu entfernen.
- Platzieren Sie die beiden Platindrähte mit einem mechanischen oder motorisierten Manipulator senkrecht zum Boden der Schüssel. Stellen Sie sicher, dass die Elektrodenanschlüsse relativ zur Längsachse der Faser und einige Millimeter von den Faserenden entfernt ausgerichtet sind und dass der Abstand zwischen den Elektroden 5 mm beträgt (Abbildung 4B). Passen Sie die Elektrodenpositionierung weiter an, indem Sie entweder die Schüssel drehen oder jede Elektrode auf einem unabhängigen Mikromanipulator montieren (Abbildung 4B).
- Schalten Sie das Durchlicht ein und finden Sie die Fasern im Sichtfeld mit einem 20x-Objektiv. Bewegen Sie den EGFP-Filterwürfel in den Lichtweg.
HINWEIS: Mit einem Mikroskop mit Epifluoreszenz und einem Objektiv mit geringer Vergrößerung (2x) ist es möglich, die Transfektionseffizienz des Konstrukts im gesamten Muskel vor der Faserdissoziation durch die Beurteilung der EGFP-Expression zu beurteilen (Abbildung 5A). - Aktivieren Sie mit einem ferngesteuerten Lichtverschluss das 488-nm-Anregungslicht, um die EGFP-positiven Fasern zu identifizieren. Bewahren Sie die x-y-Position der Faser mit einem motorisierten Mikroskoptisch auf der Schüssel auf. Das EGFP-Signal ist innerhalb der Faser oft heterogen (Abbildung 4B). Zentrieren Sie die gespeicherte Position auf das hellste EGFP-Signal.
- Nachdem Sie EGFP-positive Fasern identifiziert haben, kehren Sie zur ersten gespeicherten Lokalisation zurück. Geben Sie mit einem manuellen Triggerschalter zwei sequenzielle Stimulationsimpulse mit einer Dauer von 1 ms und einer Amplitude von 20 V ab. Stellen Sie die Polarität der Impulse auf alternierend ein.
- Beobachten Sie nach der Stimulation zwei konzentrische, homogene Faserkontraktionen als Reaktion auf die beiden Impulse entgegengesetzter Polarität. Eine lokale Kontraktion oder das Fehlen einer Kontraktion in den Reaktionen auf Impulse mit alternativer Polarität deuten auf lokale, nicht propagierte passive Reaktionen oder Ungenauigkeit hin41. Schließen Sie diese Fasern für den Rest des Experiments aus.
- Geben Sie 2 μl 10 mM MTS-5-TAMRA-Lösung direkt in die Schale und mischen Sie vorsichtig mit einer 1.000-μl-Pipette (10 μM Endkonzentration). Achten Sie darauf, die Schüssel nicht zu bewegen, da sonst die gespeicherten Faserpositionen verloren gehen. 4-5 min inkubieren, um die Diffusion des fluoreszierenden Thiolmoleküls in das Lumen des transversalen Tubulussystems zu ermöglichen.
- Wenden Sie bipolare, sich wiederholende Stimulationen an, um aufeinanderfolgende Aktionspotentialzüge mit einer Rate von 50 Hz für 300 ms alle 1 s für 5 Minuten hervorzurufen.
HINWEIS: Die Pulsfolgen ermöglichen den Zugang zu den Cysteinen, die in das S4 von EGFP-CaV1.1 eingeführt wurden, um mit MTS-5-TAMRA zu reagieren. Die Fähigkeit der Faser, sich als Reaktion auf Stimulation mechanisch zusammenzuziehen, ist wichtig, damit der Lumeninhalt des transversalen Tubulus mit der extrazellulären Umgebung zirkulieren kann. - Entfernen Sie die Färbelösung mit einer 1.000-μl-Pipette aus der Schale und ersetzen Sie sie durch 2 ml Ringer-Lösung bei Raumtemperatur. Es können zwei oder drei Runden erforderlich sein, um unkonjugiertes MTS-5-TAMRA vollständig zu entfernen. Lassen Sie die gefärbte Faser mindestens 10 Minuten lang vom Färbeprotokoll erholen.
- Beurteilen Sie wie in Schritt 5.6 den Zustand der Faser und die elektrische Aktivität erneut, indem Sie die symmetrische Faserkontraktion als Reaktion auf die wechselnde Polarität beobachten. Schließen Sie Fasern, die nicht auf beide Stimulationen reagieren, aus dem Rest des Experiments aus.
- Bewegen Sie den MTS-5-TAMRA-Filterwürfel in den Lichtweg. Aktivieren Sie mit einem ferngesteuerten Lichtverschluss das 533-nm-Anregungslicht, um eine homogene MTS-5-TAMRA-Färbung auf den Fasern zu bestätigen.
HINWEIS: Bei der Färbung mit MTS-5-TAMRA reagieren sowohl gentechnisch hergestellte als auch endogene Cystone mit dem Maleimid-Derivat (Abbildung 5B). Daher ist es schwierig, die richtige Reaktion mit dem interessierenden Cystein zu bewerten. CaV1.1 wird hauptsächlich im transversalen Tubulus exprimiert und bildet ein unterscheidbares Doppelbandmuster. Mit einem konfokalen oder Epifluoreszenzmikroskop konnte ein x-y-Bild verwendet werden, um die korrekte Färbung und den Eintritt und die Diffusion des transversalen Tubulus von MTS-5-TAMRA zu bestätigen (Abbildung 5C).
6. Signalerfassung und -verarbeitung
Anmerkungen: Vor der Durchführung fluorometrischer Messungen muss die Signalerfassung sorgfältig geplant werden, um das optimale Signal-Rausch-Verhältnis zu erhalten. Langsamere Abtastraten ermöglichen eine bessere Lichtdetektion und reduzieren gleichzeitig die Anzahl der Punkte, die bei der Umlagerung der Proteinkonformation erfasst würden. Im Fall von EGFP-CaV1.1-cys tritt die durch eine Aktionspotentialwellenform induzierte Ladungsbewegung in ~1-10 msauf 37. Um mehrere Punkte zu erhalten, um die Entwicklung der Bewegung im Laufe der Zeit zu verfolgen, wurde die Erfassung auf 50 μs pro Punkt eingestellt.
- Platzieren Sie die Faser mit einem geeigneten Vergrößerungssystem in der Mitte des Sichtfelds. Für diese Experimente wurde ein invertiertes Objektiv mit 60-facher Ölöffnung und numerischer Apertur (NA) verwendet. Optimieren Sie die Beleuchtung und die Faserposition mit dem motorisierten Tisch und der Membran, um einen kreisförmigen Bereich mit dem Durchmesser der Faser zu beleuchten, in dem das EGFP-Signal maximal ist (Abbildung 4B).
- Sobald die Faser für die Aufnahme positioniert ist, richten Sie die beiden unabhängig voneinander montierten Platindrähte für die Feldstimulation an jedem Ende der Faser aus. Richten Sie die Drähte auf der Hauptachse der Fasern in einer geraden Linie aus und lassen Sie sie in einem Abstand von 5 mm zur Faser in der Mitte stehen (Abbildung 4B).
- Stellen Sie die Erfassungsanregungs- und Emissionsfilter auf die richtigen Einstellungen für MTS-5-TAMRA ein. Starten Sie das Experiment, indem Sie das in der Erfassungssoftware geschriebene Protokoll ausführen. Dieser Schritt löst alle nachgeschalteten Geräte aus (z. B. Protokolleditor, Lichtverschluss, Impulsgeber).
HINWEIS: Dieses Protokoll ermöglicht einen kurzen Zeitraum (d. h. 10 ms) der Baseline-Erfassung vor der Abgabe des Feldstimulus, um nachfolgende Messungen der Ruhefluoreszenz zu ermöglichen. - Initiieren Sie ein einzelnes oder eine Reihe von Aktionspotentialen mit einem Rechteckimpuls von 0,5 oder 1 ms und 20 V. Minimieren Sie die Gesamterfassungszeit so weit wie möglich, um ein Ausbleichen des Signals zu vermeiden.
HINWEIS: Selbst wenn die Aufnahme in der Mitte der Faser erfolgt, kann ein bewegungsbezogenes Fluoreszenzsignal auftreten, das aufgrund einer Protein-Fluorophor-Konformationsänderung mit dem Fluoreszenzsignal verwechselt werden kann (Abbildung 5D). Das kontraktionsinduzierte Signal sollte im Vergleich zur erwarteten Zeit der Ladungsbewegung nach der Stimulation verzögert sein37. - Um das Signal, das sich aus S4-Bewegungen ergibt, weiter von dem Signal zu unterscheiden, das auf die Faserkontraktion zurückzuführen ist, fügen Sie der Aufzeichnungslösung 1 μl 100 mM N-Benzyl-p-toluolsulfonamid (BTS; 50 μM Endkonzentration) hinzu, um kontraktile Reaktionen zu minimieren, und wiederholen Sie Schritt 6.4. Signale, die nach der pharmakologischen Immobilisierung der Faser ein zweites Mal detektiert wurden, entsprechen der molekularen Bewegung der markierten S4-Helix (Abbildung 5D).
HINWEIS: Nach der Bewegungsunterdrückung mit BTS sollte kein Signal in der Steuerung EGFP-CaV1.1 ohne künstliches Cystein erkannt werden. - Erfassen Sie mit den gleichen Einstellungen ein ähnliches Signal an einer Stelle innerhalb der Schale, an der keine Muskelfasern oder Ablagerungen vorhanden sind, um einen Wert der Hintergrundfluoreszenz zu erhalten.
- Importieren Sie die Dateien, die den zeitlichen Verlauf der Rohfluoreszenz [Fr(t)] aus der Faser- und Hintergrundfluoreszenz [Fb(t)] enthalten, in die Datenanalysesoftware. Mittelt die Spalte, die Fb(t) enthält, um einen homogenen Fb-Wert zu erhalten. Subtrahieren Sie Fb von Fr(t), um die absoluten Fluoreszenzwerte [F(t)] zu erhalten. Glätten Sie das resultierende Signal bei Bedarf mit einer Glättungsfunktion.
HINWEIS: Mit diesem Erkennungssystem und der Häufigkeit der Erfassung haben wir uns für eine benachbarte Mittelwertfunktion mit einem Fenster von 50 Punkten für die Glättung entschieden. - Mittelwert der F(t)-Ausgangswerte in einem Zeitintervall von 10 ms vor der Stimulation, um einen Ruhefluoreszenzwert (F0) zu erhalten. Subtrahieren Sie F0 vom geglätteten F(t), um die absolute Änderung der Fluoreszenz [ΔF(t)] zu erhalten. Um dann die Fluoreszenzänderung im Laufe der Zeit relativ zur Ruhefluoreszenz (ΔF/F0) auszudrücken, teilen Sie ΔF(t) durch F0.
- Um das Ausmaß der Signalbleichung zu bewerten, definieren Sie zwei Punkte aus dem ΔF/F0-Zeitsignal, vor und nach der Stimulation und weg vom fluorometrischen Signal. Passen Sie eine lineare Funktion an diese beiden Punkte an, um eine Basislinienspur zu erhalten. Subtrahieren Sie die Basislinie im Laufe der Zeit auf ΔF/F0, um das Ausbleichen des Signals zu korrigieren.
- Subtrahieren Sie von der Zeitspalte die Verzögerung zwischen der Erfassungsinitiierung und dem Rückkopplungssignal der Stimulation, so dass t = 0 dem Beginn des elektrischen Stimulus entspricht.
HINWEIS: Um mehrere Signalvergleiche zu ermöglichen, ist es häufig erforderlich, die Amplitude des Signals zu normalisieren. Je nach Zweck des Experiments können unterschiedliche Ansätze verwendet werden. Im folgenden Ergebnisabschnitt waren wir an der Signalkinetik interessiert, daher haben wir eine einfache Methode verwendet, die darin besteht, jedes Signal um den minimal erreichten Wert (d. h. den negativen Going Peak) zu normalisieren.
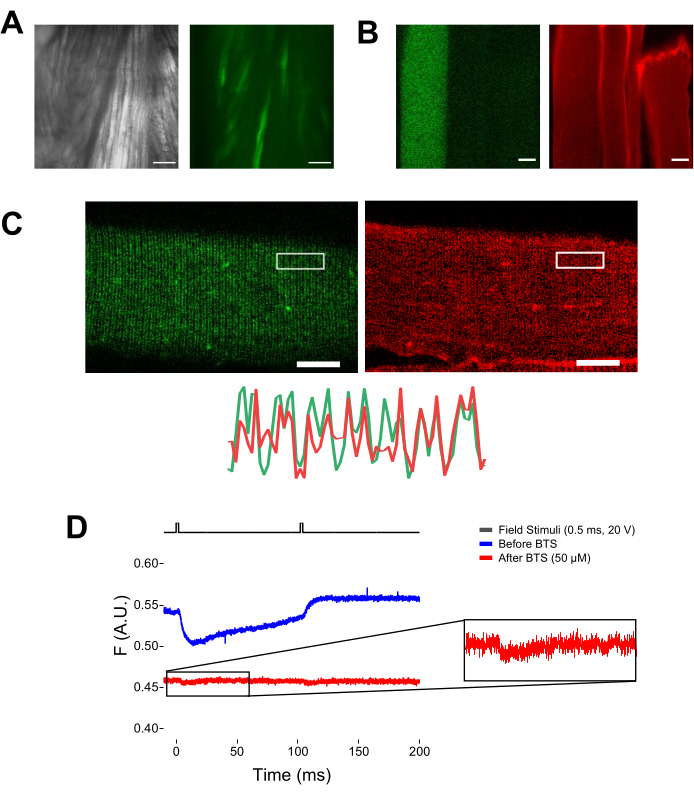
Abbildung 5: Bildgebung von Muskelfasern, die EGFP-CaV1.1-cys exprimieren, ohne und mit MTS-5-TAMRA-Färbung und repräsentativer roher fluorometrischer Aufzeichnung. (A) Beispiele für transmittierte (links) und fluoreszierende (rechts) Bilder des präparierten, nicht dissoziierten Muskels, die ein EGFP-CaV1.1 VSD-III-Konstrukt exprimieren. Maßstabsbalken: 100 μm. (B) Repräsentatives Bild einer Muskelfaser, die ein EGFP-CaV1.1 VSD-III-Konstrukt exprimiert, vor (links) und nach (rechts) MTS-5-TAMRA-Färbung. Endogene Cystone von nicht transfizierten Fasern werden ebenfalls durch den Farbstoff angefärbt. Maßstabsbalken: 30 μm. (C) Die konfokale Aufnahme eines EGFP-Ca V 1.1 VSD-III-Konstrukts (links) und der MTS-5-TAMRA-Färbung (rechts) zeigt ein klassisches Doppelbandmuster, dasfür die CaV1.1-Lokalisation auf dem transversalen Tubulussystem der Muskelfaser (unten) charakteristisch ist. Maßstabsbalken: 25 μm. (D) Repräsentative fluorometrische Aufzeichnung als Reaktion auf zwei Stimuli und gemessen mit einer Fotodiode vor (blaue Kurve) und nach (rote Kurve) Faserimmobilisierung mit N-Benzyl-p-toluolsulfonamid (BTS). Die obere schwarze Linie zeigt das Protokoll für die Faserdepolarisation durch externe Feldstimulation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Wenn sich ausbreitende Aktionspotentiale als Reaktion auf eine sich wiederholende Feldstimulation ausgelöst werden, ist es möglich, eine bestimmte Spannungssensorbewegung als Reaktion auf eine bestimmte Depolarisationsfrequenz zu verfolgen. Wie in Abbildung 6A gezeigt, kann die Bewegung von VSD-II-markierten Helices als Reaktion auf zwei aufeinanderfolgende Depolarisationen verfolgt werden, die bei 10 Hz (d. h. im Abstand von 100 ms) angewendet werden. Die Signalbleichung kann korrigiert w...
Diskussion
Hier wird ein Schritt-für-Schritt-Protokoll zur Durchführung von FSDF in Muskelfasern zur Untersuchung einzelner Spannungssensorbewegungen aus dem CaV1.1-Kanal beschrieben. Auch wenn die Anzahl der Schritte und die Vielfalt der Ansätze, die in dieser Technik kombiniert werden, komplex erscheinen mögen, werden die meisten dieser Techniken oft routinemäßig in Labors von Biophysikern/Zellbiologen eingesetzt. Die scheinbare Komplexität liegt also hauptsächlich in der Kombination all der verschiedenen Ansä...
Offenlegungen
Die Autoren berichten über keinen Interessenkonflikt.
Danksagungen
Wir danken Dr. J. Vergara (University of California, Los Angeles) für die Bereitstellung des EGFP-CaV1.1 (Kaninchen) Wildtyp-Plasmids. Wir danken dem Yale Department of Physiology Electronics Laboratory und insbesondere Henrik Abildgaard für das Design und den Bau der Fotodiode mit Track-and-Hold-Schaltung. Diese Arbeit wurde durch die Zuschüsse R01-AR075726 und R01-NS103777 der National Institutes of Health unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Referenzen
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten