Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İskelet Kas Uyarılabilirliğini Incelemek için Doğal Hücrelerde Fonksiyonel Bölgeye Yönelik Florometri
Bu Makalede
Özet
İşlevsel bölgeye yönelik florometri, protein alanı hareketlerini gerçek zamanlı olarak incelemek için kullanılan bir yöntemdir. Bu tekniğin doğal hücrelerde uygulanması için modifikasyonu, artık murin izole iskelet kası liflerindeki voltaj kapılı Ca2 + kanallarından tek voltaj sensörü hareketlerinin tespit edilmesine ve izlenmesine izin vermektedir.
Özet
İşlevsel bölgeye yönelik florometri, voltaj kapılı iyon kanalları da dahil olmak üzere çok sayıda membran proteininin yapı-fonksiyon ilişkisini araştırmak için tercih edilen teknik olmuştur. Bu yaklaşım öncelikle heterolog ekspresyon sistemlerinde, membran akımlarını, kanalların aktivitesinin elektriksel tezahürünü ve floresan ölçümlerini eşzamanlı olarak ölçmek ve yerel alan yeniden düzenlemelerini raporlamak için kullanılmıştır. İşlevsel sahaya yönelik florometri, elektrofizyoloji, moleküler biyoloji, kimya ve floresanı, sırasıyla floresan ve elektrofizyoloji yoluyla gerçek zamanlı yapısal yeniden düzenlemelerin ve fonksiyonların incelenmesine izin veren tek bir geniş kapsamlı teknikte birleştirir. Tipik olarak, bu yaklaşım, bir tiol-reaktif floresan boya ile test edilebilen bir sistein içeren mühendislik voltaj kapılı bir membran kanalı gerektirir. Yakın zamana kadar, proteinlerin bölgeye yönelik floresan etiketlemesi için kullanılan tiol-reaktif kimya, yalnızca Xenopus oositlerinde ve hücre hatlarında gerçekleştirildi ve birincil uyarılamayan hücrelere yaklaşımın kapsamını kısıtladı. Bu raporda, yetişkin iskelet kası hücrelerinde fonksiyonel bölgeye yönelik florometrinin, kas lifi elektriksel depolarizasyonunun kas kasılmasının aktivasyonu ile bağlantılı olduğu süreç olan uyarılma-kasılma eşleşmesinin erken adımlarını incelemek için uygulanabilirliği açıklanmaktadır. Bu protokol, in vivo elektroporasyon kullanarak yetişkin farelerin fleksör digitorum brevis'inin kas liflerine sistein mühendisliği ile tasarlanmış voltaj kapılı Ca2+ kanallarını (CaV1.1) tasarlamak ve transfekte etmek için metodolojileri ve fonksiyonel bölgeye yönelik florometri ölçümleri için gerekli sonraki adımları açıklamaktadır. Bu yaklaşım diğer iyon kanallarını ve proteinleri incelemek için uyarlanabilir. Memeli kasının fonksiyonel bölgeye yönelik florometrisinin kullanımı, uyarılabilirliğin temel mekanizmalarını incelemek için özellikle önemlidir.
Giriş
Canlı bir hücrede bilinen bir elektriksel uyarana yanıt olarak iyon kanalı konformasyonel yeniden düzenlemelerini izleme yeteneği, moleküler fizyoloji1 için değerli bir bilgi kaynağıdır. Voltaj kapılı iyon kanalları, transmembran voltajındaki değişiklikleri algılayan membran proteinleridir ve işlevleri voltaj değişimlerinden de etkilenir2. Geçen yüzyılda voltaj kelepçesi tekniklerinin geliştirilmesi, fizyologların membran depolarizasyonuna yanıt olarak voltaj kapılı iyon kanalları tarafından taşınan iyonik akımları gerçek zamanlı olarak incelemelerine izin verdi3. Voltaj kelepçesi teknolojisinin kullanımı, nöronlar ve kas gibi uyarılabilir hücrelerin elektriksel özelliklerini anlamada çok önemli olmuştur. 1970'lerde, voltaj kelepçesi arıtılması, voltaj kapılı kalsiyum (Ca V) ve sodyum (NaV) kanallarındaki geçit akımlarının (veya şarj hareketinin) algılanmasına izin verdi 4,5. Geçit akımları, hücre zarı6 boyunca elektrik alanındaki değişikliklere yanıt olarak voltaj sensörlerinin hareketinden kaynaklanan doğrusal olmayan kapasitif akımlardır. Geçit akımları, iyon kanalı açılışından önce veya ona eşlik eden moleküler yeniden düzenlemelerin elektriksel bir tezahürü olarak kabul edilir7. Bu akım ölçümleri kanalın işlevi hakkında değerli bilgiler sağlarken, hem iyonik akımlar hem de geçit akımları, voltaj kapılıkanalların 7 moleküller arası ve moleküller arası konformasyonel yeniden düzenlemelerinin dolaylı okumalarıdır.
İşlevsel bölgeye yönelik florometri (FSDF; voltaj kelepçeli florometri, VCF olarak da adlandırılır) 1990'ların başında geliştirilmiştir8 ve ilk kez, yerel konformasyonel değişiklikleri ve bir kanal proteininin işlevini gerçek zamanlı olarak doğrudan görüntüleme yeteneği sağlamıştır. Kanal mutajenezisi, elektrofizyoloji ve heterolog ekspresyon sistemlerinin bir kombinasyonunu kullanarak, aktive edici uyaran 9,10'a yanıt olarak spesifik kanalların veya reseptörlerin hareketli kısımlarını floresan olarak etiketlemek ve izlemek mümkündür. Bu yaklaşım, 8,10,11,12,13,14,15,16,17,18,19 gerilim kapılıiyon kanallarındaki voltaj algılama mekanizmalarını incelemek için yaygın olarak kullanılmıştır. Yetkili incelemeler için bkz: 10,20,21,22,23.
Elektrik sinyallerinin başlatılması ve yayılması için kritik öneme sahip olan Ca V ve NaV kanalları, merkezi bir gözenek ve dört özdeş olmayan voltaj algılama alanına sahip bir ana α1 alt biriminden oluşur2. Farklı birincil yapılarına ek olarak, Ca V ve NaV kanalları, yardımcı alt birimleri24 olan çok alt birim kompleksleri olarak ifade edilir. Gerilime bağlı potasyum kanalları (K V), Na V veya CaV25'in tek bir alanına benzeyen dört alt birimden oluşur. Ca V ve NaV kanallarının gözenek oluşturan ve gerilim algılayan α1 alt birimi, altı benzersiz transmembran segmentinin dört ayrı alanı için tek bir polipeptit kodlaması ile oluşturulur (S1-S6; Şekil 1A) 24,26. S1 ila S4 transmembran segmentlerinden oluşan bölge voltaj algılama alanını (VSD) ve S5 ve S6 transmembran segmentleri gözenek alanı26'yı oluşturur. Her VSD'de, S4 α-sarmalı, membran depolarizasyonuna yanıt olarak hareket eden pozitif yüklü arginin veya lizin içerir (Şekil 1A, B)7. Birkaç on yıllık araştırma ve çok çeşitli deneysel yaklaşımlardan elde edilen sonuçlar, S4 segmentlerinin membran depolarizasyonuna yanıt olarak geçit akımları üreterek dışa doğru hareket ettiği öncülünü desteklemektedir6.
FSDF, bir iyon kanalı veya başka bir protein üzerindeki belirli bir sistein kalıntısına (yani, S4 α-sarmal) konjuge edilmiş bir tiyol-reaktif boyanın floresan değişikliklerini ölçer, çünkü kanal membran depolarizasyonuna veya diğer uyaranlara yanıt olarak işlev görür10. Aslında, FSDF başlangıçta kanalın ana voltaj sensörü olarak önerilen KV kanallarındaki S4 segmentinin, geçit yükleri membran potansiyeli 8,10'daki değişikliklere yanıt olarak hareket ettiğinde hareket edip etmediğini araştırmak için geliştirilmiştir. Gerilim kapılı iyon kanalları durumunda, FSDF, kanal fonksiyonu ölçümleriyle eşzamanlı olarak dört VSD'nin bağımsız konformasyonel yeniden düzenlemelerini (herhangi bir zamanda bir VSD'yi izleme) çözebilir. Gerçekten de, bu yaklaşımı kullanarak, bireysel VSD'lerin kanal aktivasyonu ve inaktivasyonunun belirli yönleriyle farklı şekilde ilişkili olduğu gösterilmiştir 12,27,28,29,30. Her VSD'nin kanalların işlevine katkısını belirlemek yüksek önem taşır ve kanal çalışmasını daha fazla aydınlatmak ve potansiyel olarak ilaç geliştirme için yeni hedefler belirlemek için kullanılabilir.
FSDF'nin heterolog ekspresyon sistemlerinde kullanılması, kanal fonksiyonunu indirgemeci bir perspektiften anlamamızı geliştirmede son derece yardımcı olmuştur10,23. Birçok indirgemeci yaklaşım gibi, avantajlar sunar ancak aynı zamanda sınırlamaları da vardır. Örneğin, önemli bir sınırlama, heterolog sistemdeki kanal nano ortamının kısmi olarak yeniden yapılandırılmasıdır. Çoğu zaman, iyon kanalları çok sayıda aksesuar alt birimi ve işlevlerini değiştiren çok sayıda başka protein ile etkileşime girer31. Prensip olarak, farklı kanallar ve bunların aksesuar alt birimleri, çoklu protein kodlama yapıları veya polisistronik plazmidler kullanılarak heterolog sistemlerde ifade edilebilir, ancak doğal ortamları tam olarak yeniden oluşturulamaz30,32.
Grubumuz yakın zamanda, kas lifi elektriksel depolarizasyonunun kas kasılmasının aktivasyonu ile bağlantılı olduğu süreç olan uyarma-kasılma eşleşmesinin (ECC) 33,34 erken adımlarının incelenmesi için doğal ayrışmış iskelet kası liflerinde FSDF'nin bir varyantını yayınladı 35,36. İlk kez, bu yaklaşım, yetişkin bir farklılaştırılmış kas lifi37'nin doğal ortamında voltaj kapılı L tipi Ca2 + kanalından (CaV1.1, DHPR olarak da bilinir) bireysel S4 voltaj sensörlerinin hareket takibine izin verdi. Bu, hızlı stimülasyona bağlı kendi kendine yayılan depolarizasyona izin veren hücrenin elektriksel aktivitesi, in vivo elektroporasyon yoluyla cDNA plazmidini eksprese etme yeteneği, hücre içindeki kanalların doğal yüksek ekspresyonu ve bölmeli organizasyonu ve yüksek hızlı görüntüleme ve elektrofizyolojik kayıt cihazlarıyla uyumluluğu dahil olmak üzere bu hücre tipinin çoklu özellikleri göz önünde bulundurularak gerçekleştirildi. Daha önce, algılama cihazı olarak yüksek hızlı bir çizgi taramalı konfokal mikroskop kullandık37. Şimdi, tekniğin bir varyasyonu, sinyal alımı için bir fotodiyot kullanılarak sunulmaktadır. Bu fotodiyot tabanlı algılama sistemi, bu tekniğin diğer laboratuvarlarda uygulanmasını kolaylaştırabilir.
Burada, CaV1.1'den bireysel voltaj sensörü hareketinin incelenmesi için doğal hücrelerde FSDF'yi kullanmak için adım adım bir protokol açıklanmaktadır. CaV1.1 kanalı bu makale boyunca örnek olarak kullanılmış olsa da, bu teknik diğer iyon kanallarının, reseptörlerin veya yüzey proteinlerinin hücre dışı erişilebilir alanlarına uygulanabilir.
Protokol
Bu protokol Maryland Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. Aşağıdaki protokol, (1) moleküler yapı tasarımı ve sistein reaksiyona giren boya seçimi, (2) in vivo elektroporasyon, (3) kas diseksiyonu ve lif izolasyonu, (4) edinim kurulum tanımı, (5) gelişmiş yeşil floresan protein (EGFP) pozitif lif elektriksel aktivitesi ve sistein boyamasının değerlendirilmesi ve (6) sinyal edinimi ve işlenmesinden oluşan çoklu alt bölümlere ayrılmıştır. Ek olarak, her bölümün başında, FSDF'yi bir iskelet kası lifine uygularken bazı ilgili hususlar detaylandırılmıştır. Tüm protokol bölümleri, laboratuvar önlüğü ve eldivenleri de dahil olmak üzere uygun kişisel koruyucu ekipmanlarla yapılmalıdır.
1. Moleküler yapı tasarımı ve sistein reaksiyona giren boya seçimi
- Yapı tasarımı, deneyin başarısının kritik bir parçasıdır. İlk olarak, vahşi tipte, floresan olarak etiketlenmiş bir CaV1.1 cDNA yapısı oluşturun ve ekspresyonunu uygun hücre tipinde değerlendirin. Kas lifleri için, bir sitomegalovirüs (CMV) promotörü taşıyan bir plazmid kullanılarak güçlü bir transfeksiyon etkinliği elde edilebilir. Bu protokolde, zaten karakterize edilmiş bir tavşan EGFP-CaV1.1 plazmidi38 kullanılmıştır.
NOT: cDNA yapısını, voltaj kapılı bir iyon kanalına bir sistein kalıntısı sokacak şekilde tasarlarken, sistein pozisyonu kritiktir ve dikkatlice düşünülmelidir. Sistein, tiol-konjuge boya reaksiyonuna izin vermek için hücre dışı boşluktan erişilebilir olmalıdır (Şekil 1C, D) ve depolarizasyona yanıt olarak hareketini tam olarak izlemek için S4 bölgesine proksimal olmalıdır. Bununla birlikte, protein hareketine yanıt olarak boya floresansının söndürülmesine izin vermek için, tanıtılan sistein konjuge florofor, iki farklı ortamın (örneğin, membran ve hücre dışı sıvı; Şekil 1E). Ek olarak, yerleştirilen sisteinin protein fonksiyonuna müdahale etmemesini sağlamak çok önemlidir. - Uygun sistein lokalizasyonu hakkında bir fikir edinmek için, kanal yapısı hakkında veya diğer ilgili kanal proteinlerinin diğer florometri deneylerinden bilgi toplayın. Sistein mühendisliği Ca V 1.1 yapılarının tasarımı için, kanal26'nın çözülmüş kriyo-elektron mikroskobu (kriyo-EM) yapısını değerlendirin ve önceki çalışmaların sistein yerleştirmesini CaV1.2 12 gibi ilgili kanallardan veya Shaker11 ve NaChBac39 gibi diğer kanallardan karşılaştırın.
- Uygun sistein pozisyonu seçildikten sonra, sistein ikamelerini tanıtmak için ticari bölgeye yönelik bir mutajenez kiti kullanın. Bu protokolde, aşağıdaki sistein modifikasyonları, CaV1.1'in S4 voltaj algılama segmentinin her bir sitozolik ucunda bağımsız olarak tasarlanmıştır: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) ve UniProtKB: P07293 (Şekil 1B).
- İskelet kası lifleri için, yüzey zarının invaginasyonu ve CaV1.1 kanallarının baskın konumu olan enine tübül membran sistemine uygun ve hızlı difüzyon sergileyen 5-karboksitetrametilrhodamin metanetiyosülfonat (MTS-5-TAMRA) kullanın. MTS-5-TAPRA, lipit membrandan sulu bir ortama geçerken floresanda bir azalma gösterir (Şekil 1E).
NOT: Dylight veya Alexa-maleimid türevleri yüzey zarını boyar, ancak enine tübül sistemini boyamaz.
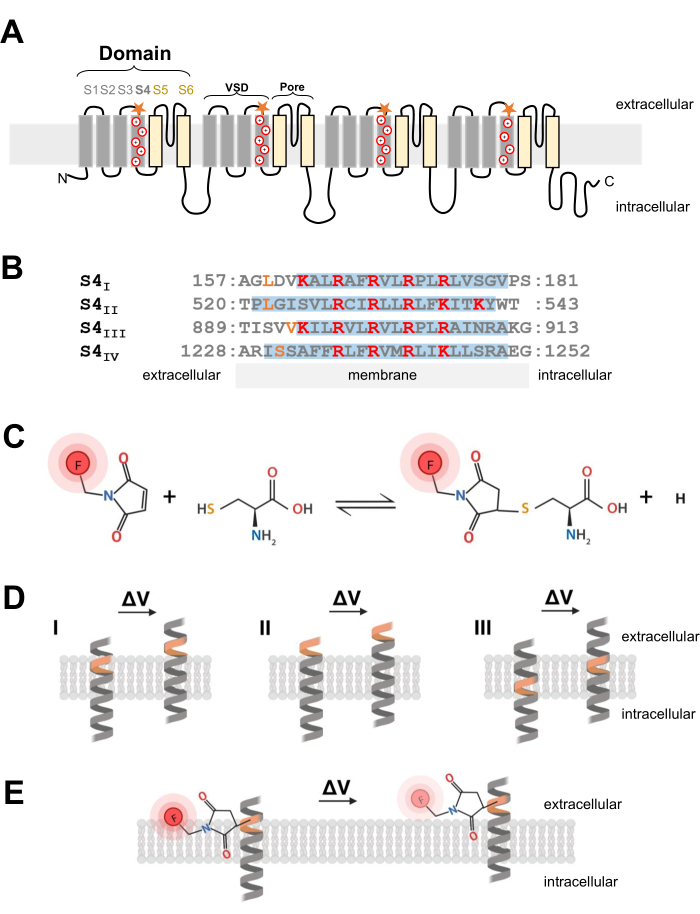
Resim 1: Bir transmembran α-sarmalın arayüzünde tiol-sistein reaksiyonunun şeması. (A) L-tipi CaV 1.1 membran topolojisi. Artı işaretleri, S4 α-sarmalındaki temel kalıntıları temsil eder ve turuncu yıldızlar, sisteinin bölgeye yönelik mutajenez yoluyla verildiği yeri gösterir. (B) Tavşan CaV1.1'in S4I'den S4IV'e dizi hizalaması (UniProtKB: P07293). Voltaj algılaması için kritik olan pozitif yüklü arginin ve lizin kalıntıları kırmızı renkle vurgulanırken, mühendislik sistein ikameleri turuncu renkle gösterilir. Bu panelreferans 37'den uyarlanmıştır. (C) Sistein-tiol floresan molekülü reaksiyonu. (D) Transmembran gerilime duyarlı α-sarmal içine sistein mutagenez yerleştirmesini gösteren diyagram. Sistein istirahatte membrana gömülmeli ve depolarizasyondan sonra hücre dışı olarak erişilebilir olmalıdır (ΔV; I). Sistein izlemesinin tipik olarak, hedef sistein depolarizasyondan önce hücre dışı boşluktan (II) erişilebiliyorsa veya depolarizasyondan sonra sistein hücre dışı boşluktan erişilemiyorsa (III) ortaya çıkması olası değildir. (E) Tiol floresan molekülü ile reaksiyondan sonra, depolarizasyona yanıt olarak α-sarmal hareketi MTS-5-TAMRA floresan emisyonunu azaltır. Florometrik sinyal, S4 sarmalının hareketi ve ardından membranın düzlemine ve sulu ortama göre boya hareketi ile üretilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. İn vivo elektroporasyon
NOT: Elektroporasyon deneyleri, daha önce tarif edildiği gibi38 modifikasyonla gerçekleştirilmiştir. Aşağıdaki bölümde, protokol farenin bir ayak pedinin elektroporasyonu için tasarlanmıştır. Her iki pençe de hazırlanmışsa hacimlerin ayarlanması gerekir.
- Aliquot 25-100 μL plazmid çözeltisi, buz üzerine yerleştirilmiş 1.5 mL'lik bir tüp içinde 2-5 μg / μL'de.
- Steril salin içinde 0,5 mL'lik bir 2 mg/mL hyaluronidaz çözeltisi hazırlayın ve çözeltiyi 1 mL'lik bir şırıngaya monte edilmiş düşük bağlayıcı protein 0,2 μm steril filtreden geçirin. Oda sıcaklığında 1,5 mL'lik bir tüpte saklayın.
- Kalibre edilmiş bir anestezi aparatı kullanarak, fareyi anestezi odasına yerleştirerekO2'de (1 L / dak) % 3 -% 4.5 izofluran kullanarak bir fareyi uyuşturun. Bir çift cımbız kullanarak kuyruğun ucunu sıkıştırarak hayvanın yeterli anestezisini onaylayın. Optimal anesteziye ulaşıldığında reaksiyon gözlenmemelidir.
- Fareyi anestezi odasından çıkarın ve farenin üzerine bir anestezi burun maskesi yerleştirin. Hayvanı sırt üstü steril bir tezgah pedi ile kaplı izotermal bir ısıtma yastığına yerleştirin. O2'de (1 L / dak) % 3 izofluran içeren kemirgen maskesini kullanarak anesteziye devam edin.
- İşlem sırasında göz kuruluğunu önlemek için, steril bir pamuk ucu ile hayvanın gözlerine ince bir yapay gözyaşı kremi tabakası uygulayın. Etil alkole doymuş steril bir mendil kullanarak hayvanın pençesini dezenfekte edin.
- Uzun 29 G steril insülin iğnesinde 0.5 kullanarak, 20 μL hyaluronidaz çözeltisini aspire edin. Cilde topuk hizasında nüfuz edin ve iğneyi deri altından ayak parmaklarının tabanına doğru kaydırın (Şekil 2A). İğneyi kademeli olarak geriye doğru hareket ettirirken çözeltiyi yavaşça enjekte edin. Pençenin altında bir bolus veya yumru gözlenmelidir (Şekil 2B).
NOT: Hayvanın yaşına ve pençenin büyüklüğüne bağlı olarak, tam miktarda çözeltinin enjekte edilmemesi muhtemeldir. Çoğu zaman, enjeksiyon noktasından küçük bir sızıntı meydana gelebilir. - İsterseniz, adım 2.5'te olduğu gibi, uygun pençe dezenfeksiyonundan sonra başka bir steril iğne kullanarak, adım 2.6'yı diğer pençe ile tekrarlayın.
- Hayvanı burun maskesinden çıkararak anestezinin bağlantısını kesin ve fareyi yiyecek ve suya ad libituma erişerek kafese geri getirin. Anesteziden tam iyileşme ~ 5 dakika içinde gözlenmelidir. Plazmid çözeltisini içeren tüpü, oda sıcaklığına ulaşmasını sağlamak için tezgahın üzerine yerleştirin.
- 1 saat sonra, hayvanı ikinci kez uyuşturun, ısıtma yastığına yerleştirin ve pençeyi 2.3-2.5 adımlarında açıklandığı gibi dezenfekte edin.
- Adım 2.6'da açıklanan tekniği kullanarak cDNA yapısının 10-20 μL'sini enjekte edin. Enjekte edilen toplam yapı miktarı pençe başına 50-100 μg'dir. İstenirse, başka bir steril şırınga kullanarak prosedürü kontralateral pençe ile tekrarlayın.
- cDNA çözeltisinin doku boyunca eşit şekilde dağılmasını sağlamak için hayvanı izotermal ısıtma yastığı üzerinde 5 dakika boyunca anestezi altında tutun.
- Elektroporasyon aparatı cihazını açın ve üretici tarafından önerildiği gibi çift elektrot dizisine bağlayın.
- Çift elektrot dizisini etil alkole doymuş bir mendil kullanarak dezenfekte edin. Pençeyi bir elinizle stabilize edin ve önce topuğun arkasındaki cildin altına bir elektrot yerleştirin. Ardından, ikinci elektrodu ayak parmaklarının tabanına yerleştirin ve her iki elektrotun oryantasyonlarının ayağın eksenine dik olmasını sağlayın (Şekil 2C). Probu ayağı veya bacağı aşırı açısal yönde kısıtlamayan bir konuma getirin.
NOT: Elektrot yerleştirme, cımbız kullanımı ve elektrotların uçlarının düzenli olarak keskinleştirilmesiyle kolaylaştırılabilir. Hayvanın yaşına bağlı olarak, pençenin boyutu değişebilir ve elektrot aralığı buna göre uyarlanmalıdır. - 1 Hz'de her biri 20 ms süreli/20 ms olmak üzere 20 darbe uygulayarak kasları elektroporate edin. 1 cm aralıklı elektrot iğneleri için, voltajı ~ 100 V'a ayarlayın. Bu, elektrot aralığı ~ 100 V / cm'ye ulaşacak şekilde değiştirilirse uyarlanmalıdır. Elektrotlar uygun şekilde yerleştirilmişse, darbe iletimi sırasında basamakların hafif fleksiyonu gözlenmelidir.
- İsterseniz 2.13 ve 2.14 adımlarını kontralateral pençe ile tekrarlayın.
- Anestezinin bağlantısını kesin ve hayvanı, elektroporate olmayan karşı arkadaşından izole edilmiş bir kafese 2 saat boyunca yiyecek ve su erişimi ad libitum ile yerleştirin. Anesteziden tam iyileşme ~ 10 dakika içinde gözlemlenmelidir. Hayvanı tekrar kafesin içine yerleştirin.
NOT: cDNA yapılarının ekspresyonu, kodlanan proteine büyük ölçüde bağlıdır. Protein döngüsü, cDNA'nın miktarı ve kalitesi, plazmid promotörü ve diğer değişkenler yapı ekspresyonunu etkileyebilir. Bu deneyde, CaV1.1'in α1S alt biriminin bir CMV promotörü ile optimal ekspresyonu 4 ila 6 hafta gerektirir, ancak 2 haftadan 12-15 aya kadar tespit edilebilir.
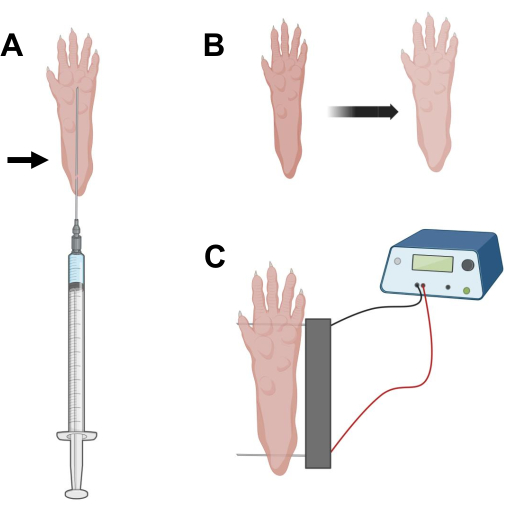
Şekil 2: Elektroporasyon için bir fare ayak pedi içinde cDNA enjeksiyonu ve elektroporasyon elektroporasyon elektrodu konumlandırma diyagramı. (A) Bir fare ayak pedi altında hyaluronidaz ve cDNA enjeksiyonu için iğne pozisyonu. Ok, deriden yerleştirme noktasını gösterir. (B) Enjeksiyondan sonra deride hafif renk değişikliği ve pençe boyutunda hafif artış geçici olarak gözlenmelidir. (C) Elektroporasyon için elektrot dizisi konumlandırması. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Kas diseksiyonu ve lif izolasyonu
NOT: İskelet kası lifi dissosiyasyonu daha önce tarif edildiği gibi 37,40,41 modifikasyonlarla gerçekleştirilmiştir. Aşağıdaki bölümde, protokol farenin iki ayak pedi için uygundur.
- Lif ayrışmasından önce, ~5 mm kalınlığa ulaşmak için 60 mm'lik plastik bir Petri kabındaki 10 parça elastomere (% w / w) bir parça kürleme maddesi ekleyerek sylgard kaplı plakayı hazırlayın. Elastomer kaplı plakanın kullanımdan önce gece boyunca kürlenmesine izin verin. Bu, uygun şekilde saklanırsa ve kullanımdan önce ve sonra% 70 etil alkol ile dezenfekte edilirse birçok kez tekrar kullanılabilir.
- % 10 fetal sığır serumu (FBS; 2 mg / mL'lik nihai konsantrasyon) ile desteklenmiş 2 mL eğirici minimum esansiyel kartal ortamında (S-MEM) 4 mg kollajenaz tip I hazırlayın. Çözeltiyi 35 mm kaplamasız bir plastik plakaya aktarın ve kabı 37 ° C,% 5 CO2'de bir inkübatöre yerleştirin.
NOT: S-MEM, glutamin ve Ca2+ içermeyen modifiye edilmiş bir MEM formülasyonudur. Bu adımdaCa2 + yokluğu, enzimatik sindirim ve tritürasyon sırasında lif kontraktürünü azaltır. - 60 mm kaplamasız plastik plakaya %10 FBS ile takviye edilmiş 5 mL S-MEM ekleyin ve inkübatörde 37 °C, %5 CO2'de saklayın.
- Hayvanları CO2 yoluyla boğulma ve ardından servikal çıkık ile ötenazi yapın. Birincil hücre izolasyonu sırasında kontaminasyonu azaltmak için, hayvan karkasını ~ 10 s boyunca% 70 etil alkole batırın. Karkası emici kağıtla çıkarın ve kurutun ve ayakları ayak bileği ile diz arasında bir çift makasla kesin (Şekil 3A).
- Hayvanın bir ayağını, pençe yukarı bakacak şekilde, elastomer kaplı plaka üzerindeki diseksiyon pimleri ile 10x büyütmede bir diseksiyon mikroskobu altında sabitleyin.
- Diseksiyon makası ve ince cımbızla, fleksör digitorum brevis (FDB) kasını açığa çıkarmak için cildi pençeden çıkarın (Şekil 3B). Doku kuruluğunu önlemek için, 1.000 μL pipet kullanarak kaslara bir damla S-MEM %10 FBS ekleyin.
- Topuk seviyesinde, tendonu kesin ve FDB kasını topuktan ayak parmağına dikkatlice diseke edin (Şekil 3B). Diseksiyonu yaparken kas üzerindeki gerginlikten mümkün olduğunca kaçının. Dokulara uygulanan çok fazla kuvvet kas lifi hasarına neden olur. Kasları hemen kollajenaz çözeltisine yerleştirin.
- 3.5-3.7 arasındaki adımları kontralateral ayakla tekrarlayın. Disseke edilmiş kası kollajenaz çözeltisine 37 ° C,% 5 CO 2 inkübatörde2 saat 45 dakika ila 3 saat 15 dakika boyunca yerleştirin. Kollajenaz enzimatik aktivitesine ve hayvanın yaşına bağlı olarak kuluçka süresini uyarlayın.
- Kas dokusu inkübe edilirken, 35 mm'lik cam tabanlı bir kabın ortasına serum veya antibiyotik olmadan 300 μL soğuk MEM ekleyin. Doğrudan MEM'e 1.20 mg / mL'de 2 μL soğuk laminin ekleyin. İstediğiniz yemek sayısı için işlemi tekrarlayın. Laminin polimerizasyonuna izin vermek için bulaşıkları hücre kültürü inkübatörüne 37 ° C,% 5 CO2'de en az 1 saat boyunca yerleştirin.
- Enzimatik sindirim tamamlandığında, büyük delikli (5 mm) ateşle cilalanmış cam Pasteur pipet ve lateks ampul kullanarak kasları S-MEM% 10 FBS içeren 60 mm'lik hücre kültürü kabına aktarın.
- Daha küçük delikli (2 mm) ateşle cilalanmış cam Pasteur pipet ve lateks ampul kullanarak, diseksiyon mikroskobu altında kası nazikçe tritüre edin (Şekil 3C). Ayrışmış kas lifleri dokudan ayrılmaya başlamalı ve çözelti içinde salınmalıdır.
NOT: Genel bir kural olarak, çok fazla uzamış tritürasyon lifleri strese sokabileceğinden ve hatta zarar verebileceğinden, daha az tritürasyon (15-30 pipet pasajı) her zaman tercih edilir. - Bir çift ince cımbız kullanarak, sinirler, tendonlar veya kan damarları gibi kas dışı dokuları çıkarın (Şekil 3D).
- Her 35 mm laminin kaplı cam taban kabına 2 mL sıcak MEM% 2 FBS ekleyin. 200 μL pipet ve steril plastik pipet ucu kullanarak, ayrışmış kas liflerini 35 mm laminin kaplı cam taban kabına aktarın (Şekil 3E).
NOT: Düşük lif yoğunluğunun elde edilmesi ve liflerin birbirlerinden iyi ayrılmasına izin verilmesi, lifin üst üste binmesini önlemek için önemlidir. - 35 mm'lik cam tabanlı kabı inkübatöre 37 °C, %5 CO2'de yerleştirin. Lifler 2-20 saatlik bir zaman diliminde kullanılabilir.
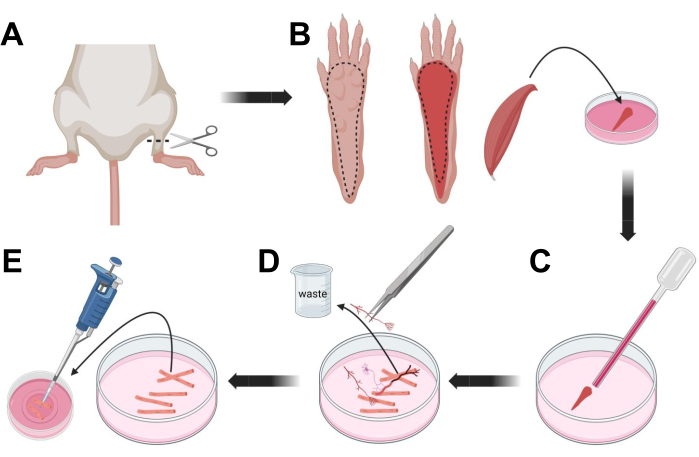
Şekil 3; Kas FDB lif diseksiyonu ve dissosiyasyonu. (A) Ayak bileği artikülasyonunun (kesikli çizgi) üzerindeki ayak diseksiyonundan sonra, FDB kasını (B) açığa çıkarmak için kesikli çizgiyi takip ederek ayak pençesinin altındaki deri çıkarılır. Kas diseke edilir ve kollajenaz çözeltisine yerleştirilir. (C) İnkübasyondan sonra, kas, bireysel kas liflerini ayrıştırmak ve elde etmek için tritüe edilir. (D) Kas liflerini laminin kaplı cam tabanlı kültür kabına aktarmadan önce kas dokusunu ve kalıntıları çıkarmak için ince cımbız kullanılır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. Edinme kurulum açıklaması
NOT: Satın alma kurulumu,42'den önce değişikliklerle açıklananlarla karşılaştırılabilir (Şekil 4A).
- Tüm bileşenleri açın: bilgisayar, AD / DA dönüştürücü ve yol kelepçesi amplifikatörü, mikroskop, motorlu aşama, manipülatör (ler), fotodiyot için güç kaynağı, ışık kaynağı, ışık deklanşörü, darbe jeneratörü ve protokol editörü.
- Darbe üretecini, ışık deklanşörünü ve protokol düzenleyicisini kontrol etmek için AD/DA'dan ÇIKIŞ sinyalini tetikleyen transistör-transistör mantığını (TTL) etkinleştirin.
- Darbe üretecinden gelen TTL çıkış sinyalini kullanın ve hassas zamansal tetiklemeyi doğrulamak için amplifikatörün bir AD kanalına bağlanın. Yeterli cihaz senkronizasyonunu sağlamak için tetikleyici tutarlılığın yeterli kontrolü, deneyden önce dikkatlice değerlendirilmelidir.
NOT: CaV1.1 durumunda, stimülasyondan sonra 4-10 ms'den daha kısa bir sürede maksimum sinyal görmeyi bekleyin (maksimum yük hareketigeliştirme zamanı 5). Sinyal hızlı ve hassastır Zamansal çözünürlük, kalsiyum geçici veya voltaj kelepçesi ile ölçülen şarj hareketi gibi diğer ölçümlerle karşılaştırmak için kritik öneme sahiptir. - Uyarma ışığını fiberin belirli bir alanına veya noktasına odaklamak için (Şekil 4B), uyarma ışığı yoluna yerleştirilmiş bir diyafram kullanın. Bu, yalnızca EGFP-CaV1.1 sinyalinin maksimum olduğu bir alanda sinyal alımını mümkün kılar (Şekil 4B).
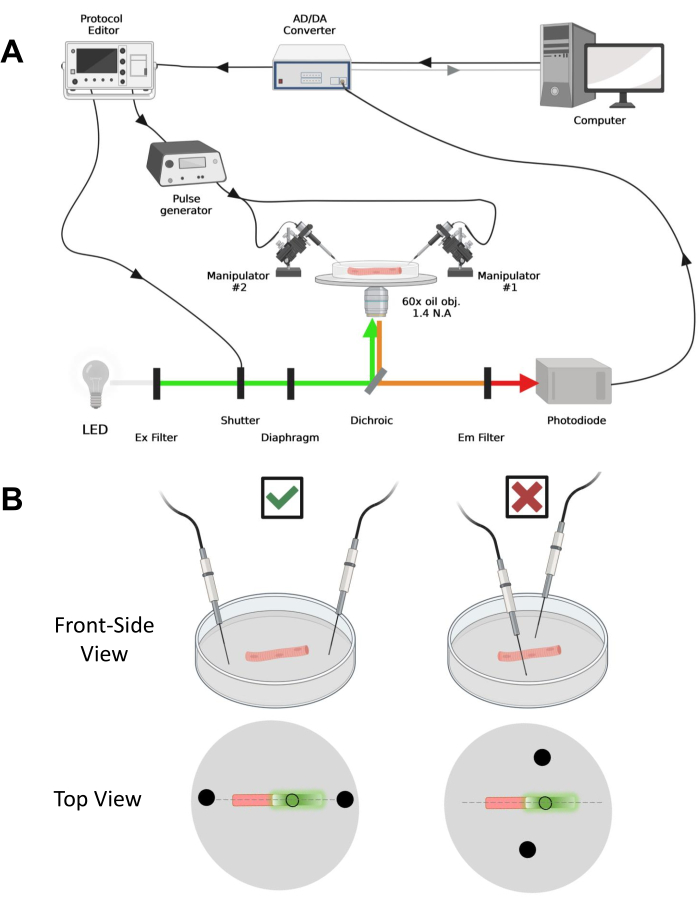
Şekil 4: Kayıt sisteminin tanımı . (A) Kayıt sisteminin farklı bileşenleri arasındaki bağlantıyı gösteren diyagram. Kurulum, motorlu bir aşamaya sahip ters çevrilmiş bir mikroskop, bir ışık yayan diyot (LED) ışık kaynağı, bir ışık deklanşörü, bir izleme ve tutma fonksiyonu43 ile özel yapım bir fotodiyot tabanlı ışık izleme devresi, bir AD / DA dönüştürücü (bir yama kelepçesi amplifikatöründen), bir analog darbe jeneratörü, alan stimülasyon elektrotlarına bağlı bir dış alan stimülasyon ünitesi, motorlu manipülatörler ve protokollerin edinilmesi, senkronizasyonu ve oluşturulması için ticari yazılımlar. Alan stimülasyonu elektrodu, bir BMC konektörü aracılığıyla darbe jeneratörüne bağlı bakır kablolara kaynaklanmış iki platin telden yapılmıştır. Hem EGFP hem de MTS-5-TAMRA sinyallerini algılamak için özel uyarma ve emisyon filtreleri kullanılır. EGFP'yi uyarmak için, 488 nm (± 20 nm) uyarma (Ex) filtreli ve LP510 nm Em filtreli bir ksenon lamba kullanılır. MTS-5-TAMRA için 530 nm LED ışık kaynağı ve LP550 nm Em filtre kullanılır. (B) Bir EGFP-CaV1.1-cys yapısını ifade eden bir elyafın, liflerin ana ekseninde (kesikli çizgi) düzgün (solda) ve yanlış (sağda) yönlendirilmiş iki alanlı stimülasyon elektrotları (siyah daireler) ile görünümü. Siyah doldurulmamış daire, ışık kaynağının önüne yerleştirilen diyafram açıklığı tarafından kontrol edilen bir çapa sahip edinim alanını temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
5. EGFP-pozitif lif elektriksel aktivitesinin ve sistein boyamasının değerlendirilmesi
NOT: İskelet kası lifi alan stimülasyonu,41'den önce tarif edildiği gibi modifikasyonlarla gerçekleştirilir. Bu yaklaşım, (1) sağlıklı, işlevsel ve elektriksel olarak duyarlı lifleri tanımlamak, (2) lifleri sistein-reaktif floresan boya ile boyamak ve (3) yayılan aksiyon potansiyeline yanıt olarak floresan sinyalini kaydetmek için kullanılır. Bu bölümün her adımı ve sonraki, floresan boya ağartmasını azaltmak için düşük ışıklı bir ortamda gerçekleştirilmelidir.
- Ayrışmış kas lifleri içeren 35 mm'lik cam tabanlı kabı mikroskop sahnesine yerleştirin. Kültür ortamını 1.000 μL'lik bir pipetle dikkatlice çıkarın ve 2 mL oda sıcaklığında Ringer çözeltisi ile değiştirin (kompozisyon için Tablo 1'e bakın). Serbest sistein içeren orijinal hücre kültürü ortamını tamamen çıkarmak için birden fazla ortam değiştirme turu gerekebilir.
- Mekanik veya motorlu bir manipülatör kullanarak, iki platin teli çanağın dibine dik olarak yerleştirin. Elektrot terminallerinin fiberin uzunlamasına eksenine göre ve fiberin uçlarından birkaç milimetre uzakta hizalandığından ve elektrotlar arasındaki ayrımın 5 mm olduğundan emin olun (Şekil 4B). Çanağı döndürerek veya her elektrodu bağımsız bir mikromanipülatöre monte ederek elektrot konumlandırmasını daha da ayarlayın (Şekil 4B).
- İletilen ışığı açın ve 20x'lik bir hedef kullanarak görüş alanındaki lifleri bulun. EGFP filtre küpünü ışık yoluna taşıyın.
NOT: Epifloresan ve düşük büyütmeli (2x) objektif ile donatılmış bir mikroskop kullanarak, EGFP ekspresyonunu değerlendirerek lif ayrışmasından önce tüm kastaki yapı transfeksiyon etkinliğini değerlendirmek mümkündür (Şekil 5A). - Uzaktan kumandalı bir ışık deklanşörü kullanarak, EGFP-pozitif lifleri tanımlamak için 488 nm uyarma ışığını etkinleştirin. Fiber x-y yerini motorlu bir mikroskop aşaması kullanarak çanak üzerinde saklayın. EGFP sinyali genellikle fiber içinde heterojendir (Şekil 4B). Kaydedilen konumu en parlak EGFP sinyaline ortalayın.
- EGFP-pozitif lifleri tanımladıktan sonra, kaydedilen ilk lokalizasyona geri dönün. Manuel bir tetik anahtarı kullanarak, 1 ms süreli ve 20 V genlikli iki sıralı stimülasyon darbesi verin. Darbelerin polaritesini dönüşümlü olarak ayarlayın.
- Stimülasyondan sonra, zıt polaritenin iki darbesine yanıt olarak iki eşmerkezli homojen lif kasılmasını gözlemleyin. Alternatif polaritenin darbelerine verilen yanıtlarda lokal bir kasılma veya kasılmanın olmaması, yerel yayılmamış pasif tepkileri veya uyarılmazlığıgösterir 41. Deneyin geri kalanında bu lifleri hariç tutun.
- 2 μL 10 mM MTS-5-TAMRA çözeltisini doğrudan kabın içine ekleyin ve 1.000 μL pipetle (10 μM son konsantrasyon) yavaşça karıştırın. Çanağı hareket ettirmemeye dikkat edin, aksi takdirde depolanan lif pozisyonları kaybolur. Floresan tiol molekülünün enine tübül sistemi lümenine difüzyonuna izin vermek için 4-5 dakika inkübe edin.
- 5 dakika boyunca her 1 saniyede 300 ms için 50 Hz hızında ardışık aksiyon potansiyeli trenlerini uyandırmak için bipolar tekrarlayan stimülasyonlar uygulayın.
NOT: Darbe trenleri, MTS-5-TAMRA ile reaksiyona girmek için EGFP-CaV1.1'in S4'üne yerleştirilen sisteinlere erişilebilirlik sağlar. Lifin stimülasyona yanıt olarak mekanik olarak büzülme yeteneği, transvers tübül lümen içeriğinin hücre dışı ortamla döngü yapması için önemlidir. - Lekeleme solüsyonunu 1.000 μL pipetle çanaktan çıkarın ve 2 mL oda sıcaklığında Ringer çözeltisi ile değiştirin. Konjuge edilmemiş MTS-5-TAMRA'yı tamamen çıkarmak için iki veya üç tur gerekebilir. Lekeli lifin boyama protokolünden en az 10 dakika iyileşmesine izin verin.
- Adım 5.6'da olduğu gibi, alternatif polariteye yanıt olarak simetrik lif kasılmasını gözlemleyerek lif sağlığını ve elektriksel aktiviteyi yeniden değerlendirin. Her iki stimülasyona da cevap vermeyen lifleri deneyin geri kalanından hariç tutun.
- MTS-5-TAMRA filtre küpünü ışık yoluna taşıyın. Uzaktan kumandalı bir ışık deklanşörü kullanarak, lifler üzerindeki homojen MTS-5-TAMRA lekelemesini doğrulamak için 533 nm uyarma ışığını etkinleştirin.
NOT: MTS-5-TAMRA ile boyandıktan sonra, hem mühendislik hem de endojen sisteinler maleimid türevi ile reaksiyona girer (Şekil 5B). Bu nedenle, ilgilenilen sistein ile uygun reaksiyonu değerlendirmek zordur. CaV1.1 esas olarak enine tübülde ifade edilir ve ayırt edilebilir bir çift bant paterni oluşturur. Bir konfokal veya epifloresan mikroskop kullanarak, MTS-5-TAPRA'nın uygun boyanmasını ve enine tübül girişini ve difüzyonunu doğrulamak için bir x-y görüntüsü kullanılabilir (Şekil 5C).
6. Sinyal toplama ve işleme
NOT: Florometrik ölçümler yapılmadan önce, sinyal alımı optimum sinyal/gürültü oranını elde etmek için dikkatlice tasarlanmalıdır. Daha yavaş örnekleme oranları, protein konformasyonel yeniden düzenlenmesi sırasında elde edilecek noktaların sayısını azaltırken daha fazla ışık algılamasına izin verir. EGFP-CaV1.1-cys durumunda, bir aksiyon potansiyeli dalga formu tarafından indüklenen yük hareketi ~ 1-10 ms37'de gerçekleşir. Hareketin zaman içindeki evrimini izlemek için birden fazla nokta elde etmek için, edinme nokta başına 50 μs'ye ayarlandı.
- Fiberi uygun bir büyütme sistemi ile görüş alanının ortasına yerleştirin. Bu deneyler için, 60x yağ 1.4 sayısal açıklık (NA) ters çevrilmiş hedefi kullanıldı. EGFP sinyalinin maksimum olduğu fiber çapının dairesel bir alanını aydınlatmak için aydınlatmayı ve fiber konumunu motorlu sahne ve diyafram ile optimize edin (Şekil 4B).
- Elyaf elde edilmek üzere konumlandırıldıktan sonra, bağımsız olarak monte edilmiş iki alan stimülasyonu platin telini elyafın her iki ucuna yönlendirin. Liflerin ana eksenindeki telleri düz bir çizgi halinde hizalayın ve merkezdeki fiber ile 5 mm aralıklarla yerleştirin (Şekil 4B).
- Satın alma uyarım ve emisyon filtrelerini MTS-5-TAMRA için uygun ayarlara ayarlayın. Edinme yazılımında yazılı protokolü yürüterek denemeyi başlatın. Bu adım tüm aşağı akış cihazlarını tetikler (yani, protokol editörü, ışık deklanşörü, darbe jeneratörü).
NOT: Bu protokol, sonraki dinlenme floresan ölçümlerine izin vermek için alan uyarıcısının verilmesinden önce kısa bir süre (yani 10 ms) taban çizgisi edinimine izin verir. - 0,5 veya 1 ms, 20 V kare darbe ile tek veya bir aksiyon potansiyeli treni başlatın. Sinyal ağartmayı önlemek için toplam edinme süresini mümkün olduğunca en aza indirin.
NOT: Fiberin merkezinde kayıt yapılsa bile, harekete bağlı bir floresan sinyali oluşabilir ve protein-florofor konformasyonel değişikliği nedeniyle floresan sinyaliyle karıştırılabilir (Şekil 5D). Kasılmaya bağlı sinyal, stimülasyon sonrası beklenen şarj hareketi süresine kıyasla geciktirilmelidir37. - S4 hareketlerinden kaynaklanan sinyali, fiber büzülmesinden kaynaklanan sinyalden daha fazla ayırt etmek için, kasılma tepkilerini en aza indirmek ve adım 6.4'ü tekrarlamak için kayıt çözeltisine 1 μL 100 mM N-benzil-p-toluen sülfonamid (BTS; 50 μM nihai konsantrasyon) ekleyin. Fiber farmakolojik immobilizasyondan sonra ikinci kez tespit edilen sinyaller, etiketli S4 sarmalının moleküler hareketine karşılık gelir (Şekil 5D).
NOT: BTS ile hareket baskılanmasından sonra mühendislik sistein içermeyen EGFP-CaV1.1 kontrolünde sinyal algılanmamalıdır. - Aynı ayarları kullanarak, bir arka plan floresan değeri elde etmek için çanak içinde kas lifi veya döküntü bulunmayan bir yerde benzer bir sinyal elde edin.
- Ham floresanın [Fr(t)] zaman seyrini içeren dosyaları fiberden ve arka plan floresansından [Fb(t)] veri analiz yazılımına aktarın. Homojen bir Fb değeri elde etmek için Fb(t) içeren sütunun ortalaması. Mutlak floresan [F(t)] değerlerini elde etmek için Fb'yi Fr(t)'den çıkarın. Elde edilen sinyali gerekirse yumuşatma işleviyle düzgünleştirin.
NOT: Bu algılama sistemi ve edinme sıklığı ile, yumuşatma için 50 noktalık bir pencereye sahip bitişik ortalama bir işlev kullanmaya karar verdik. - Dinlenme floresan değeri (F0) elde etmek için stimülasyondan önce 10 ms'lik bir zaman aralığında taban çizgisi F (t) değerlerinin ortalaması. Floresandaki mutlak değişimi [ΔF(t)] elde etmek için düzleştirilmiş F(t)'den F0'ı çıkarın. Daha sonra, dinlenme floresansına (ΔF / F0) göre zaman içindeki floresan değişimini ifade etmek için, ΔF (t) 'yi F0'a bölün.
- Sinyal ağartmanın derecesini değerlendirmek için, zaman içinde ΔF / F0'dan sinyalden, stimülasyondan önce ve sonra ve florometrik sinyalden uzakta iki nokta tanımlayın. Bir taban çizgisi izlemesi elde etmek için doğrusal bir işlevi bu iki noktaya sığdırın. Sinyal ağartmayı düzeltmek için taban çizgisini zaman içinde ΔF / F0 olarak çıkarın.
- Zaman sütunundan, edinim başlangıcı ile stimülasyondan gelen geri besleme sinyali arasındaki gecikmeyi, elektriksel uyaranın başlangıcına karşılık gelen t = 0 olacak şekilde çıkarın.
NOT: Birden fazla sinyal karşılaştırmasına izin vermek için, genellikle sinyalin genliğini normalleştirmek gerekir. Deneyin amacına bağlı olarak farklı yaklaşımlar kullanılabilir. Aşağıdaki sonuçlar bölümünde, sinyal kinetiği ile ilgileniyorduk, bu yüzden her sinyali minimum ulaşılan değerle (yani, negatif giden tepe noktası) normalleştirmekten oluşan basit bir yöntem kullandık.
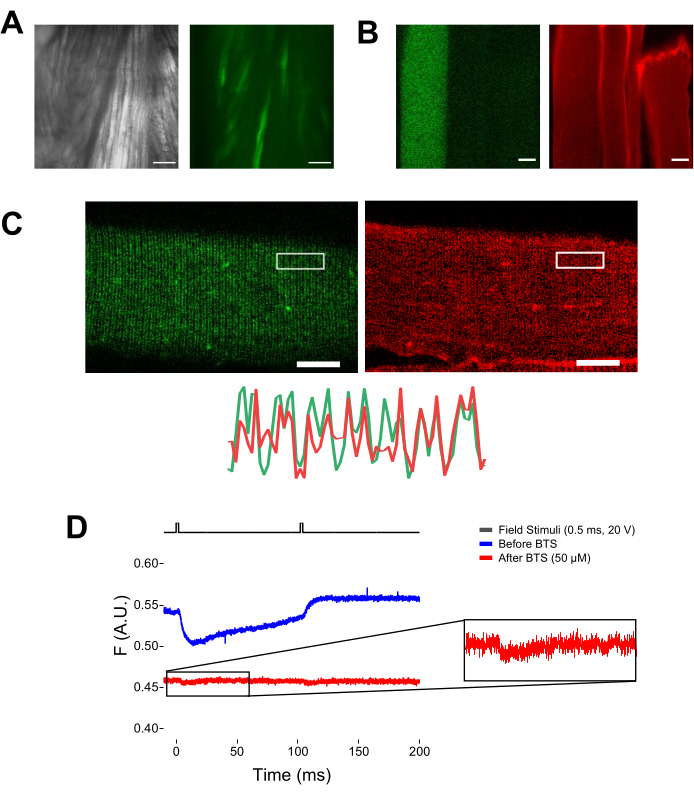
Şekil 5: MTS-5-TAMRA boyaması ve temsili ham florometrik kayıt olmadan ve MTS-5-TAMRA boyaması olmadan EGFP-CaV1.1-cys eksprese eden kas lifinin görüntülenmesi. (A) Bir EGFP-CaV1.1 VSD-III yapısını ifade eden diseke edilmiş, ayrışmamış kasın iletilen (sol) ve floresan (sağ) görüntülerine örnekler. Ölçek çubuğu: 100 μm. (B) MTS-5-TAMRA boyama işleminden önce (solda) ve sonra (sağda) bir EGFP-CaV1.1 VSD-III yapısını ifade eden bir kas lifinin temsili görüntüsü. Transfekte olmayan liflerin endojen sisteinleri de boya ile boyanır. Ölçek çubuğu: 30 μm. (C) Bir EGFP-Ca V 1.1 VSD-III yapısının (solda) ve MTS-5-TAMRA boyamasının (sağda) konfokal görüntüsü, kas lifinin enine tübül sisteminde (altta) CaV1.1 lokalizasyonunun klasik bir çift bant patern karakteristiğini göstermektedir. Ölçek çubuğu: 25 μm. (D) İki uyarana yanıt olarak temsili florometrik kayıt ve N-benzil-p-toluen sülfonemid (BTS) ile fiber immobilizasyonundan önce (mavi iz) ve sonra (kırmızı iz) bir fotodiyot ile ölçülür. Üst siyah çizgi, dış alan stimülasyonu yoluyla fiber depolarizasyon protokolünü gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
Tekrarlanan alan stimülasyonuna yanıt olarak aksiyon potansiyellerinin yayılması tetiklendiğinde, belirli bir depolarizasyon frekansına yanıt olarak spesifik voltaj sensörü hareketini izlemek mümkündür. Şekil 6A'da gösterildiği gibi, VSD-II etiketli helislerin hareketi, 10 Hz'de uygulanan iki ardışık depolarizasyonun her birine yanıt olarak izlenebilir (yani, 100 ms aralıklı). Sinyal ağartma, taban çizgisi izine çıkarılarak düzeltilebilir (Şek...
Tartışmalar
Burada, CaV1.1 kanalından bireysel voltaj sensörü hareketlerinin incelenmesi için kas liflerinde FSDF'yi yürütmek için adım adım bir protokol açıklanmaktadır. Bu teknikte birleştirilen adımların sayısı ve yaklaşımların çeşitliliği karmaşık görünse de, bu tekniklerin çoğu genellikle biyofizikçi / hücre biyoloğu laboratuvarlarında rutin olarak kullanılmaktadır. Bu nedenle, görünen karmaşıklık, esas olarak, tüm çeşitli yaklaşımların tek bir entegre teknikte birleştir...
Açıklamalar
Yazarlar çıkar çatışması olmadığını bildirmektedir.
Teşekkürler
Dr. J. Vergara'ya (Kaliforniya Üniversitesi, Los Angeles) EGFP-CaV1.1 (tavşan) vahşi tip plazmidini paylaştığı için teşekkür ederiz. Yale Fizyoloji Bölümü Elektronik Laboratuvarı'na ve özellikle Henrik Abildgaard'a iz ve tutma devreli fotodiyotun tasarımı ve yapımı için teşekkür ederiz. Bu çalışma Ulusal Sağlık Enstitüleri tarafından desteklenmiştir R01-AR075726 ve R01-NS103777
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacture field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Referanslar
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır