Method Article
توليد الخلايا القرنية المشتقة من المريض من خزعات الجلد
In This Article
Summary
تصف هذه المخطوطة بروتوكولا من خطوتين لتوليد خلايا جلدية خاصة بالمريض من الخلايا الليفية الجلدية عن طريق إعادة البرمجة العرضية إلى الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSCs) والتمايز اللاحق إلى خلايا بودوسيتي.
Abstract
الخلايا القرنية هي خلايا طلائية تقع على الموقع البولي لحاجز الترشيح الكبيبي وتساهم في وظيفة المرشح الانتقائي للكبيبة. يمكن أن تسبب الطفرات في الجينات الخاصة بالخلايا البؤرية تصلب الكبيبات القطاعي البؤري (FSGS) ، وتتأثر الخلايا البدوية أيضا في العديد من اعتلالات الكلية الأولية والثانوية الأخرى. نظرا لطبيعتها المتمايزة ، فإن نماذج زراعة الخلايا الأولية محدودة للخلايا البيضاء. لذلك ، يتم استخدام الخلايا الخالدة المشروطة بشكل شائع. ومع ذلك ، فإن هذه الخلايا المخلدة المشروطة (ciPodocytes) لها العديد من القيود: يمكن للخلايا أن تتمايز في الثقافة ، خاصة عندما تصل إلى نقطة التقاء ، والعديد من العلامات الخاصة بالخلايا الذكورية إما يتم التعبير عنها بشكل طفيف أو لا يتم التعبير عنها على الإطلاق. هذا يضع استخدام ciPodocytes وقابليتها للتطبيق للوصول الفسيولوجي والفيزيولوجي المرضي والسريري موضع تساؤل. هنا ، نصف بروتوكولا لتوليد الخلايا البدوية البشرية - بما في ذلك الخلايا البدوية الخاصة بالمريض - من خزعة لكمة الجلد عن طريق إعادة البرمجة العرضية للخلايا الليفية الجلدية إلى hiPSCs والتمايز اللاحق إلى podocytes. تشبه هذه الخلايا في الجسم الحي الخلايا البدوية بشكل أفضل بكثير من حيث الخصائص المورفولوجية ، مثل تطور عمليات القدم والتعبير عن العلامة الخاصة بالخلايا البدوية. أخيرا ، ولكن الأهم من ذلك ، تحافظ هذه الخلايا على طفرات المرضى ، مما يؤدي إلى تحسين نموذج خارج الجسم الحي لدراسة أمراض podocyte والمواد العلاجية المحتملة في نهج فردي.
Introduction
Podocytes هي خلايا ظهارية كلوية متخصصة بعد الانقسام تشكل حاجز الترشيح الكبيبي للكلية جنبا إلى جنب مع الغشاء القاعدي الكبيبي (GBM) والخلايا البطانية الكبيبية والجليكوكاليكس. ظاهريا ، تتكون الخلايا البدوية من جسم الخلية وامتدادات الغشاء الأولية التي تحركها الأنابيب الدقيقة ، بالإضافة إلى امتدادات ثانوية تسمى عمليات القدم 1,2. تم بناء حاجز الترشيح الكبيبي الذي يقوم بتصفية البول من الدم من البطانة المحصنة ، GBM ، ونوع متخصص من الوصلات بين الخلايا التي تربط عمليات قدم podocyte المجاورة ، تسمى الحجاب الحاجز الشقي ل podoctyes3. في ظل الظروف الصحية ، يتم الاحتفاظ بالبروتينات الأكبر من الألبومين من حاجز الترشيح بسبب حجمها وشحنتها4.
من المعروف أن الطفرات في الجينات الخاصة بالهيكل الخلوي أو الخلايا البدوية ، بالإضافة إلى العوامل المنتشرة التي تؤثر على مسارات إشارات الخلايا البدوية ، تحفز امحاء الخلايا أو الانفصال أو موت الخلايا المبرمج ، مما يؤدي إلى بيلة بروتينية وتصلب كبيبي. على وجه الخصوص ، إعادة ترتيب الهيكل الخلوي ، والتغيرات في قطبية podocyte أو تلف عمليات القدم مع فقدان ما يرتبط بها من تقاطعات الشق هيمحورية 5. نظرا لوضعها المتمايز بشكل نهائي ، لا يمكن استبدال الخلايا البدائية بعد انفصال GBM. ومع ذلك ، إذا تم ربط podocytes إلى GBM ، فإنها لا تزال قادرة على التعافي من محو وإصلاح عمليات القدم interdigitating6،7،8. قد يوفر الفهم الإضافي للأحداث التي تؤدي إلى تلف الخلايا البدوية في اضطرابات الكبيبات المختلفة أهدافا علاجية جديدة ستساعد في تطوير علاجات لهذه الأمراض. تلف Podocyte هو السمة المميزة لأمراض الكبيبات المختلفة ، بما في ذلك تصلب الكبيبات القطاعي البؤري (FSGS) ، اعتلال الكلية السكري ، مرض الحد الأدنى من التغيير ، واعتلال كبيبات الكلى الغشائي ، مما يتطلب نماذج موثوقة من podocyte ex vivo لدراسة الآليات المرضية وطرق العلاج المحتملة لهذه الأمراض 9,10. يمكن دراسة الخلايا القرنية خارج الجسم الحي عن طريق زراعة الخلايا الأولية الكلاسيكية بناء على عزل الكبيبات عن طريق الغربلة التفاضلية11. ومع ذلك ، نظرا للحالة المتمايزة نهائيا مع قدرة الانتشار المحدودة ، يستخدم معظم الباحثين خطوط خلايا ciPodocyte للفأر أو الخلايا البشرية التي تعبر عن المتغيرات الحساسة لدرجة الحرارة لمستضد SV40 T الكبير. بدلا من ذلك ، يتم عزل ciPodocytes من الفئران المعدلة وراثيا التي تؤوي الجين التخليدي SV40 Tag 1,12.
تتكاثر الخلايا السيبودية عند 33 °C ، ولكنها تدخل توقف النمو وتبدأ في التمايز عند 37 °C13,14. يجب أن يوضع في الاعتبار أن البيانات التجريبية التي تم الحصول عليها مع هذه الخلايا يجب تفسيرها بحذر معين ، حيث يتم إنشاء الخلايا باستخدام إدخال جيني غير طبيعي15. نظرا لأن هذه الخلايا تحتوي على جين خالد ، فإن علم وظائف الأعضاء الخلوية يتغير بسبب الانتشار المستمر12. تم التشكيك مؤخرا في خطوط خلايا Podocyte الناتجة عن هذا النهج ، حيث تعبر خلايا الفئران والإنسان والفئران عن أقل من 5٪ من synaptopodin و nephrin على مستوى البروتين ، وكذلك NPHS1 و NPHS2 على مستوى mRNA مقارنة بالتعبير الكبيبي16. علاوة على ذلك ، فإن معظم خطوط خلايا podocyte لا تعبر عن nephrin17,18. كما وصف تشيتيبرول وآخرون اختلافا كبيرا في حركة الخلية والاستجابات للبوروميسين ودوكسوروبيسين في ciPodocytes16. يمكن العثور على Podocytes في البول بعد الانفصال عن GBM في أمراض الكبيبات المختلفة19،20،21،22. يمكن زراعة الخلايا البولية القابلة للحياة خارج الجسم الحي لمدة تصل إلى 2-3 أسابيع ، لكن معظم الخلايا تخضع لموت الخلايا المبرمج23,24. ومن المثير للاهتمام ، أن الخلايا البدوية لا توجد فقط في بول المرضى الذين يعانون من مرض الكبيبات ولكن أيضا في بول الأشخاص الأصحاء ، على الأرجح عندما يكونون شيخوخة مرة أخرى مع إمكانية محدودة للتكرار في الثقافة24. علاوة على ذلك ، فإن عدد الخلايا البولية المشتقة من المسالك البولية محدود ، والخلايا غير متمايزة في الثقافة ، وتظهر عمليات قدم أقل ، وتغير التشكل ، والأهم من ذلك أن قدرتها على الانتشار محدودة. التعبير عن الجينات الخاصة بالخلايا العضلية غائب ، أو يختفي في غضون أسابيع قليلة ، أو يختلف بين هذه الحيوانات المستنسخة من الخلايا. بعض الخلايا الإيجابية للعلامة الخاصة ب podocyte عبرت بشكل مشترك عن علامة الخلايا الظهارية الأنبوبية أو الخلايا الليفية العضلية والخلايا الوسيطة ، مما يشير إلى عدم التمايز و / أو التمايز للخلايا البولية المستزرعة24,25.
في الآونة الأخيرة ، تم وصف توليد خطوط خلايا ciPodocyte المشتقة من بول المرضى والمتطوعين الأصحاء عن طريق النقل باستخدام مستضد T كبير SV40 حساس للحرارة و hTERT26. تم الكشف عن تعبير mRNA للبروتين المرتبط ب synaptopodin و nestin و CD2 ، لكن podocin mRNA كان غائبا في جميع الحيوانات المستنسخة. بالإضافة إلى مشاكل الخلايا البولية ، تحتوي هذه الخلايا أيضا على الجين الخالد المدرج ، مما يؤدي إلى العيوب التي نوقشت أعلاه.
في المقابل ، تتمتع الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSCs) بقدرة هائلة على التجديد الذاتي والتمايز إلى أنواع متعددة من الخلايا في ظل الظروف المناسبة. لقد ثبت من قبل أن hiPSCs يمكن أن تكون بمثابة مصدر غير محدود تقريبا للخلايا27,28.
هنا ، يتم وصف بروتوكول من خطوتين لتوليد خلايا بودوسيتات خاصة بالمريض من الخلايا الليفية الجلدية لخزعات الجلد المثقوبة مع إعادة البرمجة العرضية اللاحقة إلى hiPSCs والتمايز النهائي إلى الخلايا المشتقة من hiPSC (الشكل 1).
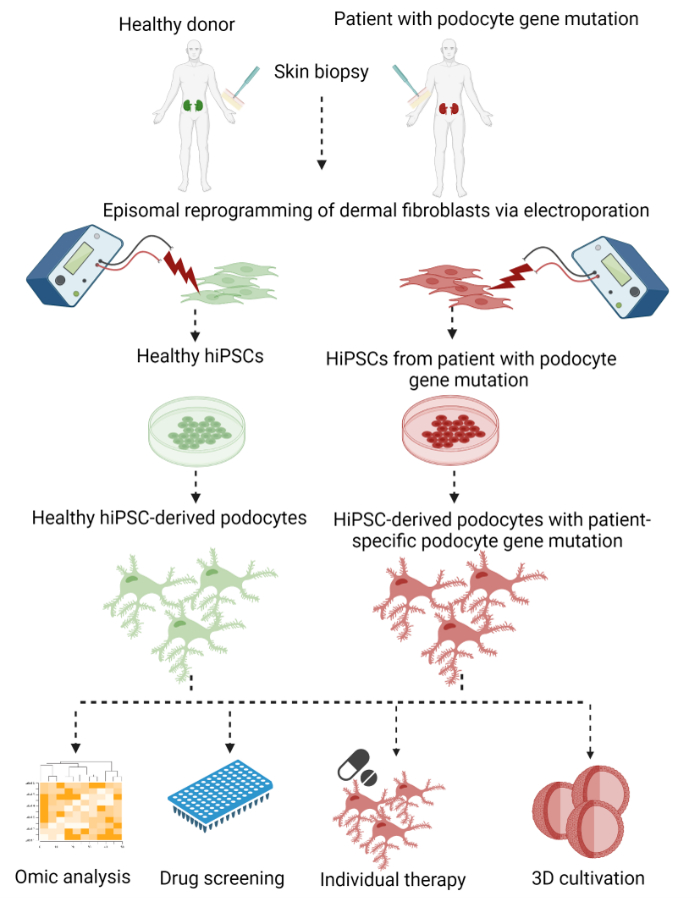
الشكل 1: بروتوكول لتوليد خلايا podocytes المشتقة من hiPSC الخاصة بالمريض. نظرة عامة رسومية على بروتوكول توليد الخلايا الليفية الخاصة بالمريض من الخلايا الليفية الجلدية لخزعة الجلد عن طريق إعادة البرمجة إلى hiPSCs والتمايز إلى خلايا بودوسيتي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
كخطوة أولى ، تم التخلص من الخلايا الليفية الجلدية الجسدية من خزعة لكمة الجلد وإعادة برمجتها إلى hiPSCs باستخدام طريقة خالية من التكامل عن طريق التثقيب الكهربائي مع البلازميدات التي تعبر عن عوامل النسخ OCT3 / 4 و KLF4 و SOX2 و c-MYC29،30،31. تم اختيار مستعمرات hiPSC الناشئة وتوسيعها لاحقا. بدأ التمايز بتحريض سلالة الأديم المتوسط عن طريق تنشيط مسار إشارات WNT ، يليه توليد الخلايا السلفية النيفرون التي كانت لا تزال قادرة على التكاثر. وأخيرا، تم تمايز الخلايا إلى خلايا بودوسيتية. في هذا الإجراء ، قمنا بتعديل ودمج البروتوكولات المنشورة مسبقا لإعادة البرمجة العرضية لتوليد hiPSCs بواسطة Bang et al.32 و Okita et al.33 ، بالإضافة إلى بروتوكول لتمايز hiPSCs إلى خلايا podocytes بواسطة Musah et al.28،34،35.
في الواقع ، كان للخلايا البدوية الناتجة عن بروتوكولنا نمط ظاهري أقرب إلى podocytes في الجسم الحي ، فيما يتعلق بتطوير شبكة متميزة من عمليات القدم الأولية والثانوية والتعبير عن علامات خاصة بالخلايا ، مثل synaptopodin و podocin و nephrin. مع استخدام الخلايا المشتقة من hiPSC ، يتم الحفاظ على الخلفية الوراثية للمريض أثناء إعادة البرمجة والتمايز. وهذا يتيح نمذجة مرض podocyte الخاص بالمريض واكتشاف المواد العلاجية المحتملة خارج الجسم الحي في عدد خلايا غير محدود تقريبا. وعلاوة على ذلك، فإن هذا البروتوكول طفيف التوغل، وفعال من حيث التكلفة، ومقبول أخلاقيا، وقد يسهل سبلا جديدة لتطوير العقاقير.
Protocol
تمت الموافقة على البروتوكول من قبل لجنة الأخلاقيات بجامعة فريدريش ألكسندر إرلانغن نورمبرغ (251_18B) ، وأعطى جميع المرضى و probands موافقة كتابية. تم إجراء جميع التجارب وفقا للمبادئ التوجيهية واللوائح ذات الصلة. للاطلاع على تكوين جميع الوسائط والحلول المستخدمة هنا، انظر الجدول 1.
1. نمو الخلايا الليفية الجلدية من خزعة لكمة الجلد
- انقل خزعة الجلد المثقوبة إلى أنبوب مخروطي معقم سعة 15 مل مع 10 مل من وسط الخلايا الليفية المسخن مسبقا.
- قم بإزالة الوسط واغسل خزعة الجلد المثقوبة ثلاث مرات باستخدام 5 مل من محلول ملحي معقم ومسخن مسبقا 1x مخزنة بالفوسفات (PBS). انقل خزعة الجلد المثقوبة بالملقط المعقم إلى صفيحة زراعة الخلايا مقاس 10 سم واقطعها بالعرض إلى ثلاث أو أربع قطع بمشرط معقم ، تاركا البشرة والأدمة.
- انقل كل قطعة إلى طبق مزرعة خلية بلاستيكية معقم مقاس 35 مم واضغط عليها برفق إلى طبق الاستزراع. إزالة الوسط الزائد حول قطع الخزعة. اتركيه ليجف لمدة 5-10 دقائق حتى يتبخر السائل وتعلق الخزعة على بلاستيك زراعة الخلايا.
- أضف 1 مل من وسط الخلايا الليفية بالتنقيط مع ماصة 1000 ميكرولتر حول الخزعة واملأها بعناية إلى حجم نهائي قدره 3 مل. زراعة في 37 درجة مئوية ، 5 ٪ CO2 لمدة 7 أيام دون تغذية وتحريك الطبق. قم بتغيير الوسط بعناية إلى وسط الخلايا الليفية الطازج المسخن مسبقا. بعد 7 أيام ، يمكن مراقبة الخلايا الليفية الشبيهة بالمغزل حول خزعة الجلد باستخدام مجهر تباينالطور 36.
ملاحظة: عندما تصل الخلايا الليفية المتضخمة إلى حافة الطبق ، انتقل مرة أخرى من الخطوة 1.3 لتوليد دفعة أخرى من الخلايا الليفية. - لتوسيع الخلايا الليفية المتضخمة ، اغسل ب 2 مل من 1x PBS المسخن مسبقا ، وافصل الخلايا الليفية ب 1 مل من 1x حمض التربسين والإيثيلين ديامينيترايتيك (EDTA) واحتضانها لمدة 5 دقائق عند 37 درجة مئوية ، 5٪ CO2. انقل الخلايا المنفصلة إلى أنبوب مخروطي سعة 15 مل واغسل طبق زراعة الخلايا ب 2 مل من وسط الخلايا الليفية الطازج المسخن مسبقا.
- قم بتجميع وسط الغسيل في الأنبوب لتحييد عامل التفكك وأجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وأعد تعليق حبيبات الخلية ب 1 مل من وسط الخلايا الليفية الطازجة المسخنة مسبقا. عد الخلايا باستخدام غرفة نيوباور أو عداد الخلايا الآلي باستخدام التريبان الأزرق والبذور 2.5 × 10 3 إلى 5 × 103 خلايا ليفية لكل سم2 في قوارير زراعة الخلايا الطازجة.
- ضع القوارير مرة أخرى في الحاضنة ووزع الخلايا بالتساوي عن طريق تحريك القوارير ثلاث مرات في كل اتجاه. في اليوم التالي ، استبدل الوسط بوسط الخلايا الليفية الطازج المسخن مسبقا. قم بتغيير الوسط مرتين في الأسبوع وانقسم عندما تصل الخلايا الليفية إلى حوالي 80٪ من التقاء.
2. تجميد الخلايا الليفية الجلدية
- لتجميد الخلايا الليفية ، اغسلها ب 5 مل من 1x PBS المسخن مسبقا. نضح برنامج تلفزيوني وفصل الخلايا الليفية مع 4 مل من 1x trypsin-EDTA. ضع القارورة مرة أخرى في الحاضنة واحتضانها لمدة 5-7 دقائق عند 37 درجة مئوية عند 5٪ CO2. راقب الانفصال باستخدام مجهر تباين الطور واضغط على جانب القارورة لفصل الخلايا.
- انقل الخلايا المنفصلة إلى أنبوب مخروطي سعة 15 mL. اغسل قارورة زراعة الخلايا ب 5 مل من وسط الخلايا الليفية الطازجة المسخنة مسبقا. قم بتجميع وسط الغسيل في الأنبوب المخروطي وأجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية.
- نضح المادة الطافية وأعد تعليق حبيبات الخلية ب 2 مل من وسط الخلايا الليفية الطازجة المسخنة مسبقا. عد الخلايا وانقل 1 × 106 خلايا إلى أنبوب مخروطي جديد. أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية.
- نضح المادة الطافية وإعادة تعليق حبيبات الخلية ب 1 مل من وسط تجميد الخلايا الليفية الباردة الذي يتكون من 90٪ مصل عجل الجنين و 10٪ ثنائي ميثيل سلفوكسيد (DMSO). ينقل إلى cryovial ، ويوضع في وعاء تجميد ، ويتجمد طوال الليل عند -80 درجة مئوية. للتخزين طويل الأجل ، ضع cryovial في خزان النيتروجين السائل في اليوم التالي.
3. إعادة البرمجة العرضية للخلايا الليفية لتوليد hiPSCs
- لإعادة البرمجة العرضية ، استخدم 1.5 × 106 خلايا ليفية من الممر 4 إلى 8. للوصول إلى رقم الخلية هذا ، استخدم دورقين إلى ثلاثة قارورة سعة 250 مل مع التقاء حوالي 70٪.
- في اليوم السابق لإعادة البرمجة ، قم بتقسيم الخلايا الليفية بنسبة 1: 2 لضمان حالتها التكاثرية. لذلك ، نضح الوسط واغسل القوارير ب 5 مل من 1x PBS المسخن مسبقا لكل قارورة. نضح برنامج تلفزيوني وفصل الخلايا الليفية مع 4 مل من 1x trypsin-EDTA. ضع القوارير مرة أخرى في الحاضنة واحتضانها لمدة 5-7 دقائق عند 37 درجة مئوية و 5٪ CO2. راقب الانفصال باستخدام مجهر تباين الطور واضغط على جانب القارورة لفصل الخلايا عن السطح البلاستيكي.
- انقل الخلايا المنفصلة إلى أنبوب مخروطي سعة 50 مل واغسل قوارير زراعة الخلايا ب 5 مل من وسط الخلايا الليفية الطازج المسخن مسبقا. قم بتجميع وسط الغسيل في الأنبوب المخروطي وأجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وأعد تعليق حبيبات الخلية في 6 مل من وسط الخلايا الليفية الطازجة المسخنة مسبقا.
- قم بإعداد ست قوارير جديدة لزراعة الخلايا عن طريق إضافة 5 مل من وسط الخلايا الليفية الطازجة الدافئة مسبقا لكل دورق. أضف 1 مل من معلق الخلايا الليفية إلى كل دورق. ضع القوارير مرة أخرى في الحاضنة ووزع الخلايا بالتساوي عن طريق تحريك القوارير ثلاث مرات في كل اتجاه.
- لإعادة البرمجة العرضية ، قم بتغطية لوحين لزراعة الخلايا مقاس 10 سم مناسبين لثقافة hiPSC ب 4 مل من محلول الطلاء البارد لكل لوحة. احتضان الألواح لمدة 1 ساعة عند 37 درجة مئوية.
ملاحظة: لزراعة hiPSCs ، يلزم وجود مواد بلاستيكية مختلفة لزراعة الخلايا وطلاء مصفوفة إضافي خارج الخلية (انظر جدول المواد). - قم بإزالة الوسائط من الخلايا الليفية واغسلها ب 10 مل من 1x PBS المسخن مسبقا لكل قارورة. قم بشفط PBS وفصل الخلايا الليفية ب 4 مل من 1x trypsin-EDTA لكل قارورة عن طريق الحضانة لمدة 5-7 دقائق عند 37 درجة مئوية. راقب الانفصال باستخدام مجهر تباين الطور ، وإذا لزم الأمر ، اضغط على جانب القارورة لفصل الخلايا عن السطح البلاستيكي.
- انقل الخلايا المنفصلة إلى أنبوب مخروطي سعة 50 mL. اغسل القوارير الفارغة ب 6 مل من وسط الخلايا الليفية المسخن مسبقا لجمع الخلايا المتبقية والتجمع في الأنبوب المخروطي. أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وأعد تعليق حبيبات الخلية في 3 مل من 1x PBS الطازج المسخن مسبقا.
- عد الخلايا وانقل 1.5 × 106 خلايا ليفية في أنبوب مخروطي جديد. أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 5 مل من وسط التثقيب الكهربائي وأجهزة الطرد المركزي مرة أخرى. في غضون ذلك ، قم بنضح محلول الطلاء من ألواح زراعة الخلايا المطلية مقاس 10 سم وأضف 7 مل من وسط الخلايا الليفية المسخنة مسبقا.
- بعد الطرد المركزي ، تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في وسط التثقيب الكهربائي بتركيز 1.5 × 106 خلايا في 250 ميكرولتر. انقل معلق الخلية سعة 250 ميكرولتر إلى كوفيت التثقيب الكهربائي بمسافة فجوة 4 مم (انظر جدول المواد).
- قم بإعداد مزيج نقل البلازميد عن طريق إضافة 4 ميكروغرام من كل بلازميد (pCXLE-hOCT3 / 4 ، pCXLE-hSK ، pCXLE-hMLN) إلى حجم إجمالي قدره 50 ميكرولتر من وسط التثقيب الكهربائي. انقله إلى الكوفيت واخلطه بالضغط برفق. بالكهرباء مع نبضة واحدة عند 280 فولت.
- قطع طرف ماصة باستخدام مقص معقم ونقل 125 ميكرولتر من الخلايا الليفية الكهربائية إلى كل من لوحات زراعة الخلايا 10 سم المعدة. توزيع الخلايا عن طريق تحريك لوحات ثلاث مرات في جميع الاتجاهات ووضعها مرة أخرى في الحاضنة. احتضان بين عشية وضحاها في 37 درجة مئوية مع 5 ٪ CO2 دون إزعاج.
- لإزالة الخلايا الميتة ، استبدل الوسط في اليوم التالي ب 7 مل من وسط الخلايا الليفية الطازجة المسخنة مسبقا. قم بتغيير الوسيط إلى وسيط ثقافة hiPSC بعد يومين من التثقيب الكهربائي واستبدله كل يوم لمدة 20 يوما القادمة.
4. اختيار وتوسيع ومراقبة الجودة من hiPSCs التي تم إنشاؤها
- راقب الخلايا يوميا لمدة 20 يوما على الأقل باستخدام مجهر تباين الطور بهدف 10x أو 20x لمراقبة تكوين مستعمرات hiPSC بعد التثقيب الكهربائي. إذا كان حجم مستعمرات hiPSC حوالي 300 ميكرومتر مع حدود مميزة وأظهرت hiPSCs نسبة عالية من النوى إلى الجسم ، فإن مستعمرات hiPSC جاهزة للاختيار عن طريق الانتقاء (الشكل 2B و C والشكل 3).
- قبل الانتقاء ، قم بتغطية لوحة 96 بئرا مناسبة لاستزراع hiPSC ب 100 ميكرولتر من محلول الطلاء لكل بئر واحتضانها لمدة 1 ساعة عند 37 درجة مئوية. أثناء الحضانة ، ضع علامة على المستعمرات ذات الأهمية في الجزء السفلي من طبق ثقافة الخلية بقلم. للتحضير النهائي للوحة 96 بئرا ، قم بإزالة محلول الطلاء وإضافة 100 ميكرولتر من وسط استزراع hiPSC المسخن مسبقا الذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632 إلى كل بئر.
- اغسل الخلايا باستخدام 1x PBS المسخن مسبقا وأضف وسط ثقافة hiPSC طازج ومسخن مسبقا يحتوي على مثبط 10 ميكرومتر ROCK Y27632 قبل الانتقاء لإزالة الخلايا الميتة. لاختيار مستعمرات hiPSC ، استخدم إبرة قياس وقسم مستعمرات hiPSC إلى قطع صغيرة عن طريق رسم شبكة في كل مستعمرة.
- باستخدام مجهر تباين الطور ، تحقق من تقسيم المستعمرات بنجاح إلى قطع. قم بنقلها باستخدام ماصة سعة 100 ميكرولتر إلى اللوحة المعدة ذات 96 بئرا. امسك الماصة في وضع مستقيم فوق المستعمرة دون لمس الخلايا لتجنب خدش المستعمرة وفقدانها.
- ضع لوحة 96 بئرا في الحاضنة عند 37 درجة مئوية مع 5٪ CO2 واترك الخلايا تلتصق طوال الليل دون إزعاج. احتفظ بالأطباق مع مزيج الخلايا الليفية و hiPSC ، في حالة عدم نجاح الانتقاء. لذلك ، قم بإزالة مثبط ROCK Y27632 عن طريق تغيير الوسيط إلى وسيط ثقافة hiPSC ووضع الألواح مرة أخرى في الحاضنة.
- في اليوم التالي ، قم بتغيير وسيط اللوحة المكونة من 96 بئرا إلى 200 ميكرولتر من وسط استزراع hiPSC الطازج وقم بتغييره كل يومين. راقب صفيحة 96 بئرا في اليوم التالي وقم بتمييز الآبار بنسخ منتقاة بنجاح.
ملاحظة: إذا لم يتم اختيار مستنسخات hiPSC التي تم انتقاؤها بالكامل بعد المحاولة الأولى ويمكن العثور على الخلايا الليفية في البئر ، كرر الانتقاء من البئر 96 أو كشط الخلايا الليفية من اللوحة.
5. توسيع استنساخ hiPSC المحدد
- راقب استنساخ hiPSC باستخدام مجهر تباين الطور. إذا وصلت hiPSCs المحددة إلى حوالي 70٪ من التقاء ، فإن استنساخ hiPSC جاهز للتوسع.
- قم بتغطية لوحة 48 بئرا مناسبة لاستزراع hiPSC ب 250 ميكرولتر من محلول الطلاء لكل بئر لمدة 1 ساعة عند 37 درجة مئوية. استبدل محلول الطلاء ب 200 ميكرولتر من وسط استزراع hiPSC الطازج المسخن مسبقا والذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632.
- لفصل hiPSCs عن لوحة 96 بئرا ، اكشط السطح البلاستيكي بطرف ماصة 1000 ميكرولتر. انقل hiPSCs المنفصلة من لوحة 96 بئرا إلى لوحة 48 بئرا. قم بتغيير الوسط في اليوم التالي إلى وسط ثقافة hiPSC طازج ومسخن مسبقا لإزالة الخلايا الميتة ومثبط ROCK Y27632.
- إذا وصلت استنساخ hiPSC إلى حوالي 70٪ من التقاء ، فقم بنقل hiPSCs إلى لوحة 24 بئرا. لذلك ، قم بتغطية لوحة 24 بئرا مناسبة لثقافة hiPSC ب 400 ميكرولتر من محلول الطلاء لكل بئر لمدة 1 ساعة عند 37 درجة مئوية. استبدل محلول الطلاء ب 400 ميكرولتر من وسط استزراع hiPSC الطازج المسخن مسبقا والذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632. نضح الوسط من 48 بئرا واغسله ب 500 ميكرولتر من 1x PBS المسخن مسبقا.
- استبدل PBS ب 100 ميكرولتر من محلول انفصال الخلايا الأنزيمية الذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632 واحتضانه عند 37 درجة مئوية لمدة 4 دقائق. اشطف hiPSCs من اللوحة باستخدام ماصة 1000 ميكرولتر. انقل الخلايا المنفصلة إلى أنبوب مخروطي سعة 15 mL. اغسل الصفيحة الفارغة المكونة من 48 بئرا بوسط استزراع hiPSC يحتوي على مثبط 10 ميكرومتر ROCK Y27632 وتجمع في الأنبوب المخروطي.
- أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وإعادة تعليق hiPSCs في 1 مل من وسط استزراع hiPSC يحتوي على مثبط 10 ميكرومتر ROCK Y27632 ونقله إلى لوحة 24 بئر. ضع اللوحة في الحاضنة عند 37 درجة مئوية عند 5٪ CO2 وقم بتوزيع الخلايا عن طريق تحريك اللوحة ثلاث مرات في جميع الاتجاهات. دع الخلايا تعلق بين عشية وضحاها دون إزعاج.
- في اليوم التالي ، قم بتغيير الوسيط إلى وسيط ثقافة hiPSC بدون مثبط ROCK Y27632.
ملاحظة: إذا وصلت استنساخ hiPSC إلى حوالي 70٪ من الالتقاء ، فقم بنقل hiPSCs إلى لوحة ذات 12 بئرا عن طريق تكرار الخطوات من 5.4 إلى 5.7 مع زيادة الأحجام المناسبة لتنسيق 12 بئرا. إذا وصلت hiPSCs من لوحة 12 بئرا إلى حوالي 70٪ من التقاء ، فقم بنقل استنساخ hiPSC إلى لوحة ذات 6 آبار مع زيادة الأحجام لتنسيق 6 آبار.
6. تجميد استنساخ hiPSC المحدد
- لتجميد استنساخ hiPSC المحدد ، قم بشفط الوسط من لوحة ذات 6 آبار. اغسل الآبار ب 2 مل من 1x PBS. نضح وفصل hiPSCs مع 1 مل من محلول انفصال الخلايا الأنزيمية التي تحتوي على 10 ميكرومتر Y27632. ضع اللوحة مرة أخرى في الحاضنة واحتضانها لمدة 4 دقائق عند 37 درجة مئوية و 5٪ CO2.
- اشطف hiPSCs من اللوحة باستخدام ماصة 1000 ميكرولتر وانقل الخلايا المنفصلة إلى أنبوب مخروطي سعة 15 مل. اغسل الطبق ب 2 مل من وسط استزراع hiPSC الطازج المسخن مسبقا والذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632. تجمع في الأنبوب المخروطي وأجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وأعد تعليق حبيبات الخلية ب 2 مل من وسط ثقافة hiPSC الطازج المسخن مسبقا والذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632.
- عد الخلايا وانقل 1 × 106 خلايا إلى أنبوب مخروطي جديد. أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. قم بنضح المادة الطافية ، وأعد تعليق حبيبات الخلية في 1 مل من وسط تجميد hiPSC البارد الخالي من المصل ، وقم بتجميده في cryovial باستخدام حاوية تجميد طوال الليل عند -80 درجة مئوية. للتخزين طويل الأجل ، ضع cryovial في خزان النيتروجين السائل في اليوم التالي.
7. مراقبة الجودة HiPSC
- توصيف مورفولوجيا hiPSC
- تحقق من مورفولوجيا hiPSC المميزة باستخدام مجهر تباين الطور بهدف 20x. بعد إعادة البرمجة ، يتغير مورفولوجيا الخلية من الخلايا الليفية الطويلة التي تشبه المغزل إلى الخلايا الجذعية السائلة الصغيرة المستديرة ، مما يوفر نسبة عالية من النوى إلى الجسم تنمو في مستعمرات ذات حدود مميزة (الشكل 2C).
- إذا نمت مستعمرات hiPSC بكثافة شديدة وحدث تمايز تلقائي ، فقم بكشط الأجزاء المتمايزة من اللوحة باستخدام طرف ماصة (الشكل 3). نظرا لأن hiPSCs لديها معدل انتشار مرتفع ، قم بإطعام ثقافات hiPSC كل يوم بوسط تغذية hiPSC طازج ومسخن مسبقا.
- توصيف علامات تعدد القدرات عن طريق تلطيخ التألق المناعي
- للتحقق من hiPSCs المتولدة لعلامة تعدد القدرات عن طريق تلطيخ التألق المناعي ، ضع أغطية بلاستيكية في لوحة 24 بئرا وقم بتغطيتها ب 250 ميكرولتر من محلول الطلاء لمدة 1 ساعة عند 37 درجة مئوية و 5٪ CO2. استبدل محلول الطلاء ب 1 مل من وسط استزراع hiPSC المسخن مسبقا يحتوي على مثبط 10 ميكرومتر ROCK Y27632.
- البذور 1.9 × 104 hiPSCs منفصلة لكل 24 بئر. دع hiPSCs تعلق بين عشية وضحاها عند 37 درجة مئوية و 5٪ CO2 دون إزعاج. راجع الخطوات من 5.4 إلى 5.6 لتفكك hiPSCs. استبدل الوسط في اليوم التالي بوسط ثقافة hiPSC بدون مثبط ROCK Y27632.
- للتلطيخ ، اغسل الخلايا ب 1 مل من 1x PBS المسخن مسبقا ثم قم بتثبيت hiPSCs بنسبة 4٪ بارافورمالدهيد لمدة 10 دقائق في درجة حرارة الغرفة. اغسل hiPSCs الثابتة باستخدام 1x PBS وقم بحظر مواقع الربط غير المحددة ب 200 ميكرولتر من محلول الحضانة المسبق لكل بئر لمدة 1 ساعة في درجة حرارة الغرفة. تمييع الأجسام المضادة الأولية Ki67 (1: 300) ، OCT3 / 4 (1: 200) ، SSEA4 (1: 100) في مخفف الأجسام المضادة.
- قم بتنظيف رقائق بلاستيكية تحتوي على 70٪ من الإيثانول وضعها في غرفة تلطيخ مملوءة بخزان مياه. ضع قطرات من 30 ميكرولتر من تخفيفات الأجسام المضادة الأولية على الرقاقة. ضع العينات الثابتة رأسا على عقب في التخفيف واحتضانها طوال الليل عند 4 درجات مئوية.
- في اليوم التالي ، اغسل العينات ثلاث مرات باستخدام 1x PBS لمدة 5 دقائق وضع 30 ميكرولتر من تخفيفات الأجسام المضادة الثانوية (1: 1,000) على بقع نظيفة على الرقاقة. ضع الغطاء ينزلق رأسا على عقب في التخفيف. احتضان لمدة 1 ساعة في درجة حرارة الغرفة في الظلام.
- بعد الحضانة ، اغسل ثلاث مرات باستخدام 1x PBS لمدة 5 دقائق. قم بتركيب العينات على شرائح زجاجية في وسط التثبيت الذي يحتوي على DAPI. اتركيه ليجف طوال الليل في درجة حرارة الغرفة وفي الظلام وصور العينات باستخدام مجهر متحد البؤر (الشكل 4).
- استبعاد البكتيريا وتلوث الميكوبلازما
- لاستبعاد التلوث البكتيري، انقل 500 ميكرولتر من hiPSCs المنفصلة إلى 5 مل من وسط لوريا بيرتاني (LB) المسخن مسبقا. راجع الخطوات من 5.4 إلى 5.6 لتفكك hiPSCs. احتضان بين عشية وضحاها في 37 درجة مئوية. إذا بدا الوسط LB عكرا ، فمن المحتمل أن يكون تلوث البكتيريا قد حدث. تجاهل الخلايا.
- لاستبعاد تلوث الميكوبلازما ، اجمع الوسط الذي لم يتم استبداله لمدة 2 أيام من 6 آبار مع حوالي 90٪ من hiPSCs المتقاربة. استخدم تفاعل البلمرة المتسلسل الكمي (qPCR) للكشف عن تلوث الميكوبلازما. تتوفر العديد من مجموعات الكشف عن الميكوبلازما التجارية لهذا الغرض.
8. تمايز hiPSCs إلى podocytes
- إعداد وتخزين عوامل النمو
- لتحضير تركيز مخزون 10 mM Y27632 ، أعد تكوين 10 مجم من Y27632 (الوزن الجزيئي 320.26 جم / مول) في 3.12 مل من الماء المعقم. قم بتخزين 100 ميكرولتر من القسامات عند -20 درجة مئوية وقم بتخفيف 1: 1000 في وسط زراعة الخلايا للوصول إلى تركيز نهائي قدره 10 ميكرومتر.
- لتحضير تركيز مخزون 30 mM CHIR99021 ، أعد تكوين 5 مجم من CHIR99021 (الوزن الجزيئي 465.34 جم / مول) في 358.2 ميكرولتر من DMSO المعقم. قم بتخزين 50 ميكرولتر من القسمة عند -20 درجة مئوية وقم بتخفيف 1: 10000 في وسط زراعة الخلايا للوصول إلى تركيز نهائي قدره 3 ميكرومتر.
- لتحضير تركيز مخزون قدره 100 ميكروغرام / مل أكتيفين أ ، أعد تكوين 100 ميكروغرام من أكتيفين أ في 1 مل من 1x PBS يحتوي على 0.1٪ من ألبومين مصل الأبقار (BSA). قم بتخزين 100 ميكرولتر من القسمة عند -20 درجة مئوية وقم بتخفيف 1: 2000 في وسط زراعة الخلايا للوصول إلى تركيز نهائي قدره 50 نانوغرام / مل.
- لتحضير تركيز مخزون قدره 100 ميكروغرام / مل من البروتين المورفجيني العظمي 7 (BMP7) ، أعد تكوين 100 ميكروغرام من BMP7 في 1 مل من الماء المعقم الذي يحتوي على 0.1٪ BSA. قم بتخزين 100 ميكرولتر من القسمة عند -20 درجة مئوية وقم بتخفيف 1: 2000 في وسط زراعة الخلايا للوصول إلى تركيز نهائي قدره 50 نانوغرام / مل.
- لتحضير تركيز مخزون قدره 100 ميكروغرام / مل من عامل نمو بطانة الأوعية الدموية (VEGF) ، أعد تكوين 100 ميكروغرام من VEGF في 1 مل من الماء المعقم. قم بتخزين 100 ميكرولتر من القسامات عند -20 درجة مئوية وقم بتخفيف 1: 4000 في وسط زراعة الخلايا للوصول إلى تركيز نهائي قدره 25 نانوغرام / مل.
- لتحضير تركيز مخزون 10 مللي متر من حمض الريتينويك المتحول، أعد تكوين 10 ملغ من حمض الريتينويك المتحولة بالكامل في 3.33 مل من DMSO المعقم. قم بتخزين 100 ميكرولتر من القسمة عند -20 درجة مئوية وقم بتخفيف 1: 100 في وسط زراعة الخلايا للوصول إلى تركيز نهائي قدره 0.5 ميكرومتر.
- تنشيط مسار إشارات WNT للحث على نسب الأديم المتوسط
- لتمييز hiPSCs إلى خلايا podocytes المشتقة من hiPSC ، لوحات زراعة خلايا معطف أو قوارير مناسبة لثقافة hiPSC مع محلول طلاء لمدة 1 ساعة عند 37 درجة مئوية و 5٪ CO2. الحجم الكلي لمحلول الطلاء هو 1 مل لكل لوحة استزراع 6 آبار أو 4 مل لكل لوحة زراعة خلية 10 سم.
- نضح الوسط وغسل hiPSCs مع 1x PBS مسخن مسبقا. نضح PBS وإضافة محلول انفصال الخلايا الأنزيمية التي تحتوي على 10 ميكرومتر Y27632 بحجم إجمالي 1 مل لكل لوحة استزراع 6 آبار أو 4 مل لكل لوحة زراعة خلية 10 سم.
- ضع اللوحة مرة أخرى في الحاضنة واحتضانها لمدة 4 دقائق عند 37 درجة مئوية و 5٪ CO2. اشطف hiPSCs من اللوحة باستخدام ماصة 1000 ميكرولتر. نقل الخلايا المنفصلة إلى أنبوب مخروطي.
- اغسل الطبق بوسط استزراع hiPSC طازج ومسخن مسبقا يحتوي على مثبط 10 ميكرومتر ROCK Y27632. قم بتجميع وسيط الغسيل في الأنبوب المخروطي لتحييد كاشف التفكك. أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وأعد تعليق حبيبات الخلية ب 2 مل من وسط ثقافة hiPSC الطازج المسخن مسبقا والذي يحتوي على مثبط 10 ميكرومتر ROCK Y27632.
- عد الخلايا والبذور 1 × 104 hiPSCs / سم2. توزيع الخلايا عن طريق تحريك ثلاث مرات في جميع الاتجاهات. دع hiPSCs تعلق طوال الليل عند 37 درجة مئوية مع 5٪ CO2 دون إزعاج.
- في اليوم التالي ، استبدل الوسط ب 2 مل من وسط تمايز الأديم المتوسط المسخن مسبقا الذي يحتوي على 1x B27 مكمل ، 1٪ بنسلين-ستربتومايسين ، 3 ميكرومتر CHIR99021 ، 50 نانوغرام / مل أكتيفين A ومثبط 10 ميكرومتر ROCK Y27632.
- التمايز إلى خلايا سلف نفرون
- بعد يومين، قم بتغيير وسط الأديم المتوسط إلى 2 مل من وسط تمايز السلف النيفرون المسخن مسبقا الذي يحتوي على 1x B27 supplement، 1٪ البنسلين-الستربتومايسين، 3 ميكرومتر CHIR99021، 50 نانوغرام/مل أكتيفين A، و 50 نانوغرام/مل BMP7 لكل صفيحة استزراع 6 آبار أو 6 مل لكل صفيحة استزراع خلوي 10 سم. قم بتغيير الوسيط كل يوم لمدة 14 يوما القادمة.
ملاحظة: تتكاثر الخلايا السلفية للنيفرون ويمكن تمريرها وتجميدها بعد 7 أيام من التمايز في وسط توسع السلف النفرون. - لتقسيم الخلايا السلفية للنيفرون ، قم بتغطية بلاستيك زراعة الخلايا المناسب لثقافة hiPSC بمحلول طلاء لمدة 1 ساعة عند 37 درجة مئوية. استبدل محلول الطلاء بوسط تمدد سلف النيفرون. نضح الوسائط وغسل الخلايا مع 1x PBS مسخن مسبقا. قم بإزالة برنامج تلفزيوني وافصل الخلايا باستخدام 1x trypsin-EDTA.
- احتضان لمدة 5 دقائق عند 37 درجة مئوية و 5٪ CO2. مراقبة انفصال الخلايا باستخدام مجهر تباين الطور. إذا لزم الأمر ، اضغط على جانب البلاستيك لفصل الخلايا عن السطح. شطف الخلايا من لوحة ونقل إلى أنبوب مخروطي. اغسل القارورة أو الصفيحة الفارغة بنفس حجم وسط تمدد السلف النيفرون المسخن مسبقا مثل كاشف التفكك.
- ادمج وسط الغسيل في الأنبوب المخروطي. أجهزة الطرد المركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية. نضح المادة الطافية وأعد تعليق حبيبات الخلية ب 2 مل من وسط تمدد السلف النيفرون الطازج المسخن مسبقا. عد الخلايا والبذور 1.5 × 104 خلايا سلف نفرون لكل سم2 لمزيد من التمايز.
ملاحظة: لتجميد الخلايا السلفية للنيفرون ، أعد تعليق 1 × 106 خلايا في 1 مل من وسط الحفظ بالتبريد البارد الخالي من المصل وانقله إلى cryovial. تجمد في وعاء تجميد عند -80 درجة مئوية طوال الليل وانقله إلى خزان النيتروجين السائل للتخزين طويل الأجل. - ضع الألواح مرة أخرى في الحاضنة وقم بتوزيع الخلايا بالتساوي عن طريق التحريض ثلاث مرات في جميع الاتجاهات. قم بتغيير الوسط في اليوم التالي إلى وسط تمايز سلف النيفرون الطازج المسخن مسبقا. استبدل الوسط كل يومين حتى يتم تمييز الخلايا لمدة 14 يوما في وسط تمايز السلف النفرون.
- بعد يومين، قم بتغيير وسط الأديم المتوسط إلى 2 مل من وسط تمايز السلف النيفرون المسخن مسبقا الذي يحتوي على 1x B27 supplement، 1٪ البنسلين-الستربتومايسين، 3 ميكرومتر CHIR99021، 50 نانوغرام/مل أكتيفين A، و 50 نانوغرام/مل BMP7 لكل صفيحة استزراع 6 آبار أو 6 مل لكل صفيحة استزراع خلوي 10 سم. قم بتغيير الوسيط كل يوم لمدة 14 يوما القادمة.
- التمايز النهائي إلى الخلايا المشتقة من hiPSC
- نضح الوسط وإضافة 2 مل من وسط تمايز الخلايا المبيضة مسبقا يحتوي على 1x B27 ملحق ، 1٪ بنسلين ستربتومايسين ، 3 ميكرومتر CHIR99021 ، 50 نانوغرام / مل أكتيفين أ ، 50 نانوغرام / مل BMP7 ، 25 نانوغرام / ميكرولتر VEGF ، و 0.5 ميكرومتر من حمض الريتينويك العابر بالكامل لكل صفيحة استزراع 6 آبار أو 6 مل لكل لوحة زراعة خلية 10 سم. ضع الألواح مرة أخرى في الحاضنة عند 37 درجة مئوية و 5٪ CO2. قم بتغيير الوسط كل يوم لمدة 4 أيام باستخدام وسط تمايز الخلايا الدافئة مسبقا.
- للحفاظ على الخلايا الجذعية العضلية في الثقافة بعد التمايز ، قم بتغذية الخلايا مرتين في الأسبوع بوسط صيانة podocyte يحتوي على 10٪ مصل عجل الجنين ، و 1٪ بنسلين-ستربتومايسين ، و 0.1٪ أنسولين-ترانسفيرين-سيلينيوم.
ملاحظة: لم تعد الخلايا العضلية المتمايزة المتمايزة تتكاثر بعد الآن. ومع ذلك ، فمن الممكن الاحتفاظ بها في زراعة الخلايا لمدة تصل إلى 4 أسابيع.
- ذوبان وتوسيع الخلايا السلفية النيفرون المجمدة
- قم بتغطية قارورة بلاستيكية جديدة لزراعة الخلايا مناسبة لثقافة hiPSC بمحلول طلاء لمدة 1 ساعة عند 37 درجة مئوية و 5٪ CO2. استبدل محلول الطلاء ب 5 مل من وسط تمدد السلف النيفرون.
- تحضير أنبوب مخروطي 15 مل مع 7 مل من وسط تمدد السلف النيفرون المسخن مسبقا. قم بإذابة الخلايا المجمدة عند 37 درجة مئوية في حمام مائي دون حركة لمدة 20 ثانية تقريبا. أخرج المبرد من الحمام المائي عندما يتم إذابة نصف الخلايا ، ويتبقى بعض الجليد.
- رش المبرد بنسبة 70٪ من الإيثانول وضعه في خزانة السلامة الحيوية. انقل الخلايا المذابة إلى الأنبوب المخروطي باستخدام وسط تمدد السلف النيفرون المسخن مسبقا. استخدم ماصة سعة 1000 ميكرولتر واترك الخلايا تجري أسفل جدار الأنبوب ببطء شديد.
- اغسل المبرد الفارغ ب 1 مل من وسط تمدد السلف النيفرون لجمع الخلايا المتبقية والتجمع في الأنبوب المخروطي. جهاز طرد مركزي عند 200 × جم لمدة 5 دقائق عند 20 درجة مئوية وإعادة تعليق حبيبات الخلية في وسط تمدد سلف النيفرون الطازج المسخن مسبقا.
- انقل الخلايا المذابة إلى القارورة المطلية وقم بتغيير الوسط في اليوم التالي إلى وسط تمدد سلف النيفرون الطازج المسخن مسبقا. قبل مزيد من التمايز ، دع الخلايا تتكاثر في وسط تمدد سلف النفرون عن طريق تغيير الوسط كل يوم ، وانتقل من الخطوة 8.3.5.
9. توصيف الخلايا المشتقة من hiPSC عن طريق تلطيخ التألق المناعي
- للتحقق من الخلايا العضلية المتمايزة للعلامة الخاصة بالخلايا البدوية عن طريق تلطيخ التألق المناعي ، ضع أغطية بلاستيكية في صفيحة من 24 بئرا وقم بتغطيتها ب 250 ميكرولتر من محلول الطلاء لمدة 1 ساعة عند 37 درجة مئوية و 5٪ CO2. استبدل محلول الطلاء ب 1 مل من وسط تمدد السلف النيفرون المسخن مسبقا. البذور 2.5 × 104 خلايا سلف نيفرون منفصلة لكل صفيحة 24 بئرا. انظر الخطوات من 8.3.2 إلى 8.3.4 لمعرفة تفكك الخلايا السلفية للنفرون.
- دع الخلايا تلتصق طوال الليل عند 37 درجة مئوية و 5٪ CO2 دون إزعاج. استبدل الوسط في اليوم التالي بوسط تمايز السلف النيفرون المسخن مسبقا.
- قم بإنهاء التمايز عن طريق تغيير الوسط كل يومين حتى يتم تمييز الخلايا لمدة 14 يوما في وسط تمايز السلف النيفرون و 5 أيام إضافية في وسط تمايز الخلايا الحمراء.
- بعد التمايز النهائي ، اغسل الخلايا ب 1 مل من 1x PBS المسخن مسبقا. إصلاح الخلايا العضلية hiPSC مع 4٪ بارافورمالدهيد لمدة 10 دقائق في درجة حرارة الغرفة. اغسل الخلايا الثابتة باستخدام 1x PBS وقم بحظر مواقع الربط غير المحددة ب 200 ميكرولتر من محلول الحضانة المسبق لكل بئر لمدة 1 ساعة في درجة حرارة الغرفة.
- تمييع الأجسام المضادة الأولية synaptopodin (1: 200) ، podocin (1: 100) ، و nephrin (1:25) في مخفف الأجسام المضادة ووضع قطرات من 30 μL تخفيف الأجسام المضادة الأولية على رقائق بلاستيكية نظيفة في غرفة تلطيخ تحتوي على خزان مياه.
- ضع شرائح الغطاء مع خلايا hiPSC الثابتة رأسا على عقب في التخفيف. احتضان بين عشية وضحاها في 4 درجة مئوية. في اليوم التالي ، اغسل ثلاث مرات باستخدام 1x PBS لمدة 5 دقائق. تمييع الأجسام المضادة الثانوية (1: 1,000) في 1x PBS ووضع قطرات من تخفيف الأجسام المضادة الثانوية 30 ميكرولتر على بقع نظيفة على الرقاقة. ضع الغطاء ينزلق رأسا على عقب في التخفيف.
- احتضان لمدة 1 ساعة في درجة حرارة الغرفة في الظلام. بعد الحضانة ، اغسل ثلاث مرات باستخدام 1x PBS لمدة 5 دقائق. قم بتركيب العينات على شرائح زجاجية في وسط تركيب يحتوي على DAPI. اتركيه ليجف طوال الليل في درجة حرارة الغرفة وفي الظلام. صور العينات باستخدام مجهر متحد البؤر.
النتائج
مع هذا البروتوكول خطوة بخطوة الذي يجمع بين إعادة البرمجة العرضية والتمايز ، من الممكن توليد خلايا podocytes تحمل طفرة المريض في جين ذي صلة بالخلايا الذكورية. وهذا يتيح تحليل التغيرات podocyt الخاصة بالمرض خارج الجسم الحي. يتم الحفاظ على الخلفية الوراثية للمريض أثناء البروتوكول خلال جميع مراحل الخلايا المختلفة. بالإضافة إلى ذلك ، يمكن التغلب على الحد من عدم كفاية عدد الخلايا من الخلايا البادوسية غير المتكاثرة المتمايزة نهائيا باستخدام الخلايا المشتقة من hiPSC. على الرغم من أن الأمر يستغرق عدة أشهر حتى يتم إنشاء الخلايا الليفية hiPSC من الخلايا الليفية الجلدية المتضخمة عن طريق إعادة البرمجة إلى hiPSCs والتمايز اللاحق إلى الخلايا البدوية ، فمن الممكن تجميد الخلايا في ثلاث خطوات مختلفة من البروتوكول (الشكل 2). التجميد ممكن للخلايا الليفية ، hiPSCs ، والخلايا السلفية النيفرون بعد التمايز في وسط تمايز السلف النيفرون لمدة 7 أيام. لذلك ، من الممكن إنشاء بنوك خلايا عاملة وتجارب واسعة النطاق.
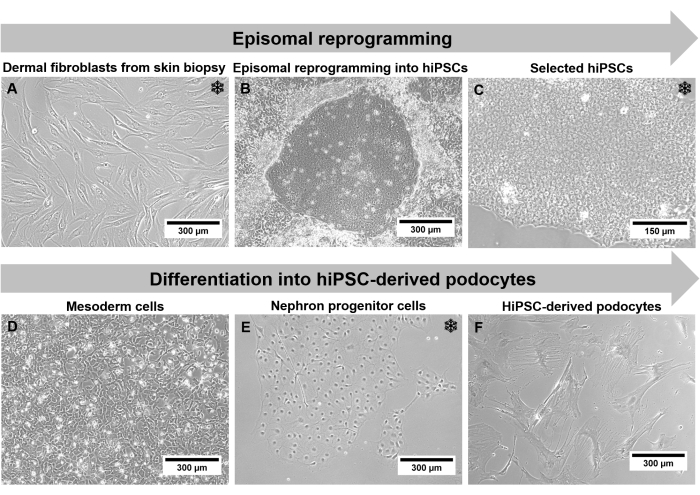
الشكل 2: الخطوات الفردية للبروتوكول من خلال مجهر تباين الطور. أ: الخلايا الليفية الجلدية المتضخمة. (ب) تشكيل مستعمرة hiPSC بعد إعادة البرمجة. (ج) ثقافة hiPSC مختارة. د: خلايا الأديم المتوسط بعد 2 أيام من التمايز. ه: الخلايا السلفية النفرية بعد 14 يوما من التمايز في وسط تمايز السلف النفرون. (F) الخلايا الطرفية المتمايزة المشتقة من hiPSC. تمثل قضبان المقياس 300 ميكرومتر (A ، B ، D-F) و 150 ميكرومتر (C). تسلط ندفة الثلج الضوء على خطوات التجميد المحتملة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نظرا لأن الخلايا المشتقة من hiPSC المتولدة تجتاز بروتوكولا طويلا مع تغييرات جذرية فيما يتعلق بنوع الخلية والتشكل ، فإن توصيف الخلية إلزامي. يمكن مراقبة مورفولوجيا الخلية ، مثل الحجم وشكل الخلية ، وكذلك سلوك النمو ، باستخدام مجهر تباين الطور. تقدم الخلايا الليفية نمطا ظاهريا طويلا يشبه المغزل بحجم 150 ميكرومتر إلى 300 ميكرومتر (الشكل 2 أ). بعد إعادة البرمجة ، تحدث مستعمرات تحتوي على 50 ميكرومتر من hiPSCs الصغيرة. تظهر هذه المستعمرات حدودا مميزة و hiPSCs تتميز بنسبة عالية من النوى إلى الجسم وزيادة معدل الانتشار (الشكل 2C). نظرا لأن الخلايا البدائية عبارة عن خلايا متمايزة بشكل نهائي ، فإن معدل الانتشار يتناقص مع التمايز التدريجي ، ويتغير مورفولوجيا الخلية إلى 300 ميكرومتر من الخلايا البدوية الكبيرة على شكل نجمة مع عمليات القدم البارزة (الشكل 2F).
يعد التقاء نقطة حرجة في ثقافة hiPSC ، ويمكن أن يظهر التمايز التلقائي عندما تنمو المستعمرات كثيفة للغاية (الشكل 3). يجب إزالة هذه المستعمرات قبل المرور عن طريق كشط الأجزاء المصابة من طبق الاستزراع.
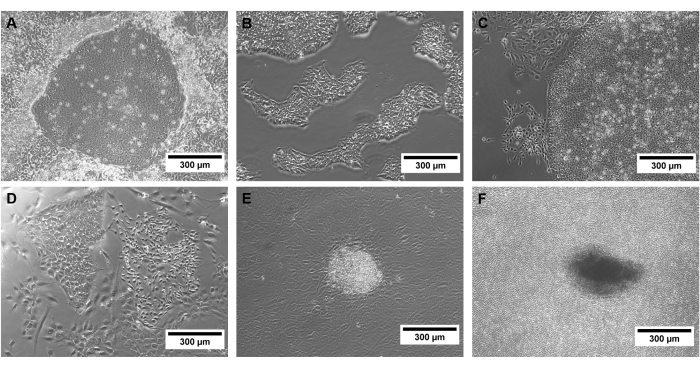
الشكل 3: أمثلة على hiPSCs ذات الجودة المختلفة. صور تباين الطور ل (A) مستعمرات hiPSC المعاد برمجتها بنجاح و (B) hiPSCs المحددة ، بالإضافة إلى (C) التمايز التلقائي ، (D ، E) مستعمرات غير hiPSC ، و (F) ثقافة hiPSC كثيفة للغاية. تمثل قضبان المقياس 300 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
يجب التحقق من صحة أنواع الخلايا المختلفة لهذا البروتوكول فيما يتعلق بالتعبير عن علامة معينة. بعد إعادة البرمجة ، تستعيد hiPSCs قدرة تعدد القدرات وتعبر عن علامات الانتشار وتعدد القدرات مثل SSEA4 و OCT3 / 4 و Ki67 (الشكل 4) 38،39،40. من المعروف أن إعادة البرمجة ، بالإضافة إلى الثقافة الطويلة ل hiPSCs والتمايز ، يمكن أن تؤدي إلى نمط نووي غير طبيعي ، أو بالأحرى إحداث طفرات41. لذلك ، يجب مراقبة الخلفية الوراثية للخلايا المستزرعة بمرور الوقت وفي ممرات مختلفة عن طريق نطاقات g وتسلسل الإكسوم الكامل.
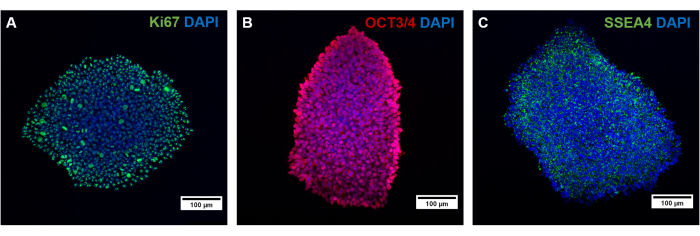
الشكل 4: توصيف hiPSCs المتولدة عن طريق تلطيخ التألق المناعي. توصيف hiPSCs المتولدة عن طريق تلطيخ (A) العلامة التكاثرية Ki67 ، وكذلك علامات تعدد القدرات (B) OCT3 / 4 و (C) SSEA4. تمثل أشرطة المقياس 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
من الناحية الشكلية ، تظهر الخلايا المشتقة من hiPSC على شكل نجمة وتعبر عن شبكة متميزة من عمليات القدم الأولية والثانوية الطويلة مقارنة بالخلايا الجذعية (الشكل 5). تعبر الخلايا المشتقة من HiPSC عن بروتينات واسمة خاصة بالخلايا الذكورية مثل synaptopodin و nephrin و podocin (الشكل 6A-C) 42.
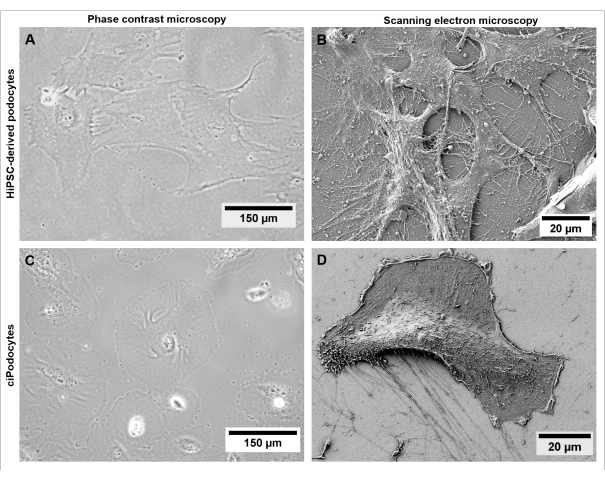
الشكل 5: مورفولوجيا الخلايا المشتقة من hiPSC مقارنة بالخلايا السيبودية. مقارنة بين الخلايا المشتقة من الخلايا الجذعية المشتقة من (A,B) من متبرع سليم إلى الخلايا الجذعية الخيطية (C,D) فيما يتعلق بمورفولوجيا الخلية و filopodia باستخدام مجهر تباين الطور (A,C) والمجهر الإلكتروني الماسح (B,D). تمثل قضبان المقياس 150 ميكرومتر (A ، C) و 20 ميكرومتر (B ، D). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لذلك ، فإن مقارنة الخلايا المشتقة من hiPSC ليس فقط من المتبرعين الأصحاء ، ولكن أيضا من المرضى الذين يعانون من طفرات في الجينات الخاصة بالخلايا البدوية ، تسمح بالتوصيف الفردي لطفرة المريض خارج الجسم الحي.
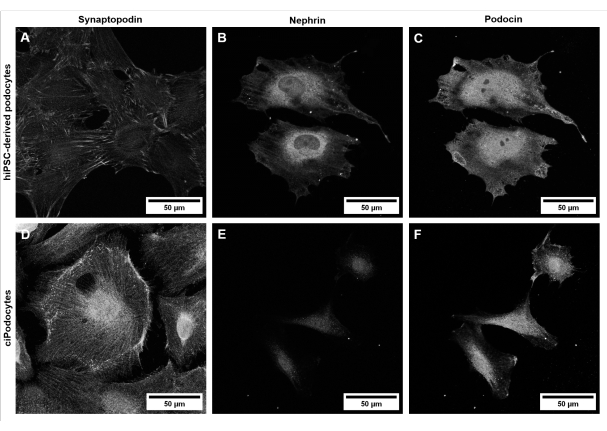
الشكل 6: توصيف علامة خاصة بالخلايا البدوية في الخلايا المشتقة من hiPSC والخلايا السيبودية. مقارنة بين الخلايا المشتقة من (A-C) المشتقة من hiPSC من متبرع سليم إلى (D-F) ciPodocytes فيما يتعلق ببروتينات العلامات الخاصة بالخلايا البادومية synaptopodin (A ، D) ، النيفرين (B ، E) ، والبودوسين (C ، F). تمثل قضبان المقياس 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1. تكوين جميع وسائط زراعة الخلايا والحلول المستخدمة في الدراسة. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
يجمع هذا البروتوكول القائم على زراعة الخلايا بين إعادة البرمجة العرضية للخلايا الليفية الجلدية البشرية في hiPSCs الخاصة بالمريض والتمايز اللاحق إلى الخلايا المشتقة من hiPSC. هذا يسمح لنا بدراسة التغيرات المرتبطة بالطفرات في الخلايا البدوية من المرضى الذين يعانون من مرض الكبيبات الوراثية فيما يتعلق بإصابة الخلايا البودية. تم تكييف بروتوكول إعادة برمجة الخلايا الليفية الجلدية بطريقة خالية من التكامل عن طريق التثقيب الكهربائي من العمل المنشور ل Bang et al.32 و Okita et al.33. تم تكييف بروتوكول التمييز بين الخلايا العضلية من hiPSCs من البروتوكول المنشور من Musah et al.28،34،35. هناك بالفعل منشورات متاحة تصف توليد الخلايا البدوية من hiPSCs27،34،35. ومع ذلك ، فإن البروتوكول المقدم هنا محسن وأقل تكلفة فيما يتعلق بتمايز hiPSCs إلى خلايا بودوسيتيات. مقارنة بالبروتوكول المنشور من Musah et al. ، اختبرنا هذا البروتوكول على كواشف طلاء مختلفة ، مثل vitronectin و laminin silk-511 ومصفوفة الغشاء القاعدي القابلة للذوبان. يمكن تقليل تركيزات الفيترونيكتين والحرير اللامينين -511 إلى 2.5 ميكروغرام / مل بدلا من 5 ميكروغرام / مل28،34،35. علاوة على ذلك ، كان من الممكن تقليل تركيزات BMP7 و activin A - عاملي نمو مكلفين للغاية - بنسبة 50٪ ، من 100 نانوغرام / مل إلى 50 نانوغرام / مل.
وهذا يتيح تمايز أقل تكلفة. كانت الخلايا السلفية للنيفرون من اليوم 7 لا تزال تتكاثر ، وظهرت إمكانية التجمد من قبل. قمنا بتوسيع هذه الخلايا بعد الذوبان وقبل التمايز النهائي في الوسط الأساسي الذي يحتوي على وسط النسر المعدل من Dulbecco (DMEM) و B27 لعدة أيام ، مما قلل التكاليف بشكل أكبر. بالإضافة إلى خطوات التمايز ، يصف هذا البروتوكول نمو الخلايا الليفية من خزعات الجلد مع الجيل اللاحق من hiPSCs الخاصة بالمريض عبر إعادة البرمجة العرضية. يتيح الجمع بين هاتين الطريقتين توليد خلايا بودوسيتات خاصة بالمريض. لذلك ، يتم توفير بروتوكول كامل خطوة بخطوة لتوليد خلايا podocytes مشتقة من hiPSC خاصة بالمريض لم يتم وصفها من قبل بمثل هذه التفاصيل.
نظرا لأن البروتوكول العام يتضمن عدة أنواع مختلفة من الخلايا ، فمن الأهمية بمكان توصيف أنواع الخلايا التي تم إنشاؤها في خطوات مختلفة. الخلايا في الثقافة لفترة طويلة من الزمن ، لذلك يجب إجراء مراقبة الجودة في ممرات مختلفة. عند العمل مع hiPSCs ، من الضروري التغذية اليومية وكذلك مراقبة سلوك الخلية والمورفولوجيا. يجب ضمان عقم وسائط التمايز عن طريق تعقيم المرشح من خلال مرشح 0.2 ميكرومتر. يستغرق البروتوكول بأكمله ، من خزعة الجلد إلى الخلايا المشتقة من hiPSC ، عدة أشهر ، ولكن من الممكن تجميد الخلايا في مراحل متميزة من العملية. يمكن تجميد الخلايا الليفية ، واستنساخ hiPSC المختار ، والخلايا السلفية النيفرون التكاثرية بعد 7 أيام في وسط تمايز السلف النيفرون ، ويمكن إنشاء بنك خلايا عامل.
على الرغم من أن الخلايا الحميدة السليمة المشتقة من hiPSC تطور شبكة متميزة من عمليات القدم الأولية والثانوية (الشكل 5A ، B) وتعبر عن علامة نموذجية خاصة بالخلايا (الشكل 6A-C) ، فإن أغشية الشق المميزة ، كما تظهر في الجسم الحي ، يصعب تقليدها في نماذج زراعة الخلايا الكلاسيكية ثنائية الأبعاد. علاوة على ذلك ، لا يمكن التواصل بين الخلايا مع أنواع الخلايا الكبيبية الأخرى في هذا الإعداد أحادي الثقافة.
نظرا لحالتها المتمايزة النهائية ونقص القدرة على الانتشار ، من الصعب دراسة podocytes خارج الجسم الحي. بمساعدة تخليد الخلايا الأولية المشروطة ، من الممكن التغلب على هذا القيد عن طريق إدخال مفتاح حساس للحرارة ، مما يؤدي إلى نموذج زراعة الخلايا حيث تتكاثر الخلايا عند 33 درجة مئوية وتتمايز عند 37 درجة مئوية13,14. على الرغم من أن هذه الخلايا الجذعية لديها إمكانات عالية لأبحاث podocyte ، إلا أن هناك قيودا ، مثل عدم وجود تعبير علامة ، ومورفولوجيا غير متمايزة ، والفشل في تشكيل عمليات القدم15,16.
يتيح تمايز الخلايا البدوية عن الخلايا الجسدية المشتقة من المريض توليد ومقارنة الخلايا البدوية المريضة مع خلايا التحكم السليمة خارج الجسم الحي. وهذا يمكننا من دراسة تلف الخلايا البدوية بسبب الطفرات في الجينات الخاصة بالخلايا الذكورية. علاوة على ذلك ، فإن العمل مع hiPSCs لديه القدرة على إنشاء نماذج مرض زراعة الخلايا ثلاثية الأبعاد ، أو بالأحرى الكائنات العضوية43,44. قد تؤدي الزراعة المشتركة للخلايا المشتقة من hiPSC مع الخلايا الكبيبية الأخرى ، مثل الخلايا البطانية الكبيبية أو الخلايا المتوسطة ، إلى رؤى جديدة فيما يتعلق بالتواصل بين الخلايا في الصحة وأمراض الكبيبات.
علاوة على ذلك ، يمكن إجراء توصيف وعلاج الخلايا البدوية الخاصة بالمريض خارج الجسم الحي في تحليل عالي الإنتاجية. يفتح النهج الفردي الفرصة للتحقيق في أهداف علاجية جديدة لطفرات محددة وأداء الطب الفردي في المستقبل.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من قبل المركز متعدد التخصصات للبحوث السريرية (IZKF) التابع لجامعة فريدريش ألكسندر إرلانغن نورنبرغ مع رقم المنحة M4-IZKF-F009 الممنوحة لجانينا مولر-ديل، ومن قبل Bundesministerium für Bildung und Forschung (BMBF) تحت اسم المشروع STOP-FSGS-Speed Translation-Oriented Progress to Treat FSGS، رقم المنحة 01GM2202D الممنوحة لجانينا مولر-ديل. نشكر أنالينا كراوس على الدعم في التقاط صور SEM.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm sterile filter | Rotilab | P668.1 | for sterilization of differentiation medium |
| all-trans retinoic acid | Stem Cell Technologies | 72262 | supplement for differentiation |
| B27 supplement (50 x), serum free | Gibco | 17504044 | supplement for serum-free differentiation medium |
| BG iMatrix-511 Silk | biogems | RL511S | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Bovine serum albumin (BSA) | Roth | 8076.4 | |
| CELLSTAR Filter Cap Cell Culture Flasks, T75, 250 mL | Greiner bio-one | 82050-856 | cell culture plastics suitable for fibroblast culture |
| CHIR99021 (5 mg) | Sigma-Aldrich | 252917-06-9 | supplement for differentiation |
| Corning Matrigel hESC qualified matrix | Corning | 354277 | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture (solubilized basement membrane matrix) |
| countess Cell Counting Chamber Slides | Invitrogen | C10283 | to count cells |
| countess II FL Automated Cell Counter | Invitrogen | to count cells | |
| cryoPure tubes, 2 ml, QuickSeal screw cap, white | Sarstedt | 72380 | cryovials for freezing of cells |
| dimethyl sulfoxide (DMSO) | Roth | A994.1 | for fibroblast freezing medium |
| DMEM/F12 (1:1) (1 x) | Gibco | 11320074 | basic medium for differentiation |
| DMEM/F12 + Glutamax | Gibco | 10565018 | basic medium for fibroblast medium |
| EVOS M5000 Imaging System | Thermo Fisher Scientific | AMF5000 | phase contrast microscope |
| fetal bovine serum premium, inactivated (FCS) | PAN Biotech | P301902 | serum for fibroblast medium, fibroblast freezing medium and podocyte maintenance medium |
| fisherbrand Electroporation Cuvettes Plus, 4 mm gap, 800 µL capacity, sterile | Fisherbrand | FB104 | cuvette used for electroporation/episomal reprogramming of fibroblasts (4mm gap) |
| fluoromount-G Mounting Medium, with DAPI | Invitrogen | 00-4959-52 | mounting medium containing dapi |
| gauge needle (0.6 x 30 mm) | BD Microlance3 | 300700 | for separation of hiPSC colonies into small pieces |
| human Recombinant Activin A Protein | 78001.1 | Stem cell technologies | supplement for differentiation |
| human recombinant bone morphogenetic protein 7 (BMP7) | Peprotech | 120-03P | supplement for differentiation |
| human VEGF-165 Recombinant Protein | Thermo Scientific | PHC9394 | supplement for differentiation |
| insulin-transferrin-selenium (ITS -G) (100 x) | Gibco | 41400045 | supplement for podocyte maintenance medium |
| LB medium | Roth | X964.1 | for sterility test of hiPSC culture |
| lookOut Mycoplasma PCR Detection Kit | Sigma Aldrich | MP0035-1KT | commercial mycoplasma detection kit |
| microscope slides | Diagonal GmbH & Co.KG | 21,102 | |
| microtube 1.5 mL | Sarstedt | 72706400 | |
| mTeSR1 Complete Kit | Stem Cell Technologies | 85850 | basic medium for serum-free hiPSC culture medium |
| nalgene freezing container Mr.Frosty | Roth | AC96.1 | to ensure optimal freezing conditions |
| normal goat serum | abcam | ab 7481 | for preincubation solution and antibody diluent |
| nunc 24 well plates | Thermo Scientific | 142485 | cell culture plastics suitable for hiPSC culture |
| nunc 48 well plates | Thermo Scientific | 152640 | cell culture plastics suitable for hiPSC culture |
| nunc 6 well plates | Thermo Scientific | 140685 | cell culture plastics suitable for hiPSC culture |
| nunc EasYDish Dishes 100 mm | Thermo Scientific | 150466 | cell culture plastics suitable for hiPSC culture |
| nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Scientific | 167008 | cell culture plastics suitable for hiPSC culture |
| nutriFreez D10 Cryopreservation Medium | Sartorius | 05-713-1E | serum-free cryopreservation medium for cryopreservation of hiPSC and nephron progenitor cells |
| Opti-MEM | Gibco | 11058021 | electroporation medium |
| pCXLE-hMLN | Addgene | #27079 | plasmid for episomal reprogramming |
| pCXLE-hOCT3/4 plasmid | Addgene | #27077 | plasmid for episomal reprogramming |
| pCXLE-hSK plasmid | Addgene | #27078 | plasmid for episomal reprogramming |
| penicillin-streptomycin | Sigma-Aldrich | P4333-100ML | to avoid bacterial contamination |
| plastic coverslips | Sarstedt | 83.1840.002 | for immunofluorescent stainings of hiPSCs and hiPSC-derived podocytes |
| ROTI Histofix | Roth | P087.3 | commercial paraformaldehyde (4 %) for fixation of cells |
| RPMI 1640 + L-Glutamine | Gibco | 21875034 | basic medium for podocyte maintenance medium |
| staining chamber StainTray Black lid | Roth | HA51.1 | |
| stemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | enzymatic cell detachment solution used for dissociation of hiPSCs |
| sterile phosphate buffered saline (PBS) (1 x) | Gibco | 14190094 | used for washing and coating |
| sterile water | Roth | T1432 | |
| syringe without needle 20 mL | BD Plastipak | 300629 | to filter sterilize differentiation medium |
| TC dish 100 mm | Sarstedt | 8,33,902 | sterile cell culture plastics used for cutting the skin biopsy and fibroblast culture |
| TC dish 35 mm | Sarstedt | 8,33,900 | sterile cell culture plastics used for outgrowing fibroblasts from skin biopsy |
| triton X 100 | Roth | 3051.3 | for preincubation solution |
| trypan Blue Stain (0.4 %) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | to count cells |
| trypsin-EDTA (10 x) | Biowest | X0930-100 | dissociation reagent used for fibroblasts and nephron progenitor cells |
| tube 15 mL | Greiner bio-one | 188271-N | |
| tube 50 mL | Greiner bio-one | 227261 | |
| vitronectin ACF | Sartorius | 05-754-0002 | extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Y-27632 dihydrochloride (10 mg) | Tocris | 1254 | to avoid apoptosis of hiPSCs during splitting |
| Primary antibodies | |||
| OCT4 | Stem Cell Technologies | 60093.1 | pluripotency marker, dilution 1:200 |
| SSEA-4 | Stem Cell Technologies | 60062FI.1 | pluripotency marker, dilution 1:100 |
| Ki67 | Abcam | ab15580 | proliferation marker, dilution 1:300 |
| synaptopodin | Proteintech | 21064-1-AP | podocyte-specific marker, dilution 1:200 |
| nephrin | Progen | GP-N2 | podocyte-specific marker, dilution 1:25 |
| podocin | proteintech | 20384-1-AP | podocyte-specific marker, dilution 1:100 |
| Secondary antibodies | |||
| goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21435 | secondary anditbody, dilution 1:1000 |
| alexa Fluor 647 Goat Anti-Rabbit SFX Kit, highly cross-adsorbed | Invitrogen | A31634 | secondary anditbody, dilution 1:1000 |
| donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A21206 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21422 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11001 | secondary anditbody, dilution 1:1000 |
References
- Mundel, P., et al. Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines. Experimental Cell Research. 236 (1), 248-258 (1997).
- Grgic, I., et al. Imaging of podocyte foot processes by fluorescence microscopy. Journal of the American Society of Nephrology. 23 (5), 785-791 (2012).
- Grahammer, F., Schell, C., Huber, T. B. The podocyte slit diaphragm-from a thin grey line to a complex signalling hub. Nature Reviews Nephrology. 9 (10), 587-598 (2013).
- Deen, W. M., Lazzara, M. J., Myers, B. D. Structural determinants of glomerular permeability. American Journal of Physiology. Renal Physiology. 281 (4), F579-F596 (2001).
- Schell, C., Huber, T. B. The evolving complexity of the podocyte cytoskeleton. Journal of the American Society of Nephrology. 28 (11), 3166-3174 (2017).
- Muller-Deile, J., Schiffer, M. Podocyte directed therapy of nephrotic syndrome-can we bring the inside out. Pediatric Nephrology. 31 (3), 393-405 (2016).
- Boehlke, C., et al. Hantavirus infection with severe proteinuria and podocyte foot-process effacement. American Journal of Kidney Diseases. 64 (3), 452-456 (2014).
- Schiffer, M., et al. Pharmacological targeting of actin-dependent dynamin oligomerization ameliorates chronic kidney disease in diverse animal models. Nature Medicine. 21 (6), 601-609 (2015).
- Kopp, J. B., et al. Podocytopathies. Nature Reviews. Disease Primers. 6 (1), 68 (2020).
- Wiggins, R. C. The spectrum of podocytopathies: a unifying view of glomerular diseases. Kidney International. 71 (12), 1205-1214 (2007).
- Mundel, P., Reiser, J., Kriz, W. Induction of differentiation in cultured rat and human podocytes. Journal of the American Society of Nephrology. 8 (5), 697-705 (1997).
- Jat, P. S., et al. Direct derivation of conditionally immortal cell lines from an H-2Kb-tsA58 transgenic mouse. Proceedings of the National Academy of Sciences. 88 (12), 5096-5100 (1991).
- Saleem, M. A., et al. A conditionally immortalized human podocyte cell line demonstrating nephrin and podocin expression. Journal of the American Society of Nephrology. 13 (3), 630-638 (2002).
- Eto, N., et al. Podocyte protection by darbepoetin: preservation of the cytoskeleton and nephrin expression. Kidney International. 72 (4), 455-463 (2007).
- Krtil, J., Platenik, J., Kazderova, M., Tesar, V., Zima, T. Culture methods of glomerular podocytes. Kidney & Blood Pressure Research. 30 (3), 162-174 (2007).
- Chittiprol, S., Chen, P., Petrovic-Djergovic, D., Eichler, T., Ransom, R. F. Marker expression, behaviors, and responses vary in different lines of conditionally immortalized cultured podocytes. American Journal of Physiology. Renal Physiology. 301 (3), F660-F671 (2011).
- Shih, N. Y., et al. CD2AP localizes to the slit diaphragm and binds to nephrin via a novel C-terminal domain. The American Journal of Pathology. 159 (6), 2303-2308 (2001).
- Yan, K., Khoshnoodi, J., Ruotsalainen, V., Tryggvason, K. N-linked glycosylation is critical for the plasma membrane localization of nephrin. Journal of the American Society of Nephrology. 13 (5), 1385-1389 (2002).
- Sir Elkhatim, R., Li, J. Y., Yong, T. Y., Gleadle, J. M. Dipping your feet in the water: podocytes in urine. Expert Review of Molecular Diagnostics. 14 (4), 423-437 (2014).
- Camici, M. Urinary detection of podocyte injury. Biomedicine & Pharmacotherapy. 61 (5), 245-249 (2007).
- Muller-Deile, J., et al. Overexpression of preeclampsia induced microRNA-26a-5p leads to proteinuria in zebrafish. Scientific Reports. 8 (1), 3621 (2018).
- Schenk, H., et al. Removal of focal segmental glomerulosclerosis (FSGS) factor suPAR using CytoSorb. Journal of Clinical Apheresis. 32 (6), 444-452 (2017).
- Petermann, A., Floege, J. Podocyte damage resulting in podocyturia: a potential diagnostic marker to assess glomerular disease activity. Nephron. Clinical Practice. 106 (2), c61-c66 (2007).
- Vogelmann, S. U., Nelson, W. J., Myers, B. D., Lemley, K. V. Urinary excretion of viable podocytes in health and renal disease. American Journal of Physiology. Renal Physiology. 285 (1), F40-F48 (2003).
- Petermann, A. T., et al. Podocytes that detach in experimental membranous nephropathy are viable. Kidney International. 64 (4), 1222-1231 (2003).
- Sakairi, T., et al. Conditionally immortalized human podocyte cell lines established from urine. American Journal of Physiology. Renal Physiology. 298 (3), F557-F567 (2010).
- Rauch, C., et al. Differentiation of human iPSCs into functional podocytes. PLoS One. 13 (9), e0203869 (2018).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1, 0069 (2017).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2 (12), 3081-3089 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Teshigawara, R., Cho, J., Kameda, M., Tada, T. Mechanism of human somatic reprogramming to iPS cell. Laboratory Investigation. 97 (10), 1152-1157 (2017).
- Bang, J. S., et al. Optimization of episomal reprogramming for generation of human induced pluripotent stem cells from fibroblasts. Animal Cells and Systems. 22 (2), 132-139 (2018).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8 (5), 409-412 (2011).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Vangipuram, M., Ting, D., Kim, S., Diaz, R., Schule, B. Skin punch biopsy explant culture for derivation of primary human fibroblasts. Journal of Visualized Experiments. (77), e3779 (2013).
- Hoffding, M. K., Hyttel, P. Ultrastructural visualization of the Mesenchymal-to-Epithelial Transition during reprogramming of human fibroblasts to induced pluripotent stem cells. Stem Cell Research. 14 (1), 39-53 (2015).
- Bharathan, S. P., et al. Systematic evaluation of markers used for the identification of human induced pluripotent stem cells. Biology Open. 6 (1), 100-108 (2017).
- Scholzen, T., Gerdes, J. The Ki-67 protein: from the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Vaz, I. M., et al. Chromosomal aberrations after induced pluripotent stem cells reprogramming. Genetics and Molecular Biology. 44 (3), 20200147 (2021).
- Reiser, J., Altintas, M. M. Podocytes. F1000Research. 5, 114 (2016).
- Ohmori, T., et al. Impaired NEPHRIN localization in kidney organoids derived from nephrotic patient iPS cells. Scientific Reports. 11 (1), 3982 (2021).
- Morizane, R., Bonventre, J. V. Generation of nephron progenitor cells and kidney organoids from human pluripotent stem cells. Nature Protocols. 12 (1), 195-207 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved