A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحليل المكاني عالي الدقة لمستويات التعبير الجيني في الأوتار
In This Article
Summary
توضح هذه المقالة كيفية تنفيذ بروتوكول محسن في الموقع للأوتار. تناقش هذه الطريقة تحضير الأنسجة ، ونفاذية القسم ، وتصميم المسبار ، وطرق تضخيم الإشارة.
Abstract
في السنوات الأخيرة ، تم تطوير العديد من البروتوكولات لعلم النسخ عالي الدقة في العديد من المجالات الطبية والبيولوجية المختلفة. ومع ذلك ، فقد تركت الأنسجة الغنية بالمصفوفة ، وعلى وجه التحديد ، الأوتار وراءها بسبب انخفاض عدد الخلايا ، وانخفاض كمية الحمض النووي الريبي لكل خلية ، ومحتوى المصفوفة العالي ، مما جعل تحليلها معقدة. واحدة من أحدث وأهم أدوات الخلية المفردة هي التحليل المكاني لمستويات التعبير الجيني في الأوتار. تتمتع أدوات الحمض النووي الريبي المكانية هذه بأهمية عالية على وجه التحديد في الأوتار لتحديد موقع خلايا معينة من مجموعات جديدة وغير معروفة ، والتحقق من صحة نتائج تسلسل الحمض النووي الريبي أحادي الخلية ، وإضافة سياق نسيجي إلى بيانات تسلسل الحمض النووي الريبي أحادية الخلية. ستمكن هذه الطرق الجديدة من تحليل الحمض النووي الريبي في الخلايا ذات الحساسية الاستثنائية والكشف عن أهداف الحمض النووي الريبي أحادي الجزيء على مستوى الخلية الواحدة ، مما سيساعد على توصيف الأوتار جزيئيا وتعزيز أبحاث الأوتار.
في ورقة الطريقة هذه ، سنركز على الطرق المتاحة لتحليل مستويات التعبير الجيني المكاني على الأقسام النسيجية باستخدام فحوصات تهجين جديدة في الموقع للكشف عن الحمض النووي الريبي المستهدف داخل الخلايا السليمة على مستويات الخلية الواحدة. أولا ، سنركز على كيفية تحضير أنسجة الوتر للمقايسات المختلفة المتاحة وكيفية تضخيم الإشارات الخاصة بالهدف دون ضوضاء في الخلفية ولكن بحساسية عالية وخصوصية عالية. بعد ذلك ، ستصف الورقة طرق نفاذية محددة ، وتصميمات المسبار المختلفة ، واستراتيجيات تضخيم الإشارة المتاحة حاليا. ستمكن هذه الطرق الفريدة لتحليل مستويات النسخ للجينات المختلفة في دقة الخلية المفردة من تحديد وتوصيف خلايا أنسجة الأوتار في السكان الصغار والمسنين لمختلف النماذج الحيوانية وأنسجة الأوتار البشرية. ستساعد هذه الطريقة أيضا في تحليل مستويات التعبير الجيني في الأنسجة الأخرى الغنية بالمصفوفة مثل العظام والغضاريف والأربطة.
Introduction
الأوتار هي الأنسجة الضامة التي تمكن من نقل القوة بين العضلاتوالعظام 1. من الناحية التنموية ، يتم اشتقاق الخلايا الوسيطة من الخلايا الوسيطة داخل تصلب الجسيدات2. أوتار الأطراف مشتقة من الأديم المتوسط الجانبي. وتنشأ الأوتار القحفية من سلالة القمة العصبية القحفية3،4. يمكن تمييز الوتر بالتعبير عن عامل نسخ التصلب5 ، على الرغم من أن العديد من العلامات تلعب أيضا دورا رئيسيا في تطور الأوتار ، بما في ذلك tenomodulin و mohawk واستجابة النمو المبكر 1/26،7،8،9.
على الرغم من العلامات القليلة المعروفة للوتر ، بشكل عام ، لا يزال التوصيف الأكثر تعمقا يمثل تحديا لأن الوتر يحتوي على خلايا تمتد عبر تدرج من الخصائص الميكانيكية الحيوية. من الوصلة العضلية ، ووسط الوتر في منتصف الجسم ، والوتر الأكثر تكلس ، توجد خلايا الأوتار في مصفوفات خارج الخلية تتراوح في خصائص الشد. نظرا لأن الوتر يجب أن يتحمل إجهاد الشد الذي يفرضه الاختلاف في القوة الميكانيكية بين الأنسجة الرخوة والصلبة ، فإن التنظيم المكاني للخلايا في الوتر مهم بشكل خاص لوظيفته. ومع ذلك ، لا يعرف سوى القليل عن هذه المجموعات السكانية الفرعية للأوتار.
يمكن استخدام العديد من أدوات النسخ المكاني عالية الدقة للبدء في توضيح المجموعات السكانية الفرعية للخلايا ، بما في ذلك على سبيل المثال لا الحصر ، تسلسل الحمض النووي الريبي أحادي الخلية أو التهجين في الموقع . ومع ذلك ، في حين أن فحوصات التنميط المكاني هذه تساعد في الكشف عن تعبير الحمض النووي الريبي عبر الأنسجة بعد التشريح المجهري أو التقسيم ، فإن هذه الطرق يمكن أن تكون صعبة عند إجراؤها على أنسجة الأوتار. الأوتار عبارة عن أنسجة غنية بالمصفوفة تتكون من ما يقرب من 86٪ من الكولاجين بواسطة الكتلة الجافة10 ، مما يجعل من الصعب استخراج الخلايا للتسلسل. نظرا لكل من المضاعفات في عزل الخلايا عن المصفوفة ، والطبيعة تحت الخلايا للوتر11 ، وعدد الحمض النووي الريبي المنخفض نسبيا ، فإن الوتر هو نسيج يصعب تحليله.
في هذه الورقة ، نقدم طريقة لتحسين فحوصات التهجين الجديدة في الموقع للاستفادة منها للأوتار من خلال توفير طرق تحضير الأنسجة والنفاذية وتصميم المسبار. إلى جانب تقنيات التسلسل الحالية ، قد يساعد هذا الباحثين على توصيف مجموعات الأوتار الفرعية مكانيا عبر الأوتار النامية أو البالغة أو المصابة مع زيادة حساسية الفحص وخصوصيته.
Protocol
تم إجراء جميع التجارب على وفقا للجنة رعاية المؤسسي واستخدامه (IACUC) وإرشادات AAALAC. تم إجراء التجارب بموجب #2013N000062 بروتوكولي معتمد في مستشفى ماساتشوستس العام. في هذه الدراسة, C57BL / J6 الفئران (5 أسابيع من العمر و P0) تم استخدامها. راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف والأدوات المستخدمة في هذا البروتوكول.
1. إعداد العينة والتثبيت
- قتل الفئران في غرفة ثاني أكسيد الكربون2 متبوعا بخلع عنق الرحم كطريقة ثانوية للقتل الرحيم. ثم استخدم المقص لقطع الأطراف الخلفية للفأر على طول مفصل الورك12. في قارورة التلألؤ ، اغمر الطرف الخلفي للفأر في محلول بارافورمالدهايد (PFA) كاف بنسبة 4٪ لتغطية العينة بالكامل ، وإصلاح الأنسجة لمدة 24 ساعة.
ملاحظة: بدلا من 4٪ PFA ، يمكن أيضا استخدام 10٪ فورمالين للتثبيت. بعد التثبيت ، يمكن تخزين العينة في محلول ملحي مخزن بالفوسفات (PBS) حتى مزيد من المعالجة. من خلال تثبيت الطرف الخلفي بالكامل ، يمكننا الحفاظ على التوتر على الوتر ولدينا الفرصة لفحص الوتر أو الوتر الأوسط أو الوصلة العضلية. - بعد إزالة PFA من قارورة التلألؤ ، اغسل العينة لمدة 3 × 10 دقائق باستخدام 1x PBS عن طريق إضافة ما يكفي من PBS لتغطية العينة. بعد ذلك ، اغمر الأطراف الخلفية في 0.5 M EDTA عند 4 درجات مئوية مع التحريك لمدة 1-2 أسابيع ، واستبدلها ب EDTA الطازج كل 2-3 أيام.
- بعد إزالة EDTA ، اغسل العينة لمدة 3 × 10 دقائق باستخدام 1x PBS ، وقم بتجفيف العينات في 70٪ EtOH ، وقم بتضمينها في البارافين في الاتجاه المطلوب. استخدم تقنيات تقسيم FFPE التقليدية لتقسيم الأنسجة بسمك 3 ميكرومتر ونقل الأقسام إلى شريحة مجهر معالجة ومشحونة (انظر جدول المواد) 13.
ملاحظة: يمكن تخزين الأقسام في درجة حرارة 4 درجات مئوية قبل الانتقال إلى الخطوات التالية. - إزالة البارافين
- اخبز الشرائح على طبق ساخن على حرارة 60 درجة مئوية لمدة ساعة واحدة ثم اترك الشرائح تصل إلى درجة حرارة الغرفة (RT). لإزالة شمع البارافين من الشرائح ، ضع الشرائح على رف منزلق وخفضها في طبق تلطيخ مليء بالزيلين. كرر في الزيلين الطازج لمدة 3 × 5 دقائق.
تنبيه: الزيلين خطير. تعامل معها بعناية. - لإعادة ترطيب الأقسام ، اغمر الشرائح في ما يلي لمدة 5 دقائق لكل غسلة ، كل ذلك في RT: اغسل 2x في 100٪ EtOH ، 1x في 75٪ EtOH مخفف في dH2O ، 1x في 50٪ EtOH مخفف في PBS ، 1x في 25٪ EtOH مخفف في PBS ، و 2x في PBS.
ملاحظة: تتم جميع خطوات الجفاف باستخدام الشرائح الموجودة على رف منزلق ومع حلول EtOH المختلفة في تلطيخ الأطباق.
- اخبز الشرائح على طبق ساخن على حرارة 60 درجة مئوية لمدة ساعة واحدة ثم اترك الشرائح تصل إلى درجة حرارة الغرفة (RT). لإزالة شمع البارافين من الشرائح ، ضع الشرائح على رف منزلق وخفضها في طبق تلطيخ مليء بالزيلين. كرر في الزيلين الطازج لمدة 3 × 5 دقائق.
2. RNAscope (ISH التجاري)بروتوكول 14 التكيف
- إعداد الحلول والمجسات
- قم بإعداد محلول TEG للمعالجة المسبقة للعينات المقسمة عن طريق الجمع بين 25 ملي مولار من Tris-HCl عند درجة الحموضة 8 و 10 ملي مولار من EDTA و 50 ملي مولار من الجلوكوز. قم بعمل حجم كاف لجميع العينات المراد معالجتها أو تحضير الفائض ؛ تعقيم الترشيح والتخزين في RT ؛ امزج المحلول بشكل صحيح قبل استخدامه.
- قم بإعداد ما يكفي من 1x Wash Buffer (انظر جدول المواد) لجميع عمليات الغسيل وتخزينها في RT.
- في حمام مائي أو حاضنة 40 درجة مئوية ، قم بتسخين المجسات ذات الأهمية لمدة 10 دقائق. ثم قم بإعداد المجسات وفقا لبروتوكول ISH14.
- المعالجة المسبقة للعينات
- بدلا من استخدام محلول المعالجة المسبقة الموصى به ، اغمر الشرائح في طبق تلطيخ يحتوي على عازلة TEG لمدة 4 ساعات عند 60 درجة مئوية.
ملاحظة: يمكن تمديد حضانة المخزن المؤقت TEG لمدة تصل إلى 6 ساعات إذا كانت الأنسجة كثيفة بشكل خاص أو إذا كان استرجاع المستضد لفكرة ربط الحمض النووي الريبي ذات الأهمية أمرا صعبا. في هذه الحالة ، يمكن إضافة نقطة توقف هنا ، حيث يتم تجفيف الشرائح وحفظها في ثلاجة 4 درجات مئوية طوال الليل. - قم بإزالة العينات من المخزن المؤقت واتركها تجف. بعد ذلك ، ارسم حول العينات بقلم حاجز كاره للماء ، واغمرها في طبق تلطيخ آخر يحتوي على البروتياز الرابع ، واحتضنها في فرن لمدة 45 دقيقة عند 40 درجة مئوية.
ملاحظة: نوصي باستخدام البروتياز الوريدي للفئران البالغة. في حالة استخدام الفئران الأصغر سنا ، مثل P0 ، نوصي باستخدام إنزيم أكثر اعتدالا ، مثل البروتياز III ، لمدة 30 دقيقة. عند استكشاف الأخطاء وإصلاحها للأعمار المختلفة ، راقب سلامة الوتر وتحقق من تدهوره. إذا كانت الأنسجة تنفصل أو متدهورة ، فقم بتقليل وقت الحضانة أو تغيير البروتياز المستخدم. - اغسل العينات مرة أخرى في المخزن المؤقت TEG لمدة 30 دقيقة ثم قم بتهجين المجسات وفقا لبروتوكول ISH14.
- أضف 50-100 ميكرولتر من كاشف التركيب أعلى العينة. ضع غطاء فوق العينات للفحص المجهري. عند التصوير ، استخدم تكبيرا عاليا (هدف 40x أو أعلى) لعرض الإشارة.
- بدلا من استخدام محلول المعالجة المسبقة الموصى به ، اغمر الشرائح في طبق تلطيخ يحتوي على عازلة TEG لمدة 4 ساعات عند 60 درجة مئوية.
3. بروتوكول HCRISH 15 التكيف
- التثبيت اللاحق
- تحضير 4٪ PFA (في PBS) ، محلول PBT (0.1٪ Tween-20 في PBS) ، والبروتيناز K في PBS (تركيز المخزون 10 مجم / مل ، التركيز النهائي 5 ميكروغرام / مل).
- لبدء خطوة الإصلاح الأولى ، اغمر الشرائح في طبق تلطيخ يحتوي على 4٪ PFA لمدة 5 دقائق ؛ بعد ذلك ، قم بإزالة محلول PFA بنسبة 4٪ وتخزينه للاستخدام في الخطوات اللاحقة. اشطف الشرائح لمدة 2 × 5 دقائق في محلول PBT وقم بإزالة محلول PBT. ضع الشرائح في طبق تلطيخ يحتوي على محلول البروتيناز K (5 ميكروغرام / مل) لمدة 5 دقائق واشطفها في محلول PBT 2 × 5 دقائق.
- ابدأ خطوة postfix الثانية واغمر الشرائح في 4٪ PFA لمدة 5 دقائق.
ملاحظة: هذا هو نفس 4٪ من PFA المحفوظة من الخطوة 3.1.2. - اشطف الشرائح لمدة 3 × 5 دقائق في محلول PBT.
ملاحظة: تتم جميع خطوات التثبيت مع الشرائح الموجودة على رف منزلق وفي أطباق تلطيخ تحتوي على المحاليل المعنية.
- الأسيتيل
- تحضير محلول الأستلة الذي يحتوي على 625 ميكرولتر من أنهيدريد الخليك ، و 3.3 مل من 1 M ثلاثي إيثانول أمين (TEA) ، و 246 مل من ddH2O. تأكد من الخلط جيدا واستخدامه مباشرة بعد التحضير.
- ضع الشرائح في محلول الأستلة لمدة 10 دقائق ثم اشطفها 3 × 5 دقائق في محلول PBT. اشطف الشرائح في ddH2O واتركها تجف في الهواء لمدة 30 دقيقة. ثم ارسم حول العينات بقلم حاجز كاره للماء.
ملاحظة: تتم جميع خطوات الأستلة باستخدام الشرائح الموجودة على رف منزلق وفي أطباق تلطيخ تحتوي على المحاليل المعنية
- التهجين
- قم بتسخين المخزن المؤقت للتهجين إلى 37 درجة مئوية وقم بتسخين غرفة مرطبة مسبقا إلى 37 درجة مئوية.
تنبيه: يحتوي المخزن المؤقت على الفورماميد، وهو مادة خطرة. إذا لم تكن الشرائح جافة بدرجة كافية ، فقم بمسح الحواف بمنديل مختبري لإزالة الدرجة العاليةالزائدة 2O. - قم بإعداد محاليل المسبار عن طريق إضافة 0.4 مللي مول من كل خليط مسبار إلى 100 ميكرولتر من المخزن المؤقت للتهجين.
ملاحظة: في حالة استخدام تصوير dHCR ، استخدم تركيزا أعلى من المسبار لتحسين كفاءة تهجين المسبار. - قم بإعداد 4 لتر من كلوريد الصوديوم سترات الصوديوم (20x SSC) عن طريق الجمع بين 3 M كلوريد الصوديوم (701.1 جم من كلوريد الصوديوم في حجم نهائي قدره 4 لتر) و 0.3 متر من Na3CH6H5O7 • 2H2O (352.8 جم) ثم ضبط الرقم الهيدروجيني النهائي إلى 7 عن طريق إضافة حمض الهيدروكلوريك أو 10 نيوتن هيدروكسيد الصوديوم. أضف ما يكفي من H2O للوصول إلى 4 لتر ، قم بإعداد 5x SSCT عن طريق تخفيف 20x SSC إلى 5x وإضافة ما يكفي من 10٪ Tween 20 بحيث يكون 0.1٪ من الحجم الإجمالي.
- أضف 200 ميكرولتر من المخزن المؤقت للتهجين إلى العينة ، ضع الشرائح في غرفة مرطبة ، واترك الشرائح تحتضن لمدة 10 دقائق. قم بإزالة محلول التهجين واستنزاف المخزن المؤقت الزائد على الشريحة عن طريق نشاف الحواف بمسح معملي.
- أضف 100 ميكرولتر من محلول المسبار المحضر أعلى العينة وضع غطاء على العينة. احتضن في فرن طوال الليل أو لمدة 12-16 ساعة في غرفة مرطبة بمحلول يحتوي على 5x SSC و 50٪ فورماميد. اضبط درجة الحرارة على 37 درجة مئوية.
ملاحظة: نظرا لأن الحضانة بين عشية وضحاها ، فإن إضافة الغطاء هو تقليل التبخر. - اترك حصة من محلول SSCT 5x في حمام مائي 37 درجة مئوية وكمية ثانية في RT. توقع أحجام هذه الحصص المطلوبة بناء على رقم العينة وعدد عمليات الغسيل في الخطوة التالية.
- قم بتسخين المخزن المؤقت للتهجين إلى 37 درجة مئوية وقم بتسخين غرفة مرطبة مسبقا إلى 37 درجة مئوية.
- غسل
- باستخدام محلول SSCT 5x المسخن مسبقا ، قم بإعداد 75٪ مخزن غسيل / 25٪ 5x SSCT ، و 50٪ مخزن غسيل / 50٪ 5x SSCT ، و 25٪ مخزن غسيل / 75٪ 5x محاليل SSCT.
- لإزالة المجسات الزائدة ، اغمر الشرائح على التوالي لمدة 15 دقيقة لكل غسلة عند 37 درجة مئوية في 75٪ مخزن غسيل / 25٪ 5x SSCT ، 50٪ مخزن غسيل / 50٪ 5x SSCT ، و 25٪ مخزن غسيل / 75٪ 5x SSCT. اسمح للغطاء أن تطفو من العينات.
- احتضن الشرائح 2 × 15 دقيقة مع 100٪ 5x SSCT ثم اغمرها في 5x SSCT لمدة 5 دقائق في RT.
ملاحظة: يمكن إجراء خطوات الغسيل باستخدام الشرائح الموجودة على رف منزلق وفي أطباق تلطيخ تحتوي على المحاليل المعنية أو مع إضافة المحاليل على شكل قطرات.
- التضخيم
- قم بإعداد 6 مللي مول من دبوس الشعر h1 و 6 مللي مول من دبوس الشعر h2 عن طريق التبريد المفاجئ 2 ميكرولتر من مخزون 3 ميكرومتر (يسخن عند 95 درجة مئوية لمدة 90 ثانية ويبرد إلى RT). حماية دبابيس الشعر من الضوء أثناء هذه العملية.
ملاحظة: يتم توفير دبابيس الشعر HCR h1 و h2 في مخزن تخزين دبوس الشعر وهي جاهزة للتبريد المفاجئ. التقط دبابيس الشعر الباردة h1 و h2 في أنابيب منفصلة. - جفف الشرائح عن طريق نشاف حوافها بمنديل معملي. بعد ذلك ، أضف 200 ميكرولتر من المخزن المؤقت للتضخيم أعلى العينة وضعه في غرفة مرطبة لمدة 30 دقيقة في RT. قم بإعداد خليط دبوس الشعر عن طريق إضافة دبابيس شعر h1 المبردة ودبابيس الشعر h2 المبردة إلى 100 ميكرولتر من المخزن المؤقت للتضخيم في RT.
- قم بإزالة المخزن المؤقت للتضخيم واستنزاف السائل الزائد على الشريحة عن طريق نشاف الحواف بمنديل مختبري. أضف 100 ميكرولتر من خليط دبوس الشعر المحضر مسبقا وضع البارافيلم فوق العينة. احتضن الشرائح لمدة لا تقل عن 4 ساعات أو طوال الليل في غرفة مظلمة ومرطبة في RT.
- لإزالة دبابيس الشعر الزائدة ، اغمر الشرائح في 5x SSCT في طبق تلطيخ واحتضنها في RT لمدة 30 دقيقة. كرر الغسيل في 5x SSCT طازج لمدة 30 دقيقة ، ومرة ثالثة لمدة 5 دقائق.
- جفف الشرائح عن طريق نشاف الحواف بمنديل مختبري وأضف 50-100 ميكرولتر من كاشف التثبيت أعلى العينة. ضع غطاء فوق العينات للفحص المجهري. عند التصوير ، استخدم تكبيرا عاليا (هدف 40x أو أعلى) لعرض الإشارة.
- قم بإعداد 6 مللي مول من دبوس الشعر h1 و 6 مللي مول من دبوس الشعر h2 عن طريق التبريد المفاجئ 2 ميكرولتر من مخزون 3 ميكرومتر (يسخن عند 95 درجة مئوية لمدة 90 ثانية ويبرد إلى RT). حماية دبابيس الشعر من الضوء أثناء هذه العملية.
النتائج
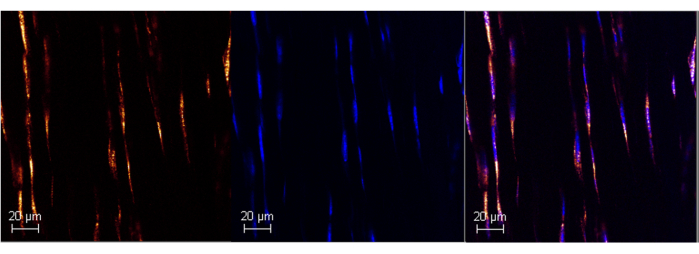
الشكل 1: تعبير Poly A RNA في وتر العرقوب في الفأر البالغ باستخدام RNAScope. صورة تمثيلية لوضع العلامات الناجحة على بولي أ في وتر العرقوب للفأر (اللوحة اليسرى) باستخدام مقايسة ISH التجار?...
Discussion
في هذه الورقة ، نصف التعديلات التي تم إجراؤها للاستفادة من أدوات ISH الحالية بحيث يمكن استخدامها في أنسجة الأوتار بدرجة عالية من الخصوصية والحساسية. نظرا لأن الوتر عبارة عن نسيج عالي الكثافة ، فيجب إجراء تعديلات على البروتوكول في كثير من الأحيان لتحقيق درجات مماثلة من اخ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يشكر المؤلفون جينا غالواي وأعضاء مختبر غالواي على دعمهم وتشجيعهم في تطوير هذه البروتوكولات واستكشاف الأخطاء وإصلاحها.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M triethanolamine buffer | |||
| 10% Formalin solution | |||
| 10% Tween-20 | |||
| 20x Saline Sodium Citrate buffer | |||
| 4% PFA | |||
| ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 | ACD | 323100 | |
| Acetic Anhydride | |||
| Axio Imager Microscope | ZEISS | ||
| C57BL/J6 mice | JAX ID: 000664 | ||
| Coverslips | Fisher | 12-541-042 | |
| ddH2O | |||
| ETDA | Thermofisher | AM9262 | |
| EtOH | |||
| Glucose | VWR Chemicals BDH | BDH9230-500G | |
| HCR RNA-FISH Bundle | Molecular Instruments Inc. | ||
| HybEZ II Hybridization System | ACD | ||
| Immedge Barrier Pen | Vector Laboratories | H4000 | |
| Leica SPE Confocal Microscope | Leica | ||
| Parafilm | Fisher | ||
| Phosphate-buffered saline (PBS, 1x) | Invitrogen | AM9625 | Dilute 10x PBS in milli-Q water to get 1x solution |
| Protease IV | |||
| Proteinase K | Roche | 3115836001 | |
| RNAscope H2O2 and Protease Reagents | ACD | PN 322381 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V3 |
| RNAscope Multiplex Fluorescent Detection Kit | ACD | PN 323110 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 |
| RNAscope Target Retrieval reagents | ACD | 322000 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V4 |
| RNAscope Wash Buffer | ACD | PN 310091 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V5 |
| RNAscope Probe Diluent | ACD | 300041 | |
| Slide holder | StatLab | 4465A | |
| Staining Dish with Lid | StatLab | LWS20WH | |
| Superfrost Plus Microscope slides | Fisher | 1255015 | treated, charged slides |
| Tris-HCl | |||
| Xylene | Sigma-Aldrich | 534056-4L |
References
- Sharma, P., Maffulli, N. Tendon injury and tendinopathy: healing and repair. Journal of Bone and Joint Surgery. 87 (1), 187-202 (2005).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Noden, D. M. The role of the neural crest in patterning of avian cranial skeletal, connective, and muscle tissues. Developmental Biology. 96 (1), 144-165 (1983).
- Chen, J. W., Galloway, J. L. The development of zebrafish tendon and ligament progenitors. Development. 141 (10), 2035-2045 (2014).
- Schweitzer, R., et al. Analysis of the tendon cell fate using Scleraxis, a specific marker for tendons and ligaments. Development. 128 (19), 3855-3866 (2001).
- Tsai, S., Nödl, M., Galloway, J. Bringing tendon biology to heel: Leveraging mechanisms of tendon development, healing, and regeneration to advance therapeutic strategies. Developmental Dynamics. 250 (3), 393-413 (2021).
- Kannus, P., et al. Location and distribution of non-collagenous matrix proteins in musculoskeletal tissues of rat. The Histochemical Journal. 30 (11), 799-810 (1998).
- Kannus, P. Structure of the tendon connective tissue. Scandinavian Journal of Medicine & Science in Sports. 10 (6), 312-320 (2000).
- Thorpe, C. T., Birch, H. L., Clegg, P. D., Screen, H. R. C. The role of the non-collagenous matrix in tendon function. International Journal of Experimental Pathology. 94 (4), 248-259 (2013).
- Lin, T. W., Cardenas, L., Soslowsky, L. J. Biomechanics of tendon injury and repair. Journal of Biomechanics. 37 (6), 865-877 (2004).
- Grinstein, M., et al. A distinct transition from cell growth to physiological homeostasis in the tendon. eLife. 8, e48689 (2019).
- Villaseñor, S., Grinstein, M. Two-photon microscopy for the study of tendons. Journal of Visualized Experiments. , e65853 (2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. Journal of Visualized Experiments. (139), e58288 (2018).
- Wang, F., et al. RNAscope®: A Novel In Situ RNA Analysis Platform for Formalin-Fixed Paraffin-Embedded Tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Choi, H. M. T., et al. Third-generation situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), 165753 (2018).
- Jackson, D. J., Herlitze, I., Hohagen, J. A whole mount in situ hybridization method for the gastropod mollusc Lymnaea stagnalis. Journal of Visualized Experiments. (109), e53968 (2016).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved